CompositionPrincipes actifs
Cholécalciférol
Excipients
Huile d’olive raffinée
Indications/Possibilités d’emploi-Prévention du rachitisme et de l’ostéomalacie chez l’enfant et l’adulte
-Prévention du rachitisme chez le prématuré
-Prévention de la carence en vitamine D chez des sujets présentant un risque correspondant et par ailleurs en bonne santé et sans trouble de l’absorption
-Prévention de la carence en vitamine D chez les patients atteints de malabsorption
-Traitement du rachitisme et de l’ostéomalacie chez l’enfant et l’adulte
Posologie/Mode d’emploiEn cas de rachitisme ou d’ostéomalacie avérés ainsi que chez les patients présentant une carence sévère et avérée en vitamine D (c-à-d. concentration de 25(OH) D <25 nmol/l ou<10 ng/ml), le traitement doit être réalisé uniquement sous surveillance médicale.
DIBASE doit être pris de préférence avec un repas.
Concernant le mode d’utilisation, voir «Remarques particulières», paragraphe «Remarques concernant la manipulation». Le produit doit être agité avant l’emploi.
DIBASE a un goût d’huile d’olive. DIBASE peut être pris pur ou mélangé immédiatement avant la prise avec une petite quantité d’aliments froids ou tièdes, afin de faciliter la prise. Le patient doit veiller à prendre la totalité de la dose.
Chez les enfants qui ne sont pas allaités, la dose prescrite doit être administrée avec un repas. DIBASE peut être mélangé avec une petite quantité d’aliments pour premier âge, de yaourt, de lait, de fromage ou d’autres produits laitiers. Les parents doivent s’assurer que l’enfant prend la dose complète.
DIBASE ne doit pas être ajouté à un biberon de lait ou à des aliments mous, car il se peut que l’enfant ne prenne pas toute la portion et ne reçoive donc pas la totalité de la dose.
Prévention
Prématurés:
2-4 gouttes (soit 400-800 U.I.) par jour jusqu’à la fin de la première année de vie
Nourrissons âgés de 0 à 1 an:
2 gouttes (soit 400 U.I.) par jour
Enfants et adolescents âgés de 1 à 18 ans:
3 gouttes (soit 600 U.I.) par jour
Adultes âgés de 19 à 59 ans:
3 gouttes (soit 600 U.I.) par jour
Adultes ≥60 ans:
4 gouttes (soit 800 U.I.) par jour
Femmes enceintes et allaitantes:
2 gouttes (soit 400 U.I.) par jour
Adultes atteints de malabsorption:
15-20 gouttes (soit 3000-4000 U.I.) par jour
Traitement
Nourrissons âgés de 0 à 1 an:
2-5 gouttes (soit 400-1000 U.I.) par jour
Enfants et adolescents âgés de 1 à 18 ans:
Traitement du rachitisme:
5-25 gouttes (soit 1000-5000 U.I.) par jour pendant les 6 premières semaines, suivies de 3-5 gouttes (soit 600-1000 U.I.) par jour.
Adultes:
Traitement de la carence sévère en vitamine D avec risque identifiable de carence en vitamine D:
7-10 gouttes (soit 1400-2000 U.I.) par jour
Traitement de l’ostéomalacie:
5-20 gouttes (soit 1000-4000 U.I.) par jour
Femmes enceintes:
7-10 gouttes (soit 1400-2000 U.I.) par jour (voir «Grossesse / Allaitement»)
Patients présentant des troubles de la fonction hépatique
Il n’existe aucune donnée sur la pharmacocinétique, l’efficacité et la sécurité de la vitamine D3 chez les patients insuffisants hépatiques. Sur la base de l’expérience disponible, aucun ajustement posologique n’est cependant nécessaire.
Patients présentant des troubles de la fonction rénale
Le traitement doit être réalisé avec prudence et sous contrôle régulier de la calcémie et de la phosphatémie (voir «Mises en garde et précautions»).
Contre-indications-Hypercalcémie, hypercalciurie
-Hypervitaminose D
-Prédisposition à développer des calculs rénaux contenant du calcium
-Pseudohypoparathyroïdisme
-Troubles de l’excrétion rénale du calcium et du phosphate
-Tuberculose pulmonaire aigüe
-Prévention du rachitisme chez le nourrisson et l’enfant en bas âge présentant une hypothyroïdie ou une hypercalcémie idiopathique
-Patients immobilisés pendant une période prolongée (p. ex. après chirurgie orthopédique corrective ou affections squelettiques nécessitant un alitement)
-Traitement concomitant par des dérivés benzothiadiaziniques
-Administration concomitante d’analogues de la vitamine D
-Hypersensibilité au principe actif cholécalciférol (vitamine D3) ou à l’un des autres composants du produit
Mises en garde et précautionsLa vitamine D entraîne une augmentation importante de la résorption du calcium. À fortes doses, toutes les vitamines D sont toxiques. Lors d’un traitement au long cours par des doses quotidiennes supérieures à 1000 U.I. de vitamine D3, il convient donc de surveiller les concentrations sériques de calcium et de phosphate ainsi que la fonction rénale. Cela s’applique en particulier aux patients âgés.
En cas d’hypercalcémie ou de signes d’altération de la fonction rénale, il convient de réduire la dose ou d’arrêter le traitement. Une réduction de la dose (ou une interruption passagère du traitement) est recommandée lorsque la concentration urinaire de calcium dépasse 7,5 mmol/24 heures (soit 300 mg/24 h).
Chez les patients atteints de sarcoïdose, DIBASE doit être prescrit avec prudence en raison de l’augmentation éventuelle du métabolisme de la vitamine D3 en sa forme active. Chez ces patients, les concentrations sériques et urinaires de calcium doivent être régulièrement surveillées.
La vitamine D3 doit être utilisée avec prudence chez les patients présentant une insuffisance rénale. Chez ces patients, la calcémie,la phosphatémie et la fonction rénale doivent être surveillées. Le risque de calcification des tissus mous doit être pris en considération.
Le lien de causalité entre une supplémentation en vitamine D3 et une lithiase rénale n’est pas établi avec certitude, mais le risque est plausible, surtout dans le contexte d’une supplémentation calcique associée. La nécessité d’une supplémentation en calcium supplémentaire doit être évaluée au cas par cas. L’administration de compléments à base de calcium nécessite une surveillance médicale étroite.
La prudence est recommandée en cas de co-administration de glycosides cardiotoniques, en raison du risque accru d’arythmies (voir «Interactions»).
La prudence est en outre recommandée chez les patients présentant des troubles du métabolisme calcique, une artériosclérose, une maladie coronarienne ou une lithiase rénale.
Lors de la prise de DIBASE, il faut veiller à ne pas utiliser d’autres médicaments contenant de la vitamine D. La quantité de vitamine D3 apportée sous forme d’aliments enrichis en vitamine D3 (p. ex. lait, graisses, produits pour nourrissons) doit être prise en considération lors de la détermination de la dose. Lors de l’utilisation de produits pour nourrissons enrichis en vitamine D3, il convient notamment de réduire en conséquence l’apport prophylactique supplémentaire de vitamine D.
Les patients, notamment ceux recevant un traitement continu à fortes doses, doivent être informés des éventuels symptômes d’un surdosage (tels que fatigue, somnolence, céphalées, manque d’appétit, nausées, vomissements, diarrhée, suivis de constipation, myalgies et arthralgies, faiblesse musculaire, polydipsie, polyurie).
InteractionsInteractions pharmacocinétiques
En cas d’utilisation concomitante de médicaments inducteurs des enzymes hépatiques, tels que les anticonvulsivants (p. ex. phénytoïne) ou les barbituriques, l’action de la vitamine D3 peut être réduite en raison d’une accélération du métabolisme.
En cas de traitement concomitant par des résines échangeuses d’ions telles que la cholestyramine, le chlorhydrate de colestipol ou l’orlistat ou par des laxatifs tels que l’huile de paraffine, l’absorption gastro-intestinale de la vitamine D3 peut être réduite.
Les antifongiques imidazolés influencent l’activité de la vitamine D3 par inhibition de la transformation de la 25-hydroxy-vitamine D3 en 1,25-dihydroxy-vitamine D3 par l’enzyme rénale 25-hydroxy-vitamine D3 1-hydroxylase.
Interactions pharmacodynamiques
En cas de traitement concomitant par des digitaliques ou d’autres glycosides cardiotoniques, le risque de toxicité des digitaliques (arythmie) peut être augmenté. Une surveillance médicale stricte du patient est nécessaire, le cas échéant en réalisant des contrôles de la concentration sérique de calcium et un ECG.
En cas de traitement concomitant par des diurétiques thiazidiques, l’élimination urinaire du calcium est réduite.
En cas d’utilisation concomitante de glucocorticoïdes, l’action de la vitamine D3 peut être réduite.
Grossesse, AllaitementGrossesse
Il n’existe que des données limitées concernant l’emploi du cholécalciférol (vitamine D3) chez la femme enceinte. Les expérimentations animales ont révélé une toxicité de reproduction (voir «Données précliniques»). Il convient d’éviter des surdosages prolongés de vitamine D pendant la grossesse, car l’hypercalcémie en résultant peut entraîner chez l’enfant une sténose aortique supravalvulaire et une rétinopathie ainsi qu’un retard physique et mental.
DIBASE ne doit donc être utilisé pendant la grossesse qu’en cas d’indication stricte et sous surveillance médicale et doit être administré à la dose minimale nécessaire pour remédier à la carence en vitamine D. Pour la prévention, il ne faut pas dépasser une dose quotidienne de 400 U.I. chez la femme enceinte. Pour le traitement d’une carence en vitamine D déjà manifeste, des doses quotidiennes allant jusqu’à 2000 U.I. (soit 10 gouttes) peuvent être utilisées en fonction de la maladie sous-jacente et de la sévérité de la carence en vitamine D, sous surveillance adéquate du bilan phospho-calcique (voir «Posologie / Mode d’emploi»). Il convient d’éviter un surdosage.
Allaitement
La vitamine D3 et ses métabolites passent dans le lait maternel. Aucun cas de surdosage n’est cependant connu chez des nourrissons allaités.
Effet sur l’aptitude à la conduite et l’utilisation de machinesAucune étude correspondante n’a été effectuée. Une influence sur l’aptitude à la conduite est cependant improbable.
Effets indésirablesListe des effets indésirables
Les effets indésirables sont rangés par classe de système d’organes de la classification MedDRA et par fréquence selon la convention suivante :
« très fréquents » (≥1/10),
« fréquents » (≥1/100 à <1/10),
« occasionnels » (≥1/1000 à <1/100),
« rares » (≥1/10 000 à <1/1000),
« très rares » (<1/10 000).
Troubles du métabolisme et de la nutrition
Occasionnels: hypercalcémie, hypercalciurie
Affections de la peau et du tissu sous-cutané
Rares: éruption cutanée, prurit, urticaire
Les autres effets indésirables sont la conséquence d’un surdosage (voir «Surdosage»).
L’annonce d’effets secondaires présumés après l’autorisation est d’une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d’effet secondaire nouveau ou grave via le portail d’annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageSignes et symptômes
Un surdosage en vitamine D entraîne une hypercalcémie et une hypercalciurie. Les symptômes d’un surdosage en vitamine D sont aspécifiques. Une fatigue, une faiblesse, une somnolence, une irritabilité, un manque d’appétit, des céphalées, des vertiges, des acouphènes, une ataxie, des arythmies, une sécheresse buccale ou une sensation de soif, un goût métallique, des crampes abdominales, des nausées, des vomissements, des diarrhées, une constipation, des exanthèmes, une polyurie, une acidose, des douleurs musculaires et osseuses, ainsi que, chez l’enfant, une hypotonie peuvent survenir. Des modifications psychiques ainsi que des troubles de la conscience sont aussi possibles dans les cas sévères.
Un surdosage chronique peut s’accompagner d’une détérioration de la fonction rénale, d’une néphrocalcinose, de modifications du poids, d’une pancréatite, d’une anémie et de crises convulsives. Un retard de croissance peut apparaître chez l’enfant et une ostéoporose peut survenir chez l’adulte. En outre, l’hypercalcémie peut provoquer des calcifications dans les vaisseaux et les organes.
L’utilisation de DIBASE doit être arrêtée lorsque la concentration sérique de calcium dépasse 10,6 mg/dl (2,65 mmol/l) et/ou la concentration urinaire de calcium dépasse 300 mg/24 heures chez l’adulte et 4-6 mg/kg/jour chez l’enfant.
Le cholécalciférol étant stocké dans l’organisme, une hypercalcémie secondaire à un surdosage chronique de vitamine D peut persister pendant plusieurs semaines ou mois.
Traitement
Il n’existe pas d’antidote spécifique. Le traitement de l’hypercalcémie est de première importance.
La première mesure à prendre est d’arrêter le produit (ainsi que de toutes les préparations supplémentaires de calcium). Le traitement dépend ensuite du degré de sévérité des symptômes et peut comporter les mesures suivantes: alimentation pauvre en calcium ou sans calcium, apport liquidien abondant, diurèse forcée (furosémide), administration de glucocorticoïdes et éventuellement de diurétiques, et le cas échéant hémodialyse ou dialyse péritonéale. L’administration de calcitonine peut aussi être indiquée en cas de surdosage chronique.
En cas d’intoxication aigüe (p. ex. en cas de surdosage accidentel), des vomissements provoqués, un lavage gastrique ou l’administration de produits à base d’huile minérale peuvent être indiqués.
Propriétés/EffetsCode ATC : A11CC05 - Vitamine D3 et analogues, cholécalciférol
Mécanisme d’action
La vitamine D est une substance présente à l’état naturel dans l’organisme humain. Le 7-déhydrocholestérol est transformé dans la peau en vitamine D3 (cholécalciférol) sous l’action des rayons UV (lumière solaire). La vitamine D3 est également apportée en quantité minime par l’alimentation (lait, beurre, jaune d’œuf, foie). Le cholécalciférol se transforme en sa forme biologiquement active, le 1,25-dihydroxycholécalciférol (calcitriol), après avoir subi deux hydroxylations successives, la première dans le foie (position 25) et la deuxième dans le tissu rénal (position 1).
Le calcitriol régule le métabolisme du calcium et du phosphate avec la parathormone et la calcitonine. Il favorise l’absorption intestinale de calcium, la fixation de calcium dans l’ostéoïde et la libération de calcium du tissu osseux. Par ailleurs, il stimule le transport passif et actif du phosphate. Dans le rein, le calcitriol inhibe l’élimination du calcium et du phosphate en favorisant la réabsorption tubulaire. La forme biologiquement active de la vitamine D3 inhibe directement la formation de parathormone (PTH) dans les glandes parathyroïdes. En outre, la sécrétion de PHT est inhibée par l’absorption accrue de calcium dans l’intestin grêle. Les besoins minimaux en vitamine D sont compris entre 400 et 800 U.I. par jour, selon l’âge. Les adultes sains peuvent couvrir leur besoins par synthèse propre lors d’une exposition suffisante au soleil.
En cas de carence en vitamine D, la calcification du squelette fait défaut (rachitisme) ou une décalcification osseuse apparaît (ostéomalacie). Les causes possibles d’une carence en vitamine D chez l’adulte sont notamment une exposition insuffisante aux rayons UV, une malabsorption ou une maldigestion (p. ex. en cas de maladie cœliaque), une cirrhose hépatique, une insuffisance rénale ainsi qu’un traitement par des anticonvulsivants ou des glucocorticoïdes.
PharmacocinétiqueAbsorption
En présence de restes alimentaires, la vitamine D3 est rapidement et presque complètement absorbée par le tractus gastro-intestinal.
Distribution
Le cholécalciférol et ses métabolites sont liés à des alpha-globulines spécifiques. Les principaux lieux de stockage sont le foie et le tissu adipeux.
Métabolisme
Après hydroxylation dans le foie en 25-hydroxycholécalciférol, une deuxième hydroxylation a lieu dans les reins et conduit à la formation du métabolite actif 1,25-dihydroxycholécalciférol (calcitriol).
Élimination
La vitamine D3 et ses métabolites sont éliminés essentiellement par la bile et les fèces.
Cinétique pour certains groupes de patients
Troubles de la fonction rénale
La clairance métabolique décrite chez les patients présentant une insuffisance rénale a été de 57% inférieure à celle observée chez les sujets ayant une fonction rénale normale.
Malabsorption
Dans les syndromes de malabsorption, l’absorption de la vitamine D3 est réduite et l’élimination augmentée.
Données précliniquesToxicité en cas d’administration répétée
Les études précliniques réalisées chez différentes espèces animales ont montré l’apparition d’effets toxiques à des doses largement supérieures à celles nécessaires à l’utilisation thérapeutique chez l’être humain.
Dans les études de toxicité après administration répétée, les effets les plus fréquemment décrits ont été une augmentation de la calciurie et une diminution de la phosphaturie ainsi qu’une protéinurie.
Une hypercalcémie peut survenir à fortes doses. Lors d’une hypercalcémie prolongée, des modifications histologiques (calcification) ayant plus fréquemment touché les reins, le cœur, l’aorte, les testicules, le thymus et la muqueuse intestinale ont été constatées.
Toxicité sur la reproduction
Chez l’animal, le cholécalciférol (vitamine D3) s’est avéré tératogène à fortes doses.
Aux doses correspondant à celles utilisées en thérapeutique, le cholécalciférol (vitamine D3) n’a pas eu d’activité tératogène.
Remarques particulièresIncompatibilités
Aucune étude de compatibilité n’ayant été effectuée, ce médicament ne doit pas être mélangé avec d’autres médicaments.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l’emballage.
Stabilité après ouverture
À utiliser dans les 6 mois suivant l’ouverture.
Remarques particulières concernant le stockage
Ne pas conserver au-dessus de 30 °C.
Ne pas conserver au réfrigérateur.
Ne pas congeler.
Conserver le récipient dans son carton pour le protéger de la lumière.
Conserver hors de portée des enfants.
Remarques concernant la manipulation
Flacon avec bouchon compte-gouttes séparé
DIBASE doit être pris de préférence avec un repas (voir «Posologie/Mode d’emploi»). Ne pas conserver les produits ou aliments auxquels DIBASE 10 000 a été ajouté pour les utiliser ou les prendre ultérieurement lors d’un prochain repas.
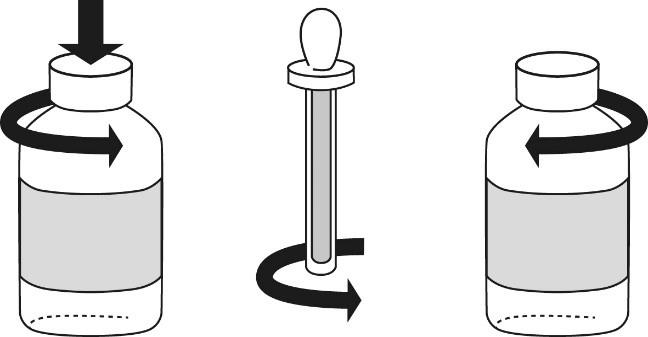
Les emballages contiennent 1 flacon et un bouchon pipette. Le flacon est fermé par un capuchon en plastique muni d’unesécurité enfant. La pipette est protégée par un cylindre en plastique. Suivre les instructions suivantes pour l’utilisation:
a.Agiter avant l’emploi.
b.Pour ouvrir le flacon, appuyer sur le couvercle tout en le tournant (voir fig. 1).
c.Avant l’utilisation du bouchon pipette, il convient de dévisser le cylindre en plastique du bouchon pipette (voir fig. 2).
d.Introduire le bouchon pipette dans le flacon pour prélever le contenu. Mettre le nombre prescrit de gouttes dans une cuillère.
e.Fermer le flacon avec le couvercle (voir fig. 3). Remettre le bouchon pipette au cylindre en plastique et le visser.
f.Remettre le flacon et le bouchon pipette dans l’emballage d’origine.
|
Figure 1
|
Figure 2
|
Figure 3
|
Flacon compte-gouttes
La boîte pliante contient un flacon compte-gouttes. Le flacon est fermé par un capuchon en plastique avec sécurité enfant. Les instructions d'ouverture et d'utilisation sont indiquées ci-dessous :
a. Pour ouvrir le flacon, appuyez sur le couvercle tout en le tournant.
b. Mettre le flacon compte-gouttes à la verticale et déposer le nombre de gouttes prescrit sur une cuillère.
c. Après l'administration des gouttes, remettre le flacon compte-gouttes dans sa position verticale normale.
d. Fermer le flacon avec le bouchon.
e. Remettre le flacon compte-gouttes dans son carton d'origine.
Numéro d’autorisation65856 (Swissmedic)
PrésentationDIBASE 10’000 U.I., solution buvable:
10 ml avec compte-gouttes séparé (D)
10 ml dans un flacon compte-gouttes (D)
Titulaire de l’autorisationEffRx Pharmaceuticals SA, 8807 Freienbach
Mise à jour de l’informationNovembre 2022
|

