CompositionPrincipes actifs
Calcipotriol sous forme de monohydrate de calcipotriol et bétaméthasone sous forme de dipropionate de bétaméthasone.
Excipients
Vaseline blanche, éther de 11-stéaryl polyoxypropylène, paraffine liquide, alpha-tocophérol, butylhydroxytoluène (E 321, 0,05 mg/g), gaz propulseur: butane, éther diméthylique.
Indications/Possibilités d’emploiTraitement du psoriasis vulgaire chez l'adulte.
Posologie/Mode d’emploiPosologie usuelle
Enstilar mousse doit être appliquée 1x par jour sur les zones de la peau affectées.
La durée recommandée de traitement par Enstilar est de 4 semaines.
En cas de réponse clinique au traitement initial par Enstilar et de récidive des lésions psoriasiques après la fin du traitement, le traitement par Enstilar peut être répété. Voir «Propriétés/Effets».
Dose maximale
La dose maximale journalière d'Enstilar ne doit pas dépasser 15 g et la dose maximale par semaine ne doit pas dépasser 100 g (cela signifie qu'un flacon de 60 g doit durer au moins 4 jours).
En cas d'utilisation simultanée d'autres produits topiques contenant du calcipotriol, la dose totale de produits contenant du calcipotriol (Enstilar inclus) ne doit pas dépasser 100 g.
Ne pas appliquer Enstilar sous pansement occlusif.
Il convient d'éviter de traiter plus de 30% de la surface corporelle totale avec des médicaments contenant du calcipotriol, voir «Mises en garde et précautions».
Enfants et adolescents
L'utilisation d'Enstilar n'est pas recommandé chez les enfants et les adolescents de moins de 18 ans.
Mode d'administration
Agiter le flacon aérosol avant utilisation. Pulvériser Enstilar en tenant le flacon à une distance d'au moins 3 cm de la peau. Lors de la pulvérisation le flacon peut être tenue dans n'importe quelle orientation sauf horizontalement. Frotter Enstilar délicatement sur les zones de la peau affectées.
Lors de l'application sur le cuir chevelu, Enstilar doit être pulvérisé dans la paume de la main, puis appliqué avec le bout des doigts sur les zones du cuir chevelu affectées. La notice d'emballage contient des instructions pour le lavage des cheveux.
Les mains doivent être lavés après chaque utilisation d'Enstilar (sauf si Enstilar est utilisé pour traiter les mains) pour éviter un transfert accidentel sur d'autres parties du corps. Il est recommandé de ne pas prendre de douche ni de bain immédiatement après l'application d'Enstilar.
Contre-indicationsHypersensibilité à l'un des principes actifs ou à un ou plusieurs excipients (voir «Composition»).
Ne pas appliquer Enstilar sur le visage, surtout à proximité des yeux (risque de cataracte).
Enstilar est contre-indiqué en cas de psoriasis en gouttes, érythrodermique, exfoliatif et pustuleux.
Enstilar ne doit pas être appliqué sous pansement occlusif car cela a entraîné une augmentation considérable des cas de folliculites dans le cadre d'une étude conduite avec des sujets sains.
Étant donné qu'Enstilar contient du calcipotriol, son utilisation est contre-indiquée chez les patients présentant des troubles avérés du métabolisme calcique (voir «Mises en garde et précautions»). En outre, comme Enstilar contient un corticostéroïde, son utilisation est également contre-indiquée en cas d'affections virales de la peau (p.ex. herpes ou varicelle) et d'infections dues à des champignons, des bactéries et des parasites, lors de manifestations cutanées liées à la tuberculose ou la syphilis, de dermatite périorale, d'atrophie cutanée, de vergetures, en cas de fragilité accrue du réseau cutané veineux, d'ichthyose, d'acné vulgaire, d'acné rosacée, de rosacée, d'ulcérations cutanées, de plaies et de prurit périanal et génital (voir «Mises en garde et précautions»).
Enstilar est contre-indiqué chez les patients atteints d'insuffisance rénale grave ou d'insuffisance hépatique grave.
Comme on ne dispose pas d'expériences concernant l'emploi du médicament chez l'enfant à ce jour, Enstilar ne doit pas être utilisé chez l'enfant.
Mises en garde et précautionsInflammabilité
Enstilar mousse contient des gaz propulseurs inflammables, le butane et l'éther diméthylique. Il faut attirer l'attention des patients sur le fait qu'il ne faut pas utiliser Enstilar mousse à proximité de flammes, flammes nues et cigarettes allumées pendant ou peu de temps après l'application.
Application correcte
Il faut instruire le patient sur l'utilisation correcte du médicament afin d'éviter toute application ou tout transfert accidentel sur le visage, la bouche ou les yeux.
Le patient doit se laver les mains après chaque application pour éviter tout transfert accidentel sur ces zones.
Influence sur le système endocrinien
Enstilar contient un stéroïde de la classe III (puissant), ainsi un traitement simultané par un autre corticoïde doit être évité. Grâce à la forme galénique de mousse d'Enstilar, les principes actifs, le dipropionate de bétaméthasone et le calcipotriol, sont mieux absorbés par la peau, que ceux des formes galéniques de pommade ou de gel disponibles pour Daivobet®. Dans le cadre d'une étude portant sur la vasoconstriction comparant l'effet d'Enstilar et de Daivobet® sur la circulation sanguine cutanée, Enstilar a montré un effet réducteur de la circulation sanguine cutanée significativement plus élevé, ce qui indique un effet plus puissant du corticostéroïde d'Enstilar par rapport à Daivobet®. Les effets indésirables observés lors d'un traitement systémique par corticoïde comme la suppression corticosurrénale ou la perturbation du contrôle métabolique du diabète sucré peuvent également se produire lors d'un traitement topique par corticoïde, en raison du passage éventuel du corticoïde dans la circulation générale.
L'application du produit sur de grandes surfaces de peau lésée comme les muqueuses ou dans les plis cutanés doit être évitée à cause du risque de résorption systémique accrue du corticostéroïde dans de tels cas (voir «Effets indésirables»).
La peau du visage et de la région génitale est très sensible aux corticostéroïdes. Un traitement de longue durée de ces régions doit être évité. Ces zones cutanées ne seront traitées qu'avec des corticoïdes moins puissants.
Des effets indésirables locaux (tels qu'une irritation oculaire ou une irritation cutanée du visage) ont occasionnellement été observés lors d'une application accidentelle d'un médicament similaire sur le visage, les yeux ou la conjonctive (voir «Effets indésirables» et «Propriétés/Effets»); en cas de contacts prolongés et répétés, il y a un risque de cataracte.
Troubles visuels
Des troubles visuels peuvent apparaitre lors d'une corticothérapie par voie systémique ou locale. Si un patient présente des symptômes tels qu'une vision floue ou d'autres troubles visuels, il faut envisager de l'adresser à un ophtalmologiste pour une évaluation des causes possibles; celles-ci comprennent, sans s'y limiter, la cataracte, le glaucome ou des affections rares telles que la choriorétinopathie séreuse centrale (CSC) qui ont été signalées après l'utilisation de corticostéroïdes par voie systémiques ou topiques.
Effets sur le métabolisme calcique
La surface corporelle totale traitée ne doit pas dépasser 30%.
En raison de la présence du calcipotriol dans Enstilar, une hypercalcémie peut survenir. Des hypercalcémies ont été observées avec d'autres produits contenant du calcipotriol. C'est la raison pour laquelle le taux de calcium sérique doit être contrôlé si la posologie maximale de 100 g/semaine est dépassée. La calcémie se normalise à l'arrêt du traitement. Le risque d'hypercalcémie est minime quand la dose maximale du calcipotriol par semaine n'est pas dépassée. En cas d'hypercalcémie, le traitement par Enstilar doit être interrompu jusqu'à ce que les paramètres du métabolisme calcique se soient à nouveau normalisés. L'hypercalcémie et l'hypercalciurie lors de l'administration d'Enstilar n'ont pas été évaluées sur une durée de plus de 4 semaines et un traitement plus long par Enstilar n'est pas recommandé.
Effets indésirables locaux
Enstilar contient un corticoïde puissant (de classe III) et l'utilisation simultanée d'autres corticoïdes sur la même zone de traitement doit être évitée.
La peau du visage et de la région génitale est très sensible aux corticoïdes. Le produit ne doit pas être utilisé sur ces zones.
Infections cutanées concomitantes
Lorsque les lésions du psoriasis se surinfectent, elles doivent être traitées par antibiotique. Cependant, si une aggravation de l'infection est observée, le traitement par corticoïde doit être interrompu (voir «Contre-indications»). Enstilar ne doit pas être appliqué sous pansement occlusif car cela a entraîné une augmentation considérable des cas de folliculites dans le cadre d'une étude conduite avec des sujets sains.
Arrêt du traitement
Le traitement d'un psoriasis par corticoïdes topiques présente un risque d'effet rebond à l'arrêt du traitement. Le développement d'une tolérance, le déclenchement d'un psoriasis pustuleux généralisé et d'une toxicité locale ou systémique peuvent survenir suite à la diminution de la fonction barrière de la peau. C'est pourquoi un suivi attentif du patient est important, même pendant la période suivant le traitement.
Traitement au long cours
Les traitements de longue durée sont associés à une augmentation du risque d'effets indésirables locaux et systémiques. La thérapie sera interrompue en cas d'effets indésirables dus au traitement corticostéroïdien de longue durée (voir «Effets indésirables»). L'arrêt d'un traitement de longue durée par corticostéroïde implique un risque d'effet rebond.
Utilisation non évaluée
Il n'existe pas de données concernant l'utilisation d'Enstilar dans le psoriasis en gouttes.
Exposition aux UV
Il est recommandé de limiter ou d'éviter les expositions intenses aux rayons UV (naturels ou artificiels) durant le traitement avec Enstilar. Le calcipotriol topique ne doit être utilisé conjointement à une irradiation UV que si le bénéfice potentiel est supérieur au risque potentiel après une évaluation soigneuse par le médecin et le patient (voir «Données précliniques»).
Effets indésirables liés aux principes actifs et excipients
Enstilar mousse contient du butylhydroxytoluène (E 321) comme excipient qui peut provoquer des réactions cutanées locales de la peau (par exemple dermatite de contact) ou une irritation des yeux et des muqueuses.
Des dermatites de contact allergiques, de l'urticaire et des réactions allergiques systémiques ont également été observées après l'administration de calcipotriol et de corticostéroïdes topiques tels que le dipropionate de bétaméthasone. Le diagnostic d'une dermatite de contact allergique aux corticostéroïdes topiques est plutôt posé sur la base de l'absence de guérison que sur la base d'une exacerbation clinique. Il convient le cas échéant de réaliser un examen adéquat au moyen d'un test épicutané (patch test).
Le patient doit être informé qu'il ne doit utiliser le médicament que pour son affection actuelle pendant la durée indiquée et s'abstenir de le transmettre à d'autres personnes.
InteractionsAucune étude d'interaction n'a été réalisée avec Enstilar.
Parce que l'acide salicylique inactive rapidement le calcipotriol, Enstilar mousse ne doit pas être mélangé avec des préparations contenant de l'acide salicylique. En revanche l'action de la bétaméthasone contenue dans Enstilar n'est cependant pas influencée par l'acide salicylique. L'acide salicylique n'est pas résorbé et reste quelques heures à la surface de la peau de sorte que l'effet du calcipotriol peut diminuer, même en cas d'application différée. Aucune expérience n'est disponible sur les interactions possibles avec d'autres produits antipsoriatiques.
Grossesse, allaitementGrossesse
Il n'existe pas de données suffisantes concernant l'application d'Enstilar chez la femme enceinte. Les études chez l'animal après administration orale de calcipotriol n'ont pas mis en évidence d'effets tératogènes, bien qu'une toxicité sur la reproduction ait été mise en évidence (voir «Données précliniques»). Les études chez l'animal ont montré en effet que les glucocorticoïdes présentaient une toxicité sur la reproduction, mais plusieurs études épidémiologiques (moins de 300 grossesses) n'ont trouvé aucun indice suggérant des malformations congénitales chez les enfants dont la mère avait été traitée par des corticostéroïdes. On n'a pas connaissance d'un risque potentiel chez la femme. Enstilar mousse ne devrait par conséquent pas être utilisé pendant la grossesse, sauf en cas de nécessité absolue.
Allaitement
La bétaméthasone passe dans le lait maternel. Aux doses thérapeutiques, les effets indésirables chez le nourrisson semblent cependant peu probables. On ne dispose pas de données sur le passage du calcipotriol dans le lait maternel. Enstilar ne devrait donc être administré qu'avec prudence aux femmes qui allaitent.
Si Enstilar doit être appliqué sur les seins, l'allaitement sera interrompu.
Effet sur l’aptitude à la conduite et l’utilisation de machinesEnstilar n'a aucune influence ou une influence négligeable sur l'aptitude à la conduite ou l'utilisation de machines.
Effets indésirablesL'estimation de la fréquence des effets indésirables repose sur l'analyse cumulée des données issues des études cliniques. Les effets indésirables les plus fréquemment rapportés au cours du traitement sont les réactions au site d'application.
Les effets indésirables sont présentés par classe de système-organe (SOC) selon MedDRA, et les effets indésirables individuels sont présentés au sein de chaque SOC par ordre décroissant de fréquence. Dans chaque catégorie de fréquence, les effets indésirables sont présentés par ordre décroissant de gravité.
Très fréquents ≥1/10
Fréquents ≥1/100 à <1/10
Occasionnels ≥1/1'000 à <1/100
Rares ≥1/10'000 à <1/1'000
Très rares <1/10'000
Fréquence inconnue ne peut être estimée sur la base des données disponibles
Infections et infestations
Occasionnels: Folliculite (observée plus fréquemment lors de d'une utilisation non recommandée sous pansement occlusif).
Affections du système immunitaire
Occasionnels: Hypersensibilité (peut inclureurticaire, œdème et réactions allergiques systémiques telles que gonflement des lèvres et de la langue ainsi que difficultés respiratoires).
Troubles du métabolisme et de la nutrition
Occasionnels: Hypercalcémie, hypercalciurie.
Affections oculaires
Non connu: Vision floue (voir «Mises en garde et précautions»).
En cas d'utilisation prolongée (voir «Propriétés/Effets»).
Fréquents: Cataractes.
Occasionnels: Choriorétinopathie.
Affections de la peau et du tissu sous-cutané
Occasionnels: Hypopigmentation de la peau, exacerbation du psoriasis.
Fréquence inconnue: Modification de la couleur des cheveux (pour les produits combinés avec le calcipotriol et la bétaméthasone, un changement temporaire de la couleur des cheveux blancs ou gris au site d'application vers le jaunâtre a été rapporté), érythème au site d'application
Troubles généraux et anomalies au site d'administration
Occasionnels: Effet rebond, douleurs au site d'application, y compris brûlures au site d'application, prurit au site d'application, irritation au site d'application.
Fréquence inconnue: Érythème au site d'application.
Troubles vasculaires
En cas d'utilisation prolongée (voir «Propriétés/Effets»).
Dans l'étude à long terme LP0053-1004, on a constaté une distribution inégale des événements cardiovasculaires graves lors de l'utilisation régulière d'Enstilar mousse 2x par semaine pendant une période allant jusqu'à 1 an par rapport au traitement intermittent. Une évaluation causale de ces cas n'est pas possible avec certitude.
Les effets indésirables suivants, considérés comme liés à la classe pharmacologique du calcipotriol et de la bétaméthasone, sont respectivement:
Calcipotriol
Les effets indésirables regroupent des réactions au site d'application, prurit, irritations cutanées, brûlure et picotements, sècheresse cutanée, érythème, rougeur cutanée, dermatite, eczéma, aggravation du psoriasis, photosensibilité et réactions d'hypersensibilité y compris angio-œdème et œdème au niveau du visage dans des cas très rares. Les effets systémiques observés après utilisation topique sont très rares et se résument à une hypercalcémie ou à une hypercalciurie (voir «Mises en garde et précautions»).
Bétaméthasone (sous forme de dipropionate)
Les réactions locales pouvant apparaître après utilisation topique, notamment après une durée de traitement prolongée, regroupent atrophie de la peau, télangiectasies, stries, folliculite, hypertrichose, dermatite périorale, dermatite allergique de contact, dépigmentation, et milium colloïde. Le risque de psoriasis pustuleux généralisé existe lors du traitement du psoriasis avec des corticoïdes topiques. Les effets indésirables systémiques observés après l'application topique de corticoïdes sont certes rares chez l'adulte, mais elles peuvent être sévères. Une suppression corticosurrénale, une cataracte, des infections, des modifications au niveau du contrôle métabolique d'un diabète sucré et une augmentation de la pression intraoculaire peuvent survenir, notamment après un traitement prolongé. Un effet systémique apparaît plus fréquemment lors d'une application sous occlusion (feuille plastique, plis cutanés), sur de grandes surfaces et lors d'un traitement de longue durée (voir «Mises en garde et précautions»).
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageSignes et symptômes
Le dépassement du dosage recommandé susmentionné peut entraîner une élévation du taux de calcium sérique qui revient à la normale à l'arrêt du traitement. Les symptômes de l'hypercalcémie incluent polyurie, constipation, faiblesse musculaire, confusion et coma. Une prolongation excessive de la durée de la corticothérapie locale peut inhiber la fonction hypophyso-surrénale, ce qui entraîne une insuffisance surrénale, normalement réversible. Dans de tels cas, un traitement symptomatique est indiqué. En cas de toxicité chronique, l'arrêt de la corticothérapie doit se faire progressivement. Un cas de syndrome de Cushing et de psoriasis pustuleux après arrêt brusque du traitement a été rapporté chez un patient souffrant à la base d'un psoriasis érythrodermique extensif traité de manière abusive par 240 g de Daivobet® par semaine (dose maximale: 100 g/semaine, cf. «Posologie/Mode d'emploi» et «Mises en garde et précautions») durant 5 mois.
Propriétés/EffetsCode ATC
D05AX52
Mécanisme d'action
Enstilar mousse associe les effets pharmacologiques du calcipotriol monohydrate qui est un analogue synthétique de la vitamine D3 et du dipropionate de bétaméthasone, un corticoïde d'origine synthétique.
Comme d'autres corticostéroïdes topiques, le dipropionate de bétaméthasone contenu dans Enstilar possède des propriétés anti-inflammatoires, immunosuppressives et vasoconstrictrices.
En association dans Enstilar, les effets anti-inflammatoires et antiprolifératifs du calcipotriol monohydrate et du dipropionate de bétaméthasone sont plus importants que lorsque ces composants sont utilisés seuls.
Bien que leurs effets pharmacologiques et cliniques soient connus, leur mécanisme d'action exact sur le psoriasis vulgaire n'est pas entièrement élucidé.
Pharmacodynamique
Vasoconstriction:
Dans le cadre d'une étude portant sur la vasoconstriction réalisée chez des sujets sains, Enstilar a été comparé à des corticostéroïdes de différentes classes d'activité et la réponse vasoconstrictrice à Enstilar était significativement plus importante que celle à une pommade contenant du calcipotriol et du dipropionate de bétaméthasone (corticostéroïde puissant, de classe III), mais plus faible que celle d'une crème contenant du clobétasol (corticostéroïde très puissant, de classe IV).
Suppression de l'axe hypothalamo-hypophyso-surrénalien (HHS):
Données à court terme sur 4 semaines
Dans des conditions d'application maximale, chez des sujets avec un psoriasis étendu sur le corps ou le cuir chevelu ayant été traités jusqu'à 4 semaines, la réponse surrénalienne à l'ACTH (adrénocorticotrophine) a été déterminée par la mesure du taux de cortisol. Aucun des 35 sujets ne présentait de réduction du taux de cortisol sérique 30 à 60 minutes après la stimulation par l'ACTH.
Données à long terme
La réponse surrénalienne à l'ACTH a été évaluée dans un sous-groupe de sujets adultes atteints de psoriasis vulgaire modéré à sévère affectant au moins 10% de la surface corporelle. Les sujets ont été randomisés pour recevoir Enstilar ou le véhicule de la mousse 2x par semaine pendant 52 semaines (traitement d'entretien à long terme). Les patients ayant fait une récidive ont été traités avec Enstilar 1x par jour pendant 4 semaines, puis ont poursuivi le traitement randomisé.
Après 52 semaines de traitement, un total de 2 sujets sur 21 dans le groupe Enstilar et 1 sujet sur 19 dans le groupe véhicule de la mousse ont présenté des taux de cortisol ≤18 µg/dl 30 minutes après l'exposition à l'ACTH. Un 3ème sujet du groupe Enstilar, qui avait un taux de cortisol normal à 30 minutes, a montré un taux de cortisol diminué <18 µg/dL à 60 minutes. Aucun des sujets de l'un ou l'autre groupe de traitement n'a présenté des taux de cortisol ≤18 µg/dL après 30 et 60 minutes (voir « Mises en garde et précautions »). Cette étude n'a pas mis en évidence d'effet cliniquement significatif sur le métabolisme calcique.
Effets sur le métabolisme calcique:
Les effets de l'application d'Enstilar une fois par jour pendant 4 semaines sur le métabolisme calcique de sujets adultes (N = 564) atteints de psoriasis vulgaire ont également été étudiés dans le cadre de trois études cliniques randomisées, multicentriques, prospectives, contrôlées contre véhicule et/ou substance active. Après application une fois par jour d'Enstilar, une élévation du taux de calcium sérique au-delà de l'intervalle normal a été observée chez 3 sujets. Une élévation du taux de calcium dans un échantillon d'urine spontanée, au-delà de l'intervalle normal, a été observée chez 17 patients.
Dans ces études Enstilar a entraîné répétitivement un rapport calcium urinaire/créatinine moyen plus élevé que le traitement de comparaison par Daivobet® pommade. Cela indique qu'Enstilar dispose d'un effet catabolique plus puissant sur le métabolisme osseux que Daivobet® pommade. L'effet d'Enstilar mousse sur le métabolisme osseux a été examiné sur une période maximale de 4 semaines. Un traitement plus long par Enstilar mousse n'est pas recommandé.
Efficacité clinique
Données à court terme sur 4 semaines
L'efficacité d'Enstilar utilisé une fois par jour a été évaluée dans trois études cliniques de 4 semaines randomisées, en double aveugle ou à l'insu de l'investigateur, incluant plus de 1100 patients atteints d'un psoriasis du corps (et également du cuir chevelu dans l'Etude 2) d'une sévérité au moins modérée selon le Physician's Global Assessment of disease severity (PGA), touchant au minimum 2% de la surface corporelle (BSA), et avec un score PASI (Psoriasis Area Severity Index) modifié (m-PASI) au moins égal à 2. Le PGA est calculé en utilisant une échelle à 5 points (blanchi, presque blanchi, léger, modéré et sévère) basée sur la sévérité moyenne des lésions. Le m-PASI est un score composite qui évalue la sévérité (érythème, squame et induration) et la surface atteinte (à l'exception du visage et des plis cutanés).
Dans le cadre de l'étude 1, 426 patients ont aléatoirement été répartis dans le groupe «Enstilar mousse» ou dans le groupe «véhicule de la mousse». Dans le cadre de l'étude 2, 302 patients ont été répartis aléatoirement dans les groupes «Enstilar mousse», «dipropionate de bétaméthasone (BDP) mousse», ou «calcipotriol mousse». Dans le cadre de l'étude 3, 376 patients ont aléatoirement été répartis dans les groupes «Enstilar mousse», «Daivobet® pommade», «véhicule de la mousse» ou «véhicule de la pommade». Le critère d'évaluation primaire était le «pourcentage de patients répondant au traitement selon le PGA après la semaine 4: blanchi ou presque blanchi chez les patients avec une maladie au moins d'intensité modérée au début du traitement (base), et blanchi chez les patients avec une maladie d'intensité légère au début du traitement.
Caractéristiques de la maladie à jour 0
|
|
Étude 1 (N=426)
|
Étude 2 (N=302)
|
Étude 3 (N=376)
| |
Sévérité de la maladie à jour 0 (PGA)
| |
Légere
|
65 (15,3%)
|
41 (13,6%)
|
63 (16,8%)
| |
Modéré
|
319 (74,9%)
|
230 (76,2%)
|
292 (77,7%)
| |
Sévère
|
42 (9,9%)
|
31 (10,3%)
|
21 (5,6%)
| |
Surface corporelle moyenne (intervalle)
|
7,5% (2 – 30%)
|
7,1% (2 – 28%)
|
7,5% (2 – 30%)
| |
m-PASI moyen (intervalle)
|
7,5 (2,0 – 47,0)
|
7,6 (2,0 – 28,0)
|
6,8 (2,0 – 22,6)
|
Pourcentage de patients répondant au traitement selon le PGA du corps à la semaine 4
|
|
Enstilar
|
Véhicule de la mousse
|
Bétaméthasone mousse
|
Calcipotriol mousse
|
Daivobet®
pommade
|
Véhicule de la pommade
| |
Étude 1
|
(N=323)
53,3%
|
(N=103)
4,8%
|
-
|
-
|
-
|
-
| |
Étude 2
|
(N=100)
45,0%
|
-
|
(N=101)
30,7%
|
(N=101)
14,9%
|
-
|
-
| |
Étude 3
|
(N=141)
54,6%
|
(N=49)
6,1%
|
-
|
-
|
(N=135)
43,0%
|
(N=51)
7,8%
|
Des résultats pour le critère primaire «pourcentage de patients répondant au traitement» sur le corps (PGA) à la semaine 4 ont montré qu'Enstilar était significativement plus efficace que tous les comparateurs inclus et que les réponses ont été observées dans tous les niveaux de sévérité de la maladie évalués à J0.
L'effet d'Enstilar sur la qualité de vie a été étudié dans l'étude 1 grâce au questionnaire générique EQ-5D-5L et au questionnaire spécifique à la dermatologie DLQI.
Une amélioration de la qualité de vie significativement plus importante en faveur d'Enstilar a été démontrée, en comparaison aux patients ayant reçu le véhicule de la mousse, avec le questionnaire DLQI à partir de la semaine 1 et tout au long du traitement. Après quatre semaines, une amélioration de la qualité de vie significativement plus importante en faveur d'Enstilar a été démontrée, en comparaison aux patients ayant reçu le véhicule de la mousse, avec le questionnaire EQ-5D-5L.
Données à long terme
L'étude LP0053-1004 (NCT02899962), randomisée, en double aveugle et contrôlée par véhicule, a évalué l'utilisation à long terme d'Enstilar mousse chez des patients atteints de psoriasis ayant obtenu un succès durable du traitement (défini par un score PGA (Physician's Global Assessment of disease severity) de «aucun» ou «presque aucun» avec au moins 2 niveaux d'amélioration par rapport au jour 0). Initialement, un total de 650 patients atteints de psoriasis ont été traités par Enstilar mousse en une application quotidienne dans le cadre d'un traitement ouvert de 4 semaines (phase de rodage). Parmi les patients qui ont atteint l'objectif de traitement avec Enstilar mousse après les 4 semaines, 521 patients ont été randomisés pour continuer à recevoir Enstilar mousse ou le véhicule de la mousse deux fois par semaine pendant 2 jours non consécutifs pendant un total de 52 semaines supplémentaires. La gravité du psoriasis a été évaluée à l'aide d'un score PGA en 5 points. La majorité des patients de cette étude (82%) avaient une maladie de gravité «modérée» au départ, 11% des patients avaient une maladie de gravité «légère» au départ et 7% des patients avaient une maladie «sévère» au départ. L'étendue de l'atteinte de la maladie, mesurée par la surface corporelle moyenne, au départ était de 8,3% (de 1 à 38%). Les patients des deux bras qui ont présenté une perte de réponse (définie par un score PGA d'au moins «léger») au cours des 52 semaines ont été traités par Enstilar mousse une fois par jour pendant 4 semaines. Par la suite, ceux qui ont retrouvé un score PGA «nul» ou «presque nul» après 4 semaines de traitement quotidien avec Enstilar mousse ont continué le traitement randomisé initial avec Enstilar mousse ou le véhicule de la mousse 2 jours par semaine.
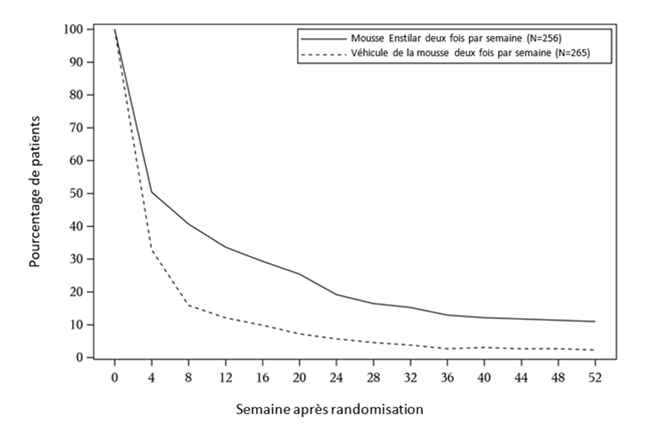
Le temps médian jusqu'à la perte de l'effet thérapeutique était de 56 jours pour les patients traités avec la mousse Enstilar deux fois par semaine, contre 30 jours pour les patients traités avec la véhicule de la mousse deux fois par semaine. Au cours de la période d'évaluation de 52 semaines, les patients du groupe Enstilar, administré deux fois par semaine, ont connu une médiane de 2,0 rechutes par rapport aux patients du groupe véhicule de la mousse, administré deux fois par semaine, qui ont connu une médiane de 3.0 récidives au total sur 52 semaines.
Les données disponibles sur la consommation dans le cadre d'un traitement de sauvetage n'ont pas montré un bénéfice cohérent de l'Enstilar par rapport au véhicule. Il ne peut être exclu qu'il y ait une forte augmentation de la consommation d'Enstilar dans un sous-groupe de sujets traités en permanence par Enstilar. L'image 1 montre le pourcentage de sujets qui ont conservé un score PGA «nul» ou «presque nul» jusqu'à la semaine 52 après la randomisation.
Image 1: Pourcentage de patients qui ont conservé un score PGA «nul» ou «presque nul» jusqu'à la semaine 52 après la randomisation.
PharmacocinétiqueAbsorption
L'ampleur de l'absorption percutanée des deux principes actifs après application topique d'Enstilar a été déterminée dans le cadre de l'étude portant sur l'axe HHS chez les patients avec un psoriasis vulgaire étendu (voir «Pharmacodynamique», étendue moyenne du psoriasis sur le corps de 17,5%, étendue moyenne du psoriasis sur la tête de 50,2%, quantité moyenne d'Enstilar appliquée par semaine pendant 4 semaines de 61,8 g ± 27,7 g écart-type (SD)). Les concentrations de calcipotriol et de dipropionate de bétaméthasone étaient inférieures à la limite de détection dans la plupart des échantillons des 35 patients ayant reçu le traitement une fois par jour pendant quatre semaines.
Le calcipotriol était quantifiable chez 1 sujet sur 35 (2,9%) et son métabolite principal, le MC1080, était quantifiable chez 3 patients sur 35 (8,6%). Chez les patients pour lesquels les concentrations étaient mesurables, la concentration plasmatique maximale (Cmax) et l'aire sous la courbe jusqu'au dernier point mesuré (AUClast) du calcipotriol étaient respectivement de 55,9 pg/mL et de 82,5 pg*h/mL; et les Cmax et AUClast moyennes ± écart-type du MC1080 étaient respectivement de 24,4 ± 1,9 pg/mL et de 59,3 ± 5,4 pg*h/mL. Le dipropionate de bétaméthasone était quantifiable chez 5 patients sur 35 (14,3%) et son métabolite principal, le bétaméthasone-17-propionate (B17P), était quantifiable chez 27 patients sur 35 (77,1%). Chez les patients pour lesquels les concentrations étaient mesurables, les concentrations plasmatiques maximales (Cmax) du dipropionate de bétaméthasone et du B17P étaient respectivement de 52,2 pg/mL et de 148 pg/mL. Les Cmax et AUClast moyennes ± écart-type étaient respectivement de 52,2 ± 19,7 pg/mL et de 36,5 ± 27,4 pg*h/mL pour le dipropionate de bétaméthasone et respectivement de 147,9 ± 224,0 pg/mL et de 683,6 ± 910,6 pg*h/mL pour le B17P. La signification clinique de ces résultats est incertaine.
Distribution
Chez les rats, les études de distribution tissulaire du calcipotriol et du dipropionate de bétaméthasone radiomarqués ont montré que le rein et le foie avaient le taux le plus élevé de radioactivité.
Métabolisme
Après une exposition systémique, les deux substances actives – calcipotriol et dipropionate de bétaméthasone – sont rapidement et largement métabolisées. Le bétaméthasone-17-propionate (B17P) représente le métabolite principal du dipropionate de bétaméthasone.
Le calcipotriol systémique est rapidement métabolisé: les études effectuées sur l'animal ont montré que la demi-vie sérique du calcipotriol administré par voie orale est inférieure à 2 heures. Cela permet de supposer que les quantités résiduelles constatées chez l'être humain quelques heures après l'application, sont surtout constituées de métabolites inactifs. Comme l'a montré l'expérimentation animale, le calcipotriol et ses métabolites sont surtout absorbés par le foie et les reins et dans une moindre mesure par les tissus graisseux et musculaires ainsi que par la rate. L'élimination s'effectue par les voies rénale et hépatique. On ignore si le calcipotriol passe dans le lait maternel après sa résorption systémique.
Les corticostéroïdes sont très fortement liés aux protéines de la circulation. Ils sont surtout métabolisés dans le foie mais aussi dans les reins et excrétés par les reins.
La présence simultanée des deux principes actifs n'influence pas leur pharmacocinétique.
Élimination
L'excrétion du calcipotriol se fait principalement via les selles (rats et cochons nains) et pour le dipropionate de bétaméthasone via les urines (rats et souris).
Données précliniquesDipropionate de bétaméthasone
Les données non cliniques issues des études conventionnelles de pharmacologie de sécurité, toxicologie en administration cutanée répétée, génotoxicité, n'ont pas révélé de risque particulier pour l'homme.
Carcinogénicité
Une étude de carcinogénicité par voie cutanée chez la souris et une étude de carcinogénicité par voie orale chez le rat n'ont pas révélé de risque augmenté de carcinogénicité du dipropionate de bétaméthasone.
Toxicité sur la reproduction
Les études réalisées avec des corticoïdes chez l'animal ont montré une toxicité pour la reproduction (fente palatine, malformations du squelette). Dans les études sur les fonctions de reproduction réalisées chez le rat après administration orale au long cours de corticoïdes, un allongement du temps de gestation ainsi qu'un travail prolongé et difficile ont été observés. Par ailleurs, une diminution de la survie, du poids corporel et de la prise de poids de la progéniture ont été observées. Il n'y a pas eu d'altération de la fertilité. La pertinence de ces données pour l'homme n'est pas connue.
Calcipotriol
Les données non cliniques issues des études conventionnelles de pharmacologie de sécurité, toxicologie en administration cutanée répétée, génotoxicité, n'ont pas révélé de risque particulier pour l'homme.
Carcinogénicité
Une étude de carcinogénicité par voie cutanée chez la souris et une étude de carcinogénicité par voie orale chez le rat n'ont pas révélé de risque augmenté de carcinogénicité.
Des études de photo(co)carcinogénicité chez la souris suggèrent que le calcipotriol pourrait augmenter l'effet inducteur de tumeurs cutanées des radiations UV.
Toxicité sur la reproduction
Chez le rat et le lapin, à la suite de l'administration orale d'une dose de 54 µg/kg/j et de 12 µg/kg/j respectivement, le calcipotriol a montré une toxicité maternelle et fœtale. Les anomalies fœtales observées de manière concomitante avec une toxicité maternelle ont inclus des signes révélateurs d'une immaturité du squelette (ossification incomplète des os du pubis et des phalanges des pattes avant, et des fontanelles hypertrophiées) et une incidence de côtes surnuméraires augmentée.
Combinaison de bétaméthasone et calcipotriol
Autres données (toxicité locale)
Dans le cadre d'une étude portant sur la tolérance locale, la combinaison de bétaméthasone et de calcipotriol a occasionné de légères irritations cutanées chez le lapin et le cochon nain ainsi que de légères irritations oculaires passagères chez le lapin. Une étude in vitro menée sur un modèle de peau a montré une perméation cutanée du calcipotriol 3 fois plus élevée et une perméation cutanée de la bétaméthasone 2 fois plus élevée avec Enstilar qu'avec Daivobet® pommade.
Remarques particulièresIncompatibilités
Enstilar ne doit pas être mélangé avec d'autres médicaments.
Stabilité
Enstilar ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Stabilité après ouverture
Les emballages entamés se conservent pendant 6 mois.
Les médicaments qui ne sont plus utilisés doivent être éliminés de façon appropriée. Ces mesures contribuent à protéger l'environnement.
Remarques particulières concernant le stockage
Conserver hors de portée des enfants.
Conserver le récipient bien fermé à 15-30°C. Protéger du soleil et ne pas exposer à une température supérieure à 50°C.
Mise en garde: extrêmement inflammable. Flacon pressurisé. Peut exploser s'il est chauffé.
Ne pas percer ni brûler le flacon, ceci s'applique aussi si le flacon est vide. Ne pas pulvériser sur des flammes ou des objets incandescents. Tenir loin des étincelles/ des flammes nues. – Ne pas fumer lors de l'utilisation.
Remarques concernant la manipulation
Agiter le flacon aérosol avant utilisation.
Afin d'éviter tout actionnement accidentel lorsque vous n'utilisez pas le médicament, refermez le flacon avec le capuchon après application du médicament.
Numéro d’autorisation65893 (Swissmedic)
PrésentationEnstilar mousse est disponible en emballage de 1 flacon aérosol (60 g). [B]
Le flacon aérosol contient 60 g de mousse (gaz propulseur non compris).
Titulaire de l’autorisationLeo Pharmaceutical Products Sarath Ltd., Kloten
Domicile: Zurich
Mise à jour de l’informationSeptembre 2021
|

