Propriétés/EffetsCode ATC
A10BJ02
Mécanisme d'action
Le liraglutide est un analogue acylé du glucagon-like peptide 1 humain (GLP-1) présentant 97 % d'homologie en termes de séquence d'acides aminés avec le GLP-1 humain, qui se lie au récepteur du GLP-1 et l'active.
Le GLP-1 est un régulateur physiologique de l'appétit et de la prise de nourriture, mais le mécanisme d'action exact n'est pas encore complètement connu. Au cours d'études d'expérimentation animale, l'administration périphérique de liraglutide a entraîné une assimilation dans des régions cérébrales spécifiques impliquées dans la régulation de l'appétit. En augmentant l'activité spécifique du GLP-1R, le liraglutide a provoqué une augmentation des signes principaux de satiété et une diminution des principaux signaux de faim, ce qui a entraîné une perte de poids.
Les récepteurs du GLP-1 agissent à des endroits spécifiques du cœur, du système vasculaire, du système immunitaire et des reins. Des études chez l'homme et chez l'animal ont montré que ces récepteurs pouvaient atténuer les effets cardiovasculaires du liraglutide, ainsi qu'entraîner une diminution de l'inflammation et une progression retardée de l'athérosclérose.
Pharmacodynamique
Le liraglutide entraîne une perte de poids chez l'homme essentiellement par la perte de masse adipeuse, la réduction relative de la graisse viscérale étant supérieure à celle de la graisse sous-cutanée. Le liraglutide régule l'appétit en augmentant la sensation de réplétion et de satiété tout en réduisant la sensation de faim et l'envie de manger, ce qui diminue la prise alimentaire. Le liraglutide n'augmente pas la dépense énergétique par rapport au placebo.
Le liraglutide stimule la sécrétion d'insuline et diminue la sécrétion de glucagon par un mécanisme glucose-dépendant, ce qui provoque une diminution de la glycémie postprandiale et de la glycémie à jeun. L'effet hypoglycémiant est plus marqué chez les patients pré-diabétiques et diabétiques que chez les patients dont les glycémies se situent dans des fourchettes normales. Des études cliniques suggèrent que le liraglutide améliore et prolonge la fonction bêta-cellulaire, selon le modèle HOMA-B, et le rapport pro-insuline/insuline.
Efficacité clinique
L'efficacité et la sécurité du liraglutide sur la régulation pondérale en association à une réduction de l'apport calorique et une augmentation de l'activité physique ont été évaluées au cours de quatre études randomisées en double aveugle et contrôlées par placebo, ayant inclus au total 5 358 patients.
Étude 1 (SCALE Obesity & Pre-Diabetes - 1839): au total, 3'731 patients obèses (IMC ≥30 kg/m2) ou en surpoids (IMC ≥27 kg/m2) présentant une dyslipidémie et/ou une hypertension artérielle ont été stratifiés selon leur stade prédiabétique au moment de l'inclusion et de leur IMC au départ (≥30 kg/m² ou <30 kg/m²). Les 3'731 patients randomisés ont reçu un traitement pendant 56 semaines et 2'254 patients randomisés prédiabétiques au moment de l'inclusion ont reçu un traitement pendant 160 semaines. Les deux périodes de traitement ont été suivies d'une période de suivi de 12 semaines sans médicament ni placebo. La thérapie de base pour tous les patients consistait en une intervention axée sur le mode de vie sous la forme d'un régime à valeur énergétique réduite et en conseils sur l'activité physique.La perte de poids a été évaluée pendant 56 semaines au cours de l'étude 1 chez les 3'731 patients randomisés (2'590 patients ont terminé l'étude).Dans la partie de l'étude 1 d'une durée de 160 semaines, le délai d'apparition du diabète sucré de type 2 a été évalué auprès de 2'254 patients randomisés atteints de pré-diabète (1'128 patients ont terminé l'étude).
Étude 2 (SCALE Diabetes - 1922): une étude randomisée de 56 semaines évaluant la perte de poids comme critère d'évaluation principal chez 846 patients obèses ou en surpoids (dont 628 ont terminé l'étude) présentant un diabète de type 2 insuffisamment contrôlé (HbA1c compris entre 7 et 10 %). Le traitement de fond au début de l'étude était soit un régime alimentaire et de l'activité physique seuls, ou en association avec un traitement par la metformine, une sulfonylurée ou une glitazone en monothérapie, soit une association de ces traitements.
Étude 3 (SCALE Maintenance - 1923): une étude de 56 semaines évaluant la perte de poids et la stabilisation du poids comme critère d'évaluation principal chez 422 patients randomisés obèses ou en surpoids (dont 305 ont terminé l'étude) présentant une hypertension artérielle ou une dyslipidémie après une perte de poids antérieure ≥5 % obtenue par un régime hypocalorique.
Étude 4 (SCALE Sleep Apnoe - 3970): une étude de 32 semaines évaluant la sévérité de l'apnée du sommeil comme critère d'évaluation principal et la perte de poids comme critère d'évaluation secondaire chez 359 patients obèses randomisés (dont 276 ont terminé l'étude) présentant une apnée obstructive du sommeil modérée ou sévère.
Poids corporel
Les données concernant la perte de poids, la réponse au traitement, l'évolution et la distribution cumulative des modifications de poids (en %) des études 1 à 3 sont rapportées dans le Tableau 3 et les schémas 1, 2, 3 et 4.
Tableau 3. Modifications du poids à la semaine 56 et à la semaine 160 par rapport à l'état initial – Études 1, 2 et 3
|
|
Étude 1
(semaine 56)
|
Étude 1
(semaine 160)
|
Étude 2
|
Étude 3
| |
|
Saxenda
n=2'437
|
Placebo
n=1'225
|
Saxenda
(n=1'472)
|
Placebo
(n=738)
|
Saxenda
n=412
|
Placebo
n=211
|
Saxenda
n=207
|
Placebo
n=206
| |
Poids corporel
| |
Valeur initiale moyenne, en kg (ET)
|
106.3
(21.2)
|
106.3
(21.7)
|
107.6
(21.6)
|
108.0
(21.8)
|
105.6
(21.9)
|
106.7
(21.2)
|
100.7
(20.8)
|
98.9
(21.2)
| |
Modification par rapport à la valeur initiale, en %
|
-8.0
|
-2.6
|
-6.2
|
-1.8
|
-5.9
|
-2.0
|
-6.3
|
-0.2
| |
Saxenda versus
placebo, en % (IC à 95 %)
|
-5.4*
(-5.8; -5.0)
|
-4.3**
(-4.9; -3.7)
|
-4.0**
(-4.8; -3.1)
|
-6.1**
(-7.5; -4.6)
| |
Modification par rapport à la valeur initiale, en kg
|
-8.4
|
-2.8
|
-6.5
|
-2.0
|
-6.2
|
-2.2
|
-6.0
|
-0.2
| |
Saxenda versus
placebo, en kg (IC à 95 %)
|
-5.6**
(-6.0; -5.1)
|
-4.6**
(-5.3; -3.9)
|
-4.1**
(-5.0; -3.1)
|
-5.9**
(-7.3; -4.4)
| |
% de patients ayant perdu ≥5 % du poids corporel
|
63.5
|
26.6
|
49.6
|
23.4
|
49.8
|
13.5
|
50.7
|
21.3
| |
Saxenda versus
placebo, kg (IC à 95 %)
|
4.8**
(4.1; 5.6)
|
3.2**
(2.6; 3.9)
|
6.4**
(4.1; 10.0)
|
3.8**
(2.4; 6.0)
| |
% de patients ayant perdu >10 % de leur poids corporel
|
32.8
|
10.1
|
24.4
|
9.5
|
22.9
|
4.2
|
27.4
|
6.8
| |
Saxenda versus
placebo, kg (IC à 95 %)
|
4.3**
(3.5; 5.3)
|
3.1**
(2.3; 4.1)
|
6.8**
(3.4; 13.8)
|
5.1**
(2.7; 9.7)
|
Analyse complète (FAS=Full Analysis Set). Concernant le poids, les valeurs initiales sont des moyennes, les modifications à la semaine 56 et à la semaine 160 par rapport aux valeurs initiales sont des moyennes estimées (LSMeans = moindres carrés) et les différences de traitement à la semaine 56 et à la semaine 160 sont des différences de traitement estimées. Pour les proportions de patients (%) ayant perdu ≥5/>10% de leur poids, les odds ratios estimés sont présentés. Les valeurs post-inclusion manquantes ont été imputées à l'aide de la dernière observation reportée (Last Observation Carried Forward, LOCF). * p <0.05. ** p <0.0001. ET = écart-type. IC = intervalle de confiance.
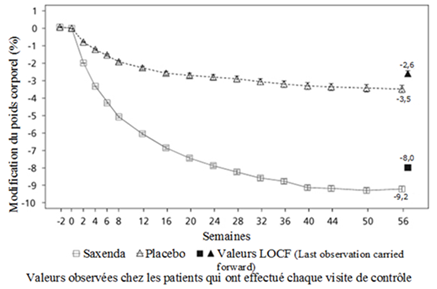
Schéma 1. Modification du poids corporel (%) par rapport à la valeur initiale dans l'étude 1 (de 0 à 56 semaines) en fonction du temps

Schéma 2. Modification du poids corporel (%) par rapport à la valeur initiale dans l'étude 1 (de 0 à 160 semaines) en fonction du temps
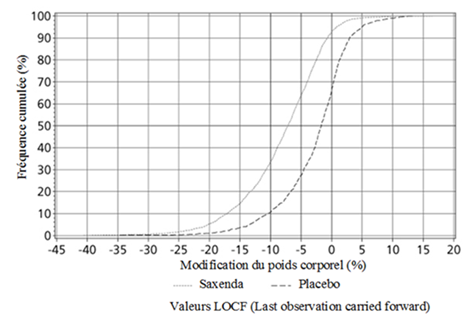
Schéma 3. Distribution cumulative de la modification de poids (%) après 56 semaines de traitement dans l'étude 1
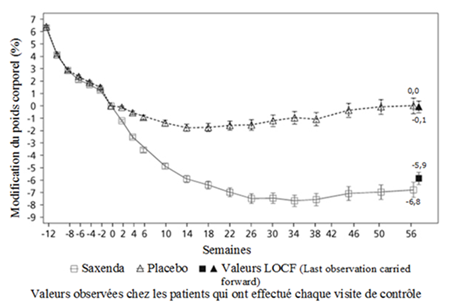
Schéma 4. Modification du poids (%) en fonction du temps dans l'étude 3 par rapport à la randomisation (semaine 0)
Avant la semaine 0, les patients avaient pour seul traitement un régime hypocalorique et de l'activité physique. Au cours de la semaine 0, les patients ont été randomisés pour recevoir Saxenda ou le placebo.
Perte de poids après 12 semaines de traitement par liraglutide (3.0 mg)
Les répondeurs précoces (early responders) étaient définis comme les patients ayant obtenu une perte de poids ≥5 % après 12 semaines avec une dose thérapeutique de liraglutide (4 semaines d'augmentation de la dose et 12 semaines de traitement). Dans le cadre de l'étude 1, 67.5 % des patients étaient des répondeurs précoces et dans le cadre de l'étude 2, 50.4 % des patients. En poursuivant le traitement au liraglutide, 86.2 % de ces répondeurs précoces devraient atteindre une réduction de poids ≥5 % après 1 an de traitement et 51 % une perte de poids ≥10 %. La perte de poids moyenne prévue chez les répondeurs précoces qui ont suivi le traitement pendant 1 an est de 11.2 % de leur poids corporel initial (9.7 % chez les hommes et 11.6 % chez les femmes). Dans le groupe de patients ayant atteint une perte de poids <5 % après un traitement de 12 semaines de 3 mg de liraglutide par jour, 6.6 % des patients ont encore présenté une perte de poids ≥10 % après 1 an.
Glycémie et paramètres cardiométaboliques
Les données concernant la glycémie et les paramètres cardiométaboliques issues des études 1 et 2 sont rapportées dans le Tableau 4.
Tableau 4. Modification de la glycémie et des paramètres cardiométaboliques par rapport à la valeur initiale, après 56 semaines (études 1 et 2) et 160 semaines (étude1)
|
|
Saxenda (n=2437)
|
Placebo (n=1225)
|
Saxenda versus placebo
| |
Étude 1 (semaine 56)
|
Valeur initiale
|
Modification
|
Valeur initiale
|
Modification
|
| |
HbA1c, %
|
5.6
|
-0.3
|
5.6
|
-0.1
|
-0.23**
(0.25; -0.21)
| |
Glycémie à jeun, mmol/l
|
5.3
|
-0.4
|
5.3
|
-0.01
|
-0.38**
(0.42; -0.35)
| |
Pression artérielle systolique, mmHg
|
123.0
|
-4.3
|
123.3
|
-1.5
|
-2.8**
(-3.6; -2.1)
| |
Pression artérielle diastolique, mmHg
|
78.7
|
-2.7
|
78.9
|
-1.8
|
-0.9*
(-1.4; - 0.4)
| |
Tour de taille, cm
|
115.0
|
-8.2
|
114.5
|
-4.0
|
-4.2**
(-4.7; -3.7)
| |
|
Saxenda
(n=1472)
|
Placebo
(n=738)
|
Saxenda versus placebo
| |
Étude 1 (semaine 160)
|
Valeur initiale
|
Modification
|
Valeur initiale
|
Modification
|
| |
HbA1c, %
|
5.75
|
-0.35
|
5.74
|
-0.14
|
-0.21**
(-0.24; -0.18)
| |
Glycémie à jeun,
mmol/l
|
5.50
|
-0.37
|
5.46
|
0.04
|
-0.41**
(-0.46; -0.36)
| |
Pression artérielle systolique, mmHg
|
124.80
|
-3.24
|
125.01
|
-0.44
|
-2.80**
(-3.81; -1.79)
| |
Pression artérielle diastolique, mmHg
|
79.40
|
-2.36
|
79.83
|
-1.74
|
-0.62
(-1.33; 0.09)
| |
Tour de taille, cm
|
116.64
|
-6.88
|
116.74
|
-3.35
|
-3.53**
(-4.23; -2.83)
| |
Étude 2
|
(n=412)
|
(n=211)
|
| |
HbA1c, %
|
7.9
|
-1.3
|
7.9
|
-0.4
|
-0.9**
(-1.1; -0.8)
| |
Glycémie à jeun, mmol/l
|
8.8
|
-1.9
|
8.6
|
-0.1
|
-1.8**
(-2.1; -1.4)
| |
Pression artérielle systolique, mmHg
|
128.9
|
-3.0
|
129.2
|
-0.4
|
-2.6*
(-4.6; - 0.6)
| |
Pression artérielle diastolique, mmHg
|
79.0
|
-1.0
|
79.3
|
-0.6
|
-0.4
(1.7; 1.0)
| |
Tour de taille, cm
|
118.1
|
-6.0
|
117.3
|
-2.8
|
-3.2**
(-4.2; -2.2)
| |
Lors de l'analyse statistique des paramètres glycémiques et cardiométaboliques, le test multiple n'a pas été évalué et les résultats ne doivent donc pas être considérés comme statistiquement confirmatoires. Analyse complète (FAS = Full Analyse Set). Pour l'HbA1c, la glycémie à jeun, la pression artérielle et le tour de taille, les valeurs initiales sont des moyennes, les modifications observées à la semaine 56 et à la semaine 160 par rapport aux valeurs initiales sont des moyennes estimées (LSmeans, moindres carrés) et les différences de traitement à la semaine 56 et à la semaine 160 sont des différences de traitement estimées. Les valeurs post-inclusion manquantes ont été calculées à l'aide de la dernière observation reportée (Last Observation Carried Forward – LOCF). * p <0.05. ** p <0.0001.
ET = écart-type. IC = intervalle de confiance.
|
Immunogénicité
Les patients traités par Saxenda peuvent développer des anticorps anti-liraglutide. Lors d'une analyse effectuée après le début du traitement, 42 (2.8 %) des 1'505 patients traités par Saxenda présentaient des anticorps anti-liraglutide. Des anticorps dotés d'un effet neutralisant au cours d'un test effectué in vitro sont apparus chez 18 (1.2 %) des 1'505 patients traités par Saxenda. La présence d'anticorps pourrait être en rapport avec l'apparition accrue de réactions au site d'injection et d'hypoglycémies rapportées. Au cours d'études cliniques, ces résultats ont été généralement d'intensité légère et disparaissaient lors de la poursuite du traitement. La détection de formation d'anticorps est fortement dépendante de la sensibilité et de la spécificité du test. En outre, l'incidence observée des anticorps détectés (y compris des anticorps neutralisants) dans un test peut être influencée par divers facteurs, comme la méthode de test, la gestion des échantillons, le déroulement du recueil des échantillons, la comédication ainsi que les maladies sous-jacentes. Cela explique pourquoi la survenue d'anticorps contre Saxenda ne peut être directement comparée à la survenue d'anticorps d'autres produits.
Évaluation cardiovasculaire
Les événements indésirables cardiovasculaires majeurs (MACE) ont été évalués par un groupe d'experts indépendants externes et définis comme infarctus du myocarde non fatal, accident vasculaire cérébral non fatal et le décès cardiovasculaire. Dans l'ensemble des études menées avec Saxenda, 6 MACE ont été observés chez les patients traités par liraglutide et 10 chez les patients recevant un placebo. Le rapport de risque et l'IC à 95 % est de 0.33 [0.12; 0.90] pour le liraglutide par rapport au placebo. Une élévation moyenne de la fréquence cardiaque de 2.5 battements par minute par rapport à la valeur initiale (allant de 1.6 à 3.6 battements par minute suivant l'étude) a été observée avec le liraglutide dans les études de phase 3, qui a atteint son maximum après environ 6 semaines et était réversible après l'arrêt du liraglutide (voir «Mises en garde et précautions»).
L'étude LEADER (Liraglutide Effect and Action in Diabetes Evaluation of Cardiovascular Outcome Results) a étudié l'incidence des événements cardiovasculaires sévères (MACE: décès cardiovasculaire, infarctus du myocarde non mortel, accident vasculaire cérébral non mortel) chez 9'340 patients présentant un diabète sucré de type 2 important et un risque cardiovasculaire accru. Après randomisation (1:1), les patients ont été traités (durée moyenne du traitement environ 3.5 ans), en plus du traitement standard, soit avec jusqu'à 1.8 mg de liraglutide par jour (4'668 patients) ou un placebo (4'672 patients). Le critère d'évaluation principal était le délai d'apparition d'un MACE. Le liraglutide a significativement réduit ce risque à la dose testée (rapport de risque 0.87 [0.78; 0,97] IC à 95 %).
Enfants et adolescents
Lors d'une étude en double-aveugle, sur l'efficacité et la sûreté de Saxenda par rapport à un placebo en ce qui concerne la perte de poids chez l'adolescent dès 12 ans souffrant d'obésité, Saxenda s'est avéré supérieur au placebo en ce qui concerne la réduction de la masse corporelle après un traitement de 56 semaines (mesuré par le IMC-SDS; voir tableau 5).
Une plus grande proportion de patients a obtenu une réduction de ≥5 % et de ≥10 % de l'IMC qu'avec le placebo, ainsi qu'une diminution moyenne de l'IMC et une perde de poids plus importante (voir tableau 5).
La modification de la composition corporelle n'a pas été étudiée.
Tous les patients doivent faire l'objet d'une surveillance étroite (voir également la règle d'arrêt du traitement à la rubrique «Indication»).
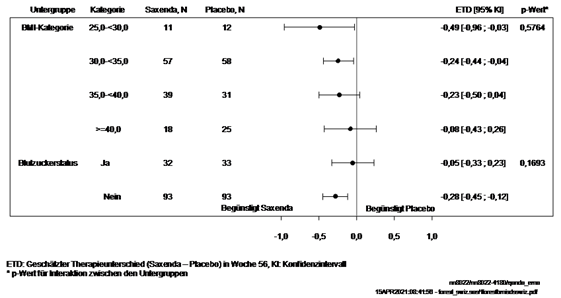
Figure 5.
Le diagramme indique les différences estimées (Saxenda vs. placebo) dans la modification de l'IMC-SDS entre le début de l'étude jusqu'à la semaine 56, en fonction de la valeur de l'IMC de départ ([kg/m2]: ≥25 - <30, ≥30 - <35, ≥35 - <40 et ≥40) et du statut glycémique au départ de l'étude (normoglycémie vs prédiabète ou diabète de type 2), y compris les valeurs p des test d'interaction.
Après une période de suivi de 26 semaines sans prise du médicament étudié ou du placebo, une reprise de poids a été observée dans le groupe Saxenda par rapport au groupe placebo (voir tableau 5):
Tableau 5. NN8022-4180 Modification du poids et de l'IMC en semaine 56 et modification de l'IMC-SDS de la semaine 56 à la semaine 82
|
|
Saxenda (N=125)
|
Placebo
(N=126)
|
Saxenda vs. Placebo
| |
IMC-SDS
|
|
|
| |
Valeur de base, IMC-SDS (SD)
|
3.14 (0.65)
|
3.20 (0.77)
|
| |
Modification moyenne en semaine 56 (95%-KI)
|
-0.23
|
-0.00
|
-0.22*
(-0.37; -0.08)
| |
Semaine 56, IMC-SDS (SD)
|
2.88 (0.94)
|
3.14 (0.98)
|
| |
Modification moyenne de la semaine 56 à la semaine 82, IMC-SDS (95%-KI)
|
0.22
|
0.07
|
0.15**
(0.07; 0.23)
| |
Poids corporel
|
|
|
| |
Valeur de base, kg (SD)
|
99.3 (19.7)
|
102.2 (21.6)
|
-
| |
Modification moyenne en semaine 56, % (95%-KI)
|
-2.65
|
2.37
|
-5.01**
(-7.63; -2.39)
| |
Modification moyenne en semaine 56, kg (95%-KI)
|
-2.26
|
2.25
|
-4.50**
(-7.17; -1.84)
| |
IMC
|
|
|
| |
Valeur de base, kg/m2 (SD)
|
35.3 (5.1)
|
35.8 (5.7)
|
-
| |
Modification moyenne en semaine 56, kg/m2 (95%-KI)
|
-1.39
|
0.19
|
-1.58**
(-2.47; -0.69)
| |
Proportion de patients avec une réduction de la valeur de base de l'IMC de ≥5% en semaine 56, % (95%-KI)
|
43.25
|
18.73
|
3.31**
(1.78; 6.16)
| |
Proportion de patients avec une rédution de la valeur de base de l'IMC de ≥10% en semaine 56, % (95%-KI)
|
26.08
|
8.11
|
4.00**
(1.81; 8.83)
| |
Groupe total (FAS=Full Analysis Set). Pour l'IMC-SDS, le poids, et l'IMC, les valeurs de base sont des moyennes, les modifications par rapport aux valeurs de base en semaine 56 sont des moyennes estimées (LSMeans) et les contrastes de traitements en semaine 56 sont des différences de traitement estimées. Les valeurs IMC -SDS en semaine 56 sont des valeurs moyennes, les modification entre la semaine 56 et la semaine 82 sont des moyennes estimées (LSMeans) et les contrastes de traitement en semaine 82 sont des différences de traitement estimées. Pour la proportion de patients pour lequel la valeur de base de l'IMC a été réduite de ≥5%/≥10%, le rapport de cotes estimé est indiqué. Les observations manquantes ont été complétées par une imputation multiple (approche de saut à a référence, x100) basée sur le groupe placebo.
*p<0.01, **p<0.001. KI=Intervalle de confiance. SD=Déviation standard.
|
En fonction de la tolérance, la dose a été augmentée à 3.0 mg chez 103 patients (82.4 %), à 2.4 mg chez 11 patients (8.8 %), à 1.8mg chez 4 patients (3.2 %), à 1.2 mg chez 4 patients (3.2 %) et 3 patients (2.4 %) sont restés à 0.6 mg.
L'efficacité et la sécurité de Saxenda chez des patients pédiatriques atteints du syndrome de Prader-Willi et d'obésité ont été évaluées dans une étude en double aveugle (partie A) pendant 16 semaines, puis en ouvert durant 36 semaines. Dans la partie A ont été inclus en tout 32 adolescents âgés de ≥12 à <18 ans (stade Tanner 2 à 5), randomisés pour recevoir soit du liraglutide 3 mg (n = 20), soit un placebo (n = 12), dont 18 et 12 respectivement sont arrivés au terme de la phase en double aveugle (semaine 16), et 17 et 12 respectivement au terme de la phase d'extension en ouvert (semaine 52). Dans la partie B, 24 enfants entre ≥6 et <12 ans (stade Tanner inférieur à 2) au total ont été randomisés pour recevoir soit du liraglutide 3 mg (n = 17), soit un placebo (n = 7), dont 16 et 7 respectivement sont arrivés au terme de la phase en double aveugle (semaine 16), et 14 et 7 respectivement au terme de la phase d'extension en ouvert (semaine 52).
Les patients ayant un poids corporel inférieur à 45 kg ont débuté l'augmentation de la dose à une dose plus faible de 0.3 mg au lieu de 0.6 mg, jusqu'à une dose maximale de 2.4 mg.
La modification estimée de l'IMC-SDS moyen était comparable dans les deux bras de traitement à la semaine 16 (différence entre le liraglutide 3 mg et le placebo [IC à 95 %]: -0.07 [-0.23; 0.09] dans la partie A et -0.06 [-1.06; 0.93] dans la partie B) comme à la semaine 52 (différence entre le liraglutide 3 mg et le placebo [IC à 95 %]: -0.14 [-0.62; 0.34] dans la partie A et -0.07 [-0.89; 0.76] dans la partie B).
|





