CompositionPrincipe actif: Ixekizumab.
Excipients: citrate de sodium dihydraté, acide citrique anhydre, chlorure de sodium, Polysorbate 80, eau pour préparation injectable.
Forme galénique et quantité de principe actif par unitéTaltz 80 mg solution injectable en seringue préremplie
Chaque seringue préremplie contient 80 mg d'ixekizumab dans 1 ml (80 mg/ml).
Taltz 80 mg solution injectable en stylo prérempli
Chaque stylo prérempli contient 80 mg d'ixekizumab dans 1 ml (80 mg/ml).
Indications/Possibilités d’emploiTaltz est indiqué dans le traitement du psoriasis en plaques modéré à sévère chez les patients adultes qui n'ont pas répondu à d'autres traitements systémiques (y compris la ciclosporine ou le méthotrexate, ou la puvathérapie) ou qui ne peuvent pas les suivre en raison de contre-indications ou d'intolérance.
Posologie/Mode d’emploiTaltz doit être utilisé sous la conduite et la surveillance d'un médecin expérimenté dans le diagnostic et le traitement du psoriasis.
La dose recommandée est de 160 mg en injection sous-cutanée (deux injections de 80 mg) à la semaine 0, suivie de 80 mg (une injection) aux semaines 2, 4, 6, 8, 10 et 12, puis 80 mg (une injection) toutes les 4 semaines.
Chez les patients <100 kg, un schéma posologique alternatif avec 160 mg à la semaine 0 et dès la semaine 2, 80 mg toutes les 4 semaines peut être pris en considération (voir «Propriétés/Effets»).
Chez les patients qui n'ont pas répondu au bout de 20 semaines, un arrêt du traitement doit être envisagé. Certains patients ayant une réponse initiale partielle peuvent obtenir une amélioration en poursuivant le traitement au-delà de 20 semaines.
Les données de sécurité et d'efficacité au-delà de 1 an sont limitées, avec 3298 patients atteints de psoriasis qui ont été exposés à ixekizumab pendant au moins 1 an (ce qui représente une exposition de 5946.7 patients-années), dont 1166 patients qui ont été exposés à ixekizumab pendant au moins 2 ans (2941.3 patients-années d'exposition).
Mode d'administration
Avant le début du traitement, le médecin doit vérifier ce qui suit:
Le patient comprend que Taltz est un traitement inédit dont l'expérience est limitée et les risques à long terme inconnus.
Taltz est administré en injection sous-cutanée, alternativement dans le haut du bras, le ventre ou la cuisse.
Il faut éviter d'effectuer les injections dans les zones de peau présentant des lésions psoriasiques.
Après une formation adaptée à la technique d'injection sous-cutanée, les patients peuvent eux-mêmes s'injecter Taltz si le médecin estime que c'est approprié. Des instructions détaillées pour l'administration sont décrites dans le manuel d'utilisation de la seringue et du stylo.
Groupes de patients particuliers
Insuffisance rénale/insuffisance hépatique
Taltz n'a pas été étudié chez ces groupes de patients.
Patients âgés
Sur les 4204 patients atteints de psoriasis en plaques exposés à Taltz dans les études cliniques, 301 étaient âgés de 65 ans et plus, et 36 de 75 ans et plus. Aucune adaptation de dose n'est nécessaire (voir «Pharmacocinétique»).
Pédiatrie
La sécurité et l'efficacité de Taltz n'ont pas encore été établies chez les enfants et les adolescents de moins de 18 ans.
Contre-indicationsHypersensibilité sévère au principe actif ou à l'un des excipients.
Infections actives graves (par exemple tuberculose active, sepsis, infection opportuniste grave).
Mises en garde et précautionsInfections
Le traitement par Taltz est associé à une augmentation du taux d'infections telles que les infections des voies respiratoires supérieures, la candidose buccale, la conjonctivite et les infections fongiques à dermatophytes (teigne) (voir «Effets indésirables»).
Taltz doit être administré avec précaution chez les patients atteints d'une infection chronique ou active ou ayant des antécédents d'infections récidivantes. Taltz ne doit pas être administré à des patients présentant une infection active, en particulier les infections à VIH, VHB ou VHC. Si une telle infection se développe pendant le traitement avec Taltz, une étroite surveillance est nécessaire. Les patients doivent être informés de la nécessité de consulter un médecin si des signes ou des symptômes indiquant une infection apparaissent. La thérapie avec Taltz doit être arrêtée en cas de non-réponse à un traitement anti-infectieux standard ainsi qu'en cas d'infection grave. Le traitement avec Taltz ne doit reprendre que lorsque l'infection a disparu.
Taltz ne doit pas être administré à des patients atteints de tuberculose active. Chez les patients présentant une tuberculose latente, il faut envisager un traitement antituberculeux avant l'instauration du traitement par Taltz.
Maladies malignes
Les études cliniques jusqu'à un an n'ont montré aucune augmentation du risque de maladies malignes. Les résultats des études concernant la sécurité à long terme ne sont pas encore disponibles. Etant donné que les patients atteints de psoriasis sont une population à risque, les patients psoriasiques doivent être examinés, avant et pendant le traitement par Taltz pour détecter la présence de tumeurs cutanées.
Réactions d'hypersensibilité
Des réactions graves d'hypersensibilité, y compris des cas d'angioedème et d'urticaire ont été rapportées. En cas de réaction d'hypersensibilité grave, l'administration de Taltz doit être interrompue immédiatement et un traitement approprié instauré.
Maladie inflammatoire de l'intestin, y compris maladie de Crohn et rectocolite hémorragique
Des nouveaux cas ou des aggravations de maladie inflammatoire de l'intestin, y compris maladie de Crohn et rectocolite hémorragique ont été rapportés sous traitement avec Taltz. Dans de tels cas, la thérapie doit être soigneusement réévaluée et son interruption envisagée. Les patients doivent dans tous les cas être soigneusement surveillés.
Vaccinations
Taltz ne doit pas être utilisé avec des vaccins vivants, car il n'y a pas de données disponibles concernant la vaccination avec des vaccins vivants sous Taltz.
Il est recommandé de compléter toute vaccination prévue avant le début du traitement par Taltz. Il convient de respecter un certain délai entre les vaccins vivants et le début du traitement, conformément aux directives actuelles en matière de vaccination concernant les principes actifs immunosuppresseurs.
Dans une étude ouverte chez 83 volontaires sains avec randomisation 1:1 à un groupe de contrôle ou à ixekizumab 160 mg à la semaine 0 et 80 mg à la semaine 2, la réponse immunitaire a été examinée pour deux vaccins inactivés contre le tétanos (Boostrix®) et le pneumocoque (Pneumovax-23®) administrés à la semaine 2. Jusqu'à la semaine 6 après l'immunisation aucun problème de sécurité n'a en principe été constaté dans ce petit groupe de volontaires sains. Cependant, l'extrapolation de l'efficacité et la sécurité des vaccins inactivés à la population cible n'est possible que de manière limitée. Les données sur la réponse immunitaire n'étaient pas suffisantes pour pouvoir conclure à une réponse immunitaire adéquate à ces vaccins après l'administration de Taltz dans la population cible.
Association à d'autres médicaments biologiques
L'administration concomitante de Taltz avec d'autres médicaments biologiques n'a pas été étudiée et n'est pas recommandée.
InteractionsLa sécurité de Taltz en association avec d'autres agents immunomodulateurs ou de la photothérapie ainsi qu'avec des vaccins vivants n'a pas été étudiée.
Aucune étude formelle in vivo sur les interactions avec d'autres médicaments n'a été réalisée.
L'expression des enzymes hépatiques CYP450 est réprimée par les cytokines qui stimulent les inflammations chroniques. De ce fait, l'expression des CYP450 pourrait changer si une inhibition des cytokines par ixekizumab était engagée.
Les patients prenant des médicaments dont la dose est déterminée de manière individuelle et qui sont métabolisés par les enzymes CYP450 3A4, 1A2 ou 2C9 (par exemple atorvastatine, inhibiteurs des canaux calciques, théophylline, acénocoumarol, phenprocoumone, phénytoïne, ciclosporine ou benzodiazépine), devraient faire l'objet d'un contrôle au début et à la fin d'un traitement par ixekizumab et la dose de ces substances devrait être adaptée au besoin. Compte tenu de sa longue demi-vie d'élimination, l'action de l'ixekizumab sur l'activité des enzymes CYP450 peut persister plusieurs semaines après la fin du traitement.
Grossesse/AllaitementGrossesse
Il existe des données limitées concernant l'utilisation de l'ixekizumab chez la femme enceinte. Il est connu que les IgG humaines traversent la barrière placentaire et ixekizumab est une IgG. Par conséquent, il est possible que l'ixekizumab passe de la mère au fœtus. Pendant la grossesse et chez les femmes en âge de procréer qui n'utilisent pas de contraception efficace, Taltz ne doit pas être administré, à moins d'une nécessité absolue. Les patientes doivent être informées d'utiliser des méthodes contraceptives efficaces pendant au moins 10 semaines après la dernière dose de Taltz.
Les études réalisées sur l'animal n'ont pas mis clairement en évidence d'effets délétères directs ou indirects sur la grossesse, le développement embryonnaire/fœtal, l'accouchement ou le développement post-natal (voir «Données précliniques»). Comme la réponse chez l'homme ne peut pas toujours être prédite à partir des études de reproduction chez l'animal, Taltz ne doit être utilisé pendant la grossesse que si le bénéfice l'emporte clairement sur les risques.
Allaitement
On ne sait pas si l'ixekizumab est excrété dans le lait maternel chez l'être humain ou s'il passe dans la circulation sanguine après ingestion. Cependant, l'ixekizumab est excrété à de faibles taux dans le lait des guenons Cynomolgus. Comme beaucoup de médicaments, dont les anticorps, sont excrétés dans le lait maternel, un risque pour le nouveau-né/l'enfant en bas âge ne peut pas être exclu. En raison de possible dommages pour le nourrisson, il est recommandé de ne pas allaiter pendant le traitement avec Taltz et pendant au-moins 10 semaines après la dernière dose. Il convient donc de décider soit d'arrêter l'allaitement, soit d'interrompre le traitement par Taltz en tenant compte du bénéfice de l'allaitement pour l'enfant et de celui du traitement pour la mère.
Fertilité
L'effet de l'ixekizumab sur la fertilité chez l'être humain n'a pas été évalué. Les études réalisées sur l'animal n'ont pas mis en évidence d'effets délétères directs ou indirects sur la fertilité (voir «Données précliniques»).
Effet sur l’aptitude à la conduite et l’utilisation de machinesL'effet de Taltz sur l'aptitude à conduire des véhicules ou à utiliser des machines n'a pas été étudié.
Effets indésirablesAu total, 4736 patients ont été traités par Taltz au cours des études cliniques dans le psoriasis en plaques (n = 4204) ou l'arthrite rhumatoïde (n = 532). Sur l'ensemble de ces patients, 2190 patients atteints de psoriasis ont été exposés à Taltz pendant au moins un an, ce qui représente 3531 patients-année d'exposition.
Trois études de phase III contrôlées versus placebo dans le psoriasis en plaques ont été intégrées pour évaluer la sécurité de Taltz par rapport au placebo jusqu'à 12 semaines après le début du traitement. Au total, 3119 patients ont été évalués (1161 patients à la dose de 80 mg toutes les 4 semaines (1×/4 sem.), 1167 patients à la dose de 80 mg toutes les 2 semaines (1×/2 sem.) et 791 patients sous placebo).
Dans deux de ces études de phase III la sécurité de Taltz a aussi été comparée à étanercept jusqu'à 12 semaines après le début du traitement (729 patients sous 80 mg 1×/4sem., 734 patients sous 80 mg 1×/2 sem. et 739 patients sous étanercept).
Les effets indésirables les plus fréquemment rapportés ont été des réactions au site d'injection et des infections des voies respiratoires supérieures (le plus souvent, rhinopharyngite). La plupart des réactions étaient d'intensité légère à modérée.
La fréquence des effets indésirables est indiquée comme suit: «très fréquents» (>10%), «fréquents» (>1%, <10%), «occasionnels» (>0.1%, <1%), «rares» (>0.01%, <0.1%), «très rares» (<0.01%).
Infections et infestations
Très fréquent: infection des voies respiratoires supérieures (14% avec 1×/2 sem. 13.4% avec 1×/4 sem.).
Fréquent: infection fongique à dermatophytes (teigne)
Occasionnel: grippe, rhinite, candidose buccale, conjonctivite.
Rare: candidose oesophagienne.
Troubles de la circulation sanguine et lymphatique
Occasionnel: neutropénie.
Troubles respiratoires, thoraciques et médiastinaux
Fréquent: douleurs oropharyngées.
Troubles gastro-intestinaux
Fréquent: nausées, diarrhée.
Troubles hépatobiliaires
Fréquent: enzymes hépatiques élevées
Troubles cutanés et des tissus sous-cutanés
Occasionnel: urticaire.
Troubles généraux et accidents liés au site d'administration
Très fréquent: réactions au site d'injection (16.8% avec 1×/2 sem et 12.9% avec 1×/4 sem).
Description d'effets indésirables sélectionnés
Réactions au site d'injection
Les réactions au site d'injection les plus fréquemment observées étaient érythème et douleur. Pour la majorité, ces réactions ont été d'intensité légère à modérée et n'ont pas donné lieu à l'arrêt de Taltz.
Infections
La majorité des infections étaient des effets indésirables non graves et d'intensité légère à modérée, tels que rhinopharyngite et infections des voies respiratoires supérieures qui n'ont pas nécessité l'arrêt du traitement.
Pendant la période contrôlée versus placebo des études cliniques de phase III dans le psoriasis en plaques (au total 2328 patients ont été traités avec Taltz et 791 patients avec placebo jusqu'à 12 semaines), des infections ont été rapportées chez 27.2% des patients traités par Taltz pendant une durée maximale de 12 semaines, contre 22.9% des patients traités par placebo.
Des infections graves sont survenues chez 13 (0,6%) des patients recevant Taltz et 3 (0,4%) des patients recevant le placebo (voir «Mises en garde et précautions»). Les événements indésirables graves (SAE) liés aux infections, rapportés chez plus de 1 patient de l'ensemble du groupe ixekizumab, étaient cellulite (n = 3), appendicite (n = 2) et érysipèle (n = 2). La proportion de patients qui ont interrompu le traitement en raison d'effets indésirables liés aux infections, était similaire dans l'ensemble du groupe ixekizumab (8 patients [0,3%]) et dans le groupe placebo (2 patients [0,3%]).
Conformément au mécanisme d'action, on a observé une augmentation de candidose orale et, à une exception près, tous les cas étaient de gravité légère ou modérée. Aucun SAE ni arrêt de traitement n'a été rapporté en raison de candidose.
Sur la durée totale du traitement, les infections ont été rapportées chez 52.8% des patients traités par Taltz (46.9 pour 100 patients-année). Les infections graves ont été rapportées chez 1.6% des patients traités par Taltz (1.5 pour 100 patients-année).
Neutropénie
Une neutropénie légère a été fréquemment rapportée chez les patients sous Taltz. Une neutropénie de grade ≥3 (<1000 cellules/mm3) a été rapportée occasionnellement sous Taltz. La neutropénie était en général transitoire, n'a nécessité ni l'arrêt de Taltz ni une hospitalisation et n'était pas associée à une incidence accrue d'infections.
Sécurité en comparaion à étanercept
Dans les 2 études cliniques contrôlées comprenant un comparateur actif UNCOVER-2 et UNCOVER-3, le taux d'événements indésirables graves a été de 1.9% dans le groupe étanercept comme dans le groupe Taltz et le taux d'arrêt pour cause d'événement indésirable a été de 1.2% dans le groupe étanercept et de 2.0% dans le groupe Taltz. Le taux d'infections a été de 21.5% dans le groupe étanercept et de 26.0% dans le groupe Taltz, avec la majorité des événements qui était d'intensité légère à modérée. Le taux d'infections graves a été de 0.4% dans le groupe étanercept et de 0.5% dans le groupe Taltz.
Immunogénicité
Environ 9 à 17% des patients traités par Taltz à la posologie recommandée ont développé des anticorps anti-ixekizumab; dans la majorité des cas, les titres étaient faibles et n'ont pas été associés à une diminution de la réponse clinique jusqu'à 60 semaines de traitement. Cependant, environ 1% des patients traités par Taltz ont présenté des anticorps neutralisants associés à de faibles concentrations du médicament et à une baisse de la réponse clinique. Un lien entre l'immunogénicité et les événements indésirables apparus pendant le traitement n'a pas été établi.
SurdosageDes doses jusqu'à 180 mg ont été administrées par voie sous-cutanée dans le cadre d'essais cliniques sans apparition de toxicité dose-limitante. Des surdosages jusqu'à 240 mg par voie sous-cutanée ont été rapportés sans apparition d'événement indésirable grave. En cas de surdosage, il est recommandé de surveiller l'apparition de signes ou de symptômes de réactions indésirables et d'instaurer immédiatement un traitement symptomatique.
Propriétés/EffetsCode ATC: L04AC13
Mécanisme d'action
L'ixekizumab est un anticorps monoclonal recombinant humanisé sélectif pour l'interleukine 17-A. L'ixekizumab, produit par des cellules ovariennes de hamster chinois (CHO), est un anticorps monoclonal IgG4 modifié qui se lie spécifiquement et avec une affinité élevée (<3 pM) à la cytokine pro-inflammatoire interleukine 17A (à la fois à l'IL-17A et à l'hétérodimère IL-17A/F). Des concentrations élevées d'IL-17A ont été associées à la pathogenèse de diverses maladies autoimmunes. Dans le psoriasis, le ligand IL-17A joue un rôle important dans la prolifération et l'activation excessives des kératinocytes. La neutralisation de l'IL-17A par l'ixekizumab inhibe ces phénomènes. L'ixekizumab ne se lie pas aux ligands IL-17B, IL-17C, IL-17D, IL-17E ni IL-17F.
L'ixekizumab a une faible capacité de liaison aux récepteurs Fcγ ou aux composants du complément. Les essais de liaison in vitro ont confirmé que l'ixekizumab ne se lie pas aux récepteurs humains Fcγ I, IIa et IIIa ni au composant du complément C1q.
Pharmacodynamie
Sur la base des données des biopsies de peau psoriasiques issues d'une étude de phase I, on observe une tendance dose-dépendante en faveur d'une diminution de l'épaisseur de l'épiderme, du nombre de kératinocytes, de lymphocytes T et de cellules dendritiques en prolifération, ainsi que des diminutions des marqueurs d'inflammation locale entre le stade initial et le jour 43. En conséquence, le traitement par ixekizumab réduit l'érythème, l'induration et la desquamation dans les lésions de psoriasis en plaques.
Efficacité clinique
L'efficacité et la sécurité de Taltz ont été évaluées dans le cadre de trois études de phase III randomisées, en double-aveugle, contrôlées versus placebo chez des patients adultes atteints de psoriasis en plaques modéré à sévère, candidats à la photothérapie ou à un traitement systémique (UNCOVER-1, UNCOVER-2 et UNCOVER-3). L'efficacité et la sécurité de Taltz ont également été évaluées versus étanercept (UNCOVER-2 et UNCOVER-3). Les patients randomisés dans le groupe Taltz qui, à la 12ème semaine, étaient répondeurs selon le score sPGA (static Physician Global Assessment ou Evaluation Globale du Médecin) (0,1) ont été à nouveau randomisés dans le groupe placebo ou Taltz pendant 48 semaines supplémentaires (UNCOVER-1 et UNCOVER-2). Les patients randomisés dans le groupe placebo, étanercept ou Taltz, non-répondeurs selon le score sPGA (0,1), ont été traités par Taltz jusqu'à 48 semaines.
Sur les 3866 patients inclus dans ces études contrôlées versus placebo, 64% avaient reçu un traitement systémique antérieur (biologique, systémique conventionnel ou psoralène et ultraviolets A (PUVA)), 43.5% avaient déjà été traités par photothérapie, 49.3% avaient déjà reçu un traitement systémique conventionnel et 26.4% avaient déjà reçu une biothérapie pour le traitement du psoriasis. Sur l'ensemble de ces patients, 14.9% avaient reçu au moins un agent anti-TNF alfa et 8.7% un anti-IL-12/IL-23. A l'inclusion 23.4% des patients avaient des antécédents d'arthrite psoriasique.
Critères d'exclusion
Les critères d'exclusion essentiels qui s'opposaient à la participation dans UNCOVER-1, UNCOVER-2 et UNCOVER-3 étaient l'utilisation concomitante de traitements anti-psoriasiques systémiques ou biologiques ou la photothérapie, tout trouble médical grave ou maladie instables, sauf le psoriasis en plaques, et toute infection grave actuelle ou récente. Dans UNCOVER-2 et 3 UNCOVER-3, l'utilisation précédente d'étanercept était un critère d'exclusion.
Dans ces trois études, les co-critères d'évaluation principaux étaient la proportion de patients ayant atteint une réponse PASI 75 (Psoriasis Area and Severity Index; PASI 75 = amélioration du PSAI d'au-moins 75%) et une réponse sPGA 0 («blanchi») ou 1 («minimal») à la 12ème semaine par rapport au placebo. A l'inclusion, les patients de tous les groupes de traitement présentaient un score PASI médian compris entre 17.4 et 18.3; 48.3% à 51.2% des patients présentaient un score sPGA initial de sévère ou très sévère et un score de prurit moyen compris entre 6.3 et 7.1 sur l'échelle d'évaluation numérique des démangeaisons (itch NRS [Numeric Rating Scale]).
Tableau 1: réponse clinique après 12 semaines (NRI) dans les études UNCOVER-1, -2 et -3
|
|
Placebo
|
Taltz
80 mg 1×/4 sem.
|
Taltz
80 mg 1×/2 sem.
|
Etanercept
50 mg deux fois par semaine
| |
UNCOVER 1
| |
Nombre de patients (N)
|
431
|
432
|
433
|
NA
| |
sPGA de 0 (blanchi) ou de 1 (minimal), n (%)
|
14 (3.2%)
|
330 (76.4%)a
|
354 (81.8%)a
|
NA
| |
sPGA de 0 (blanchi), n (%)
|
0
|
149 (34.5%)a
|
160 (37.0%)a
|
NA
| |
PASI 75, n (%)
|
17 (3.9%)
|
357 (82.6%)a
|
386 (89.1%)a
|
NA
| |
PASI 90, n (%)
|
2 (0.5%)
|
279 (64.6%)a
|
307 (70.9%)a
|
NA
| |
PASI 100, n (%)
|
0
|
145 (33.6%)a
|
153 (35.3%)a
|
NA
| |
UNCOVER 2
| |
Nombre de patients (N)
|
168
|
347
|
351
|
358
| |
sPGA de 0 (blanchi) ou de 1 (minimal), n (%)
|
4 (2.4%)
|
253 (72.9%)a
|
292 (83.2%)a
|
129 (36.0%)a
| |
sPGA de 0 (blanchi), n (%)
|
1 (0.6%)
|
112 (32.3%)a,b
|
147 (41.9%)a,b
|
21 (5.9%)c
| |
PASI 75, n (%)
|
4 (2.4%)
|
269 (77.5%)a
|
315 (89.7%)a
|
149 (41.6%)a
| |
PASI 90, n (%)
|
1 (0.6%)
|
207 (59.7%)a,b
|
248 (70.7%)a,b
|
67 (18.7%)a
| |
PASI 100, n (%)
|
1 (0.6%)
|
107 (30.8%)a,b
|
142 (40.5%)a,b
|
19 (5.3%)c
| |
UNCOVER 3
| |
Nombre de patients (N)
|
193
|
386
|
385
|
382
| |
sPGA de 0 (blanchi) ou de 1 (minimal), n (%)
|
13 (6.7%)
|
291 (75.4%)a,b
|
310 (80.5%)a,b
|
159 (41.6%)a
| |
sPGA de 0 (blanchi), n (%)
|
0
|
139 (36.0%)a,b
|
155 (40.3%)a,b
|
33 (8.6%)a
| |
PASI 75, n (%)
|
14 (7.3%)
|
325 (84.2%)a,b
|
336 (87.3%)a,b
|
204 (53.4%)a
| |
PASI 90, n (%)
|
6 (3.1%)
|
252 (65.3%)a,b
|
262 (68.1%)a,b
|
98 (25.7%)a
| |
PASI 100, n (%)
|
0
|
135 (35.0%)a,b
|
145 (37.7%)a,b
|
28 (7.3%)a
|
Abréviations: n = nombre de patients dans cette catégorie; N = nombre de patients dans la population en intention de traiter: NA = non applicable; NRI = Non-Responder Imputation; NRS = numeric rating scale; PASI = Psoriasis Area and Severity Index; 1×/2 sem. = toutes les 2 semaines; 1×/4 sem. = toutes les 4 semaines; sPGA = static Physician Global Assessment.
a p <0.001 versus au placebo
b p <0.001 versus étanercept
c p <0.01 versus placebo
L'étude UNCOVER-1 comptait 1296 patients. Les patients ont été randomisés (1:1:1) pour recevoir pendant 12 semaines le placebo ou Taltz (80 mg toutes les deux ou quatre semaines [1×/2 sem. ou 1×/4 sem.] après une dose initiale de 160 mg).
L'étude UNCOVER-2 comptait 1224 patients. Les patients ont été randomisés (1:2:2:2) pour recevoir pendant 12 semaines le placebo ou Taltz (80 mg toutes les deux ou quatre semaines [1×/2 sem. ou 1×/4 sem.] après une dose initiale de 160 mg) ou de l'étanercept 50 mg deux fois par semaine.
L'étude UNCOVER-3 comptait 1346 patients. Les patients ont été randomisés (1:2:2:2) pour recevoir pendant 12 semaines le placebo ou Taltz (80 mg toutes les deux ou quatre semaines [1×/2 sem. ou 1×/4 sem.] après une dose initiale de 160 mg) ou de l'étanercept 50 mg deux fois par semaine.
Le dosage de 80 mg 1×/2 sem. a démontré dans toutes les études pour tous les critères d'évaluation une efficacité supérieure (voir tableau ci-dessus), en particulier dans les degrés élevés d'amélioration de la peau (PASI 90, PASI 100, sPGA 0) et dans la réduction des démangeaisons.
En comparaison avec le placebo et l'étanercept, à la semaine 12, des améliorations significativement supérieures par rapport aux valeurs initiales ont été observées dans le psoriasis des ongles (mesuré par le Nail Psoriasis Severity Index (NAPSI)), dans le psoriasis du cuir chevelu (mesuré par le Psoriasis Scalp Severity Index (PSSI)) et le psoriasis palmoplantaire (mesuré par le Psoriasis Palmoplantar Severity Index (PPASI)).
Taltz a été associé à une efficacité précoce avec une diminution supérieure à 50% du score PASI moyen à la semaine 2 (Figure 1). Le pourcentage de patients ayant obtenu une réponse PASI 75 était significativement supérieur dans le groupe Taltz comparé aux groupes placebo et étanercept dès la semaine 1. Environ 25% des patients traités par Taltz ont obtenu un score PASI inférieur à 5 à la semaine 2, plus de 55% ont obtenu un score PASI inférieur à 5 à la semaine 4 et jusqu'à 85% à la semaine 12 (contre respectivement 2.7%, 14% et 53% dans le groupe étanercept). Une amélioration significative de l'intensité des démangeaisons a été observée à la semaine 1 chez les patients traités par Taltz.
Taltz a également montré un effet favorable sur le prurit, qui était significativement supérieur au placebo.
Figure 1. Score PASI, amélioration en pourcentage à chaque visite suivant la visite initiale (mBOCF) dans la population en intention de traiter pendant la phase d'induction – UNCOVER-2 et UNCOVER-3
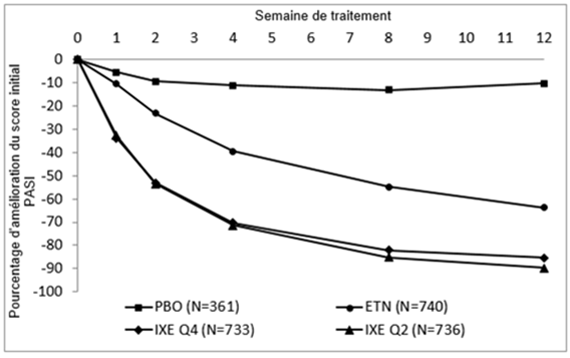
L'efficacité et la sécurité de Taltz ont été démontrées quels que soient l'âge, le sexe, l'origine ethnique, le poids corporel, le score de gravité PASI initial, et la prise d'un traitement antérieur biologique. Les taux de réponse après 12 semaines chez les patients traités par Taltz 80 mg 1×/2 sem étaient pour les sous-groupes <100 kg et ≥100 kg respectivement PASI 75 (90.1% et 85.7%) et sPGA 0,1 (84.5% et 75.6%). Les taux de réponse après 12 semaines chez les patients traités par Taltz 80 mg 1×/4 sem étaient pour les sous-groupes <100 kg et ≥100 kg respectivement PASI 75 (85.6% et 74.2%) et sPGA 0,1 (79.0% et 67.4%). La réponse n'a pas été différente chez les patients avec psoriasis des ongles, psoriasis du visage ou psoriasis du cuir chevelu au début de l'étude. Taltz s'est montré efficace chez les patients ayant reçu précédemment un traitement systémique, avec ou sans exposition biologique préalable, y compris des patients en échec aux traitements biologiques/anti-TNF. Les améliorations des critères d'évaluation sPGA et PASI chez les patients présentant une arthrite psoriasique concomitante au départ de l'étude étaient semblables à ceux de l'ensemble de la population avec psoriasis en plaques modéré à sévère. Environ 45% des patients présentaient un psoriasis dans la zone du visage au départ de l'étude. Parmi ces patients, 80,4% des patients traités avec Taltz étaient débarrassées du psoriasis dans la zone du visage à la semaine 12.
Efficacité chez les non-répondeurs à l'étanercept: chez les patients identifiés comme non-répondeurs à l'étanercept selon le score sPGA (0,1) à la semaine 12 dans l'étude UNCOVER-2 (N = 200) puis traités par Taltz 80 mg 1×/4 sem. après une période de sevrage thérapeutique de 4 semaines, 73% ont obtenu un score sPGA (0,1) et 83.5% un PASI 75 après 12 semaines de traitement.
Maintien de la réponse à la semaine 60
Afin d'évaluer le maintien de la réponse, les patients initialement randomisés dans le groupe Taltz et considérés comme répondeurs à la semaine 12 (c'est-à-dire, score sPGA de 0,1) dans les études UNCOVER-1 et UNCOVER-2 ont été re-randomisés pour 48 semaines supplémentaires dans l'un des groupes de traitement suivants: placebo ou Taltz (80 mg toutes les quatre ou douze semaines ([1×/4 sem. ou 1×/12 sem.]).
Les patients qui n'ont pas atteint un sPGA (0,1) à la semaine 12 ou qui ont subi une rechute pendant la phase de maintenance (sPGA ≥3), ont reçu par la suite Taltz 1×/4 sem.
Chez les répondeurs sPGA (0,1) à la semaine 12 (dans les études combinées UNCOVER-1 et UNCOVER-2), la proportion de patients qui ont maintenu cette réponse à la semaine 60 était significativement plus élevée chez les patients traités avec Taltz 80 mg 1×/4 sem. (71%) comparé à ceux traités par Taltz 80 mg 1×/12 sem. (35.5%) ou le placebo (7%).
Le tableau 2 montre les taux de réponse chez les patients re-randomisés pour recevoir la dose de maintenance recommandée de Taltz 80 mg toutes les 4 semaines, en fonction de la dose randomisée à l'inclusion.
Tableau 2. Maintien de la réponse et de l'efficacité au bout de 60 semaines (résultats combinés des études UNCOVER-1 et UNCOVER-2, NRI)
|
Critère d'évaluation
|
80 mg 1×/2 sem. (induction)/Placebo (maintien) (N = 211)
|
80 mg 1×/4 sem. (induction)/Placebo (maintien) (N = 191)
|
80 mg 1×/2 sem (induction)/80 mg 1×/4 sem (maintien) (N = 221)
|
80 mg 1×/4 sem. (induction)/80 mg 1×/4 sem. (maintien) (N = 195)
| |
Score sPGA de 0 (blanchi) ou de 1 (minimal) conservé
|
7.6%
|
6.3%
|
78.3%
|
68.7%
| |
Score sPGA de 0 (blanchi) conservé ou atteint
|
2.8%
|
1.6%
|
58.8%
|
49.2%
| |
PASI 75 conservé ou atteint
|
9.0%
|
7.9%
|
83.3%
|
74.4%
| |
PASI 90 conservé ou atteint t
|
4.7%
|
4.7%
|
76.5%
|
66.7%
| |
PASI 100 conservé ou atteint t
|
2.8%
|
1.6%
|
57.5%
|
49.7%
|
Abréviations: N = nombre de patients dans la population d'analyse; NRI = Non-Responder Imputation
76.4% des répondeurs sPGA (0,1) à la semaine 12, qui ont été assignés au traitement de maintenance Taltz 80 mg 1×/4 sem., avaient un PASI <5 maintenu ou atteint à la semaine 60. L'amélioration de la gravité de la démangeaison a été maintenue jusqu'à la semaine 60 chez les patients traités avec Taltz qui étaient répondeurs sPGA (0,1) à la semaine 12.
En ce qui concerne le maintien de la réponse jusqu'à la semaine 60, Taltz a permis de maintenir la réponse chez les patients ayant précédemment reçu un traitement systémique, avec ou sans exposition préalable à des traitements biologiques/anti-TNF, y compris les patients en échec aux traitements biologiques/anti-TNF.
Pour les patients ayant obtenu un score sPGA de répondeurs (0,1) à la semaine 12 et re-randomisés dans le groupe placebo, le délai moyen de rechute (sPGA ≥3) a été de 164 (95% CI [143, 169]) jours en regroupant les études UNCOVER-1 et UNCOVER-2. Parmi ces patients, 71.5% ont de nouveau obtenu un score sPGA de 0,1 dans les 12 semaines suivant la reprise du traitement par Taltz 80 mg 1×/4 sem.
Pour les patients ayant obtenu un score sPGA de répondeurs (0,1) à la semaine 12, les améliorations du psoriasis des ongles, du cuir chevelu et palmoplantaire persistaient aussi jusqu'à la semaine 60.
Qualité de vie/Résultats rapportés par les patients
Des améliorations statistiquement significatives du score DLQI (Dermatology Life Quality Index ou indice de qualité de vie en dermatologie) ont été démontrées entre l'inclusion et la 12e semaine (études 1 à 3). Ces améliorations se sont maintenues pendant 60 semaines. Taltz était associé à des améliorations significativement supérieures des douleurs cutanées (mesurées au moyen de l'échelle analogique visuelle, visual analogic scale ou VAS).
PharmacocinétiqueAbsorption
Après une dose unique sous-cutanée d'ixekizumab chez des patients atteints de psoriasis, les concentrations sériques maximales moyennes ont été obtenues dans les 4 à 7 jours, avec un intervalle de dose compris entre 5 et 160 mg. La concentration sérique maximale (Cmax) moyenne (écart-type) d'ixekizumab, après une dose initiale de 160 mg, a été de 19.9 (8.15) µg/ml.
Après une dose initiale de 160 mg, l'état d'équilibre a été obtenu à la semaine 8 avec la posologie de 80 mg 1×/2 sem. Les estimations de la Cmax,ss, (concentration maximale à l'état d'équilibre) et de la Ctrough,ss (concentration résiduelle à l'état d'équilibre) moyennes (écart-type) sont respectivement de 21.5 (9.16) µg/mL et de 5.23 (3.19) µg/mL.
Après le passage à la semaine 12, du régime posologique de 80 mg 1×/2 sem. au régime posologique de 80 mg 1×/4 sem., l'état d'équilibre serait atteint au bout de 10 semaines environ. Les estimations de la Cmax,ss, et de la C trough,ss moyennes (écart-type) sont respectivement de 14.6 ±(6.04) µg/ml et de 1.87 (1.30) µg/ml.
La biodisponibilité absolue moyenne de l'ixekizumab était estimée entre 54 et 90% selon les analyses. Après injection sous-cutanée dans l'abdomen, le haut du bras ou la cuisse, des concentrations sériques similaires sont atteintes.
Distribution
Selon les analyses pharmacocinétiques de la population, le volume de distribution total moyen à l'état d'équilibre était de 7.11 litres.
Biotransformation
L'ixekizumab étant un anticorps monoclonal, il devrait être décomposé en petits peptides et en acides aminés par les voies cataboliques de la même manière que les IgGs endogènes.
Elimination
Dans l'analyse pharmacocinétique de population, la clairance sérique moyenne a été de 0.0161 l/h. La clairance est indépendante de la dose. La demi-vie d'élimination moyenne, estimée d'après l'analyse pharmacocinétique de la population, est de 13 jours chez les patients atteints de psoriasis en plaques.
Linéarité/Non-linéarité
L'exposition (AUC) a augmenté proportionnellement à la dose administrée pour une gamme posologique comprise entre 5 et 160 mg en injection sous-cutanée.
Cinétique pour certains groupes de patients
Patients âgés
Sur la base d'une analyse pharmacocinétique de la population avec un nombre limité de patients âgés (n = 94 patients de 65 ans et plus et n = 12 patients de 75 ans et plus), la clairance chez les patients âgés et les patients de moins de 65 ans était similaire.
Insuffisance rénale ou hépatique
Aucune étude de pharmacologie clinique spécifique destinée à évaluer les effets de l'insuffisance rénale et de l'insuffisance hépatique sur les paramètres pharmacocinétiques de l'ixekizumab n'a été réalisée.
Données précliniquesLes données non cliniques obtenues chez des singes Cynomolgus n'ont pas révélé de risque particulier pour l'homme sur la base des études de toxicologie en administration répétée, des évaluations de pharmacologie de sécurité et des études de toxicité sur la reproduction et sur le développement.
L'administration d'ixekizumab à des singes Cynomolgus pendant 39 semaines à des doses sous-cutanées allant jusqu'à 50 mg/kg une fois par semaine n'a produit aucune toxicité d'organe, ni d'effet indésirable sur la fonction immunitaire (par ex., réponse des anticorps dépendant des lymphocytes T et activité des cellules NK). Une dose sous-cutanée hebdomadaire de 50 mg/kg à des singes représente environ 19 fois la dose initiale de 160 mg de Taltz et entraîne, chez les singes, une exposition (AUC) au moins 61 fois supérieure à l'exposition moyenne prévue chez l'homme à l'état d'équilibre après administration de la dose recommandée.
Aucune étude non clinique n'a été réalisée pour évaluer le potentiel carcinogène ou mutagène de l'ixekizumab.
Aucun effet sur les organes reproducteurs, les cycles menstruels ou le sperme n'a été observé chez des singes Cynomolgus sexuellement matures ayant reçu une dose hebdomadaire sous-cutanée de 50 mg/kg d'ixekizumab pendant 13 semaines.
Dans les études de toxicité du développement, l'administration sous-cutanée d'ixekizumab à des doses allant jusqu'à 50 mg/kg une fois par semaine chez des singes cynomolgus depuis le début de l'organogenèse jusqu'à peu de temps avant la fin de la grossesse ou jusqu'à la naissance n'a pas induit d'effet embryotoxique ou tératogène, et n'a pas eu d'effet sur le cours de l'accouchement ni sur le développement morphologique, fonctionnel ou immunologique de la progéniture de leur naissance jusqu'à l'âge de 6 mois. L'incidence plus élevée de décès postnatal chez les singes était principalement attribuable à la négligence des mères ou à des naissances prématurées. Il s'agit de résultats qui sont fréquemment observés chez les singes et ne sont probablement pas causés par l'ixekizumab. En raison du petit nombre d'animaux, la valeur prédictive de l'étude est limitée.
Les études de toxicité du développement ont montré que l'ixekizumab traversait le placenta et était présent dans le sang de la descendance jusqu'à l'âge de 6 mois.
Remarques particulièresIncompatibilités
Non applicable (médicament à dose unique pour utilisation sous-cutanée).
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Remarques concernant le stockage
Stocker au réfrigérateur (2–8 °C). Conserver dans l'emballage original, afin de protéger le contenu de la lumière.
Ne pas congeler. Taltz ne doit pas être utilisé s'il a été congelé.
Remarques concernant la manipulation
Médicament à conserver hors de portée des enfants.
Ne pas agiter.
Taltz est une solution stérile, sans agent conservateur, limpide et incolore à légèrement jaune.
Ne pas utiliser si la solution contient des particules ou si elle est trouble et/ou de couleur marron.
Les seringues préremplies et les stylos préremplis sont à usage unique.
Le manuel d'utilisation joint à l'information destinée aux patients de la seringue préremplie, respectivement du stylo prérempli, doit être suivi scrupuleusement.
Numéro d’autorisation65906, 65907 (Swissmedic).
PrésentationTaltz solution injectable en seringue préremplie: 1 et 2 (B)
Taltz solution injectable en stylo prérempli: 1 et 2 (B)
Titulaire de l’autorisationEli Lilly (Suisse) SA, 1214 Vernier/GE.
Mise à jour de l’informationMars 2016.
|

