CompositionPrincipes actifs
eftrenonacog alfa (facteur de coagulation IX humain (ADNr))
Excipients
Poudre: saccharose, histidine, mannitol, polysorbate 20, hydroxyde de sodium (pour l’ajustement du pH), acide chlorhydrique (pour l’ajustement du pH)
Solvants: solution de chlorure de sodium, eau pour injection
Sodium par flacon: 0,3 mmol (6,4 mg).
Indications/Possibilités d’emploiALPROLIX est indiqué pour le traitement et le traitement préventif des saignements chez les patients atteints d’hémophilie B (déficit congénital en facteur IX).
Posologie/Mode d’emploiLe traitement doit se faire sous le contrôle d’un médecin expérimenté dans le traitement de l’hémophilie.
Surveillance de la thérapie
Pendant la thérapie, une détermination adéquate du taux de facteur IX est conseillée afin d’adapter au mieux la posologie et la fréquence des injections répétées à effectuer. La réponse de chaque patient au facteur IX peut varier, ce qui se manifeste par des demi-vies différentes et des récupérations différentes. En ce qui concerne la posologie basée sur le poids corporel, il peut s’avérer nécessaire de procéder à un ajustement chez les patients en surcharge ou en insuffisance pondérale. C’est surtout lors d’interventions chirurgicales importantes qu’une surveillance précise de la thérapie de substitution à l’aide d’une analyse de la coagulation (activité du facteur IX dans le plasma) est indispensable.
Lors de l’utilisation d’un test de coagulation in-vitro en une seule étape sur la base du temps de céphaline activée (aPTT) afin de déterminer l’activité du facteur IX dans les échantillons sanguins du patient, les résultats de l’activité du facteur IX peuvent être considérablement influencés aussi bien par le type de réactif aPTT utilisé que par le témoin de référence utilisé. Ce point doit être tout particulièrement pris en compte en cas de changement de laboratoire et/ou des réactifs utilisés dans le test.
Les mesures effectuées à l’aide d’un test de coagulation en une seule étape au cours duquel un réactif aPTT à base de kaoline est utilisé conduisent probablement à une sous-évaluation du taux d’activité.
Posologie
La posologie et la durée de la thérapie de substitution se basent sur le degré de gravité du déficit en facteur IX, la localisation et l’étendue du saignement, ainsi que l’état clinique du patient.
Le nombre d’unités du facteur IX à appliquer est indiqué en Unités Internationales (U.I.) sur la base de la norme actuelle de l’OMS pour les préparations de facteur IX. L’activité du facteur IX dans le plasma est représentée en pourcentage (par rapport à un plasma humain normal) ou en unités internationales (par rapport à une norme internationale pour le facteur IX dans le plasma).
Une unité internationale (U.I.) de facteur IX Fc recombinant correspond à la quantité de facteur IX dans un ml de plasma humain normal.
Traitement en fonction de la situation
Le calcul de la dose nécessaire de facteur IX Fc recombinant se base sur le résultat empirique selon lequel 1 unité internationale (U.I.) de facteur IX par kg de poids corporel augmente l’activité du facteur IX dans le plasma de 1 % par rapport à l’activité normale (U.I./dl). La dose nécessaire se calcule avec la formule suivante:
Unités nécessaires = poids corporel (kg) x augmentation souhaitée du facteur -IX (%) (U.I.) x valeur inverse de la récupération déterminée (U.I./kg par U.I./dl).
La dose nécessaire, ainsi que la fréquence de l’application, doivent toujours s’orienter par rapport à l’efficacité clinique au cas par cas. Si le contrôle des saignements nécessite une administration supplémentaire, il convient alors de tenir compte de la durée de demi-vie d’ALPROLIX la plus longue (voir «pharmacocinétique»). Un retard de la durée jusqu’à l’atteinte de l’activité maximale n´est pas à attendre.
Lors des saignements décrits ci-après, l’activité du facteur IX ne doit pas descendre en dessous de l’activité plasmatique indiquée (en % de la norme, ou en U.I./dl) sur la période correspondante. Les données figurant dans le tableau 1 peuvent servir de valeurs indicatives pour la posologie lors des épisodes hémorragiques et les interventions chirurgicales.
Tableau 1: directives pour la posologie d’ALPROLIX dans le cadre du traitement des épisodes hémorragiques et lors d’interventions chirurgicales
|
Degré de gravité du saignement / Nature de l’intervention chirurgicale
|
Taux de facteur IX nécessaire (%) (U.I./dl)
|
Fréquence de l’application (en heures) / durée de la thérapie (en jours)
| |
Saignement
|
|
| |
Hémarthrose à un stade précoce, saignement musculaire ou saignement buccal
|
20-40
|
Répéter l’injection toutes les 48 heures, jusqu’à ce que l’épisode hémorragique (identifié par les douleurs) se soit atténué ou qu’une guérison ait été atteinte.1
| |
Hémarthrose étendue, saignement musculaire ou hématome
|
30-60
|
Répéter l’injection toutes les 24 à 48 heures, jusqu’à ce que les douleurs et les troubles aigus aient disparu.1
| |
Saignements dangereux pour la vie du patient
|
60-100
|
Répéter l’injection toutes les 8 à 24 heures, jusqu’à ce que le pronostic vital du patient ne soit plus engagé.
| |
Interventions chirurgicales
|
|
| |
Interventions de petite envergure, y compris extraction dentaire
|
30-60
|
Si nécessaire, répéter l’injection toutes les 24 à 48 heures, jusqu’à ce qu’une guérison ait été atteinte.
| |
Interventions chirurgicales de grande envergure
|
80-100
(pré- et postopératoires)
|
Si nécessaire, répéter l’injection toutes les 8 à 24 heures, jusqu’à ce que la plaie ait suffisamment cicatrisé, puis poursuivre la thérapie pendant au moins 7 jours, afin de maintenir une activité du facteur IX de 30% à 60% (U.I./dl).
|
1 Voir le tableau 3 au paragraphe «Pharmacocinétique».
Traitement préventif
Pour la prévention de longue durée des saignements, sont recommandées les posologies initiales suivantes:
· 50 U.I./kg une fois par semaine, ajustement de la posologie selon la réponse individuelle du patient, ou
· 100 U.I./kg tous les 10 jours, ajustement de l’intervalle selon la réponse individuelle du patient. Chez certains patients, lorsque les saignements sont bien contrôlés par le traitement administré une fois tous les 10 jours, un allongement de l’intervalle de traitement à 14 jours ou plus peut être possible.
La posologie maximale conseillée pour le traitement préventif est de 100 U.I./kg.
Instructions spéciales pour la posologie
Patients âgés
L’expérience avec les patients âgés de 65 ans et plus est limitée.
Enfants et adolescents
Chez les enfants de moins de 12 ans, il peut être nécessaire d’appliquer des doses plus élevées, ou des intervalles d’administration plus courts. La posologie initiale recommandée est de 50-60 U.I./kg tous les 7 jours. Pour les adolescents à partir de 12 ans, les mêmes recommandations de posologie que pour les adultes sont applicables (voir «Propriétés/Effets» et «Pharmacocinétique»). La dose maximale recommandée pour le traitement préventif est de 100 U.I./kg.
Les données disponibles pour le traitement des enfants de moins de 6 ans lors d’interventions chirurgicales sont limitées.
Type d’application
Application intraveineuse
ALPROLIX doit être injecté par voie intraveineuse sur une durée de plusieurs minutes. La vitesse d’administration être déterminée en fonction de l'état du patient et ne doit pas dépasser 10 ml/min.
Une utilisation sous forme de perfusion continue n’est pas autorisée, elle n’est donc pas recommandée (voir «Mises en garde et précautions»).
Pour les remarques sur la reconstitution du médicament avant l’utilisation, voir «Remarques concernant la manipulation».
Documentation du numéro de lot
Afin d’assurer la traçabilité des médicaments fabriqués à l’aide de la biotechnologie, il est conseillé de documenter le nom commercial et le numéro de lot pour chaque traitement.
Contre-indicationsHypersensibilité au principe actif ou à l’un des excipients.
Mises en garde et précautionsHypersensibilité
Lors d’une thérapie à base d’ALPROLIX, des réactions d’hypersensibilité allergique ont été rapportées. Il convient d’ordonner aux patients de stopper immédiatement l’utilisation du médicament et de s’adresser à leur médecin si des symptômes d’hypersensibilité apparaissent. Les patients doivent être informés des premiers signes des réactions d’hypersensibilité, y compris papules, urticaire généralisé, sensations d’oppression dans la poitrine, sifflements, hypotonie et chocs anaphylactiques.
Dans le cas d’un choc anaphylactique, il convient d’appliquer la thérapie médicale standard pour le traitement du choc.
Inhibiteurs
Après un traitement répété par des préparations de facteur IX, les patients doivent être surveillés afin de détecter l’éventuel développement d’anticorps neutralisants (inhibiteurs). Ces derniers doivent être quantifiés au moyen de tests biologiques adaptés et exprimés en unités Bethesda (U.B.).
Les rapports publiés dans la littérature spécialisée montrent une corrélation entre l’apparition d’un inhibiteur du facteur IX et les réactions allergiques. C’est pourquoi les patients présentant des réactions allergiques doivent être testés afin de détecter la présence d’éventuels inhibiteurs. Il convient de noter que les patients ayant des inhibiteurs de facteur IX présentent un risque plus important de réactions anaphylactiques en cas d’exposition ultérieure au facteur IX.
En raison du risque de réactions allergiques après l’administration de préparations de facteur IX, il convient de réaliser les premières applications de facteur IX selon l’estimation du médecin traitant et sous observation médicale dans des établissements équipés pour traiter les réactions allergiques.
Thromboembolie
En raison du risque potentiel de complications thromboemboliques, l'utilisation de produits à base de facteur IX chez les patients souffrant d'une maladie du foie, les patients postopératoires, les nouveau-nés ou les patients présentant un risque d'événements thrombotiques ou de coagulopathie de consommation (coagulation intravasculaire disséminée, CIVD) doit faire l'objet d'une surveillance clinique à l'aide de tests biologiques appropriés afin de détecter les signes précurseurs d’une coagulopathie thrombotique ou d'une coagulopathie de consommation. Dans ces cas, le bénéfice du traitement par ALPROLIX doit être mis en balance avec les risques de ces complications.
Perfusion continue
La sécurité et l’efficacité de l’utilisation d’APROLIX en perfusion continue ne sont pas démontrées (voir «Posologie/Mode d’emploi»).
Événements cardiovasculaires
Chez les patients présentant déjà des facteurs de risque cardiovasculaire, un traitement de substitution par des produits de facteur IX peut augmenter le risque cardiovasculaire.
Complications liées aux cathéters
Si un cathéter veineux central (CVC) est nécessaire, il convient de tenir compte du risque de complications associées au CVC, y compris ’le risque d’infections locales, de bactériémies et de thromboses au point d’insertion du cathéter.
Enfants et adolescents
Les avertissements et mesures de précaution indiqués valent aussi bien pour les adultes que pour les enfants.
Remarque concernant les excipients
Ce médicament contient moins de 1 mmol (23 mg) de sodium par flacon, c.-à-d. qu’il est essentiellement « sans sodium ». Il contient 0,3 mmol (soit 6,4 mg) de sodium par flacon. Il convient d’en tenir compte pour les patients devant veiller à suivre une alimentation pauvre en sodium.
InteractionsIl n’a été fait état d’aucune interaction entre ’ALPROLIX et d’autres médicaments. Aucune étude d’interaction n’a été menée.
Grossesse, AllaitementGrossesse
Aucune étude de reproduction n’a été menée sur des animaux avec ALPROLIX. Une étude a été effectuée sur le transfert placentaire chez les souris (voir «Données précliniques»). L’hémophilie B ’étant rare chez les femmes, il n’existe aucune expérience sur l’utilisation du facteur IX pendant la grossesse et l’allaitement. Par conséquent, il convient de n’utiliser le facteur IX pendant la grossesse et l’allaitement qu’en cas de nécessité absolue.
Effet sur l’aptitude à la conduite et l’utilisation de machinesALPROLIX n’a aucune influence sur l’aptitude à la conduite ou l’utilisation de machines.
Effets indésirablesRésumé du profil de sécurité
Dans de rares cas, en relation avec les traitements de substitution par des facteurs de coagulation, des réactions d’hypersensibilité ou des réactions allergiques sont possibles et peuvent comprendre des angio-œdèmes, une sensation de brûlure et de piqûre au site de perfusion, des frissons, une sensation de chaleur, une urticaire généralisée, des papules, une hypotonie, une léthargie, des nausées, une agitation, une tachycardie, une sensation d’oppression dans la poitrine, des fourmillements, des vomissements, des sifflements. Dans certains cas, ces réactions ont évolué en une grave anaphylaxie (avec choc) et ont été accompagnées de l’apparition d’inhibiteurs de facteur IX (voir également le paragraphe «Mises en garde et précautions»). Chez les patients atteints d’hémophilie B, il peut se former des anticorps neutralisants (inhibiteurs) contre le facteur IX. Ces inhibiteurs se manifestent sous la forme d’une réponse clinique insuffisante au médicament. Dans ce cas, il convient de contacter un centre spécialisé dans l’hémophilie. Après des essais d'induire une tolérance immunitaire chez les patients atteints d'hémophilie B avec des inhibiteurs du facteur IX et des réactions allergiques, des cas de syndrome néphrotique ont été signalés.
Après l’administration de préparations de facteur IX, il existe un risque d’épisodes thromboemboliques. Ce risque est plus élevé avec les produits ayant un faible degré de pureté. Lors de l’utilisation de facteur IX ultra-pur, les complications thromboemboliques sont rares.
Liste des effets indésirables
Patients atteints (PTPs) : La sécurité d’ALPROLIX a été observé chez un total de 153 patients atteints d’hémophilie B sévère dans le cadre de deux études cliniques de phase III et d’une étude d’extension. Les événements indésirables ont été surveillés sur 561 sujets-années au total. Le nombre total de jours d’exposition a été de 26 106, avec une médiane de 165 (intervalle : 1 à 528) jours d’exposition par sujet.
Patients non traités antérieurement (PUP) : un total de 33 patients atteints d'hémophilie B sévère ont été suivis dans le cadre d'un essai clinique. Les événements indésirables ont été surveillés sur un total de 57,51 patients-années. Le nombre total de jours d'exposition était de 2233, avec une valeur médiane de 76 (intervalle de 1 à 137) jours d'exposition par patient.
La sécurité Les effets indésirables les plus fréquemment signalés lors de la prise d’ALPROLIX étaient, avec une incidence de 1,3 %, les céphalées, la paresthésie orale et l’uropathie obstructive (PTPs), érythème au site d'injection, bien que Inhibition du facteur IX et hypersensibilité chez les PUPs.
Les effets indésirables sont indiqués conformément à la classification des systèmes d’organes MedDRA (SOC et termes préférés).
Les fréquences ont été estimées selon la convention suivante: très fréquent (≥1/10); fréquent (<1/100, ≥1/10); occasionnel (<1/1000, ≥1/100); rare (<1/10’000, ≥1/1000); très rare (<1/10’000), inconnu (la fréquence ne peut être estimée sur la base des données disponibles). Les effets indésirables suivants ont été signalés dans le cadre d’études cliniques ou après l’introduction au marché sur ALPROLIX.
Tableau 2: effets indésirables de ALPROLIX
|
Classification des systèmes d’organes MedDRA
|
Effets indésirables
|
Fréquences
| |
Affections hématologiques et du système lymphatique
|
Inhibiteurs du factor IX
|
Fréquent 1
| |
Affections du système immunitaire
|
Hypersensibilité
Anaphylaxie
|
Fréquent 1
Cas singuliers
| |
Troubles du métabolisme et de la nutrition
|
Perte d’appétit
|
Occasionnel
| |
Affections du système nerveux
|
Céphalées
Vertiges
Dysgueusie
|
Fréquent
Occasionnel
Occasionnel
| |
Affections cardiaques
|
Palpitations
|
Occasionnel
| |
Affections vasculaires
|
Hypotonie
|
Occasionnel
| |
Affections gastro-intestinales
|
Paresthésie orale
Mauvaise haleine
|
Fréquent
Occasionnel
| |
Affections du rein et des voies urinaires
|
Uropathie obstructive
Hématurie
Colique néphrétique
Syndrome néphrotique (suite tentative tolérance immunitaire)
|
Fréquent
Occasionnel Occasionnel
Cas singuliers
| |
Troubles généraux et anomalies au site d’administration
|
Érythème au site d'injection
Fatigue
Douleurs au site de perfusion
|
Fréquent
Occasionnel Occasionnel
|
1 La fréquence se réfère à l'occurrence dans l'étude avec les PUP. Les deux événements que sont l'inhibition du facteur IX et l'hypersensibilité sont survenus dans l'étude IV pour le même PUP. Voir la description d'effets indésirables sélectionnés
Description d’effets indésirables spécifiques
Dans l'ensemble du programme d'études cliniques, un patient (précédemment non traité) de l'étude IV a présenté un faible titre d'inhibiteurs du facteur IX associé à une hypersensibilité (voir "Efficacité clinique"). Après la commercialisation, le développement d'inhibiteurs du facteur IX et l'hypersensibilité (y compris l'anaphylaxie) ont été observés.
Enfants et adolescents
Chez l’enfant, les effets indésirables ont la même fréquence, la même nature et le même degré de sévérité que chez l’adulte.
L’annonce d’effets secondaires présumés après l’autorisation est d’une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d’effet secondaire nouveau ou grave via le portail d’annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageAucun cas de surdosage n’a été rapporté à ce jour.
Propriétés/EffetsCode ATC
B02BD04
Mécanisme d’action
L’eftrenonacog alfa (facteur de coagulation IX humain recombinant, protéine de fusion Fc [rFIXFc]) possède 867 acides aminés. Il est fabriqué à l’aide de la ‘technologie de l’ADN recombinant dans une lignée cellulaire embryonnaire rénale humaine (HEK) et sans adjonction de protéines exogènes, humaines ou animales, lors du processus de culture cellulaire, de purification ou de formulation finale.
Le facteur IX est une glycoprotéine à chaîne simple, avec une masse moléculaire d’env. 55000 Daltons. Le facteur de coagulation dépend de la vitamine K. Le facteur IX est activé par le facteur XIa dans le système de coagulation endogène et par le facteur VII / complexe facteur tissulaire dans le système de coagulation exogène. Le facteur IX activé, associé au facteur VIII activé, active le facteur X. Le facteur X activé transforme la prothrombine en thrombine. La thrombine transforme alors le fibrinogène en fibrine, et il se forme un caillot de sang.
L’hémophilie B est un trouble héréditaire, lié au sexe, de la coagulation sanguine, engendré par le faible taux de facteur IX fonctionnel. Elle entraîne des saignements dans les articulations, les muscles ou les organes internes, que ce soit de manière spontanée ou suite à un traumatisme chirurgical ou à un accident. La thérapie de substitution permet d’accroître le taux de facteur IX dans le plasma, ce qui permet de corriger provisoirement le déficit de facteur IX et la tendance hémorragique.
Pharmacodynamique
ALPROLIX (eftrenonacog alfa) est une protéine de fusion à action longue et entièrement recombinante, composée de facteur de coagulation IX humain, lié de manière covalente au domaine Fc de l’immunoglobine G1 humaine, et produit par la ’technologie de l’ADN recombinant.
La région Fc de l’immunoglobine G1 humaine se lie au récepteur Fc néonatal. Ce récepteur est exprimé pendant toute la vie du patient et fait partie d’une voie métabolique naturelle qui protège l’immunoglobine de la destruction lysosomale en réintégrant cette protéine dans la circulation sanguine, ce qui entraîne une longue demi-vie dans le plasma.
Efficacité clinique
La sécurité, l’efficacité et la pharmacocinétique d’ALPROLIX ont fait l’objet de deux études internationales ouvertes sur les patients atteints (PTPs) - une étude de phase 3 menée chez des adultes et des adolescents, appelée ici étude I, et une étude pédiatrique de phase 3, appelée étude II - (voir «Enfants et Adolescents»). La sécurité et l'efficacité d'ALPROLIX ont également été étudiées chez des patients (PUP) atteints d'hémophilie B sévère non traités auparavant (étude IV) ; voir «Enfants et Adolescents».
Dans le cadre de l’étude I, une comparaison de l’efficacité de deux régimes de traitement prophylactique (intervalle hebdomadaire fixe à une posologie de 50 UI/kg, et individualisé à une posologie de 100 UI/kg initialement tous les 10 jours) avec celle d’un traitement personnalisé a été effectuée. Cette étude a été conduite auprès d’un total de 123 patients de sexe masculin prétraités (12 à 71 ans) et atteints d’hémophilie B grave (activité FIX endogène ≤ 2%). Tous les patients ont reçu ALPROLIX et ont été suivis jusqu’à 77 semaines après le traitement.
Sur les 123 sujets qui ont achevé l’étude I, 93 ont été recrutés dans l’étude III (étude d’extension), avec une durée de suivi total médiane de 6,5 ans.
Il est à noter que le taux de saignement annualisé (Annualised Bleeding Rates, ABR) n’est pas comparable entre les différents concentrés de facteur, ni entre les différentes études cliniques.
Prophylaxie hebdomadaire fixe et individualisée :
La dose hebdomadaire médiane pour les sujets inclus dans le groupe hebdomadaire fixe était de 45,17 UI/kg (écart interquartile [EIQ] : 38,1-53,7) dans l’étude I. Parmi les sujets évaluables en termes d’efficacité, les taux de saignement annualisés ABR médians correspondants ont été de 2,95 (EIQ : 1,01-4,35) et sont restés du même ordre pendant toute la durée de l’étude III (1,85 [EIQ : 0,76-4,0]). Le taux médian de saignements articulaires spontanés a été de 0,38 (EIQ : 0,00-1,43) chez les sujets de l’étude III.
Chez les sujets dans le groupe individualisé, l’intervalle d’administration médian était de 12,53 jours (EIQ : 10,4-13,4) dans l’étude I l’ABR médian correspondant était de 1,38 (EIQ : 0,00-3,43) et est resté du même ordre pendant toute la durée de l’étude III (1,85 [EIQ : 0,76-4,0]).
Les intervalles d’administration et la consommation de facteur dans l’étude III (étude d’extension) sont restés comparables à ceux de l’étude I pour les deux protocoles de traitement prophylactique.
Aucun épisode hémorragique ne s’est produit chez 42 % des sujets sous prophylaxie individualisée et chez 23,0 % des sujets sous prophylaxie hebdomadaire. La proportion de sujets présentant ≥ 1 articulation cible à l’inclusion était plus faible dans le groupe de prophylaxie individualisée que dans le groupe de prophylaxie hebdomadaire (27,6 % et 57,1 %, respectivement).
Traitement des saignements:
Sur les 636 épisodes hémorragiques qui avaient été observés lors de l’étude I, 90,4 % ont été résolus avec 1 injection et 97,3 % avec 2 injections ou moins. La dose médiane par injection, en traitement d’un épisode hémorragique, était de 46,07 U.I./kg (EIQ : 32,86-57,03) UI/kg. La dose globale médiane utilisée pour traiter un épisode hémorragique a été de 51,47 UI/kg (EIQ : 35,21-61,73) dans le groupe de prophylaxie hebdomadaire, de 49,62 (EIQ : 35,71-94,82) dans le groupe de prophylaxie individualisée et de 46,58 (EIQ : 33,33-59,41) dans le groupe de traitement à la demande.
Prise en charge péri-opératoire (prophylaxie chirurgicale) :
Au total, 35 interventions chirurgicales majeures ont été réalisées et évaluées chez 22 sujets (21 adultes et adolescents et 1 patient pédiatrique âgé de < 12 ans) dans l’étude I et dans l’étude III. Sur les 35 interventions chirurgicales majeures, 28 (80,0 %) ont nécessité une dose préopératoire unique pour maintenir l’hémostase pendant l’intervention chirurgicale. La médiane des doses moyennes par injection utilisée pour maintenir l’hémostase pendant l’intervention était de 94,7 UI/kg (intervalle : 49-152 UI/kg). La dose totale reçue le jour de l’intervention a été comprise entre 49 et 341 UI/kg, et la dose totale reçue pendant les 14 jours de la période péri-opératoire a été comprise entre 60 et 1 947 UI/kg.
La réponse hémostatique a été jugée excellente ou bonne dans 100 % des interventions chirurgicales majeures.
Enfants et adolescents
Lors de l’étude II, un total de 30 patients pédiatriques de sexe masculin prétraités et atteints d’hémophilie B grave (activité FIX endogène ≤ 2%) a été inclus. Les patients étaient âgés de moins de 12 ans (15 avaient moins de 6 ans et 15 avaient de 6 à 12 ans). Tous les patients ont reçu ALPROLIX et ont été suivis jusqu’à 52 semaines après le traitement.
Les 30 patients ont tous été traités par ALPROLIX selon un protocole de traitement prophylactique, en débutant à la dose de 50 - 60 UI/kg tous les 7 jours, avec possibilité d’ajustement de la dose jusqu’à un maximum de 100 UI/kg et de l’intervalle d’administration entre un minimum d’une fois par semaine et un maximum de deux fois par semaine. Parmi les 30 patients qui ont achevé l’étude II, 27 ont été recrutés dans l’étude III (étude d’extension). La durée médiane dans les études II + III était de 2,88 ans, avec un nombre moyen de 166 jours d’exposition.
L'étude IV a inclus 33 patients (PUP) de l'enfance et de l'adolescence atteints d'hémophilie B sévère (≤ 2 % d'activité FIX endogène) qui n'avaient jamais été traités auparavant. L'âge médian à l'inclusion dans l'étude était de 0,6 an (intervalle : 0,08 à 2 ans) ; 78,8 % des participants étaient âgés de moins d'un an. La durée médiane du traitement par ALPROLIX a été de 83,01 semaines au total (fourchette : 6,7 à 226,7 semaines), avec un nombre médian de jours d'exposition de 76 au total (fourchette : 1 à 137 jours).
Prophylaxie individualisée :
La médiane des doses hebdomadaires moyennes d’ALPROLIX était de 59,40 UI/kg (écart interquartile dans l’étude II : 52,95 à 64,78 UI/kg) chez les sujets âgés de < 6 ans et de 57,78 UI/kg (écart interquartile : 51,67 à 65,01 UI/kg) chez les sujets âgés de 6 à < 12 ans. Globalement, l’intervalle d’administration médian était de 6,99 jours (écart interquartile : 6,94 à 7,03) et ne s’est pas révélé différent selon la cohorte d’âge. À l’exception d’un patient chez lequel la dernière dose prescrite était de 100 UI/kg tous les 5 jours, les dernières doses prescrites chez les 29 autres patients étaient de 70 UI/kg maximum tous les 7 jours. Aucun épisode hémorragique ne s’est produit chez 33 % des sujets pédiatriques. Les intervalles d’administration et la consommation de facteur dans l’étude III sont restés comparables à ceux de l’étude II.
Les taux de saignement annualisés médians chez les sujets âgés de < 12 ans évaluables en termes d’efficacité étaient de 1,97 (écart interquartile : 0,00 - 3,13) dans l’étude II et sont restés du même ordre tout au long de l’étude III (étude d’extension).
Chez les PUP (étude IV), la dose hebdomadaire moyenne médiane d'ALPROLIX était de 57,96 UI/kg (intervalle interquartile de 52,45 à 65,06 UI/kg) et l'intervalle de dosage médian était de 7 jours (intervalle interquartile de 6,95 à 7,12 jours). Les intervalles de dosage et la consommation de facteurs étaient similaires dans l'étude IV et dans les études II et III. Parmi les PUP recevant une prophylaxie, 8 (28,6 %) n'ont pas connu d'épisodes hémorragiques. Le TBA médian de tous les participants sous prophylaxie était de 1,24 (écart interquartile de 0,0 à 2,49).
Traitement des épisodes hémorragiques :
Sur les 60 événements hémorragiques observés au cours de l’étude II, 75 % ont pu être contrôlés par 1 injection et, globalement, 91,7 % des événements hémorragiques ont pu être contrôlés par 2 injections ou moins. La médiane des doses moyennes par injection utilisée pour traiter un épisode hémorragique a été de 63,51 (écart interquartile : 48,92 à 99,44) UI/kg. La dose globale médiane utilisée pour traiter un épisode hémorragique a été de 68,22 UI/kg (écart interquartile : 50,89 à 126,19).
Sur les 58 épisodes hémorragiques chez des PUP sous prophylaxie dans l'étude IV, 87,9 % ont pu être contrôlés avec 1 injection et 96,6 % au total avec 2 injections ou moins. La dose médiane moyenne par injection pour traiter un épisode hémorragique était de 71,92 UI/kg (écart interquartile de 52,45 à 100,81 UI/kg). La dose totale médiane pour le traitement d'un épisode hémorragique était de 78,74 U.I./kg (intervalle interquartile de 53,57 à 104,90 U.I./kg).
PharmacocinétiqueAbsorption
Toutes les études sur la pharmacocinétique d’ALPROLIX ont été menées auprès de patients atteints d’hémophilie B grave et ayant déjà reçu un traitement. Les données présentées dans ce paragraphe ont été recueillies à l’aide d’un test de coagulation en 1 étape, avec un réactif aPTT à base de silicium étalonné avec un facteur IX plasmatique témoin. Les propriétés pharmacocinétiques ont été évaluées auprès de 22 patients (≥19 ans) traités par ALPROLIX (rFIXFc). Le prélèvement des échantillons pharmacocinétiques a été effectué avant l’administration de 50 U.I./kg de rFIX (Benefix) ainsi qu’à 8 moments, sur une période allant jusqu’à 96 heures (4 jours) après l’administration. Après une phase de sevrage d’au moins 120 heures (5 jours), les patients ont reçu une dose unique de 50 U.I./kg d’ALPROLIX. Le prélèvement des échantillons pharmacocinétiques a été effectué ’avant l’administration, puis à 11 moments, sur une période allant jusqu’à 240 heures (10 jours) après l’administration. Les paramètres pharmacocinétiques après l’administration d’une dose de 50 U.I./kg d’ALPROLIX sont indiqués dans le tableau 3.
Tableau 3: paramètres pharmacocinétiques d’ALPROLIX (50 U.I./kg)
|
Paramètres pharmacocinétiques1
|
ALPROLIX
(IC à 95%)
| |
N=22
| |
Récupération incrémentielle (U.I./dl par U.I./kg)
|
0,92
(0,77-1,10)
| |
ASC/Dose
(U.I.*h/dl par U.I./kg)
|
31.32
(27,88-35,18)
| |
Cmax (U.I./dl)
|
40,81
(33,60-49,58)
| |
CL (ml/h/kg)
|
3,19
(2,84-3,59)
| |
t1/2α (h)
|
5,03
(3,20-7,89)
| |
t1/2β (h)
|
82,12
(71,39-94,46)
| |
MRT (h)
|
98,60
(88,16-110,29)
| |
Vss (ml/kg)
|
314,80
(277,8-356,8)
| |
Temps jusqu’à 1% (en jours)
|
11,22
(10,20-12,35)
|
1 Les paramètres pharmacocinétiques sont indiqués sous forme de moyennes géométriques (IC à 95%)
Abréviations: IC = intervalle de confiance; Cmax = activité maximale; ASC = aire sous la courbe de l’activité FIX en fonction du temps; t1/2α = demi-vie de répartition;
t1/2β = demi-vie d’élimination; CL = clairance; Vss = volume de distribution à l’équilibre; MRT = durée de séjour moyenne.
La demi-vie d’élimination d’ALPROLIX (82 heures) est influencée par la région Fc déterminée de manière avérée dans les modèles animaux par le métabolisme du récepteur Fc néonatal.
Un modèle pharmacocinétique de population a été développé. Il repose sur les données de l’activité FIX de 161 patients de tous les âges (2 à 76 ans) pesant entre 12,5 et 186,7 kg et ayant participé à trois études cliniques (12 patients dans une étude de phase 1/2a, ainsi que 123 patients dans l’étude I et 26 patients dans l’étude II). La valeur attendue en termes de clairance d’ALPROLIX pour un adulte typique de 70 kg est de 2,30 dl/h et le volume de distribution à l’équilibre est de 194,8 dl pour ALPROLIX. Le modèle a été appliqué pour la prévision du profil activité-temps après une administration unique d’ALPROLIX chez des patients atteints d’hémophilie B grave (voir tableau 4).
Tableau 4: activité FIX prédite [U.I./dl] après une administration unique d’ALPROLIX1 chez des patients âgés de ≥12 ans
|
Dose (I.E./kg)
|
Fin de l’injection
|
12 heures
|
24 heures
(jour 1)
|
36 heures
|
48 heures
(jour 2)
|
72 heures
(jour 3)
|
Jour 5
|
Jour 7
|
Jour 10
|
Jour 14
| |
Médiane (5è, 95è)
| |
50
|
52,0
|
21,7
|
15,2
|
11,3
|
8,4
|
5,5
|
3,02
|
1,93
|
1,07
|
0,495
| |
[31,8; 82]
|
[15,0; 31,0]
|
[10,2; 21,5]
|
[7,50; 16,5]
|
[5,5; 12,5]
|
[3,59; 8,25]
|
[1,88; 4,65]
|
[0.99; 3.12]
|
[0,345; 1,95]
|
[0,0829; 1,17]
| |
100
|
104,0
|
43,4
|
30,4
|
22,6
|
16,8
|
11
|
6,03
|
3,85
|
2,13
|
0,991
| |
[63,6; 164]
|
[30,0; 62,0]
|
[20,4; 42,9]
|
[15,0; 32,9]
|
[11; 24,9]
|
[7,18; 16,5]
|
[3,77; 9,29
|
[1,98; 6,24]
|
[0,691; 3,89]
|
[0,166; 2,34]
|
1 Voir «Posologie/Mode d’emploi»
Distribution
Voir « Absorption ».
Métabolisme
Voir « Absorption ».
Élimination
Voir « Absorption ».
Cinétique pour certains groupes de patients
Enfants et adolescents
Les paramètres pharmacocinétiques d’ALPROLIX ont été déterminés chez les adolescents au cours de l’étude I et chez les enfants au cours de l’étude II (le prélèvement des échantillons pharmacocinétiques a été effectué avant l’administration et à plusieurs moments, sur une période allant jusqu’à 336 heures (14 jours) après l’administration dans l’étude I / avant l’administration et à 7 moments sur une période allant jusqu’à 168 heures (7 jours) après l’administration dans l’étude II.
Le tableau 5 présente les paramètres pharmacocinétiques qui ont été calculés sur la base des données pédiatriques de 35 patients âgés de moins de 18 ans.
Tableau 5: comparaison des paramètres pharmacocinétiques d’ALPROLIX (rFIXFc) par classe d’âge
|
Paramètres pharmacocinétiques1
|
Étude II
|
Étude I
| |
<6 ans
(intervalle 2-4)
|
6 à <12 ans
(intervalle 6-10)
|
12 à <18 ans
(intervalle 12-17)
| |
N = 11
|
N = 13
|
N = 11
| |
IR
(U.I./dl par U.I./kg)
|
0,5898
(0,5152; 0,6752)
|
0,7170
(0,6115; 0,8407)
|
0,8470
(0,6767; 1,0600)
| |
ASC/Dose
(U.I.*h/dl par U.I./kg)
|
22,71
(20,32; 25,38)
|
28,53
(24,47; 33,27)
|
29,50
(25,13; 34,63)
| |
t½ (h)
|
66,49
(55,86; 79,14)
|
70,34
(60,95; 81,17)
|
82,22
(72,30; 93,50)
| |
MRT (h)
|
83,65
(71,76; 97,51)
|
82,46
(72,65; 93,60)
|
93,46
(81,77; 106,81)
| |
CL (ml/h/kg)
|
4,365
(3,901; 4,885)
|
3,505
(3,006; 4,087)
|
3,390
(2,88; 3,979)
| |
Vss (ml/kg)
|
365,1
(316,2; 421,6)
|
289,0
(236,7; 352,9)
|
316,8
(267,4; 375,5)
|
1Les paramètres pharmacocinétiques de l’analyse non compartimentale sont indiqués sous forme de moyennes géométriques (IC à 95%)
Abréviations: IC = intervalle de confiance; IR = récupération incrémentielle; ASC = aire sous la courbe de l’activité FIX en fonction du temps; t1/2 = demi-vie terminale; MRT = durée de séjour moyenne; CL = clairance; Vss = volume de distribution à l’équilibre
Données précliniquesSur la base des études de toxicité aiguë et de toxicité en cas d’administration répétée, qui incluaient les évaluations de la toxicité locale et de la pharmacologie de sécurité, les données précliniques ne permettent pas d’identifier de risque particulier pour l’être humain. Des études axées sur la génotoxicité, la cancérogénicité, la toxicité reproductive ou le développement embryonnaire et fœtal n’ont pas été menées. Une étude sur le transfert plasmatique a démontré que chez la souris, Eftrenonacog alfa (rFIXFc) passent la barrière placentaire.
Fertilité
Aucune étude de fertilité n’a été menée sur des animaux avec ALPROLIX.
Remarques particulièresIncompatibilités
En l’absence d’études de compatibilité, ce médicament ne doit pas être mélangé à d’autres médicaments.
N’utiliser que le kit d’injection fourni, car certains équipements d’injection risquent, en raison d’une adsorption du facteur de coagulation IX sur les surfaces intérieures, de causer l’échec du traitement.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l’emballage. Pendant la durée de conservation, le médicament peut être entreposé, pendant une période unique de 6 mois maximum, à température ambiante (jusqu’à 30°C). Noter sur l’emballage la date à laquelle le médicament est sorti du réfrigérateur. Après la conservation du médicament à température ambiante, ne pas le replacer au réfrigérateur.
Après la reconstitution
La stabilité chimique et physique a été montrée pour 6 heures à température ambiante (jusqu’à 30°C). Si le médicament n’est pas utilisé dans les 6 heures, l’éliminer. Pour des raisons microbiologiques, le médicament doit être utilisé immédiatement après sa reconstitution. Si cela s’avère impossible, les délais d’utilisation et les conditions de conservation relèvent de la responsabilité de l’utilisateur. Protéger le médicament des rayons directs du soleil.
Remarques particulières concernant le stockage
Conserver hors de portée des enfants.
Conserver le récipient dans son carton pour le protéger de la lumière. Conserver au réfrigérateur (2-8°C). Ne pas congeler. Ce médicament est destiné à une utilisation unique. Les restes de solution doivent être éliminés correctement.
Conditions de conservation après reconstitution du médicament: voir «Stabilité».
Remarques concernant la manipulation
Le contenu du flacon contenant la poudre lyophilisée pour solution injectable doit être reconstituée à l’aide du solvant fourni (solution de chlorure de sodium) dans la seringue préremplie, en utilisant l’adaptateur stérile pour flacons. Incliner légèrement le flacon dans un sens et dans l’autre jusqu’à ce que la solution soit entièrement dissoute.
La solution reconstituée doit être claire à légèrement irisée et incolore. Le médicament reconstitué doit être inspecté visuellement avant l'administration pour vérifier l'absence de particules et de décoloration. La solution ne doit pas être utilisée si elle est trouble ou présente des dépôts.
Ce produit est à usage unique. ALPROLIX ne doit pas être mélangé avec d'autres solutions injectables ou pour perfusion.
Le médicament non utilisé ou les déchets doivent être éliminés de manière appropriée.
Un emballage d’ALPROLIX contient:
|
|
A) 1 flacon de poudre
B) 5 ml de solvant, dans une seringue pré-remplie
C) 1 tige de piston
D) 1 adaptateur pour flacons
E) 1 kit de perfusion
F) 2 tampons d'alcool
G) 2 pansements
H) 1 compresse de gaze
|
Préparation:
Avant l’ouverture du flacon, se laver les mains
|
1. Vérifiez le nom et le dosage indiqués sur l'emballage afin de vous assurer qu'il contient le bon produit. Vérifiez la date de péremption sur le carton extérieur d'ALPROLIX. Ne pas utiliser si la date de péremption du médicament est dépassée.
| |
2. Si ALPROLIX a été conservé dans un réfrigérateur, attendez que le flacon d'ALPROLIX (A) et la seringue contenant le solvant (B) soient à température ambiante avant de les utiliser. N'utilisez pas de source de chaleur externe.
| |
3. Placez le flacon sur une surface propre et plane. Retirez le bouchon en plastique du flacon..
|
| |
4. Nettoyez le haut du flacon à l'aide d'un des tampons d'alcool (F) fournis dans l'emballage et laissez-le sécher à l'air. Après l'avoir essuyé, évitez tout contact avec la partie supérieure du flacon ou tout autre objet.
|
| |
5. Retirez le papier de protection de l'adaptateur en plastique transparent (D). Ne retirez pas l'adaptateur de son capuchon protecteur. Évitez de toucher l'intérieur de l'emballage de l'adaptateur de flacon.
| |
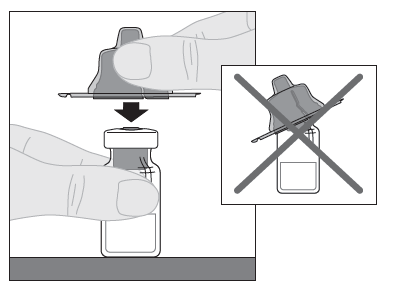
6.Placez le flacon sur une surface plane. Tenez l'adaptateur du flacon par son capuchon protecteur et placez-le tout droit sur le haut du flacon. Poussez fermement l'adaptateur vers le bas jusqu'à ce qu'il s'enclenche en haut du flacon et que le mandrin de l'adaptateur traverse le bouchon du flacon.
|
|
| |
7. Raccordez la tige du piston (C) à la seringue de solvant en insérant l'extrémité de la tige du piston dans l'ouverture du piston de la seringue. Tournez vigoureusement la tige de piston dans le sens des aiguilles d'une montre jusqu'à ce qu'elle soit bien fixée dans le piston de la seringue.
|
| |
8. Cassez le capuchon en plastique inviolable blanc de la seringue de solvant en le pliant vers le bas au niveau de la perforation jusqu'à ce qu'il se brise. Posez le capuchon sur une surface plane, face vers le bas. Ne touchez pas l'intérieur du capuchon ou l'embout de la seringue.
|
| |
9. Retirez le capuchon de protection de l'adaptateur et jetez-le.
|
| |
10. Connectez la seringue de solvant à l'adaptateur de flacon en insérant l'extrémité de la seringue dans l'ouverture de l'adaptateur. Appuyez et tournez fermement la seringue dans le sens des aiguilles d'une montre jusqu'à ce qu'elle soit bien fixée.
|
| |
11. Poussez lentement la tige du piston vers le bas pour injecter la totalité du solvant dans le flacon d'ALPROLIX.
|
| |
12. Laisser la seringue sur l'adaptateur et la tige du piston abaissée et agiter doucement le flacon jusqu'à ce que la poudre soit dissoute.
Ne pas agiter.
|
| |
13. La solution finale doit être contrôlée visuellement avant l'administration. La solution doit être claire à légèrement irisée et incolore. Elle ne doit pas être utilisée si elle est trouble ou si elle contient des particules visibles.
| |
14. Veillez à ce que la tige du piston soit toujours complètement enfoncée dans la seringue, puis retournez le flacon. Retirez lentement la tige du piston pour aspirer toute la solution dans la seringue à travers l'adaptateur du flacon.
Remarque : si vous utilisez plus d'un flacon d'ALPROLIX par injection, préparez chaque flacon séparément en suivant les instructions ci-dessus (étapes 1 à 13). Retirez la seringue de solvant et laissez l'adaptateur de flacon connecté. Une seule grande seringue Luer Lock peut être utilisée pour aspirer les solutions préparées de chacun des flacons individuels.
|
| |
15. Retirez la seringue de l'adaptateur de flacon en tirant doucement sur le flacon et en le tournant dans le sens inverse des aiguilles d'une montre.
|
| |
16. Jetez le flacon et l'adaptateur.
Remarque : si vous n'utilisez pas la solution immédiatement, le capuchon de la seringue doit être replacé avec précaution sur l'embout de la seringue. Ne touchez pas l'embout de la seringue ou l'intérieur du capuchon.
Une fois préparé, ALPROLIX peut être conservé à température ambiante pendant 6 heures au maximum avant d'être administré. Après cette période, ALPROLIX préparé doit être éliminé. Protéger de la lumière directe du soleil.
|
Administration:
|
1.Ouvrez l'emballage contenant le kit de perfusion et retirez le capuchon à l'extrémité de la tubulure. Raccordez la seringue contenant la solution ALPROLIX préparée à l'extrémité de la tubulure de perfusion en la tournant dans le sens des aiguilles d'une montre.
|
| |
2.Si nécessaire, utilisez un garrot et préparez le site d'injection en essuyant soigneusement la peau avec le deuxième tampon d'alcool de l'emballage.
| |
3. Retirez tout l'air de la tubulure de perfusion en appuyant lentement sur la tige du piston jusqu'à ce que le liquide atteigne l'aiguille du dispositif de perfusion. Ne faites pas passer la solution à travers l'aiguille. Retirez la gaine de protection en plastique transparent de l'aiguille.
| |
4. Insérez l'aiguille du dispositif de perfusion dans une veine, comme indiqué par votre médecin ou votre professionnel de santé, et retirez le garrot. Si vous le souhaitez, vous pouvez utiliser l'un des pansements (G) de l'emballage pour fixer les ailettes en plastique de l'aiguille au site d'injection. Le médicament préparé doit être injecté par voie intraveineuse pendant plusieurs minutes. Il est possible que votre médecin modifie la vitesse d'injection recommandée pour vous afin de vous rendre la tâche plus confortable.
| |
5. Une fois l'injection terminée et l'aiguille retirée, rabattez le protège-aiguille sur l'aiguille et laissez-le s'enclencher.
|
| |
6.Jeter l'aiguille usagée, la solution non utilisée, la seringue et le flacon vide de manière sûre dans un conteneur approprié pour les déchets médicaux, car ces matériaux peuvent blesser d'autres personnes s'ils ne sont pas éliminés de manière appropriée. Le matériel ne doit pas être réutilisé.
|
Numéro d’autorisation66039 (Swissmedic)
Présentation1 emballage contient (B):
·1 flacon de poudre de 250 U.I., 500 U.I., 1000 U.I., 2000 U.I. ou 3000 U.I.
·5 ml de solvant dans une seringue préremplie
·1 tige de piston, 1 adaptateur stérile pour flacons pour la reconstitution, 1 kit de perfusion’ stérile, 2 tampons d’alcool, 2 pansements, 1 compresse de gaze.
Titulaire de l’autorisationSwedish Orphan Biovitrum AG, Basel
Mise à jour de l’informationdécembre 2021
|

