CompositionPrincipes actifs
Baricitinib.
Excipients
Cellulose microcristalline, croscarmellose sodique (correspond à 0.8 mg de sodium), stéarate de magnésium, mannitol, oxyde de fer (E172), lécithine (E322), macrogol, alcool polyvinylique, talc, dioxyde de titane (E171).
Indications/Possibilités d’emploiPolyarthrite rhumatoïde
Olumiant est indiqué en association avec des antirhumatismaux modificateurs de la maladie (DMARDs, disease-modifying anti-rheumatic drugs) conventionnels y compris le méthotrexate (MTX) chez des patients adultes atteints de polyarthrite rhumatoïde (PR) active modérée à sévère, n'ayant pas suffisamment répondu à un traitement par un ou plusieurs DMARDs ou ne l'ayant pas toléré.
En cas d'intolérance au MTX ou lorsque le traitement avec MTX est inapproprié, Olumiant peut être utilisé en monothérapie.
Chez des patients atteints de PR modérée à sévère préalablement non traités, l'efficacité d'Olumiant en monothérapie ou en association avec le MTX a été démontrée (voir «Propriétés/Effets»).
Olumiant associé au méthotrexate a montré une réduction du taux de progression des destructions articulaires mesurées par radiographies et une amélioration des fonctions physiques.
Dermatite atopique
Olumiant est indiqué dans le traitement de la dermatite atopique (DA) modérée à sévère chez des patients adultes, lorsqu'une thérapie avec des médicaments topiques ne permet pas un contrôle adéquat de la maladie ou n'est pas recommandée.
Pelade (Alopecia areata)
Olumiant est indiqué pour le traitement de la pelade sévère (≥50 % du cuir chevelu affecté) chez les patients adultes jusqu'à 60 ans au maximum dont la maladie ne peut pas être suffisamment contrôlée avec des traitements topiques (voir «Propriétés/Effets, Efficacité clinique»). Olumiant ne devrait pas être utilisé en combinaison avec d'autres traitements systémiques pour la pelade.
COVID-19
Olumiant est indiqué, en association avec le remdésivir, pour le traitement de la maladie du coronavirus 2019 (COVID-19) confirmée par la mise en évidence directe du virus chez des patients adultes hospitalisés qui nécessitent une oxygénation et qui requièrent une supplémentation d'oxygène à bas débit, une oxygénothérapie à haut débit ou une ventilation non invasive (voir «Propriétés / Effets»).
Posologie/Mode d’emploiLe traitement doit être initié par un médecin expérimenté dans le diagnostic et le traitement des maladies pour lesquelles Olumiant est indiqué.
Posologie usuelle
Polyarthrite rhumatoïde
La dose recommandée d'Olumiant est de 4 mg une fois par jour. Chez les patients âgés de 75 ans et plus et chez les patients présentant une infection chronique ou récurrente, une dose initiale de 2 mg peut éventuellement être appropriée. Chez les patients qui ont atteint un contrôle durable de l'activité de la maladie avec 4 mg une fois par jour, une dose d'entretien de 2 mg peut être suffisante (voir «Propriétés/Effets, Efficacité clinique, Olumiant 4 mg vs 2 mg»).
L'association avec des DMARDs biologiques ou avec d'autres inhibiteurs des Janus kinases (JAK) n'a pas été étudiée et n'est pas recommandée.
Dermatite atopique
La dose initiale recommandée d'Olumiant est de 4 mg une fois par jour. Pour les patients atteints d'infections chroniques ou récurrentes la dose initiale est de 2 mg une fois par jour. Le traitement doit être arrêté après 8 semaines en l'absence d'amélioration. La dose doit être réduite à 2 mg une fois par jour chez les patients dont l'activité de la maladie est contrôlée durablement avec 4 mg une fois par jour (voir «Propriétés/effets, efficacité clinique, réduction de la dose»).
Olumiant peut être utilisé avec ou sans corticostéroïde topique.
L'association avec des immunomodulateurs biologiques, d'autres inhibiteurs des JAK, la ciclosporine ou d'autres immunosuppresseurs puissants n'a pas été étudiée et n'est pas recommandée.
Pelade (Alopecia areata)
Le traitement doit être instauré et surveillé par des dermatologues expérimentés dans le diagnostic et le traitement de la pelade, après évaluation individuelle du rapport bénéfice-risque (voir «Mises en garde et précautions»).
La dose recommandée d'Olumiant est de 4 mg une fois par jour. Il n'y a pas de données disponibles pour les patients atteints d'infections chroniques et/ou récurrentes (voir «Efficacité clinique»).
Dès que les patients atteignent une réponse durable (repousse satisfaisante des cheveux qui reste stable sur plusieurs mois) au traitement avec 4 mg, la dose doit être réduite à 2 mg une fois par jour (voir «Propriétés/Effets, Efficacité clinique, Réduction de la dose»). La dose efficace la plus faible doit être utilisée.
Le rapport bénéfice/risque du traitement doit être réévalué à intervalles réguliers sur une base individuelle.
Le traitement doit être arrêté chez les patients qui ne présentent pas de réponse clinique (amélioration de 25% au minimum du score SALT) après 36 semaines de traitement.
Il n'y a pas de données significatives d'efficacité et de sécurité au-delà d'un an de traitement. Par conséquent, le traitement doit être interrompu après un maximum de 1 an à moins que le bénéfice ne l'emporte clairement sur le risque potentiel.
L'association avec des immunomodulateurs biologiques, d'autres inhibiteurs des JAK, la ciclosporine ou d'autres immunosuppresseurs puissants n'a pas été étudiée et n'est pas recommandée.
COVID-19
La dose recommandée d'Olumiant est de 4 mg une fois par jour pendant 14 jours ou jusqu'à la sortie de l'hôpital, selon ce qui se produit en premier.
Dans l'étude ACTT-2, la dose recommandée de remdésivir en association avec Olumiant (baricitinib) était d'une dose initiale de 200 mg sous forme de perfusion IV le jour 1, suivie de doses d'entretien de 100 mg une fois par jour du jour 2 au jour 10 au maximum ou jusqu'à la sortie d'hôpital, selon ce qui se produit en premier. Les doses de remdésivir déjà administrées avant l'hospitalisation ont été prises en compte, de manière à ne pas dépasser un maximum de 10 perfusions de remdésivir.
Le traitement avec le baricitinib et le remdésivir doit être poursuivi même si le patient est devenu négatif dans des tests directs du SARS-CoV-2.
Instauration du traitement
Polyarthrite rhumatoïde, dermatite atopique et pelade
Le traitement ne doit pas être instauré ou doit être temporairement interrompu chez des patients ayant un nombre absolu de lymphocytes inférieur à 0.5 x 109 cellules/l, un nombre absolu de neutrophiles inférieur à 1 x 109 cellules/l, ou un taux d'hémoglobine inférieur à 8 g/dl. Le traitement peut être instauré ou rétabli une fois ces valeurs améliorées au-delà de ces limites (voir «Mises en garde et précautions»).
Ajustement de la posologie du fait d'effets indésirables/d'interactions
Co-administration avec des inhibiteurs de l'OAT3
La dose recommandée est de 2 mg une fois par jour chez les patients traités par l'inhibiteur du transporteur d'anions organiques de type 3 (OAT3) probénécide (voir «Interactions»).
Instructions posologiques particulières
Patients présentant des troubles de la fonction hépatique
Polyarthrite rhumatoïde, dermatite atopique et pelade
Aucun ajustement de dose n'est nécessaire chez les patients ayant une insuffisance hépatique légère à modérée. L'administration d'Olumiant n'est pas recommandée chez les patients présentant une insuffisance hépatique sévère (voir «Pharmacocinétique»).
COVID-19
Olumiant n'a pas été étudié chez des patients ayant une insuffisance hépatique sévère.
Patients présentant des troubles de la fonction rénale
Polyarthrite rhumatoïde, dermatite atopique et pelade
La dose recommandée est de 2 mg une fois par jour chez les patients ayant un taux de filtration glomérulaire estimé entre 30 et 60 ml/min/1.73 m2. L'administration d'Olumiant n'est pas recommandée chez les patients ayant un taux de filtration glomérulaire estimé inférieur à 30 ml/min/1.73 m2 (voir «Pharmacocinétique»).
COVID-19
La dose recommandée chez les patients présentant un taux de filtration glomérulaire estimé entre 30 et 60 ml/min/1.73 m2 est de 2 mg une fois par jour. L'utilisation d'Olumiant n'est pas recommandée chez des patients dont le taux de filtration glomérulaire estimé est < 30 ml/min/1.73 m2 (voir aussi «Mises en garde et précautions, COVID-19» et «Effets indésirables, Liste des effets indésirables», Note d»).
Patients âgés
Polyarthrite rhumatoïde et dermatite atopique
L'expérience clinique chez les patients âgés de 75 ans et plus est très limitée, et chez ces patients, une dose initiale de 2 mg peut éventuellement être appropriée.
Pelade
L'expérience clinique chez les patients âgés de 60 ans et plus est très limitée, ces patients ne devraient donc pas être traités avec le baricitinib.
COVID-19
Aucune adaptation de la dose n'est nécessaire chez les patients âgés de ≥75 ans.
Enfants et adolescents
La sécurité et l'efficacité d'Olumiant chez les enfants et les adolescents en-dessous de 18 ans n'ont pas été étudiées.
Mode d'administration
Olumiant doit être pris par voie orale, une fois par jour pendant ou en dehors d'un repas, et peut être pris à tout moment de la journée.
Administration alternative en cas de COVID-19
Chez les patients qui ne sont pas en état d'avaler un comprimé entier, des modes d'administration alternatifs peuvent être envisagés:
·dispersion orale
·sonde de gastrostomie (sonde G)
·sonde nasogastrique (sonde NG) ou sonde orogastrique (sonde OG)
Voir «Remarques particulières/Instructions pour la manipulation»
Contre-indicationsHypersensibilité au principe actif ou à l'un des excipients.
COVID-19
Chez les patients atteints de COVID-19, une contre-indication à une prophylaxie contre les thromboembolies veineuses (TEV) représente également une contre-indication au traitement avec le baricitinib (voir aussi «Mises en garde et précautions» et «Effets indésirables»).
Mises en garde et précautionsUtilisation chez les patients de plus de 65 ans
Compte tenu du risque accru d'infections graves, d'infarctus du myocarde et de tumeurs malignes associés aux inhibiteurs des JAK chez les patients de plus de 65 ans, Olumiant ne doit être utilisé chez ces patients que si aucune alternative thérapeutique appropriée n'est disponible (voir plus de détails dans «Mises en garde et précautions»).
Infections
Olumiant est associé à une augmentation du taux d'infections, telles qu'infections des voies respiratoires supérieures, par rapport au placebo (voir «Effets indésirables»). Olumiant ne doit pas être administré à des patients présentant une infection systémique active (excepté infection à SARS-CoV-2 (COVID-19), lorsque Olumiant est adminstré dans cette indication). Des infections graves et parfois mortelles causées par des bactéries, des mycobactéries, des champignons invasifs, des virus ou d'autres agents pathogènes opportunistes sont survenues chez des patients atteints de polyarthrite rhumatoïde traités par Olumiant. Dans les groupes de patients suivants, les risques et bénéfices du traitement doivent être soupesés avant de commencer l'administration d'Olumiant: patients présentant des infections chroniques ou récidivantes, ou ayant des antécédents d'infection grave ou opportuniste.
Dans la polyarthrite rhumatoïde, la dermatite atopique et la pelade, en cas de survenue d'une infection, le patient doit faire l'objet d'une surveillance étroite et le traitement par Olumiant doit être temporairement interrompu si le patient ne répond pas à un traitement standard. Le traitement ne doit être réinstauré qu'une fois l'infection résolue.
Anomalies hématologiques
Dans la polyarthrite rhumatoïde, la dermatite atopique et la pelade, un nombre absolu de neutrophiles inférieur à 1 x 109 cellules/l, un nombre absolu de lymphocytes inférieur à 0.5 x 109 cellules/l et un taux d'hémoglobine inférieur à 8 g/dl ont été rapportés chez moins de 1 % des patients dans les études cliniques. Le traitement ne doit pas être instauré ou doit être temporairement interrompu chez des patients ayant un nombre absolu de lymphocytes inférieur à 0.5 x 109 cellules/l, un nombre absolu de neutrophiles inférieur à 1 x 109 cellules/l, ou un taux d'hémoglobine inférieur à 8 g/dl (voir «Posologie/Mode d'emploi»).
Réactivation virale
Des réactivations virales, dont des cas de réactivation de virus herpétiques (p.ex. herpès zoster, herpès simplex), ont été rapportés dans les études cliniques (voir «Effets indésirables»). Si un patient développe un herpès zoster, le traitement par Olumiant doit être temporairement interrompu jusqu'à la résolution de l'épisode.
Un dépistage des hépatites virales doit être effectué avant de débuter un traitement par Olumiant, conformément aux recommandations cliniques. Les patients présentant des signes d'hépatite B ou C active ont été exclus des études cliniques. Les patients testés positifs pour les anticorps du virus de l'hépatite C mais pas pour l'ARN de ce virus ont été autorisés à participer. Les patients ayant des anticorps dirigés contre les antigènes de surface et contre la nucléocapside du virus de l'hépatite B, sans présence d'antigène de surface du virus de l'hépatite B, ont également été autorisés à participer; une surveillance étroite par mesure de l'expression de l'ADN du virus de l'hépatite B (VHB) doit être mise en place chez ces patients. En cas de détection de l'ADN du VHB, un hépatologue doit être consulté.
Tuberculose
Les patients présentant une tuberculose active ont été exclus des études cliniques. Des cas de tuberculose, réactivation ou nouvelles apparition ont été décrits chez des patients traités par Olumiant Avant d'instaurer un traitement par Olumiant, il convient de rechercher chez tous les patients la présence éventuelle d'une tuberculose active ou inactive (latente). Il est recommandé d'inclure à cette recherche une anamnèse médicale précise permettant de détecter tout contact antérieur éventuel des personnes avec une tuberculose active ainsi que tout traitement immunosuppresseur antérieur ou en cours. La réalisation de tests de dépistage adaptés (p.ex. radiographie du thorax et test à la tuberculine) conformes aux recommandations locales est recommandée. Le traitement de la tuberculose active doit être instauré avant le début du traitement par Olumiant. Lorsqu'un test tuberculinique cutané est réalisé pour une tuberculose latente, une induration de 5 mm ou plus doit être considérée comme positive, même lorsqu'une vaccination par le bacille de Calmette et Guérin (BCG) a été antérieurement pratiquée.
Une attention particulière doit être portée sur la possibilité d'une tuberculose non détectée chez les patients provenant de pays où la prévalence de la tuberculose est élevée ou ayant voyagé dans ces pays, de même que chez les patients en contact étroit avec des personnes atteintes de tuberculose active.
En cas de diagnostic d'une tuberculose latente, un traitement antituberculeux prophylactique doit être instauré conformément aux recommandations locales avant de commencer un traitement par Olumiant.
L'instauration d'une prophylaxie de tuberculose avant un traitement par Olumiant doit également être envisagée pour les patients présentant plusieurs facteurs significatifs de risque de tuberculose malgré un test de tuberculose négatif, et chez les patients atteints de tuberculose latente ou active dans l'anamnèse médicale, chez qui la mise en place d'un traitement adéquat ne peut pas être confirmée. La décision d'instaurer un traitement antituberculeux chez ces patients devra dépendre autant du risque de tuberculose latente que du risque lié au traitement antituberculeux. Si nécessaire, il conviendra de consulter un médecin expérimenté en matière de traitement de la tuberculose.
Vaccination
On ne dispose d'aucune donnée concernant la réponse après vaccination par des vaccins vivants chez les patients traités par Olumiant. L'utilisation de vaccins vivants n'est pas recommandée immédiatement avant ou pendant le traitement avec Olumiant. L'intervalle de temps entre un vaccin vivant et le traitement avec le baricitinib doit être conforme aux recommandations vaccinales actuelles pour les agents immunomodulateurs.
L'influence du baricitinib sur la réponse humorale après administration de vaccins inactivés a été évaluée chez 106 patients atteints de polyarthrite rhumatoïde sous traitement stable par baricitinib 2 ou 4 mg, recevant des vaccins inactivés contre le pneumocoque ou contre le tétanos. La majorité de ces patients (n = 94) recevait du méthotrexate en co-médication. Pour la population totale, la vaccination contre le pneumocoque a entraîné une réponse humorale de type IgG positive chez 68.0 % (IC: 95 %: 58.4 %, 76.2 %) des patients. Une réponse humorale de type IgG positive au vaccin contre le tétanos a été atteinte chez 43.1 % (IC 95 %: 34.0 %, 52.8 %) des patients. Ces données ne permettent pas d'exclure une diminution significative de la réponse vaccinale en cas de traitement concomitant par Olumiant, en particulier la réponse vaccinale aux toxines tétaniques.
Le statut vaccinal de tous les patients, y compris la vaccination varicelle/herpès zoster, doit être mis à jour conformément aux recommandations vaccinales actuellement en vigueur avant l'instauration du traitement par Olumiant. Conformément à ces recommandations, le vaccin vivant contre l'herpès zoster ne doit être administré qu'aux patients ayant des antécédents connus de varicelle ou qui sont positifs pour varicelle-zona. Le vaccin doit être administré au moins 2 semaines, mais de préférence 4 semaines, avant le traitement avec un agent immunomodulateur actif tel que le baricitinib.
Mortalité toutes causes confondues
Dans une vaste étude se sécurité randomisée post-commercialisation d'un autre inhibiteur des JAK chez des patients atteints de PR âgés de 50 ans et plus présentant au moins un facteur de risque cardiovasculaire, un taux plus élevé de mortalité toutes causes confondues, y compris la mort subite d'origine cardiovasculaire, a été observé chez les patients traités avec l'inhibiteur des JAK comparé aux patients traités par inhibiteurs du TNF. Avant de commencer ou de poursuivre le traitement par Olumiant, pesez les bénéfices et les risques pour chaque patient.
Tumeurs malignes
Le risque de tumeurs malignes est accru chez les patients atteints de polyarthrite rhumatoïde (PR). Dans une vaste étude randomisée, contrôlée contre comparateur actif, avec un autre inhibiteur des JAK chez des patients atteints de PR âgés de 50 ans et plus présentant au moins un facteur de risque cardiovasculaire additionnel, une incidence accrue de tumeurs malignes, en particulier carcinome pulmonaire et lymphome, a été observée par rapport aux patients traités avec des inhibiteurs du TNF. Cette étude a montré un risque accru supplémentaire de tumeurs malignes chez les patients de plus de 65 ans et chez les patients qui fument actuellement ou qui ont fumé dans le passé. Des lymphomes et d'autres tumeurs malignes ont aussi été rapportés chez des patients recevant du baricitinib.
Le baricitinib ne doit être utilisé chez les patients suivants que si aucune alternative thérapeutique appropriée n'est disponible:
·patients de plus de 65 ans,
·patients qui fument actuellement ou qui ont fumé dans le passé,
·patients présentant d'autres facteurs de risque de malignité (par exemple, tumeur maligne actuelle ou antécédent de malignité autre qu'un cancer de la peau non mélanocytaire traité avec succès).
Cancer de la peau non mélanocytaire (NMSC)
Des NMSC ont été rapportés chez des patients traités par Olumiant. Le taux d'incidence était de 0.3 pour 100 patients-années dans la polyarthrite rhumatoïde, de 0.2 dans la dermatite atopique et de 0.1 dans la pelade.
Dans une vaste étude de sécurité randomisée post-commercialisation avec un autre inhibiteur des JAK chez des patients atteints de PR âgés de 50 ans et plus présentant au moins un facteur de risque cardiovasculaire, une augmentation globale des cas de NMSC, y compris de carcinome épidermoïde de la peau, a été observée chez les patients traités par l'inhibiteur de JAK par rapport aux inhibiteurs du TNF. Étant donné que l'incidence des NMSC est plus élevée chez les patients âgés et chez les patients ayant des antécédents de NMSC, ces patients doivent être traités avec prudence. Des examens cutanés réguliers sont recommandés pour les patients présentant un risque accru de cancer de la peau.
Thromboembolies veineuses (TEV)
Des thromboses veineuses profondes (TVP) et des embolies pulmonaires (EP) ont été rapportées chez des patients recevant du baricitinib. Dans une vaste étude randomisée, contrôlée contre comparateur actif, avec un autre inhibiteur des JAK chez des patients atteints de PR âgés de 50 ans et plus présentant au moins un facteur de risque cardiovasculaire, une incidence accrue et dose-dépendante de TEV, y compris embolies pulmonaires, a été observée chez les patients traités par l'inhibiteur des JAK comparé à ceux qui ont reçu des inhibiteurs du TNF. La majorité de ces événements étaient graves et certains ont entraîné la mort. Dans une étude observationnelle retrospective, un taux plus élevé d'événements thromboemboliques veineux a également été observé chez les patients atteints de PR traités par le baricitinib par rapport aux patients traités par les inhibiteurs du TNF.
Les prescripteurs doivent évaluer les patients pour les facteurs de risque de TVP/EP avant le début du traitement et régulièrement pendant le traitement. Évaluez rapidement les patients présentant des signes et symptômes d'un événement de TVP/EP et arrêtez le traitement par Olumiant chez les patients suspectés d'avoir un événement de TVP/EP, quelle que soit la dose ou l'indication.
Evénements cardiovasculaires indésirables graves (major adverse cardiovascular events, MACE)
Comparé aux inhibiteurs du TNF, dans une vaste étude randomisée, contrôlée contre comparateur actif, avec un autre inhibiteur des JAK chez des patients atteints de PR âgés de 50 ans et plus présentant au moins un facteur de risque cardiovacsulaire, une incidence accrue de MACE, y compris infarctus du myocarde (IM), accident vasculaire cérébral (AVC) et décès cardiovasculaire a été observée. Cette étude a montré un risque accru supplémentaire de MACE chez les patients de plus de 65 ans, les patients qui fument actuellement ou ont fumé dans le passé et les patients présentant des facteurs de risque cardiovasculaire.
Dans une étude observationnelle rétrospective du baricitinib chez des patients atteints de PR, un taux plus élevé de MACE a été observé par rapport aux patients traités par des inhibiteurs du TNF.
Le baricitinib ne doit être utilisé chez les patients suivants que si aucune alternative thérapeutique appropriée n'est disponible:
·patients de plus de 65 ans,
·patients qui fument actuellement ou qui ont fumé dans le passé,
·patients présentant d'autres facteurs de risque cardiovasculaire.
Lipides
Une augmentation des paramètres lipidiques a été rapportée chez des patients traités par Olumiant, par rapport au placebo (voir «Effets indésirables»). Sous traitement par une statine, les taux élevés de LDL-cholestérol ont baissé pour atteindre les valeurs mesurées avant le début du traitement par Olumiant. L'effet de ces élévations des paramètres lipidiques sur la morbidité et la mortalité cardiovasculaire n'a pas été déterminé. Les paramètres lipidiques doivent être évalués environ 12 semaines après le début du traitement par Olumiant. Les patients doivent être pris en charge conformément aux recommandations cliniques locales relatives à la gestion de l'hyperlipidémie.
Élévations des transaminases hépatiques
Des augmentations de l'alanine aminotransférase (ALAT) et de l'aspartate aminotransférase (ASAT) à un niveau supérieur ou égal à 5 et 10 fois la limite supérieure de la norme ont été rapportées chez moins de 1 % des patients au cours des études cliniques. Si des augmentations de l'ALAT ou de l'ASAT sont observées et qu'une lésion hépatique d'origine médicamenteuse est suspectée, le traitement par Olumiant doit être temporairement interrompu jusqu'à ce que ce diagnostic soit exclu.
Hypersensibilité
Depuis la commercialisation, des cas d'hypersensibilité médicamenteuse associés à l'administration de baricitinib ont été rapportés. En cas de réaction allergique grave ou anaphylactique, le traitement par baricitinib doit être immédiatement interrompu.
Diverticulite
Des cas de diverticulite et de perforation gastro-intestinale ont été rapportés dans les essais cliniques et après la mise sur le marché. Le baricitinib doit être utilisé avec prudence chez les patients atteints d'une maladie diverticulaire, et en particulier chez les patients traités de manière chronique avec des médicaments concomitants associés à un risque accru de diverticulite, comme les anti-inflammatoires non stéroïdiens, corticostéroïdes et opioïdes. Les patients présentant une nouvelle apparition de signes et symptômes abdominaux doivent être évalués rapidement pour une détection précoce de diverticulite ou de perforation gastro-intestinale.
COVID-19
Chez les patients qui recevaient du baricitinib, des cas de thromboembolies veineuses (TEV) ont été rapportés. Une infection à la COVID-19 augmente le risque de TEV. L'incidence des TEV dans l'étude pivot de phase 3 ACTT-2 (voir la description de l'étude au chapitre «Efficacité clinique») était de 3.2% et 0.7% chez les patients qui avaient un score ordinal de 5 et de 4.9% et 6.3% chez les patients qui avaient un score ordinal de 6 traités respectivement avec baricitinib + remdésivir ou remdésivir seul. Les patients COVID-19 qui doivent être traités par baricitininb doivent recevoir une prophylaxie contre les TEV (voir «Contre-indications» et «Effets indésirables»).
L'association avec des DMARDs biologiques ou avec d'autres inhibiteurs de Janus kinases (JAK) n'a pas été étudiée et n'est pas recommandée.
La fonction rénale doit être surveillée. Chez les patients COVID-19 traités avec baricitinib + remdésivir, une augmentation de la réduction du taux de filtration glomérulaire a été observée avec l'augmentation du score ordinal. L'incidence d'une baisse du taux de filtration glomérulaire dans l'étude ACTT-2 a été de 8.5% et 8.4% chez les patients qui avaient un score ordinal de 5, de 11.7% et 9.0% chez les patients qui avaient un score ordinal de 6 et de 19.2% et 10.9% chez les patients qui avaient un score ordinal de 7 traités respectivement avec baricitinib + remdésivir ou avec remdésivir seul (voir aussi «Posologie/Mode d'emploi, Patients présentant des troubles de la fonction rénale» et «Effets indésirables» .
Il n'y a que des données très limitées sur l'utilisation d'Olumiant chez des patients présentant des anomalies hématologiques: un nombre absolu de lymphocytes (ALC) < 0.2 x 109 cellules/l, un nombre absolu de neutrophiles (ANC) < 1 x 109 cellules/l ou un taux d'hémoglobine < 8 g/dl ont été observés respectivement chez 1.6%, 3.6% et 7.5% des patients COVID-19 traités avec Olumiant dans l'étude pivot ACTT-2. Les risques et bénéfices d'un traitement avec Olumiant doivent être soigneusement pesés avant le début du traitement chez ces patients.
Excipients
Ce médicament contient moins de 1 mmol (23 mg) de sodium par comprimé, c'est-à-dire qu'il est essentiellement «sans sodium».
InteractionsEffet du baricitinib sur d'autres médicaments
Enzymes du cytochrome P450
In vitro le baricitinib n'a montré aucune inhibition significative de l'activité des enzymes CYP 3A, 1A2, 2B6, 2C8, 2C9, 2C19 et 2D6. In vitro, la baricitinib a induit les CYP1A2, 2B6, 2C8, 2D6, 3A4 et 3A5. Les CYP2C9, 2C19 et la glycoprotéine-P (Pgp) n'ont pas été induits. La pertinence clinique de ces résultats n'est pas connue. Dans les études de pharmacologie clinique, la co-administration de baricitinib avec le substrat du CYP3A simvastatine n'a donné lieu à aucun changement cliniquement significatif sur l'exposition à ce médicament.
Transporteurs
In vitro, ni les transporteurs Pgp, ni les polypeptides transporteurs d'anions organiques (OATP) 1B1 n'ont été inhibés par le baricitnib. In vitro, le baricitinib a inhibé l'OAT1, l'OAT2, l'OAT3, les transporteurs de cations organiques (OCT)1, OCT2, OATP1B3, les protéines BCRP, MATE1 et MATE2-K. Des changements cliniquement significatifs de la pharmacocinétique des médicaments qui sont substrats de ces transporteurs sont cependant improbables. Dans les études de pharmacologie clinique, aucun effet cliniquement significatif n'a été observé lorsque le baricitinib a été co-administré avec de la digoxine (substrat de la Pgp) ou du méthotrexate (substrat de plusieurs transporteurs, voir ci-dessus).
Effet d'autres médicaments sur le baricitinib
Enzymes du cytochrome P450
In vitro, le baricitinib est un substrat de l'enzyme du cytochrome P450 (CYP) 3A4. Dans les études de pharmacologie clinique, la coadministration de baricitinib et de kétoconazole (inhibiteur du CYP3A) n'a donné lieu à aucun effet cliniquement significatif. La co-administration de baricitinib et de fluconazole (inhibiteur des CYP3A/CYP2C19/CYP2C9) ou de rifampicine (inducteur du CYP3A) n'a donné lieu à aucun changement cliniquement significatif de l'exposition au baricitinib.
Transporteurs
In vitro, le baricitinib est un substrat pour le transporteur d'OAT3, la Pgp, la protéine de résistance du cancer du sein (BCRP) et la protéine MATE 2-K (Multidrug and toxic extrusion protein). Dans une étude de pharmacologie clinique, l'administration de probénécide (un inhibiteur de l'OAT3) a donné lieu à une augmentation d'environ 2 fois de l'AUC(0-∞), sans influence sur le Cmax ou le Tmax du baricitinib. Par conséquent, chez les patients prenant l'inhibiteur de l'OAT3 probénécide, la dose de 2 mg une fois par jour est recommandée (voir «Posologie/Mode d'emploi»). Le diclofénac et l'ibuprofène, également des inhibiteurs de l'OAT3, ont eu une influence minimale sur l'exposition au baricitinib dans une analyse pharmacocinétique de population. La co-administration de baricitinib et de ciclosporine (inhibiteur de Pgp/BCRP) ou de méthotrexate (substrat de plusieurs transporteurs, incluant OATP1B1, OAT1, OAT3, BCRP, MRP2, MRP3 et MRP4) n'a donné lieu à aucun effet cliniquement significatif sur l'exposition au baricitinib.
Grossesse, allaitementFemmes en âge de procréer
Les femmes en âge de procréer doivent être informées d'éviter une grossesse pendant le traitement avec Olumiant et ce jusqu'à au-moins une semaine après la fin du traitement.
Grossesse
Il a été démontré que la transduction de signal médiée par les JAK/STAT est impliquée dans l'adhésion et la polarité cellulaires qui peuvent affecter le développement embryonnaire précoce. Les données d'utilisation d'Olumiant pendant la grossesse sont limitées. Les études chez l'animal ont montré une toxicité sur la reproduction. Le baricitinib s'est avéré être tératogène chez les rats et les lapins (voir «Données précliniques»).
Olumiant ne doit pas être utilisé pendant la grossesse, à moins que cela soit clairement nécessaire. Si une patiente tombe enceinte pendant le traitement par Olumiant, elle doit être informée des risques potentiels pour le foetus.
Allaitement
On ignore si le baricitinib ou ses métabolites sont excrétés dans le lait maternel. Les données chez les rates allaitantes ont montré une excrétion du baricitinib dans le lait (voir «Données précliniques»).
Un risque pour le nouveau-né ou l'enfant ne peut pas être exclu. Les femmes ne doivent donc pas allaiter pendant le traitement avec Olumiant.
Effet sur l’aptitude à la conduite et l’utilisation de machinesL'influence d'Olumiant sur l'aptitude à la conduite ou à l'utilisation de machines n'a pas fait l'objet d'études spécifiques.
Effets indésirablesDans les études cliniques sur la polyarthrite rhumatoïde, les effets indésirables les plus fréquemment rapportés qui sont survenus chez au moins 2 % des patients traités par Olumiant en monothérapie ou en association avec des DMARDs conventionnels synthétiques, ont été l'augmentation du LDL-cholestérol, les infections des voies respiratoires supérieures et les nausées. La plupart des effets indésirables étaient d'intensité légère à modérée.
Dans les études cliniques sur la dermatite atopique, les effets indésirables les plus fréquemment rapportés qui sont survenus chez au moins 2 % des patients traités par Olumiant en monothérapie ou en association avec des corticostéroïdes topiques, ont été les infections des voies respiratoires supérieures (17.5 %), l'augmentation du LDL-cholestérol (13.2 %) et les céphalées (6.3 %). Les infections rapportées avec le traitement par Olumiant incluaient l'herpès simplex (6.1 %).
Dans des études cliniques sur la pelade, les effets indésirables les plus fréquemment rapportés qui sont survenus chez au moins 2% des patients traités par Olumiant ont été LDL-cholestérol élevé, infections des voies respiratoires supérieures, céphalées, acné, CPK élevée à plus de 5 fois la limite supérieure de la norme (LSN), infections urinaires et nausée.
Dans une étude sur la COVID-19, les effets indésirables le plus fréquemment rapportés survenus chez au-moins 2 % des patients sous Olumiant ont été une thrombocytose, une ASAT ≥3 x LSN, une ALAT ≥3 x LSN, une neutropénie et une thrombose veineuse profonde.
Polyarthrite rhumatoïde
Au total, 3770 patients ont été traités par Olumiant au cours des études cliniques dans la polyarthrite rhumatoïde, ce qui représente 14744 patients-années d'exposition. Parmi ces patients, 79% ont été exposés à Olumiant pendant au moins un an et l'exposition médiane a été de 4.6 ans.
Sept études contrôlées contre placebo ont été intégrées (1142 patients traités par 4 mg une fois par jour et 1215 patients sous placebo) pour évaluer le profil d'effets secondaires d'Olumiant en comparaison au placebo jusqu'à 16 semaines de traitement.
Dermatite atopique
Au total, 2636 patients ont été traités par Olumiant au cours des études cliniques dans la dermatite atopique, ce qui représente une exposition de 4628 patients-années. Parmi ces patients, 63% ont été exposés à Olumiant pendant au moins un an et l'exposition médiane a été de 1.6 an.
Cinq études contrôlées contre placebo ont été intégrés (489 patients traités par 4 mg une fois par jour et 743 patients sous placebo) pour évaluer la sécurité d'Olumiant en comparaison au placebo pendant une période allant jusqu'à 16 semaines après le début du traitement.
Pelade
Au total, 1303 patients ont été traités par Olumiant dans des études cliniques sur la pelade, ce qui correspond à une exposition totale de 1868.3 patients-années. Parmi ces patients, 80% ont étéexposés à Olumiant pendant au moins un an et l'exposition médiane a été de 1.5 an.
Deux études contrôlées contre placebo ont été intégrées (540 patients traités par 4 mg une fois par jour et 371 patients sous placebo) afin d'évaluer la sécurité d'emploi d'Olumiant en comparaison au placebo, sur une période allant jusqu'à 36 semaines après le début du traitement.
COVID-19
Au total, 507 patients ont été traités avec Olumiant associé au remdésivir sur une période allant jusqu'à 14 jours dans une étude contrôlée avec placebo.
Liste des effets indésirables (données des essais cliniques et de post- commercialisation)
La fréquence des effets indésirables est indiquée comme suit: «très fréquents» (≥1/10), «fréquents» (<1/10, ≥1/100), «occasionnels» (<1/100, ≥1/1000), «rares» (<1/1000, ≥1/10'000), «très rares» (<1/10'000).
En l'absence d'autres indications, les fréquences se basent sur des données intégrées pour les indications polyarthrite rhumatoïde (PR), dermatite atopique (DA) et pelade.
Infections et infestations
Très fréquent: Infections des voies respiratoires supérieures (16.9%)
Fréquent: herpès zostera,f, herpès simplex, infections urinaires, pneumonie i
Affections hématologiques et du système lymphatique
Fréquent: thrombocytose >600 x 109 cellules/l*, b, d, f
Occasionnel: neutropénie <1 x 109 cellules/l* d
Affections cardiaques
Occasionnel: événements cardiovasculaires indésirables graves (MACE) (y compris infarctus du myocarde, accident vasculaire cérébral et mort cardiovasculaire)**
Troubles du métabolisme et de la nutrition
Très fréquent: élévation du LDL-cholestérol ≥3.36 mmol/l* (26.0 %)
Occasionnel: élévation des triglycérides ≥5.65 mmol/l*
Tumeurs bénignes, malignes et non précisées (y compris kystes et polypes)
Occasionnel: tumeurs malignes (y compris lymphomes)**, cancer de la peau à l'exception des mélanomes**
Affections du système nerveux
Fréquent: céphalées.
Affections gastro-intestinales
Fréquent: nauséesb, douleurs abdominalesf
Occasionnel: diverticulite.
Affections hépatobiliaires
Fréquent: élévation des ALAT ≥3 x LSN *, b
Occasionnel: élévation des ASAT ≥3 x LSN* d, g
Affections de la peau et du tissu sous-cutané
Fréquent: éruption cutanée, acnéc.
Occasionnel: gonflement du visage, urticaire.
Affections vasculaires
Occasionnel: thrombose veineuse profonde d.
Affections du rein et des voies urinaires
Très fréquent: diminution du taux de filtration glomérulaire (GFR)d, e
Affections respiratoires, thoraciques et médiastinales
Occasionnel: embolie pulmonaired, h
Investigations
Fréquent: élévation de la créatine phosphokinase >5 x LSN*, c
Occasionnel: prise de poids.
a très rare dans les essais cliniques sur la dermatite atopique
b occasionnel dans les essais cliniques sur la dermatite atopique
c occasionnel dans les essais cliniques sur la polyarthrite rhumatoïde
d chez les patients qui ont été traités avec le baricitinib dans l'étude clinique sur la COVID-19, il y a eu très fréquemment une thrombocytose (13.2%), une AST ≥3 x LSN (10.5%) et une diminution du GFR (OS 5: 8.5%; OS 6: 11.7%, OS 7: 19.2%) ainsi que, fréquemment, une embolie pulmonaire, une thrombose veineuse profonde et une neutropénie (voir aussi «Contre-indications» et«Mises en garde et précautions»).
e spécifique aux patients COVID-19
f occasionnel dans les études cliniques sur la pelade.
g fréquent dans les études cliniques sur la pelade.
h fréquence basée sur des études cliniques sur la polyarthrite rhumatoïde et la dermatite atopique.
i occasionnel dans la dermatite atopique et la pelade.
* Sur la base des résultats de laboratoire de routine. LSN = limite supérieure de la norme.
** voir «Description d'effets secondaires sélectionnés»
Description d'effets secondaires sélectionnés
Infections
Dans les études contrôlées sur la polyarthrite rhumatoïde jusqu'à 16 semaines, le taux d'incidence de toutes les infections (taux de patients ayant au moins 1 événement pour 100 patients-années d'exposition) a été de 101 avec Olumiant, contre 83 avec le placebo. La plupart des infections étaient d'intensité légère à modérée. Les taux de déclaration d'effets secondaires liés à une infection pour Olumiant par rapport au placebo ont été: infections des voies respiratoires supérieures (14.7 % vs 11.7 %), herpes simplex (1.8 % vs 0.7 %) et zona (herpès zoster) (1.4 % vs 0.4 %). Le taux d'infections graves avec Olumiant (1.1 %) a été similaire à celui observé avec le placebo (1.2 %). Les infections graves les plus fréquentes sous Olumiant ont été le zona (herpès zoster) et la cellulite. Le taux d'infections graves est resté stable au cours de l'exposition à long terme. Le taux d'incidence global des infections graves dans le programme d'études cliniques dans la PR a été de 3.2 pour 100 patients-années.
Dans les études contrôlées sur la dermatite atopique jusqu'à 16 semaines, le taux d'incidence de toutes les infections, sur la base du taux de patients ayant au moins 1 événement pour 100 patients-années d'exposition, a été de 155 avec Olumiant 4 mg, contre 118 avec le placebo. La plupart des infections étaient d'intensité légère à modérée. Des infections ont été rapportées chez 31.5 %, 29.8 % et 24.2 % des patients jusqu'à 16 semaines dans les groupes 4 mg, 2 mg et placebo respectivement. Les pourcentages de patients ayant rapporté des effets indésirables liés à une infection avec Olumiant 4 mg en comparaison au placebo ont été: infections des voies respiratoires supérieures (17.5 % vs 14.1 %), infections urinaires (2.0 % vs 0.8 %), herpès simplex (6.1 % vs 2.7 %), herpès zoster (0 % vs 0.3 %). Dans les études cliniques sur la dermatite atopique, la fréquence des infections a généralement été similaire à celle observée chez les patients atteints de polyarthrite rhumatoïde, à l'exception de l'herpès zoster qui a été très rare. Il y a eu moins d'infections cutanées nécessitant un traitement antibiotique avec Olumiant 4 mg (3.4 %) qu'avec placebo (4.4 %). Le même pourcentage de patients atteints d'infections graves a été observé avec Olumiant 4 mg et placebo (0.6 %). Le taux d'incidence global d'infections graves dans le programme d'études cliniques sur la DA a été de 2.1 pour 100 patients-années.
Dans des études contrôlées sur la pelade portant sur une durée allant jusqu'à 36 semaines, le taux d'incidence de toutes les infections sous Olumiant 4 mg, calculé sur la base des patients présentant au moins 1 événement sur 100 patients-années d'exposition, a été de 57 versus 56 sous placebo. La plupart des infections étaient de gravité légère à modérée. Des infections ont été signalées chez 30.6 %, 32.3 % et 29.1 % des patients jusqu'à 36 semaines dans les groupes recevant respectivement 4 mg, 2 mg et le placebo. Le pourcentage des patients qui ont signalé des effets indésirables relatifs à des infections pour Olumiant 4 mg comparé au placebo a été le suivant: infections de voies respiratoires supérieures (17.8 % vs. 16.2 %), infections urinaires (3.3 % vs. 1.6 %), herpes simplex (1.3 % vs. 3.2 %), herpes zoster (0.9 % vs. 0.5 %). Des infections graves ont été rapportées chez 0.2 % des patients traités par Olumiant 4 mg, versus 0 % des patients traités avec le placebo. Globalement, le taux d'incidence des infections graves dans le programme d'études cliniques sur la pelade a été de 0.8 sur 100 patients-années.
Élévations des transaminases hépatiques
Dans les études contrôlées sur la polyarthrite rhumatoïde, jusqu'à 16 semaines, des élévations de l'alanine aminotransférase (ALAT) et de l'aspartate aminotransférase (ASAT) supérieures ou égales à 3 fois la limite supérieure de la norme (LSN) ont été observées chez 1.4 % et 0.8 % des patients traités par Olumiant, contre 1.0 % et 0.8 % des patients traités par placebo respectivement. La plupart des cas d'élévations des transaminases hépatiques étaient asymptomatiques et transitoires.
L'association d'Olumiant avec des médicaments potentiellement hépatotoxiques, comme le méthotrexate, a entraîné une fréquence accrue de ces élévations.
Le schéma et l'incidence de l'élévation d'ALAT/ASAT sont restés stables dans le temps, y compris dans l'étude d'extension à long terme.
Dans les études contrôlées sur la dermatite atopique jusqu'à 16 semaines, des élévations de l'ALAT et de l'ASAT ≥3 x LSN ont été observées occasionnellement chez 0.2 % et 0.5 % des patients traités par Olumiant 4 mg, contre 0.8 % et 0.8 % des patients sous placebo respectivement. La plupart des cas d'élévation des transaminases hépatiques étaient asymptomatiques et transitoires. Le schéma et la fréquence des augmentations d'ALAT/ASAT sont restés stables dans le temps, y compris dans l'étude d'extension à long terme.
Dans les études contrôlées sur la pelade jusqu'à 36 semaines, les élévations d'ALAT et d'ASAT ≥3 x LSN ont été observées chez 1.3 % et 1.1 % des patients traités par Olumiant 4 mg, contre 2.7 % et 2.2 % des patients sous placebo respectivement. La plupart des cas d'élévations des transaminases hépatiques ≥3 x LSN ont été asymptomatiques et transitoires.
Élévations des lipides
Dans les données intégrées des études cliniques portant sur la PR, la DA et la pelade, le traitement par baricitinib a été associé à une élévation des triglycérides et à des élévations dose-dépendantes du cholestérol total, du LDL-cholestérol et du HDL-cholestérol.
Chez les patients avec PR, les élévations ont été observées à 12 semaines et sont restées stables par la suite y compris pendant l'étude d'extension à long terme. Dans les études contrôlées jusqu'à 16 semaines, une élévation du LDL-cholestérol ≥3.36 mmol/l a été observée chez 33.6 % des patients sous Olumiant contre 10.3 % des patients sous placebo. Une élévation des triglycérides ≥5.65 mmol/l a été observées chez 0.4 % des patients sous Olumiant contre 0.5 % des patients sous placebo. Aucun changement du rapport LDL/HDL n'a été observé.
Sous traitement par statine, les taux élevés de LDL-cholestérol ont baissé pour atteindre les valeurs mesurées avant le début du traitement par Olumiant.
Chez les patients avec DA, des augmentations ont été observées à 12 semaines et les taux moyens de cholestérol total et de LDL-cholestérol ont augmenté jusqu'à la semaine 52. Dans les études contrôlées jusqu'à 16 semaines, une élévation du LDL-cholestérol ≥3.36 mmol/l a été observée chez 13.2% des patients sous Olumiant contre 6.3% sous placebo. Une augmentation des triglycérides ≥5.65 mmol/l a été observée chez 0.7% des patients sous Olumiant contre 0.8% des patients sous placebo. Il n'y a pas eu d'augmentation du rapport LDL/HDL. Aucune relation dose-effet n'a été observée dans les études contrôlées jusqu'à 16 semaines pour le cholestérol total, le LDL-cholestérol ou le HDL-cholestérol. Il n'y a pas eu d'augmentation des taux de triglycérides.
Chez les patients atteints de pelade, des élévations ont été observées à 12 semaines et les taux moyens de cholestérol total et de LDL-cholestérol ont augmenté jusqu'à la semaine 52. Dans les études contrôlées jusqu'à 36 semaines, une élévation du LDL-cholestérol ≥3.36 mmol/l a été observée chez 28.1 % des patients sous Olumiant contre 17.7 % sous placebo, et le taux d'incidence global avec le baricitinib dans le programme d'études cliniques sur la pelade a été de 17.2 pour 100 patients-années. Une élévation des triglycérides ≥5.65 mmol/l a été observée chez 0.8 % des patients sous Olumiant 4 mg, contre 0.9 % des patients sous placebo.
Créatine phosphokinase (CPK)
Dans les études contrôlées sur la polyarthrite rhumatoïde jusqu'à 16 semaines, des augmentations des valeurs de la CPK (> 5 x LSN) ont été observées chez 0.8 % des patients traités par Olumiant et 0.3 % des patients ayant reçu le placebo. La plupart des cas ont été transitoires et n'ont pas nécessité l'arrêt du traitement.
Dans des études contrôlées sur la DA jusqu'à 16 semaines, des augmentations des valeurs de la CPK ont été fréquentes et ont été observées chez 3.3 %, 2.5 %, et 1.9 % des patients traités respectivement par Olumiant 4 mg, 2 mg et placebo. La plupart des cas ont été transitoires et n'ont pas nécessité l'arrêt du traitement.
Dans les études cliniques sur la PR et la DA, il n'y a eu aucun cas de rhabdomyolyse confirmé. Le schéma et l'incidence de l'élévation de la CPK sont restés stables dans le temps, y compris dans l'étude d'extension à long terme.
Dans des études contrôlées sur la pelade, des élévations des valeurs de CPK ont été fréquentes jusqu'à 36 semaines et elles sont survenues respectivement chez 5.1 %, 2.2 %, et 3.6 % des patients traités avec Olumiant 4 mg, 2 mg ou placebo. Le taux d'incidence global des élévations de CPK sous baricitinib dans le programme d'études cliniques sur la pelade a été de 4.1 pour 100 patients-années. La plupart des cas ont été transitoires et n'ont pas nécessité l'arrêt du traitement. Il n'y a eu aucun cas de rhabdomyolyse confirmé. La CPK moyenne était élevée à la semaine 4 et elle s'est maintenue par la suite à une valeur supérieure à la valeur initiale.
Neutropénie
Dans les études contrôlées sur la PR et la DA jusqu'à 16 semaines, des diminutions du nombre de neutrophiles en-dessous de 1 x 109 cellules/l ont été observées chez 0.2 % des patients traités par Olumiant contre 0 % des patients sous placebo. Aucune corrélation claire n'a été établie entre les baisses du nombre de neutrophiles et la survenue d'infections graves. En revanche, dans les études cliniques, le traitement a été interrompu en cas de découverte d'un nombre absolu de neutrophiles < 1 x 109 cellules/l. Le schéma et l'incidence des diminutions du nombre de neutrophiles sont restés stables dans le temps, y compris pendant l'étude d'extension à long terme.
Dans des études contrôlées sur la pelade jusqu'à 36 semaines, des diminutions du nombre de neutrophiles en-dessous de 1 x 109 cellules/l ont été observées chez 0.9 % des patients traités par Olumiant 4 mg et chez 0 % des patients sous placebo. Une diminution du nombre moyen de neutrophiles a été observée à la semaine 4, le nombre de neutrophiles est revenu à la valeur initiale à la semaine 16 et est resté stable par la suite au niveau de la valeur initiale.
Thrombocytose
Dans les études contrôlées sur la polyarthrite rhumatoïde, jusqu'à 16 semaines, des augmentations du nombre de plaquettes au-dessus de 600 x 109 cellules/l ont été observées chez 2.0 % des patients traités par Olumiant 4 mg et 1.1 % des patients ayant reçu le placebo.
Dans les études contrôlées sur la dermatite atopique jusqu'à 16 semaines, des augmentations du nombre de plaquettes au-dessus de 600 x 109 cellules/l ont été observées chez 0.6 % des patients traités par Olumiant 4 mg et 0 % des patients sous placebo. L'incidence de la thrombocytose dans les études sur la dermatite atopique était occasionnelle et moins fréquente que chez les patients atteints de polyarthrite rhumatoïde.
Aucun lien n'a été établi entre l'augmentation du nombre de plaquettes et les effets indésirables de nature thrombotique. Le schéma et l'incidence des augmentations du nombre de plaquettes sont restés stables dans le temps à une valeur plus élevée que celle observée à l'inclusion, y compris pendant l'étude d'extension à long terme.
Dans des études contrôlées sur la pelade jusqu'à 36 semaines, des augmentations du nombre de plaquettes au-dessus de 600 x 109 cellules/l ont été observées chez 0.4 % des patients sous Olumiant 4 mg et chez 0 % des patients sous placebo. Des augmentations du nombre moyen de plaquettes ont été observées et sont restées stables au fil du temps à une valeur supérieure à la valeur initiale.
Maladies tumorales malignes
Les données cliniques ne sont pas suffisantes pour déterminer l'incidence possible d'affections malignes après exposition au baricitinib. Dans des études à long terme, le taux d'incidence de maladies tumorales malignes à l'exception du cancer de la peau non-mélanocytaire était de 0.9 pour 100 patients-années dans la polyarthrite rhumatoïde et de 0.3 pour 100 patients-années dans la dermatite atopique. Des études de sécurité à long terme sont en cours.
Dans le programme clinique de la pelade, le taux d'incidence global des tumeurs malignes autres que le cancer de la peau non-mélanocytaire était de 0.2 pour 100 patients-années et le taux d'incidence global des cancers de la peau autres que le mélanome était de 0.1 pour 100 patients-années.
Événements cardiovasculaires indésirables graves (MACE)
Dans des études à long terme, le taux d'incidence des MACE, y compris infarctus du myocarde, accident vasculaire cérébral et décès d'origine cardiovasculaire, a été de 0.5 pour 100 patients-années dans la polyarthrite rhumatoïde et de 0.1 pour 100 patients-années dans la dermatite atopique.
Dans le programme clinique de la pelade, le taux d'incidence global des MACE, y compris infarctus du myocarde, accidents vasculaires cérébraux et décès d'origine cardiovasculaire, était de 0.1 pour 100 patients-années.
Thromboembolies veineuses (TEV)
Dans des études à long terme, le taux d'incidence de TEV, y compris thromboses veineuses profondes et embolies pulmonaires, a été de 0.5 pour 100 patients-années dans la polyarthrite rhumatoïde et de 0.1 pour 100 patients-années dans la dermatite atopique.
Dans le programme clinique de la pelade, le taux d'incidence global de TEV, y compris thromboses veineuses profondes et embolies pulmonaires, était de 0.1 pour 100 patients-années.
COVID-19
Dans l'étude ACTT-2 contrôlée contre placebo, la proportion de nouvelles ou graves infections était plus basse chez les patients sous baricitinib + remdésivir (respectivement 6 % et 2.4 %) que chez les patients sous remdésivir + placebo (respectivement 11 % et 3.9 %).
Une proportion plus élevée de TEV dues au traitement ont été diagnostiquées dans le bras de l'étude recevant le baricitinib + remdésivir (4.1 %) comparé au bras recevant le placebo (3.1 %). Une embolie pulmonaire et une thrombose veineuse profonde ont été rapportées respectivement chez 1 % et 2.4 % des patients du groupe baricitinib + remdésivir. Des nombres bas de neutrophiles et des nombres élevés de thrombocytes ont été observés plus fréquemment dans le bras du traitement avec le baricitinib (respectivement 11.1 % vs. 5.6 % et 50.5 % vs. 42.2 %).
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageDes doses uniques jusqu'à 40 mg et des doses multiples jusqu'à 20 mg par jour pendant 10 jours ont été administrées dans le cadre des études cliniques, sans toxicité limitant la dose. Les données pharmacocinétiques d'une dose unique de 40 mg, administrée à des volontaires sains, indiquent que plus de 90 % de la dose administrée devrait être éliminée dans les 24 heures. En cas de surdosage, il est recommandé de surveiller le patient pour détecter l'apparition de signes et de symptômes d'effets indésirables. Les patients développant des effets indésirables doivent recevoir un traitement approprié.
Propriétés/EffetsCode ATC
L04AA37
Mécanisme d'action
Le baricitinib est un inhibiteur sélectif et réversible des Janus kinases (JAK), avec une plus forte sélectivité pour JAK 1 et JAK 2. Dans des tests d'activité d'enzymes isolées, le baricitinib a inhibé l'activité de JAK1, JAK2, de la tyrosine kinase 2 et de JAK3 avec des valeurs de CI50 de 5.9, 5.7, 53 et > 400 nM respectivement.
Les Janus kinases sont des enzymes qui sont impliquées dans la transduction des signaux intracellulaires provenant de récepteurs membranaires pour divers cytokines et facteurs de croissance impliqués dans l'hématopoïèse, l'inflammation et la fonction immunitaire. Dans la voie de signalisation intracellulaire, les JAK phosphorylent et activent des transducteurs de signaux et activateurs de transcription ((signal transducers and activators of transcription, STATs), qui activent l'expression des gènes dans la cellule. Le baricitinib module ces voies de signalisation par inhibition de l'activité enzymatique de JAK1 et de JAK2, réduisant ainsi la phosphorylation et l'activation des STATs.
Le baricitinib a été identifié comme un inhibiteur de NAK (numb-associated kinase), avec une affinité élevée pour la protéine kinase 1 associée à AP2 (AAK1) - 8.2 nM, pour BIKE - 20 nM et pour GAK - 120 nM. Les deux NAK, AAK1 et GAK, sont tout particulièrement associées à la pénétration du SARS-CoV-2 (COVID-19) dans les cellules humaines.
Pharmacodynamique
Inhibition de la phosphorylation de STAT3 induite par l'IL-6
L'administration du baricitinib a entraîné une inhibition dose-dépendante de la phosphorylation de STAT3 induite par l'IL-6 dans le sang total de sujets sains, avec une inhibition maximale qui a été observée 2 heures après l'administration de la dose et est revenue à une valeur proche de celle observée à l'inclusion dans les 24 heures. Des niveaux similaires d'inhibition ont été observés en utilisant l'IL-6 ou la thrombopoïétine (TPO) comme stimulus.
Immunoglobulines
Les valeurs moyennes d'IgG, d'IgM et d'IgA sériques ont diminué dans les 12 semaines suivant le début du traitement par Olumiant et sont restées stables pendant au moins 104 semaines. Chez la plupart des patients, les modifications des immunoglobulines sont restées dans l'intervalle normal de référence.
Des élévations des anticorps IgG dirigés contre les antigènes S1/S2 du SARS-CoV-2 ont été observées dans un échantillon limité de patients COVID-19 modérément à sévèrement atteints, hospitalisés et traités avec le baricitinib.
Lymphocytes
Le nombre absolu moyen de lymphocytes a augmenté dans la semaine suivant l'instauration du traitement par Olumiant, est revenu au même niveau qu'à l'inclusion à la semaine 24, puis est resté stable pendant au moins 104 semaines. Pour la plupart des patients, les modifications du nombre de lymphocytes sont restées dans l'intervalle normal de référence.
Thrombocytes
Sur le plan clinique, les thrombocytoses ont été plus fréquemment observées sous baricitinib que sous placebo (voir «Effets indésirables, Description d'effets indésirables sélectionnés, Thrombocytose»).
Protéine C-réactive
Chez les patients atteints de polyarthrite rhumatoïde, des diminutions de la protéine Créactive (CRP) sérique ont été observées dès la première semaine de traitement par Olumiant et se sont maintenues pendant toute la durée du traitement.
Peau
Dans un modèle de peau humaine traitée avec des cytokines pro-inflammatoires (c'est-à-dire IL-4, IL-13, IL-31), le baricitinib a réduit l'expression de pSTAT3 dans les kératinocytes épidermiques, et a augmenté l'expression de la filaggrine.
Biomarqueur pour la COVID-19
Le baricitinib abaisse les valeurs de cytokines et de biomarqueurs en rapport avec la COVID-19, notamment IL-6, IFN-γ, MCP-3, CXCL10, IL-10, MCP-2, CCL19, PTX3 et IL-27. En outre, les valeurs de marqueurs qui sont réduites chez des patients COVID-19 modérément à sévèrement atteints ont augmenté avec l'administration de baricitinib; ceci concerne CCL17, GDF2 et SCF.
Efficacité clinique
Polyarthrite rhumatoïde
L'efficacité et la sécurité d'Olumiant administré une fois par jour ont été évaluées dans 4 études de phase III multicentriques, randomisées, en doubleaveugle chez des patients ayant une polyarthrite rhumatoïde active, modérée à sévère, diagnostiquée conformément aux critères ACR/EULAR 2010 (voir Tableau 1). Les patients de plus de 18 ans pouvaient participer à ces études. La présence d'au moins 6 articulations douloureuses et 6 articulations gonflées était requise à l'inclusion. Tous les patients arrivés au terme de ces études étaient éligibles pour participer à une étude d'extension à long terme et recevoir jusqu'à 4 ans de traitement.
Tableau 1. Synthèse des études cliniques
|
Nom de l'étude (Durée)
|
Population
(Nombre total)
|
Bras de traitement
|
Synthèse des objectifs principaux des études
| |
RA-BEGIN
(52 semaines)
|
Naïfs de MTX1
(584)
|
Olumiant 4 mg 1x/j
Olumiant 4 mg 1x/j + MTX
MTX
|
Critère principal: ACR20 à la semaine 24
Capacité fonctionnelle (HAQ-DI)
Progression radiographique (mTSS)
Faible activité de la maladie et rémission (SDAI)
| |
RA-BEAM
(52 semaines)
|
MTX-RI2
(1305)
|
Olumiant 4 mg 1x/j
Adalimumab 40 mg SC 1x/2sem
Placebo
Tous les patients étaient sous MTX en traitement de fond
|
Critère principal: ACR20 à la semaine 12
Capacité fonctionnelle (HAQ-DI)
Progression radiographique (mTSS)
Faible activité de la maladie et rémission (SDAI)
Raideur articulaire matinale
| |
RA-BUILD
(24 semaines)
|
cDMARD-RI3
(684)
|
Olumiant 4 mg 1x/j
Olumiant 2 mg 1x/j
Placebo
Sous DMARDs conventionnels (cDMARDs) en traitement de fond5, si l'administration du cDMARD était stable à l'entrée dans l'étude.
|
Critère principal: ACR20 à la semaine 12
Capacité fonctionnelle (HAQ-DI)
Faible activité de la maladie et rémission (SDAI)
Progression radiographique (mTSS)
Raideur articulaire matinale
| |
RA-BEACON
(24 semaines)
|
TNF-RI4
(527)
|
Olumiant 4 mg 1x/j
Olumiant 2 mg 1x/j
Placebo
Sous cDMARDs en traitement de fond5
|
Critère principal: ACR20 à la semaine 12
Capacité fonctionnelle (HAQ-DI)
Faible activité de la maladie et rémission (SDAI)
|
1x/j = une fois par jour; 1x/2sem = toutes les 2 semaines; SC = sous-cutané
1 Patients ayant reçu moins de 3 administrations de méthotrexate (MTX); naïfs de traitement par d'autres antirhumatismaux modificateurs de la maladie conventionnels (cDMARDs) ou biologiques (bDMARDs).
2 Patients ayant eu une réponse inadéquate au MTX (+/- d'autres cDMARDs); naïfs de traitement biologique.
3 Patients ayant eu une réponse inadéquate ou étant intolérant à au moins 1 cDMARD; naïfs de traitement biologique.
4 Patients ayant eu une réponse inadéquate ou étant intolérant à au moins 1 bDMARD; incluant au moins un inhibiteur du TNF.
Réponse clinique
Dans les 3 études contrôlées contre placebo, une proportion statistiquement significativement plus élevée de patients traités par Olumiant 4 mg une fois par jour a montré une réponse ACR20, ACR50 et ACR70 à 12 et 24 semaines comparé au placebo (tableau 2). Le délai d'apparition de l'efficacité a été court pour toutes les mesures, avec des réponses significativement plus élevées dès la semaine 1. Des taux de réponse persistants et durables ont été observés, avec des réponses ACR20/50/70 qui se sont maintenus pendant au moins 2 ans, y compris pendant l'étude d'extension à long terme.
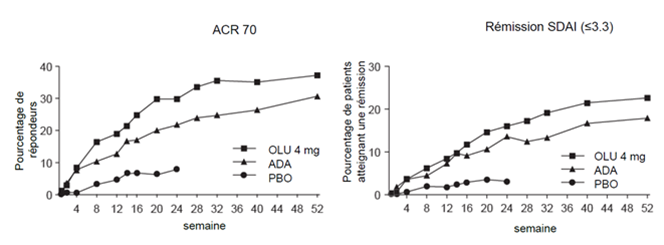
Dans l'étude avec contrôle actif RA-BEAM, une proportion statistiquement significativement plus élevée de patients traités avec Olumiant a obtenu une réponse ACR20/50/70 après 12 semaines par rapport à adalimumab et les différences ont été maintenues pendant plus de 52 semaines (Figure 1). Radiographiquement, aussi bien Olumiant qu'adalimumab ont montré des effets statistiquement significatifs sur l'inhibition des lésions structurales articulaires par rapport au placebo. Adalimumab a été numériquement un peu meilleur que Olumiant (voir ci-dessous «Réponse radiographique»).
Le traitement par Olumiant 4 mg, seul ou en association avec des cDMARDs, a entraîné une amélioration significative de toutes les composantes individuelles de la réponse ACR, incluant le nombre d'articulations douloureuses et gonflées, les évaluations globales du patient et du médecin, l'indice HAQ-DI (Health Assessment Questionnaire-Disability Index), l'évaluation de la douleur et la CRP, par rapport au placebo ou au MTX en monothérapie. Dans l'étude RA-BEAM, le traitement par Olumiant a entraîné une amélioration significative des évaluations globales du patient et du médecin, de l'indice HAQ-DI, de l'évaluation de la douleur et de la CRP aux semaines 12, 24 et 52 par rapport à l'adalimumab.
Rémission et faible niveau d'activité de la maladie
La proportion de patients atteignant la rémission, définie par un SDAI ≤3.3 et un CDAI ≤2.8, aux semaines 12 et 24, était statistiquement significativement plus élevée dans le groupe Olumiant 4 mg que dans le groupe placebo ou MTX (tableau 2). Dans l'étude RA-BEAM, Olumiant et adalimumab étaient tous deux supérieurs comparés au placebo, mesuré par un SDAI ≤3.3 à la semaine 12 et les différences ont été maintenues jusqu'à la semaine 52 (Figure 1).
Dans les 4 études, la proportion de patients atteignant un faible niveau d'activité de la maladie ou la rémission (DAS-28 lié à la vitesse de sédimentation DAS28-VS ou DAS-28 lié au dosage à ultrasensible de la CRP DAS28-CRPus ≤3.2 et DAS28-VS ou DAS28-CRPus < 2.6) aux semaines 12 et 24 était significativement plus élevée dans le groupe Olumiant 4 mg que dans le groupe placebo ou MTX.
En tenant compte de l'étude d'extension à long terme, les taux de rémission et de faible niveau d'activité de la maladie se sont maintenus pendant au moins 2 ans.
Tableau 2. Réponse, rémission et capacité fonctionnelle
|
Étude
|
RA-BEGIN
Patients naïfs de MTX
|
RA-BEAM
Patients MTX-RI
|
RA-BUILD
Patients cDMARD-RI
|
RA-BEACON
Patients TNF-RI
| |
Groupe de traitement
|
MTX
|
OLU
4 mg
|
OLU
4 mg
+ MTX
|
PBO
|
OLU
4 mg
|
ADA
40 mg 1x/2 sem.
|
PBO
|
OLU
2 mg
|
OLU 4 mg
|
PBO
|
OLU 2 mg
|
OLU
4 mg
| |
N
|
210
|
159
|
215
|
488
|
487
|
330
|
228
|
229
|
227
|
176
|
174
|
177
| |
ACR20:
| |
Semaine 12
|
59 %
|
79 %***
|
77 %***
|
40 %
|
70 %***†
|
61 %***
|
39 %
|
66 %***
|
62 %***
|
27 %
|
49 %***
|
55 %***
| |
Semaine 24
|
62 %
|
77 %**
|
78 %***
|
37 %
|
74 %***†
|
66 %***
|
42 %
|
61 %***
|
65 %***
|
27 %
|
45 %***
|
46 %***
| |
Semaine 52
|
56 %
|
73 %***
|
73 %***
|
|
71 %††
|
62 %
|
|
|
|
|
|
| |
ACR50:
| |
Semaine 12
|
33 %
|
55 %***
|
60 %***
|
17 %
|
45 %***††
|
35 %***
|
13 %
|
33 %***
|
34 %***
|
8 %
|
20 %**
|
28 %***
| |
Semaine 24
|
43 %
|
60 %**
|
63 %***
|
19 %
|
51 %***
|
45 %***
|
21 %
|
41 %***
|
44 %***
|
13 %
|
23 %*
|
29 %***
| |
Semaine 52
|
38 %
|
57 %***
|
62 %***
|
|
56 %†
|
47 %
|
|
|
|
|
|
| |
ACR70:
| |
Semaine 12
|
16 %
|
31 %***
|
34 %***
|
5 %
|
19 %***†
|
13 %***
|
3 %
|
18 %***
|
18 %***
|
2 %
|
13 %***
|
11 %**
| |
Semaine 24
|
21 %
|
42 %***
|
40 %***
|
8 %
|
30 %***†
|
22 %***
|
8 %
|
25 %***
|
24 %***
|
3 %
|
13 %***
|
17 %***
| |
Semaine 52
|
25 %
|
42 %***
|
46 %***
|
|
37 %
|
31 %
|
|
|
|
|
|
| |
DAS28-hsCRP ≤3.2:
| |
Semaine 12
|
30 %
|
47 %***
|
56 %***
|
14 %
|
44 %***††
|
35 %***
|
17 %
|
36 %***
|
39 %***
|
9 %
|
24 %***
|
32 %***
| |
Semaine 24
|
38 %
|
57 %***
|
60 %***
|
19 %
|
52 %***
|
48 %***
|
24 %
|
46 %***
|
52 %***
|
11 %
|
20 %*
|
33 %***
| |
Semaine 52
|
38 %
|
57 %***
|
63 %***
|
|
56 %†
|
48 %
|
|
|
|
|
|
| |
DAS28-VS ≤3.2:
| |
Semaine 12
|
15 %
|
21 %
|
34 %***
|
7 %
|
24 %***
|
21 %***
|
7 %
|
21 %***
|
22 %***
|
4 %
|
13 %**
|
12 %**
| |
Semaine 24
|
23 %
|
36 %**
|
39 %***
|
10 %
|
32 %***
|
34 %***
|
10 %
|
29 %***
|
32 %***
|
7 %
|
11 %
|
17 %**
| |
Semaine 52
|
27 %
|
36 %
|
45 %***
|
|
39 %
|
36 %
|
|
|
|
|
|
| |
SDAI ≤3.3:
| |
Semaine 12
|
6 %
|
14 %*
|
20 %***
|
2 %
|
8 %***
|
7 %***
|
1 %
|
9 %***
|
9 %***
|
2 %
|
2 %
|
5 %
| |
Semaine 24
|
10 %
|
22 %**
|
23 %***
|
3 %
|
16 %***
|
14 %***
|
4 %
|
17 %***
|
15 %***
|
2 %
|
5 %
|
9 %**
| |
Semaine 52
|
13 %
|
25 %**
|
30 %***
|
|
23 %
|
18 %
|
|
|
|
|
|
| |
CDAI ≤2.8:
| |
Semaine 12
|
7 %
|
14 %*
|
19 %***
|
2 %
|
8 %***
|
7 %**
|
2 %
|
10 %***
|
9 %***
|
2 %
|
3 %
|
6 %
| |
Semaine 24
|
11 %
|
21 %**
|
22 %**
|
4 %
|
16 %***
|
12 %***
|
4 %
|
15 %***
|
15 %***
|
3 %
|
5 %
|
9 %*
| |
Semaine 52
|
16 %
|
25 %*
|
28 %**
|
|
22 %
|
18 %
|
|
|
|
|
|
| |
HAQ-DI (changement depuis l'inclusion):
| |
Semaine 12
|
-0.61
|
-0.92***
|
-0.98***
|
-0.34
|
-0.66***††
|
-0.56***
|
-0.36
|
-0.57***
|
-0.56***
|
-0.17
|
-0.37***
|
-0.41***
| |
Semaine 24
|
-0.74
|
-1.04***
|
-1.03***
|
-0.35
|
-0.75***††
|
-0.63***
|
-0.38
|
-0.62***
|
-0.62***
|
-0.15
|
-0.38***
|
-0.43***
| |
Semaine 52
|
-0.71
|
-0.99***
|
-1.06***
|
|
-0.77††
|
-0.66
|
|
|
|
|
|
|
ADA = adalimumab; MTX = méthotrexate; OLU = Olumiant; PBO = Placebo
* p ≤0.05; ** p ≤0.01; *** p ≤0.001 versus placebo (versus MTX pour l'étude RA-BEGIN)
† p ≤0.05; †† p ≤0.01; ††† p ≤0.001 versus adalimumab
Figure 1. ACR70 et rémission SDAI, étude RA-BEAM
Réponse radiographique
Les effets d'Olumiant sur la progression des lésions structurales articulaires a été évalué radiographiquement dans les études RA-BEGIN (objectif principal), RA-BEAM (objectif principal) et RA-BUILD (objectif exploratoire), au moyen du Score Total de Sharp modifié (mTSS) et de ses composantes, du score d'érosion et du score de rétrécissement de l'espace articulaire (Joint Space Narrowing Score).
Dans RA-BEAM, le traitement par Olumiant 4 mg ainsi que l'adalimumab ont montré une inhibition statistiquement significative de la progression des lésions structurales articulaires par rapport au placebo (tableau 3). Les analyses des scores d'érosions et du rétrécissement de l'espace articulaire étaient cohérentes avec les scores globaux. La proportion de patients sans progression radiographique (changement mTSS ≤0) a été significativement plus élevée dans le groupe Olumiant 4 mg que dans le groupe placebo aux semaines 24 et 52.
Tableau 3. Modifications radiographiques
|
Étude
|
RA-BEGIN
Patients naïfs de MTX
|
RA-BEAM
Patients sous MTX-RI
|
RA-BUILD°
Patients sous cDMARDs-RI
| |
Groupe de traitement
|
MTX
|
OLU 4 mg
|
OLU 4 mg
+ MTX
|
PBOa
|
OLU 4 mg
|
ADA 40 mg 1x/ 2sem.
|
PBO
|
OLU 2 mg
|
OLU 4 mg
| |
N
|
210
|
159
|
215
|
488
|
487
|
330
|
228
|
229
|
227
| |
Score Total de Sharp modifié, changement moyen depuis l'inclusion:
| |
Semaine 16
|
|
|
|
0.69
|
0.35***
|
0.28***
|
|
|
| |
Semaine 24
|
0.61
|
0.39
|
0.29*
|
0.90
|
0.41***
|
0.33***
|
0.70
|
0.33*
|
0.15**
| |
Semaine 52
|
1.02
|
0.80
|
0.40**
|
1.80
|
0.71***
|
0.60***
|
|
|
| |
Score d'érosion, changement moyen depuis l'inclusion:
| |
Semaine 16
|
|
|
|
0.50
|
0.25***
|
0.21***
|
|
|
| |
Semaine 24
|
0.47
|
0.33
|
0.26*
|
0.61
|
0.29***
|
0.24***
|
0.47
|
0.30
|
0.11**
| |
Semaine 52
|
0.81
|
0.55
|
0.34**
|
1.23
|
0.51***
|
0.42***
|
|
|
| |
Score de rétrécissement de l'espace articulaire, changement moyen depuis l'inclusion:
| |
Semaine 16
|
|
|
|
0.20
|
0.11
|
0.08*
|
|
|
| |
Semaine 24
|
0.14
|
0.06
|
0.03
|
0.29
|
0.12**
|
0.10**
|
0.23
|
0.03*
|
0.04*
| |
Semaine 52
|
0.21
|
0.25
|
0.06
|
0.58
|
0.21***
|
0.19**
|
|
|
| |
Proportion de patients sans progression radiographiqueb:
| |
Semaine 16
|
|
|
|
72 %
|
81 %**
|
82 %**
|
|
|
| |
Semaine 24
|
68 %
|
76 %
|
81 %**
|
70 %
|
81 %***
|
83 %***
|
74 %
|
72 %
|
80 %
| |
Semaine 52
|
66 %
|
69 %
|
80 %**
|
70 %
|
79 %**
|
81 %**
|
|
|
|
ADA = adalimumab; MTX = méthotrexate; OLU = Olumiant; PBO = Placebo
a Données avec le placebo à la semaine 52 issues d'une extrapolation linéaire
b Aucune progression = modification mTSS ≤0.
* p ≤0.05; ** p ≤0.01; *** p ≤0.001 versus placebo (versus MTX pour l'étude RA-BEGIN)
° objectif exploratoire dans RA-BUILD
Réponse fonctionnelle et résultats liés à l'état de santé
Le traitement par Olumiant 4 mg, seul ou en association avec des cDMARDs, a entraîné une amélioration significative de la capacité fonctionnelle par rapport à tous les comparateurs (placebo, MTX, adalimumab), telle que mesurée par l'indice HAQ-DI, aux semaines 12, 24 et 52 (tableau 2). Des améliorations ont été observées dès la semaine 1 et, dans les études RA-BEGIN et RA-BEAM, ces améliorations se sont maintenues jusqu'à 52 semaines. Dans l'étude RA-BEAM, 67% des patients sous Olumiant 4 mg ont atteint au-moins une différence cliniquement importante (diminution du score HAQ-DI de ≥0.30) à la semaine 24 par rapport à 37% avec le placebo et 60% sous adalimumab (p <0.001 et p = 0.049 respectivement). L'amélioration avec Olumiant a persisté au moins 2 ans.
Le traitement par Olumiant 4 mg, seul ou en association avec des cDMARDs, a entraîné une amélioration significative de la douleur par rapport à tous les comparateurs (placebo, MTX, adalimumab), mesurée sur une échelle visuelle analogique de 0 à 100, à 12, 24 et 52 semaines. Dans l'étude RA-BEAM, la variation moyenne du score de la douleur sous Olumiant 4 mg par rapport à la valeur d'inclusion était de -33.6 à la semaine 24 comparé à -17.5 pour le placebo et -28.8 dans le groupe de traitement avec adalimumab (p < 0.001 et p = 0.004 respectivement).
Dans les études RA-BEAM et RA-BUILD, la durée et la sévérité de la raideur articulaire matinale ont été évaluées à l'aide d'un journal quotidien du patient pendant 12 semaines. Dans l'étude RA-BEAM, les patients sous Olumiant ont montré après 12 semaines une durée médiane de la raideur articulaire matinale de 27 minutes comparé à 60 minutes sous placebo et 37 minutes sous adalimumab (p < 0.001 et p = 0.024 respectivement). Dans l'étude RA-BEAM, les patients sous Olumiant ont montré après 12 semaines une sévérité moyenne de la raideur articulaire matinale de 3.0 comparé à 4.1 sous placebo et 3.5 sous adalimumab, mesurée par une échelle d'évaluation numérique de 0 à 10, avec 0 pour aucune raideur articulaire (p < 0.001 et p = 0.002 respectivement). Dans l'étude RA-BUILD, des résultats similaires versus placebo ont été observés.
Dans toutes les études, les patients traités par Olumiant ont rapporté des améliorations de la qualité de vie, mesurée par le score du statut fonctionnel du questionnaire abrégé (Short Form 36) de qualité de vie SF-36 et de la fatigue, mesurée par le score d'évaluation fonctionnelle du traitement des maladies chroniques (FACIT-F, Functional Assessment of Chronic Illness Therapy-Fatigue) et la productivité au travail mesurée par le Work Productivity and Activity Impairment Questionnaire: Rheumatoid arthritis (WPAI-RA).
Olumiant 4 mg vs. 2 mg
Dans les études cliniques incluant les doses d'Olumiant de 2 mg et 4 mg une fois par jour (RA-BUILD et RA-BEACON), l'efficacité sur les signes et les symptômes a été montrée pour les deux dosages. Un début d'action plus rapide avec une proportion numériquement plus élevée de patients atteignant un faible niveau d'activité de la maladie et une progression radiographique plus faible des lésions articulaires a été constatée avec la dose de 4 mg par rapport à 2 mg. Les différences ont été observées principalement chez les patients de la population bDMARD-RI (RA BEACON), mais très peu chez les patients qui n'avaient encore jamais été traités par un médicament biologique.
Dans l'étude d'extension à long terme, les patients des études RA-BEAM, RA-BUILD et RA-BEACON ayant atteint un état de faible niveau d'activité de la maladie prolongé ou de rémission (CDAI ≤10) après au moins 15 mois de traitement avec Olumiant 4 mg une fois par jour, ont été de nouveau randomisés selon un rapport 1:1, en double-aveugle, pour continuer à recevoir la dose de 4 mg une fois par jour ou réduire la dose à 2 mg une fois par jour.
La majorité des patients a maintenu un état de faible niveau d'activité de la maladie ou sont restés en rémission aussi après la diminution à 2 mg:
·à la semaine 12: 234/251 (93 %) ayant continué la dose de 4 mg et 207/251 (82 %) ayant reçu la dose réduite à 2 mg (p ≤0.001)
·à la semaine 24: 163/191 (85 %) ayant continué la dose de 4 mg et 144/189 (76 %) ayant reçu la dose réduite à 2 mg (p ≤0.05)
·à la semaine 48: 57/73 (78 %) ayant continué la dose de 4 mg et 51/86 (59 %) ayant reçu la dose réduite à 2 mg (p ≤0.05)
La majorité des patients qui n'a pas conservé un état de faible niveau d'activité de la maladie ou ne sont pas restés en rémission après la réduction de la dose ont pu retrouver le contrôle de la maladie après la réinstauration de la dose de 4 mg.
Dermatite atopique
L'efficacité et la sécurité d'Olumiant en monothérapie ou en association avec des corticostéroïdes topiques (CST) ont été évaluées dans 3 études cliniques de phase III randomisées, en double aveugle, contrôlées versus placebo, d'une durée de 16 semaines (BREEZE-AD1, -AD2 et -AD7). Les études ont inclus 1568 patients atteints d'une dermatite atopique modérée à sévère définie par un score Investigator's Global Assessment (IGA) ≥3, un score Eczema Area and Severity Index (EASI) (≥16, et un Body Surface Area (surface corporelle, BSA) ≥10 %. Les patients éligibles étaient âgés de plus de 18 ans et présentaient une réponse insuffisante ou une intolérance aux médicaments topiques. Les patients étaient autorisés à recevoir un traitement de secours (comprenant un traitement topique ou systémique) mais étaient dès lors considérés comme non-répondeurs. Tous les patients ayant terminé ces études étaient éligibles pour participer à une étude d'extension à long terme (BREEZE-AD3) jusqu'à 2 ans de traitement continu.
L'étude clinique de phase III, BREEZE-AD4, randomisée, en double-aveugle, contrôlée versus placebo, a évalué l'efficacité du baricitinib en association avec des corticostéroïdes topiques chez des patients atteints de DA modérée à sévère et présentant un échec thérapeutique, une intolérance ou une contre-indication à un traitement oral à la ciclosporine.
Tableau 4. Synthèse des études cliniques
|
Nom de l'étude (Durée)
|
Nombre de patients traités (N)
|
Traitement concomitanta
|
Groupes de traitement (QD)
|
Mesures des résultats
| |
BREEZE AD-1
(16 semaines)
|
624
|
aucun
|
OLU 4 mg
OLU 2 mg
OLU 1 mg Placebo
|
·Critère principal: IGA 0 ou 1b à la semaine 16
·Amélioration de ≥50%, 75 % ou 90 % de l'Eczema Area and Severity Index par rapport à la valeur initiale (Baseline) (EASI 50, 75, 90)
·Amélioration de ≥75 % sur l'échelle SCORing Atopic Dermatitis (SCORAD)
·Amélioration du Itch Numerical Rating Scale (NRS) ≥4 points
·Effet du prurit sur le sommeil, tel que mesuré par l'Atopic Dermatitis Sleep Scale (ADSS)
·Gravité de la douleur cutanée, telle que mesurée par le Skin Pain Numerical Rating Scale (NRS)
·Patient-Oriented Eczema Measure (POEM)
·Index de qualité de vie en dermatologie (DLQI)
·Hospital Anxiety and Depression Scale (HADS)
| |
BREEZE AD-2
(16 semaines)
|
615
|
aucun
| |
BREEZE AD-7
(16 semaines)
|
329
|
CST;
ICT en cas de besoin
|
OLU 4 mg
OLU 2 mg Placebo
| |
BREEZE AD-4
(jusqu'à 200 semaines)
|
462
|
CST;
ICT en cas de besoin
|
OLU 4 mg
OLU 2 mg
OLU 1 mg
Placebo
|
OLU = Olumiant; QD = une fois par jour; ICT = inhibiteur de la calcineurin topique; CST = corticostéroïdes topiques
a Les patients ont utilisé un traitement concomitant tout au long de l'étude
b Investigators Global Assessment Score de 0 («disparition») ou 1 («quasi disparition») avec une réduction ≥2 points sur une échelle de sévérité de 5 points de 0 à 4.
Caractéristiques à l'inclusion
Dans les études en monothérapie (BREEZE-AD1 et BREEZE-AD2) la moyenne d'âge dans tous les groupes de traitement était de 35.2 ans, le poids moyen était de 73.3 kg, 37.7 % étaient des femmes, 63.5 % étaient caucasiens, 30 % étaient asiatiques et 0.2 % avaient la peau noire. Dans ces études, 54 % des patients avaient un score IGA à l'inclusion de 3 (DA modérée), 46 % avaient un score IGA de base de 4 (DA sévère) et 59.9 % des patients avaient reçu un traitement systémique préalable pour la dermatite atopique. Le score EASI moyen à l'inclusion était de 32.2, le score BSA moyen à l'inclusion était de 52.3, le score NRS du prurit moyen hebdomadaire à l'inclusion était de 6.6, le score SCORAD moyen à l'inclusion était de 67.8, le score POEM moyen à l'inclusion était de 20.6, le score DLQI moyen à l'inclusion était de 14.0, le score HADS moyen pour la dépression à l'inclusion était de 5.0 et le score HADS moyen pour l'anxiété à l'inclusion était de 6.1.
Dans l'étude en association avec les CST (BREEZE-AD7), la moyenne d'âge dans tous les groupes de traitement était de 33.8 ans, le poids moyen était de 72.9 kg, 34.3 % étaient des femmes, 45.6 % étaient caucasiens et 51.1 % étaient asiatiques. Dans cette étude, 54.9% des patients avaient un score IGA à l'inclusion de 3, 45.1% avaient un score IGA à l'inclusion de 4 et 66.4% des patients avaient reçu un traitement systémique préalable. Le score EASI moyen à l'inclusion était de 29.6, le score BSA moyen à l'inclusion était de 50.3, le score NRS du prurit moyen à l'inclusion était de 7.1, le score SCORAD moyen à l'inclusion était de 67.2, le POEM moyen à l'inclusion était de 21.1, le DLQI moyen à l'inclusion était de 14.9, le score HADS moyen pour la dépression à l'inclusion était de 5.5 et le score HADS moyen pour l'anxiété à l'inclusion était de 6.6.
Dans l'étude en association avec les CST (BREEZE-AD4) la moyenne d'âge dans tous les groupes de traitement était de 38.2 ans, le poids moyen était de 75.5 kg, 35.9 % étaient des femmes, 77.8 % étaient caucasiens et 19.2 % étaient asiatiques. Dans cette étude, 48.7 % des patients avaient un score IGA à l'inclusion de 3, 51.3 % avaient un score IGA de base de 4 et 78.8 % des patients avaient reçu un traitement systémique préalable. Le score EASI moyen à l'inclusion était de 31.8, le score BSA moyen à l'inclusion était de 51.8, le score NRS duprurit moyen hebdomadaire à l'inclusion était de 6.8, le score SCORAD moyen à l'inclusion était de 68.8, le score POEM moyen à l'inclusion était de 21.2, le score DLQI moyen à l'inclusion était de 14.0, le score HADS moyen pour la dépression à l'inclusion était de 5.0 et le score HADS moyen pour l'anxiété à l'inclusion était de 6.2.
Réponse clinique
Études cliniques en monothérapie sur 16 semaines (BREEZE-AD1 et BREEZE-AD2)
Dans les études BREEZE-AD1 et BREEZE-AD2, une proportion significativement plus élevée de patients randomisés pour recevoir baricitinib 4 mg a obtenu une réponse IGA 0 ou 1, un EASI75, ou une amélioration ≥4 points sur l'échelle du prurit (Itch NRS) par rapport au placebo à la semaine 16 (Tableau 5).
Une proportion significativement plus élevée de patients randomisés pour recevoir baricitinib 4 mg a atteint une amélioration rapide du score NRS duprurit par rapport au placebo (défini comme ≥4 points d'amélioration dès la première semaine de traitement; p < 0.001).
Les figures 2 et 3 montrent, respectivement, le pourcentage moyen de changement par rapport aux valeurs de l'EASI à l'inclusion et la proportion de patients présentant au moins 4 points d'amélioration sur l'échelle du prurit (Itch NRS). Les résultats pour la période contrôlée par placebo sont présentés jusqu'à la semaine 16, avec des résultats à long terme disponibles jusqu'aux semaines 68 et 32 pour les figures 2 et 3, respectivement.
Les effets du traitement dans les sous-groupes de patients (poids, âge, sexe, origine ethnique, sévérité de la maladie et traitement antérieur, y compris immunosuppresseurs) dans BREEZE-AD1 et BREEZE-AD2 étaient cohérents avec les résultats dans la population globale de l'étude.
Tableau 5. Efficacité du baricitinib en monothérapie à la semaine 16 (FASa)
|
Etude
|
BREEZE-AD1
|
BREEZE-AD2
| |
Groupe de traitement
|
PBO
|
OLU
2 mg
|
OLU
4 mg
|
PBO
|
OLU
2 mg
|
OLU
4 mg
| |
N
|
N = 249
|
N = 123
|
N = 125
|
N = 244
|
N = 123
|
N = 123
| |
IGA 0 ou 1,
% de répondeursb, c
|
4.8 %
|
11.4 %*
|
16.8 %***
|
4.5 %
|
10.6 %*
|
13.8 %***
| |
EASI-75,
% de répondeursc
|
8.8 %
|
18.7 %**
|
24.8 %***
|
6.1 %
|
17.9 %***
|
21.1 %***
| |
SCORAD75,
% de répondeursc
|
1.2 %
|
7.3 %+
|
10.4 %***
|
1.6 %
|
7.3 %**
|
11.4 %***
| |
Itch NRS (amélioration ≥4 points), % de répondeursc,d
|
7.2 %
|
12.0% +
|
21.5 %***
|
4.7 %
|
15.1 %**
|
18.7 %***
|
OLU = Olumiant; PBO = Placebo
*p ≤0.05; **p ≤0.01; ***p ≤0.001 +non significatif en partie en raison de la hiérarchie des tests par rapport au placebo.
a Full analysis set (FAS, Analyse de la population totale de l'étude), inclut tous les patients randomisés.
b Un répondeur est défini comme un patient ayant atteint un score IGA de 0 ou 1 («disparition» ou «quasi disparition») avec une réduction ≥2 points sur l'échelle IGA 0-4.
c Imputation des non-répondeurs: les patients ayant reçu un traitement de secours ont été définitivement stoppés du traitement à l'étude. Les patients avec des données manquantes ont été considérés comme non-répondeurs.
d Résultats présentés dans un sous-ensemble de patients éligibles pour une évaluation (patients avec un score NRS duprurit ≥4 à l'inclusion).
Figure 2. Variation moyenne en pourcentage du score EASI par rapport à l'inclusion dans BREEZE-AD1et BREEZE-AD2 (FAS)a avec les données à long terme de BREEZE-AD3b, c
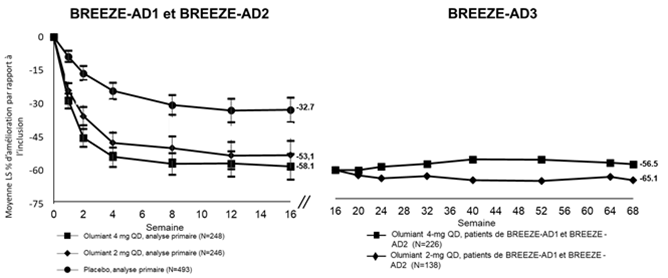
a Full analysis set (FAS) inclut tous les patients randomisés. Les données recueillies après un traitement de secours ou après un arrêt définitif du médicament à l'étude ont été considérées comme manquantes. Les moyennes LS proviennent d'analyses MMRM.
b La modified last observation carried forward (mLOCF) a été utilisée. La technique d'imputation mLOCF remplace les données manquantes par la dernière évaluation après inclusion non manquante.
c Dans BREEZE-AD3, la taille de l'échantillon de patients pour Olumiant 2 mg est réduite car les non-répondeurs à cette dose dans BREEZE-AD1 et BREEZE-AD2 ont été re-randomisés à la dose de 2 mg ou 4 mg 1:1. Les répondeurs et répondeurs partiels sont restés à la même dose.
Remarque: les barres d'erreur représentent un IC de 95%.
Figure 3. Proportion de patients présentant au moins 4 points d'amélioration du Itch NRS dans BREEZE-AD1 and BREEZE-AD2 a avec les données à long terme de BREEZE-AD3b
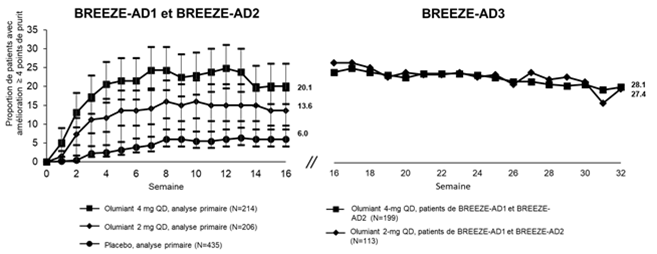
a Les résultats ont été présentés dans un sous-ensemble de patients éligibles à l'évaluation (patients atteints avec score prurit NRS≥4 à l'inclusion). Les patients qui ont reçu un traitement de secours ont été définitivement stoppés du traitement à l'étude. Les patients dont les données étaient manquantes ont été considérés comme non-répondeurs (imputation des non-répondeurs).
b Dans BREEZE-AD3, la taille de l'échantillon de patients pour Olumiant 2 mg est réduite parce que les non-répondeurs à cette dose dans BREEZE-AD1 et BREEZE-AD2 ont été re-randomisés à la dose de 2 mg ou 4 mg 1:1. Les répondeurs et les répondeurs partiels sont restés à la même dose. Les patients ayant cessé définitivement de prendre le médicament de l'étude ou pour lesquels des données manquaient ont été comptés comme non-répondeurs (Non Responder Imputation).
Remarque: les barres d'erreur représentent un IC de 95 %. L'augmentation du pourcentage observé dans BREEZE-AD3 est due au fait que les patients qui ont été secourus avec des CST dans BREEZE-AD1 et -AD2 n'ont pas été considérés comme des non-répondeurs.
Étude clinique sur 16 semaines en association avec des CST (BREEZE-AD7)
Dans BREEZE-AD7, une proportion significativement plus élevée de patients randomisés pour recevoir baricitinib 4 mg+CST a atteint une réponse IGA de 0 ou 1, unEASI75, ou une amélioration ≥4 points du score NRS duprurit par rapport au placebo à la semaine 16 (Tableau 6).
Une proportion significativement plus élevée de patients randomisés pour recevoir baricitinib 4 mg a atteint une amélioration rapide du score NRS duprurit par rapport au placebo (défini comme ≥4 points d'amélioration dès la deuxième semaine; p < 0.001).
Les figures 4 et 5 montrent, respectivement, le pourcentage moyen de changement par rapport aux valeurs de l'EASI à l'inclusion et la proportion de patients présentant au moins 4 points d'amélioration du score NRS duprurit. Les résultats pour la période contrôlée par placebo sont présentés jusqu'à la semaine 16, avec des résultats à long terme disponibles jusqu'aux semaines 68 et 32 pour les figures 4 et 5, respectivement.
Les effets du traitement dans les sous-groupes de patients (poids, âge, sexe, origine ethnique, sévérité de la maladie et traitement antérieur, y compris immunosuppresseurs) dans BREEZE-AD7 étaient cohérents avec les résultats dans la population globale de l'étude.
Tableau 6. Efficacité du baricitinib en association avec des CSTa à la semaine 16 (FAS)b
|
Etude
|
BREEZE- AD7
| |
Groupe de traitement
|
PBOa
|
OLU 2 mg a
|
OLU 4 mg a
| |
N
|
109
|
109
|
111
| |
IGA 0 ou 1,
% de répondeursc, d
|
14.7 %
|
23.9 %
|
30.6 %**
| |
EASI-75,
% de répondeursd
|
22.9 %
|
43.1 %+
|
47.7 %***
| |
SCORAD75,
% de répondeursd
|
7.3 %
|
11.0 %+
|
18.0 %+
| |
Itch NRS (amélioration ≥4 points), % de répondeursd, e
|
20.2 %
|
38.1 %+
|
44.0 %***
|
OLU = Olumiant; PBO = Placebo
*p ≤0.05; **p ≤0.01; ***p ≤0.001 vs. +non significatif en partie en raison de la hiérarchie des tests, par rapport au placebo.
a Tous les patients ont reçu une thérapie concomitante avec des corticostéroïdes topiques et ont été autorisés à utiliser des inhibiteurs topiques de la calcineurine.
b Full Analysis Set (FAS) inclut tous les patients randomisés.
c Un répondeur est défini comme un patient avec un IGA 0 ou 1 («disparition» ou «quasi disparition») avec une réduction de ≥2 points sur l'échelle IGA de 0 à 4.
d Imputation des non-répondeurs: les patients ayant bénéficié d'une thérapie de secours ont été définitivement stoppés du traitement à l'étude. Les patients dont les données étaient manquantes ont été considérés comme non-répondeurs.
eRésultats présentés dans un sous-ensemble de patients éligibles pour évaluation (patients avec un score NRS du prurit ≥4 à l'inclusion).
Figure 4. Variation moyenne en pourcentage du score EASI par rapport à l'inclusion dans BREEZE-AD7 (FAS) a avec les données à long terme de BREEZE-AD3b
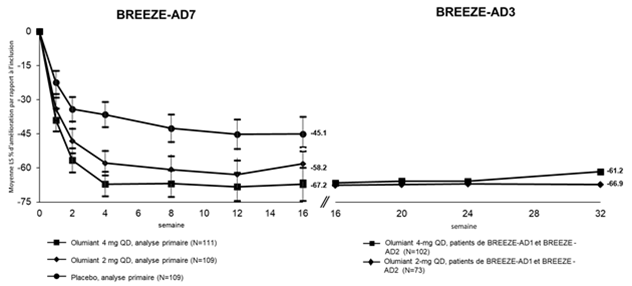
a Full analysis set (FAS) inclut tous les patients randomisés. Les données recueillies après un traitement de secours ou après un arrêt définitif du médicament à l'étude ont été considérées comme manquantes. Les moyennes LS proviennent d'analyses MMRM.
b La modified last observation carried forward (mLOCF) a été utilisée. La technique d'imputation mLOCF remplace les données manquantes par la dernière évaluation après inclusion non manquante.
Remarque: les barres d'erreur représentent un IC de 95%.
Figure 5. Proportion de patients avec au moins 4 points d'amélioration du score Itch NRS dans BREEZE-AD7 a avec les données à long terme de BREEZE-AD3 b
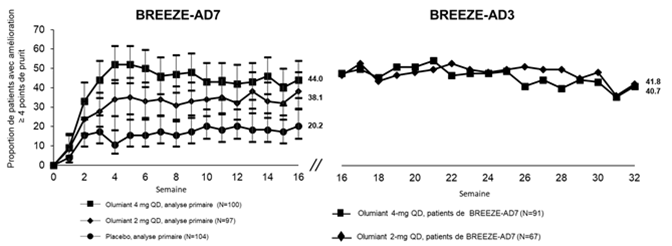
a Les résultats ont été présentés dans un sous-ensemble de patients éligibles à l'évaluation (patients avec un score prurit NRS≥4 à l'inclusion). Les patients ayant suivis un traitement de secours ont été définitivement stoppés du traitement à l'étude. Les patients dont les données étaient manquantes ont été notés comme non-répondeurs (imputation des non-répondeurs).
b Dans BREEZE-AD3, la taille de l'échantillon de patients pour Olumiant 2 mg est réduite parce que les non-répondeurs à cette dose dans BREEZE-AD7 ont été re-randomisés à la dose de 2 mg ou 4 mg 1:1. Les répondeurs et les répondeurs partiels sont restés à la même dose. Les patients ayant cessé définitivement de prendre le médicament à l'étude ou pour lesquels des données manquaient ont été comptés comme non-répondeurs (Non Responder Imputation).
Remarque: les barres d'erreur représentent un IC de 95 %.
Maintien de la réponse
Afin d'évaluer le maintien de la réponse, 1373 sujets traités par baricitinib pendant 16 semaines dans les études cliniques BREEZE-AD1 (N=541), BREEZE-AD2 (N =540) et BREEZE-AD7 (N=292) étaient éligibles pour participer à une étude d'extension à long terme BREEZE-AD3. Les données sont disponibles sur une durée cumulée maximale de 68 semaines de traitement pour les patients des études BREEZE-AD1 et BREEZE-AD2, et sur une durée cumulée maximale de 32 semaines de traitement pour les patients de l'étude BREEZE-AD7. Une différence soutenue par rapport au placebo a été observée dans les bras baricitinib. Des différences numériques constantes sont apparues entre la dose plus élevée de 4 mg et la dose de 2 mg, au détriment de la dose plus élevée de 4 mg (voir figure 6).
Figure 6. Persistance d'IGA 0 ou 1 pour baricitinib 4 mg et 2 mg dans BREEZE-AD3 jusqu'à la semaine 68a

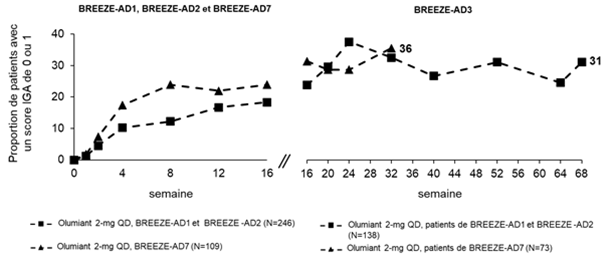
a L'imputation des non-répondeurs a été utilisée. Les patients qui ont cessé définitivement de prendre le médicament à l'étude ou pour lesquels il manquait des données ont été considérés comme non-répondeurs.
Réponse clinique chez les patients en situation d'échec au traitement à la ciclosporine, d'intolérance à celle-ci ou de contre-indication au traitement à la ciclosporine (étude BREEZE-AD4)
Au total, 462 patients ont été inclus, soit en situation d'échec au traitement (n=173), soit en cas d'intolérance (n=75) ou de contre-indication (n=126) à la ciclosporine orale.
Le critère principal d'évaluation était la proportion de patients ayant atteint un EASI-75 à la semaine 16 et a été atteint dans le groupe de traitement par le barictinib à 4 mg. Les résultats à la semaine 24 sont résumés dans le tableau 7.
Tableau 7. Efficacité du baricitinib en association avec des CST à la semaine 24 dans BREEZE-AD4 (FAS)b
|
Etude
|
BREEZE- AD4
| |
Groupe de traitement
|
PBOa
|
OLU 2 mga
|
OLU 4 mga
| |
N
|
93
|
185
|
92
| |
EASI-75,
% de répondeursc
|
15.1 %
|
27.0 %
|
28.3 %*
| |
EASI, moyenne LS % variation par rapport la valeur initiale (SE) d
|
-45.10
(4.24 )
|
-57.24 **
(2.80 )
|
-58.46 ***
(4.02 )
| |
IGA 0 ou 1,
% de répondeursc, e
|
12.9 %
|
18.9 %
|
13.0 %*
| |
Itch NRS, moyenne LS % de variation par rapport à l'inclusion (SE) d,f
|
-15.35
(5.35 )
|
-30.11 **
(3.50)
|
-33.16 **
(4.97)
| |
variation du score DLQI, moyenne (SE)d
|
-4.90 (0.74 )
|
-6.81
(0.49 )
|
-7.65 **
(0.71 )
|
SE = standard error (erreur standard). *p ≤0.05; **p ≤0.01; ***p ≤0.001, +non significant en partie en raison de la hiérarchie des tests par rapport au placebo.
Note: IGA (0,1) et EASI75 sont des paramètres gated. Tous les autres paramètres ne sont pas gated.
a Tous les patients ont reçu une thérapie concomitante avec des corticostéroïdes topiques et ont été autorisés à utiliser des inhibiteurs topiques de la calcineurine.
b Full analysis set (FAS, Analyse de la population totale de l'étude), inclut tous les patients randomisés.
c Imputation des non-répondeurs: les patients ayant bénéficié d'une thérapie de secours ont été définitivement stoppés du traitement à l'étude. Les patients dont les données étaient manquantes étaient considérés comme non-répondeurs.
d Les données recueillies après une thérapie de secours ou l'arrêt définitif du médicament à l'étude ont été considérées comme manquantes. Les valeurs moyennes LS proviennent d'analyses du MMRM qui comprennent des imputations multiples pour les données manquantes.
e Un répondeur est défini comme un patient avec un IGA 0 ou 1 («disparition» ou «quasi disparition») avec une réduction de ≥2 points sur l'échelle IGA de 0 à 4.
f L'ensemble des analyses évaluables comprend les patients ayant un NRS non nul à l'inclusion.
Réduction de dose
Dans l'étude d'extension à long terme BREEZE-AD3, les patients ayant obtenu une peau sans symptômes ou une maladie persistante minimale ou légère (IGA 0, 1 ou 2) avec Olumiant 4 mg une fois par jour ont été ré randomisés en double aveugle pour poursuivre le traitement à 4 mg une fois par jour ou pour réduire la dose à 2 mg une fois par jour. La majorité des patients re-randomisés à Olumiant 2 mg ont maintenu leur réponse 16 semaines après la re-randomisation. La majorité des patients qui ont perdu l'activité faible de la maladie ou un statut de peau sans symptômes après la réduction de la dose ont retrouvé le contrôle de la maladie après être revenus à Olumiant 4 mg.
Qualité de vie/résultats rapportés par les patients
Pendant la période de 16 semaines contrôlée par placebo, les patients traités par 2 mg et 4 mg de baricitinib ont montré une amélioration du prurit, du sommeil (scores ADSS), des douleurs cutanées et de la qualité de vie (scores DLQI) par rapport aux patients randomisés pour le placebo.
Pelade (Alopecia areata)
L'efficacité et la sécurité du baricitinib une fois par jour ont été examinées dans une étude adaptative de phase II/III (BRAVE-AA1) et une étude de phase III (BRAVE-AA2). Les deux études étaient des études randomisées, en double aveugle, contrôlées contre placebo, sur une durée de 36 semaines avec des phases de prolongation allant jusqu'à 200 semaines. Dans les deux études, les patients ont été randomisés dans un rapport de 2:2:3 pour recevoir un placebo, 2 mg ou 4 mg de baricitinib. Les patients éligibles étaient des adultes âgés de 18 à 60 ans pour les hommes et de 18 à 70 ans pour les femmes, avec un épisode actuel de plus de 6 mois de pelade sévère (perte de cheveux touchant ≥50 % du cuir chevelu). Les patients avec un épisode actuel de plus de 8 ans n'étaient pas éligibles sauf si des épisodes de repousse avaient été observés sur les zones atteintes du cuir chevelu au cours des 8 dernières années. Les patients souffrant d'hépatite virale chronique et/ou d'infections actives ont été exclus des études.
Les seuls traitement concomitants de la pelade autorisés étaient le finastéride (ou d'autres inhibiteurs de la 5-alpha-réductase), le minoxidil oral ou topique et la solution ophtalmique de bimatoprost en pour les cils, s'il y avait une dose stable à l'entrée dans l'étude.
Le critère principal d'efficacité des deux études était la proportion de sujets qui atteignaient un score SALT ≤20 (au moins 80 % du cuir chevelu couvert de cheveux) à la semaine 36. En outre, les deux études ont évalué la chute des cheveux estimée par les patients au niveau du cuir chevelu sur une échelle en 5 points (Scalp Hair Assessment PRO™) et la chute des cils et des sourcils évaluée par le médecin de l'étude à l'aide d'une échelle en 4 points (ClinRO Measure for Eyebrow Hair Loss™, ClinRO Measure for Eyelash Hair Loss™).
Caractéristiques à l'inclusion
La partie de phase III de l'étude BRAVE-AA1 et l'étude de phase III BRAVE-AA2 ont englobé 1200 patients adultes. Sur l'ensemble des groupes de traitement l'âge moyen était de 37.5 ans, 61 % des patients étaient des femmes.
La durée moyenne de la pelade depuis son apparition et la durée moyenne de l'épisode actuel de perte de cheveux étaient respectivement de 12.2 ans et 3.9 ans. Le score SALT médian sur l'ensemble des études était de 96 et environ 44 % des patients présentaient une pelade universelle. Dans l'ensemble des études, à l'inclusion, 69 % des patients présentaient une perte significative ou totale des sourcils et 58 % présentaient une perte significative ou totale des cils, mesurées par des scores de 2 ou de 3 dans les échelles ClinRO pour les sourcils et les cils. Environ 90 % des patients avaient reçu au moins un traitement contre la pelade avant de participer aux études, et 50 % au moins un immunosuppresseur systémique. L'utilisation de traitements concomitants autorisés dans la pelade n'a été rapportée que par 4.3 % des patients au cours des études.
Réponse clinique
Dans les deux études, une proportion significativement plus importante de patients randomisés sous baricitinib 4 mg une fois par jour a atteint un score SALT ≤20 à la semaine 36 comparativement à ceux sous placebo, et ce dès la semaine 8 dans l'étude BRAVE-AA1 et dès la semaine 12 dans l'étude BRAVE-AA2. Une efficacité similaire a été observée pour la plupart des critères d'évaluation secondaires (Tableau 8). La figure 7 montre la proportion de patients ayant atteint un SALT ≤20 par rapport à la valeur initiale jusqu'à la semaine 36. Les effets du traitement dans les sous-groupes (sexe, âge, poids, débit de filtration glomérulaire estimé, origine ethnique, région géographique, gravité de la maladie, durée de l'épisode actuel de pelade) étaient en accord à la semaine 36 avec les résultats obtenus pour l'ensemble de la population de l'étude.
Tableau 8. Efficacité du baricitinib jusqu'à la semaine 36 (FASa)
|
Étude
|
BRAVE-AA1
|
BRAVE-AA2
| |
Groupe de traitement
|
PBO
N=189
|
BARI 2 mg
N=184
|
BARI 4 mg
N=281
|
PBO
N=156
|
BARI 2 mg
N=156
|
BARI 4 mg
N=234
| |
SALT ≤20 à la semaine 36
|
5.3%
|
21.7%**
|
35.2%**
|
2.6%
|
17.3%**
|
32.5%**
| |
SALT ≤20 à la semaine 24
|
4.8%
|
11.4%**
|
26.7%**
|
1.3%
|
10.9%**
|
28.2%**
| |
Scalp Hair Assessment PRO de 0 ou 1 à la semaine 36 avec ≥2 points d'amélioration par rapport à la valeur initiale b
|
5.0%
|
16.0%**
|
33.1%**
|
4.0%
|
16.1%**
|
34.4%**
| |
ClinRO Measure for Eyebrow Hair Loss de 0 ou 1 à la semaine 36 avec ≥2 points d'amélioration par rapport à la valeur initiale c
|
3.2%
|
19.1%**
|
31.4%**
|
4.5%
|
11.5%*
|
34.8%**
| |
ClinRO Measure for Eyelash Hair Loss de 0 ou 1 à la semaine 36 avec ≥2 points d'amélioration par rapport à la valeur initiale d
|
3.1%
|
13.5%*
|
33.5%**
|
5.6%
|
10.1%
|
34.3%**
|
BARI = baricitinib; PBO = placebo
* statistiquement significatif versus placebo sans ajustement pour la multiplicité; ** statistiquement significatif versus placebo avec ajustement pour la multiplicité.
a Full Analysis Set (FAS, population totale), englobe tous les patients randomisés.
b 0 = pas de chute de cheveux, 1 = chute de cheveux dans une zone limitée du cuir chevelu (de 1% à 20%). Chez les patients qui ont un score Scalp Hair PRO ≥3 au début de l'étude (n=181, 175 respectivement 275 pour BRAVE-AA1 et n=151, 149 respectivement 215 pour BRAVE-AA2)
c 0 = sourcils couvrant en totalité, sans zones de perte de poils, 1 = lacunes minimes dans les poils des sourcils, avec une distribution régulière. Chez les patients qui ont un score ClinRO Measure for Eyebrow Hair loss ≥2 au début de l'étude (n=124, 136 respectivement 188 pour BRAVE-AA1 et n = 112, 104 respectivement 161 pour BRAVE-AA2)
d 0 = les cils forment une ligne continue le long des paupières des deux yeux, 1 = il y a des lacunes minimes, les cils sont implantés à intervalles réguliers le long des paupières des deux yeux. Chez les patients qui ont un score ClinRO Measure for Eyelash Hair Loss ≥2 au début de l'étude (n=96, 111 respectivement 167 pour BRAVE-AA1 et n=90, 89 respectivement 140 pour BRAVE-AA2)
Figure 7. Proportion de patients avec un SALT ≤20
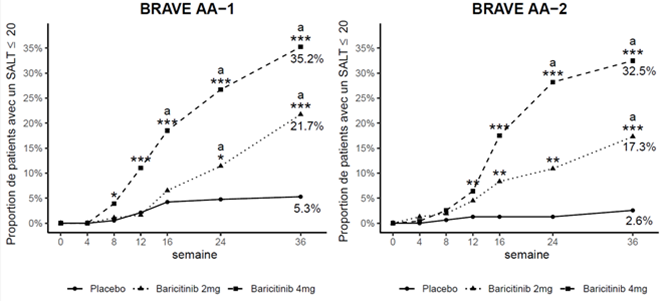
a Statistiquement significatif après ajustement pour la multiplicité.
* Valeur de p pour baricitinib versus placebo ≤0.05; ** Valeur de p pour baricitinib versus placebo ≤0.01; *** Valeur de p pour baricitinib versus placebo ≤0.001.
Efficacité jusqu'à la semaine 52
La proportion de patients traités par le baricitinib atteignant un SALT ≤20 a continué d'augmenter après la semaine 36, atteignant 39.0 % des patients sous baricitinib 4 mg à la semaine 52. Les résultats dans les sous-groupes pour la sévérité de la maladie à l'inclusion et la durée de l'épisode de pelade à la semaine 52 correspondaient à ceux observés à la semaine 36 et aux résultats de la population générale de l'étude.
Réduction de la dose
Dans l'étude BRAVE-AA2, les patients ayant reçu du baricitinib 4 mg une fois par jour depuis la randomisation initiale et ayant atteint un SALT ≤20 à la semaine 52 ont été de nouveau randomisés en double aveugle pour continuer à prendre le traitement de 4 mg une fois par jour ou pour réduire la dose à 2 mg une fois par jour. Les résultats montrent que 96 % des patients qui sont restés sous baricitinib 4 mg et 74 % des patients qui ont été rerandomisés pour prendre du baricitinib 2 mg ont maintenu leur réponse à la semaine 76.
COVID-19
Dans une étude clinique randomisée, en double aveugle, contrôlée contre placebo (ACTT-2), le baricitinib 4 mg une fois par jour + remdésivir a été comparé au placebo + remdésivir chez 1033 patients COVID-19 adultes hospitalisés.
L'échelle de classification en 8 points (Ordinal Score, OS) du NIAID (National Institute of Allergy and Infectious Diseases) suivante a été utilisée pour classer la maladie de base en fonction de son degré de gravité:
8. Mort;
7. Hospitalisé, avec ventilation mécanique invasive ou ECMO (oxygénation par membrane extracorporelle);
6. Hospitalisé, avec ventilation non invasive ou oxygénothérapie à haut débit;
5. Hospitalisé, avec supplémentation d'oxygène à bas débit;
4. Hospitalisé, sans supplémentation d'oxygène à bas débit, mais avec traitement médical (en lien avec la COVID-19 ou autre);
3. Hospitalisé, sans supplémentation d'oxygène à bas débit - ne nécessitant plus de traitement médical;
2. Non hospitalisé, avec limitations des activités et/ou supplémentation d'oxygène à domicile;
1. Non hospitalisé, sans limitations des activités
L'étude incluait 14% de patients avec OS 4, 55% de patients avec OS 5, 21% de patients avec OS 6 et 11 % de patients avec OS 7.
Le critère clinique principal a été le temps écoulé jusqu'à la guérison dans les 29 jours qui ont suivi la randomisation, la guérison étant définie comme l'obtention d'un OS de la catégorie 1, 2 ou 3.
Les patients ont été randomisés dans un rapport de 1:1, stratifiés selon le degré de gravité de la maladie au moment de l'inclusion dans l'étude, pour recevoir un traitement de baricitinib + remdésivir (n=515) ou de placebo + remdésivir (n=518). Les patients ont été traités selon le schéma suivant:
·Baricitinib 4 mg ou placebo une fois par jour (par voie orale) sur 14 jours ou jusqu'à la sortie de l'hôpital
·Remdésivir 200 mg le jour 1, suivi de 100 mg une fois par jour (par perfusion intraveineuse) les jours suivants, sur une période de traitement totale de 10 jours ou jusqu'à la sortie de l'hôpital.
L'âge moyen des patients au début de l'étude était de 55 ans, 30% des patients ayant 65 ans ou plus. 63 % des patients étaient des hommes, 48 % étaient caucasiens, 15 % avaient la peau noire et 10% étaient asiatiques. 83% des patients présentaient des comorbidités, l'obésité (56 %), l'hypertension (52 %) et le diabète de type 2 (37 %) étant les comorbidités les plus fréquentes. Les caractéristiques démographiques et les caractéristiques liées à la maladie étaient équilibrées dans le groupe de l'association et dans le groupe du placebo.
En ce qui concerne la population totale (ITT), le temps moyen écoulé jusqu'à la guérison a été de 7 jours sous baricitinib + remdésivir, par rapport à 8 jours sous placebo + remdésivir [Hazard Ratio: 1.15 (IC 95 % 1.00, 1.31); p=0.047]. Le bénéfice clinique sous baricitibib + remdésivir a été le plus prononcé chez les patients qui nécessitaient une supplémentation d'oxygène à bas débit (OS 5), une ventilation non invasive ou une oxygénothérapie à haut débit (OS 6) (voir Tableau 9). Chez les patients qui nécessitaient une ventilation mécanique invasive ou une ECMO (OS 7), la durée moyenne jusqu'à la guérison n'a pas pu être estimée. Chez les patients qui ne nécessitaient pas d'oxygène (OS 4), il n'y a pas eu d'avantage manifeste avec le baricitinib + remdésivir au niveau du temps médian écoulé jusqu'à la guérison (5 jours) par rapport au remdésivir (4 jours) (Recovery Rate Ratio 0.88 [IC 95 % 0.62–1.23]).
Tableau 9. Résultats de guérison en fonction du score ordinal au début de l'étude pour les patients nécessitant de l'oxygène - Étude ACTT-2a
|
|
Score ordinal au début de l'étude - Population ITT
| |
|
5
|
6
|
7
| |
|
Oxygène à
bas débit
|
Ventilation non invasive ou oxygène à haut débit
|
Ventilation mécanique invasive/ECMO
| |
|
BARI
+ RDV
(n=288)
|
PBO
+ RDV
(n=276)
|
BARI
+ RDV
(n=103)
|
PBO
+ RDV
(n=113)
|
BARI
+ RDV
(n=54)
|
PBO
+ RDV
(n=57)
| |
Nombre de guérisons
|
262
|
243
|
82
|
73
|
22
|
21
| |
Temps médian écoulé jusqu'à la guérison
Jours (IC à 95 %)
|
5
(5, 6)
|
6
(5, 6)
|
10
(9, 13)
|
18
(13, 21)
|
NE
(25, NE)
|
NE
(26, NE)
| |
Recovery Rate Ratio
Joursa (IC 95 %)
|
1.17
(0.98, 1.39)
|
1.51
(1.10, 2.08)
|
1.08
(0.59, 1.97)
|
ECMO = oxygénation extracorporelle par membrane, ITT = Intention to Treat, RDV = remdésivir, PBO = placebo, BARI= baricitinib
a Recovery Rate Ratio calculé selon le modèle stratifié de Cox. Un Recovery Rate Ratio >1 indique un avantage pour le baricitinib + remdésivir. NE = non évaluable.
La mortalité au jour 29 dans la population totale s'est élevée à 4.7 % (n=24/515) dans le groupe baricitinib/remdésivir, par rapport à 7.1 % (n=37/518) dans le groupe placebo/remdésivir (Hazard Ratio: 0.65; [IC 95 % de 0.39 à 1.09]; p=0.102). Le bénéfice clinique du baricitinib était le plus prononcé chez les patients qui nécessitaient une supplémentation d'oxygène à bas débit, une ventilation non invasive ou une oxygénothérapie à haut débit (voir Tableau 10):
Tableau 10. Résultats de mortalité au jour 29 en fonction du score ordinal au début de l'étude pour les patients nécessitant de l'oxygène - Étude ACTT-2
|
|
Score ordinal au début de l'étude – Population ITTc
| |
|
5
|
6
|
7
| |
|
Oxygène à bas débit
|
Ventilation non invasive ou oxygène à haut débit
|
Ventilation mécanique invasive/ECMO
| |
|
BARI
+ RDV
(n=288)
|
PBO
+ RDV
(n=276)
|
BARI
+ RDV
(n= 103)
|
PBO
+ RDV
(n=113)
|
BARI
+ RDV
(n=54)
|
PBO
+ RDV
(n=57)
| |
Mortalité au jour 29 – N (%)a
|
5
(1.9%)
|
12
(4.7%)
|
7
(7.5%)
|
13
(13.0%)
|
12 (23.1%)
|
12
(22.6%)
| |
Hazard Ratiob
(IC 95 %)
|
0.4
(0.14, 1.14)
|
0.55
(0.22, 1.38)
|
1.00 (0.45, 2.22)
|
a Les indications de pourcentages se basent sur la méthode de Kaplan-Meier.
b Les Hazard Ratios pour les sous-groupes de l'échelle ordinale au début de l'étude proviennent de modèles non stratifiés de Proportional-Hazard de Cox.
c ITT = Intention-To-Treat Population = tous les patients randomisés .
Des analyses par sous-groupes ont montré pour les patients âgés de moins de 40 ans et pour les patients sans comorbidités une durée plus longue du temps écoulé jusqu'à la guérison lorsqu'ils étaient traités avec le baricitinib+remdésivir plutôt qu'avec le remdésivir seul, mais leurs chances de guérison (Recovery Rate Ratio) se situaient un peu au-dessus de celles du traitement avec remdésivir seul:
·Patients de moins de 40 ans (n=162/1033): 6 versus 5 jours; Recovery Rate Ratio (IC 95 %): 1.01 (0.74-1.38)
·Patients sans comorbidités (n=138/1033): 7 versus 6 jours; Recovery Rate Ratio (IC 95 %): 1.11 (0.79-1.55)
Des analyses de sous-groupes ont montré pour les femmes et pour les patients non obèses aucune différence dans le temps écoulé jusqu'à la guérison lorsqu'ils étaient traités avec le baricitinib+remdésivir plutôt qu'avec le remdésivir seul mais leurs chances de guérison (Recovery Rate Ratio) se situaient un peu au-dessus de celles du traitement avec remdésivir seul:
·Femmes (n=316/1033): 7 versus 7 jours; Recovery Rate Ratio (IC 95 %): 1.06 (0.85-1.32)
·Patients non obèses (n=362/1033): 9 versus 9 jours; Recovery Rate Ratio (IC 95 %): 1.07 (0.87-1.32)
PharmacocinétiqueAbsorption
Après administration orale, le baricitinib est rapidement absorbé avec un tmax médian d'environ 1 heure et une biodisponibilité absolue d'environ 80 %. L'administration pendant les repas n'a pas été associée à un effet cliniquement pertinent sur l'exposition.
Distribution
Le volume moyen de distribution après une administration par perfusion intraveineuse a été de 76 l, ce qui indique la distribution du baricitinib dans les tissus. Environ 50 % du baricitinib se lie à des protéines plasmatiques. Le baricitinib est un substrat des transporteurs Pgp, BCRP, OAT3 et MATE2-K, qui jouent un rôle dans la distribution du principe actif.
Métabolisme
Le métabolisme du baricitinib est médié par le CYP3A4, avec environ 6 % de la dose identifiée comme ayant subi une biotransformation. Aucun métabolite n'était quantifiable dans le plasma. Seulement 4 métabolites oxydatifs mineurs ont été identifiés (3 dans les urines et 1 dans les selles).
Élimination
L'élimination rénale est le principal mécanisme de la clairance du baricitinib par filtration glomérulaire et sécrétion active via OAT3, Pgp, BCRP et MATE2-K. Après une prise orale de baricitinib marqué au 14C, 75.2% et 19.9% de la dose radioactive ont été excrétés dans l'urine et les selles respectivement, en majeure partie sous forme inchangée.
La clairance moyenne du barictinib est de 9.4 l/h chez les patients avec PR et d'environ 11 l/h chez les patients avec DA et pelade.
La demi-vie est de 13 à 16 heures chez les patients avec PR, DA et pelade.
Cinétique pour certains groupes de patients
Facteurs intrinsèques
Le poids corporel, le sexe, la race et l'origine ethnique n'ont pas eu d'effet cliniquement pertinent sur la pharmacocinétique du baricitinib. Les effets moyens des facteurs intrinsèques sur les paramètres pharmacocinétiques (AUC et Cmax) sont généralement restés dans la variabilité pharmacocinétique interindividuelle du baricitinib. Par conséquent, aucun ajustement de dose n'est nécessaire sur la base de ces facteurs liés au patient.
Troubles de la fonction hépatique
Dans la polyarthrite rhumatoïde et la dermatite atopique, une insuffisance hépatique modérée n'a pas eu d'effet sur la pharmacocinétique du baricitinib. Aucune adaptation de dose n'est donc nécessaire chez les patients ayant une insuffisance hépatique légère ou modérée. L'utilisation de baricitinib n'a pas été étudiée chez les patients présentant une insuffisance hépatique sévère et n'est donc pas recommandée chez ces patients.
Dans la COVID-19, le baricitinib n'a pas été étudié chez des patients présentant une insuffisance hépatique sévère.
Troubles de la fonction rénale
La fonction rénale a eu un effet significatif sur l'exposition au baricitinib. Chez les sujets avec insuffisance rénale légère, modérée et sévère, l'AUC0-inf a augmenté respectivement de 1.41, 2.22 et 4.05 fois par rapport aux sujets avec fonction rénale normale. La demi-vie a été prolongée de 8.4 heures chez les sujets avec fonction rénale normale à 19 h chez les sujets avec insuffisance rénale sévère. Par contre l'effet de fonction rénale sur le Cmax du baricitinib a été faible. La dose recommandée de baricitinib est de 2 mg une fois par jour chez les patients ayant un taux de filtration glomérulaire estimé entre 30 et 60 ml/min/1.73 m2. L'administration d'Olumiant n'est pas recommandée chez les patients ayant un taux de filtration glomérulaire estimé inférieur à 30 ml/min/1.73 m2.
Patients âgés
L'âge n'a pas eu d'effet sur l'exposition au baricitinib (Cmax et AUC).
Données précliniquesLes organes cibles de la toxicité qui ont été associés à l'effet pharmacologique du baricitinib dans les études de toxicité avec administration répétée, comprennent la moelle osseuse, le sang périphérique et le tissu lymphoïde. Les effets primaires sur les paramètres sanguins, les organes lymphoïdes et la moelle osseuse, qui ont été associés à une immunosuppression, étaient généralement réversibles et liés à l'inhibition de JAK. Les marges de sécurité établies par ces effets immunosuppresseurs dans les études de toxicité générale étaient faibles.
Mutagénicité
Le baricitinib n'a été ni clastogène ni mutagène.
Carcinogénicité
La baricitinb n'a pas été carcinogène dans une étude de 6 mois chez des souris transgéniques rasH2 ni dans une étude de 2 ans chez le rat.
Toxicité sur la reproduction
Dans les études de développement embryofoetal chez le rat et le lapin, le barictinib s'est avéré être tératogène (malformations du squelette) et a réduit la croissance/le poids du fœtus à des doses correspondant à respectivement environ 10 et 39 fois l'exposition humaine (4 mg une fois par jour).
Le no-observed-adverse-effect level (NOAEL) pour le développement embryofoetal était de 2 mg/kg/jour chez le rat (correspondant à 2.2 fois l'exposition systémique chez l'homme avec une dose de 4 mg/jour) et de 10 mg/kg/jour chez le lapin (correspondant à 6 fois l'exposition systémique chez l'homme avec une dose de 4 mg/jour).
Dans une étude de fertilité combinée sur des rats mâles et femelles, le baricitinib a diminué les capacités d'accouplement globales (diminution des indices de fertilité et de conception). Chez les rats femelles, une diminution du nombre de corps jaunes et de sites d'implantation, une augmentation des pertes avant implantation et/ou d'effets indésirables sur la survie intrautérine des embryons ont été observées. Comme il n'a pas été observé d'effet sur la spermatogenèse (évaluée par histopathologie) ou sur les critères d'évaluation de la semence/du sperme chez les rats mâles, la diminution des capacités d'accouplement globales est sans doute due à ces effets sur les femelles. Le NOAEL pour la fertilité masculine était 15 mg/kg/jour (correspondant à 12 fois l'exposition systémique chez l'homme avec une dose de 4 mg/jour). Le NOAEL pour la fertilité féminine et le développement embryonnaire précoce était 5 mg/kg/jour chez le lapin (correspondant à 4 fois l'exposition systémique chez l'homme avec une dose de 4 mg/jour).
Le baricitinib a été détecté dans le lait de rats allaitantes. La relation entre la faible survie postnatale et le faible poids des petits observés dans une étude pré- et postanatale, et l'exposition au baricitinib pendant l'allaitement n'est pas claire, puisque les aimaux ont été exposés au baricitinib aussi pendant la gestation.
Dans une étude menée chez des rats juvéniles sur une période de traitement allant du jour 10 au jour 90 après la naissance, des effets sur les os, y compris dégénérescence / atrophie de la tête fémorale et du col du fémur, ainsi que sur le système immunitaire, ont été observés. Le NOAEL pour l'étude était de 1 mg/kg/jour.
Autres données (toxicité locale, phototoxicité, immunotoxicité)
Aucune évidence de phototoxicité n'a été trouvée pour le baricitinib.
Remarques particulièresStabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Remarques particulières concernant le stockage
Ne pas conserver au-dessus de 30°C.
Conserver hors de portée des enfants.
Remarques concernant la manipulation
Les comprimés peuvent être dispersés entiers ou être fractionnés pour la dispersion. Lors du fractionnement des comprimés, il faut veiller à appliquer des mesures de contrôle appropriées ou utiliser un équipement de protection personnelle.
·Placer les comprimés dans un récipient dans lequel se trouve au moins le volume d'eau minimal pour la dispersion (voir tableau ci-dessous) à température ambiante; remuer avec précaution pour les disperser.
·Administrer immédiatement.
·Rincer le récipient avec au moins le volume d'eau minimal (voir tableau ci-dessous) à température ambiante et administrer immédiatement.
Volumes de dispersion et de rinçage pour l'administration alternative
|
Administration par
|
Volume de dispersion
|
Volume de rinçage du récipient
| |
Dispersion orale
|
10 ml
(au moins 5 ml)
|
10 ml
(au moins 5 ml)
| |
Sonde G
|
15 ml
(au moins 10 ml)
|
15 ml
(au moins 10 ml)
| |
Sonde NG ou sonde OG
|
30 ml
|
15 ml
|
Avec les sondes NG ou les sondes OG dotées d'un FR de 8 ou plus petit, des obturations de la tubulure ont été observées.
Numéro d’autorisation66215 (Swissmedic).
PrésentationOlumiant 2 mg: 28 comprimés pelliculés (B)
Olumiant 4 mg: 28 comprimés pelliculés (B)
Titulaire de l’autorisationEli Lilly (Suisse) SA, 1214 Vernier/GE.
Mise à jour de l’informationJanvier 2024
|








