Propriétés/EffetsCode ATC
A10AE
Mécanisme d'action
Suliqua
Suliqua associe 2 agents anti-hyperglycémiques aux mécanismes d'action complémentaires: l'insuline glargine, analogue de l'insuline basale et le lixisénatide, agoniste du récepteur du GLP-1, qui ciblent respectivement le glucose plasmatique à jeun (FPG) et le glucose plasmatique postprandial (PPG) pour améliorer le contrôle de la glycémie chez les patients atteints du diabète de type 2, tout en réduisant au minimum la prise de poids et le risque d'hypoglycémie.
Insuline glargine
L'activité principale de l'insuline, y compris l'insuline glargine, consiste à réguler le métabolisme du glucose. L'insuline et ses analogues réduisent le glucose sanguin en stimulant l'absorption du glucose périphérique, en particulier par les muscles squelettiques et les graisses et en inhibant la production de glucose hépatique. L'insuline inhibe la lipolyse, la protéolyse et stimule la synthèse des protéines.
Lixisénatide
Le lixisénatide est un agoniste sélectif du récepteur du GLP-1. Le récepteur du GLP-1 est la cible du GLP-1 natif, hormone incrétine endogène qui renforce de façon glucose-dépendante la sécrétion d'insuline par les cellules bêta du pancréas.
L'action du lixisénatide résulte d'une interaction spécifique avec les récepteurs du GLP-1, entraînant une augmentation de la formation d'adénosine monophosphate cyclique (cAMP) intracellulaire. Le lixisénatide stimule la sécrétion d'insuline lorsque la glycémie augmente mais pas lorsqu'elle est normale, ce qui limite le risque d'hypoglycémie. En parallèle, la sécrétion du glucagon est inhibée. En cas d'hypoglycémie, le mécanisme de secours que constitue la sécrétion de glucagon est donc préservé.
Le lixisénatide ralentit la vidange gastrique, réduisant ainsi la vitesse à laquelle le glucose provenant des aliments apparaît dans la circulation sanguine. Cet effet sur la vidange gastrique pourrait aussi contribuer à la perte de poids.
Pharmacodynamique
Suliqua
L'association de l'insuline glargine et du lixisénatide n'a pas d'incidence sur la pharmacodynamie de l'insuline glargine. L'effet de l'association de l'insuline glargine et du lixisénatide sur la pharmacodynamie du lixisénatide n'a pas été étudié dans les études de phase I.
Conformément au profil de concentration de l'insuline glargine en fonction du temps, relativement constant sur 24 heures, sans pic prononcé lorsqu'elle est administrée seule, le profil du taux d'utilisation du glucose en fonction du temps était similaire, sans pic prononcé, après administration de l'association insuline glargine/lixisénatide.
Le temps d'absorption des insulines, y compris Suliqua, peut varier d'un individu à l'autre et également chez le même individu.
Insuline glargine
Les études cliniques sur l'insuline glargine (100 unités/ml) montrent que l'effet hypoglycémiant sur une base molaire (en d'autres termes lorsque le produit est administré aux mêmes doses) de l'insuline glargine intraveineuse est à peu près le même que celui de l'insuline humaine.
Lixisénatide
Une étude comparative versus placebo conduite sur 28 jours chez des diabétiques de type 2 a évalué les effets de 5 à 20 µg de lixisénatide administrés une fois par jour ou deux fois par jour, sur la glycémie induite par un repas d'épreuve standardisé pris au petit déjeuner. Les doses de 10 et 20 µg de lixisénatide, administrés une fois par jour ou deux fois par jour, ont amélioré le contrôle glycémique en réduisant les concentrations en glucose postprandiales et à jeun. Le lixisénatide administré dans cette étude le matin à la dose de 20 µg une fois par jour a maintenu des réductions statistiquement significatives de la glycémie postprandiale après le petit déjeuner, le déjeuner et le dîner.
Glucose postprandial
Une étude conduite sur 4 semaines chez des diabétiques de type 2 évaluant le lixisénatide en association avec la metformine et sur 8 semaines en association avec l'insuline glargine avec ou sans metformine, la dose de 20 µg de lixisénatide administrée une fois par jour avant le petit déjeuner, a démontré une réduction du glucose plasmatique postprandial (AUC 0:30-4:30h) après un repas test. Le nombre de patients chez qui le taux de glucose postprandial était inférieur à 7,77 mmol/l était de 69,3% après 28 jours et de 76,1% après 56 jours.
Sécrétion d'insuline
Une étude sur le lixisénatide administré en monothérapie a montré que le produit restaure à lui seul la première phase de sécrétion d'insuline chez les diabétiques de type 2 de manière glucose-dépendante par 2,8 fois (IC à 90%; 2,5-3,1) et augmente la sécrétion d'insuline de deuxième phase de 1,6 fois (IC à 90%; 1,4-1,7) par rapport au placebo d'après la mesure de l'AUC.
Vidange gastrique
Après un repas test standardisé, le lixisénatide ralentit la vidange gastrique et réduit ainsi la vitesse d'absorption du glucose postprandial. Après 28 jours de traitement sous lixisénatide administré en monothérapie, l'effet de ralentissement de la vidange gastrique est maintenu chez les diabétiques de type 2.
Sécrétion du glucagon
Le lixisénatide administré seul à raison de 20 µg une fois par jour a démontré une réduction des taux du glucagon postprandial par rapport aux taux de base après un repas test chez les diabétiques de type 2. Une étude de clamp hypoglycémique comparative versus placebo conduite chez des sujets sains évaluant l'effet d'une injection unique de 20 µg de lixisénatide sur la réponse du glucagon, a montré que la réponse du glucagon contre-régulatrice est préservée dans des conditions hypoglycémiques en présence de concentrations plasmatiques efficaces en lixisénatide.
Électrophysiologie cardiaque (QTc)
L'effet du lixisénatide sur la repolarisation cardiaque a été évalué dans une étude QTc (à 1,5 fois la dose d'entretien autorisée) qui n'a indiqué aucune conséquence pertinente du lixisénatide sur la repolarisation ventriculaire.
Fréquence cardiaque
Les études comparatives versus placebo de phase III sur Suliqua n'ont montré aucune augmentation de la fréquence cardiaque moyenne.
Efficacité clinique
La sécurité de Suliqua et son efficacité sur le contrôle de la glycémie ont été évaluées dans deux études cliniques randomisées conduites chez des diabétiques de type 2:
·Traitement d'appoint des antidiabétiques oraux (ADO) [patients n'ayant jamais reçu d'insuline]
·Patients précédemment sous insuline basale
Dans chacun des essais comparatifs avec substance active, le traitement sous Suliqua a produit des améliorations cliniquement et statistiquement significatives de l'hémoglobine A1c (HbA1c).
Par rapport à l'insuline glargine administrée seule, le traitement combiné a permis d'obtenir des taux d'HbA1c inférieurs et une réduction d'HbA1c plus importante sans augmenter les taux d'hypoglycémies (voir «Effets indésirables»).
Dans l'étude clinique du traitement d'appoint de la metformine, la dose initiale était de 10 doses unitaires. Dans l'étude clinique du traitement remplaçant l'insuline basale, la dose initiale était de 20 ou 30 doses unitaires, selon la dose antérieure d'insuline. Dans les deux études, la dose était ajustée une fois par semaine, selon les valeurs du glucose plasmatique à jeun mesurées par le patient.
·Traitement d'appoint des antidiabétiques oraux (ADO) [patients n'ayant jamais reçu d'insuline]
Étude clinique du diabète de type 2 insuffisamment équilibré sous ADO
Un total de 1 170 diabétiques de type 2 a été réparti de manière aléatoire dans une étude contrôlée versus traitement actif, conduite en ouvert sur 30 semaines en vue d'évaluer l'efficacité et la sécurité de Suliqua par rapport aux composants individuels, à savoir l'insuline glargine (100 unités/ml) et le lixisénatide.
Les diabétiques de type 2, recevant la metformine seule ou la metformine et un second ADO, c'est-à-dire une sulfonylurée ou un glinide ou un inhibiteur de SGLT-2 (sodium/glucose cotransporteur 2) ou un inhibiteur de la dipeptidyl peptidase-4 (DPP-4) et chez qui ce traitement ne permettait pas de contrôler correctement la glycémie (HbA1c de 7,5% à 10% chez les patients antérieurement sous metformine seule et 7,0% à 9% chez les patients antérieurement sous metformine et second antidiabétique oral) ont commencé une période de pré-inclusion de 4 semaines. Pendant cette phase de pré-inclusion, la metformine a été optimisée et les autres ADO ont été arrêtés. À la fin de la phase de pré-inclusion, les patients chez qui le contrôle glycémique restait insuffisant (HbA1c entre 7% et 10%) ont été répartis de manière aléatoire soit dans le groupe sous Suliqua, sous insuline glargine ou sous lixisénatide. Au total, 58% des patients recevaient un deuxième ADO au moment de la sélection.
Les diabétiques de type 2 présentaient les caractéristiques suivantes: l'âge moyen était de 58,4 ans, 50,6% des individus étaient des hommes, l'IMC moyen au départ était de 31,7 kg/m2 et le diabète remontait à environ 9 ans en moyenne.
Au bout de la 30ème semaine, Suliqua a produit une amélioration statistiquement significative du taux d'HbA1c (valeur p <0,0001) par rapport aux composants individuels. Dans une analyse préétablie de ce critère d'évaluation primaire, les différences observées ont été cohérentes au regard du taux d'HbA1c initial (<8% ou ≥8%) ou de l'utilisation d'ADO au départ (metformine seule ou metformine plus deuxième ADO).
Voir le tableau et la figure ci-dessous pour les autres critères d'évaluation de l'étude.
Résultats au bout de 30 semaines: étude clinique du traitement d'appoint de la metformine (population en mITT)
|
|
Suliqua
|
Insuline glargine
|
Lixisénatide
| |
Nombre de sujets (mITT)
|
468
|
466
|
233
| |
HbA1c (%)
| |
Valeur initiale (moyenne; après pré-inclusion)
|
8,1
|
8,1
|
8,1
| |
Fin d'étude (moyenne)
|
6,5
|
6,8
|
7,3
| |
Variation par les moindres carrés par rapport à la valeur initiale (moyenne)
|
- 1,6
|
-1,3
|
-0,9
| |
Différence par rapport à l'insuline glargine
|
-0,3
|
| |
[intervalle de confiance à 95%]
|
[-0,4; -0,2]
|
| |
(valeur de p)
|
(<0,0001)
|
| |
Différence par rapport au lixisénatide
|
|
|
-0,8
| |
[intervalle de confiance à 95%]
|
|
|
[-0,9; -0,7]
| |
(valeur de p)
|
|
|
(<0,0001)
| |
Nombre de patients (%) parvenant à un taux d'HbA1c <7% à la semaine 30
|
345 (74%)
|
277 (59%)
|
77 (33%)
| |
Glucose plasmatique à jeun (mmol/l)
| |
Valeur initiale (moyenne)
|
9,88
|
9,75
|
9,79
| |
Fin d'étude (moyenne)
|
6,32
|
6,53
|
8,27
| |
Variation par les moindres carrés par rapport à la valeur initiale (moyenne)
|
-3,46
|
-3,27
|
-1,50
| |
Variation par les moindres carrés par rapport à l'insuline glargine (moyenne)
|
-0,19
|
|
| |
[IC à 95%]
|
[-0,420 à 0,038]
|
|
| |
(valeur de p)
|
(0,1017)
|
|
| |
Variation par les moindres carrés par rapport au lixisénatide (moyenne)
|
-1,96
|
|
| |
[IC à 95%]
|
[-2,246 à -1,682]
|
|
| |
(valeur de p)
|
(<0,0001)
|
|
|
|
|
Suliqua
|
Insuline glargine
|
Lixisénatide
| |
Nombre de sujets (mITT)
|
468
|
466
|
233
| |
GPP 2 heures (mmol/l)
| |
[excursion glycémique 2 heures* (mmol/L)]
| |
Variation par les moindres carrés de la valeur initiale à la semaine 30
|
-5,68
|
-3,31
|
-4,58
| |
(moyenne)
|
[-2,31]
|
[-0,18]
|
[-3,23]
| |
Poids corporel moyen (kg)
| |
Valeur initiale (moyenne)
|
89,4
|
89,8
|
90,8
| |
Variation par les moindres carrés par rapport à la valeur initiale (moyenne)
|
-0,3
|
1,1
|
-2,3
| |
Comparaison versus insuline glargine
|
|
-1,4
|
| |
[intervalle de confiance à 95%]
|
|
[-1,9 à -0,9]
|
| |
(valeur de p)
|
|
(<0,0001)
|
| |
Comparaison versus lixisénatide [intervalle de confiance à 95%]
|
|
|
2,01
[1,4 à 2,6]
| |
Nombre de patients (%) parvenant à un taux d'HbA1c <7,0% sans prise de poids au bout de la semaine 30
|
202
(43,2%)
|
117
(25,1%)
|
65
(27,9%)
| |
Pourcentage de différence par rapport à l'insuline glargine
|
|
18,1
|
| |
[intervalle de confiance à 95%]
|
|
[12,2 à 24,0]
|
| |
(valeur de p)
|
|
(<0,0001)
|
| |
Pourcentage de différence par rapport au lixisénatide [intervalle de confiance à 95%]
|
|
|
15,2
[8,1 à 22,4]
| |
Prise quotidienne d'insuline glargine
| |
Variation par les moindres carrés de la dose d'insuline au bout de la semaine 30 (moyenne)
|
39,8
|
40,5
|
N/A
|
* PPG 2 heures moins la valeur du glucose avant le repas
Taux d'HbA1c (%) moyen au début de la sélection, au moment de la randomisation et à chaque point dans le temps (sujets allant au terme de l'étude) et à la semaine 30 (LOCF*) - population en mITT
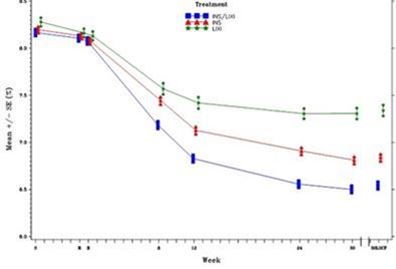
* LOCF = Last observation carried forward ou dernières observations disponibles
Les patients sous Suliqua ont montré une réduction statistiquement significative
du profil moyen du glucose plasmatique auto-mesurée (SMPG) à 7 points entre le début et la semaine 30 (-3,35 mmol/l) par rapport aux patients sous insuline glargine
(-2,66 mmol/l; différence -0,69 mmol/l) et par rapport aux patients sous lixisénatide
(-1,95 mmol/l; différence -1,40 mmol/l) (p <0,0001 pour les deux comparaisons).
À tous les points dans le temps, les valeurs moyennes du glucose plasmatique sur 30 semaines étaient plus faibles dans le groupe sous Suliqua que dans le groupe sous insuline glargine ou sous lixisénatide, sauf en ce qui concerne la valeur avant le petit déjeuner qui était semblable entre le groupe sous Suliqua et le groupe sous insuline glargine.
·Patients précédemment sous insuline basale
Études cliniques du diabète de type 2 insuffisamment équilibré sous insuline basale
Un total de 736 diabétiques de type 2 a participé à une étude multicentrique randomisée en groupes parallèles, à deux bras, contrôlée versus traitement actif, conduite en ouvert sur 30 semaines en vue d'évaluer l'efficacité et la sécurité de Suliqua par rapport à l'insuline glargine (100 unités/ml).
Les patients sélectionnés avaient un diabète de type 2 et recevaient de l'insuline basale depuis au moins 6 mois à une dose quotidienne stable comprise entre 15 et 40 U, seule ou associée à un ou deux ADO (metformine ou une sulfonylurée ou un glinide ou un inhibiteur de SGLT-2 ou un inhibiteur de DPP-4). Ils présentaient un taux d'HbA1c compris entre 7,5% et 10% et une glycémie à jeun inférieure ou égale à 10,0 mmol/l ou 11,1 mmol/l, selon le traitement antidiabétique antérieur.
Après la sélection, les patients éligibles (n = 1 018) ont entamé une phase de pré-inclusion de 6 semaines pendant laquelle ils sont restés ou sont passés à l'insuline glargine, lorsqu'ils prenaient une autre insuline basale, et leur dose d'insuline était ajustée/stabilisée tout en poursuivant la metformine (le cas échéant). Tout autre ADO était arrêté.
À la fin de la période de pré-inclusion, les patients avec un taux d'HbA1c compris entre 7 et 10%, une glycémie à jeun ≤7,77 mmol/l et une dose quotidienne d'insuline glargine de 20 à 50 unités, ont été randomisés dans le groupe sous Suliqua (n = 367) ou sous insuline glargine (n = 369).
Les diabétiques de type 2 présentaient les caractéristiques suivantes: l'âge moyen était de 60 ans, 46,7% des individus étaient des hommes, l'IMC moyen au moment de la sélection était d'environ 31 kg/m2 et le diabète remontait à environ 12 ans en moyenne.
Au bout de la 30ème semaine, Suliqua a produit une amélioration statistiquement significative du taux d'HbA1c (valeur p <0,0001) par rapport à l'insuline glargine.
Voir le tableau et la figure ci-dessous pour les autres critères d'évaluation de l'étude.
Résultats à 30 semaines: étude clinique du diabète de type 2 insuffisamment équilibré sous insuline basale (population en mITT)
|
|
Suliqua
|
Insuline glargine
| |
Nombre de sujets (mITT)
|
366
|
365
| |
HbA1c (%)
| |
Lors de la sélection (moyenne)
|
8,5
|
8,5
| |
Valeur initiale (moyenne; après pré-inclusion)
|
8,1
|
8,1
| |
Fin du traitement (moyenne)
|
6,9
|
7,5
| |
Variation par les moindres carrés par rapport à la valeur initiale (moyenne)
|
-1,1
|
-0,6
| |
Différence par rapport à l'insuline glargine
|
-0,5
| |
[intervalle de confiance à 95%]
|
[-0,6; -0,4]
| |
(valeur de p)
|
(<0,0001)
| |
Patients [n (%)] parvenant à un taux d'HbA1c <7% au bout de la semaine 30
|
201 (54,9%)
|
108 (29,6%)
| |
Glucose plasmatique à jeun (mmol/l)
| |
Valeur initiale (moyenne)
|
7,33
|
7,32
| |
Fin d'étude (moyenne)
|
6,78
|
6,69
| |
Variation par les moindres carrés par rapport à la valeur initiale (moyenne)
|
-0,35
|
-0,46
| |
GPP 2 heures (mmol/l) [excursion glycémique 2 heures* (mmol/L)]
| |
Variation par les moindres carrés de la valeur initiale à la semaine 30 (moyenne)
|
-4,72
[-3,90]
|
-1,39
[-0,47]
| |
Poids corporel moyen (kg)
| |
Valeur initiale (moyenne)
|
87,8
|
87,1
| |
Variation par les moindres carrés par rapport à la valeur initiale (moyenne)
|
-0,7
|
0,7
| |
Comparaison versus insuline glargine
|
-1,4
| |
[intervalle de confiance à 95%]
|
[-1,8 à -0,9]
| |
(valeur de p)
|
(<0,0001)
|
|
|
Suliqua
|
Insuline glargine
| |
Nombre de sujets (mITT)
|
366
|
365
| |
Nombre de patients (%) parvenant à un taux d'HbA1c <7,0% sans prise de poids à la semaine 30
|
125
(34,2%)
|
49
(13,4%)
| |
Pourcentage de différence par rapport à l'insuline glargine
|
20,8
| |
[intervalle de confiance à 95%]
|
[15,0 à 26,7]
| |
(valeur de p)
|
(<0,0001)
| |
Prise quotidienne d'insuline glargine
| |
Valeur initiale (moyenne)
|
35,0
|
35,2
| |
Critère d'évaluation (moyenne)
|
46,7
|
46,7
| |
Variation par les moindres carrés de la dose d'insuline à la semaine 30 (moyenne)
|
10,6
|
10,9
|
* PPG 2 heures moins la valeur du glucose avant le repas
Taux d'HbA1c (%) moyen au début de la sélection, à la randomisation et à chaque point dans le temps (sujets allant au terme de l'étude) et à la semaine 30 (LOCF*) - population en mITT
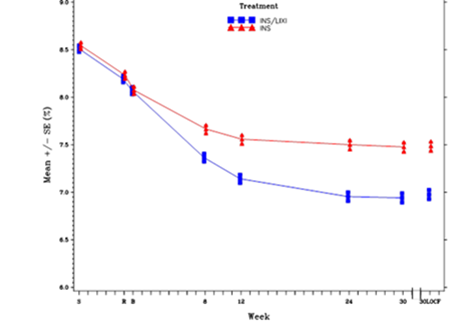
* LOCF = Last observation carried forward, ou dernières observations disponibles
Études sur l'évolution cardiovasculaire
La sécurité cardiovasculaire de l'insuline glargine et du lixisénatide a été établie respectivement dans les essais cliniques ORIGIN et ELIXA. Aucun essai sur l'évolution cardiovasculaire n'a été conduit avec Suliqua.
Insuline glargine
L'essai ORIGIN (Outcome Reduction with Initial Glargine Intervention) est une étude ouverte, randomisée, conduite chez 12 537 patients à haut risque cardiovasculaire (CV) et présentant une anomalie de la glycémie à jeun (AGJ), une intolérance au glucose ou un diabète de type 2 à un stade précoce, qui a comparé LANTUS au traitement standard au moment de la première occurrence d'un événement cardiovasculaire indésirable majeur (MACE). Le MACE se définissait comme un critère combiné associant décès d'origine cardiovasculaire, infarctus du myocarde non fatal et accident vasculaire cérébral non fatal. La durée médiane du suivi de l'étude était de 6,2 ans. L'incidence de MACE avec LANTUS et le traitement standard était similaire dans l'essai ORIGIN [hazard ratio (IC à 95%) pour MACE; 1,02 (0,94, 1,11)].
Lixisénatide
L'étude ELIXA multinationale, randomisée, en double aveugle, contrôlée versus placebo, a évalué les résultats cardiovasculaires (CV) pendant le traitement par lixisénatide chez des patients (n = 6068) diabétiques de type 2 ayant récemment présenté un syndrome coronarien aigu. Le critère combiné d'efficacité primaire était le temps écoulé avant la première apparition de l'un des événements suivants validés par le comité d'adjudication des événements cardiovasculaires: décès de cause cardiovasculaire, infarctus du myocarde non fatal, AVC non fatal ou hospitalisation pour angor instable. Parmi les critères secondaires d'évaluation CV figurait l'un des événements du critère d'évaluation principal, ou une hospitalisation pour insuffisance cardiaque ou pour revascularisation coronarienne. La durée médiane du suivi de l'étude était de 25,8 et 25,7 mois dans le groupe sous lixisénatide et le groupe sous placebo, respectivement.
L'incidence du critère d'évaluation primaire dans le groupe sous lixisénatide et le groupe sous placebo était similaire: le hazard ratio (HR) pour le lixisénatide contre placebo était de 1,017, avec un intervalle de confiance (IC) à 95% bilatéral associé de 0,886 à 1,168. Des pourcentages similaires entre les traitements ont aussi été observés pour les critères d'évaluation secondaires, et pour chacune des composantes individuelles des critères d'évaluation combinés. Les pourcentages de patients hospitalisés pour insuffisance cardiaque étaient de 4,0% et 4,2% dans le groupe sous lixisénatide et le groupe sous placebo, respectivement (HR [IC à 95%] = 0,96 [0,75 – 1,23]).
|


