Propriétés/EffetsCode ATC
N05AX16
Mécanisme d'action
REXULTI est un nouveau principe actif antipsychotique atypique, dont l'activité pharmacologique repose sur la modulation de l'activité sérotonine-dopamine. Bien que le mécanisme d'action précis du brexpiprazole dans le traitement de la schizophrénie ou de l'agitation dans la démence d'Alzheimer ne soit pas totalement connu, on suppose que la pharmacologie du brexpiprazole repose principalement sur l'association d'une haute affinité de liaison et d'une activité fonctionnelle sur plusieurs récepteurs monoaminergiques. Son effet modulateur sur les systèmes sérotoninergique et dopaminergique repose sur l'association d'une activité partiellement agoniste sur les récepteurs sérotoninergiques 5-HT1A et les récepteurs dopaminergiques D2 et d'une activité antagoniste sur les récepteurs sérotoninergiques 5-HT2A, les affinités pour tous ces récepteurs étant similaires et élevées (Ki : 0,1–0,5 nM).
Le brexpiprazole affiche en outre une activité antagoniste sur les récepteurs noradrénergiques α1B/2C dans la même zone Ki sous-nanomolaire (Ki : 0,2–0,6 nM). L'activité partiellement agoniste sur le récepteur 5HT1A/D2 combinée à l'activité antagoniste sur les récepteurs 5-HT2A et α1B/2C est susceptible de contribuer à l'effet antipsychotique du brexpiprazole.
Pharmacodynamique
Le brexpiprazole a une affinité élevée (Ki < 5 nM) pour plusieurs récepteurs monoarminergiques, notamment les récepteurs sérotoninergiques 5-HT1A, 5-HT2A, 5-HT2B et 5-HT7, les récepteurs dopaminergiques D2 et D3, ainsi que les récepteurs noradrénergiques α1A, α1B, α1D et α2C. Le brexpiprazole est un agoniste partiel des récepteurs 5-HT1A, D2 et D3 et un antagoniste des récepteurs 5-HT2A, 5-HT2B, 5-HT7, α1A, α1B, α1D et α2C.
Le brexpiprazole possède une faible activité intrinsèque sur les récepteurs dopaminergiques D2. Le brexpiprazole a une affinité modérée pour les récepteurs histaminiques H1 (19 nM) et une affinité très faible pour les récepteurs muscariniques M1 (inhibition de 67% à 10 µM). Le rapport dose/efficacité et le ratio d'exposition cerveau/plasma ont été déterminés dans des études précliniques in vivo ou ex vivo sur les récepteurs D2/D3, 5-HT2A, 5-HT1A, 5-HT6 et 5-HT7 ainsi que sur le transporteur de 5-HT. Les résultats concordent avec les affinités de liaison relatives in vivo et démontrent l'activité du brexpiprazole sur plusieurs points d'ancrage du système nerveux central en cas d'exposition plasmatique significative.
Dans une étude complète sur l'intervalle QTc menée auprès de patients atteints de schizophrénie ou d'un trouble schizo-affectif, REXULTI n'a pas provoqué d'allongement de l'intervalle QTcF après 12 jours à une dose thérapeutique (4 mg /jour) ou extra-thérapeutique (12 mg /jour). Aucune corrélation n'a été observée entre les concentrations en brexpiprazole et l'allongement de l'intervalle QTcF.
Efficacité clinique
Schizophrénie
L'efficacité de REXULTI dans le traitement de patients adultes atteints de schizophrénie selon les critères DSM-IV-TR a été démontrée dans deux études randomisées en double aveugle contrôlées par placebo sur 6 semaines à dose fixe (études 331-10-231 et 331-10-230) et dans une étude à long terme sur le traitement d'entretien (étude 331-10-232).
Pour les patients concernés, une hospitalisation ou un allongement de la durée d'hospitalisation pour le traitement d'une rechute aiguë de la schizophrénie s'est avérée bénéfique. Ils ont dû au préalable recevoir un traitement ambulatoire approprié par antipsychotiques et ont bien répondu à ce traitement (sauf à la clozapine) au cours des 12 derniers mois ayant précédé le début de l'étude.
Dans les études 331-10-231 und 331-10-230, les patients ont été randomisés aux doses journalières de REXULTI 2 mg ou 4 mg ou au placebo. Les patients des groupes REXULTI ont commencé le traitement à 1 mg une fois par jour le jour 1. Le jour 5, la dose de REXULTI a été augmentée à 2 mg une fois par jour. Le jour 8, la dose a été soit maintenue à 2 mg pendant les 5 semaines restantes de l'étude, soit augmentée à 4 mg une fois par jour selon le groupe de traitement.
Les études 331-10-231 und 331-10-230 comprenaient également deux groupes de traitement recevant une dose de REXULTI plus faible de 0,25 mg/jour et 1 mg/jour. Celles-ci n'ont toutefois pas été reprises dans l'analyse principale.
Le principal critère d'évaluation de l'efficacité des deux études était la modification du score global sur l'échelle PANSS (Positive and Negative Syndrome Scale) entre le départ et la semaine 6. L'échelle PANSS comporte 30 items et mesure les symptômes positifs (7 items) et négatifs (7 items) de la schizophrénie, ainsi que la physiopathologie générale (16 items). Chaque item est évalué sur une échelle de 1 (inexistant) à 7 (extrême). Le score global sur l'échelle PANSS s'étend de 30 (meilleur résultat) à 210 (pire résultat). Le principal critère d'évaluation secondaire des études était la modification de la valeur entre le départ et la semaine 6 sur l'échelle CGI-S (Clinical Global Impression – Severity of Illness Scale). CGI-S est une échelle validée, évaluée par le médecin, qui détermine l'état clinique actuel du patient en termes de gravité des symptômes. Les autres critères d'évaluation secondaires étaient entre autres l'échelle PSP (Personal and Social Performance Scale) validée et évaluée par le médecin, qui mesure les compétences personnelle et sociale.
Dans l'étude 331-10-231, REXULTI a été étudié aux deux posologies (2 mg/jour et 4 mg/jour) par rapport au placebo à l'aide du score global sur l'échelle PANSS (tableau 3). Dans l'étude 331-10-232, REXULTI a été étudié à la posologie de 4 mg/jour par rapport au placebo à l'aide du score global sur l'échelle PANSS (tableau 3). Pour la posologie de 2 mg/jour, seule l'étude 331-10-231 a démontré une efficacité statistiquement significative. L'analyse des groupes de population par âge, sexe et origine ethnique n'a pas démontré de différences de sensibilité de la réponse.
Le tableau 3 récapitule les résultats concernant le critère d'évaluation principal de l'efficacité pour les études 331-10-231 et 331-10-230.
Tableau 3: Principaux résultats d'efficacité pour les études sur 6 semaines concernant la schizophrénie (études 331-10-231 und 331-10-230)
|
|
Paramètre d'efficacité principal: PANSS
| |
Etude
|
Groupe de traitement
|
N
|
Valeur de départ moyenne (SD)
|
Ecart moyen LS par rapport à la valeur de départ (SE)
|
Différence LS moyennea (IC à 95%)
|
Valeur P
| |
331-10-231
|
REXULTI (2 mg/jour)*
|
180
|
95,85 (13,75)
|
-20,73 (1,55)
|
-8,7
(-13,1; -4,4)
|
<0,0001
| |
REXULTI (4 mg/jour)*
|
178
|
94,70 (1,06)
|
-19,65 (1,54)
|
-7,6
(-12,0; -3,1)
|
-0,0006
| |
Placebo
|
178
|
95,69 (11,46)
|
-12,01 (1,60)
|
--
|
-
| |
331-10-230
|
REXULTI
(2 mg/jour)
|
179
|
96,30 (12,91)
|
-16,61 (1,49)
|
-3.1
(-7,2; 1,1)
|
0,1448
| |
REXULTI (4 mg/jour)*
|
181
|
94,99 (12,38)
|
-20,00 (1,48)
|
-6.5
(-10,6; -2,4)
|
-0,0022
| |
Placebo
|
180
|
94,63 (12,84)
|
-13,53 (1,52)
|
--
|
-
|
SD: écart type; SE: erreur standard; LS: moindres carrés; IC: intervalle de confiance non ajusté.
* Supériorité statistiquement significative de REXULTI par rapport au placebo
a Différence (REXULTI moins placebo) de modification moyenne des moindres carrés entre la valeur de départ et à la semaine 6
REXULTI a été supérieur au placebo aux posologies de 2 mg/jour et 4 mg/jour concernant les critères d'évaluation secondaires (score CGI-S et score global sur l'échelle PSP). Les résultats des critères d'évaluation secondaires (scores CGI-S et PSP) confirment donc la supériorité de REXULTI par rapport au placebo et son effet cliniquement significatif.
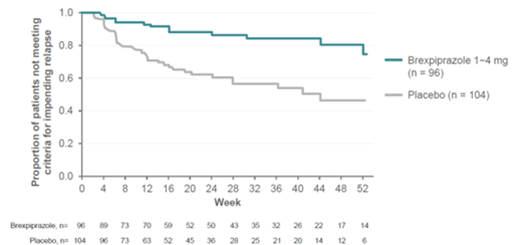
Une analyse intermédiaire établie précédemment a démontré que la durée avant rechute imminente était statistiquement significativement plus longue chez les patients randomisés dans le groupe REXULTI (1-4 mg/jour) que chez patients randomisés dans le groupe placebo (p = 0,0008, test Log-Rank). L'analyse finale a confirmé la durée statistiquement significativement plus longue avant rechute imminente pour les patients du groupe REXULTI par rapport au groupe placebo (p = 0,0001, Log-Rank Test). Les courbes de Kaplan-Meier du nombre cumulé de patients du dernier groupe d'analyse, ayant subi une rechute durant la phase de traitement en double aveugle dans les groupes REXULTI et placebo sont représentés dans l'illustration 1. Lors de l'analyse finale, le rapport de risque déduit du modèle de risque proportionnel de Cox était de 3,42 pour la comparaison entre le placebo et REXULTI (IC à 95%: 1,82; 6,41, taux de rechute 13,54% contre 38,46%). Les patients du groupe placebo présentaient donc un risque 3.42 fois plus élevé de rechute imminente que ceux du groupe REXULTI.
Illustration 1: Courbes de Kaplan-Meier concernant le temps avant rechute imminente (phase d'entretien en double aveugle - échantillon aléatoire d'efficacité) – analyse finale, étude 3
Agitation dans la démence d'Alzheimer
L'efficacité de REXULTI dans le traitement de l'agitation dans la démence d'Alzheimer (ADA) a été démontrée dans deux études randomisées en double aveugle contrôlées par placebo sur 12 semaines à dose fixe (études 331-12-283 et 331-14-213). Les patients de l'étude devaient satisfaire à un diagnostic de maladie d'Alzheimer probable selon les critères du National Institute of Neurological and Communicative Diseases and Stroke/Alzheimer's Disease and Related Disorders Association (NINCDS-ADRDA) et à un score de ≥5 à ≤22 sur l'échelle Mini-mental Examination (MMSE).
Lors de l'inclusion dans l'étude, les patients devaient présenter un score total de ≥4 pour l'item agitation/agressivité du NPI/NPI-NH (Neuropsychiatric Inventory-Nursing Home Version). Les patients devaient présenter au moment de l'inclusion dans l'étude un tel degré d'agitation qu'une pharmacothérapie était justifiée après exclusion d'autres causes.
Les patients atteints de la ADA qui n'avaient pas répondu à deux ou plusieurs antipsychotiques par le passé étaient exclus du programme de développement clinique REXULTI.
L'étude 331-12-283 incluait 433 patients âgés en moyenne de 74 ans (intervalle: 51 à 90 ans). L'étude 331-14-213 incluait 345 patients âgés en moyenne de 74 ans (intervalle: 56 à 90 ans).
Dans l'étude 331-12-283, 78 (18 %) des patients traités par REXULTI et 36 (8%) des patients traités par placebo présentaient des symptômes psychotiques avant le début de l'étude. Dans l'étude 331-14-213, 44 (19 %) des patients traités par REXULTI et 21 (18 %) des patients traités par placebo ont rapporté des antécédents de symptômes psychotiques.
Le principal critère d'évaluation de l'efficacité dans l'ensemble des études était la modification des scores sur l'échelle d'agitation de Cohen-Mansfield (Cohen-Mansfield Agitation Inventory, CMAI) entre l'inclusion et la semaine 12. Le CMAI est un questionnaire évalué par les médecins composé de 29 items qui évalue la fréquence des manifestations d'agitation chez les patients âgés en fonction des commentaires des soignants.
Les patients de l'étude 331-14-213 devaient remplir les critères du 1er facteur du CMAI (comportement agressif) en plus des critères généraux d'inclusion au début de l'étude. Pour cela, les patients doivent présenter l'une des caractéristiques suivantes: ≥1 type de comportement agressif plusieurs fois par semaine, ou ≥2 types de comportement agressif une ou deux fois par semaine, ou ≥3 types de comportement agressif moins d'une fois par semaine. Le terme de comportement agressif comprend les actions suivantes: donner des coups (y compris à soi-même), donner des coups de pied, griffer, agripper, bousculer, se blesser soi-même ou autrui, lancer des objets, jurer ou agresser verbalement, cracher, briser des objets ou détruire des biens, crier et mordre. De plus, dans l'étude 331-14-213, les patients devaient répondre au critère d'agitation chez les patients présentant des troubles cognitifs selon la définition consensuelle préliminaire de l'International Psychogeriatric Association (IPA) (2014).
Les patients de l'étude 331-12-283 ont été randomisés pour recevoir une dose fixe de REXULTI 1 mg une fois par jour, 2 mg une fois par jour ou un placebo. Dans cette étude, les patients recevant REXULTI 2 mg une fois par jour ont présenté une amélioration des scores CMAI à la semaine 12 par rapport aux patients recevant le placebo. Les patients de l'étude 331-14-213 ont été randomisés pour recevoir une dose fixe de REXULTI 2 mg ou 3 mg une fois par jour (bras de traitement combiné) ou un placebo. Dans cette étude, les patients recevant REXULTI 2 mg ou 3 mg une fois par jour ont présenté une amélioration des scores CMAI à la semaine 12 par rapport aux patients recevant le placebo.
Comme le montre le Tableau 4, la variation moyenne du score CMAI à la semaine 12 était significativement plus importante chez les patients traités par REXULTI 2 mg/jour ou 3 mg/jour que chez les patients sous placebo. À la dose de 1 mg une fois par jour, aucune variation significative du score CMAI par rapport à la valeur de référence n'a été observée dans cette population de patients.
Tableau 4: Modification du score global sur l'échelle CMAI à la semaine 12 par rapport au score de référence chez les patients agités atteints de la démence d'Alzheimer dans les études 331-12-283 et 331-14-213
|
Étude
|
Groupe de traitement
|
N
|
Valeur moyenne de référence
(SD)
|
Variation de la moyenne des moindres carrés (SE)
|
Différence entre les traitements†
(IC à 95 %)
| |
331-12-283
|
REXULTI 1 mg/jour
|
134
|
70,5 (16,0)
|
-17,6 (1,3)
|
0,2 (-3,4; 3,9)
| |
REXULTI 2 mg/jour‡
|
138
|
71,0 (16,6)
|
-21,6 (1,3)
|
-3,8 (-7,4; -0,2)
| |
Placebo
|
131
|
72,2 (17,9)
|
-17,8 (1,3)
|
—
| |
331-14-213*
|
REXULTI 2 mg/jour ou 3 mg/jour‡
|
225
|
80,6 (16,6)
|
-22,6 (1,1)
|
-5,3 (-8,8; -1,9)
| |
Placebo
|
116
|
79,2 (17,5)
|
-17,3 (1,4)
|
—
|
SD: écart-type, SE: erreur standard; IC: intervalle de confiance non ajusté
† Différence (médicament moins placebo) entre les variations des moyennes ajustées depuis la valeur de référence
‡ Supériorité statistiquement significative des posologies par rapport au placebo
* Échantillon d'efficacité enrichi (sujets atteints de la ADA avec un comportement agressif minimum défini comme critère CMAI facteur 1).
L'étude du critère d'évaluation principal dans les sous-groupes de population (selon l'âge, l'origine ethnique ou le sexe) n'a révélé aucune différence de réponse entre ces groupes.
Pour l'étude 331-14-213, une analyse de réaction post-hoc a été réalisée dans laquelle une variation cliniquement significative (Meaningful Within Patient Change, MWPC) sous brexpiprazole a été définie comme une variation du score global sur l'échelle CMAI à la semaine 12 d'au moins 20 points par rapport à la valeur de référence. La proportion de patients présentant un MWPC était de 57 % chez les patients traités par REXULTI et de 37 % chez les patients traités par placebo.
Données à long terme
Schizophrénie
L'étude à long terme (étude 331-10-232) était une étude randomisée en double aveugle contrôlée par placebo de mesure de l'efficacité, la sécurité et la tolérabilité de REXULTI 1-4 mg/jour comme traitement d'entretien chez l'adulte atteint de schizophrénie. Dans cette étude, la posologie du brexpiprazole a pu être ajustée à la discrétion de l'investigateur. La dose modale la plus fréquente pour les patients stabilisés randomisés dans le groupe du brexpiprazole était de 4 mg/jour (64 patients, 66%), suivie de 3 mg/jour (25 patients, 25.8%), 2 mg/jour (7 patients, 7.2%) et 1 patient (1%) a reçu une dose modale de 1 mg/jour.
Agitation dans la démence d'Alzheimer
Une étude d'extension en ouvert sur 12 semaines (étude 331-201-00182) évaluant la sécurité et la tolérance du brexpiprazole chez des patients souffrant d'agitation associée à une démence de type Alzheimer a mis en évidence des valeurs globales moyennes sur l'échelle CMAI similaires après 12 semaines de traitement chez des patients précédemment traités par brexpiprazole ou placebo dans l'étude contrôlée précédente. Pour différentes valeurs CMAI moyennes à l'inclusion (groupe brexpiprazole précédent 57,3 [SD 17,1] versus groupe placebo précédent 62,9 [18,1], la variation moyenne (SD) par rapport à l'inclusion était, comme prévu, plus importante chez les 86 sujets du groupe placebo précédent (-12,5 [SD 16,6]) que chez les 140 sujets du groupe brexpiprazole précédent (−7,1 [SD 12,3]).
|

