CompositionAimovig 70 mg/ml, 140 mg/ml
Principes actifs
Erenumabum (fabriqué par génie génétique en utilisant des cellules ovariennes de hamster chinois).
Excipients
Saccharum, Polysorbatum 80, Natrii hydroxidum corresp. à 0,2 mg/ml de sodium, Acidum aceticum glaciale, Aqua ad iniectabile.
Indications/Possibilités d’emploiTraitement prophylactique de la migraine chez l'adulte, pour autant qu'il soit indiqué.
Posologie/Mode d’emploiL'indication pour le traitement doit être posée par un médecin expérimenté dans le domaine du traitement de la migraine et celui-ci doit accompagner le patient dans le cadre de la poursuite du traitement. En cas de réponse thérapeutique insuffisante, ou au plus tard au bout de 12 mois, il convient de procéder à une réévaluation de la poursuite du traitement.
Afin d'assurer la traçabilité des médicaments biotechnologiques, il convient de documenter pour chaque traitement le nom commercial et le numéro de lot.
Une dose d'Aimovig de 70 mg sous forme d'injection sous-cutanée une fois par mois est recommandée.
Chez les patients montrant une efficacité insuffisante avec cette posologie, cette dernière peut être augmentée à 140 mg une fois par mois tant qu'une efficacité supérieure est ainsi démontrée.
Patients présentant des troubles de la fonction hépatique
Aucune étude clinique n'a été réalisée auprès de patients présentant des troubles de la fonction hépatique. Aucun ajustement de la posologie n'est recommandé chez les patients atteints d'insuffisance hépatique, car l'érénumab, une immunoglobuline G humaine, n'est pas métabolisé par les enzymes du cytochrome P450 et sa clairance n'est pas effectuée majoritairement par le foie.
Patients présentant des troubles de la fonction rénale
Aucun ajustement de la posologie n'est nécessaire chez les patients présentant un trouble léger à modéré de la fonction rénale. L'analyse pharmacocinétique de la population de données intégrées provenant des études cliniques avec Aimovig n'a montré aucune différence entre les patients présentant un trouble léger ou modéré et ceux ayant une fonction rénale normale en ce qui concerne la pharmacocinétique de l'érénumab. Les patients présentant un trouble sévère de la fonction rénale (DFGe < 30 ml/min/1,73 m2) n'ont pas été étudiés.
Patients âgés
Le nombre de patients de plus de 65 ans ayant été inclus dans les études cliniques n'est pas suffisant pour pouvoir affirmer si les patients de cet âge réagissent autrement que des patients plus jeunes. Un ajustement de la posologie n'est pas nécessaire, l'âge du patient n'ayant pas d'influence sur la pharmacocinétique de l'érénumab.
Enfants et adolescents
La sécurité et l'efficacité d'Aimovig pour les enfants et les adolescents n'ont pas été étudiées. Aimovig ne doit donc pas être utilisé dans cette catégorie d'âge.
Prise retardée
Au cas où une dose prévue a été oubliée, elle doit être administrée le plus rapidement possible et les injections suivantes doivent être planifiées mensuellement à partir de la date de la dernière injection.
Mode d'administration
Aimovig est destiné à l'auto-administration par le patient dans la paroi abdominale ou dans la cuisse. Il faut alterner les zones d'injection et l'injection ne doit pas être effectuée dans des zones où la peau est sensible, blessée, rougie, ou durcie. Les injections peuvent également être administrées dans le bras par une autre personne.
La personne administrant le médicament doit avoir été formée à la technique d'administration par un spécialiste. De plus amples instructions concernant le mode d'emploi figurent dans l'information destinée aux patients (notice d'emballage).
Contre-indicationsHypersensibilité au principe actif, l'érénumab, ou à l'un des excipients selon la composition.
Mises en garde et précautionsRéactions d'hypersensibilité
Des réactions d'hypersensibilité graves, y compris un rash, un angio-œdème et des réactions anaphylactoïdes, ont été rapportées avec Aimovig depuis sa commercialisation. Ces réactions peuvent survenir en l'espace de quelques minutes, certaines peuvent toutefois également apparaître plus d'une semaine après le traitement. Si une réaction d'hypersensibilité grave ou sévère survient, l'utilisation d'Aimovig doit immédiatement être arrêtée et un traitement approprié doit être initié.
Constipation accompagnée de complications graves
Aimovig peut provoquer des constipations accompagnées de sévères complications (voir «Effets indésirables»).
Les patients qui prennent Aimovig doivent donc faire l'objet d'une surveillance permettant de déceler les signes d'une constipation sévère et recevoir un traitement clinique approprié.
La prise concomitante de médicaments associés à une motilité gastro-intestinale réduite peut accroître le risque de constipation sévère et de complications potentielles.
Patients souffrant de maladies cardiovasculaires sévères
Les patients souffrant de certaines maladies cardiovasculaires sévères ont été exclus de la participation aux études cliniques. Il n'existe pas de données sur la sécurité pour ces patients.
Patients sensibles au latex
Le capuchon amovible du stylo prérempli Aimovig contient du latex de caoutchouc naturel sec qui peut provoquer des réactions allergiques chez les personnes sensibles au latex.
Sodium
Ce médicament contient moins de 1 mmol de sodium (23 mg) par stylo prérempli (70 mg/ml, 140 mg/ml), c'est-à-dire qu'il est essentiellement «sans sodium».
InteractionsLors d'une étude en ouvert portant sur les interactions médicamenteuses pharmacocinétiques entre Aimovig et un contraceptif oral d'association chez des sujets sains de sexe féminin, l'érénumab (140 mg par voie sous-cutanée [SC], dose unique) n'a eu aucune influence sur la pharmacocinétique d'un contraceptif oral d'association contenant de l'éthinylestradiol et du norgestimate.
Lors d'une étude randomisée, en double aveugle, contrôlée contre placebo chez des sujets sains, l'administration concomitante d'érénumab (140 mg par voie intraveineuse [IV], dose unique) et de sumatriptan par comparaison avec l'administration de sumatriptan seul n'a eu aucune influence sur la pression artérielle au repos. Aimovig n'a pas eu d'influence sur la pharmacocinétique du sumatriptan.
L'érénumab n'est pas métabolisé par les enzymes du cytochrome P450. Des interactions avec des médicaments concomitants qui sont des substrats, des inducteurs ou des inhibiteurs des enzymes du cytochrome P450 sont donc improbables.
Grossesse, allaitementGrossesse
Il n'existe pas de données suffisantes concernant l'emploi d'Aimovig chez la femme enceinte. Les expérimentations animales n'ont révélé aucun effet délétère direct ou indirect en ce qui concerne la toxicité sur la reproduction (voir «Données précliniques»).
Les expérimentations animales ne permettent pas toujours de prévoir la réaction chez l'être humain, on ignore donc si Aimovig est nocif pour le fœtus lorsqu'il est administré à une femme enceinte. Aimovig ne doit pas être utilisé pendant une grossesse, sauf en cas de nécessité absolue.
Allaitement
On ignore si Aimovig passe dans le lait maternel humain. Étant donné que de nombreux médicaments, entre autres les anticorps, sont éliminés dans le lait maternel, un risque pour le nouveau-né ou pour l'enfant en bas âge ne peut pas être exclu. La décision d'arrêter l'allaitement ou la prise d'Aimovig doit donc être prise en mettant en balance le bénéfice possible d'Aimovig pour la mère et celui de l'allaitement pour le nourrisson.
Fertilité
Il n'existe aucune donnée concernant l'effet d'Aimovig sur la fertilité chez l'être humain. Les expérimentations animales n'ont révélé aucun signe d'effets délétères concernant la fertilité (voir «Données précliniques»).
Effet sur l’aptitude à la conduite et l’utilisation de machinesAucune étude correspondante n'a été effectuée. Sur la base des données disponibles, on s'attend cependant à ce qu'Aimovig n'ait aucune influence sur l'aptitude à la conduite ou l'utilisation de machines.
Effets indésirablesPour l'évaluation de la sécurité d'Aimovig par comparaison à un placebo jusqu'à 12 semaines après le début du traitement, les données de deux études cliniques de phase 3 et de deux études cliniques de phase 2 sur la migraine ont été combinées.
2656 patients au total ont participé aux études contrôlées contre placebo. 1613 patients ont reçu Aimovig et 1043 patients ont reçu un placebo. Parmi ces premiers, 893 patients ont reçu une dose de 70 mg d'Aimovig et 507 patients ont reçu une dose de 140 mg d'Aimovig.
Le collectif total pour l'évaluation de la sécurité, y compris les patients se trouvant dans la phase d'extension en ouvert avec Aimovig, était de 2537 patients (3040,2 patients-années) ayant reçu au moins une dose d'Aimovig: 2280 patients ont été traités pendant au moins 6 mois, 1320 patients ont été traités pendant au moins 12 mois et 217 patients ont été traités pendant 5 ans. Le profil général de sécurité d'Aimovig est resté constant pendant les 5 années de la phase de traitement en ouvert.
Les fréquences sont définies comme suit:
«Très fréquents» (≥1/10), «fréquents» (< 1/10 à ≥1/100), «occasionnels» (< 1/100 à ≥1/1000), «rares» (< 1/1000 à > 1/10 000), «très rares» (< 1/10 000), «fréquence inconnue» (ne peut être estimée sur la base des données disponibles).
Affections du système immunitaire
Fréquence inconnue: réactions d'hypersensibilité, y compris rash, angio-œdème et réactions anaphylactoïdes (voir «Mises en garde et précautions»).
Affections gastro-intestinales
Fréquents: constipation (voir «Mises en garde et précautions» et «Description d'effets indésirables spécifiques»).
Affections de la peau et du tissu sous-cutané
Fréquents: démangeaisons.
Affections musculo-squelettiques et du tissu conjonctif
Fréquents: crampes musculaires.
Troubles généraux et anomalies au site d'administration
Fréquents: réactions au site d'injection (douleurs, érythème ou démangeaisons).
Effets indésirables après commercialisation
Affections du système immunitaire
Fréquence inconnue: réactions d'hypersensibilité, y compris rash, angio-œdème et réactions anaphylactoïdes (voir «Mises en garde et précautions»).
Affections vasculaires
Fréquence inconnue: hypertension (voir «Description d'effets indésirables spécifiques et informations complémentaires»).
Affections gastro-intestinales
Fréquence inconnue: des cas de constipation accompagnée de complications sévères ont été rapportés (voir «Mises en garde et précautions» et «Description d'effets indésirables spécifiques et informations complémentaires»).
Fréquence inconnue: ulcères dans la bouche (p.ex. stomatite, ulcération buccale, bulles buccales).
Affections de la peau et du tissu sous-cutané
Fréquence inconnue: alopécie.
Fréquence inconnue: rash (p.ex. rash papuleux, rash avec exfoliation, rash érythémateux, urticaire, vésication).
Description d'effets indésirables spécifiques et informations complémentaires
Immunogénicité
Lors des quatre études cliniques portant sur la prophylaxie de la migraine (20120178, 20120295, 20120296 et 20120297), l'incidence du développement d'anticorps contre l'érénumab pendant la phase de traitement en double aveugle a été de 6,3% (56/884) chez les patients sous traitement par 70 mg d'Aimovig (3 d'entre eux ont présenté une activité neutralisante in vitro) et de 2,6% (13/504) chez les patients sous traitement par 140 mg d'Aimovig (aucun d'entre eux n'a présenté d'activité neutralisante in vitro). En prenant en compte l'ensemble des données des 4 études jusqu'à la phase d'extension en ouvert, l'incidence du développement d'anticorps anti-érénumab était de 8,0% (185/2303) chez les patients ayant reçu seulement 70 mg ou 140 mg d'Aimovig tout au long de l'étude (8 d'entre eux ont présenté une activité neutralisante in vitro). Dans une étude en ouvert avec une durée de traitement allant jusqu'à 256 semaines, l'incidence du développement d'anticorps anti-érénumab était de 11,0% (25/225) chez les patients ayant reçu seulement 70 mg ou 140 mg d'Aimovig pendant toute l'étude (2 d'entre eux ont présenté une activité neutralisante in vitro). Le développement d'anticorps anti-érénumab n'a pas eu d'incidence sur l'efficacité ou la sécurité d'Aimovig.
L'incidence des anticorps anti-médicaments (ADA) dépend fortement de la sensibilité et de la spécificité du test. En outre, l'incidence de la positivité de l'anticorps observée (y compris les anticorps neutralisants) dans un test peut être influencée par plusieurs facteurs, par exemple par la méthodologie du test, la manipulation des échantillons, le moment du prélèvement des échantillons, les médicaments concomitants et la maladie de base. Par conséquent, la comparaison de l'incidence des anticorps anti-érénumab avec l'incidence des anticorps contre d'autres médicaments peut être fallacieuse.
Constipation
La constipation a été l'un des effets secondaires les plus fréquents observés dans les études cliniques rapportées au cours de la phase de 12 semaines contrôlée contre placebo (jusqu'à 3% des cas).
Tous les cas étaient de degré léger ou moyen. Après la commercialisation, des cas de constipation accompagnée de complications sévères ont en outre été rapportés. Certains cas ont nécessité une hospitalisation, y compris avec intervention chirurgicale. Pour la plupart des patients, la constipation est survenue après la première dose d'Aimovig. Cependant, des cas de constipation ont aussi été rapportés plus tard au cours du traitement. Le traitement par Aimovig a été interrompu dans la plupart des cas de grave constipation rapportés. Un grand nombre de ces cas concernaient des patients avec des antécédents de constipation ou qui utilisaient simultanément des médicaments associés à une motilité gastro-intestinale diminuée (voir «Mises en garde et précautions»).
Hypertension
Après la mise sur le marché, des cas d'hypertension et d'aggravation d'une hypertension préexistante ont été signalés. Nombre de ces cas ont été rapportés chez des patients présentant une hypertension préexistante ou un risque d'hypertension.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageIl n'existe aucune expérience de surdosage d'Aimovig lors des études cliniques. Lors des études cliniques, des doses allant jusqu'à 280 mg ont été administrées par voie sous-cutanée sans qu'une toxicité limitant la dose n'ait été constatée.
En cas de surdosage, la personne concernée doit être traitée de façon symptomatique et des mesures d'aides doivent être prises si besoin.
Propriétés/EffetsCode ATC
N02CD01
Mécanisme d'action/Pharmacodynamique
L'érénumab est un anticorps monoclonal antagoniste humain dirigé contre le récepteur du peptide lié au gène de la calcitonine (récepteur CGRP [calcitonin gene-related peptide]) sans effet pharmacologique important sur les récepteurs de l'adrénomédulline, de la calcitonine et de l'amyline et sans effet agoniste sur le récepteur CGRP.
Le CGRP est un neuropeptide qui module la transmission du signal nociceptif et un vasodilatateur qui a été associé à la physiopathologie de la migraine.
Le récepteur CGRP se situe sur des sites qui sont pertinents pour la physiopathologie de la migraine. L'érénumab entre en compétition de manière puissante et spécifique avec le CGRP en termes de liaison au récepteur CGRP et inhibe ainsi la fonction du CGRP au récepteur CGRP.
Lors d'une étude randomisée en double aveugle et contrôlée contre placebo (20140254) visant à évaluer l'efficacité d'Aimovig (140 mg par voie intraveineuse, dose unique) chez des patients atteints d'angine de poitrine stable, Aimovig n'a pas conduit à une diminution de la durée de l'effort lors du test du tapis roulant par comparaison au placebo et n'a pas entraîné d'aggravation de l'ischémie myocardique.
Efficacité clinique
Migraine chronique
Étude 20120295
Aimovig a été évalué dans le cadre d'une étude randomisée, multicentrique, d'une durée de 12 semaines, contrôlée contre placebo, en double aveugle sur la prophylaxie de la migraine chronique. En tout, 667 patients ayant un antécédent de migraine avec ou sans aura (≥15 jours de céphalées par mois, avec ≥8 jours de migraine par mois) ont été randomisés pour recevoir toutes les 4 semaines durant 12 semaines un placebo (n = 286), 70 mg d'Aimovig (n = 191) ou 140 mg d'Aimovig (n = 190) par injection sous-cutanée.
Au début de l'étude, la fréquence moyenne des migraines était d'environ 18 jours de migraine par mois et était similaire dans tous les groupes de traitement. Au cours de l'étude, les patients avaient le droit d'utiliser des traitements aigus contre les céphalées, par exemple des triptans, des dérivés de l'ergotamine et des AINS.
L'âge médian des patients était de 43 ans (tranche d'âge: 18–66 ans), 83% étaient de sexe féminin et 94% étaient blancs. Les patients ayant souffert d'un infarctus du myocarde, d'un accident vasculaire cérébral, d'accidents ischémiques transitoires, d'une angine de poitrine instable, subi un pontage coronarien ou autres procédures de revascularisation au cours des 12 derniers mois précédant la sélection ont été exclus de l'étude (20120295).
Le critère d'évaluation principal était la modification du nombre de jours de migraine par mois au mois 3 par rapport au début de l'étude. Les critères d'évaluation secondaires incluaient l'obtention d'une diminution du nombre de jours de migraine par mois de 50 à 100% (répondeur à ≥50%) par rapport au début de l'étude et la modification du nombre de jours par mois avec recours à une médication aiguë spécifique de la migraine par rapport au début de l'étude.
Illustration 1 Variation du nombre de jours de migraine par mois dans l'étude (20120295)
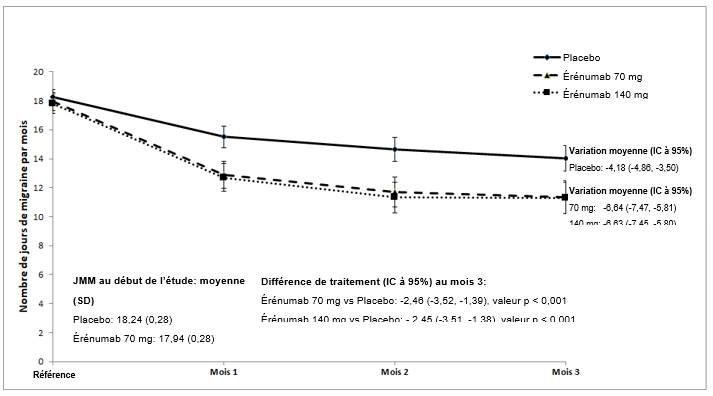
Sont indiqués les valeurs moyennes des moindres carrés et les intervalles de confiance à 95%.
La valeur p pour la différence des moyennes des moindres carrés entre l'érénumab et le placebo lors de l'évaluation au mois 3 (critère d'évaluation principal) était < 0,001.
Tableau 1 Variations de l'efficacité et des résultats rapportés par les patients eux-mêmes à la semaine 12 par rapport au début de l'étude (référence) dans l'étude (20120295)
|
|
Aimovig 70 mg
(n = 188)
|
Aimovig 140 mg
(n = 187)
|
Placebo
(n = 281)
|
Différence de traitement/
Odds ratioc (IC à 95%)
|
valeur pa
| |
Répondeurs
JMM ≥50%c
pourcentage (%)
|
39,9
|
41,2
|
23,5
|
ORd
70 mg: 2,18 (1,46; 3,27)
140 mg: 2,34 (1,56; 3,51)
|
< 0,001
| |
Nombre de jours avec recours à une médication aiguë spécifique de la migraine (par mois)e
Variation moyenneb (IC à 95%)
|
-3,45
(-4,02, -2,87)
|
-4,13
(-4,70; -3,56)
|
-1,58
(-2,05; -1,11)
|
DT
70 mg: -1,86 (-2,60, -1,13)
140 mg: -2,55 (-3,28; -1,82)
|
< 0,001
| |
DT = différence de traitement, IC = intervalle de confiance; JMM = jours de migraine par mois, OR = odds ratio
a. Toutes les valeurs p sont indiquées en tant que valeurs p non ajustées qui, après ajustement en vue de la comparaison multiple, sont statistiquement significatives.
b. La variation des moyennes des moindres carrés par rapport au début de l'étude au mois 3, la différence de traitement et la valeur p reposent sur un modèle linéaire à effets mixtes prenant en compte le groupe de traitement, la valeur par mois au début de l'étude, les facteurs de stratification (région [Amérique du Nord vs Europe] et l'utilisation excessive de médicaments [disponible vs non disponible]), la visite planifiée et l'interaction entre le groupe de traitement et la visite planifiée sans imputation en cas de données manquantes.
c. Les répondeurs sont définis comme les patients qui parviennent à une diminution ≥50% du nombre de jours de migraine par mois par rapport au début de l'étude (référence).
d. L'odds ratio et la valeur p pour les répondeurs ≥50% au mois 3 reposent sur un test de Cochran-Mantel-Haenszel stratifié après imputation des données manquantes comme non-réponse (Non-response).
e. Des médicaments spécifiques de la migraine sont par exemple les triptans et les dérivés de l'ergotamine.
|
Migraine épisodique
Étude 20120296, STRIVE
L'étude (20120296) est une étude randomisée, multicentrique, d'une durée de 24 semaines, contrôlée contre placebo et en double aveugle visant à évaluer Aimovig comme traitement prophylactique de la migraine épisodique. En tout, 955 patients ayant un antécédent de migraine d'une durée supérieure ou égale à 12 mois, avec ou sans aura et 4 à 14 jours de migraine par mois ont été randomisés pour recevoir toutes les 4 semaines durant 24 semaines 70 mg d'Aimovig (n = 317), 140 mg d'Aimovig (n = 319) ou un placebo (n = 319) par injection sous-cutanée.
Au début de l'étude, la fréquence moyenne des migraines était d'environ 8 jours de migraine par mois et était similaire dans tous les groupes de traitement. Au cours de l'étude, les patients avaient le droit d'utiliser des traitements aigus contre les céphalées, par exemple des triptans, des dérivés de l'ergotamine et des AINS.
L'âge médian des patients était de 42 ans (18–65 ans), 85% étaient de sexe féminin et 89% étaient blancs. Les patients consommant des médicaments de manière abusive, les patients ayant souffert d'un infarctus du myocarde, d'un accident vasculaire cérébral, d'accidents ischémiques transitoires, d'une angine de poitrine instable, subi un pontage coronarien ou autres procédures de revascularisation au cours des 12 derniers mois précédant la sélection ont été exclus de la participation à l'étude (20120296).
Le critère d'évaluation principal était la modification des jours de migraine durant les mois 4 à 6 par rapport au début de l'étude. Les critères d'évaluation secondaires étaient entre autres l'obtention d'une diminution du nombre moyen des jours de migraine par mois de 50 à 100% (répondeur à ≥50%) par rapport au début de l'étude et la modification du nombre moyen de jours par mois avec recours à une médication aiguë spécifique de la migraine par rapport au début de l'étude.
Des différences par rapport au placebo ont déjà été observées au bout d'un mois.
Illustration 2 Variation du nombre de jours de migraine par mois dans l'étude (20120296)a
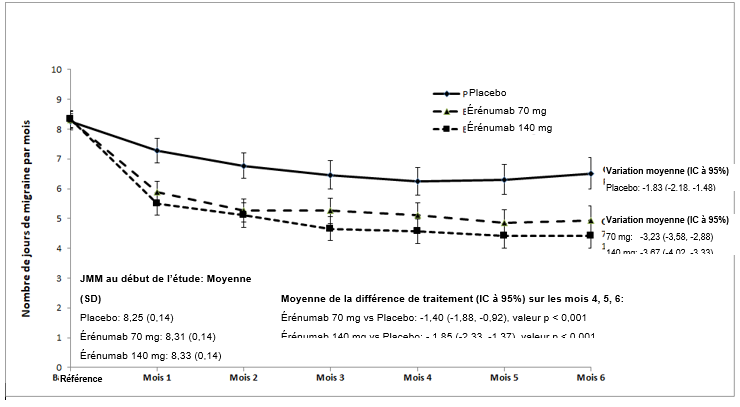
a Les indications sont les moyennes des moindres carrés et les intervalles de confiance à 95%.
La valeur p pour la différence des moyennes des moindres carrés entre l'érénumab et le placebo comme valeur moyenne des mois 4, 5 et 6 (variable de résultat principale) était < 0,001.
Tableau 2 Variations de l'efficacité et des résultats rapportés par les patients eux-mêmes par rapport au début de l'étude (référence) au cours des semaines 13 à 24 dans l'étude (20120296)
|
|
Aimovig 70 mg
(n = 312)
|
Aimovig 140 mg
(n = 318)
|
Placebo
(n = 316)
|
Différence de traitement/Odds ratio
(IC à 95%)
|
valeur pa
| |
Répondeurs JMM ≥50% c
pourcentage (%)
|
43,3
|
50,0
|
26,6
|
ORd
70 mg: 2,13 (1,52; 2,98)
140 mg: 2,81 (2,01; 3,94)
|
< 0,001
| |
Nombre de jours avec recours à une médication aiguë spécifique de la migraine par moise
Variation moyenneb
(IC à 95%)
|
-1,13
(-1,34; -0,92)
|
-1,61
(-1,83; -1,40)
|
-0,20
(-0,41; 0,02)
|
DT
70 mg:-0,94 (-1,23; -0,64)
140 mg: -1,42 (-1,71; -1,12)
|
< 0,001
| |
DT = différence de traitement, IC = intervalle de confiance; JMM = jours de migraine par mois, OR = odds ratio
a Toutes les valeurs p sont données en tant que valeurs p non ajustées qui, après ajustement en vue de la comparaison multiple, sont statistiquement significatives.
b La modification des moyennes des moindres carrés par rapport au début de l'étude au cours des mois 4 à 6, la différence de traitement et la valeur p reposent sur un modèle linéaire à effets mixtes prenant en compte le groupe de traitement, la valeur au début de l'étude, les facteurs de stratification (région [Amérique du Nord vs le reste du monde] et l'utilisation préalable de médicaments prophylactiques [pas d'utilisation, seulement une utilisation préalable, une utilisation concomitante]), la visite planifiée et l'interaction entre le groupe de traitement et la visite planifiée sans imputation en cas de données manquantes.
c Les répondeurs sont définis comme des patients qui parviennent à une diminution ≥50% du nombre de jours de migraine par mois par rapport au début de l'étude (référence).
d L'odds ratio et la valeur p pour des répondeurs ≥50% au cours des mois 4 à 6 reposent sur un test de Cochran-Mantel-Haenszel stratifié après imputation des données manquantes comme non-réponse (Non-response).
e Des médications spécifiques de la migraine sont par exemple les triptans et les dérivés de l'ergotamine.
|
Étude de suivi à long terme
Au terme d'une étude contrôlée contre placebo, au cours d'une phase de traitement en ouvert sur 5 ans (durée médiane: 2,0 ans), 383 patients ont d'abord reçu 70 mg d'érénumab; 250 d'entre eux ont augmenté leur dose à 140 mg (durée médiane: 2,7 ans). 214 ont achevé la phase de traitement en ouvert de 5 ans. Sur les 383 patients, 168 (43,9%) ont arrêté le traitement, les raisons les plus fréquentes ayant été le souhait du patient (84 patients; 21,9%), des événements indésirables (19 patients; 5,0%), une perte de vue lors du suivi («lost to follow-up ») (14 patients; 3,7%) et un manque d'efficacité (12 patients; 3,1%). Les résultats montrent que l'efficacité dans la phase de traitement en ouvert de l'étude a été maintenue pendant une durée maximale de 5 ans.
PharmacocinétiqueAbsorption
L'érénumab présente une cinétique non linéaire en raison de la liaison au récepteur CGRP. L'administration sous-cutanée d'une dose de 70 mg et 140 mg à des sujets sains a conduit à une valeur moyenne de Cmax (écart-type [standard deviation, SD]) de 6,1 [2,1] et 15,8 [4,8] µg/ml et à une valeur moyenne de l'AUClast [SD] de 159 [58] et de 505 [139] jour*µg/ml.
Les taux résiduels sériques après l'administration sous-cutanée de doses de 70 mg et 140 mg toutes les 4 semaines ont augmenté de moins du double (Cmin [SD] 5,7 [3,1] et 6,2 [2,9] µg/ml avec une posologie de 70 mg et Cmin [SD] 12,8 [6,5] et 14,9 [6,5] µg/ml avec une posologie de 140 mg chez des patients atteints de migraine épisodique ou chronique) et se sont rapprochés de l'état d'équilibre après une administration pendant 12 semaines.
Suite à l'administration sous-cutanée d'une dose unique de 70 mg ou de 140 mg d'Aimovig à des adultes sains, la durée médiane jusqu'au pic de concentration sérique a été d'environ 6 jours. La biodisponibilité absolue estimée sur la base de l'analyse pharmacocinétique de population était de 82%.
Distribution
Après administration intraveineuse d'une dose unique de 140 mg, le volume moyen de distribution (SD) pendant la phase terminale (Vz) a été estimé à 3,86 (0,77) litres.
Métabolisme
La demi-vie effective d'Aimovig estimée sur la base de l'analyse pharmacocinétique de population est de 28 jours.
Élimination
Deux phases d'élimination ont été observées pour Aimovig. À faibles concentrations, l'élimination d'Aimovig a lieu principalement par liaison saturable à la molécule cible (récepteur CGRP), à des concentrations plus élevées en grande partie par une voie d'élimination protéolytique non spécifique et non saturable.
Linéarité/non-linéarité
Après administration sous-cutanée mensuelle de doses de 70 et 140 mg, la pharmacocinétique d'Aimovig dans l'intervalle posologique est linéaire avec une augmentation de la concentration sérique proportionnelle à la dose.
Cinétique pour certains groupes de patients
L'analyse pharmacocinétique (PK) de population a permis de conclure que la pharmacocinétique de l'érénumab n'a été influencée dans aucun des groupes de patients autorisés en fonction de l'âge, du sexe, de l'ethnie, du sous-type de migraine (migraine épisodique ou chronique) ou du débit de filtration glomérulaire estimé (DFGe). Les patients présentant un dysfonctionnement rénal sévère (DFGe < 30 ml/min/1,73 m2) n'ont pas été étudiés.
Données précliniquesSur la base d'études conventionnelles de pharmacologie de sécurité, de la toxicité de dosages multiples et de la toxicité sur la reproduction et le développement, les données précliniques n'ont pas révélé de risque particulier pour l'homme.
Mutagénicité
Le potentiel de mutagénicité d'Aimovig n'a pas été étudié. Cependant, il est peu probable que des anticorps monoclonaux modifient l'ADN ou les chromosomes.
Carcinogénicité
Aucune étude sur la carcinogénicité n'a été effectuée avec Aimovig. Aimovig n'est pas actif pharmacologiquement chez les rongeurs, mais présente une activité biologique chez les singes cynomolgus; cette espèce animale n'est cependant pas un modèle approprié pour l'étude du risque de formation de tumeur.
Toxicité sur la reproduction
Lors d'une étude sur la reproduction réalisée chez des singes cynomolgus (étude sur le développement pré- et postnatal renforcé [ePPND, enhanced pre- and postnatal development]), aucune incidence sur la gestation et sur le développement embryo-fœtal ou postnatal (jusqu'à l'âge de 6 mois) n'a été constatée lorsque l'érénumab a été administré à des animaux pendant la gestation à des doses qui ont entraîné une exposition 17 fois plus élevée que celle obtenue chez des patients sous traitement avec 140 mg une fois par mois (en se basant sur la valeur de l'AUC sérique). Chez les singes nouveau-nés, l'érénumab a été détecté dans le sérum à la naissance, ce qui confirme que l'érénumab, comme d'autres anticorps IgG, traverse la barrière placentaire.
Autres données (toxicité locale, phototoxicité, immunotoxicité)
Lors d'études de toxicité chronique chez des singes sexuellement matures auxquels une dose allant jusqu'à 150 mg/kg d'Aimovig a été administrée par voie sous-cutanée deux fois par semaine sur une durée maximale de 6 mois, aucun effet indésirable n'a été constaté pour des expositions systémiques qui étaient jusqu'à 123 fois plus élevées que dans le cas de l'administration de la dose clinique de 140 mg toutes les 4 semaines (en se basant sur la valeur de l'AUC sérique). De plus, aucun effet indésirable sur des marqueurs de substitution pour la fertilité (modifications pathologiques et anatomiques ou histopathologiques au niveau des organes de reproduction) n'a été rapporté lors de ces études.
Remarques particulièresIncompatibilités
En l'absence d'études de compatibilité, ce médicament ne doit pas être mélangé à d'autres médicaments.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient. Le stylo prérempli est destiné à un usage unique.
Remarques particulières concernant le stockage
Conserver au réfrigérateur (2–8 °C).
Conserver le stylo prérempli dans l'emballage d'origine, dans son carton, pour le protéger de la lumière.
Conserver hors de portée des enfants.
Après avoir retiré Aimovig du réfrigérateur, il peut être conservé à température ambiante (15–25 °C) et doit ensuite être utilisé dans un délai de 7 jours. Aimovig ne doit pas être remis au réfrigérateur après avoir atteint la température ambiante.
Remarques concernant la manipulation
Le liquide doit être contrôlé avant l'utilisation. Ne pas injecter si le liquide est trouble ou nettement jaune ou s'il contient des flocons ou des particules.
Avant l'administration sous-cutanée, Aimovig doit être placé au moins 30 minutes à température ambiante.
Ne pas agiter la préparation.
Numéro d’autorisation66748 (Swissmedic)
PrésentationSolution injectable en stylo prérempli: 1 stylo prérempli à 70 mg ou 140 mg. [B]
Titulaire de l’autorisationNovartis Pharma Schweiz AG Risch; domicile: 6343 Rotkreuz
Mise à jour de l’informationSeptembre 2022
|


