Propriétés/EffetsCode ATC
N02CD01
Mécanisme d'action/Pharmacodynamique
L'érénumab est un anticorps monoclonal antagoniste humain dirigé contre le récepteur du peptide lié au gène de la calcitonine (récepteur CGRP [calcitonin gene-related peptide]) sans effet pharmacologique important sur les récepteurs de l'adrénomédulline, de la calcitonine et de l'amyline et sans effet agoniste sur le récepteur CGRP.
Le CGRP est un neuropeptide qui module la transmission du signal nociceptif et un vasodilatateur qui a été associé à la physiopathologie de la migraine.
Le récepteur CGRP se situe sur des sites qui sont pertinents pour la physiopathologie de la migraine. L'érénumab entre en compétition de manière puissante et spécifique avec le CGRP en termes de liaison au récepteur CGRP et inhibe ainsi la fonction du CGRP au récepteur CGRP.
Lors d'une étude randomisée en double aveugle et contrôlée contre placebo (20140254) visant à évaluer l'efficacité d'Aimovig (140 mg par voie intraveineuse, dose unique) chez des patients atteints d'angine de poitrine stable, Aimovig n'a pas conduit à une diminution de la durée de l'effort lors du test du tapis roulant par comparaison au placebo et n'a pas entraîné d'aggravation de l'ischémie myocardique.
Efficacité clinique
Migraine chronique
Étude 20120295
Aimovig a été évalué dans le cadre d'une étude randomisée, multicentrique, d'une durée de 12 semaines, contrôlée contre placebo, en double aveugle sur la prophylaxie de la migraine chronique. En tout, 667 patients ayant un antécédent de migraine avec ou sans aura (≥15 jours de céphalées par mois, avec ≥8 jours de migraine par mois) ont été randomisés pour recevoir toutes les 4 semaines durant 12 semaines un placebo (n = 286), 70 mg d'Aimovig (n = 191) ou 140 mg d'Aimovig (n = 190) par injection sous-cutanée.
Au début de l'étude, la fréquence moyenne des migraines était d'environ 18 jours de migraine par mois et était similaire dans tous les groupes de traitement. Au cours de l'étude, les patients avaient le droit d'utiliser des traitements aigus contre les céphalées, par exemple des triptans, des dérivés de l'ergotamine et des AINS.
L'âge médian des patients était de 43 ans (tranche d'âge: 18–66 ans), 83% étaient de sexe féminin et 94% étaient blancs. Les patients ayant souffert d'un infarctus du myocarde, d'un accident vasculaire cérébral, d'accidents ischémiques transitoires, d'une angine de poitrine instable, subi un pontage coronarien ou autres procédures de revascularisation au cours des 12 derniers mois précédant la sélection ont été exclus de l'étude (20120295).
Le critère d'évaluation principal était la modification du nombre de jours de migraine par mois au mois 3 par rapport au début de l'étude. Les critères d'évaluation secondaires incluaient l'obtention d'une diminution du nombre de jours de migraine par mois de 50 à 100% (répondeur à ≥50%) par rapport au début de l'étude et la modification du nombre de jours par mois avec recours à une médication aiguë spécifique de la migraine par rapport au début de l'étude.
Illustration 1 Variation du nombre de jours de migraine par mois dans l'étude (20120295)
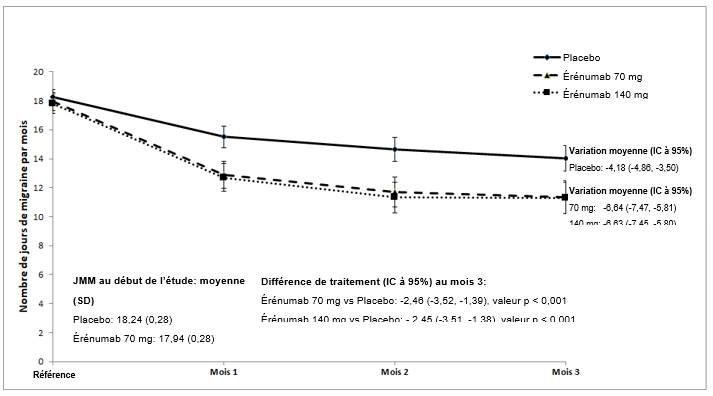
Sont indiqués les valeurs moyennes des moindres carrés et les intervalles de confiance à 95%.
La valeur p pour la différence des moyennes des moindres carrés entre l'érénumab et le placebo lors de l'évaluation au mois 3 (critère d'évaluation principal) était < 0,001.
Tableau 1 Variations de l'efficacité et des résultats rapportés par les patients eux-mêmes à la semaine 12 par rapport au début de l'étude (référence) dans l'étude (20120295)
|
|
Aimovig 70 mg
(n = 188)
|
Aimovig 140 mg
(n = 187)
|
Placebo
(n = 281)
|
Différence de traitement/
Odds ratioc (IC à 95%)
|
valeur pa
| |
Répondeurs
JMM ≥50%c
pourcentage (%)
|
39,9
|
41,2
|
23,5
|
ORd
70 mg: 2,18 (1,46; 3,27)
140 mg: 2,34 (1,56; 3,51)
|
< 0,001
| |
Nombre de jours avec recours à une médication aiguë spécifique de la migraine (par mois)e
Variation moyenneb (IC à 95%)
|
-3,45
(-4,02, -2,87)
|
-4,13
(-4,70; -3,56)
|
-1,58
(-2,05; -1,11)
|
DT
70 mg: -1,86 (-2,60, -1,13)
140 mg: -2,55 (-3,28; -1,82)
|
< 0,001
| |
DT = différence de traitement, IC = intervalle de confiance; JMM = jours de migraine par mois, OR = odds ratio
a. Toutes les valeurs p sont indiquées en tant que valeurs p non ajustées qui, après ajustement en vue de la comparaison multiple, sont statistiquement significatives.
b. La variation des moyennes des moindres carrés par rapport au début de l'étude au mois 3, la différence de traitement et la valeur p reposent sur un modèle linéaire à effets mixtes prenant en compte le groupe de traitement, la valeur par mois au début de l'étude, les facteurs de stratification (région [Amérique du Nord vs Europe] et l'utilisation excessive de médicaments [disponible vs non disponible]), la visite planifiée et l'interaction entre le groupe de traitement et la visite planifiée sans imputation en cas de données manquantes.
c. Les répondeurs sont définis comme les patients qui parviennent à une diminution ≥50% du nombre de jours de migraine par mois par rapport au début de l'étude (référence).
d. L'odds ratio et la valeur p pour les répondeurs ≥50% au mois 3 reposent sur un test de Cochran-Mantel-Haenszel stratifié après imputation des données manquantes comme non-réponse (Non-response).
e. Des médicaments spécifiques de la migraine sont par exemple les triptans et les dérivés de l'ergotamine.
|
Migraine épisodique
Étude 20120296, STRIVE
L'étude (20120296) est une étude randomisée, multicentrique, d'une durée de 24 semaines, contrôlée contre placebo et en double aveugle visant à évaluer Aimovig comme traitement prophylactique de la migraine épisodique. En tout, 955 patients ayant un antécédent de migraine d'une durée supérieure ou égale à 12 mois, avec ou sans aura et 4 à 14 jours de migraine par mois ont été randomisés pour recevoir toutes les 4 semaines durant 24 semaines 70 mg d'Aimovig (n = 317), 140 mg d'Aimovig (n = 319) ou un placebo (n = 319) par injection sous-cutanée.
Au début de l'étude, la fréquence moyenne des migraines était d'environ 8 jours de migraine par mois et était similaire dans tous les groupes de traitement. Au cours de l'étude, les patients avaient le droit d'utiliser des traitements aigus contre les céphalées, par exemple des triptans, des dérivés de l'ergotamine et des AINS.
L'âge médian des patients était de 42 ans (18–65 ans), 85% étaient de sexe féminin et 89% étaient blancs. Les patients consommant des médicaments de manière abusive, les patients ayant souffert d'un infarctus du myocarde, d'un accident vasculaire cérébral, d'accidents ischémiques transitoires, d'une angine de poitrine instable, subi un pontage coronarien ou autres procédures de revascularisation au cours des 12 derniers mois précédant la sélection ont été exclus de la participation à l'étude (20120296).
Le critère d'évaluation principal était la modification des jours de migraine durant les mois 4 à 6 par rapport au début de l'étude. Les critères d'évaluation secondaires étaient entre autres l'obtention d'une diminution du nombre moyen des jours de migraine par mois de 50 à 100% (répondeur à ≥50%) par rapport au début de l'étude et la modification du nombre moyen de jours par mois avec recours à une médication aiguë spécifique de la migraine par rapport au début de l'étude.
Des différences par rapport au placebo ont déjà été observées au bout d'un mois.
Illustration 2 Variation du nombre de jours de migraine par mois dans l'étude (20120296)a
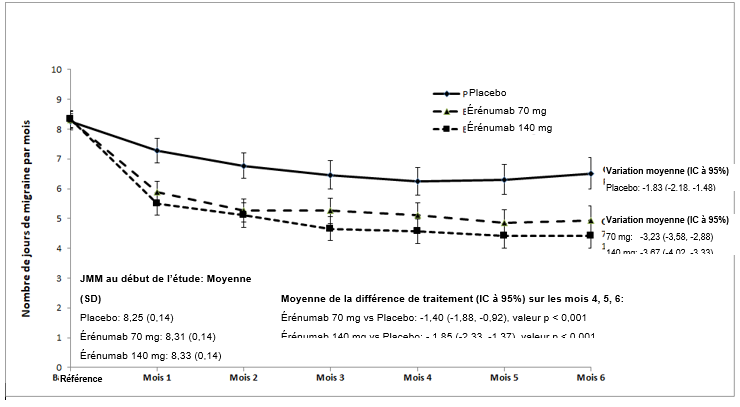
a Les indications sont les moyennes des moindres carrés et les intervalles de confiance à 95%.
La valeur p pour la différence des moyennes des moindres carrés entre l'érénumab et le placebo comme valeur moyenne des mois 4, 5 et 6 (variable de résultat principale) était < 0,001.
Tableau 2 Variations de l'efficacité et des résultats rapportés par les patients eux-mêmes par rapport au début de l'étude (référence) au cours des semaines 13 à 24 dans l'étude (20120296)
|
|
Aimovig 70 mg
(n = 312)
|
Aimovig 140 mg
(n = 318)
|
Placebo
(n = 316)
|
Différence de traitement/Odds ratio
(IC à 95%)
|
valeur pa
| |
Répondeurs JMM ≥50% c
pourcentage (%)
|
43,3
|
50,0
|
26,6
|
ORd
70 mg: 2,13 (1,52; 2,98)
140 mg: 2,81 (2,01; 3,94)
|
< 0,001
| |
Nombre de jours avec recours à une médication aiguë spécifique de la migraine par moise
Variation moyenneb
(IC à 95%)
|
-1,13
(-1,34; -0,92)
|
-1,61
(-1,83; -1,40)
|
-0,20
(-0,41; 0,02)
|
DT
70 mg:-0,94 (-1,23; -0,64)
140 mg: -1,42 (-1,71; -1,12)
|
< 0,001
| |
DT = différence de traitement, IC = intervalle de confiance; JMM = jours de migraine par mois, OR = odds ratio
a Toutes les valeurs p sont données en tant que valeurs p non ajustées qui, après ajustement en vue de la comparaison multiple, sont statistiquement significatives.
b La modification des moyennes des moindres carrés par rapport au début de l'étude au cours des mois 4 à 6, la différence de traitement et la valeur p reposent sur un modèle linéaire à effets mixtes prenant en compte le groupe de traitement, la valeur au début de l'étude, les facteurs de stratification (région [Amérique du Nord vs le reste du monde] et l'utilisation préalable de médicaments prophylactiques [pas d'utilisation, seulement une utilisation préalable, une utilisation concomitante]), la visite planifiée et l'interaction entre le groupe de traitement et la visite planifiée sans imputation en cas de données manquantes.
c Les répondeurs sont définis comme des patients qui parviennent à une diminution ≥50% du nombre de jours de migraine par mois par rapport au début de l'étude (référence).
d L'odds ratio et la valeur p pour des répondeurs ≥50% au cours des mois 4 à 6 reposent sur un test de Cochran-Mantel-Haenszel stratifié après imputation des données manquantes comme non-réponse (Non-response).
e Des médications spécifiques de la migraine sont par exemple les triptans et les dérivés de l'ergotamine.
|
Étude de suivi à long terme
Au terme d'une étude contrôlée contre placebo, au cours d'une phase de traitement en ouvert sur 5 ans (durée médiane: 2,0 ans), 383 patients ont d'abord reçu 70 mg d'érénumab; 250 d'entre eux ont augmenté leur dose à 140 mg (durée médiane: 2,7 ans). 214 ont achevé la phase de traitement en ouvert de 5 ans. Sur les 383 patients, 168 (43,9%) ont arrêté le traitement, les raisons les plus fréquentes ayant été le souhait du patient (84 patients; 21,9%), des événements indésirables (19 patients; 5,0%), une perte de vue lors du suivi («lost to follow-up ») (14 patients; 3,7%) et un manque d'efficacité (12 patients; 3,1%). Les résultats montrent que l'efficacité dans la phase de traitement en ouvert de l'étude a été maintenue pendant une durée maximale de 5 ans.
|


