CompositionPrincipes actifs
Tisagenlecleucel: lymphocytes T autologues génétiquement modifiés ex vivo au moyen d'un vecteur lentiviral codant pour un récepteur antigénique chimérique (CAR) ciblant CD19.
Excipients
·Solution d'électrolytes multiples pour injection, type 1, pH 7,4, 31,25% (v/v) (chlorure de sodium (1,97 mg/ml), chlorure de potassium (0,13 mg/ml), chlorure de magnésium (0,10 mg/ml), acétate de sodium (1,27 mg/ml), gluconate de sodium (1,73 mg/ml))
·Dextrose et chlorure de sodium pour injection, 31,25% (v/v) (dextrose (16,4 mg/ml), chlorure de sodium (1,48 mg/ml), 5'hydroxyméthylfurfural (0,00048 mg/ml))
·Dextran 40 (LMD) 10% dans dextrose à 5% pour injection, 10% (v/v) (dextran 40 (11,0 mg/ml), dextrose (5%) (5,0 mg/ml), 5'hydroxyméthylfurfural (0,00048 mg/ml))
·Albumine humaine 25%, 20% (v/v) (albumine (52,4 mg/ml), sodium (0,676 mg/ml), potassium (0,016 mg/ml), N-acétyltryptophanate (1,08 mg/ml), caprylate (0,630 mg/ml), aluminium (0,04 μg/ml))
·Diméthylsulfoxyde, 7,5% (v/v) (DMSO (82,5 mg/ml), diméthylsulfone (0,03 mg/ml))
Indications/Possibilités d’emploiKymriah est une thérapie immunocellulaire autologue dirigée contre CD19 pour les indications suivantes:
·Le traitement des patients pédiatriques et jeunes adultes jusqu'à l'âge de 25 ans atteints de leucémie aiguë lymphoblastique (LAL) à cellules B réfractaire, en rechute après greffe ou après deux lignes de traitement ou ultérieurement.
·Le traitement des adultes atteints de lymphome diffus à grandes cellules B (LDGCB) en rechute ou réfractaire après la deuxième ligne ou lignes ultérieures d'un traitement systémique.
·Le traitement des adultes atteints d'un lymphome folliculaire (LF) en rechute ou réfractaire après la troisième ligne ou les lignes ultérieures d'un traitement systémique.
Posologie/Mode d’emploiKymriah doit être administré dans un centre de traitement qualifié par le titulaire de l'autorisation. Le traitement doit être initié et mené sous la direction et la supervision d'un médecin ayant de l'expérience dans le traitement des hémopathies malignes et formé à l'administration et à la prise en charge des patients traités par Kymriah, y compris la maîtrise d'un éventuel syndrome de libération des cytokines (SLC).
Avant la perfusion, un minimum de deux doses de tocilizumab ainsi qu'un équipement d'urgence par patient et des possibilités adaptées de surveillance médicale intensive doivent être disponibles en prévision d'un éventuel syndrome de libération des cytokines. Le centre de traitement doit pouvoir accéder rapidement (dans un délai de 8 heures) à des doses supplémentaires de tocilizumab.
Kymriah est réservé à un usage autologue uniquement.
La préparation et la libération de Kymriah nécessitent habituellement environ 3 à 4 semaines. Dans certains cas, malgré la réussite de la leucaphérèse, un patient peut ne pas pouvoir être traité par Kymriah (pour plus de détails, voir «Propriétés/Effets»).
Pour administration intraveineuse uniquement. Ne pas utiliser de filtre de déleucocytation.
Traitement à usage unique.
Traitement préalable (chimiothérapie lymphodéplétive)
Avant l'initiation de la déplétion lymphocytaire, la disponibilité de Kymriah doit être confirmée. Il est recommandé, pour les indications LAL à cellules B et LDGCB, de perfuser Kymriah 2 à 14 jours après la fin de la chimiothérapie lymphodéplétive. Pour la LF, il est recommandé de perfuser Kymriah 2 à 6 jours après la fin de la chimiothérapie lymphodéplétive.
Une chimiothérapie lymphodéplétive peut ne pas être réalisée si le patient présente une cytopénie significative dans la semaine précédant la perfusion, à savoir si le nombre de globules blancs (GB) est inférieur à 1000 cellules/microlitre.
Lorsque plus de 4 semaines séparent la fin de la chimiothérapie lymphodéplétive et la perfusion de Kymriah et si le nombre de GB est > 1000 cellules/microlitre, le patient doit recevoir une nouvelle chimiothérapie lymphodéplétive avant la perfusion de Kymriah.
LAL à cellules B: le schéma posologique suivant est recommandé pour la chimiothérapie lymphodéplétive.
·Fludarabine (30 mg/m2/jour en IV pendant 4 jours) et cyclophosphamide (500 mg/m2/jour en IV pendant 2 jours à partir de la première administration de fludarabine).
Si le patient a présenté auparavant une cystite hémorragique de grade 4 pendant un traitement par le cyclophosphamide, ou s'il s'est avéré réfractaire à un traitement contenant du cyclophosphamide administré peu avant la chimiothérapie lymphodéplétive, le schéma posologique suivant doit alors être appliqué:
·Cytarabine (500 mg/m2/jour en IV pendant 2 jours) et étoposide (150 mg/m2/jour en IV pendant 3 jours à partir de la première administration de cytarabine).
LDGCB et LF: le schéma posologique suivant est recommandé pour la chimiothérapie lymphodéplétive.
·Fludarabine (25 mg/m2/jour en IV pendant 3 jours) et cyclophosphamide (250 mg/m2/jour en IV pendant 3 jours à partir de la première administration de fludarabine).
Si le patient a présenté auparavant une cystite hémorragique de grade 4 pendant un traitement par le cyclophosphamide, ou s'il s'est avéré réfractaire à un traitement contenant du cyclophosphamide administré avant la chimiothérapie lymphodéplétive, le schéma posologique suivant doit alors être appliqué:
·Bendamustine (90 mg/m2/jour en IV pendant 2 jours).
Évaluation clinique avant la perfusion
Le traitement par Kymriah doit être retardé chez certains patients à risque (voir «Mises en garde et précautions»).
Surveillance après la perfusion
Les signes et symptômes d'un potentiel syndrome de libération des cytokines, d'événements neurologiques et autres toxicités doivent être surveillés quotidiennement chez les patients au cours des 10 premiers jours suivant la perfusion. Les médecins doivent envisager une hospitalisation au cours des 10 premiers jours après la perfusion ou aux premiers signes ou symptômes de SLC et/ou d'événements neurologiques.
Après les 10 premiers jours suivant la perfusion, la surveillance du patient doit être réalisée à la discrétion du médecin.
Les patients doivent être informés de leur obligation de rester à proximité (à 2 heures de trajet) d'un établissement médical qualifié pendant au moins 4 semaines suivant la perfusion.
Si la plupart des cas de syndrome de libération des cytokines et de neurotoxicité de Kymriah surviennent pendant les quatre premières semaines suivant la perfusion, de tels cas pourraient également survenir ultérieurement et nécessiter un traitement.
Schéma thérapeutique
Kymriah est prévu pour un emploi unique.
Prémédication:
Afin de minimiser d'éventuelles réactions aiguës à la perfusion, il est recommandé d'administrer aux patients de l'acétaminophène/du paracétamol et de la diphénhydramine ou un autre antihistaminique H1 30 à 60 minutes avant la perfusion de Kymriah. Les corticostéroïdes ne doivent être utilisés à aucun moment, sauf en cas de situation mettant en jeu le pronostic vital (voir «Mises en garde et précautions»).
Posologie chez les patients enfants, les adolescents et les jeunes adultes atteints de LAL à cellules B
·Pour les patients pesant jusqu'à 50 kg: 0,2 à 5 × 106 lymphocytes T viables CAR-positifs/kg de poids corporel.
·Pour les patients pesant plus de 50 kg: 0,1 à 2,5 × 108 lymphocytes T viables CAR-positifs (indépendamment du poids corporel).
Posologie chez les patients atteints de LDGCB ou de LF:
·0,6 à 6 x108 lymphocytes T viables CAR-positifs (indépendamment du poids corporel).
Populations particulières de patients
Patients atteints d'affections hépatiques ou rénales
Kymriah étant un traitement à base de cellules, il n'est pas excrété par les reins ni par le métabolisme hépatique. Aucune étude n'a été réalisée avec des patients atteints d'affections hépatiques ou rénales.
Pédiatrie
Voir population cible générale
LAL à cellules B: aucune étude formelle n'a été réalisée chez les enfants de moins de 3 ans.
LDGCB: la sécurité d'emploi et l'efficacité de Kymriah chez les enfants et les adolescents âgés de moins de 18 ans n'ont pas encore été établies.
LF: la sécurité d'emploi et l'efficacité de Kymriah chez les enfants et les adolescents âgés de moins de 18 ans ne sont pas encore établies. Aucune donnée n'est disponible.
Patients âgés (à partir de 65 ans)
LAL à cellules B: la sécurité et l'efficacité de Kymriah dans cette population n'ont pas encore été établies.
LDGCB et LF: aucun ajustement posologique n'est requis chez les patients âgés de plus de 65 ans (voir «Propriétés/Effets»).
Patients séropositifs pour le virus de l'hépatite B (VHB), le virus de l'hépatite C (VHC), ou le virus de l'immunodéficience humaine (VIH)
Il n'existe aucune expérience en matière de préparation de Kymriah pour des patients testés positifs au VIH, à une infection active par le VHB ou le VHC. Ainsi, un produit de leucaphérèse provenant de ces patients n'est pas accepté pour la préparation de Kymriah. Procédez à un dépistage du VHB, du VHC et du VIH conformément aux lignes directrices cliniques avant de prélever des cellules en vue de la préparation.
Leucémie ou lymphome avec atteinte active du système nerveux central (SNC)
L'expérience de l'utilisation de Kymriah chez les patients présentant une leucémie ou un lymphome avec atteinte active du SNC est limitée. Par conséquent, le rapport bénéfice-risque de Kymriah n'a pas été étudié dans ces populations.
Mode d'administration
Kymriah doit être utilisé par voie intraveineuse exclusivement.
Précautions à prendre avant de manipuler et d'administrer Kymriah
Ce médicament contient des cellules sanguines humaines génétiquement modifiées. Les professionnels de santé manipulant Kymriah doivent donc, comme pour tout matériel d'origine humaine, prendre les précautions nécessaires (porter des gants et des lunettes de protection) afin d'éviter toute transmission de maladies infectieuses (voir «Remarques particulières»).
Préparation pour la perfusion
Confirmation de l'identité du patient: avant la perfusion de Kymriah, il convient de vérifier que l'identité du patient correspond aux informations propres au patient figurant sur la poche de perfusion de Kymriah.
Vérification et décongélation de la poche de perfusion: la décongélation et la perfusion de Kymriah doivent être coordonnées. L'heure de début de la perfusion doit être confirmée à l'avance, et la décongélation ajustée de sorte que Kymriah soit disponible pour la perfusion lorsque le receveur est prêt. Une fois que Kymriah est décongelé et qu'il est à température ambiante (20 °C-25 °C), il doit être perfusé dans les 30 minutes afin de maintenir au maximum la viabilité cellulaire du produit, en incluant toute interruption éventuelle au cours de la perfusion (voir «Remarques particulières», rubrique «Remarques concernant la manipulation»).
Administration
Du tocilizumab ainsi qu'un équipement d'urgence doivent être disponibles avant la perfusion et pendant la phase de récupération.
Kymriah doit être administré sous la forme d'une perfusion par voie intraveineuse au moyen d'une tubulure intraveineuse sans latex ne possédant pas de filtre de déleucocytation, au rythme d'environ 10 à 20 ml par minute, par écoulement par gravité; le rythme doit être adapté aux enfants et aux volumes plus petits. La totalité du contenu de la poche de perfusion doit être perfusée. Une solution de chlorure de sodium à 9 mg/ml (0,9%) pour injection doit être utilisée pour amorcer la tubulure avant la perfusion ainsi que pour la rincer après la perfusion. Lorsque le volume complet de Kymriah a été perfusé, la poche de perfusion doit être rincée avec 10 à 30 ml de solution de chlorure de sodium à 9 mg/ml (0,9%) pour injection par rétro-amorçage (back priming) pour s'assurer que le plus de cellules possible sont perfusées au patient.
Dans les études cliniques, l'injection sous pression par voie intraveineuse a constitué une méthode alternative pour l'administration de faibles doses de Kymriah (< 20 ml).
Contre-indicationsKymriah est contre-indiqué chez les patients présentant une hypersensibilité connue au tisagenlecleucel ou à l'un des excipients, notamment le diméthylsulfoxyde (DMSO) et le dextran 40 (voir «Mises en garde et précautions»).
Les contre-indications aux chimiothérapies lymphodéplétives doivent être prises en compte.
Mises en garde et précautionsMotifs entraînant le report du traitement
En raison des risques associés au traitement par Kymriah, la perfusion doit être retardée si un patient présente l'une des conditions suivantes:
·effets indésirables graves non résolus (en particulier atteintes pulmonaires, cardiaques ou hypotension artérielle) dus aux précédentes chimiothérapies;
·infection active non contrôlée;
·maladie du greffon contre l'hôte (GVH) active;
·aggravation clinique significative de la leucémie ou progression rapide du lymphome après la chimiothérapie lymphodéplétive.
Dons de sang, d'organes, de tissus ou de cellules
Les patients traités par Kymriah ne doivent pas effectuer de dons de sang, d'organes, de tissus, de sperme, d'ovocytes ni de cellules.
Information des patients
Avant la perfusion, il conviendra d'informer précisément le patient de la nécessité de contacter son médecin immédiatement en cas d'apparition de symptômes d'un syndrome de libération des cytokines (SLC) ou de symptômes neurologiques après la perfusion de Kymriah. Le patient doit, en outre, être informé qu'il doit rester à moins de 2 heures de route du lieu où il a reçu le traitement par Kymriah, et ce pendant au moins 4 semaines.
Il conviendra aussi de porter à l'attention du patient que bien que la plupart des SLC et des symptômes neurologiques surviennent pendant les quatre premières semaines suivant la perfusion, de tels effets indésirables et d'autres effets indésirables peuvent aussi se produire à tout moment et nécessiter un traitement.
Syndrome de libération des cytokines (SLC)
Des cas de syndrome de libération des cytokines, y compris des événements ayant engagé le pronostic vital ou fatals, ont été observés fréquemment après perfusion de Kymriah. Dans presque tous les cas, le SCL s'est produit entre 1 et 10 jours (délai d'apparition médian de 3 jours) après la perfusion de Kymriah chez les patients pédiatriques et jeunes adultes atteints d'un LAL à cellules B, entre 1 et 9 jours (délai d'apparition médian de 3 jours) après la perfusion de Kymriah chez les patients adultes atteints de LDGCB et entre 1 et 14 jours (délai d'apparition médian de 4 jours) après la perfusion de Kymriah chez les patients adultes atteints de LF. Le délai de résolution médian des symptômes de SLC était de 8 jours pour le LAL à cellules B, de 7 jours chez les patients atteints de LDGCB et de 4 jours chez les patients atteints de LF.
Les symptômes du SLC peuvent inclure une fièvre élevée, une hypotension, une hypoxie, une dyspnée, une tachypnée, une tachycardie, de la fatigue, des céphalées, des frissons, des myalgies, des arthralgies, des nausées, des vomissements, de la diarrhée, une hyperhidrose, un rash et une anorexie. Des défaillances d'organes incluant une insuffisance cardiaque, une insuffisance rénale et des lésions hépatiques accompagnées d'une augmentation de l'aspartate aminotransférase (ASAT), d'une augmentation de l'alanine aminotransférase (ALAT) ou d'une augmentation de la bilirubine peuvent également être observées. Dans certains cas, une coagulation intravasculaire disséminée (CIVD) avec de faibles taux de fibrinogène, un syndrome d'hyperperméabilité capillaire (SHC), un syndrome d'activation des macrophages (SAM) et une lymphohistiocytose hémophagocytaire peuvent survenir dans le contexte d'un SLC. Il convient de surveiller étroitement l'apparition de signes ou symptômes de ces événements, y compris la fièvre, chez les patients.
Les facteurs de risque du SLC sévère (tempête de cytokines) chez les patients pédiatriques et jeunes adultes atteints de LAL à cellules B sont: une charge tumorale élevée avant la perfusion, une charge tumorale non contrôlée ou en phase d'accélération après la chimiothérapie lymphodéplétive, une infection active et une apparition précoce de fièvre ou du SLC après la perfusion de Kymriah. Une charge tumorale élevée avant la perfusion de Kymriah a été identifiée comme étant un facteur de risque de développement d'un SLC sévère chez les adultes atteints de LDGCB.
Pour toutes les indications, un traitement prophylactique et thérapeutique approprié des infections doit être administré, et il est nécessaire de s'assurer de la résolution complète de toutes les infections existantes. Des infections peuvent également survenir durant un SLC et augmenter le risque d'évolution fatale. Les paramètres de coagulation doivent être évalués fréquemment, conformément aux normes locales, et traités en conséquence, notamment en ce qui concerne le traitement par cryoprécipités ou concentrés de fibrinogène.
Traitement du SLC associé à Kymriah
Pour réduire le risque de complications du SLC ou pour traiter les complications du SLC, les patients traités par Kymriah peuvent recevoir un traitement à base d'un anti-interleukine-6 (par exemple, le tocilizumab). Ce traitement peut être complété par des corticoïdes, si nécessaire. Les stratégies de traitement du SLC peuvent reposer sur les dernières directives de l'American Society of Clinical Oncology (ASCO) et/ou les directives institutionnelles/académiques locales correspondantes.
Avant la perfusion, un minimum de 2 doses de tocilizumab par patient doivent être disponibles pour administration au centre de perfusion. Le centre de traitement doit pouvoir accéder rapidement à des doses supplémentaires de tocilizumab. Le tisagenlecleucel poursuit son expansion et persiste après l'administration de tocilizumab et de corticostéroïdes.
Les patients présentant un dysfonctionnement cardiaque cliniquement significatif doivent être pris en charge conformément aux normes de soins intensifs et des mesures telles qu'une échocardiographie doivent être envisagées.
Les antagonistes du facteur de nécrose tumorale (anti-TNF) ne sont pas recommandés dans le traitement du SLC associé à Kymriah.
Événements neurologiques
Des événements neurologiques (également appelés syndrome de neurotoxicité associé aux cellules immunitaires effectrices [ICANS]), en particulier les signes et symptômes d'une encéphalopathie, un état confusionnel ou un délire, peuvent survenir fréquemment avec Kymriah et peuvent être sévères ou engager le pronostic vital. Les autres manifestations ont inclus des troubles de l'état de conscience, des crises convulsives, une aphasie et des troubles de la parole. La plupart des événements neurologiques sont survenus dans les 8 semaines suivant la perfusion de Kymriah et ont été transitoires. La durée médiane d'apparition des premiers événements neurologiques, qui sont apparus à tout moment après la perfusion de Kymriah, était de 8 jours pour la LAL à cellules B, de 6 jours pour le LDGCB et de 9 jours pour le LF. La durée médiane de résolution était de 7 jours pour la LAL à cellules B, de 13 jours pour le LDGCB et de 2 jours pour le LF.
Les événements neurologiques peuvent être concomitants avec le SLC, apparaître après la résolution du SLC ou en l'absence de SLC.
L'apparition d'événements neurologiques chez les patients doit être surveillée. Pour réduire le risque d'événements neurologiques (y compris, l'ICANS) (voir ci-dessus) ou pour traiter les événements neurologiques, les patients traités par Kymriah peuvent recevoir un traitement de soutien, qui se base sur les dernières directives de l'American Society of Clinical Oncology (ASCO) et/ou les directives institutionnelles/académiques locales correspondantes.
Infections et neutropénie fébrile
Les patients présentant une infection active non contrôlée ne doivent pas démarrer le traitement par Kymriah tant que l'infection n'est pas complètement résolue. Avant la perfusion de Kymriah, une prophylaxie anti-infectieuse doit être administrée conformément aux lignes directrices locales, sur la base du degré d'immunosuppression antérieure.
Des infections graves, y compris des infections ayant engagé le pronostic vital ou ayant été fatales, ont été observées fréquemment chez des patients après la perfusion de Kymriah. Chez les patients immunodéprimés, des cas d'infection opportunistes ayant engagé le pronostic vital ou ayant été fatales ont été rapportés, notamment des mycoses disséminées et une réactivation virale (par exemple, HHV-6 et leucoencéphalopathie multifocale progressive [LEMP]). Chez les patients présentant des événements neurologiques, la possibilité d'une telle infection doit être envisagée et les mesures diagnostiques adaptées doivent être prises. Les patients doivent faire l'objet d'une surveillance afin de détecter l'apparition de signes et symptômes d'infection et de les traiter de manière appropriée. S'il y a lieu, une antibioprophylaxie doit être administrée et des examens de surveillance de la maladie avant et pendant le traitement par Kymriah doivent être réalisés. Les infections sont connues pour compliquer l'évolution et le traitement du SLC concomitant. Il convient de tenir compte de la possibilité d'infections opportunistes du système nerveux central chez les patients présentant des effets secondaires neurologiques et de réaliser les examens diagnostiques appropriés.
Une neutropénie fébrile pouvant être concomitante avec le SLC a été observée fréquemment chez des patients après la perfusion de Kymriah. En cas de neutropénie fébrile, l'infection doit être évaluée et traitée de manière appropriée par des antibiotiques à large spectre, des solutés de remplissage, et d'autres traitements symptomatiques selon les indications médicales.
Chez les patients obtenant une rémission complète après la perfusion de Kymriah, les faibles taux d'immunoglobulines résultants peuvent accroître le risque d'infections. Une attention particulière doit être portée aux signes et symptômes d'infection, en tenant compte de l'âge du patient et des lignes directrices.
Cytopénies prolongées
Les patients peuvent continuer de présenter une cytopénie pendant plusieurs semaines après la chimiothérapie lymphodéplétive et la perfusion de Kymriah et doivent dans ce cas être traités conformément aux lignes directrices. Chez la majorité des patients ayant présenté une cytopénie au jour 28 après le traitement par Kymriah, la cytopénie avait régressé au grade 2 ou à un grade inférieur dans les trois mois suivant le traitement pour les patients pédiatriques atteints de LAL à cellules B ou de LDGCB et dans les 6 mois suivant le traitement pour les patients atteints de LF. Une neutropénie prolongée est associée à un risque d'infection accru. Les facteurs de croissance myéloïdes, en particulier les facteurs de stimulation de colonies de granulocytes et de macrophages (granulocyte macrophage colony stimulating factor, GM-CSF), peuvent aggraver les symptômes du syndrome de libération des cytokines et ne sont donc pas recommandés au cours des 3 premières semaines après la perfusion de Kymriah et jusqu'à résolution complète du SLC.
Cancers secondaires
Les patients traités par Kymriah peuvent développer des cancers secondaires ou une rechute de leur cancer. Des cancers à lymphocytes T sont apparus après le traitement d'hémopathies malignes par des immunothérapies autologues à base de lymphocytes T génétiquement modifiées dirigées contre BCMA et CD19, y compris Kymriah. Des tumeurs malignes à lymphocytes T, y compris les tumeurs CAR-positives, peuvent apparaître plusieurs semaines après la perfusion et peuvent également être mortelles. Les patients doivent être surveillés à vie pour détecter d'éventuelles tumeurs malignes secondaires, notamment celles qui proviennent des lymphocytes T. Dans le cas où un cancer secondaire survient, le titulaire de l'autorisation doit être contacté pour qu'il puisse donner des instructions sur la collecte d'échantillons du patient en vue de leur analyse.
Hypogammaglobulinémie
Une hypogammaglobulinémie (IgG) et une agammaglobulinémie (IgG) peuvent apparaître chez les patients après la perfusion de Kymriah. Les taux d'immunoglobulines doivent être surveillés après le traitement par Kymriah. Des mesures adaptées à l'âge et conformes aux lignes directrices, de type prophylaxie anti-infectieuse et antibioprophylaxie, ainsi que substitution des immunoglobulines, doivent être prises pour les patients dont les taux d'immunoglobulines sont faibles.
Vaccins vivants
La sécurité d'une vaccination avec des vaccins vivants pendant ou après le traitement par Kymriah n'a pas été évaluée. La vaccination par des vaccins vivants n'est pas recommandée pendant au moins 6 semaines avant le début d'une chimiothérapie lymphodéplétive, pendant le traitement par Kymriah, et jusqu'à récupération immunitaire après le traitement par Kymriah.
Syndrome de lyse tumorale
Un syndrome de lyse tumorale (SLT) pouvant être sévère a été observé occasionnellement. Afin de réduire le risque de SLT, les patients ayant un taux élevé d'acide urique ou une charge tumorale élevée doivent recevoir de l'allopurinol, ou une autre prophylaxie, avant la perfusion de Kymriah. Les signes et symptômes de SLT doivent faire l'objet d'une surveillance et les événements doivent être pris en charge conformément aux lignes directrices thérapeutiques.
Pathologies concomitantes
Les patients ayant des antécédents de troubles actifs du SNC ou une fonction rénale, hépatique, pulmonaire ou cardiaque limitée ont été exclus des études. Ces patients sont probablement plus vulnérables aux effets indésirables décrits ci-dessous et nécessitent donc une attention particulière.
Antécédent de greffe de cellules souches
L'administration de Kymriah n'est pas recommandée dans les 4 mois suivant une greffe de cellules souches (GCS) allogéniques, car il existe un risque potentiel d'aggravation d'une maladie du greffon contre l'hôte (GVH). La leucaphérèse pour la préparation de Kymriah devra être réalisée au moins 12 semaines après une GCS allogénique.
Réactivation de virus
Une réactivation de virus, comme p.ex. une réactivation du virus de l'hépatite B (VHB), peut se produire chez les patients traités par des médicaments dirigés contre les lymphocytes B et pourrait conduire à une hépatite fulminante, à une insuffisance hépatique ou au décès.
Traitement antérieur par un traitement anti-CD19
L'expérience concernant l'utilisation de Kymriah chez les patients précédemment exposés à une thérapie ciblée contre les CD19 est limitée. Kymriah n'est pas recommandé pour les patients qui ont développé une récidive avec leucémie CD19-négative après un traitement anti-CD19 antérieur.
Interférence avec les tests sérologiques
En raison d'une légère similitude de séquences génétiques courtes entre le vecteur lentiviral utilisé pour la préparation de Kymriah et le VIH, certains tests d'amplification d'acide nucléique (AAN) du commerce servant à la détection du VIH peuvent donner un résultat faux positif.
Risque pour le fœtus
Le tisagenlecleucel peut causer chez la mère une lymphopénie des lymphocytes B, qui peut représenter un risque pour le fœtus. Kymriah n'est donc pas recommandé chez la femme enceinte et la planification d'une éventuelle grossesse après le traitement par Kymriah doit faire l'objet d'une discussion avec le médecin traitant (voir «Grossesse, Allaitement»). Les femmes enceintes et les femmes en âge de procréer doivent être informées du risque possible pour le fœtus.
Teneur en sodium et potassium
Ce médicament contient 24,3 à 121,5 mg de sodium par unité de dosage, ce qui correspond à 1 à 6% de la quantité journalière maximale de 2 g de sodium apportée par l'alimentation recommandée par l'OMS pour un adulte.
Ce médicament contient du potassium; toutefois, il contient moins de 1 mmol (39 mg) de potassium par unité de dosage, c.-à-d. qu'il est pratiquement «sans potassium».
Teneur en dextran 40 et diméthylsulfoxyde (DMSO)
Ce médicament contient 11 mg de dextran 40 et 82,5 mg de diméthylsulfoxyde (DMSO) par ml. Des réactions d'hypersensibilité graves, notamment une anaphylaxie, ont été rapportées (voir «Effets indésirables»). Kymriah peut déclencher des réactions anaphylactiques après une administration par voie parentérale. Tous les patients doivent être observés attentivement pendant toute la durée de la perfusion.
InteractionsAucune étude d'interactions médicamenteuses pharmacocinétiques ou pharmacodynamiques évaluant le tisagenlecleucel n'a été réalisée. L'administration concomitante de médicaments connus pour inhiber la fonction des lymphocytes T n'a pas été étudiée. L'administration de faibles doses de corticostéroïdes dans le cadre du traitement du SLC n'impacte pas l'expansion et la persistance des cellules CAR-T. L'administration concomitante de médicaments connus pour stimuler les fonctions des lymphocytes T n'a pas été étudiée et les effets ne sont pas connus.
Grossesse, allaitementFemmes en âge de procréer/Contraception chez les hommes et les femmes
Chez les femmes en âge de procréer, un test de grossesse doit être réalisé avant de commencer le traitement par Kymriah.
Pour les patients recevant une chimiothérapie lymphodéplétive, consulter l'information professionnelle de la chimiothérapie lymphodéplétive administrée pour obtenir des informations concernant la nécessité d'une contraception efficace.
Les données d'exposition sont insuffisantes pour permettre une recommandation sur la durée de contraception après un traitement par Kymriah.
Les femmes en âge de procréer et actives sexuellement doivent utiliser une méthode de contraception fiable pendant la chimiothérapie préparatoire et jusqu'à 6 mois après l'administration de Kymriah (méthodes de contraception entraînant un taux de grossesse inférieur à 1%). Lorsqu'une grossesse est planifiée ou souhaitée, cela doit faire l'objet d'une discussion avec le médecin traitant.
Grossesse
Il n'existe pas de données sur l'utilisation de Kymriah chez la femme enceinte. Aucune étude n'a été conduite chez l'animal pour déterminer si Kymriah peut avoir un effet nocif sur le fœtus lorsqu'il est administré pendant la grossesse. On ne sait pas si Kymriah peut être transmis au fœtus. Compte tenu du mécanisme d'action, les cellules transduites pourraient induire une toxicité fœtale, notamment une lymphopénie des lymphocytes B, si elles traversaient la barrière placentaire. Les femmes enceintes doivent être informées du risque possible pour le fœtus. Kymriah n'est donc pas recommandé chez la femme enceinte. Une grossesse après un traitement par Kymriah doit faire l'objet d'une discussion avec le médecin traitant.
Les femmes enceintes ayant reçu Kymriah peuvent présenter une hypogammaglobulinémie. Une évaluation des taux d'immunoglobulines est indiquée chez les nouveau-nés dont la mère a été traitée par Kymriah.
Allaitement
On ne sait pas si les cellules de Kymriah sont excrétées dans le lait maternel. On ne peut exclure un risque pour le nouveau-né/nourrisson allaité. Les femmes qui allaitent doivent être averties du risque potentiel pour l'enfant allaité.
Après l'administration de Kymriah, l'allaitement doit faire l'objet d'une discussion avec le médecin traitant.
Fertilité
Aucune donnée n'est disponible concernant l'effet de Kymriah sur la fertilité.
Les effets de Kymriah sur la fertilité de l'homme et de la femme n'ont pas été évalués lors des études animales.
Effet sur l’aptitude à la conduite et l’utilisation de machinesKymriah a une grande influence sur l'aptitude à participer à la circulation routière et à utiliser des machines.
En raison des événements neurologiques potentiels, incluant une altération de la conscience et des convulsions, les patients recevant Kymriah présentent un risque d'altération ou de diminution de l'état de conscience ou de la coordination dans les 8 semaines suivant la perfusion. Il est recommandé aux patients de ne pas conduire et de n'entreprendre ni activités ni travaux dangereux, comme l'utilisation de machines lourdes ou potentiellement dangereuses, pendant cette période.
Effets indésirablesRésumé du profil de sécurité
L'évaluation de la sécurité a été basée sur 291 patients en tout (79 patients pédiatriques et jeunes adultes atteints de LAL à cellules B, 115 patients adultes atteints de LDGCB et 97 patients adultes atteints de LF) ayant reçu Kymriah dans le cadre de trois études cliniques pivots multicentriques.
LAL à cellules B
Les effets indésirables décrits dans cette rubrique sont survenus chez 79 patients auxquels Kymriah a été administré par perfusion lors de l'étude clinique pivot multicentrique CCTL019B2202.
Les effets indésirables non hématologiques les plus fréquents ont été le syndrome de libération des cytokines (SLC) (77%), les infections (72%), l'hypogammaglobulinémie (53%), la fièvre (42%) et un appétit diminué (38%).
Les effets indésirables hématologiques les plus fréquents ont été la diminution des globules blancs (100%), la diminution de l'hémoglobine (100%), la diminution des neutrophiles (100%), la diminution des lymphocytes (100%) et la diminution des plaquettes (97%).
Des effets indésirables de grade 3 et 4 ont été décrits chez 89% des patients. L'effet indésirable non hématologique de grade 3 ou 4 le plus fréquent était le SLC (48%).
Les effets indésirables hématologiques de grade 3 et 4 les plus fréquentes ont été la diminution des globules blancs (97%), la diminution des lymphocytes (96%), la diminution des neutrophiles (95%), la diminution des plaquettes (77%) et la diminution de l'hémoglobine (48%).
Les effets indésirables de grade 3 et 4 ont été observés chez plus de patients dans les 8 premières semaines après la perfusion (82%) que pendant la période commençant 8 semaines après la perfusion (51%).
LDGCB
Les effets indésirables décrits dans cette rubrique ont été décrits chez 115 patients ayant reçu une perfusion de Kymriah dans le cadre d'une étude multicentrique globale, à savoir l'étude clinique pivot en cours CCTL019C2201.
Les effets indésirables non hématologiques les plus fréquents ont été le syndrome de libération des cytokines (57%), les infections (58%), la fièvre (35%), les diarrhées (31%), les nausées (29%), l'hypotension (25%) et la fatigue (27%).
Les effets indésirables hématologiques les plus fréquents ont été la diminution des lymphocytes (100%), la diminution des globules blancs (99%), la diminution de l'hémoglobine (99%), la diminution des neutrophiles (97%) et la diminution des plaquettes (95%).
Des effets indésirables de grade 3 et 4 ont été décrits chez 88% des patients. Les effets indésirables non hématologiques de grade 3 et 4 les plus fréquents ont été les infections (34%) et le syndrome de libération des cytokines (23%).
Les effets indésirables hématologiques de grade 3 et 4 les plus fréquents (> 25%) ont été la diminution des lymphocytes (95%), la diminution des neutrophiles (82%), la diminution du nombre de globules blancs (78%), la diminution de l'hémoglobine (59%) et la diminution des plaquettes (56%).
Les effets indésirables de grade 3 et 4 ont été observés chez plus de patients dans les 8 premières semaines après la perfusion (82%) que pendant la période commençant 8 semaines après la perfusion (48%).
LF
Les effets indésirables décrits dans cette rubrique ont été décrits chez 97 patients ayant reçu Kymriah dans le cadre d'une étude multicentrique globale internationale, à savoir l'étude clinique pivot en cours CCTL019E2202.
Les effets indésirables non hématologiques les plus fréquents (> 25%) ont été le syndrome de libération des cytokines (50%), les infections (50%), et les céphalées (26%).
Les effets indésirables hématologiques les plus fréquents ont été la diminution de l'hémoglobine (94%), la diminution des lymphocytes (92%), la diminution des globules blancs (91%), la diminution des neutrophiles (89%) et la diminution des plaquettes (89%).
Des effets indésirables de grade 3 et 4 ont été décrits chez 76% des patients. Les effets indésirables non hématologiques de grade 3 et 4 les plus fréquents ont été les infections (16%).
Les effets indésirables hématologiques de grade 3 et 4 les plus fréquents (> 25%) ont été la diminution des lymphocytes (87%), la diminution du nombre de globules blancs (74%), la diminution des neutrophiles (71%), la diminution des plaquettes (26%) et la diminution de l'hémoglobine (25%).
Les effets indésirables de grade 3 et 4 ont été plus souvent observés dans les 8 premières semaines après la perfusion (69%) que pendant la période après la 8e semaine (42%).
Tableau des effets indésirables observés pendant les études cliniques
Les effets indésirables décrits dans cette rubrique sont survenus chez 79 patients pédiatriques et jeunes adultes atteints de LAL à cellules B r/r, 115 adultes atteints de LDGCB r/r et respectivement, 97 patients adultes atteints de LF ayant reçu Kymriah en perfusion dans le cadre des études cliniques internationales multicentriques en cours (CCTL019B2202, CCTL019C2201 et CCTL019E2202). Les effets indésirables observés pendant ces études cliniques sont répertoriés par classe de système d'organes selon la classification MedDRA. Dans chaque classe de système d'organes, les effets indésirables sont classés par ordre décroissant de fréquence, utilisant la convention suivante: très fréquent (≥1/10); fréquent (≥1/100, < 1/10); occasionnel (≥1/1000, < 1/100); rare (≥1/10 000, < 1/1000); très rare (< 1/10 000); fréquence non connue (non estimable sur la base des données disponibles).
Infections et infestations1)
Très fréquent: infections – agent pathogène non précisé (46%), infection virale (20%), infection bactérienne (17%), infection fongique (9%)
Affections hématologiques et du système lymphatique
Très fréquent: anémie (36%), neutropénie (26%), neutropénie fébrile (20%), hémorragie2) (19%), thrombopénie (15%)
Fréquent: leucopénie, lymphopénie, pancytopénie, lymphohistiocytose hémophagocytaire, coagulopathie, fibrinogène sanguin diminué, INR augmenté, D-dimère de fibrine augmenté, temps de céphaline activée allongé, TP allongé
Occasionnel: aplasie des lymphocytes B
Affections du système immunitaire
Très fréquent: syndrome de libération des cytokines (60%), hypogammaglobulinémie3) (27%)
Fréquent: réactions liées à la perfusion, maladie du greffon contre l'hôte4)
Troubles du métabolisme et de la nutrition
Très fréquent: hypokaliémie (19%), appétit diminué (18%), hypophosphatémie (16%), hypomagnésémie (11%)
Fréquent: hypocalcémie, hypoalbuminémie5), hyperglycémie, hyponatrémie, hyperférritinémie6), hyperuricémie, hypercalcémie, hyperkaliémie, syndrome de lyse tumorale, hyperphosphatémie, hypernatrémie, hypermagnésémie
Affections psychiatriques
Fréquent: anxiété, trouble du sommeil7), délire8)
Affections du système nerveux
Très fréquent: céphalée9) (27%), encéphalopathie10) (16%)
Fréquent: sensation vertigineuse11), neuropathie périphérique12), tremblements13), dysfonctionnement moteur14), convulsion15), troubles de parole16), syndrome de neurotoxicité associé aux cellules immunitaires effectrices, névralgie17), ataxie18)
Occasionnel: infarctus cérébral ischémique
Affections oculaires
Fréquent: dégradation de la vision19)
Affections cardiaques
Très fréquent: tachycardie20) (13%)
Fréquent: insuffisance cardiaque21), fibrillation atriale, arrêt cardiaque
Occasionnel: extrasystoles ventriculaires
Affections vasculaires
Très fréquent: hypotension22) (21%)
Fréquent: hypertension, thrombose23), syndrome d'hyperperméabilité capillaire
Occasionnel: bouffée congestive
Affections respiratoires, thoraciques et médiastinales
Très fréquent: toux24) (20%), dyspnée25) (16%), hypoxie (10%)
Fréquent: douleurs oropharyngées26), épanchement pleural, congestion nasale, œdème pulmonaire27), tachypnée, syndrome de détresse respiratoire aiguë
Occasionnel: infiltration pulmonaire
Affections gastro-intestinales
Très fréquent: diarrhée (28%), nausées (24%), constipation (16%), vomissements (15%), douleur abdominale28) (12%)
Fréquent: stomatite, distension abdominale, bouche sèche, ascite
Affections hépatobiliaires
Très fréquent: augmentation des enzymes hépatiques29) (14%)
Fréquent: hyperbilirubinémie
Affections de la peau et du tissu sous-cutané
Très fréquent: rash30) (13%)
Fréquent: prurit, sueurs nocturnes, érythème, hyperhidrose
Affections musculosquelettiques et du tissu conjonctif
Très fréquent: douleurs musculo-squelettiques31) (17%), arthralgie (13%)
Fréquent: myalgies
Affections du rein et des voies urinaires
Très fréquent: insuffisance rénale aiguë32) (14%)
Troubles généraux et anomalies au site d'administration
Très fréquent: fièvre (32%), fatigue33) (23%), œdèmes34) (20%), douleurs35) (15%)
Fréquent: frissons, asthénie, maladie pseudo-grippale, syndrome de défaillance multiviscérale, poids diminué
1) Les infections et infestations mentionnées représentent des termes de groupe de haut niveau.
2) L'hémorragie inclut l'hémorragie anale, la cloque de sang, le sang dans les urines, l'hémorragie au site du cathéter, l'hémorragie cérébrale, l'hémorragie conjonctivale, la contusion, la cystite hémorragique, la coagulation intravasculaire disséminée, l'ulcère duodénal avec hémorragie, l'épistaxis, la contusion oculaire, les hémorragies gastro-intestinales, le saignement des gencives, l'hémarthrose, l'hématémèse, l'hématochézie, l'hématome, l'hématurie, l'hémoptysie, les règles abondantes, l'hémorragie du gros intestin, le méléna, l'hémorragie buccale, l'hémorragie des muqueuses, la bulle hémorragique dans la bouche, l'hématome péritonéal, les pétéchies, l'hémorragie pharyngée, une hémorragie après une intervention, une hémorragie pulmonaire, le purpura, l'hémorragie rétinienne, l'hématome sous-dural, l'hématome traumatique, l'hémorragie tumorale, l'hémorragie de la zone gastro-intestinale supérieure et le saignement vaginal.
3) L'hypogammaglobulinémie inclut: immunoglobulines diminuées, immunoglobulines A dans le sang diminuées, déficit immunitaire, immunoglobulines G dans le sang diminuées, immunoglobulines M dans le sang diminuées, déficit immunitaire commun variable, hypogammaglobulinémie.
4) La maladie du greffon contre l'Hôte (GVH) inclut: maladie GVH, maladie GVH dans le tractus GI, maladie GVH de la peau.
5) L'hypoalbuminémie inclut: réduction du taux d'albumine dans le sang et hypoalbuminémie.
6) L'hyperferritinémie inclut: l'hyperferritinémie et l'augmentation de la ferritine sérique.
7) Les troubles du sommeil incluent: les troubles du sommeil, l'insomnie et le cauchemar.
8) Le délire inclut l'agitation, le délire, les hallucinations, les hallucinations visuelles, l'irritabilité et l'instabilité psychomotrice.
9) Les céphalées incluent les céphalées et la migraine.
10) L'encéphalopathie inclut les troubles de l'état de conscience, les modifications de l'humeur, l'automatisme, les troubles cognitifs, l'état confusionnel, les troubles de l'attention, l'encéphalopathie, le syndrome d'encéphalopathie postérieure réversible, la somnolence, la léthargie, l'atteinte de la mémoire, l'encéphalopathie métabolique et les pensées anormales.
11) La sensation vertigineuse inclut la sensation vertigineuse, la présyncope et la syncope.
12) Les neuropathies périphériques incluent la dysesthésie, la paresthésie, les neuropathies sensorielles périphériques, les neuropathies périphériques, l'hyperesthésie et l'hypoesthésie.
13) Les tremblements incluent la dyskinésie et les tremblements.
14) Le dysfonctionnement moteur inclut les spasmes musculaires, les soubresauts musculaires, la myoclonie et la myopathie.
15) La convulsion inclut la convulsion, les crises convulsives généralisées tonico-cloniques et l'état de mal épileptique.
16) Les troubles de la parole incluent les troubles de la parole, la dysarthrie et l'aphasie.
17) La névralgie inclut la névralgie et la sciatique.
18) L'ataxie inclut l'ataxie et la dysmétrie.
19) La dégradation de la vision inclut la vision trouble et la dégradation de la vision.
20) La tachycardie inclut la tachycardie sinusale, la tachycardie supraventriculaire et la tachycardie.
21) L'insuffisance cardiaque inclut l'insuffisance cardiaque, le dysfonctionnement ventriculaire gauche, l'insuffisance cardiaque congestive et le dysfonctionnement du ventricule droit.
22) L'hypotension inclut l'hypotension et le syndrome d'hypotension orthostatique.
23) La thrombose inclut la thrombose veineuse profonde, l'embolie, l'embolie pulmonaire, la thrombose, la thrombose de la veine cave et la thrombose veineuse.
24) La toux inclut la toux, la toux productive et le syndrome de toux des voies aériennes supérieures.
25) La dyspnée inclut l'insuffisance respiratoire aiguë, la dyspnée, la dyspnée d'effort, la détresse respiratoire et l'insuffisance respiratoire.
26) Les douleurs oropharyngées incluent les douleurs buccales et les douleurs oropharyngées.
27) L'œdème pulmonaire inclut l'œdème pulmonaire aigu et l'œdème pulmonaire.
28) La douleur abdominale inclut la douleur abdominale, la douleur abdominale haute et la gêne abdominale.
29) L'augmentation des enzymes hépatiques inclut l'augmentation de l'alanine aminotransférase, l'augmentation de l'aspartate aminotransférase, l'augmentation de la phosphatase alcaline sanguine, l'augmentation des enzymes hépatiques et l'augmentation des transaminases.
30) Le rash inclut la dermatite, la dermatite acnéiforme, la dermite de contact, le rash, le rash maculopapuleux, le rash papuleux et le rash prurigineux.
31) Les douleurs musculo-squelettiques incluent les douleurs dorsales, les douleurs osseuses, les douleurs lombaires, les douleurs thoraciques, qui concernent la musculature squelettique, les douleurs musculo-squelettiques, les douleurs cervicales, les douleurs thoraciques non d'origine cardiaque.
32) L'atteinte rénale aiguë inclut l'atteinte rénale aiguë, l'anurie, l'azotémie, la créatinine sanguine anormale, la créatinine sanguine augmentée, l'insuffisance rénale, le dysfonctionnement des tubules rénaux et la nécrose tubulaire rénale.
33) La fatigue inclut la fatigue et le malaise.
34) L'œdème inclut l'hyperhydratation, la rétention liquidienne, l'œdème périphérique, l'œdème généralisé, l'œdème localisé, et l'œdème du visage et le gonflement périphérique.
35) Les douleurs incluent les douleurs et les douleurs dans une extrémité.
Description de certains effets indésirables
Syndrome de libération des cytokines
Dans l'étude clinique en cours portant sur les patients pédiatriques et jeunes adultes présentant une LAL à cellules B (N = 79), des syndromes de libération des cytokines ont été rapportés chez 77% des patients (48% de grade 3 ou 4). Deux décès sont survenus dans les 30 jours après la perfusion de Kymriah, dont un patient décédé d'une progression de la leucémie en rapport avec un éventuel syndrome de libération des cytokines et un patient ayant présenté une hémorragie intracrânienne à l'issue mortelle, survenue au cours d'un syndrome de libération des cytokines en voie de guérison avec syndrome du compartiment abdominal, coagulopathie et insuffisance rénale.
Dans l'étude clinique en cours portant sur le LDGCB (N = 115), des syndromes de libération des cytokines ont été rapportés chez 57% des patients, (23% de grade 3 ou 4).
Dans l'étude clinique encore en cours avec des patients atteints de LF (N = 97), un syndrome de libération des cytokines a été rapporté chez 50% des patients, mais aucun événement de grade 3 ou 4. Un événement de SLC ayant commencé > 1 an après le traitement par Kymriah a eu une issue fatale.
Dans les études avec des patients pédiatriques et jeunes adultes atteints de LAL à cellules B et de LDGCB, le syndrome de libération des cytokines a été classé selon l'échelle de Penn comme suit: grade 1: réactions légères nécessitant des traitements symptomatiques; grade 2: réactions modérées nécessitant des traitements par voie intraveineuse; grade 3: réactions sévères nécessitant des doses faibles de vasopresseurs ou une supplémentation en oxygène; grade 4: réactions potentiellement mortelles nécessitant des vasopresseurs à fortes doses ou une intubation; grade 5: décès.
Dans l'étude sur le LF, le syndrome de libération des cytokines a été classé selon les critères de Lee comme suit: grade 1: symptômes généraux légers nécessitant un traitement symptomatique; grade 2: symptômes nécessitant une intervention modérée, p.ex. oxygénothérapie à bas débit ou vasopresseurs à faible dose; grade 3: symptômes nécessitant une intervention agressive, par exemple oxygénothérapie à haut débit et vasopresseurs à forte dose; grade 4: symptômes potentiellement mortels nécessitant une intubation; grade 5: décès.
Pour la prise en charge clinique du syndrome de libération des cytokines, se reporter à la rubrique «Mises en garde et précautions».
Infections et neutropénie fébrile
Des infections sévères (grades 3 et 4) pouvant engager le pronostic vital ou être fatales sont survenues chez 48% des patients présentant une LAL à cellules B après une perfusion de Kymriah. L'incidence globale (tous grades) était de 72% (non précisées 57%, virales 38%, bactériennes 27% et fongiques 15%) (voir «Mises en garde et précautions»). 43% des patients ont présenté une infection quelconque dans les 8 semaines suivant la perfusion de Kymriah.
Des infections sévères (grades 3 et 4) pouvant engager le pronostic vital ou être fatales sont survenues chez 34% des patients présentant un LDGCB. L'incidence globale (tous grades) était de 58% (non précisées 48%, bactériennes 15%, fongiques 11% et virales 11%) (voir «Mises en garde et précautions»). 37% des patients ont présenté une infection quelconque dans les 8 semaines.
Des infections sévères (grades 3 et 4) sont survenues chez 16% des patients présentant un LF. L'incidence globale (tous grades) était de 50% (non précisées 36%, virales 17%, bactériennes 6% et fongiques 2%) (voir «Mises en garde et précautions»). 19% des patients ont présenté une infection quelconque dans les 8 semaines.
Une neutropénie fébrile sévère (grade 3 ou 4) a été observée chez 34% des patients pédiatriques et jeunes adultes atteints de LAL à cellules B, chez 17% des patients atteints de LDGCB et chez 12% des patients atteints de LF. Se reporter à «Mises en garde et précautions» pour le traitement de la neutropénie fébrile avant et après la perfusion de Kymriah.
Cytopénies prolongées
Les cytopénies sont très fréquentes pendant des chimiothérapies antérieures et le traitement par Kymriah.
Chez tous les patients pédiatriques et jeunes adultes atteints de LAL à cellules B, des cytopénies de grade 3 et 4 non résolues 28 jours après la perfusion ont été rapportées à un moment donné après la perfusion de Kymriah d'après les analyses biologiques; elles incluaient une leucopénie (57%), une neutropénie (54%), une lymphopénie (44%), une thrombopénie (42%) et une anémie (13%).
Tous les adultes atteints de LDGCB ont présenté des cytopénies de grade 3 et 4 à un moment donné après la perfusion de Kymriah. Les cytopénies de grade 3 et 4 non résolues au jour 28 incluaient une thrombopénie (39%), une lymphopénie (29%), une neutropénie (25%), une leucopénie (21%) et une anémie (14%).
99% des patients adultes atteints de LF ont présenté des cytopénies de grade 3 et 4 à un moment donné après la perfusion de Kymriah. Les cytopénies de grade 3 et 4 non résolues au jour 28 après la perfusion de Kymriah incluaient une lymphopénie (23%), une thrombopénie (17%), une neutropénie (16%), une leucopénie (13%) et une anémie (réduction du taux d'hémoglobine) (3%).
Effets indésirables neurologiques
La majorité des événements neurotoxiques sont survenus dans les 8 semaines suivant la perfusion et ont été transitoires.
Des manifestations d'encéphalopathie et/ou de délire sont survenues chez 39% des patients pédiatriques et jeunes adultes atteints de LAL à cellules B dans les 8 semaines suivant la perfusion de Kymriah (de grade 3 ou 4 dans 13% des cas). Des manifestations d'encéphalopathie et/ou de délire sont survenues chez 20% des patients atteints de LDGCB dans les 8 semaines suivant la perfusion de Kymriah (de grade 3 ou 4 dans 11% des cas).
Chez les patients atteints de LF, celles-ci ont été rapportées chez 9% des patients (1% de grade 3 ou 4) dans les 8 semaines suivant la perfusion de Kymriah.
Pour la prise en charge clinique des toxicités neurologiques, voir «Mises en garde et précautions».
Hypogammaglobulinémie
Une hypogammaglobulinémie a été rapportée chez 53% des patients atteints de LAL r/r, chez 17% des patients atteints de LDGCB r/r et chez 17% des patients atteints de LF traités par Kymriah.
Les femmes enceintes ayant reçu Kymriah peuvent présenter une hypogammaglobulinémie. Le taux d'immunoglobulines doit être évalué chez les nouveau-nés des mères traitées par Kymriah.
Immunogénicité
Dans les études cliniques, l'immunogénicité humorale du tisagenlecleucel a été déterminée en mesurant le taux d'anticorps CAR19 murin (anti-CAR19m) sérique avant et après administration. La majorité des patients étaient positifs pour les anticorps anti-CAR19m avant administration, qu'il s'agisse de patients pédiatriques et de jeunes adultes atteints de LAL (B2202, 91,1%), de patients adultes atteints de LDGCB (C2201, 93,9%) ou de patients adultes atteints de LF (E2202, 66,0%).
Les anticorps anti-CAR19m induits par le traitement ont été détectés chez 40,5% des patients pédiatriques et jeunes adultes atteints de LAL, chez 8,7% des patients adultes atteints de LDGCB et chez 28,7% des patients adultes atteints de LF. Les anticorps anti-CAR19m préexistants et induits par le traitement n'ont pas eu d'impact sur la réponse clinique, ni d'impact sur l'expansion et la persistance du tisagenlecleucel. Rien n'indique que la présence d'anticorps anti-CAR19m préexistants et induits par le traitement aurait un impact sur la sécurité ou l'efficacité de Kymriah.
Aucune réponse immunitaire médiée par les lymphocytes T n'a été observée chez les patients pédiatriques et jeunes adultes atteints de LAL à cellules B, les patients adultes atteints de LDGCB r/r, ni chez les patients adultes atteints de LF.
Population pédiatrique – lymphome non hodgkinien
33 patients pédiatriques atteints d'un lymphome non hodgkinien (LNH) à cellules B récidivant ou réfractaire ont été traités par le tisagenlecleucel dans une étude de phase II (C2202, BIANCA). L'expérience globale en termes de sécurité chez les patients pédiatriques et chez les jeunes adultes atteints de LNH CD19+ r/r à cellules B matures confirme le profil de sécurité connu du tisagenlecleucel.
Effets indésirables médicamenteux issus de signalements spontanés et de rapports bibliographiques (fréquence inconnue)
Les effets indésirables suivants sont issus d'expériences obtenues avec Kymriah après l'autorisation de mise sur le marché, à savoir de déclarations spontanées, de rapports bibliographiques, de programmes d'accès étendus et d'études cliniques, à l'exception des études menées en vue de l'autorisation de mise sur le marché réalisées à l'échelle mondiale. Ces événements provenant de déclarations spontanées issues d'une population de taille indéterminée, il n'est pas toujours possible d'évaluer leur fréquence de manière fiable ou d'établir un lien de causalité avec l'exposition au tisagenlecleucel.
Fréquence inconnue: réaction anaphylactique/réaction liée à la perfusion, neurotoxicité, cancers secondaires provenant des lymphocytes T.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
Propriétés/EffetsCode ATC
L01XL04
Mécanisme d'action
Le tisagenlecleucel est une thérapie anticancéreuse immunocellulaire autologue impliquant la reprogrammation des lymphocytes T du patient à l'aide d'un transgène codant pour un récepteur antigénique chimérique (CAR), afin d'identifier et d'éliminer les cellules exprimant le CD19. Le CAR est constitué d'un fragment d'anticorps murin à chaîne unique, qui reconnaît le CD19 et est fusionné aux domaines de signalisation intracellulaire de 4-1BB (CD137) et CD3 zêta. Le composant CD3 zêta est essentiel pour initier l'activation des lymphocytes T et l'activité anti-tumorale, tandis que le 4-1BB favorise l'expansion et la persistance de Kymriah. Lors de la liaison aux cellules exprimant le CD19, le CAR transmet un signal favorisant l'expansion des lymphocytes T, la destruction des cellules cibles et la persistance de Kymriah.
Pharmacodynamique
Électrophysiologie cardiaque
Kymriah est un produit à base de cellules et il ne devrait pas prolonger l'intervalle QT, c'est pourquoi aucune étude formelle de l'intervalle QT n'a été réalisée.
Efficacité clinique
Leucémie aiguë lymphoblastique (LAL)
La sécurité et l'efficacité du traitement par Kymriah chez les patients pédiatriques et jeunes adultes atteints d'une LAL à cellules B en rechute et réfractaire (r/r) ont été évaluées dans trois études à un seul bras menées en ouvert (205 patients perfusés au total). Chez tous les patients, des produits de leucaphérèse ont été recueillis et cryoconservés avant ou après l'entrée dans l'étude.
CCTL019B2202
L'étude pivot (B2202) est une étude de phase II multicentrique à un seul bras conduite chez des patients pédiatriques et des jeunes adultes atteints d'une leucémie aiguë lymphoblastique à cellules B r/r, réfractaire à la chimiothérapie, en récidive médullaire après une GCS allogénique ou après deux lignes de traitement ou plus, ou pour laquelle la GCS allogénique n'était pas possible.
Les patients atteints des syndromes génétiques suivants avec troubles congénitaux de l'hématopoïèse (défaillance médullaire) étaient exclus de l'étude:
Maladie de Fanconi, syndrome de Kostmann, syndrome de Shwachman ou autres troubles de l'hématopoïèse; des patients atteints du syndrome de Down ont été inclus dans l'étude. Les patients présentant un lymphome/une leucémie de Burkitt n'étaient pas autorisés (p.ex. patients atteints de LAL à cellules B différenciées, leucémie à cellules B [slg positifs ou positivité kappa ou lambda limitée] LAL, avec morphologie FAB L3 et/ou translocation MYC).
Sur les 97 patients inclus dans la cohorte principale, 79 ont reçu Kymriah; 18 patients (19%) ont quitté l'étude avant la perfusion de Kymriah (7 patients sont décédés, 8 patients n'ont pas pu recevoir la perfusion en raison de problèmes lors de la préparation de Kymriah, et 3 patients en raison d'événements indésirables).
Les patients ayant reçu la perfusion avaient entre 3 et 24 ans, avec un âge médian de 11 ans, et 8% étaient atteints d'une pathologie réfractaire primaire. 61 pour cent des patients avaient reçu auparavant une greffe de cellules souches. L'âge médian de tous les patients inclus à l'étude était de 11 ans, avec une plage de 3 à 27 ans; 8% étaient atteints d'une pathologie réfractaire primaire. 61% des patients inclus avaient reçu auparavant une GCS. La majorité des patients (69/79, 87%) a reçu un traitement de transition en attendant de recevoir Kymriah. Au total, 76 des 79 patients ayant reçu Kymriah en perfusion ont reçu une chimiothérapie lymphodéplétive après l'inclusion dans l'étude et avant la perfusion de Kymriah.
77% des patients ont été hospitalisés pour la perfusion et le moment médian de sortie de l'hôpital était après 21 jours; 68% de ces patients sont restés à l'hôpital au moins 10 jours après la perfusion. Sur les 23% de patients à l'origine non hospitalisés pour la perfusion, 83% ont été hospitalisés ultérieurement.
L'efficacité de Kymriah a été évaluée sur la base du critère d'évaluation principal, le taux de rémission global (ORR, overall remission rate), qui a inclus le meilleur taux de réponse globale en tant que rémission complète (complete remission, CR) ou rémission complète avec un rétablissement hématologique incomplet (CRi), dans les 3 mois suivant la perfusion, par un comité d'évaluation indépendant. L'efficacité a aussi été évaluée sur la base de la durée de rémission (DOR, duration of remission) et du pourcentage de patients ayant obtenu une CR ou une CRi avec maladie résiduelle minimale (MRD, minimal residual disease) < 0,01% (évaluation par cytométrie de flux (MRD négative)). Le délai médian entre la perfusion de Kymriah et la dernière visite du dernier patient (Last Patient Last Visit, LPLV) (17 novembre 2022) était de 79,4 mois (plage de 59,7 à 90,3). Les résultats relatifs à l'efficacité issus de cette étude sont représentés dans le tableau 1.
L'ORR a été cohérent dans tous les sous-ensembles. Huit patients ayant reçu une perfusion de Kymriah ont reçu une greffe alors qu'ils étaient en rémission.
Tableau 1 Étude B2202: Résultats d'efficacité chez les patients pédiatriques et jeunes adultes atteints de leucémie aiguë lymphoblastique (LAL) à cellules B en rechute/réfractaire
|
Critère d'évaluation principal
|
Patients inclus
N = 97
|
Patients perfusés
N = 79
| |
Taux de rémission global (ORR)1,2, n (%)
IC à 95%
|
65 (67,0)
(56,7; 76,2)
p < 0,0001
|
65 (82,3)
(72,1; 90,0)
p < 0,0001
| |
CR3, n (%)
|
49 (50,5)
|
49 (62,0)
| |
CRi4, n (%)
|
16 (16,5)
|
16 (20,3)
| |
Critère d'évaluation secondaire le plus important
|
N = 97
|
N = 79
| |
CR ou CRi avec moelle osseuse négative pour la MRD5,6, n (%)
IC à 95%
|
64 (66,0)
(55,7; 75,3)
p < 0,0001
|
64 (81,0)
(70,6; 89,0)
p < 0,0001
| |
Durée de la rémission (DOR)7
|
N = 66
|
N = 66
| |
% de probabilité d'absence d'événement à 12 mois (IC à 95%)
|
67,4 (53,2; 78,1)
|
67,4 (53,2; 78,1)
| |
% de probabilité d'absence d'événement à 24 mois (IC à 95%)
|
58,4 (43,7; 70,5)
|
58,4 (43,7; 70,5)
| |
% de probabilité d'absence d'événement à 36 mois (IC à 95%)
|
53,9 (39,2; 66,5)
|
53,9 (39,2; 66,5)
| |
% de probabilité d'absence d'événement à 54 mois (IC à 95%)
|
49,2 (34,6; 62,3)
|
49,2 (34,6; 62,3)
| |
Médiane (mois) (IC à 95%)
|
46,8 (17,8; NE9)
|
46,8 (17,8; NE)
| |
Autres critères d'évaluation secondaires
|
N = 97
|
N = 79
| |
Survie sans événement (SSE)8
|
|
| |
% de probabilité de survie à 12 mois (IC à 95%)
|
NA11
|
57,2 (44,5; 68,0)
| |
% de probabilité de survie à 24 mois (IC à 95%)
|
NA11
|
49,6 (36,7; 61,2)
| |
% de probabilité de survie à 36 mois (IC à 95%)
|
NA11
|
45,8 (33,0; 57,6)
| |
% de probabilité de survie à 48 mois (IC à 95%)
|
NA11
|
41,8 (29,1, 53,9)
| |
% de probabilité de survie à 60 mois (IC à 95%)
|
NA11
|
41,8 (29,1, 53,9)
| |
Médiane (mois) (IC à 95%)
|
NA11
|
23,7 (9,2; NE.10)
| |
Survie globale (SG)9
|
|
| |
% de probabilité de survie à 12 mois (IC à 95%)
|
69,5 (59,2; 77,7)
|
77,1 (66,1; 84,9)
| |
% de probabilité de survie à 24 mois (IC à 95%)
|
57,6 (46,9; 66,8)
|
67,8 (56,1; 77,0)
| |
% de probabilité de survie à
36 mois (IC à 95%)
|
52,8 (42,1; 62,4)
|
63,5 (51,6; 73,2)
| |
% de probabilité de survie à 48 mois (IC à 95%)
|
49,0 (38,4; 58,9)
|
59,0 (46,9; 69,2)
| |
% de probabilité de survie à 60 mois (IC à 95%)
|
46,3 (35,7; 56,3)
|
55,7 (43,6; 66,3)
| |
Médiane (mois) (IC à 95%)
|
49,9 (19,4; NE)
|
Non atteinte (45,6; NE)
| |
Les critères d'efficacité ont été analysés sur la base des patients inclus dans la cohorte principale.
1 Le statut de rémission doit être maintenu pendant au moins 28 jours sans signe clinique de récidive.
2 Valeur nominale unilatérale exacte de p sur la base de H0 (hypothèse nulle): ORR ≤20% vs Ha (hypothèse alternative): ORR > 20%
3 La CR (rémission complète) était définie comme: < 5% de blastes dans la moelle osseuse, les blastes sanguins circulants devant être < 1%, aucun signe de maladie extramédullaire, et récupération complète des numérations du sang périphérique (plaquettes > 100 000/µl et taux absolu de neutrophiles [absolute neutrophil counts, ANC] > 1000/µl) sans transfusion sanguine.
4 La CRi (rémission complète avec récupération hématologique sanguine incomplète) était définie comme: < 5% de blastes dans la moelle osseuse, les blastes circulant dans le sang devant être < 1%, aucun signe de maladie extramédullaire, et sans récupération complète des numérations du sang périphérique avec ou sans transfusion sanguine.
5 Une MRD (minimal residual disease [maladie résiduelle minimale]) négative était définie comme une MRD < 0,01% (mesurée par cytométrie de flux).
6 Valeur nominale unilatérale exacte de p sur la base de H0: taux de rémission avec négativité de MRD ≤15% vs Ha: > 15%.
7 La DOR était définie comme le délai entre l'apparition d'une CR ou d'une CRi et la récidive ou le décès en raison de la maladie sous-jacente, selon l'événement le plus précoce (N = 66). Un patient a obtenu une rémission après 3 mois.
8 La SSE était définie comme le délai entre la perfusion de Kymriah et la survenue la plus précoce de l'un des événements suivants: décès quelle qu'en soit la cause pour les patients perfusés après obtention d'une rémission, perte de rémission ou absence de réponse au traitement.
9 La SG était définie comme le délai entre la date de perfusion de Kymriah et le décès quelle qu'en soit la cause pour les patients perfusés, et entre l'inclusion dans l'étude et le décès quelle qu'en soit la cause pour les patients inclus. Sur les 79 patients perfusés dans la cohorte principale, 46 patients (58,2%) ont été censurés pour la SG, parmi lesquels 31 patients (39,2%) ont terminé le suivi de l'étude et les 15 autres patients (19,0%) ont interrompu le suivi de l'étude. Les motifs d'abandon comprenaient: décision du patient/tuteur/médecin (N = 5), manque d'efficacité, y compris absence de rémission ou rechute après rémission (N = 2), nouveau traitement pour l'indication de l'étude pendant la rémission (N = 7) et «perdu de vue pour le suivi» (N = 1).
10 Non évaluable
11 Non applicable
|
Populations particulières de patients
Aucune différence d'efficacité ou de sécurité n'a été observée entre les différents sous-groupes d'âge.
Patients souffrant d'une leucémie avec atteinte active du système nerveux central (SNC)
L'expérience dans l'utilisation de Kymriah chez les patients présentant une leucémie ou un lymphome avec atteinte active du SNC est limitée. Par conséquent, le bénéfice et les risques de Kymriah n'ont pas été évalués dans ces populations.
Lymphome diffus à grandes cellules B (LDGCB)
La sécurité et l'efficacité du traitement par Kymriah chez les patients adultes atteints d'un lymphome diffus à grandes cellules B (LDGCB) en rechute ou réfractaire (r/r) ont été évaluées dans une étude pivot à un seul bras menée en ouvert. 167 patients ont été inclus dans l'étude et 115 d'entre eux ont reçu la perfusion (99 patients de la cohorte principale et 16 patients de la cohorte A).
CCTL019C2201
L'étude pivot (C2201) est une étude de phase II multicentrique à un seul bras conduite chez des patients adultes atteints d'un LDGCB en rechute ou réfractaire ayant reçu ≥2 lignes de chimiothérapie, dont du rituximab et des anthracyclines, ou en rechute après une greffe de cellules souches hématopoïétiques (GCSH) autologues. Les patients atteints de lymphome avec atteinte active du SNC, de lymphome à grandes cellules B riche en lymphocytes T et en histiocytes (LBRCTH), de lymphome cutané primitif à grandes cellules B, de lymphome médiastinal primitif à grandes cellules B (LBPM), de LDGCB EBV positif chez les patients âgés, de transformation de Richter, ou de lymphome de Burkitt ont été exclus de l'étude C2201. Parmi les 167 patients inclus dans l'étude, 115 patients ont reçu une perfusion de Kymriah. Environ 31% des patients ont arrêté l'étude avant l'administration de Kymriah. 13 (8%) des patients n'ont pas reçu Kymriah en raison de problèmes de préparation. Autres raisons d'interruption avant la perfusion de Kymriah: décès (n = 16; 10%), décision du médecin/progression de la maladie sous-jacente (n = 16; 10%), décision du patient (n = 2; 1%), événements indésirables (n = 4; 2%) et déviation par rapport au plan d'étude (n = 1; 1%) survenus pendant l'attente de la préparation de Kymriah dans le cadre des études cliniques.
L'âge médian des patients ayant reçu la perfusion était de 56 ans (tranche d'âge: 22 à 76 ans), 77% des patients avaient une maladie de stade III ou IV au moment de l'entrée dans l'étude, 51% avaient déjà reçu 3 lignes de traitement ou plus contre le LDGCB. 49% des patients avaient reçu auparavant une greffe de cellules souches. 55% des patients avaient été réfractaires à la dernière ligne de traitement. L'âge médian de tous les patients inclus dans l'étude était de 58 ans (tranche d'âge: 22 à 76 ans). 78% des patients avaient une maladie de stade III ou IV au moment de l'entrée dans l'étude, 53% avaient reçu auparavant 3 lignes de traitement ou plus. 44% des patients avaient reçu auparavant une GCS. 59% des patients avaient été réfractaires à la dernière ligne de traitement.
Chez tous les patients (n = 167, c.-à-d. tous les patients qui avaient été inclus dans l'étude), des produits de leucaphérèse ont été recueillis et cryoconservés avant ou après l'entrée dans l'étude. La majorité des patients ayant reçu une perfusion (103/115, 90%) ont reçu un traitement de transition dans l'attente de Kymriah, et 107 des 115 patients (93%) ont reçu une chimiothérapie lymphodéplétive. Kymriah a été administré en dose unique par perfusion intraveineuse, à l'hôpital ou en consultation externe, dans un centre de traitement par Kymriah qualifié. La plage de dosage autorisée dans l'étude allait de 1,0 à 5,0 x 108 lymphocytes T viables CAR-positifs.
88% des patients ont été hospitalisés pour la perfusion et le délai médian de sortie de l'hôpital était de 15 jours; 60% de ces patients sont restés à l'hôpital au moins 10 jours après la perfusion. Sur les 12% de patients à l'origine non hospitalisés pour la perfusion, 50% ont été hospitalisés ultérieurement.
L'efficacité de Kymriah a été évaluée selon le critère d'évaluation principal, à savoir le meilleur taux de réponse globale (ORR), la réponse complète (CR) et la réponse partielle (PR) selon l'évaluation de l'IRC s'appuyant sur la classification de Lugano (Cheson et al. 2014), ainsi que selon les critères d'évaluation secondaires, incluant la durée de la réponse (DOR) (tableau 2). Le critère d'évaluation principal a été évalué pour 99 patients traités dans le monde, ayant reçu Kymriah préparé aux États-Unis dans l'usine de Novartis et qui ont été suivis pendant au moins trois mois ou qui ont arrêté l'étude plus tôt après l'administration de Kymriah. Le délai médian entre la perfusion de Kymriah et la LPLV a été de 75,1 mois (plage: 58,1 à 86,6).
Parmi ces 99 patients inclus à l'analyse du critère d'évaluation principal, le meilleur ORR a été de 54,5% (54/99), avec un intervalle de confiance (IC) à 95% de (44,2%, 64,6%). 41 patients (41,4%) ont obtenu une CR et 13 patients (13,1%) ont obtenu une PR. Parmi les 41 patients ayant obtenu une réponse complète (CR), 16 patients ont d'abord montré un taux de réponse globale sous la forme d'une réponse partielle (PR) qui s'est améliorée en une CR au cours du temps, la plupart des patients (13/16) ayant obtenu une conversion de PR à CR en l'espace de 6 mois après la perfusion du tisagenlecleucel. L'ORR a été globalement cohérent dans les différents sous-groupes démographiques et pronostiques, sauf chez les 14 patients de moins de 40 ans, parmi lesquels un patient seulement a eu une CR et un patient seulement a eu une PR. Comme le nombre de patients de moins de 40 ans était faible, on ne peut tirer que des conclusions limitées concernant l'efficacité dans ce groupe de patients.
Aucun des patients ayant reçu une perfusion de Kymriah n'a reçu de greffe après avoir obtenu une CR ou une PR.
Tableau 2 Étude C2201: Résultats d'efficacité chez les patients adultes atteints de lymphome diffus à grandes cellules B (LDGCB) en rechute ou réfractaire après deux lignes ou plus de traitement systémique
|
|
Patients inclus N = 167
|
Patients perfusés N = 115
| |
Critère d'évaluation principal1
|
N = 147
|
N = 99
| |
Taux de réponse globale (ORR) (CR + PR)2, n (%)
IC à 95%
|
54 (36,7)
(28,9; 45,1)
|
54 (54,5)
(44,2; 64,6)
| |
CR, n (%)
|
41 (27,9)
|
41 (41,4)
| |
PR, n (%)
|
13 (8,8)
|
13 (13,1)
| |
Réponse au mois 3
|
N = 147
|
N = 99
| |
ORR (%)
|
40 (27,2)
|
40 (40,4)
| |
CR (%)
|
34 (23,1)
|
34 (34,3)
| |
Réponse au mois 6
|
N = 147
|
N = 99
| |
ORR (%)
|
34 (23,1)
|
34 (34,3)
| |
CR (%)
|
31 (21,1)
|
31 (31,3)
| |
Durée de réponse (DOR)3
|
N = 54
|
N = 54
| |
Médiane (mois) (IC à 95%)
|
Non atteinte (10,0; NE6)
|
Non atteinte (10,0; NE6)
| |
% de probabilité d'absence de rechute à 12 mois (IC à 95%)
|
63,4 (48,2; 75,2)
|
63,4 (48,2; 75,2)
| |
% de probabilité d'absence de rechute à 24 mois (IC à 95%)
|
60,8 (45,5; 73,1)
|
60,8 (45,5; 73,1)
| |
% de probabilité d'absence de rechute à 36 mois (IC à 95%)
|
60,8 (45,5; 73,1)
|
60,8 (45,5; 73,1)
| |
% de probabilité d'absence de rechute à 48 mois (IC à 95%)
|
60,8 (45,5; 73,1)
|
60,8 (45,5; 73,1)
| |
% de probabilité d'absence de rechute à 54 mois (IC à 95%)
|
60,8 (45,5; 73,1)
|
60,8 (45,5; 73,1)
| |
Autres critères d'évaluation secondaires
|
N = 167
|
N = 115
| |
Survie sans événement (SSE)4
|
|
| |
% de probabilité de survie à 12 mois (IC à 95%)
|
NA7
|
29,2 (21,1; 37,7)
| |
% de probabilité de survie à 24 mois (IC à 95%)
|
NA7
|
24,6 (17,1; 32,9)
| |
% de probabilité de survie à 36 mois (IC à 95%)
|
NA7
|
23,7 (16,3; 31,9)
| |
% de probabilité de survie à 48 mois (IC à 95%)
|
NA7
|
23,7 (16,3; 31,9)
| |
% de probabilité de survie à 60 mois (IC à 95%)
|
NA7
|
20,3 (13,3; 28,4)
| |
Médiane (mois) (IC à 95%)
|
NA7
|
2,8 (2,1; 3,1)
| |
Survie globale (SG)5
|
|
| |
% de probabilité de survie à 12 mois (IC à 95%)
|
41,0 (32,9; 48,9)
|
48,2 (38,6; 57,1)
| |
% de probabilité de survie à 24 mois (IC à 95%)
|
33,3 (25,6; 41,2)
|
40,5 (31,2; 49,5)
| |
% de probabilité de survie à 36 mois (IC à 95%)
|
29,4 (22,1; 37,2)
|
36,6 (27,6, 45,6)
| |
% de probabilité de survie à 48 mois (IC à 95%)
|
27,9 (20,7; 35,6)
|
34,7 (25,9; 43,7)
| |
% de probabilité de survie à 60 mois (IC à 95%)
|
25,5 (18,5; 33,1)
|
31,7 (23,1; 40,6)
| |
Médiane (mois) (IC à 95%)
|
8,2 (5,8; 11,7)
|
11,1 (6,6; 23,9)
| |
1
Le critère d'évaluation principal a été analysé chez tous les patients dont Kymriah a été préparé à l'usine américaine de Novartis.
2 L'ORR est la proportion de patients ayant obtenu la meilleure réponse globale (best overall response, BOR) de CR ou PR sur la base de la classification de Lugano (Cheson et al. 2014). Les patients non perfusés ont été assignés à une BOR = inconnue (c.-à-d. non répondeurs).
3 La DOR était définie comme le délai entre l'obtention d'une CR ou d'une PR, selon ce qui est survenu en premier, et la rechute ou le décès en raison d'un LDGCB.
4 La SSE était définie comme le délai entre la perfusion de Kymriah et l'événement le plus précoce parmi les suivants: décès quelle qu'en soit la cause pour les patients perfusés après obtention d'une réponse, perte d'une réponse ou progression de la maladie ou nouveau traitement de la maladie à l'exception d'une GCS.
5 La SG était définie comme le délai entre la perfusion de Kymriah et le décès quelle qu'en soit la cause (N = 115) et comme le délai entre l'inclusion dans l'étude et le décès quelle qu'en soit la cause pour les patients inclus (N = 165). Sur les 115 patients perfusés, 39 patients (33,9%) ont été censurés pour la SG, parmi lesquels 28 patients (24,3%) qui ont terminé le suivi de l'étude et les 11 autres patients (9,6%) qui ont interrompu le suivi de l'étude. Les motifs d'arrêt comprenaient: la décision du patient/médecin (N = 5), la progression de la maladie (N = 5) et l'arrêt du suivi (N = 1).
6 Non évaluable
7 Non applicable
|
Pédiatrie
Une étude de phase II du tisagenlecleucel (C2202, BIANCA) a été réalisée chez 34 patients (enfants et jeunes adultes) atteints d'un lymphome non hodgkinien (LNH) à cellules B récidivant ou réfractaire. Parmi les 33 patients qui ont reçu la perfusion de Kymriah, 28 patients (24 patients de 3 à 17 ans et 4 patients de 20 à 22 ans) présentaient une atteinte mesurable avant la perfusion et ont été inclus dans l'ensemble d'analyse de l'efficacité (efficacy analysis set, EAS). L'ensemble d'analyse de l'efficacité incluait le lymphome de Burkitt (n = 15), le lymphome diffus à grandes cellules B (n = 8), le lymphome médiastinal primitif à cellules B (n = 3), le lymphome de la zone grise (n = 1) et le lymphome hautement malin avec réarrangements de MYC et BCL2 (n = 1). L'âge médian de ces patients était de 14,0 ans (plage: de 3 à 22 ans), 9 étaient de sexe féminin (32,1%), 19 étaient de sexe masculin (67,9%). Le nombre médian de lignes de traitement antérieures était de 1 (plage: 1-3); 17,9% des patients avaient reçu précédemment une (1) greffe de cellules souches hématopoïétiques. 96,4% des patients ayant reçu la perfusion avaient reçu une chimiothérapie de transition dans l'attente du traitement par Kymriah. Les patients ont reçu la dose autorisée de tisagenlecleucel dans l'indication de LAL.
Les résultats pour l'ensemble d'analyse de l'efficacité (n = 28) ont montré un ORR de 32,1% (IC à 95%: 15,9; 52,4) avec une CR de 7,1%. L'analyse des sous-groupes a aussi montré un ORR plus faible chez les patients atteints de lymphome de Burkitt (20%, IC à 95%: 4,3; 48,1) que chez les patients atteints de lymphome diffus à grandes cellules B (37,5%, IC à 95%: 8,5; 75,5) ou d'autres diagnostics inclus dans l'étude (60,0%, IC à 95%: 14,7; 94,7). Compte tenu que les données concernant le traitement de patients pédiatriques atteints de lymphome non hodgkinien à cellules B r/r sont limitées à 33 patients, aucune conclusion définitive ne peut en être tirée concernant l'efficacité dans ce groupe de patients. Les données limitées disponibles n'indiquent aucun bénéfice pour la population étudiée.
Lymphome folliculaire (LF)
La sécurité et l'efficacité du traitement par Kymriah chez les patients adultes atteints d'un lymphome folliculaire (LF) en rechute ou réfractaire (r/r) ont été évaluées dans une étude à un seul bras menée en ouvert, multicentrique, de phase II.
CCTL019E2202
L'étude pivot E2202 (étude ELARA) est une étude de phase II multicentrique à un seul bras en ouvert conduite chez des patients adultes atteints d'un LF r/r. L'étude a été menée avec des patients qui avaient été réfractaires à un deuxième traitement systémique ou plus (notamment, anticorps anti-CD20 et agent alkylant), qui ont rechuté dans les six mois suivant l'arrêt d'un traitement d'entretien par anticorps anti-CD20, après au moins deux lignes de traitement, ou qui ont rechuté après une greffe de cellules souches hématopoïétiques (GCSH) autologues. Les patients participants avaient reçu en moyenne 4 lignes de traitement antérieures (plage de 2 à 13). 75,5% (74) des patients avaient reçu ≥3 lignes de traitement antérieures. Les patients souffrant d'infection active ou grave, de lymphome transformé ou d'autre lymphome agressif, ayant eu une GCSH allogène ou souffrant de maladies avec atteinte active du SNC ont été exclus de l'étude.
Parmi les 98 patients qui ont participé à l'étude et qui ont subi la leucaphérèse, 97 patients ont reçu une perfusion de Kymriah. Un patient a atteint une réponse complète avant la perfusion, laquelle a été attribuée à sa ligne de traitement précédente, et a été retiré de l'étude sur décision médicale avant la perfusion. Parmi les 97 patients ayant reçu la perfusion de Kymriah, 94 présentaient une maladie mesurable au début de l'étude et ont été intégrés dans l'analyse de l'efficacité (Efficacy Analysis Set [EAS]). Kymriah a été administré à tous les patients recrutés.
Les caractéristiques cliniques importantes suivantes étaient présentées par les 94 patients de la population d'efficacité: l'âge moyen était de 57 ans (plage de 29 à 73 ans), 86% des patients avaient une maladie de stade III-IV au début de l'étude, 61% avaient un score FLIPI élevé, 65% présentaient une maladie étendue au début de l'étude, 79% étaient réfractaires à la dernière ligne de traitement, 69% étaient doublement réfractaires, 37% avaient antérieurement reçu une greffe de celles souches autologues et chez 65%, la maladie avait avancé au cours des 24 mois (POD24) après le début du premier traitement combiné avec anti-CD20. 44 patients (47%) ont reçu un traitement de transition entre la leucaphérèse et l'administration de Kymriah, et tous les patients ont reçu une chimiothérapie lymphodéplétive. Chez tous les patients qui ont reçu une perfusion, Kymriah a été administré sous forme d'une perfusion intraveineuse unique sous hospitalisation ou en ambulatoire (18%).
L'efficacité a été évaluée au moyen du critère d'évaluation principal de taux de réponse complète (CRR), qui est déterminé par un IRC sur base de la classification de Lugano (Cheson et al. 2014), ainsi qu'à l'aide des critères d'évaluation secondaires de taux de réponse globale (ORR), de durée de la réponse (DOR) et de survie sans progression (SSP) selon l'IRC, ainsi que de la survie globale (SG). La première évaluation de la maladie devrait être réalisée au mois 3 après la perfusion.
Parmi les 94 patients ayant une maladie mesurable avant la perfusion, qui ont été intégrés à l'analyse de l'efficacité, et présentant une durée médiane de suivi de 29 mois, une CR a été observée chez 64 patients (68%, IC à 95%: 57,7, 77,3); 17 (18%) ont atteint une RP. L'ORR après l'évaluation par l'IRC se situait à 86% (81 patients) (IC à 95%: 77,5, 92,4). Tous les répondeurs avaient atteint la réponse (CR ou RP) lors de la première évaluation après la perfusion. Parmi les 65 patients qui avaient obtenu une RC, 14 patients ont d'abord présenté une RP. Au cours des 6 mois suivant la perfusion, une CR a pu être établie chez la plupart des patients. Aucun patient ayant reçu une perfusion de Kymriah n'a dû être greffé pendant sa réponse au traitement (CR ou RP).
La probabilité qu'un patient présente une réponse durable (DOR) de ≥9 mois se situe à 77% (IC à 95%: 65,4, 84,6), alors que la probabilité qu'un patient qui a atteint une RC présente une durée de réponse ≥9 mois se situe à 89% (IC à 95%: 77,6, 94,4). La probabilité d'une survie sans progression (SSP) après 12 mois se situe à 67% (IC à 95%: 56,3, 75,9), alors que la probabilité de survie globale (SG) après 12 mois se situe à 95% (IC à 95%: 88,1, 98,2).
Tableau 3 Étude E2202: Résultats d'efficacité chez les patients adultes atteints de LF en rechute ou réfractaire
|
|
Population d'efficacité
N = 94
| |
Taux de réponse complète (CRR), n (%)
IC à 95%
|
64 (68,1)
(57,7; 77,3)
| |
Taux de réponse globale (ORR), n (%)
IC à 95%
|
81 (86,2)
(77,5; 92,4)
| |
Durée de la réponse (DOR), mois
|
| |
Médiane (IC à 95%)
% probabilité d'absence de récidive après 9 mois, (IC à 95%)
|
Non atteint (15,6, NE*)
76,6 (65,4; 84,6)
| |
DOR chez les patients qui ont atteint une BOR de RC, mois
Médiane (IC à 95%)
% probabilité d'absence de récidive après 9 mois, (IC à 95%)
|
Non atteint (NE, NE)
88,6 (77,6; 94,4)
| |
Survie sans progression (SSP), mois
|
| |
Médiane (IC à 95%)
SSP après 12 mois, % (IC à 95%)
|
Non atteint (18,2; NE)
67,2 (56,3; 75,9)
| |
Survie globale (SG), mois
|
| |
Médiane (IC à 95%)
SG après 12 mois, % (IC à 95%)
|
Non atteint
95,3 (88,1; 98,2)
| |
*NE: non estimable
|
|
Figure 1 Courbe de Kaplan-Meier de la durée de réponse (DOR) selon l'évaluation par l'IRC (Efficacy Analysis Set [EAS])
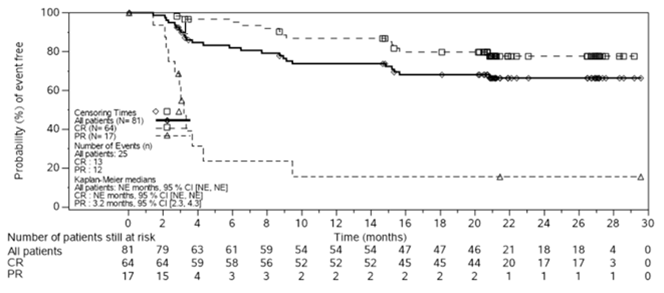
- Le temps est calculé par rapport au début de la réponse, 1 mois = 30,4375 jours.
Figure 2 Courbe de Kaplan-Meier de la survie sans progression (SSP) selon l'évaluation par l'IRC (EAS)

- Le temps est calculé par rapport à la perfusion de tisagenlecleucel, 1 mois = 30,4375 jours.
Indication expérimentale (lymphome non hodgkinien, LNH)
Une étude de phase III, CCTL019H2301 (BELINDA), a été menée dans une indication expérimentale sur 322 patients porteurs d'un LNH agressif, réfractaires ou en récidive dans les 365 jours suivant leur dernière dose d'immunochimiothérapie de première ligne et pour lesquels une greffe de cellules souches (GCS) était envisagée. Les patients ont été randomisés selon un ratio de 1:1 et ont reçu soit un traitement par tisagenlecleucel soit un traitement standard (SOC), défini comme une immunochimiothérapie à base de platine suivie d'une chimiothérapie à haute dose (CTHD) et d'une greffe de cellules souches hématopoïétiques autologues (CSHA) lorsqu'ils avaient répondu au traitement.
Aucune différence statistiquement significative n'a été observée pour le critère d'évaluation principal, la survie sans événement (EFS), entre le tisagenlecleucel et le SOC (test log-rank stratifié p = 0,69, unilatéral). Après une durée d'observation médiane de 10 mois (plage: 2,9; 23,2) l'EFS médiane (IC à 95%) a été de 3,0 mois avec le tisagenlecleucel (IC à 95%: 2,9; 4,2) contre 3,0 mois avec le SOC (IC à 95%: 3,0; 3,5). Aucun test statistique n'a été effectué pour la SG, car le critère d'évaluation principal EFS n'était pas statistiquement significatif. La SG médiane a été de de 16,9 mois (IC à 95%: 11,1, NE) dans le groupe tisagenlecleucel contre 15,3 mois (IC à 95%: 12,3, NE) dans le groupe SOC. Quatre-vingt-un patients du groupe SOC (50,6%) ont changé de traitement et ont reçu une perfusion de tisagenlecleucel.
Aucun nouveau signal de sécurité n'a été observé pour le tisagenlecleucel dans cette étude.
PharmacocinétiqueAprès l'administration de Kymriah à des patients pédiatriques et des jeunes adultes atteints de LAL à cellules B, à des patients atteints de LDGCB r/r et à des patients atteints de LF r/r, Kymriah a présenté généralement une expansion initiale rapide, suivie d'une décroissance bi-exponentielle plus lente. Pour toutes les indications, la variabilité interindividuelle élevée était liée aux paramètres d'exposition in vivo (ASC0-28j et Cmax).
Cinétique cellulaire chez les patients pédiatriques atteints d'une LAL à cellules B
Un résumé des paramètres de la cinétique cellulaire du tisagenlecleucel est présenté dans le tableau 4.
L'expansion maximale (Cmax), mesurée par PCR quantitative en temps réel (PCRq), était environ 50,2% supérieure chez les patients CR/CRi (n = 114, sur la base du nombre de patients avec paramètres évaluables) comparativement aux patients non répondeurs (NR) (n = 10). Une expansion retardée et plus faible a été observée chez les patients non répondeurs (NR) (N = 12) par rapport aux patients répondeurs (N = 114).
Tableau 4 Paramètres de la cinétique cellulaire du tisagenlecleucel chez les patients pédiatriques et les jeunes adultes atteints d'une LAL à cellules B r/r (B2202, B2205J)
|
Paramètre
|
Données statistiques
|
Patients répondeurs
N = 114
|
Patients non répondeurs
N = 12
| |
Cmax (copies/μg)
|
Moyenne géométrique (CV%), n
|
32 900 (173,8), 114
|
21 900 (80,7), 10
| |
Tmax (jour)
|
Médiane [min; max], n
|
9,85 [5,70; 54,8], 114
|
20,1 [12,6; 62,7], 10
| |
ASC0–28j (copies/µg*jour)
|
Moyenne géométrique (CV%), n
|
286 000 (194,9), 114
|
232 000 (104,5), 8
| |
T½ (jour)
|
Moyenne géométrique (CV%), n
|
40,0 (436,8), 72
|
3,78 (222,0), 4
| |
Tlast (jour)
|
Médiane [min; max], n
|
190 [17,8; 1860], 114
|
28,8 [13,9; 888], 11
|
Cinétique cellulaire chez les patients présentant un LDGCB
Un résumé des paramètres de la cinétique cellulaire du tisagenlecleucel chez les patients atteints de LDGCB est présenté dans le tableau 6 ci-dessous.
Tableau 5 Paramètres de la cinétique cellulaire du tisagenlecleucel chez les patients atteints de LDGCB r/r
|
Paramètre
|
Données statistiques
|
Patients répondeurs
(CR et PR)
N = 44
|
Patients non répondeurs
(MS/MP/inconnu)
N = 71
| |
Cmax (copies/μg)
|
Moyenne géométrique (CV%), n
|
6070 (256,8), 44
|
5000 (391,7), 67
| |
Tmax (jour)
|
Médiane [min; max], n
|
9,02 [5,78; 27,7], 44
|
8,84 [0,994; 26,7], 67
| |
ASC0–28j (copies/µg*jour)
|
Moyenne géométrique (CV%), n
|
63 000 (177,7), 43
|
52 300 (321,4), 62
| |
T½ (jour)
|
Moyenne géométrique (CV%), n
|
151 (487,5), 31
|
11,6 (196,2), 49
| |
Tlast (jour)
|
Médiane [min; max], n
|
930 [17,1; 1830], 44
|
41,9 [0,994; 1480], 67
|
Cinétique cellulaire chez les patients présentant un LF
Un résumé des paramètres de la cinétique cellulaire du tisagenlecleucel chez les patients atteints de LF selon la BOR est présenté dans le tableau 6 ci-dessous.
La moyenne géométrique de l'ASC0-84j chez les répondeurs (CR et PR) était semblable à celle des non-répondeurs (MS et MP) sur base de la BOR clinique. Toutefois, la moyenne géométrique de l'ASC0-28j était supérieure de 186% chez les répondeurs par comparaison aux non-répondeurs, alors que la moyenne géométrique de la Cmax était supérieure de 109% chez les répondeurs par comparaison aux non-répondeurs. En raison de la variabilité interindividuelle élevée, du faible nombre de non-répondeurs et du chevauchement de la zone d'expansion entre répondeurs et non-répondeurs, la différence d'exposition doit toutefois être interprétée avec prudence.
Tableau 6 Paramètres de la cinétique cellulaire du tisagenlecleucel chez des patients atteints de LF en rechute/réfractaire
|
Paramètre
|
Données statistiques
|
Patients répondeurs
(CR et PR)
N = 81
|
Patients non répondeurs
(MS/MP)
N = 12
| |
Cmax (copies/ μg)
|
Moyenne géométrique (CV%), n
|
6280 (331), 67
|
3000 (1190), 8
| |
Tmax (jour)
|
Moyenne [min; max], n
|
9,92 [2,62, 28,0], 67
|
13,0 [7,73, 16,0], 8
| |
ASC0-28j (copies/μg*jour)
|
Moyenne géométrique (CV%), n
|
57 500 (261), 66
|
20 100 (18 100), 7
| |
T½ (jour)
|
Moyenne géométrique (CV%), n
|
43,8 (287), 43
|
24,4 (180), 6
| |
Tlast (jour)
|
Médiane [min; max], n
|
191 [19,9, 558], 73
|
107 [18,7, 366], 10
|
Traitement concomitant par tocilizumab et corticostéroïdes
Chez les patients traités par le tocilizumab ou des corticostéroïdes en raison d'un SLC, le transgène du tisagenlecleucel continue son expansion et persiste après l'administration du tocilizumab et des stéroïdes.
Absorption
Non pertinent. Kymriah est une immunothérapie par lymphocytes T administrée par perfusion intraveineuse.
Distribution
Chez les patients pédiatriques et les jeunes adultes atteints de LAL à cellules B, il a été démontré que Kymriah est présent dans le sang et la moelle osseuse respectivement jusqu'à 5 ans et 6 mois. La distribution de Kymriah du sang vers la moelle osseuse s'élevait à 51% de la quantité présente dans le sang au jour 28, contre 67% aux mois 3 et 6. De plus, Kymriah est actif jusqu'à un an dans le liquide céphalorachidien des patients pédiatriques et des jeunes adultes atteints de LAL à cellules B (étude B2101J).
Chez les patients atteints de LDGCB (étude C2201) ayant obtenu une réponse complète, Kymriah a été détecté jusqu'à cinq ans dans le sang périphérique et jusqu'au mois 9 dans la moelle osseuse. Le taux de répartition de Kymriah dans la moelle osseuse était proche de 70% de la quantité présente dans le sang au jour 28 et de 50% au mois 3 chez les patients répondeurs et non répondeurs.
Chez les patients atteints de LF (étude E2202) ayant obtenu une réponse complète, Kymriah a été détecté jusqu'à 18 mois dans le sang périphérique et jusqu'au mois 3 dans la moelle osseuse. Le taux de répartition dans la moelle osseuse se situait à 54% de la quantité présente dans le sang au mois 3 chez les patients répondeurs et non répondeurs.
Métabolisme
Non pertinent, Kymriah étant une thérapie immunocellulaire.
Élimination
Le profil d'élimination de Kymriah inclut une décroissance bi-exponentielle dans le sang périphérique et la moelle osseuse.
Linéarité/non-linéarité
La dose et les paramètres cinétiques cellulaires sont indépendants, de sorte qu'il n'y a pas de relation apparente entre l'ASC0–28j ou la Cmax et la dose.
Patients âgés (65 ans ou plus)
Les diagrammes de dispersion des paramètres de la cinétique cellulaire en fonction de l'âge (22 à 76 ans chez les patients LDGCB et 29 à 73 ans chez les patients LF) n'ont révélé aucune relation significative entre les paramètres de la cinétique cellulaire (ASC0–28j et Cmax) et l'âge.
Sexe
Le sexe n'est pas une caractéristique significative qui influence l'expansion du tisagenlecleucel chez les patients présentant une LAL à cellules B, ceux présentant un LDGCB et ceux présentant un LF.
Groupes ethniques
La majorité des patients traités par Kymriah sont caucasiens; les données permettant de déterminer l'impact des particularités ethniques sur l'expansion de Kymriah chez les patients pédiatriques et les jeunes adultes atteints de LAL, chez ceux atteints de LDGCB et chez ceux atteints de LF sont donc limitées. Dans l'étude B2202, 73,4% des patients étaient caucasiens, 12,7% étaient d'origine asiatique et 13,9% avaient une autre origine ethnique.
Dans l'étude C2201, 85% des patients étaient caucasiens, 9% étaient d'origine asiatique, 4% étaient noirs ou d'origine afro-américaine et 3 patients (3%) d'origine ethnique inconnue.
Dans l'étude E2202, 76% des patients étaient caucasiens, 13% étaient d'origine asiatique, 1% étaient noirs ou d'origine afro-américaine et 10% des patients d'origine ethnique inconnue.
Poids corporel
Chez les patients atteints de LAL et ceux atteints de LDGCB et de LF, sur l'ensemble des catégories de poids (LAL: de 14,4 à 137 kg; LDGCB: de 38,4 à 186,7 kg; LF: 44,3 à 127,7 kg), les diagrammes de dispersion des paramètres cinétiques cellulaires PCRq en fonction du poids n'ont révélé aucune relation apparente entre les paramètres cinétiques cellulaires et le poids.
Insuffisance rénale
Kymriah est un produit à base de cellules et, compte tenu de son mécanisme d'action, l'insuffisance rénale ne devrait pas avoir d'influence sur l'expansion du tisagenlecleucel ni sur la cinétique cellulaire. En conséquence, aucune étude formelle n'a été menée concernant l'insuffisance rénale.
Greffe antérieure
Une greffe antérieure n'a eu aucun impact sur l'expansion ou la persistance du tisagenlecleucel chez les patients pédiatriques et les jeunes adultes atteints de LAL à cellules B, les adultes atteints de LDGCB et les patients atteints de LF.
Insuffisance hépatique
Kymriah est un produit à base de cellules et, compte tenu de son mécanisme d'action, l'insuffisance hépatique ne devrait pas avoir d'influence sur l'expansion du tisagenlecleucel ni sur la cinétique cellulaire. En conséquence, aucune étude formelle n'a été menée concernant l'insuffisance hépatique.
Données précliniquesL'évaluation de la sécurité non clinique de Kymriah a essentiellement consisté en l'analyse du risque de croissance cellulaire non contrôlée des lymphocytes T transduits in vitro et in vivo, ainsi que du risque de toxicité liée à la dose, de la biodistribution et de la persistance. Aucun risque de ce type n'a été identifié sur la base de ces études.
En l'absence de modèles non cliniques in vivo validés, le syndrome de libération des cytokines (SLC) et le syndrome de lyse tumorale (SLT) n'ont pas pu être étudiés lors d'essais sur des animaux.
Pharmacologie de sécurité et toxicité en administration répétée
Aucune étude de pharmacologie de sécurité n'a été réalisée, car la distribution tissulaire de la cible est limitée (CD19 étant exprimé uniquement sur les lymphocytes B dans le sang et les tissus lymphatiques) et parce que, en vertu du principe pharmacologique (à savoir la cytotoxicité liée aux lymphocytes T spécifique de groupes cibles), de telles études de sécurité ne sont pas justifiées.
Aucune étude de la toxicité en administration répétée n'a été menée.
Carcinogénicité et mutagénicité
Les tests de génotoxicité et les études de cancérogénicité chez les rongeurs ne sont pas adaptés pour évaluer le risque de mutagenèse par insertion des produits de thérapie cellulaire génétiquement modifiés. Aucun autre modèle animal pertinent n'a été établi.
Les études d'expansion in vitro avec des lymphocytes T CAR-positifs (Kymriah) provenant de donneurs sains et de patients (Kymriah) n'ont pas montré de signes de transformation ou d'immortalisation des lymphocytes T. Les études in vivo chez les souris immunodéprimées n'ont pas montré de signes d'anomalie de la croissance cellulaire ni de signes d'expansion clonale des cellules jusqu'à 7 mois, ce qui correspond à la période d'observation significative la plus longue pour des modèles de souris immunodéprimées. Une analyse du site d'insertion génomique du vecteur lentiviral a été réalisée avec les produits Kymriah de 14 donneurs individuels (12 patients et 2 participants sains). Aucun élément de preuve d'une intégration préférentielle à proximité de gènes préoccupants ni d'une croissance préférentielle de cellules hébergeant des sites d'intégration préoccupants n'a été obtenu.
Toxicité pour la reproduction
Aucune étude non clinique de sécurité de la reproduction n'a été menée, faute d'un modèle animal adéquat.
Études expérimentales sur de jeunes animaux
Aucune étude de toxicité chez les jeunes animaux n'a été menée.
Remarques particulièresIncompatibilités
En l'absence d'études de tolérance, ce médicament ne doit pas être mélangé à d'autres médicaments.
Remarques concernant la manipulation (vérification et décongélation de la poche ou des poches de perfusion)
La poche de perfusion doit être placée à l'intérieur d'une seconde poche stérile durant la décongélation afin de protéger les ports de connexion de toute contamination et d'éviter tout déversement dans l'éventualité peu probable où la poche de perfusion fuirait. Kymriah doit être décongelé à 37 °C au bain-marie ou à sec, jusqu'à ce que la poche de perfusion ne contienne plus de glace visible. Après la décongélation, la poche doit être sortie immédiatement du dispositif de décongélation et conservée à température ambiante (20 °C à 25 °C) jusqu'à la perfusion (pendant 30 minutes au maximum, perfusion incluse; voir «Posologie/Mode d'emploi», rubrique «Mode d'administration»). Lorsque plusieurs poches de perfusion ont été obtenues pour une dose de traitement (le nombre de poches qui constituent une dose est indiqué dans le certificat de lot [batch certificate]), la poche suivante ne doit pas être décongelée avant que le contenu de la poche précédente ait été perfusé.
Kymriah ne doit pas être modifié. Par exemple, Kymriah ne doit pas être lavé (centrifugé et remis en suspension dans un nouveau milieu) avant la perfusion.
La ou les poches de perfusion doivent être examinées avant décongélation pour vérifier qu'elles ne sont pas endommagées ou déchirées. Si une poche de perfusion est endommagée ou n'est pas étanche, il ne faut pas perfuser le contenu, et la poche doit être éliminée conformément aux dispositions nationales en vigueur en matière de sécurité biologique (voir «Posologie/Mode d'emploi»).
Précautions particulières pour le transport et l'élimination
Tout médicament non utilisé ou déchet doit être éliminé conformément aux exigences nationales.
Les directives locales en matière de sécurité biologique applicables à la manipulation et à l'élimination des produits contenant des organismes génétiquement modifiés doivent être respectées.
Kymriah doit être transporté au sein du laboratoire et de l'hôpital dans des conteneurs fermés, étanches et incassables.
Déchets solides et liquides: tout le matériel ayant été en contact avec Kymriah doit être traité et éliminé comme déchet potentiellement infectieux conformément aux procédures locales à l'hôpital.
Stabilité
Ce médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Remarques particulières concernant le stockage
Kymriah doit être conservé et transporté dans un système à température contrôlée à ≤ -120 °C, par exemple dans un récipient pour conservation cryogénique (Dewar) dans la phase vapeur de l'azote liquide.
La date de péremption est indiquée sur l'étiquette du produit. Ne décongeler qu'au moment de l'utilisation du produit.
Tenir Kymriah hors de portée des enfants.
Pour les conditions de conservation du médicament après décongélation, voir «Remarques concernant la manipulation».
Numéro d’autorisation66778 (Swissmedic)
Présentation1 ou plusieurs poches de perfusion contenant une dose totale de 1,2 × 106–6,0 × 108 lymphocytes T viables CAR-positifs. [A]
Titulaire de l’autorisationNovartis Pharma Schweiz AG, Risch; domicile: 6343 Rotkreuz
Mise à jour de l’informationNovembre 2024
|


