Propriétés/EffetsCode ATC
L01XL04
Mécanisme d'action
Le tisagenlecleucel est une thérapie anticancéreuse immunocellulaire autologue impliquant la reprogrammation des lymphocytes T du patient à l'aide d'un transgène codant pour un récepteur antigénique chimérique (CAR), afin d'identifier et d'éliminer les cellules exprimant le CD19. Le CAR est constitué d'un fragment d'anticorps murin à chaîne unique, qui reconnaît le CD19 et est fusionné aux domaines de signalisation intracellulaire de 4-1BB (CD137) et CD3 zêta. Le composant CD3 zêta est essentiel pour initier l'activation des lymphocytes T et l'activité anti-tumorale, tandis que le 4-1BB favorise l'expansion et la persistance de Kymriah. Lors de la liaison aux cellules exprimant le CD19, le CAR transmet un signal favorisant l'expansion des lymphocytes T, la destruction des cellules cibles et la persistance de Kymriah.
Pharmacodynamique
Électrophysiologie cardiaque
Kymriah est un produit à base de cellules et il ne devrait pas prolonger l'intervalle QT, c'est pourquoi aucune étude formelle de l'intervalle QT n'a été réalisée.
Efficacité clinique
Leucémie aiguë lymphoblastique (LAL)
La sécurité et l'efficacité du traitement par Kymriah chez les patients pédiatriques et jeunes adultes atteints d'une LAL à cellules B en rechute et réfractaire (r/r) ont été évaluées dans trois études à un seul bras menées en ouvert (205 patients perfusés au total). Chez tous les patients, des produits de leucaphérèse ont été recueillis et cryoconservés avant ou après l'entrée dans l'étude.
CCTL019B2202
L'étude pivot (B2202) est une étude de phase II multicentrique à un seul bras conduite chez des patients pédiatriques et des jeunes adultes atteints d'une leucémie aiguë lymphoblastique à cellules B r/r, réfractaire à la chimiothérapie, en récidive médullaire après une GCS allogénique ou après deux lignes de traitement ou plus, ou pour laquelle la GCS allogénique n'était pas possible.
Les patients atteints des syndromes génétiques suivants avec troubles congénitaux de l'hématopoïèse (défaillance médullaire) étaient exclus de l'étude:
Maladie de Fanconi, syndrome de Kostmann, syndrome de Shwachman ou autres troubles de l'hématopoïèse; des patients atteints du syndrome de Down ont été inclus dans l'étude. Les patients présentant un lymphome/une leucémie de Burkitt n'étaient pas autorisés (p.ex. patients atteints de LAL à cellules B différenciées, leucémie à cellules B [slg positifs ou positivité kappa ou lambda limitée] LAL, avec morphologie FAB L3 et/ou translocation MYC).
Sur les 97 patients inclus dans la cohorte principale, 79 ont reçu Kymriah; 18 patients (19%) ont quitté l'étude avant la perfusion de Kymriah (7 patients sont décédés, 8 patients n'ont pas pu recevoir la perfusion en raison de problèmes lors de la préparation de Kymriah, et 3 patients en raison d'événements indésirables).
Les patients ayant reçu la perfusion avaient entre 3 et 24 ans, avec un âge médian de 11 ans, et 8% étaient atteints d'une pathologie réfractaire primaire. 61 pour cent des patients avaient reçu auparavant une greffe de cellules souches. L'âge médian de tous les patients inclus à l'étude était de 11 ans, avec une plage de 3 à 27 ans; 8% étaient atteints d'une pathologie réfractaire primaire. 61% des patients inclus avaient reçu auparavant une GCS. La majorité des patients (69/79, 87%) a reçu un traitement de transition en attendant de recevoir Kymriah. Au total, 76 des 79 patients ayant reçu Kymriah en perfusion ont reçu une chimiothérapie lymphodéplétive après l'inclusion dans l'étude et avant la perfusion de Kymriah.
77% des patients ont été hospitalisés pour la perfusion et le moment médian de sortie de l'hôpital était après 21 jours; 68% de ces patients sont restés à l'hôpital au moins 10 jours après la perfusion. Sur les 23% de patients à l'origine non hospitalisés pour la perfusion, 83% ont été hospitalisés ultérieurement.
L'efficacité de Kymriah a été évaluée sur la base du critère d'évaluation principal, le taux de rémission global (ORR, overall remission rate), qui a inclus le meilleur taux de réponse globale en tant que rémission complète (complete remission, CR) ou rémission complète avec un rétablissement hématologique incomplet (CRi), dans les 3 mois suivant la perfusion, par un comité d'évaluation indépendant. L'efficacité a aussi été évaluée sur la base de la durée de rémission (DOR, duration of remission) et du pourcentage de patients ayant obtenu une CR ou une CRi avec maladie résiduelle minimale (MRD, minimal residual disease) < 0,01% (évaluation par cytométrie de flux (MRD négative)). Le délai médian entre la perfusion de Kymriah et la dernière visite du dernier patient (Last Patient Last Visit, LPLV) (17 novembre 2022) était de 79,4 mois (plage de 59,7 à 90,3). Les résultats relatifs à l'efficacité issus de cette étude sont représentés dans le tableau 1.
L'ORR a été cohérent dans tous les sous-ensembles. Huit patients ayant reçu une perfusion de Kymriah ont reçu une greffe alors qu'ils étaient en rémission.
Tableau 1 Étude B2202: Résultats d'efficacité chez les patients pédiatriques et jeunes adultes atteints de leucémie aiguë lymphoblastique (LAL) à cellules B en rechute/réfractaire
|
Critère d'évaluation principal
|
Patients inclus
N = 97
|
Patients perfusés
N = 79
| |
Taux de rémission global (ORR)1,2, n (%)
IC à 95%
|
65 (67,0)
(56,7; 76,2)
p < 0,0001
|
65 (82,3)
(72,1; 90,0)
p < 0,0001
| |
CR3, n (%)
|
49 (50,5)
|
49 (62,0)
| |
CRi4, n (%)
|
16 (16,5)
|
16 (20,3)
| |
Critère d'évaluation secondaire le plus important
|
N = 97
|
N = 79
| |
CR ou CRi avec moelle osseuse négative pour la MRD5,6, n (%)
IC à 95%
|
64 (66,0)
(55,7; 75,3)
p < 0,0001
|
64 (81,0)
(70,6; 89,0)
p < 0,0001
| |
Durée de la rémission (DOR)7
|
N = 66
|
N = 66
| |
% de probabilité d'absence d'événement à 12 mois (IC à 95%)
|
67,4 (53,2; 78,1)
|
67,4 (53,2; 78,1)
| |
% de probabilité d'absence d'événement à 24 mois (IC à 95%)
|
58,4 (43,7; 70,5)
|
58,4 (43,7; 70,5)
| |
% de probabilité d'absence d'événement à 36 mois (IC à 95%)
|
53,9 (39,2; 66,5)
|
53,9 (39,2; 66,5)
| |
% de probabilité d'absence d'événement à 54 mois (IC à 95%)
|
49,2 (34,6; 62,3)
|
49,2 (34,6; 62,3)
| |
Médiane (mois) (IC à 95%)
|
46,8 (17,8; NE9)
|
46,8 (17,8; NE)
| |
Autres critères d'évaluation secondaires
|
N = 97
|
N = 79
| |
Survie sans événement (SSE)8
|
|
| |
% de probabilité de survie à 12 mois (IC à 95%)
|
NA11
|
57,2 (44,5; 68,0)
| |
% de probabilité de survie à 24 mois (IC à 95%)
|
NA11
|
49,6 (36,7; 61,2)
| |
% de probabilité de survie à 36 mois (IC à 95%)
|
NA11
|
45,8 (33,0; 57,6)
| |
% de probabilité de survie à 48 mois (IC à 95%)
|
NA11
|
41,8 (29,1, 53,9)
| |
% de probabilité de survie à 60 mois (IC à 95%)
|
NA11
|
41,8 (29,1, 53,9)
| |
Médiane (mois) (IC à 95%)
|
NA11
|
23,7 (9,2; NE.10)
| |
Survie globale (SG)9
|
|
| |
% de probabilité de survie à 12 mois (IC à 95%)
|
69,5 (59,2; 77,7)
|
77,1 (66,1; 84,9)
| |
% de probabilité de survie à 24 mois (IC à 95%)
|
57,6 (46,9; 66,8)
|
67,8 (56,1; 77,0)
| |
% de probabilité de survie à
36 mois (IC à 95%)
|
52,8 (42,1; 62,4)
|
63,5 (51,6; 73,2)
| |
% de probabilité de survie à 48 mois (IC à 95%)
|
49,0 (38,4; 58,9)
|
59,0 (46,9; 69,2)
| |
% de probabilité de survie à 60 mois (IC à 95%)
|
46,3 (35,7; 56,3)
|
55,7 (43,6; 66,3)
| |
Médiane (mois) (IC à 95%)
|
49,9 (19,4; NE)
|
Non atteinte (45,6; NE)
| |
Les critères d'efficacité ont été analysés sur la base des patients inclus dans la cohorte principale.
1 Le statut de rémission doit être maintenu pendant au moins 28 jours sans signe clinique de récidive.
2 Valeur nominale unilatérale exacte de p sur la base de H0 (hypothèse nulle): ORR ≤20% vs Ha (hypothèse alternative): ORR > 20%
3 La CR (rémission complète) était définie comme: < 5% de blastes dans la moelle osseuse, les blastes sanguins circulants devant être < 1%, aucun signe de maladie extramédullaire, et récupération complète des numérations du sang périphérique (plaquettes > 100 000/µl et taux absolu de neutrophiles [absolute neutrophil counts, ANC] > 1000/µl) sans transfusion sanguine.
4 La CRi (rémission complète avec récupération hématologique sanguine incomplète) était définie comme: < 5% de blastes dans la moelle osseuse, les blastes circulant dans le sang devant être < 1%, aucun signe de maladie extramédullaire, et sans récupération complète des numérations du sang périphérique avec ou sans transfusion sanguine.
5 Une MRD (minimal residual disease [maladie résiduelle minimale]) négative était définie comme une MRD < 0,01% (mesurée par cytométrie de flux).
6 Valeur nominale unilatérale exacte de p sur la base de H0: taux de rémission avec négativité de MRD ≤15% vs Ha: > 15%.
7 La DOR était définie comme le délai entre l'apparition d'une CR ou d'une CRi et la récidive ou le décès en raison de la maladie sous-jacente, selon l'événement le plus précoce (N = 66). Un patient a obtenu une rémission après 3 mois.
8 La SSE était définie comme le délai entre la perfusion de Kymriah et la survenue la plus précoce de l'un des événements suivants: décès quelle qu'en soit la cause pour les patients perfusés après obtention d'une rémission, perte de rémission ou absence de réponse au traitement.
9 La SG était définie comme le délai entre la date de perfusion de Kymriah et le décès quelle qu'en soit la cause pour les patients perfusés, et entre l'inclusion dans l'étude et le décès quelle qu'en soit la cause pour les patients inclus. Sur les 79 patients perfusés dans la cohorte principale, 46 patients (58,2%) ont été censurés pour la SG, parmi lesquels 31 patients (39,2%) ont terminé le suivi de l'étude et les 15 autres patients (19,0%) ont interrompu le suivi de l'étude. Les motifs d'abandon comprenaient: décision du patient/tuteur/médecin (N = 5), manque d'efficacité, y compris absence de rémission ou rechute après rémission (N = 2), nouveau traitement pour l'indication de l'étude pendant la rémission (N = 7) et «perdu de vue pour le suivi» (N = 1).
10 Non évaluable
11 Non applicable
|
Populations particulières de patients
Aucune différence d'efficacité ou de sécurité n'a été observée entre les différents sous-groupes d'âge.
Patients souffrant d'une leucémie avec atteinte active du système nerveux central (SNC)
L'expérience dans l'utilisation de Kymriah chez les patients présentant une leucémie ou un lymphome avec atteinte active du SNC est limitée. Par conséquent, le bénéfice et les risques de Kymriah n'ont pas été évalués dans ces populations.
Lymphome diffus à grandes cellules B (LDGCB)
La sécurité et l'efficacité du traitement par Kymriah chez les patients adultes atteints d'un lymphome diffus à grandes cellules B (LDGCB) en rechute ou réfractaire (r/r) ont été évaluées dans une étude pivot à un seul bras menée en ouvert. 167 patients ont été inclus dans l'étude et 115 d'entre eux ont reçu la perfusion (99 patients de la cohorte principale et 16 patients de la cohorte A).
CCTL019C2201
L'étude pivot (C2201) est une étude de phase II multicentrique à un seul bras conduite chez des patients adultes atteints d'un LDGCB en rechute ou réfractaire ayant reçu ≥2 lignes de chimiothérapie, dont du rituximab et des anthracyclines, ou en rechute après une greffe de cellules souches hématopoïétiques (GCSH) autologues. Les patients atteints de lymphome avec atteinte active du SNC, de lymphome à grandes cellules B riche en lymphocytes T et en histiocytes (LBRCTH), de lymphome cutané primitif à grandes cellules B, de lymphome médiastinal primitif à grandes cellules B (LBPM), de LDGCB EBV positif chez les patients âgés, de transformation de Richter, ou de lymphome de Burkitt ont été exclus de l'étude C2201. Parmi les 167 patients inclus dans l'étude, 115 patients ont reçu une perfusion de Kymriah. Environ 31% des patients ont arrêté l'étude avant l'administration de Kymriah. 13 (8%) des patients n'ont pas reçu Kymriah en raison de problèmes de préparation. Autres raisons d'interruption avant la perfusion de Kymriah: décès (n = 16; 10%), décision du médecin/progression de la maladie sous-jacente (n = 16; 10%), décision du patient (n = 2; 1%), événements indésirables (n = 4; 2%) et déviation par rapport au plan d'étude (n = 1; 1%) survenus pendant l'attente de la préparation de Kymriah dans le cadre des études cliniques.
L'âge médian des patients ayant reçu la perfusion était de 56 ans (tranche d'âge: 22 à 76 ans), 77% des patients avaient une maladie de stade III ou IV au moment de l'entrée dans l'étude, 51% avaient déjà reçu 3 lignes de traitement ou plus contre le LDGCB. 49% des patients avaient reçu auparavant une greffe de cellules souches. 55% des patients avaient été réfractaires à la dernière ligne de traitement. L'âge médian de tous les patients inclus dans l'étude était de 58 ans (tranche d'âge: 22 à 76 ans). 78% des patients avaient une maladie de stade III ou IV au moment de l'entrée dans l'étude, 53% avaient reçu auparavant 3 lignes de traitement ou plus. 44% des patients avaient reçu auparavant une GCS. 59% des patients avaient été réfractaires à la dernière ligne de traitement.
Chez tous les patients (n = 167, c.-à-d. tous les patients qui avaient été inclus dans l'étude), des produits de leucaphérèse ont été recueillis et cryoconservés avant ou après l'entrée dans l'étude. La majorité des patients ayant reçu une perfusion (103/115, 90%) ont reçu un traitement de transition dans l'attente de Kymriah, et 107 des 115 patients (93%) ont reçu une chimiothérapie lymphodéplétive. Kymriah a été administré en dose unique par perfusion intraveineuse, à l'hôpital ou en consultation externe, dans un centre de traitement par Kymriah qualifié. La plage de dosage autorisée dans l'étude allait de 1,0 à 5,0 x 108 lymphocytes T viables CAR-positifs.
88% des patients ont été hospitalisés pour la perfusion et le délai médian de sortie de l'hôpital était de 15 jours; 60% de ces patients sont restés à l'hôpital au moins 10 jours après la perfusion. Sur les 12% de patients à l'origine non hospitalisés pour la perfusion, 50% ont été hospitalisés ultérieurement.
L'efficacité de Kymriah a été évaluée selon le critère d'évaluation principal, à savoir le meilleur taux de réponse globale (ORR), la réponse complète (CR) et la réponse partielle (PR) selon l'évaluation de l'IRC s'appuyant sur la classification de Lugano (Cheson et al. 2014), ainsi que selon les critères d'évaluation secondaires, incluant la durée de la réponse (DOR) (tableau 2). Le critère d'évaluation principal a été évalué pour 99 patients traités dans le monde, ayant reçu Kymriah préparé aux États-Unis dans l'usine de Novartis et qui ont été suivis pendant au moins trois mois ou qui ont arrêté l'étude plus tôt après l'administration de Kymriah. Le délai médian entre la perfusion de Kymriah et la LPLV a été de 75,1 mois (plage: 58,1 à 86,6).
Parmi ces 99 patients inclus à l'analyse du critère d'évaluation principal, le meilleur ORR a été de 54,5% (54/99), avec un intervalle de confiance (IC) à 95% de (44,2%, 64,6%). 41 patients (41,4%) ont obtenu une CR et 13 patients (13,1%) ont obtenu une PR. Parmi les 41 patients ayant obtenu une réponse complète (CR), 16 patients ont d'abord montré un taux de réponse globale sous la forme d'une réponse partielle (PR) qui s'est améliorée en une CR au cours du temps, la plupart des patients (13/16) ayant obtenu une conversion de PR à CR en l'espace de 6 mois après la perfusion du tisagenlecleucel. L'ORR a été globalement cohérent dans les différents sous-groupes démographiques et pronostiques, sauf chez les 14 patients de moins de 40 ans, parmi lesquels un patient seulement a eu une CR et un patient seulement a eu une PR. Comme le nombre de patients de moins de 40 ans était faible, on ne peut tirer que des conclusions limitées concernant l'efficacité dans ce groupe de patients.
Aucun des patients ayant reçu une perfusion de Kymriah n'a reçu de greffe après avoir obtenu une CR ou une PR.
Tableau 2 Étude C2201: Résultats d'efficacité chez les patients adultes atteints de lymphome diffus à grandes cellules B (LDGCB) en rechute ou réfractaire après deux lignes ou plus de traitement systémique
|
|
Patients inclus N = 167
|
Patients perfusés N = 115
| |
Critère d'évaluation principal1
|
N = 147
|
N = 99
| |
Taux de réponse globale (ORR) (CR + PR)2, n (%)
IC à 95%
|
54 (36,7)
(28,9; 45,1)
|
54 (54,5)
(44,2; 64,6)
| |
CR, n (%)
|
41 (27,9)
|
41 (41,4)
| |
PR, n (%)
|
13 (8,8)
|
13 (13,1)
| |
Réponse au mois 3
|
N = 147
|
N = 99
| |
ORR (%)
|
40 (27,2)
|
40 (40,4)
| |
CR (%)
|
34 (23,1)
|
34 (34,3)
| |
Réponse au mois 6
|
N = 147
|
N = 99
| |
ORR (%)
|
34 (23,1)
|
34 (34,3)
| |
CR (%)
|
31 (21,1)
|
31 (31,3)
| |
Durée de réponse (DOR)3
|
N = 54
|
N = 54
| |
Médiane (mois) (IC à 95%)
|
Non atteinte (10,0; NE6)
|
Non atteinte (10,0; NE6)
| |
% de probabilité d'absence de rechute à 12 mois (IC à 95%)
|
63,4 (48,2; 75,2)
|
63,4 (48,2; 75,2)
| |
% de probabilité d'absence de rechute à 24 mois (IC à 95%)
|
60,8 (45,5; 73,1)
|
60,8 (45,5; 73,1)
| |
% de probabilité d'absence de rechute à 36 mois (IC à 95%)
|
60,8 (45,5; 73,1)
|
60,8 (45,5; 73,1)
| |
% de probabilité d'absence de rechute à 48 mois (IC à 95%)
|
60,8 (45,5; 73,1)
|
60,8 (45,5; 73,1)
| |
% de probabilité d'absence de rechute à 54 mois (IC à 95%)
|
60,8 (45,5; 73,1)
|
60,8 (45,5; 73,1)
| |
Autres critères d'évaluation secondaires
|
N = 167
|
N = 115
| |
Survie sans événement (SSE)4
|
|
| |
% de probabilité de survie à 12 mois (IC à 95%)
|
NA7
|
29,2 (21,1; 37,7)
| |
% de probabilité de survie à 24 mois (IC à 95%)
|
NA7
|
24,6 (17,1; 32,9)
| |
% de probabilité de survie à 36 mois (IC à 95%)
|
NA7
|
23,7 (16,3; 31,9)
| |
% de probabilité de survie à 48 mois (IC à 95%)
|
NA7
|
23,7 (16,3; 31,9)
| |
% de probabilité de survie à 60 mois (IC à 95%)
|
NA7
|
20,3 (13,3; 28,4)
| |
Médiane (mois) (IC à 95%)
|
NA7
|
2,8 (2,1; 3,1)
| |
Survie globale (SG)5
|
|
| |
% de probabilité de survie à 12 mois (IC à 95%)
|
41,0 (32,9; 48,9)
|
48,2 (38,6; 57,1)
| |
% de probabilité de survie à 24 mois (IC à 95%)
|
33,3 (25,6; 41,2)
|
40,5 (31,2; 49,5)
| |
% de probabilité de survie à 36 mois (IC à 95%)
|
29,4 (22,1; 37,2)
|
36,6 (27,6, 45,6)
| |
% de probabilité de survie à 48 mois (IC à 95%)
|
27,9 (20,7; 35,6)
|
34,7 (25,9; 43,7)
| |
% de probabilité de survie à 60 mois (IC à 95%)
|
25,5 (18,5; 33,1)
|
31,7 (23,1; 40,6)
| |
Médiane (mois) (IC à 95%)
|
8,2 (5,8; 11,7)
|
11,1 (6,6; 23,9)
| |
1
Le critère d'évaluation principal a été analysé chez tous les patients dont Kymriah a été préparé à l'usine américaine de Novartis.
2 L'ORR est la proportion de patients ayant obtenu la meilleure réponse globale (best overall response, BOR) de CR ou PR sur la base de la classification de Lugano (Cheson et al. 2014). Les patients non perfusés ont été assignés à une BOR = inconnue (c.-à-d. non répondeurs).
3 La DOR était définie comme le délai entre l'obtention d'une CR ou d'une PR, selon ce qui est survenu en premier, et la rechute ou le décès en raison d'un LDGCB.
4 La SSE était définie comme le délai entre la perfusion de Kymriah et l'événement le plus précoce parmi les suivants: décès quelle qu'en soit la cause pour les patients perfusés après obtention d'une réponse, perte d'une réponse ou progression de la maladie ou nouveau traitement de la maladie à l'exception d'une GCS.
5 La SG était définie comme le délai entre la perfusion de Kymriah et le décès quelle qu'en soit la cause (N = 115) et comme le délai entre l'inclusion dans l'étude et le décès quelle qu'en soit la cause pour les patients inclus (N = 165). Sur les 115 patients perfusés, 39 patients (33,9%) ont été censurés pour la SG, parmi lesquels 28 patients (24,3%) qui ont terminé le suivi de l'étude et les 11 autres patients (9,6%) qui ont interrompu le suivi de l'étude. Les motifs d'arrêt comprenaient: la décision du patient/médecin (N = 5), la progression de la maladie (N = 5) et l'arrêt du suivi (N = 1).
6 Non évaluable
7 Non applicable
|
Pédiatrie
Une étude de phase II du tisagenlecleucel (C2202, BIANCA) a été réalisée chez 34 patients (enfants et jeunes adultes) atteints d'un lymphome non hodgkinien (LNH) à cellules B récidivant ou réfractaire. Parmi les 33 patients qui ont reçu la perfusion de Kymriah, 28 patients (24 patients de 3 à 17 ans et 4 patients de 20 à 22 ans) présentaient une atteinte mesurable avant la perfusion et ont été inclus dans l'ensemble d'analyse de l'efficacité (efficacy analysis set, EAS). L'ensemble d'analyse de l'efficacité incluait le lymphome de Burkitt (n = 15), le lymphome diffus à grandes cellules B (n = 8), le lymphome médiastinal primitif à cellules B (n = 3), le lymphome de la zone grise (n = 1) et le lymphome hautement malin avec réarrangements de MYC et BCL2 (n = 1). L'âge médian de ces patients était de 14,0 ans (plage: de 3 à 22 ans), 9 étaient de sexe féminin (32,1%), 19 étaient de sexe masculin (67,9%). Le nombre médian de lignes de traitement antérieures était de 1 (plage: 1-3); 17,9% des patients avaient reçu précédemment une (1) greffe de cellules souches hématopoïétiques. 96,4% des patients ayant reçu la perfusion avaient reçu une chimiothérapie de transition dans l'attente du traitement par Kymriah. Les patients ont reçu la dose autorisée de tisagenlecleucel dans l'indication de LAL.
Les résultats pour l'ensemble d'analyse de l'efficacité (n = 28) ont montré un ORR de 32,1% (IC à 95%: 15,9; 52,4) avec une CR de 7,1%. L'analyse des sous-groupes a aussi montré un ORR plus faible chez les patients atteints de lymphome de Burkitt (20%, IC à 95%: 4,3; 48,1) que chez les patients atteints de lymphome diffus à grandes cellules B (37,5%, IC à 95%: 8,5; 75,5) ou d'autres diagnostics inclus dans l'étude (60,0%, IC à 95%: 14,7; 94,7). Compte tenu que les données concernant le traitement de patients pédiatriques atteints de lymphome non hodgkinien à cellules B r/r sont limitées à 33 patients, aucune conclusion définitive ne peut en être tirée concernant l'efficacité dans ce groupe de patients. Les données limitées disponibles n'indiquent aucun bénéfice pour la population étudiée.
Lymphome folliculaire (LF)
La sécurité et l'efficacité du traitement par Kymriah chez les patients adultes atteints d'un lymphome folliculaire (LF) en rechute ou réfractaire (r/r) ont été évaluées dans une étude à un seul bras menée en ouvert, multicentrique, de phase II.
CCTL019E2202
L'étude pivot E2202 (étude ELARA) est une étude de phase II multicentrique à un seul bras en ouvert conduite chez des patients adultes atteints d'un LF r/r. L'étude a été menée avec des patients qui avaient été réfractaires à un deuxième traitement systémique ou plus (notamment, anticorps anti-CD20 et agent alkylant), qui ont rechuté dans les six mois suivant l'arrêt d'un traitement d'entretien par anticorps anti-CD20, après au moins deux lignes de traitement, ou qui ont rechuté après une greffe de cellules souches hématopoïétiques (GCSH) autologues. Les patients participants avaient reçu en moyenne 4 lignes de traitement antérieures (plage de 2 à 13). 75,5% (74) des patients avaient reçu ≥3 lignes de traitement antérieures. Les patients souffrant d'infection active ou grave, de lymphome transformé ou d'autre lymphome agressif, ayant eu une GCSH allogène ou souffrant de maladies avec atteinte active du SNC ont été exclus de l'étude.
Parmi les 98 patients qui ont participé à l'étude et qui ont subi la leucaphérèse, 97 patients ont reçu une perfusion de Kymriah. Un patient a atteint une réponse complète avant la perfusion, laquelle a été attribuée à sa ligne de traitement précédente, et a été retiré de l'étude sur décision médicale avant la perfusion. Parmi les 97 patients ayant reçu la perfusion de Kymriah, 94 présentaient une maladie mesurable au début de l'étude et ont été intégrés dans l'analyse de l'efficacité (Efficacy Analysis Set [EAS]). Kymriah a été administré à tous les patients recrutés.
Les caractéristiques cliniques importantes suivantes étaient présentées par les 94 patients de la population d'efficacité: l'âge moyen était de 57 ans (plage de 29 à 73 ans), 86% des patients avaient une maladie de stade III-IV au début de l'étude, 61% avaient un score FLIPI élevé, 65% présentaient une maladie étendue au début de l'étude, 79% étaient réfractaires à la dernière ligne de traitement, 69% étaient doublement réfractaires, 37% avaient antérieurement reçu une greffe de celles souches autologues et chez 65%, la maladie avait avancé au cours des 24 mois (POD24) après le début du premier traitement combiné avec anti-CD20. 44 patients (47%) ont reçu un traitement de transition entre la leucaphérèse et l'administration de Kymriah, et tous les patients ont reçu une chimiothérapie lymphodéplétive. Chez tous les patients qui ont reçu une perfusion, Kymriah a été administré sous forme d'une perfusion intraveineuse unique sous hospitalisation ou en ambulatoire (18%).
L'efficacité a été évaluée au moyen du critère d'évaluation principal de taux de réponse complète (CRR), qui est déterminé par un IRC sur base de la classification de Lugano (Cheson et al. 2014), ainsi qu'à l'aide des critères d'évaluation secondaires de taux de réponse globale (ORR), de durée de la réponse (DOR) et de survie sans progression (SSP) selon l'IRC, ainsi que de la survie globale (SG). La première évaluation de la maladie devrait être réalisée au mois 3 après la perfusion.
Parmi les 94 patients ayant une maladie mesurable avant la perfusion, qui ont été intégrés à l'analyse de l'efficacité, et présentant une durée médiane de suivi de 29 mois, une CR a été observée chez 64 patients (68%, IC à 95%: 57,7, 77,3); 17 (18%) ont atteint une RP. L'ORR après l'évaluation par l'IRC se situait à 86% (81 patients) (IC à 95%: 77,5, 92,4). Tous les répondeurs avaient atteint la réponse (CR ou RP) lors de la première évaluation après la perfusion. Parmi les 65 patients qui avaient obtenu une CR, 14 patients ont d'abord présenté une PR. Au cours des 6 mois suivant la perfusion, une CR a pu être établie chez la plupart des patients. Aucun patient ayant reçu une perfusion de Kymriah n'a dû être greffé pendant sa réponse au traitement (CR ou RP).
La probabilité qu'un patient présente une réponse durable (DOR) de ≥9 mois se situe à 77% (IC à 95%: 65,4, 84,6), alors que la probabilité qu'un patient qui a atteint une CR présente une durée de réponse ≥9 mois se situe à 89% (IC à 95%: 77,6, 94,4). La probabilité d'une survie sans progression (SSP) après 12 mois se situe à 67% (IC à 95%: 56,3, 75,9), alors que la probabilité de survie globale (SG) après 12 mois se situe à 95% (IC à 95%: 88,1, 98,2).
Tableau 3 Étude E2202: Résultats d'efficacité chez les patients adultes atteints de LF en rechute ou réfractaire
|
|
Population d'efficacité
N = 94
| |
Taux de réponse complète (CRR), n (%)
IC à 95%
|
64 (68,1)
(57,7; 77,3)
| |
Taux de réponse globale (ORR), n (%)
IC à 95%
|
81 (86,2)
(77,5; 92,4)
| |
Durée de la réponse (DOR), mois
|
| |
Médiane (IC à 95%)
% probabilité d'absence de récidive après 9 mois, (IC à 95%)
|
Non atteint (15,6, NE*)
76,6 (65,4; 84,6)
| |
DOR chez les patients qui ont atteint une BOR de RC, mois
Médiane (IC à 95%)
% probabilité d'absence de récidive après 9 mois, (IC à 95%)
|
Non atteint (NE, NE)
88,6 (77,6; 94,4)
| |
Survie sans progression (SSP), mois
|
| |
Médiane (IC à 95%)
SSP après 12 mois, % (IC à 95%)
|
Non atteint (18,2; NE)
67,2 (56,3; 75,9)
| |
Survie globale (SG), mois
|
| |
Médiane (IC à 95%)
SG après 12 mois, % (IC à 95%)
|
Non atteint
95,3 (88,1; 98,2)
| |
*NE: non estimable
|
|
Figure 1 Courbe de Kaplan-Meier de la durée de réponse (DOR) selon l'évaluation par l'IRC (Efficacy Analysis Set [EAS])
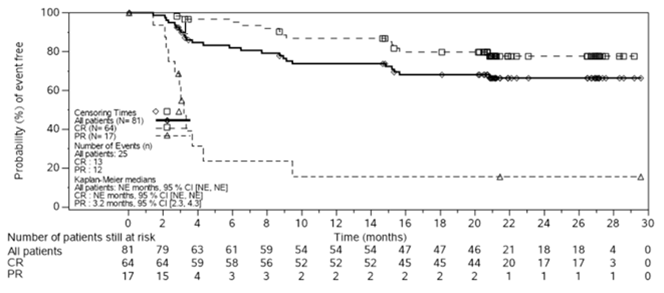
- Le temps est calculé par rapport au début de la réponse, 1 mois = 30,4375 jours.
Figure 2 Courbe de Kaplan-Meier de la survie sans progression (SSP) selon l'évaluation par l'IRC (EAS)

- Le temps est calculé par rapport à la perfusion de tisagenlecleucel, 1 mois = 30,4375 jours.
Indication expérimentale (lymphome non hodgkinien, LNH)
Une étude de phase III, CCTL019H2301 (BELINDA), a été menée dans une indication expérimentale sur 322 patients porteurs d'un LNH agressif, réfractaires ou en récidive dans les 365 jours suivant leur dernière dose d'immunochimiothérapie de première ligne et pour lesquels une greffe de cellules souches (GCS) était envisagée. Les patients ont été randomisés selon un ratio de 1:1 et ont reçu soit un traitement par tisagenlecleucel soit un traitement standard (SOC), défini comme une immunochimiothérapie à base de platine suivie d'une chimiothérapie à haute dose (CTHD) et d'une greffe de cellules souches hématopoïétiques autologues (CSHA) lorsqu'ils avaient répondu au traitement.
Aucune différence statistiquement significative n'a été observée pour le critère d'évaluation principal, la survie sans événement (EFS), entre le tisagenlecleucel et le SOC (test log-rank stratifié p = 0,69, unilatéral). Après une durée d'observation médiane de 10 mois (plage: 2,9; 23,2) l'EFS médiane (IC à 95%) a été de 3,0 mois avec le tisagenlecleucel (IC à 95%: 2,9; 4,2) contre 3,0 mois avec le SOC (IC à 95%: 3,0; 3,5). Aucun test statistique n'a été effectué pour la SG, car le critère d'évaluation principal EFS n'était pas statistiquement significatif. La SG médiane a été de de 16,9 mois (IC à 95%: 11,1, NE) dans le groupe tisagenlecleucel contre 15,3 mois (IC à 95%: 12,3, NE) dans le groupe SOC. Quatre-vingt-un patients du groupe SOC (50,6%) ont changé de traitement et ont reçu une perfusion de tisagenlecleucel.
Aucun nouveau signal de sécurité n'a été observé pour le tisagenlecleucel dans cette étude.
|


