CompositionPrincipes actifs
Gemtuzumabum ozogamicinum.
Le gemtuzumab ozogamicine est un conjugué anticorps-médicament (CAM) composé d'un anticorps monoclonal dirigé contre le CD33 (hP67.6; anticorps immunoglobuline [Ig] G4 kappa humanisé recombinant produit par culture de cellules de mammifères dans les cellules NS0), qui est lié par covalence à l'agent cytotoxique Nacétylgamma-calichéamicine.
Excipients
Dextranum 40, saccharum, natrii chloridum, natrii dihydrogenophosphas monohydricus, dinatrii hydrogenophosphas anhydricus.
Teneur en sodium: 12.54 mg par flacon.
Indications/Possibilités d’emploiMylotarg est utilisé en association avec la daunorubicine (DNR) et la cytarabine (AraC) dans le traitement des patients adultes atteints de leucémie myéloïde aiguë (LMA) d'expression positive du CD33 nouvellement diagnostiquée, à l'exception de la leucémie aiguë promyélocytaire (LAP), naïfs de traitement (voir «Mises en garde et précautions» et «Efficacité clinique»).
Posologie/Mode d’emploiMylotarg ne doit être administré que sous la supervision d'un médecin expérimenté dans l'utilisation des médicaments anticancéreux et dans un environnement où tous les appareils de réanimation sont immédiatement accessibles.
Mylotarg ne doit être utilisé que chez les patients pouvant recevoir une chimiothérapie d'induction intensive.
Afin d'assurer la traçabilité des médicaments biotechnologiques, il convient de documenter pour chaque traitement le nom commercial et le numéro de lot.
Prémédication
Une prémédication par un corticostéroïde, un antihistaminique et du paracétamol est recommandée 1 h avant l'administration afin de diminuer les symptômes liés à la perfusion (voir «Mises en garde et précautions»).
Il convient de prendre des mesures appropriées visant à prévenir le développement d'une hyperuricémie liée à la lyse tumorale, telles que l'hydratation ainsi que l'administration d'hypo-uricémiants ou d'autres médicaments pour le traitement d'une hyperuricémie (voir «Mises en garde et précautions»).
Posologie usuelle
Induction
La dose recommandée de Mylotarg est de 3 mg/m2/dose (jusqu'à un flacon de 5 mg au maximum) administrée en perfusion de 2 h aux Jours 1, 4 et 7 en association avec la DNR et l'AraC. La DNR est administrée à la dose de 60 mg/m2/jour en perfusion de 30 min du Jour 1 au Jour 3, et l'AraC à la dose de 200 mg/m2/jour en perfusion continue du Jour 1 au Jour 7.
Lorsqu'une deuxième induction est nécessaire, Mylotarg ne doit pas être administré au cours du deuxième traitement d'induction. Pour la deuxième induction, seules la DNR et l'AraC doivent être administrées, aux dosages suivantes: 35 mg/m2/jour de DNR aux Jours 1 et 2 et 1 g/m2 d'AraC toutes les 12 heures du Jour 1 au Jour 3.
Consolidation
Pour les patients présentant une rémission complète (RC) après induction (définie comme la présence de moins de 5% de cellules blastiques dans une moelle normocellulaire et une numération absolue des neutrophiles [NAN] supérieure à 1.0x109 cellules/l avec une numération plaquettaire dans le sang périphérique supérieure ou égale à 100x109/l en l'absence de transfusion), jusqu'à 2 cycles de consolidation avec de la DNR et de l'AraC sont recommandés. Pour la DNR et l'AraC, une administration de DNR par voie intraveineuse (60 mg/m2 pendant un jour [premier cycle] ou deux jours [deuxième cycle]) en association avec de l'AraC par voie intraveineuse (1 g/m2 toutes les 12 h, en perfusion de 2 h du Jour 1 au Jour 4) avec Mylotarg par voie intraveineuse (3 mg/m2/dose en perfusion de 2 h jusqu'à une dose maximale d'un flacon de 5 mg au Jour 1, à chaque cycle) est recommandée.
Tableau 1: Schémas posologiques pour Mylotarg en association avec la chimiothérapie
|
Cycle de traitement
|
Mylotarg
|
Daunorubicine
|
Cytarabine
| |
Premier cycle de traitement d'inductiona
|
3 mg/m2/dose (jusqu'à un flacon de 5 mg au maximum) aux Jours 1, 4 et 7
|
60 mg/m2/jour du Jour 1 au Jour 3
|
200 mg/m2/jour du Jour 1 au Jour 7
| |
Deuxième cycle de traitement d'induction (si nécessaire)
|
Mylotarg ne doit pas être administré au cours d'un deuxième cycle de traitement d'induction.
|
35 mg/m2/jour aux Jours 1 et 2
|
1 g/m2 toutes les 12 h, du Jour 1 au Jour 3
| |
Cycle de consolidation 1a ,b
|
3 mg/m2/dose (jusqu'à un flacon de 5 mg au maximum) au Jour 1
|
60 mg/m2/jour au Jour 1
|
1 g/m2 toutes les 12 h du Jour 1 au Jour 4
| |
Cycle de consolidation 2a ,b
|
3 mg/m2/dose (jusqu'à un flacon de 5 mg au maximum) au Jour 1
|
60 mg/m2/jour aux Jours 1 et 2
|
1 g/m2 toutes les 12 h du Jour 1 au Jour 4
| |
a. Voir Tableau 3 et Tableau 4 pour toute information relative aux ajustements posologiques.
b. Pour les patients présentant une rémission complète (RC) après le traitement d'induction.
|
Modification du schéma thérapeutique en cas d'hyperleucocytose
Chez les patients atteints de LMA hyperleucocytaire (numération des leucocytes ≥30'000/mm3), une cytoréduction est recommandée soit par une leucaphérèse, soit par hydroxyurée orale, soit par l'administration d'AraC avec ou sans hydroxyurée afin de réduire le nombre de globules blancs (GB) 48 heures avant l'administration de Mylotarg.
Si l'AraC est utilisée dans le cadre d'une leucoréduction avec ou sans hydroxyurée chez des patients atteints de LMA hyperleucocytaire de novo, naïfs de traitement et recevant Mylotarg en polythérapie, le traitement de l'hyperleucocytose par l'AraC sera instauré au Jour 1, avec l'administration de Mylotarg à une dose de 3 mg/m2 (jusqu'à un flacon de 5 mg au maximum) aux Jours 3, 6 et 9 de la chimiothérapie d'induction. Des ajustements doivent être réalisés selon la pratique médicale standard (voir le Tableau 2 et le Tableau 3 pour de plus amples renseignements sur l'ajustement de la posologie).
Tableau 2: Ajustement du schéma thérapeutique en vue de traiter une hyperleucocytose par la cytarabine
|
Cycle de traitement
|
Mylotarg
|
Daunorubicine
|
Cytarabine
|
Hydroxyurée
| |
Premier cycle de traitement d'inductiona
|
3 mg/m2/dose (jusqu'à un flacon de 5 mg au maximum) aux Jours 3, 6 et 9
|
60 mg/m2/jour du Jour 3 au Jour 5
|
200 mg/m2/jour du Jour 1 au Jour 7
|
Jour 1 (conformément aux pratiques médicales en vigueur)
| |
Pour connaître les recommandations posologiques s'appliquant au cycle de consolidation, voir Tableau 1.
a. Voir Tableau 3 et Tableau 4 pour toute information supplémentaire relative aux ajustements posologiques.
|
Ajustement de la posologie du fait d'effets indésirables/d'interactions
Un ajustement posologique de Mylotarg est recommandé en fonction de la sécurité et de la tolérance individuelles (voir «Mises en garde et précautions»). Certains effets indésirables peuvent nécessiter d'interrompre ou d'arrêter définitivement le traitement par Mylotarg (voir «Mises en garde et précautions» et «Effets indésirables»).
Les Tableaux 3 et 4 présentent les recommandations en matière d'ajustements posologiques en cas de toxicités hématologiques et non hématologiques, respectivement.
Tableau 3: Ajustements posologiques en cas de toxicités hématologiques
|
Toxicités hématologiques
|
Ajustements posologiques
| |
Thrombopénie persistante (numération plaquettaire <100'000/mm3 à la date planifiée de début du cycle de consolidation)
|
·Retarder le début du cycle de consolidation.
·En cas de récupération d'une numération plaquettaire ≥100'000/mm3 dans les 14 jours suivant la date planifiée de début du cycle de consolidation: instaurer un cycle de traitement de consolidation (comme indiqué dans le Tableau 1).
·En cas de récupération d'une numération plaquettaire <100'000/mm3 et ≥50'000/mm3 dans les 14 jours suivant la date planifiée de début du cycle de consolidation: le traitement par Mylotarg ne doit pas être réinstauré et le traitement de consolidation ne doit comprendre que la DNR et l'AraC.
·Si la numération plaquettaire reste <50'000/mm3 pendant plus de 14 jours, si la récupération prend plus de 14 jours, ou si la numération plaquettaire n'est pas rétablie à ≥50'000/mm3, l'instauration du traitement de consolidation doit être réévaluée et une ponction de moelle osseuse doit être effectuée en vue de réévaluer l'état du patient.
| |
Neutropénie persistante
|
·Si la numération des neutrophiles ne remonte pas à >500/mm3 dans les 14 jours suivant la date planifiée de début du cycle de consolidation (14 jours après la récupération hématologique complète suivant le premier cycle), le traitement par Mylotarg doit être arrêté. Mylotarg ne doit alors pas être utilisé lors des cycles de consolidation.
| |
Abréviations: LMA = leucémie myéloïde aiguë; AraC = cytarabine; DNR = daunorubicine.
|
Tableau 4: Ajustements posologiques en cas de toxicités non hématologiques
|
Toxicités non hématologiques
|
Ajustements posologiques
| |
MVO/SOS
|
Arrêter le traitement par Mylotarg (voir «Mises en garde et précautions»).
| |
Taux de bilirubine totale >2x LSN et taux d'ASAT et/ou d'ALAT >2.5x LSN
|
Reporter le traitement par Mylotarg jusqu'à ce que le taux de bilirubine totale soit rétabli à ≤2x LSN et que le taux d'ASAT et d'ALAT soit rétabli à ≤2.5x LSN avant l'administration de chaque dose.
Envisager de ne pas administrer la dose prévue de Mylotarg si elle doit être reportée de plus de 2 jours entre les perfusions consécutives.
| |
Réactions liées à la perfusion
|
Interrompre la perfusion et instaurer une prise en charge médicale appropriée en fonction de la sévérité des symptômes. Les patients doivent être surveillés jusqu'à ce que les signes et symptômes cliniques disparaissent complètement et que la perfusion puisse reprendre.
Il convient d'envisager l'arrêt définitif du traitement en cas de réactions à la perfusion sévères ou menaçant le pronostic vital (voir «Mises en garde et précautions»).
| |
Autres toxicités non hématologiques graves ou menaçant le pronostic vital
|
Interrompre le traitement par Mylotarg jusqu'au retour à une toxicité ne dépassant pas une toxicité légère.
Envisager de ne pas administrer la dose prévue de Mylotarg si elle doit être reportée de plus de 2 jours entre les perfusions consécutives.
| |
Abréviations: ALAT = alanine aminotransférase; ASAT = aspartate aminotransférase; SOS = syndrome d'obstruction sinusoïdale; LSN = limite supérieure de la normale; MVO = maladie veinoocclusive du foie.
|
Instructions posologiques particulières
Patients présentant des troubles de la fonction hépatique
Aucun ajustement de la dose initiale n'est nécessaire chez les patients présentant un trouble de la fonction hépatique, défini par un taux de bilirubine totale ≤2x la limite supérieure de la normale (LSN) et des taux d'aspartate aminotransférase (ASAT)/d'alanine aminotransférase (ALAT) ≤2.5x LSN. Reporter le traitement par Mylotarg jusqu'à ce que le taux de bilirubine totale soit rétabli à ≤2x LSN et que le taux d'ASAT et d'ALAT soit rétabli à ≤2.5x LSN avant l'administration de chaque dose (voir Tableau 4, «Mises en garde et précautions» et «Pharmacocinétique»).
Patients présentant des troubles de la fonction rénale
Aucun ajustement posologique n'est nécessaire chez les patients présentant un trouble léger à modéré de la fonction rénale. Mylotarg n'a pas été étudié chez les patients atteints de trouble sévère de la fonction rénale.
Patients âgés
Aucune adaptation posologique n'est nécessaire chez les patients âgés (≥65 ans) (voir «Pharmacocinétique»).
Pour les patients >70 ans, voir «Mises en garde et précautions».
Enfants et adolescents
La sécurité et l'efficacité chez les enfants et les adolescents de moins de 18 ans ne sont pas établies.
Mode d'administration
Mylotarg doit être administré par voie intraveineuse et doit être reconstitué et dilué avant administration. Une fois reconstituée à la concentration de 1 mg/ml selon les instructions, la quantité extractible du flacon est de 4.5 mg (4.5 ml). La solution reconstituée et diluée doit être administrée par perfusion intraveineuse sur une période de 2 h et sous étroite surveillance clinique (y compris du pouls, de la pression artérielle et de la température corporelle). Mylotarg ne doit pas être administré en injection rapide ou bolus intraveineux (voir «Remarques concernant la manipulation»).
Pour les instructions concernant la reconstitution et la dilution du médicament avant administration, voir «Remarques concernant la manipulation».
Contre-indicationsHypersensibilité au gemtuzumab ozogamicine ou à l'un des excipients (voir «Composition»).
Mises en garde et précautionsHépatotoxicité, y compris maladie veino-occlusive du foie/syndrome d'obstruction sinusoïdale (MVO/SOS)
Des cas d'hépatotoxicité, y compris certains cas d'insuffisance hépatique et de MVO/SOS menaçant le pronostic vital, voire fatals, ont été observés chez des patients traités par Mylotarg (voir «Effets indésirables»).
Sur la base d'une analyse des facteurs de risque potentiels, les patients adultes ayant reçu Mylotarg en monothérapie avant ou après une greffe de cellules souches hématopoïétiques (GCSH) et les patients atteints d'un trouble modéré ou sévère de la fonction hépatique présentent un risque accru de développement d'une MVO (voir «Effets indésirables»).
En raison du risque de MVO/SOS, les signes et symptômes de MVO/SOS doivent être étroitement surveillés. Ceux-ci peuvent inclure des élévations de l'ALAT, de l'ASAT, de la bilirubine totale et de la phosphatase alcaline (qui doivent être contrôlées avant chaque administration de Mylotarg), une hépatomégalie (éventuellement douloureuse), un gain pondéral rapide et une ascite. Le contrôle exclusif de la bilirubine totale ne permet pas forcément d'identifier tous les patients à risque de MVO/SOS. Il est recommandé que tout patient développant des anomalies de la fonction hépatique fasse l'objet d'un contrôle plus fréquent des paramètres hépatiques et de la survenue de signes ou symptômes cliniques d'hépatotoxicité. Concernant les patients devant bénéficier d'une GCSH, une surveillance étroite des paramètres hépatiques est recommandée au cours de la période post-GCSH. Aucune relation claire n'a été constatée entre la MVO et le moment de la GCSH lors de l'utilisation de doses plus élevées de Mylotarg en monothérapie. Cependant, un intervalle de 2 mois entre la dernière dose de Mylotarg et la GSCH était recommandé au cours de l'étude ALFA-0701.
Le traitement des signes ou symptômes cliniques de toxicité hépatique peut nécessiter une interruption ou l'arrêt définitif du traitement par Mylotarg (voir «Posologie/Mode d'emploi»). Chez les patients présentant une MVO/SOS, le traitement par Mylotarg doit être définitivement arrêté et un traitement spécifique de la MVO/SOS doit être instauré conformément aux pratiques médicales en vigueur.
Réactions liées à la perfusion (y compris anaphylaxie)
Au cours des études cliniques, des réactions liées à la perfusion, y compris des cas d'anaphylaxie, ont été rapportées (voir «Effets indésirables»). Des cas de réactions fatales liées à la perfusion ont été rapportés au cours de la période post-commercialisation. Les signes et symptômes de réactions liées à la perfusion peuvent inclure de la fièvre et des frissons, et plus rarement une hypotension, une tachycardie et des symptômes respiratoires, pouvant survenir dans les 24 h suivant l'administration. La perfusion de Mylotarg doit être effectuée sous étroite surveillance clinique (y compris du pouls, de la pression artérielle et de la température corporelle). Une prémédication par un corticostéroïde, un antihistaminique et du paracétamol est recommandée 1 h avant l'administration de Mylotarg (voir «Posologie/Mode d'emploi»). La perfusion doit être immédiatement interrompue chez les patients présentant des réactions graves à la perfusion, notamment une dyspnée, un bronchospasme ou une hypotension cliniquement significative. Les patients doivent être surveillés jusqu'à ce que les signes et symptômes cliniques disparaissent complètement. L'arrêt définitif du traitement doit être envisagé chez les patients présentant des signes et symptômes d'anaphylaxie, y compris des difficultés respiratoires sévères ou une hypotension cliniquement significative (voir «Posologie/Mode d'emploi»).
Myélosuppression
Au cours des études cliniques, des cas de neutropénie, de thrombopénie, d'anémie, de leucopénie, de neutropénie fébrile, de lymphopénie et de pancytopénie, dont certaines menaçant le pronostic vital ou fatales, ont été rapportés (voir «Effets indésirables»). Les complications associées à la neutropénie et à la thrombopénie peuvent inclure des infections et des événements hémorragiques. Des infections et des événements hémorragiques ont été rapportés, dont certains menaçant le pronostic vital ou fatals.
Un hémogramme doit être réalisé avant chaque administration de Mylotarg. Pendant le traitement, les patients doivent être surveillés afin de détecter tout signe ou symptôme clinique d'infection, de saignement/hémorragie ou d'autres effets d'une myélosuppression. Des contrôles cliniques habituels ainsi que des tests biologiques de surveillance sont indiqués pendant et après le traitement.
Le traitement de patients présentant des infections sévères, des saignements/hémorragies ou d'autres effets de la myélosuppression, y compris une neutropénie sévère ou une thrombopénie persistante, peut nécessiter un report du traitement ou un arrêt définitif du traitement par Mylotarg (voir «Posologie/Mode d'emploi»).
Syndrome de lyse tumorale (SLT)
Au cours des études cliniques, des SLT ont été rapportés (voir «Effets indésirables»). Des cas fatals de SLT dû à une insuffisance rénale aiguë ont été rapportés dans le cadre de la surveillance post-commercialisation. Chez les patients atteints de LMA hyperleucocytaire, une leucoréduction par hydroxyurée ou via une leucaphérèse doit être envisagée afin de restaurer le nombre de leucocytes dans le sang périphérique à un taux inférieur à 30'000/mm3 avant l'administration de Mylotarg, en vue de réduire le risque de SLT (voir «Posologie/Mode d'emploi»).
Les patients doivent être surveillés afin de détecter tout signe ou symptôme cliniques de SLT et être pris en charge conformément aux pratiques médicales en vigueur. Des mesures appropriées visant à prévenir le développement d'une hyperuricémie liée à la lyse tumorale, telles que l'hydratation, l'administration d'hypo-uricémiants (par ex. l'allopurinol) ou d'autres agents pour le traitement de l'hyperuricémie (par ex. la rasburicase) doivent être prises.
LMA associée à un risque cytogénétique élevé
L'efficacité de Mylotarg a été démontrée chez les patients atteints de LMA présentant un profil de risque cytogénétique favorable ou modéré. L'ajout de Mylotarg à la DNR et à l'AraC n'a pas amélioré la survie sans événement (SSE) dans le sous-groupe des patients présentant une cytogénétique à risque élevé (RR 1.11; IC à 95%: 0.63-1.95).
Contraception
Il est nécessaire d'informer les femmes en âge de procréer ou les partenaires de femmes en âge de procréer qu'ils doivent utiliser 2 méthodes de contraception fiables pendant tout le traitement par Mylotarg et pendant au moins 7 mois (pour les femmes) ou 4 mois (pour les hommes) après l'administration de la dernière dose (voir «Grossesse, Allaitement»).
Populations particulières de patients
Patients >70 ans
Des patients âgés de 50 à 70 ans ont été inclus dans l'étude pivot ALPHA-0701 (voir «Efficacité clinique»). Il n'existe aucune donnée sur l'efficacité et la sécurité de Mylotarg 3 mg/m2 en association avec la daunorubicine et la cytarabine pour l'indication approuvée pour les patients âgés de >70 ans. Dans une étude destinée à évaluer Mylotarg en association expérimentale, une augmentation de la mortalité a été observée chez les patients âgés de >70 ans en comparaison du groupe témoin sans Mylotarg. L'augmentation de la mortalité était principalement due à des infections de grade 5 (sepsis et pneumonies). Dans une étude destinée à évaluer Mylotarg en monothérapie, une augmentation de la mortalité principalement due à des sepsis de grade 5 a été observée chez les patients âgés de >70 ans.
Teneur en sodium
Ce médicament contient moins de 1 mmol (23 mg) de sodium par flacon, c.-à-d. qu'il est essentiellement «sans sodium».
Ce médicament peut faire l'objet d'une préparation supplémentaire avec des solutions contenant du sodium pour son utilisation (voir «Remarques particulières - Remarques concernant la manipulation»). Il convient alors de tenir compte de l'ensemble du sodium administré au patient, toutes sources confondues.
InteractionsAucune étude clinique d'interaction médicamenteuse n'a été réalisée avec Mylotarg.
Effet d'autres médicaments sur le gemtuzumab ozogamicine
In vitro, le Nacétyl-gamma-calichéamicine diméthylhydrazide est principalement métabolisé par réduction non enzymatique. Par conséquent, il est peu probable que l'administration concomitante de gemtuzumab ozogamicine avec des inhibiteurs ou des inducteurs du cytochrome P450 (CYP) ou des médicaments qui métabolisent les enzymes de l'uridine diphosphate-glucuronosyltransférase (UGT) altère l'exposition au Nacétyl-gamma-calichéamicine diméthylhydrazide.
Des études in vitro ont montré que le N-acétyl-gamma-calichéamicine diméthylhydrazide est un substrat de la P-glycoprotéine (P-gp), un transporteur d'efflux. La pertinence clinique n'a pas été étudiée.
D'après les analyses de pharmacocinétique de population, il n'est pas prévu que l'association de gemtuzumab ozogamicine avec l'hydroxyurée, la DNR et l'AraC entraîne des modifications cliniquement significatives de la PK du hP67.6 ou de la calichéamicine non conjuguée.
Effet du gemtuzumab ozogamicine sur d'autres médicaments
Effets sur les substrats du CYP
In vitro, le Nacétyl-gamma-calichéamicine diméthylhydrazide et le gemtuzumab ozogamicine présentaient un faible potentiel d'inhibition des activités du CYP1A2, du CYP2A6 (testé uniquement avec le gemtuzumab ozogamicine), du CYP2B6, du CYP2C8, du CYP2C9, du CYP2C19, du CYP2D6 et du CYP3A4/5 à des concentrations cliniquement pertinentes. In vitro, le Nacétyl-gamma-calichéamicine diméthylhydrazide et le gemtuzumab ozogamicine présentaient un faible potentiel d'induction des activités du CYP1A2, du CYP2B6 et du CYP3A4 à des concentrations cliniquement pertinentes.
Effets sur les substrats de l'UGT
In vitro, le N-acétyl-gamma-calichéamicine diméthylhydrazide présentait un faible potentiel d'inhibition des activités de l'UGT1A1, de l'UGT1A4, de l'UGT1A6, de l'UGT1A9 et de l'UGT2B7 à des concentrations cliniquement pertinentes.
Effets sur les substrats transporteurs de médicaments
In vitro, le Nacétyl-gamma-calichéamicine diméthylhydrazide présentait un faible potentiel d'inhibition des activités de la P-gp, de la protéine de résistance au cancer du sein (BCRP), de la pompe d'exportation des sels biliaires (BSEP), de la protéine associée à la multirésistance médicamenteuse (MRP) 2 et des protéines d'extrusion de multiples médicaments et toxines (MATE)1 et MATE2K, des transporteurs d'anions organiques (OAT)1 et OAT3, des transporteurs de cations organiques (OCT)1 et OCT2 et des polypeptides de transport d'anions organiques (OATP)1B1 et OATP1B3 à des concentrations cliniquement pertinentes.
Effets sur les agents chimiothérapeutiques co-administrés
D'après les analyses pharmacocinétiques (PK) de population, il n'est pas prévu que l'association de gemtuzumab ozogamicine avec la DNR et l'AraC entraîne des modifications cliniquement significatives de la PK de ces agents.
Grossesse, allaitementFemmes en âge de procréer / Contraception chez les hommes et les femmes
Il doit être conseillé aux femmes en âge de procréer d'éviter de débuter une grossesse pendant le traitement par Mylotarg.
Il est nécessaire d'informer les femmes en âge de procréer ou les partenaires de femmes en âge de procréer qu'ils doivent utiliser 2 méthodes de contraception fiables pendant tout le traitement par Mylotarg et pendant au moins 7 mois (pour les femmes) et 4 mois (pour les hommes) après l'administration de la dernière dose.
Grossesse
À ce jour, il n'existe aucune expérience ou uniquement une expérience très limitée sur l'utilisation du gemtuzumab ozogamicine chez la femme enceinte. Des études effectuées chez l'animal ont mis en évidence une toxicité sur la reproduction (voir «Données précliniques»).
Mylotarg ne doit pas être utilisé pendant la grossesse, sauf si le bénéfice potentiel pour la mère l'emporte sur les risques potentiels pour le fœtus. Les femmes enceintes, les patientes débutant une grossesse au cours du traitement par le gemtuzumab ozogamicine ou les patients de sexe masculin recevant le traitement et dont la partenaire est enceinte doivent être informés des risques potentiels pour le fœtus.
Allaitement
Il n'existe aucune information concernant la présence de gemtuzumab ozogamicine ou de ses métabolites dans le lait maternel, sur les effets sur l'enfant allaité ou sur les effets sur la production de lait. En raison des effets indésirables potentiels chez les enfants allaités, les femmes ne doivent pas allaiter pendant le traitement par Mylotarg et pendant au moins 1 mois après l'administration de la dernière dose (voir «Données précliniques»).
Fertilité
Aucune information concernant la fertilité chez les patients n'est disponible. D'après les données précliniques, le traitement par le gemtuzumab ozogamicine peut entraîner une altération de la fertilité masculine et féminine (voir «Données précliniques»). Avant de débuter le traitement, les hommes et les femmes doivent se renseigner sur la préservation de la fertilité.
Effet sur l’aptitude à la conduite et l’utilisation de machinesMylotarg a une certaine influence sur l'aptitude à la conduite ou l'utilisation de machines. Les patients doivent être informés qu'une fatigue, une sensation vertigineuse et des céphalées peuvent survenir au cours du traitement par Mylotarg (voir «Effets indésirables»). Par conséquent, la prudence est de rigueur lors de la conduite automobile ou l'utilisation de machines.
Effets indésirablesLe profil de sécurité global de Mylotarg repose sur les données provenant de patients atteints de leucémie myéloïde aiguë issues de l'étude ALFA-0701 portant sur la polythérapie, d'autres études cliniques et de l'expérience post-commercialisation.
Au cours de l'étude portant sur la polythérapie, les effets indésirables apparus sous traitement (EIAT) considérés comme étant les plus importants pour comprendre le profil de sécurité de Mylotarg étaient les hémorragies de tous grades, les MVO de tous grades ainsi que les infections sévères.
Des informations concernant les effets indésirables, issues d'autres études cliniques et de l'expérience post-commercialisation, sont également présentées dans le Tableau 5 afin de caractériser complètement les effets indésirables.
Au cours de l'étude ALFA-0701 portant sur la polythérapie, les effets indésirables graves cliniquement pertinents ont été les suivants: hépatotoxicité, y compris MVO/SOS (3.8%), hémorragie (9.9%), infections sévères (41.2%) et syndrome de lyse tumorale (1.5%). Au cours des autres études cliniques, les effets indésirables graves cliniquement pertinents ont également inclus: réactions liées à la perfusion (2.1%), thrombopénie (19.0%), neutropénie (29.1%), neutropénie fébrile (10.7%) et anémie (5.8%).
Les effets indésirables les plus fréquents (>30%) survenus au cours de l'étude portant sur la polythérapie ont été les suivants: hémorragie et infection. Au cours des autres études cliniques, les effets indésirables les plus fréquents (>30%) étaient les suivants: pyrexie, nausée, infection, frissons, hémorragie, vomissement, thrombopénie, fatigue, céphalées, stomatite et diarrhée.
Les effets indésirables les plus fréquents (≥1%) ayant entraîné l'arrêt définitif du traitement au cours de l'étude portant sur la polythérapie ont été les suivants: thrombopénie, MVO, hémorragie et infection. Les effets indésirables les plus fréquents (≥1%) ayant entraîné l'arrêt définitif du traitement au cours des autres études cliniques ont été les suivants: infection, hémorragie, défaillance multi-viscérale et MVO.
Le Tableau 5 contient les données provenant de patients atteints de LMA nouvellement diagnostiquée dans l'étude ALFA-0701, dans laquelle seules des données de sécurité sélectionnées sont prises en compte, et des données de patients qui ont reçu Mylotarg pour le traitement de la LMA en rechute/réfractaire dans d'autres études. Les effets indésirables sont présentés ci-après par classe de systèmes d'organes et par catégories de fréquence, selon la convention suivante: «très fréquents» (≥1/10), «fréquents» (≥1/100 à <1/10), «occasionnels» (≥1/1'000 à <1/100), «rares» (≥1/10'000 à <1/1'000), «très rares» (<1/10'000) et «Fréquence inconnue» (ne peut être estimée sur la base des données disponibles).
Tableau 5: Effets indésirables chez les patients ayant reçu Mylotarg
|
Classe de systèmes d'organes
Fréquence
|
ALFA-0701 et autres études cliniques (n=458)
| |
Tous grades
%
|
Grade 3/ 4
%
| |
Infections et infestations
| |
Très fréquents
| |
Infection*, a
|
77.9
|
76.3
| |
Affections hématologiques et du système lymphatique
| |
Très fréquents
| |
Thrombopénie**
|
100
|
100
| |
Leucopénie**
|
100
|
100
| |
Anémie**
|
100
|
86.2
| |
Lymphopénie**
|
98.5
|
90.7
| |
Neutropénie**
|
97.7
|
96.1
| |
Temps de prothrombine allongé**
|
84.8
|
3.3
| |
Temps de céphaline activée allongé**
|
80.0
|
6.4
| |
Neutropénie fébrile++
|
22.3
|
15.3
| |
Fréquents
| |
Pancytopénieb, ++
|
4.6
|
4.0
| |
Affections du système immunitaire
| |
Fréquents
| |
Réaction liée à la perfusionc, ++
|
6.4
|
3.1
| |
Troubles du métabolisme et de la nutrition
| |
Très fréquents
| |
Hyperglycémied, **
|
92.0
|
19.2
| |
Hyperuricémie**
|
32.5
|
2.6
| |
Appétit diminué++
|
23.5
|
5.2
| |
Fréquents
| |
Syndrome de lyse tumorale*, ++
|
2.1
|
1.5
| |
Affections du système nerveux
| |
Très fréquents
| |
Céphalées ++
|
33.9
|
10.4
| |
Affections cardiaques
| |
Très fréquents
| |
Tachycardiee, ++
|
11.3
|
4.0
| |
Affections vasculaires
| |
Très fréquents
| |
Hémorragief, *
|
90.1
|
20.6
| |
Hypotensiong, ++
|
17.7
|
12.8
| |
Hypertensionh, ++
|
15.0
|
8.9
| |
Affections respiratoires, thoraciques et médiastinales
| |
Très fréquents
| |
Dyspnéei, ++
|
23.2
|
10.7
| |
Fréquence inconnue
| |
Pneumonie interstitielle*
|
|
| |
Affections gastro-intestinales
| |
Très fréquents
| |
Nausées++
|
62.7
|
33.3
| |
Vomissements++
|
53.2
|
28.4
| |
Stomatitej, ++
|
32.1
|
10.4
| |
Diarrhée++
|
30.3
|
12.5
| |
Douleurs abdominalesk, ++
|
29.4
|
6.1
| |
Constipation++
|
22.9
|
4.3
| |
Fréquents
| |
Ascite++
|
2.8
|
0.3
| |
Dyspepsie++
|
7.6
|
0.9
| |
Œsophagite++
|
1.8
|
0.6
| |
Fréquence inconnue
| |
Colite neutropénique*
|
|
| |
Affections hépatobiliaires
| |
Très fréquents
| |
Aspartate aminotransférase (ASAT) augmentée**
|
89.2
|
14.0
| |
Phosphatase alcaline augmentée**
|
79.7
|
13.3
| |
Alanine aminotransférase (ALAT) augmentée**
|
78.3
|
10.9
| |
Hyperbilirubinémiel, **
|
51.6
|
7.1
| |
Lactate déshydrogénase sanguine augmentée++
|
14.1
|
6.1
| |
Fréquents
| |
Maladie veino-occlusive du foiem, *
|
4.6
|
2.3
| |
Gamma-glutamyltransférase augmentée++
|
2.4
|
1.2
| |
Fonction hépatique anormalen, ++
|
2.1
|
1.2
| |
Hépatomégalie++
|
2.1
|
0.6
| |
Ictère++
|
1.8
|
0.9
| |
Occasionnels
| |
Insuffisance hépatique*, #, ++
|
0.3
|
0.3
| |
Syndrome de Budd-Chiari#, ++
|
0.3
|
0.3
| |
Affections de la peau et du tissu sous-cutané
| |
Très fréquents
| |
Rasho, ++
|
17.7
|
4.9
| |
Fréquents
| |
Érythèmep, ++
|
8.0
|
1.8
| |
Prurit++
|
4.9
|
0.3
| |
Affections du rein et des voies urinaires
| |
Fréquence inconnue
| |
Cystite hémorragique*
|
|
| |
Troubles généraux et anomalies au site d'administration
| |
Très fréquents
| |
Pyrexieq, ++
|
72.8
|
44.6
| |
Frissons++
|
58.4
|
14.7
| |
Fatiguer, ++
|
37.0
|
9.8
| |
Œdèmes, ++
|
18.7
|
2.8
| |
Fréquents
| |
Défaillance multi-viscérale*, ++
|
1.8
|
0.6
| |
++ N = 327 provenant d'autres études cliniques avec Mylotarg.
* Y compris d'issue fatale.
** N = 131; la fréquence est basée sur des résultats de laboratoire (grade selon les critères CTCAE concernant les événements indésirables [Common Terminology Criteria for Adverse Events] du National Cancer Institute [NCI CTCAE] v4.03).
# Cas isolés.
Abréviations: N = nombre de patients, TP = terme préférentiel (preferred term, PT).
a. N = 131; le terme «infection» englobe: sepsis et bactériémie (53.4%), infection fongique (15.3%), infection des voies aériennes inférieures (5.3%), infection bactérienne (9.2%), infection gastro-intestinale (8.4%), infection cutanée (2.3%) et autres infections (28.4%). Après la mise sur le marché, des infections pulmonaires fongiques, y compris mycose pulmonaire et pneumonie à Pneumocystis jirovecii*, et des infections bactériennes, y compris infection à Stenotrophomonas, ont également été rapportées (Fréquence inconnue).
b. Le terme «pancytopénie» englobe les TP rapportés suivants: pancytopénie et insuffisance de la moelle osseuse.
c. Le terme «réaction liée à la perfusion» englobe les TP rapportés suivants: réaction liée à la perfusion, urticaire, hypersensibilité, bronchospasme, hypersensibilité médicamenteuse et urticaire au site d'injection#.
d. Le terme «hyperglycémie» englobe les TP rapportés suivants: hyperglycémie et glucose sanguin augmenté#.
e. Le terme «tachycardie» englobe les TP rapportés suivants: tachycardie, tachycardie sinusale, fréquence cardiaque augmentée# et tachycardie supraventriculaire.
f. N = 131; le terme «hémorragie» englobe: hémorragie du système nerveux central (3.1%), hémorragie gastro-intestinale haute (33.6%), hémorragie gastro-intestinale basse (17.6%), saignement sous-cutané (60.3%), autre hémorragie (64.9%) et épistaxis (62.6%).
g. Le terme «hypotension» englobe les TP rapportés suivants: hypotension et pression artérielle diminuée.
h. Le terme «hypertension» englobe les TP rapportés suivants: hypertension et pression artérielle augmentée.
i. Le terme «dyspnée» englobe les TP rapportés suivants: dyspnée et dyspnée d'effort.
j. Le terme «stomatite» englobe les TP rapportés suivants: inflammation muqueuse, douleurs oropharyngées, stomatite, ulcération buccale, douleur buccale, bulles buccales, stomatite aphteuse, ulcération linguale, glossodynie, érythème de la muqueuse buccale, glossite# et bulles oropharyngées#.
k. Le terme «douleurs abdominales» englobe les TP rapportés suivants: douleurs abdominales, douleurs abdominales basses, douleurs abdominales hautes, gêne abdominale haute et abdomen sensible.
l. Le terme «hyperbilirubinémie» englobe les TP rapportés suivants: bilirubine sanguine augmentée et hyperbilirubinémie.
m. N = 131; le terme «maladie veino-occlusive du foie» englobe les TP rapportés suivants: maladie veino-occlusive et maladie veino-occlusive du foie*, #.
n. Le terme «fonction hépatique anormale» englobe les TP rapportés suivants: tests hépatiques anormaux et fonction hépatique anormale.
o. Le terme «rash» englobe les TP rapportés suivants: rash, dermatite, dermatite allergique#, dermatite bulleuse, dermite de contact, dermite exfoliatrice#, rash médicamenteux, prurit allergique# et rash érythémateux#, rash maculeux#, rash maculopapuleux, rash papuleux, rash prurigineux, rash bulleux#.
p. Le terme «érythème» englobe les TP rapportés suivants: érythème au site du cathéter, érythème et érythème du site de perfusion#.
q. Le terme «pyrexie» englobe les TP rapportés suivants: pyrexie, température augmentée et hyperthermie.
r. Le terme «fatigue» englobe les TP rapportés suivants: fatigue, asthénie, léthargie et malaise.
s. Le terme «œdème» englobe les TP rapportés suivants: œdème, œdème de la face, œdème périphérique, gonflement du visage, œdème généralisé et œdème périorbitaire.
|
Description d'effets indésirables spécifiques et informations complémentaires
Hépatotoxicité, y compris maladie veino-occlusive du foie / syndrome d'obstruction sinusoïdale (MVO/SOS)
Au cours de l'étude ALFA-0701 portant sur la polythérapie, des données sur des MVO et des modifications des paramètres hépatiques ont été collectées. Une caractérisation supplémentaire des effets indésirables induits par l'hépatotoxicité est fournie grâce aux études portant sur la monothérapie.
Au cours de l'étude ALFA-0701 portant sur la polythérapie (n=131), une MVO a été rapportée chez 6 (4.6%) patients pendant ou après le traitement, 2 (1.5%) de ces réactions se sont avérées mortelles (voir Tableau 5). 5 (3.8%) de ces réactions sont survenues dans les 28 jours suivant l'administration d'une dose de gemtuzumab ozogamicine. Un événement de MVO est survenu plus de 28 jours après l'administration de la dernière dose de gemtuzumab ozogamicine; l'un de ces événements est survenu quelques jours après l'instauration d'un régime de conditionnement pour une GCSH. Le délai médian de survenue d'une MVO après l'administration de la dernière dose de gemtuzumab ozogamicine a été de 9 jours (intervalle: 2 à 298 jours). Une MVO a également été rapportée chez 2 patients ayant reçu Mylotarg comme traitement de suivi après la rechute d'une LMA suite à une chimiothérapie dans le groupe témoin de l'étude portant sur la polythérapie. Chez ces deux patients, la MVO est survenue plus de 28 jours après la dernière dose de gemtuzumab ozogamicine. Chez l'un de ces patients, la MVO est survenue 25 jours après une GCSH consécutive. Un patient (2.0%) sous monothérapie a développé un syndrome d'hyperperméabilité capillaire fatal dont les symptômes concordaient avec ceux d'une MVO (ascite et hyperbilirubinémie).
Sur la base d'une analyse des facteurs de risque potentiels chez les patients adultes ayant reçu Mylotarg en monothérapie, les patients ayant bénéficié d'une GCSH avant l'exposition au gemtuzumab ozogamicine étaient 2.6 fois plus susceptibles (IC à 95%: 1.448-4.769) de développer une MVO par rapport aux patients n'ayant pas bénéficié d'une GCSH avant le traitement par le gemtuzumab ozogamicine. Les patients ayant bénéficié d'une GCSH après le traitement par le gemtuzumab ozogamicine étaient 2.9 fois plus susceptibles (IC à 95%: 1.502-5.636) de développer une MVO par rapport aux patients n'ayant pas bénéficié d'une GCSH après le traitement par le gemtuzumab ozogamicine. Les patients ayant présenté un trouble modéré/sévère de la fonction hépatique à l'inclusion étaient 8.7 fois plus susceptibles (IC à 95%: 1.879-39.862) de développer une MVO par rapport aux patients n'ayant pas présenté de trouble modéré/sévère de la fonction hépatique à l'inclusion.
Les patients doivent être surveillés afin de détecter toute hépatotoxicité, selon les recommandations mentionnées à la rubrique «Mises en garde et précautions». Le traitement des signes et symptômes cliniques de toxicité hépatique peut nécessiter une interruption ou l'arrêt définitif du traitement par Mylotarg (voir rubrique «Posologie/Mode d'emploi»).
Myélosuppression
Au cours de l'étude ALFA-0701 portant sur la polythérapie menée chez des patients naïfs de traitement atteints de LMA de novo et recevant des doses fractionnées de gemtuzumab ozogamicine en association avec une chimiothérapie, des diminutions du nombre de leucocytes, de neutrophiles et de plaquettes de grade 3/4 ont été observées chez 131 (100%), 124 (96.1%) et 131 (100%) patients, respectivement.
Régénération des plaquettes et des neutrophiles
Au cours de la phase d'induction de l'étude ALFA-0701 portant sur la polythérapie, 109 patients (83.2%) et 99 patients (75.6%) ont récupéré une numération plaquettaire à 50'000/mm3 et 100'000/mm3, respectivement. Les délais médians jusqu'à récupération de la numération plaquettaire à 50'000/mm3 et 100'000/mm3 ont été de 34 et 35 jours, respectivement. Au cours du premier cycle de consolidation, 92 (94.8%) et 71 (73.2%) patients ont présenté une récupération de la numération plaquettaire à 50'000/mm3 et 100'000/mm3, respectivement. Les délais médians jusqu'à récupération de la numération plaquettaire à 50'000/mm3 et 100'000/mm3 ont été de 32 et 35 jours, respectivement. Au cours du deuxième cycle de consolidation, 80 (97.6%) et 70 (85.4%) patients ont présenté une récupération de la numération plaquettaire à 50'000/mm3 et 100'000/mm3, respectivement. Les délais médians jusqu'à récupération de la numération plaquettaire à 50'000/mm3 et 100'000/mm3 ont été de 36.5 et 43 jours, respectivement.
Une thrombopénie avec numération plaquettaire <50'000/mm3 persistant 45 jours après le début du traitement chez les patients répondeurs (RC et récupération plaquettaire incomplète [RCp]) est survenue chez 22 (20.4%) des patients. Le nombre de patients présentant une thrombopénie persistante est resté similaire d'un cycle de traitement à l'autre (8 [7.4%] patients en phase d'induction, 8 [8.5%] patients pendant le premier cycle de consolidation et 10 [13.2%] patients pendant le deuxième cycle de consolidation).
Au cours de la phase d'induction de l'étude ALFA-0701 portant sur la polythérapie, 121 (92.4%) et 118 (90.1%) patients ont présenté une récupération des neutrophiles documentée à une NAN de 500/mm3 et 1'000/mm3, respectivement. Le délai médian jusqu'à récupération des neutrophiles à une NAN de 500/mm3 et 1'000/mm3 a été de 25 jours. Au cours du premier cycle de consolidation du traitement, 94 (96.9%) patients ont obtenu une récupération de la numération des neutrophiles à 500/mm3 et 91 (94%) patients ont présenté une récupération de la numération des neutrophiles à 1'000/mm3. Les délais médians jusqu'à récupération des neutrophiles à une NAN de 500/mm3 et 1'000/mm3 ont été de 21 et 25 jours, respectivement. Au cours du deuxième cycle de consolidation du traitement, 80 (97.6%) patients ont obtenu une récupération des neutrophiles à un taux de 500/mm3 et 79 (96.3%) patients ont présenté une récupération des neutrophiles à un taux de 1'000/mm3. Les délais médians jusqu'à récupération des neutrophiles à une NAN de 500/mm3 et 1'000/mm3 ont été de 22 et 27 jours, respectivement.
Infections
Au cours de l'étude ALFA-0701 portant sur la polythérapie, menée chez des patients atteints de LMA de novo recevant des doses fractionnées de gemtuzumab ozogamicine en association avec une chimiothérapie (n=131), 102 (77.9%) patients ont présenté des infections sévères (de grade ≥3), toutes causes confondues. Un décès lié au traitement dû à un choc septique a été rapporté chez 1 (0.8%) patient. Des infections sévères d'issue fatale ont été rapportées chez 2 (1.53%) patients du groupe Mylotarg et chez 4 (2.92%) patients du groupe témoin.
Chez les patients adultes qui ont reçu une monothérapie fractionnée, des infections sévères (grade ≥3), y compris des infections d'issue fatale, ont été observées. Les infections de grade 3/4 les plus fréquentes étaient le sepsis et la pneumonie.
Événements hémorragiques
Au cours de l'étude ALFA-0701 portant sur la polythérapie (n=131), des événements hémorragiques de tous grades et de grade 3/4 ont été rapportés chez 118 (90.1%) et 27 (20.6%) patients, respectivement. Les événements hémorragiques de grade 3 les plus fréquents étaient l'hématémèse (3.1%), l'hémoptysie (3.1%) et l'hématurie (2.3%). Des événements hémorragiques de grade 4 ont été rapportés chez 4 (3.1%) patients (hémorragie gastro-intestinale, hémorragie et hémorragie pulmonaire alvéolaire [2 patients]). Des événements hémorragiques d'issue fatale ont été rapportés chez 3 (2.3%) patients (hématome cérébral, hématome intracrânien et hématome sous-dural).
Chez les patients adultes qui ont reçu une monothérapie fractionnée, des saignements/événements hémorragiques de tous grades de sévérité, y compris de grade 3/4, ont été rapportés. Aucun saignement/événement hémorragique fatal n'a été rapporté.
Le traitement de patients présentant des infections sévères, des saignements/hémorragies ou d'autres effets de la myélosuppression, y compris une neutropénie sévère ou une thrombopénie persistante, peut nécessiter un report ou un arrêt définitif du traitement par Mylotarg (voir «Posologie/Mode d'emploi» et «Mises en garde et précautions»).
Immunogénicité
Comme toutes les protéines thérapeutiques, le gemtuzumab ozogamicine présente un potentiel immunogène.
La détection des anticorps anti-médicament (ADA) dépend fortement de la sensibilité et de la spécificité du test. L'incidence d'une détection positive d'anticorps au cours d'un test peut être influencée par plusieurs facteurs, notamment la méthode d'analyse, les concentrations en médicament circulant, la manipulation des échantillons, le moment de prélèvement des échantillons, les traitements concomitants et les maladies sous-jacentes. Pour ces raisons, la comparaison de l'incidence des anticorps dirigés contre Mylotarg avec l'incidence des anticorps dirigés contre d'autres médicaments peut être trompeuse.
Dans une autre étude clinique, le développement d'ADA dirigés contre Mylotarg a été évalué chez 50 patients adultes atteints de LAM CD33 positive en rechute ou réfractaire.
L'incidence d'ADA et d'anticorps neutralisants (NAb, neutralising antibodies) était de 12.0% et de 2.0%, respectivement. Dans une analyse de pharmacocinétique de population, la présence d'ADA n'a eu aucun effet statistiquement significatif ou cliniquement pertinent sur la PK de l'anticorps hP67.6 total ou de la calichéamicine conjuguée. Aucun des patients n'a présenté d'anaphylaxie, d'hypersensibilité ou d'autres séquelles cliniques liées aux ADA. Sur la base des données limitées disponibles, aucune association directe entre la présence d'ADA et les éventuels problèmes liés à la sécurité du produit n'a pu être établie.
Population pédiatrique
La sécurité et l'efficacité de Mylotarg chez les enfants et adolescents n'ont pas été établies (voir «Posologie/Mode d'emploi»).
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageAucun cas de surdosage de Mylotarg n'a été rapporté à ce jour dans l'expérience clinique. Les doses uniques supérieures à 9 mg/m2 n'ont pas été testées chez les adultes. Le traitement d'un surdosage par Mylotarg doit se composer de mesures de soutien générales.
Propriétés/EffetsCode ATC
L01FX02
Mécanisme d'action
Le gemtuzumab ozogamicine est un conjugué anticorps-médicament (CAM) dirigé contre le CD33. Le gemtuzumab est un anticorps de la classe des immunoglobulines de type G sous-type 4 (IgG4) humanisé qui reconnaît spécifiquement le CD33 humain. La partie anticorps se lie spécifiquement à l'antigène CD33, protéine d'adhésion dépendante de l'acide sialique présente sur la surface des blastes leucémiques myéloïdes et sur les cellules immatures normales de la lignée myélomonocytaire, mais pas sur les cellules souches hématopoïétiques normales. La Nacétyl-gamma-calichéamicine, molécule de bas poids moléculaire, est un produit naturel semi-synthétique cytotoxique. La Nacétyl-gamma-calichéamicine est liée par covalence à l'anticorps via un agent de liaison AcBut (acide 4-(4-acétylphénoxy)butyrique). Les données précliniques suggèrent que l'activité antitumorale du gemtuzumab ozogamicine est due à la liaison du CAM aux cellules cancéreuses exprimant le CD33, suivie par l'internalisation du complexe CAM-CD33 et par la libération intracellulaire du Nacétylgamma-calichéamicine diméthylhydrazide via le clivage hydrolytique de l'agent de liaison. L'activation du Nacétyl-gamma-calichéamicine diméthylhydrazide induit des ruptures des doubles brins d'ADN, induisant par la suite un arrêt du cycle cellulaire et une mort cellulaire apoptotique.
La saturation d'un pourcentage élevé de sites antigéniques CD33 est supposée nécessaire pour l'administration maximale de calichéamicine aux cellules blastiques leucémiques. Plusieurs études en monothérapie ont permis de mesurer la saturation de la cible (CD33) après l'administration de Mylotarg chez des patients atteints de LMA en rechute ou réfractaire. Dans toutes les études, une saturation en CD33 presque maximale dans le sang périphérique a été observée après l'administration de Mylotarg à tous les niveaux de dose de 2 mg/m2 ou plus, ce qui suggère qu'une faible dose de gemtuzumab ozogamicine est suffisante pour lier tous les sites CD33 disponibles.
Électrocardiographie
L'effet de Mylotarg sur l'intervalle QT corrigé a été évalué dans le cadre d'une autre étude clinique chez 50 patients adultes atteints de LAM CD33 positive en rechute ou réfractaire, traités par 3 mg/m2 de Mylotarg les jours 1, 4 et 7. La plus grande modification moyenne de l'intervalle QTcF par rapport à la valeur initiale était de 5.10 ms (IC à 90%: 2.15, 8.06 ms). Aucun patient n'a présenté une augmentation de l'intervalle QTcF par rapport à la valeur initiale >60 ms et aucun patient n'a présenté un intervalle QTcF >480 ms. Respectivement un (1) événement de fibrillation auriculaire (grade 3) et de tachycardie supraventriculaire (grade 3) sont survenus chez le même patient. Aucun effet indésirable de grade 4 ou 5 sur la conduction cardiaque n'a été rapporté.
Aucune étude spéciale («thorough») portant sur l'intervalle QT contrôlée par placebo et moxifloxacine n'a été menée avec Mylotarg à des doses suprathérapeutiques.
Efficacité clinique
Étude ALFA-0701 portant sur des patients naïfs de traitement atteints d'une LMA de novo
L'efficacité et la sécurité de Mylotarg ont été évaluées dans le cadre d'une étude de phase III multicentrique, randomisée, en ouvert, comparant d'une part l'administration de Mylotarg selon un schéma standard de chimiothérapie d'induction comprenant l'association de DNR et d'AraC (DA), et d'autre part l'administration de DA seule. Les patients éligibles avaient entre 50 et 70 ans et présentaient une LMA de novo non traitée auparavant (étude ALFA-0701). Les patients atteints de leucémie aiguë promyélocytaire (LAP, LMA M3) et les patients atteints de LMA provenant d'un syndrome myélodysplasique (SMD) ou d'une LMA déjà traitée auparavant ont été exclus de l'étude.
Le critère d'évaluation primaire était la survie sans événement (SSE). Les critères d'évaluation secondaires étaient les taux de RC et de RCp (rémission complète avec récupération plaquettaire incomplète), la survie sans rechute (SSR), la survie globale (SG) et la sécurité de l'association DA avec ou sans Mylotarg.
Au total, 271 patients ont été randomisés dans cette étude, dont 135 pour recevoir un traitement d'induction par la DNR à raison de 60 mg/m2/jour, administré en perfusion de 30 minutes du Jour 1 au Jour 3 et l'AraC à raison de 200 mg/m2/jour en perfusion continue du Jour 1 au Jour 7 (3+7 DA), plus 3 mg/m2/dose de Mylotarg (jusqu'à un maximum d'un flacon de 5 mg) administrés en perfusion de 2 heures aux Jours 1, 4 et 7, et 136 patients pour recevoir 3+7 DA seule. Un deuxième cycle de traitement d'induction avec DA mais sans Mylotarg, quel que soit le bras de randomisation, a été autorisé. Les patients de l'un ou l'autre bras n'ayant pas reçu le deuxième cycle de traitement d'induction et n'ayant pas obtenu de RC après l'induction pouvaient recevoir un traitement de sauvetage composé d'idarubicine, d'AraC et d'un facteur de stimulation des colonies de granulocytes (G-CSF).
Les patients présentant une RC ou une RCp ont reçu un traitement de consolidation via au maximum 2 cycles de traitement comprenant de la DNR par voie intraveineuse (60 mg/m2 le Jour 1 [premier cycle] ou pendant 2 jours [deuxième cycle]) en association avec de l'AraC administré par voie intraveineuse (1 g/m2 chaque 12 h, administré en perfusion de 2 h du Jour 1 au Jour 4) avec ou sans Mylotarg, en fonction de leur randomisation initiale. Dans chaque cycle de consolidation une dose de 3 mg/m2 de Mylotarg a été administrée en perfusion pendant 2 h jusqu'à un flacon de 5 mg au maximum au Jour 1. Les patients ayant obtenu une rémission étaient également éligibles à une GCSH allogénique. Un intervalle d'au moins 2 mois a été recommandé entre l'administration de la dernière dose de Mylotarg et la greffe.
Dans l'ensemble, l'âge médian des patients a été de 62 ans (intervalle: 50 à 70 ans) et la plupart des patients (87.8%) ont présenté un indice de performance ECOG (Eastern Cooperative Oncology Group) de 0 à 1 au moment de l'inclusion. Les caractéristiques initiales étaient équilibrées entre les groupes de traitement à l'exception du sexe. En effet, un pourcentage plus élevé d'hommes a été inclus dans le groupe Mylotarg (54.8%) par rapport au groupe DA seule (44.1%). Dans l'ensemble, respectivement 59.0% et 65.3% des patients ont présenté une maladie LMA à risque favorable/intermédiaire documentée selon les classifications de risque du National Comprehensive Cancer Network (NCCN) et de l'European LeukaemiaNet (ELN) 2010. L'expression du CD33 sur les blastes de LMA par cytométrie en flux harmonisée à partir des résultats biologiques locaux a été déterminée chez 194 sur 271 (71.6%) patients au total. Peu de patients (13.7%) ont présenté une faible expression du CD33 (moins de 30% des blastes).
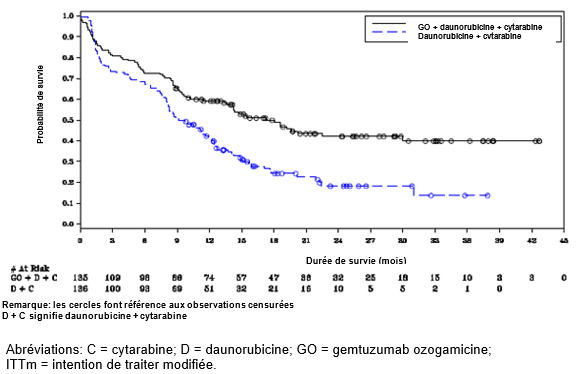
L'essai a atteint son objectif principal visant à démontrer que l'ajout de Mylotarg en doses fractionnées (3x3 mg/m2) à la chimiothérapie d'induction standard pour les patients naïfs de traitement atteints de LMA de novo a entraîné une amélioration statistiquement et cliniquement significative de la SSE. La SSE médiane a été de 17.3 mois (IC à 95%: 13.4-30.0) dans le bras Mylotarg versus 9.5 mois (IC à 95%: 8.1-12.0) dans le bras DA seule; rapport de risque (RR) 0.562 (IC à 95%: 0.415-0.762); valeur de p bilatérale = 0.0002 par test du log-rank. Les données d'efficacité issues de l'étude ALFA-0701 sont présentées dans le Tableau 6 et la courbe de Kaplan-Meier de la SSE apparaît à la Figure 1.
Tableau 6: Résultats d'efficacité provenant de l'étude ALFA-0701 (population en ITTm)
|
|
Mylotarg +
daunorubicine + cytarabine
|
Daunorubicine + cytarabine
| |
Survie sans événement (évaluée par l'investigateur)
|
n=135
|
n=136
| |
Nombre d'événements, n (%)
|
73 (54.1)
|
102 (75.0)
| |
SSE médiane en mois [IC à 95%]a
|
17.3 [13.4-30.0]
|
9.5 [8.1-12.0]
| |
Probabilité de SSE à 2 ans [IC à 95%]b
|
42.1 [32.9-51.0]
|
18.2 [11.1-26.7]
| |
Probabilité de SSE à 3 ans [IC à 95%]b
|
39.8 [30.2-49.3]
|
13.6 [5.8-24.8]
| |
Rapport de risque [IC à 95%]c
|
0.562 [0.415-0.762]
|
| |
Valeur de pd
|
0.0002
|
| |
Survie sans événement (selon une étude indépendante)
|
n=135
|
n=136
| |
Nombre d'événements, n (%)
|
78 (57.8)
|
100 (73.5)
| |
SSE médiane en mois [IC à 95%]a
|
13.6 [9.0, 19.2]
|
8.5 [7.5, 12.0]
| |
Probabilité de SSE à 2 ans [IC à 95%]b
|
38.5 [29.6, 47.3]
|
18.1 [11.1, 26.5]
| |
Probabilité de SSE à 3 ans [IC à 95%]b
|
36.5 [27.3, 45.7]
|
13.6 [5.8, 24.7]
| |
Rapport de risque [IC à 95%]c
|
0.661 [0.491, 0.891]
|
| |
Valeur de pd
|
0.0059
|
| |
Survie sans rechute (évaluée par l'investigateur)
|
n=110
|
n=100
| |
Nombre d'événements, n (%)
|
49 (44.5)
|
66 (66.0)
| |
SSR médiane en mois [IC à 95%]a
|
28.0 [16.3-non estimable]
|
11.4 [10.0-14.4]
| |
Rapport de risque [IC à 95%]c
|
0.526 [0.362-0.764]
|
| |
Valeur de pd
|
0.0006
|
| |
Survie globale
|
n=135
|
n=136
| |
Nombre de décès, n (%)
|
80 (59.3)
|
88 (64.7)
| |
SG médiane en mois [IC à 95%]a
|
27.5 [21.4-45.6]
|
21.8 [15.5-27.4]
| |
Rapport de risque [IC à 95%]c
|
0.807 [0.596-1.093]
|
| |
Valeur de pd
|
0.1646
|
| |
Taux de réponse (évalué par l'investigateur)
|
n=135
|
n=136
| |
Réponse globale en % [IC à 95%]e
|
81.5 [73.89-87.64]
|
73.5 [65.28-80.72]
| |
RC
|
70.4
|
69.9
| |
RCp
|
11.1
|
3.7
| |
Différence de risque [IC à 95%]f
|
7.95 [-3.79-19.85]
|
| |
Valeur de pg
|
0.1457
|
| |
D'après la définition initiale de la SSE: dates de l'événement (échec de l'induction, rechute ou décès). Lors d'une évaluation par l'investigateur, l'échec du traitement d'induction, la rechute ou le décès a été déterminé; l'étude indépendante a considéré que la date de l'échec au traitement d'induction était la date de randomisation.
La population en ITTm a inclus tous les patients ayant été randomisés, sauf en cas de retrait du consentement avant le début du traitement, et ayant été évalués en fonction du bras de randomisation initial.
Abréviations: RC = rémission complète; RCp = rémission complète avec récupération plaquettaire incomplète; IC = intervalle de confiance; SSE = survie sans événement; ITTm = intention de traiter modifiée; n = nombre; SG = survie globale; SSR = survie sans rechute.
a. Médiane estimée par la méthode de Kaplan-Meier; IC basé sur la méthode de Brookmeyer-Crowley avec transformation log-log.
b. Estimée à partir de la courbe de Kaplan-Meier. Probabilité (%) calculée via la méthode limite-produit; IC calculé à partir de la transformation log-log de la probabilité de survie à l'aide d'une approximation normale et de la formule de Greenwood.
c. Basé sur le modèle à risques proportionnels de Cox versus daunorubicine + cytarabine.
d. Valeur de p bilatérale estimée à partir du test du log-rank.
e. Réponse définie comme RC + RCp.
f. Différence de réponse globale; IC basé sur la méthode de Santner et Snell.
g. Sur la base d'un test exact de Fisher.
|
Figure 1. Courbe de Kaplan-Meier de la survie sans événement évaluée par l'investigateur à partir des données issues de l'étude ALFA-0701 (population en ITTm)
Utilisation dans le cadre d'une LMA associée à un profil cytogénétique à risque élevé
Dans les analyses de sous-groupes de l'étude ALFA-0701, l'ajout de Mylotarg à la DNR et l'AraC a amélioré la SSE dans le sous-groupe de patients présentant un profil de risque cytogénétique favorable ou intermédiaire (RR 0.46; IC à 95%: 0.31, 0.68), ce qui n'est pas le cas dans le sous-groupe de patients présentant un profil de risque cytogénétique élevé (RR 1.11; IC à 95%: 0.63, 1.95).
PharmacocinétiqueLe gemtuzumab ozogamicine est un conjugué anticorps-médicament (CAM) composé d'un anticorps monoclonal dirigé contre le CD33 (hP67.6) qui est lié par covalence à l'agent cytotoxique Nacétyl-gamma-calichéamicine. La pharmacocinétique (PK) du gemtuzumab ozogamicine a été étudiée à l'aide des caractéristiques PK de l'anticorps (hP67.6) total ainsi que de la calichéamicine conjuguée et non conjuguée.
Les données PK cliniques ont été recueillies à la suite de l'administration de Mylotarg selon un schéma posologique en monothérapie (de 3 mg/m2 jusqu'à un flacon de 5 mg aux jours 1, 4 et 7). Les paramètres d'exposition déterminés par la moyenne géométrique de l'ASC336 (aire sous la courbe de concentration plasmatique en fonction du temps, de l'instant zéro à 336 heures après la dose) et de la Cmax (concentration plasmatique maximale) après l'administration de doses multiples de calichéamicine conjuguée et d'anticorps hP67.6 total étaient respectivement de 461'500 pg.h/ml et 11'740 pg/ml et de 26'820 ng.h/ml et 585.6 ng/ml. Les données PK de la calichéamicine non conjuguée ne sont pas présentées en raison de problèmes d'instabilité dans le plasma.
Un résumé des paramètres PK chez les patients ayant reçu 9 mg/m2 de gemtuzumab ozogamicine (2 doses à un intervalle de 14 jours) est présenté dans le Tableau 7.
Tableau 7: Résumé des paramètres pharmacocinétiques de hP67.6 et de la calichéamicine non conjuguée après l'administration par voie intraveineuse de 9 mg/m2 de gemtuzumab ozogamicine
|
Sous-ensemble testé
|
Période d'administration de la dose
|
Cmax (ng/ml)
|
AUCinf (ng•h/ml)
| |
hP67.6
|
1
|
3'028±1'943
|
137'400±142'080
| |
2
|
3'618±1'634
|
263'700±305'120
| |
Calichéamicine non conjuguée
|
1
|
5.79±3.50
|
317±340
| |
2
|
6.64±3.71
|
397±286
| |
Toutes les valeurs sont fournies sous forme de moyenne ± écart-type
|
Absorption
Non pertinent.
Distribution
In vitro, la liaison du Nacétyl-gamma-calichéamicine diméthylhydrazide aux protéines plasmatiques humaines est d'environ 97%. Dans l'analyse de pharmacocinétique de population, qui comporte les données de 50 patients présentant une LMA en rechute ou réfractaire, le volume total de distribution de l'anticorps hP67.6 était d'environ 20 l après un schéma posologique en monothérapie (de 3 mg/m2 jusqu'à un flacon de 5 mg aux jours 1, 4 et 7).
Métabolisme
Le métabolisme du gemtuzumab ozogamicine et de la Nacétyl-calichéamicine n'a pas été étudié in vivo chez l'humain. On suppose que le gemtuzumab ozogamicine est internalisé après sa liaison à la cible CD33 et que la Nacétyl-calichéamicine est libérée par scission hydrolytique. Des études in vitro ont démontré que le Nacétyl-gamma-calichéamicine diméthylhydrazide est fortement métabolisé, principalement par réduction non enzymatique de la fraction disulfure.
Élimination
D'après une analyse de pharmacocinétique de population portant sur les données de 50 patients atteints de LAM en rechute ou réfractaire, la clairance de l'anticorps hP67.6 total était de 0.288 l/h, et la demi-vie d'élimination terminale (t½) a été estimée à 96.6 heures suivant un schéma d'administration de Mylotarg en monothérapie (de 3 mg/m2 jusqu'à un flacon de 5 mg aux jours 1, 4 et 7).
Les voies d'excrétion de la Nacétyl-calichéamicine et de ses métabolites n'ont pas été systématiquement étudiées in vivo et chez l'humain.
Cinétique pour certains groupes de patients
Âge, origine ethnique et sexe
Dans une analyse pharmacocinétique de population, aucune influence significative de l'âge, de l'origine ethnique et du sexe n'a été observée sur la pharmacocinétique du gemtuzumab ozogamicine.
Troubles de la fonction hépatique
Aucune étude PK officielle sur le gemtuzumab ozogamicine n'a été réalisée chez les patients présentant des troubles de la fonction hépatique.
D'après une analyse pharmacocinétique de population, la clairance du gemtuzumab ozogamicine (anticorps hP67.6 et calichéamicine non conjuguée) ne devrait pas être affectée par un trouble léger de la fonction hépatique tel que défini par le National Cancer Institute Organ Dysfunction Working Group (NCI ODWG). L'analyse a inclus 405 patients dans les catégories suivantes de troubles de la fonction hépatique du NCI ODWG: trouble léger de la fonction hépatique (B1, n=58 et B2, n=19), trouble modéré de la fonction hépatique (C, n=6) et fonction hépatique normale (n=322) (voir «Posologie/Mode d'emploi»). La PK du gemtuzumab ozogamicine chez les patients présentant un trouble modéré de la fonction hépatique (bilirubine totale supérieure à 1.5x à 3.0x LSN) était comparable à celle des patients présentant une fonction hépatique normale, cependant elle doit être interprétée avec prudence car l'échantillon est petit (n=6). La PK du gemtuzumab ozogamicine n'a pas été étudiée chez les patients présentant un trouble sévère de la fonction hépatique (bilirubine totale supérieure à 3x LSN).
Troubles de la fonction rénale
Aucune étude PK officielle sur le gemtuzumab ozogamicine n'a été réalisée chez les patients présentant une insuffisance rénale.
D'après une analyse pharmacocinétique de population réalisée auprès de 406 patients, la clairance du gemtuzumab ozogamicine chez les patients présentant un trouble léger de la fonction rénale (clairance de la créatinine [Clcr] 60-89 ml/min; n=149) ou trouble modéré de la fonction rénale (Clcr 30-59 ml/min; n=47) a été similaire à celle observée chez les patients présentant une fonction rénale normale (Clcr ≥90 ml/min; n=209). La PK du gemtuzumab ozogamicine n'a pas pu être étudiée chez les patients présentant un trouble sévère de la fonction rénale (Clcr 15-29 ml/min; n=1).
Données précliniquesToxicité en cas d'administration répétée
Les principales toxicités sont survenues dans le foie, la moelle osseuse et les organes lymphoïdes, les paramètres hématologiques (diminution de la masse érythrocytaire et des leucocytes [principalement des lymphocytes]), les reins, les yeux et les organes sexuels masculins et féminins. Les effets sur le foie, les reins et les organes sexuels mâles chez le rat et sur les tissus lymphoïdes chez le singe (environ 18 fois chez le rat et 36 fois chez le singe l'exposition clinique humaine après la troisième dose humaine de 3 mg/m2 sur la base de l'AUC168) n'ont pas été réversibles. Au cours de l'étude de 12 semaines, des effets indésirables ont été observés sur les organes sexuels femelles et les yeux chez le singe (respectivement environ 193 et 322 fois l'exposition clinique humaine après la troisième dose humaine de 3 mg/m2 sur la base de l'AUC168). On ignore quelle est la pertinence pour l'humain des résultats irréversibles observés chez les animaux. Aucun effet sur le système nerveux n'a été observé chez les animaux après l'administration de Mylotarg. Des modifications du système nerveux ont été identifiées chez des rats avec d'autres conjugués anticorps à base de calichéamicine.
Génotoxicité
Le gemtuzumab ozogamicine s'est révélé clastogène. Cela est cohérent avec l'induction connue d'une rupture de brins d'ADN par la calichéamicine et d'autres antibiotiques antitumoraux de la classe des ènediynes. Le Nacétyl-gamma-calichéamicine diméthylhydrazide (la cytotoxine libérée) s'est révélé mutagène et clastogène.
Carcinogénicité
Aucune étude de carcinogénicité formelle portant sur le gemtuzumab ozogamicine n'a été réalisée. Au cours d'études de toxicité, des rats ont développé des lésions prénéoplasiques (hyperplasie minime à légère des cellules ovales) dans le foie à environ 54 fois l'exposition clinique humaine après la troisième dose humaine de 3 mg/m2 (sur la base de l'AUC168). Aucune lésion prénéoplasique ou néoplasique n'a été observée chez les singes jusqu'à environ 115 fois l'exposition clinique humaine après la troisième dose humaine de 3 mg/m2 (sur la base de l'AUC168). La pertinence pour l'être humain de ces résultats observés chez les animaux n'est pas claire.
Toxicité sur la reproduction
Au cours d'une étude de fertilité menée chez le rat femelle, un nombre légèrement inférieur de corps jaunes et une augmentation de l'embryolétalité ont été observés en présence d'une toxicité maternelle (environ 9.7 fois l'exposition clinique humaine après la troisième dose humaine de 3 mg/m2, sur la base de l'AUC168). Au cours de l'étude de 12 semaines, des effets sur l'appareil reproducteur de singes femelles ont été observés (atrophie des ovaires, de l'oviducte, de l'utérus et du col de l'utérus, à environ 193 fois l'exposition clinique humaine après la troisième dose de 3 mg/m2).
Au cours d'une étude de fertilité masculine, les effets sur la reproduction masculine ont inclus une baisse du nombre de spermatogonies et de spermatocytes, une baisse du nombre de spermatides testiculaires et de la quantité de sperme épididymaire, une vacuolisation du noyau dans les spermatides et/ou l'apparition de cellules géantes. Des effets sur les testicules, les épididymes et les glandes mammaires ainsi que sur la fertilité ont également été constatés. Lors d'un nouvel accouplement des rats mâles après une période sans traitement de 9 semaines, les effets sur le sperme et la fertilité ont été plus marqués, mais une récupération partielle des taux de spermatogonies et de spermatocytes a pu être observée dans les testicules. Les effets sur les organes sexuels des rats mâles ont été partiellement réversibles ou non réversibles (voir «Grossesse, Allaitement»). Des effets sur les organes sexuels mâles (testicules, épididymes, vésicules séminales) chez le singe ont été observés à environ 66 fois l'exposition clinique humaine après la troisième dose de 3 mg/m2.
Au cours d'une étude de toxicité embryofœtale, une diminution du poids corporel du fœtus, une incidence plus élevée des côtes déformées chez le fœtus et une incidence plus faible d'ossification du squelette fœtal ont été observées. L'augmentation de l'embryolétalité ainsi que les anomalies morphologiques fœtales ont inclus des malformations digitales, l'absence de la crosse aortique, des anomalies au niveau des os longs des membres antérieurs, une déformation des omoplates, l'absence de centre vertébral et des sternèbres soudées. Une augmentation de l'embryolétalité a également été observée en présence d'une toxicité maternelle. La dose la plus faible ayant eu des effets embryofœtaux correspondait à 9.7 fois l'exposition clinique humaine après la troisième dose humaine de 3 mg/m2, sur la base de l'AUC168 (voir «Grossesse, Allaitement»).
Remarques particulièresIncompatibilités
En l'absence d'études de compatibilité, ce médicament ne doit pas être mélangé à d'autres médicaments.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Stabilité après ouverture
Les solutions reconstituées et diluées de Mylotarg doivent être protégées de la lumière. Les solutions doivent être utilisées immédiatement. Ne pas congeler la solution reconstituée et diluée.
Si le médicament ne peut pas être utilisé immédiatement:
·Après reconstitution, le flacon d'origine peut être conservé jusqu'à 16 h au réfrigérateur (2-8 °C) ou jusqu'à 3 h à température ambiante (en dessous de 30 °C).
·La solution diluée peut être conservée jusqu'à 18 h au réfrigérateur (2-8 °C) et jusqu'à 6 h à température ambiante (en dessous de 30 °C). La durée de conservation autorisée à température ambiante (en dessous de 30 °C) comprend le temps requis pour la préparation de la solution diluée, l'adaptation à la température ambiante, si nécessaire, et l'administration au patient. Le délai maximal à partir de la préparation de la solution diluée jusqu'à son administration ne doit pas excéder 24 h.
Remarques particulières concernant le stockage
Conserver au réfrigérateur (2-8 °C), à l'abri de la lumière et hors de portée des enfants. Ne pas congeler.
Remarques concernant la manipulation
Utiliser une technique aseptique appropriée pour les procédures de reconstitution et de dilution. Mylotarg est sensible à la lumière et doit être protégé des rayons ultraviolets pendant la reconstitution, la dilution et l'administration.
Reconstitution
·Calculer la dose (en mg) de Mylotarg nécessaire.
·Avant de procéder à la reconstitution, attendre environ 5 minutes pour permettre au flacon d'atteindre la température ambiante (en dessous de 30 °C). Reconstituer chaque flacon de 5 mg à l'aide de 5 ml d'eau pour préparations injectables, afin d'obtenir une solution à usage unique de 1 mg/ml de gemtuzumab ozogamicine.
·Remuer doucement le flacon pour faciliter la dissolution. Ne pas agiter.
·Inspecter visuellement la solution reconstituée en vue de détecter toute particule ou coloration anormale. La solution reconstituée peut contenir de petites particules blanches à blanc cassé, opaques à translucides et amorphes à fibreuses.
·Mylotarg ne contient aucun conservateur bactériostatique.
·Si la solution reconstituée ne peut pas être utilisée immédiatement, elle doit être conservée dans le flacon d'origine, pendant 16 h maximum, au réfrigérateur (entre 2 °C et 8 °C) ou jusqu'à 3 h à température ambiante (en dessous de 30 °C). Protéger de la lumière et ne pas congeler.
Dilution
·Calculer le volume requis de solution reconstituée nécessaire pour obtenir le dosage approprié, en fonction de la surface corporelle du patient. Prélever cette quantité du flacon à l'aide d'une seringue. Les flacons de Mylotarg contiennent 5 mg de médicament, sans surremplissage. Une fois reconstituée à la concentration de 1 mg/ml comme indiqué, la quantité extractible du flacon est de 4.5 mg (4.5 ml). Protéger de la lumière. Éliminer toute solution reconstituée non utilisée encore présente dans le flacon.
·Les doses doivent être mélangées en vue d'obtenir une concentration comprise entre 0.075 mg/ml et 0.234 mg/ml, conformément aux instructions suivantes:
·Les doses inférieures à 3.9 mg doivent être préparées en vue de l'administration à l'aide d'une seringue. Ajouter la solution reconstituée de Mylotarg dans une seringue avec une solution injectable de chlorure de sodium à 9 mg/ml (0.9%), jusqu'à l'obtention d'une concentration finale comprise entre 0.075 mg/ml et 0.234 mg/ml. Protéger de la lumière.
·Les doses supérieures ou égales à 3.9 mg doivent être diluées dans une seringue ou un contenant de perfusion dans un volume approprié de solution injectable de chlorure de sodium à 9 mg/ml (0.9%), jusqu'à l'obtention d'une concentration finale comprise entre 0.075 mg/ml et 0.234 mg/ml. Protéger de la lumière.
·Retourner doucement le contenant de perfusion afin de mélanger la solution diluée. Ne pas agiter.
·Après la dilution avec une solution injectable de chlorure de sodium à 9 mg/ml (0.9%), la solution de Mylotarg doit être perfusée immédiatement. Si le médicament n'est pas utilisé immédiatement, il peut être conservé jusqu'à 18 h au réfrigérateur (2-8 °C) et jusqu'à 6 h à température ambiante (en dessous de 30 °C). La durée de conservation autorisée à température ambiante (en dessous de 30 °C) comprend le temps requis pour la préparation de la solution diluée, la remontée jusqu'à température ambiante, si nécessaire, et l'administration au patient. Le délai maximal à partir de la préparation de la solution diluée jusqu'à son administration ne doit pas excéder 24 h. Protéger de la lumière et ne pas congeler.
·Il est recommandé d'utiliser un contenant de perfusion constitué de polychlorure de vinyle (PVC) avec DEHP, d'éthylène-acétate de vinyle (EVA) ou de polyoléfine (polypropylène et/ou polyéthylène).
Administration
·Il est nécessaire de procéder à une filtration de la solution diluée. Pour la perfusion de Mylotarg, il faut utiliser un filtre en ligne de 0.2 micron fait de polyéthersulfone (PES) à faible liaison protéique.
·L'administration des doses par seringue doit être effectuée via des lignes de perfusion de petit diamètre (micro alésage) avec un filtre en ligne de 0.2 micron fait de PES à faible liaison protéique.
·Pendant la perfusion, la poche à perfusion ou la seringue doivent être protégées de la lumière à l'aide d'une couverture occultante (bloquant les rayons ultraviolets). Il n'est pas nécessaire de protéger la tubulure de perfusion de la lumière.
·Perfuser la solution diluée pendant 2 h. La perfusion doit être terminée avant la fin de la durée de conservation autorisée de la solution diluée à température ambiante (en dessous de 30 °C) de 6 h.
·L'utilisation de tubulures de perfusion constituées de PVC (avec ou sans DEHP), de polyuréthane ou de polyéthylène est recommandée.
Ne pas mélanger ou administrer Mylotarg en perfusion avec d'autres médicaments.
Numéro d’autorisation66879 (Swissmedic).
PrésentationMylotarg 5 mg: 1 flacon [A].
Titulaire de l’autorisationPfizer AG, Zürich.
Mise à jour de l’informationMai 2023
LLD V012
|

