| Information professionnelle sur Jivi® 1000, 2000, 3000 UI: | Bayer (Schweiz) AG | | CompositionPrincipes actifs
Damoctocog alfa pégol (facteur VIII de coagulation humain recombinant, pégylé, délété du domaine B [PEG-BDD-rFVIII]).
Excipients
Poudre: Saccharum, Histidinum, Glycinum, Natrii chloridum 4.7 mg, Calcii chloridum dihydricum, Polysorbat 80 (produit à partir de maїs génétiquement modifié, Zea mays), acidum aceticum glaciale q.s. ad pH.
Solvant
2.5 ml Aqua ad injectabilia.
Indications/Possibilités d’emploiTraitement et prophylaxie des hémorragies chez des patients ≥12 ans atteints d'hémophilie A (déficit congénital en facteur VIII) préalablement traités (PTP).
Jivi ne contient pas de facteur de von Willebrand. Par conséquent, il n'est pas indiqué dans le traitement de la maladie de von Willebrand.
Posologie/Mode d’emploiLa posologie et la durée du traitement substitutif en facteur VIII dépendent des besoins du patient (en fonction du poids du patient, de la sévérité du déficit en facteur VIII, de la localisation et de l'importance de l'hémorragie et du taux de facteur VIII souhaité).
Le calcul de la posologie nécessaire de facteur VIII repose sur l'analyse empirique établissant que l'administration de 1 UI de facteur VIII par kg de poids corporel accroît l'activité du facteur VIII dans le plasma de 1.5% à 2.5% – rapportée à la valeur normale.
L'effet clinique du facteur VIII est l'élément le plus important pour évaluer l'efficacité du traitement. La dose maximale recommandée par injection est d'environ 6000 UI.
Dans certaines circonstances, des posologies plus élevées de Jivi que celles calculées peuvent s'avérer nécessaires pour obtenir des résultats cliniques satisfaisants. Si la dose calculée ne permet pas d'obtenir le taux de FVIII attendu ou de maîtriser l'hémorragie, il faut penser à la présence d'un inhibiteur du facteur VIII ou d'un anticorps anti-PEG.
Traitement à la demande
La formule suivante permet de calculer la dose nécessaire:
Unités nécessaires (UI) = poids corporel (kg) × accroissement souhaité du facteur VIII (% ou UI/dl) × valeur inverse de la récupération attendue/observée.
La posologie nécessaire pour l'obtention d'une hémostase dépend du type et de la sévérité de l'épisode hémorragique.
En présence d'évènements hémorragiques tels que ceux cités ci-dessous, l'activité du facteur VIII ne doit pas descendre en dessous du niveau d'activité plasmatique indiqué (en [% par rapport à la valeur normale] UI/dl]) pendant la période correspondante. Le tableau ci-dessous (Tableau 1) peut être utilisé à titre indicatif pour déterminer la posologie nécessaire au cours des épisodes hémorragiques et des interventions chirurgicales.
Tableau 1
|
Sévérité de l'hémorragie/Type d'intervention chirurgicale
|
Taux d'activité du facteur VIII nécessaire
(%) (UI/dl)
|
Fréquence d'administration (heures)/Durée du traitement (jours)
| |
Hémorragies
| |
Hémorragies légères (stades précoces d'hémarthroses, hémorragies musculaires légères, hémorragies de la cavité buccale)
|
20-40
|
Injection toutes les 24 à 48 heures jusqu'à l'arrêt de l'hémorragie (signalée par la douleur) ou la cicatrisation.
| |
Hémorragies modérées à sévères (hémarthroses marquées, hémorragies musculaires ou hématomes)
|
30-60
|
Répéter l'injection toutes les 24 à 48 heures jusqu'à la disparition des douleurs et de l'invalidité.
| |
Hémorragies mettant en jeu le pronostic vital
|
60-100
|
Répéter l'injection toutes les 8 à 24 heures jusqu'à ce que le patient soit hors de danger.
| |
Interventions chirurgicales
| |
Interventions mineures y compris extractions dentaires
|
30-60
|
Injections toutes les 24 heures; au moins 1 jour jusqu'à la cicatrisation.
| |
Interventions majeures
|
80–100 (phase pré- et post-opératoire)
|
Répéter les injections toutes les 12 à 24 heures jusqu'à cicatrisation satisfaisante, puis poursuivre le traitement pendant au moins 7 jours supplémentaires pour maintenir le taux de facteur VIII entre 30% et 60%.
|
Surveillance du traitement
Au cours du traitement, il est conseillé d'effectuer une détermination appropriée des taux de facteur VIII plasmatique afin de confirmer que des niveaux adéquats de facteur VIII sont obtenus. Chaque patient peut réagir différemment au facteur VIII et présenter des demi-vies et une récupération variables. Dans certains cas, en particulier chez les jeunes patients, des intervalles posologiques plus courts ou des doses plus importantes peuvent être nécessaires. Une adaptation posologique basée sur le poids corporel peut être nécessaire chez les patients présentant un faible poids ou un surpoids. Dans le cas particulier d'interventions chirurgicales majeures, une surveillance étroite du traitement substitutif par détermination du statut de coagulation (mesure de l'activité du facteur VIII) est indispensable.
Prophylaxie
Toutes les décisions concernant le choix du schéma thérapeutique approprié pour la prophylaxie doivent être fondées sur le jugement clinique et sur les caractéristiques et la réponse au traitement de chaque patient.
Le schéma posologique initial recommandé est de 30 à 40 UI/kg deux fois par semaine. Le schéma posologique peut aussi être de 45 à 60 UI/kg tous les 5 jours, selon la fréquence des épisodes hémorragiques.
Le schéma posologique de Jivi peut être individualisé en réduisant la fréquence d'administration, p. ex. 60 UI/kg tous les 7 jours.
Mode et durée d'administration
Après dissolution dans le solvant fourni, Jivi est administré par voie intraveineuse. La vitesse d'injection doit être déterminée en fonction de la réponse de chaque patient.
Posologie pour des groupes de patients particuliers
Enfants et adolescents
Jivi ne doit pas être utilisé chez les patients naïfs de traitement ni chez les patients de moins de 12 ans.
Patients non préalablement traités
Jivi ne doit pas être utilisé chez les patients non préalablement traités (PUP).
Insuffisance rénale/insuffisance hépatique
L'adaptation posologique chez les patients insuffisants rénaux/hépatiques n'a pas été étudiée lors des études cliniques.
Tests de coagulation
En cas d'utilisation d'un test de coagulation en un temps reposant sur le temps de céphaline activé (TCA) (activated partial thromboplastin time aPTT) pour déterminer l'activité du facteur VIII dans les échantillons de sang du patient, les résultats peuvent être fortement influencés par le type de réactif utilisé pour la détermination du TCA et par le standard de référence utilisé, ce qui peut entraîner une surestimation ou une sous-estimation de l'activité du facteur VIII.
Des tests chromogéniques (conformément à la pharmacopée européenne) peuvent être utilisés pour effectuer une mesure correcte de l'activité du facteur VIII induite par Jivi, des différences significatives entre les résultats du test de coagulation en un temps reposant sur le TCA et ceux du test chromogénique peuvent toutefois être observées. Ceci a son importance lors de la surveillance de l'activité du facteur VIII de Jivi et en cas de changement de laboratoire et/ou de réactifs utilisés pour le test.
Dans le cas de produits à base de facteur VIII modifiés dont la demi-vie est prolongée, les résultats du test de coagulation en un temps dépendent fortement du standard de référence utilisé et du type de réactif utilisé pour la détermination du TCA, ce qui peut entraîner une surestimation ou une sous-estimation de l'activité du facteur VIII. Une étude sur le terrain a révélé que l'activité du facteur VIII de Jivi dans le plasma peut être mesurée avec exactitude en utilisant soit une méthode validée de dosage sur substrat chromogénique soit un test de coagulation en un temps. Dans le cadre de cette étude réalisée sur le terrain, l'activité du facteur VIII de Jivi dans les échantillons plasmatiques a été sous-estimée lorsque des tests en un temps spécifiques à base de silice (p.ex. APTT-SP [temps de céphaline activé/phospholipide synthétique], STA-PTT [Stago STA-PTT Automate 5] ont été utilisés.
Afin d'assurer la traçabilité des médicaments biotechnologiques, il convient de documenter pour chaque traitement le nom commercial et le numéro de lot.
Contre-indicationsHypersensibilité au principe actif ou à l'un des excipients.
Réactions allergiques connues aux protéines de souris ou de hamster.
Mises en garde et précautionsHypersensibilité
Lors de l'utilisation de Jivi, des réactions d'hypersensibilité incluant l'anaphylaxie peuvent survenir.
Les patients doivent être informés des premiers signes possibles de réaction d'hypersensibilité, tels que l'oppression thoracique, la sensation de vertige, l'hypotension légère et les nausées survenant pendant l'injection, qui peuvent évoluer en une réaction anaphylactique. Un traitement symptomatique de la réaction d'hypersensibilité doit être instauré sous la forme qui s'impose. Les réactions allergiques ou anaphylactiques exigent une interruption immédiate de l'injection. En cas d'anaphylaxie, le traitement de l'état de choc doit respecter les directives de traitement standard actuelles.
Des réactions d'hypersensibilité peuvent aussi être provoquées par des anticorps anti-PEG (voir rubrique ci-dessous «Réponse immunitaire au polyéthylène glycol (PEG)»).
Inhibiteurs
La formation d'anticorps neutralisants du facteur VIII (facteurs inhibiteurs) est une complication connue du traitement de patients atteints d'hémophilie A. Ces inhibiteurs sont en général des immunoglobulines IgG dirigées contre l'activité procoagulante du facteur VIII qui est exprimée en unités Bethesda modifiées (B.E.). Le risque d'apparition d'inhibiteurs est corrélé à l'exposition au facteur de coagulation VIII ainsi qu'à d'autres facteurs génétiques et environnementaux, ce risque étant le plus important au cours des 20 premiers jours de l'exposition. Des inhibiteurs n'apparaissent que rarement après plus de 100 jours d'exposition. Les patients traités par un facteur VIII doivent être surveillés attentivement sur le plan clinique et au moyen de tests de laboratoire adéquats afin de détecter l'apparition d'inhibiteurs.
Réponse immunitaire au polyéthylène glycol (PEG)
Au cours des 4 premiers jours d'exposition, une réponse immunitaire clinique associée aux anticorps anti-PEG, se manifestant par des symptômes d'hypersensibilité aiguë et/ou une perte d'efficacité clinique a été observée surtout chez les patients âgés de moins de 6 ans (chez 10 patients sur 44).
Chez les patients à partir de l'âge de 7 ans, un patient a développé une réaction d'hypersensibilité associée à une augmentation du taux d'anticorps IgM anti-PEG le 4e jour de l'exposition. Un autre patient a présenté une perte d'efficacité clinique associée à un titre d'anticorps IgM anti-PEG élevé après le 2e jour d'exposition.
Cette réponse immunitaire clinique a été transitoire et est survenue en l'absence d'inhibiteurs du facteur VIII. Les patients ont pu reprendre le traitement par le facteur VIII qui avait auparavant été efficace.
En cas de suspicion clinique de perte d'efficacité du médicament, il est recommandé d'effectuer des tests pour déceler la présence d'inhibiteurs du facteur VIII et évaluer la récupération du facteur VIII.
Après l'injection, un faible taux de facteur VIII en l'absence de taux décelables d'inhibiteurs de facteur FVIII indique que la perte d'efficacité est probablement attribuable à la présence d'un titre élevé d'anticorps IgM anti-PEG. Le cas échéant, il faut arrêter le traitement par Jivi et les patients doivent passer sans délai à un produit de facteur VIII non pégylé qui avait déjà été efficace auparavant.
En raison de la nature transitoire des anticorps IgM anti-PEG qui disparaissent dans les 4 à 6 semaines, une reprise du traitement par Jivi peut être envisagée. Les taux de récupération du facteur VIII doivent être contrôlés lors de la reprise du traitement.
Aucun cas de changement de classe des immunoglobulines passant de IgM à IgG n'a été observé.
Infections liées au cathéter
Des infections liées au cathéter peuvent se produire si Jivi est administré par le biais d'un cathéter central (voie veineuse centrale, VVC). De telles infections ne sont pas intrinsèquement liées au médicament.
Affections cardiovasculaires
Dès la normalisation de leur coagulation sous le traitement par le facteur VIII, les patients atteints d'hémophilie et présentant des facteurs de risque cardiovasculaires ou une affection cardiovasculaire ont le même risque d'évènement cardiovasculaire que les patients ne souffrant pas d'hémophilie.
Autres remarques
Jivi contient moins de 1 mmol (correspondant à 23 mg) de sodium par flacon, c.-à-d. qu'il est essentiellement «sans sodium».
InteractionsAucune interaction médicamenteuse des produits à base de facteur VIII humain de coagulation n'a été rapportée.
Grossesse, allaitementGrossesse et allaitement
Aucune étude expérimentale sur la reproduction avec le facteur VIII n'a été effectuée chez l'animal.
En raison de la très grande rareté de l'hémophilie A chez la femme, aucune expérience de l'utilisation du facteur VIII durant la grossesse et l'allaitement n'est disponible. Le facteur VIII ne doit donc être utilisé durant la grossesse et l'allaitement qu'en cas d'indication absolue.
Fertilité
Les effets sur la fertilité humaine ne sont pas connus. Les administrations répétées de Jivi dans le cadre des études expérimentales chez l'animal n'ont mis en évidence aucun effet lié au traitement sur les organes masculins de reproduction.
Effet sur l’aptitude à la conduite et l’utilisation de machinesJivi n'a aucune influence sur l'aptitude à la conduite ou l'utilisation de machines.
Effets indésirablesLa population totale de sécurité comprenait 256 patients (148 patients ≥12 ans, 108 patients <12 ans) issus de quatre études de phase I et de phase-III déterminantes pour l'autorisation [une étude de phase-I et trois études de phase-III: L'étude PROTECT VIII (l'étude de sécurité n'inclut pas les cas purement chirurgicaux, sauf en cas d'apparition d'inhibiteurs), PROTECT Kids et Alfa PROTECT]. Chez les 208 patients ≥7 ans, la durée médiane de participation à l'étude était de 497 jours. Le nombre total de jours d'exposition était de 21516 avec une médiane de 92 jours d'exposition (fourchette: 1 à 309) par patient; la durée médiane de participation à l'étude des patients pédiatriques <7 ans était de 212 jours avec au total 1845 jours d'exposition et un nombre médian de 52 jours d'exposition (fourchette: 1 à 68) par patient.
Les effets indésirables les plus souvent décrits (≥5%) au cours des études cliniques chez les PTP étaient les céphalées (15.5%), la toux (8.6%) et la fièvre (9.0%).
Les effets indésirables survenus dans le cadre des études cliniques sont indiqués ci-dessous par systèmes d'organes et par fréquence. Les fréquences sont définies comme suit: «Très fréquents» (≥1/10), «Fréquents» (<1/10, ≥1/100), «Occasionnels» (<1/100, ≥1/1000).
Affections du système immunitaire
Fréquents: Réactions d'hypersensibilité.
Affections psychiatriques
Fréquents: Insomnie.
Affections du système nerveux
Très fréquents: Céphalées.
Fréquents: Vertiges.
Occasionnels: Dysgueusie.
Affections gastro-intestinales
Fréquents: Douleurs abdominales, nausées, vomissements.
Affections de la peau et du tissu sous-cutané
Fréquents: Érythème (comprenant érythème et érythème polymorphe), éruption (comprenant éruption et éruption papuleuse).
Occasionnels: Prurit (démangeaisons).
Troubles généraux et anomalies au site d'administration
Fréquents: Réactions locales au site d'injection (comprenant prurit au site d'injection, éruption au site d'injection, douleurs au site d'injection et prurit au site de ponction veineuse), fièvre.
Occasionnels: Bouffées de chaleur.
Affections respiratoires, thoraciques et médiastinales
Fréquents: Toux.
Études de sécurité à long terme (études d'extension)
Dans le cadre de l'étude PROTECT VIII, 121 patients, adultes et adolescents (>12 ans) ont poursuivi l'étude d'extension. La durée médiane totale de la participation à l'étude (étude principale et étude d'extension) était de 3,9 ans (fourchette: 0.8 à 7.0 ans). Les patients ont accumulé une durée d'exposition médiane de 224 jours (fourchette: 23 à 698 jours) par patient. 36 patients ont été traités pendant au moins 5 ans. L'ensemble des patients ayant participé à l'étude principale et à l'étude d'extension ont accumulé 33 437 jours d'exposition.
Dans le cadre de l'étude PROTECT Kids, 59 patients sur 73 de moins de 12 ans ont poursuivi l'étude d'extension. La durée totale médiane de la participation à l'étude (étude principale et étude d'extension) était de 5.8 ans (fourchette: 1.0 à 6.6 ans) avec une durée médiane d'exposition de 430 jours (fourchette 98 à 671 jours) par patient. 39 patients ont été traités pendant au moins 5 ans.
Le nombre médian de jours d'exposition par patient était de 237 jours (min-max: 1 à 698 jours) pour l'ensemble des patients inclus dans les études cliniques portant sur Jivi.
Au total, 75 patients ont été observés pendant une durée de traitement de plus de 5 ans dans le cadre des deux études d'extension.
Au cours de l'étude d'extension PROTECT VIII et de l'étude pédiatrique d'extension (PROTECT Kids), aucune modification concernant le profil de sécurité de Jivi n'a été observée.
Immunogénicité
L'immunogénicité de Jivi a été évaluée au cours d'études cliniques menées auprès de 158 patients (dont des patients subissant une intervention chirurgicale). Il s'agissait d'adolescents (≥12 ans) et d'adultes atteints d'hémophilie A sévère (activité du facteur VIII <1%) préalablement traités et exposés auparavant au produit pendant ≥150 jours.
Inhibiteurs du facteur VIII
Il n'y a pas eu de cas nouveaux ou confirmés d'apparition d'inhibiteurs du facteur VIII. Un seul résultat positif non confirmé a été rapporté avec un faible taux d'inhibiteurs du facteur VIII (1.7 BE/ml) chez un patient adulte ayant subi une intervention chirurgicale.
Anticorps anti-PEG
L'immunogénicité contre le PEG a été évaluée par la recherche des anticorps anti-PEG et des tests ELISA spécifiques pour la détection des anticorps IgM anti-PEG. Après 4 jours d'exposition, un patient (âgé de 19 ans) souffrant d'asthme a présenté une réaction d'hypersensibilité clinique après une injection de Jivi. Le patient a rapporté des céphalées, des douleurs abdominales, un essoufflement et des bouffées de chaleur; tous ces symptômes ont disparu après administration d'un traitement anti-asthmatique standard. Aucune autre intervention médicale n'a été nécessaire. L'évènement était associé à une augmentation transitoire du titre d'anticorps IgM anti-PEG. Un nouveau test effectué dans le cadre du suivi a donné un résultat négatif.
Du 5e jour d'exposition à la fin des études d'extension, aucune réponse immunitaire clinique au PEG susceptible d'entraîner une perte d'efficacité du médicament ou une hypersensibilité n'a été observée.
Information concernant des populations de patients particuliers
Enfants (patients pédiatriques (108 PTP <12 ans))
Dans l'étude clinique PROTECT Kids, des réactions indésirables provoquées par une réponse immunitaire transitoire tels qu'une réaction d'hypersensibilité au PEG ont été observées chez des enfants <6 ans. Chez 10 patients sur 44 (23%) dans la catégorie d'âge des moins de 6 ans, une perte d'efficacité du médicament a été constatée au cours des 4 premiers jours d'exposition en raison d'anticorps neutralisants dirigés contre le PEG. Chez 3 patients sur 44 (7%), la perte d'efficacité du médicament était associée à des réactions d'hypersensibilité (voir la rubrique «Mises en garde et précautions»). Des déclencheurs ou prédicteurs d'une réponse immunitaire contre le PEG n'ont pas pu être identifiés. Voir également rubrique «Propriétés, Efficacité clinique, Enfants et adolescents âgés de moins de 12 ans».
Dans l'étude clinique Alfa PROTECT, un enfant de plus de 7 ans a développé un titre élevé des anticorps IgM anti-PEG neutralisants associé à une perte d'efficacité clinique dans les 4 premiers jours d'exposition. Les anticorps ont disparu après l'arrêt de Jivi. Le patient a repris le traitement par Jivi 2 mois plus tard.
Un faible titre d'anticorps IgM anti-PEG transitoires a été observé chez quelques patients pédiatriques dans les 4 premiers jours d'exposition, ce qui a entraîné une faible diminution de la récupération avec Jivi.
SurdosageAucun symptôme de surdosage par Jivi n'est connu à ce jour.
Propriétés/EffetsCode ATC
B02BD02
Mécanisme d'action/pharmacodynamique
Jivi est une protéine de facteur VIII de coagulation recombinante (rFVIII), PEGylée, conjuguée, délétée du domaine B (BDD). Le poids moléculaire de la protéine est d'environ 230 kDa. Jivi remplace temporairement le facteur VIII de coagulation manquant nécessaire à une hémostase efficace chez les patients atteints d'hémophilie A congénitale. En raison de la PEGgylation, Jivi a une demi-vie terminale (t½) prolongée et présente une augmentation de l'aire sous la courbe (AUC) La PEGylation du domaine A3 avec un PEG ramifié de 60 kDa (2 chaînes de 30 kDa) réduit la liaison aux récepteurs physiologiques de la clairance du facteur VIII en maintenant les fonctions normales de la molécule de facteur VIII.
Le temps de céphaline activé (TCA) est allongé en cas d'hémophilie. La détermination du TCA est un test in-vitro conventionnel permettant de mesurer l'activité biologique du facteur VIII.
Le traitement par un facteur VIII recombinant induit une normalisation du TCA qui est comparable au TCA obtenu avec un facteur VIII dérivé du plasma. L'administration de Jivi accroît les taux plasmatiques de facteur VIII permettant ainsi une correction temporaire du déficit en facteur VIII et de la tendance hémorragique.
Efficacité clinique
Études cliniques
Au total, 232 patients atteints d'hémophilie A sévère préalablement traités, ont participé au programme d'études cliniques comprenant une étude de phase -I- et deux études de phase -II/III-. 159 patients étaient âgés de 12 ans ou plus.
Phase II/III: Une étude multinationale, ouverte, non contrôlée, partiellement randomisée a évalué la pharmacocinétique, la sécurité d'emploi et l'efficacité de Jivi administré dans le cadre d'un traitement à la demande, dans le cadre d'un traitement prophylactique comprenant trois schémas thérapeutiques (deux fois par semaine 30-40 UI/kg, tous les 5 jours 45-60 UI/kg et tous les 7 jours 60 UI/kg) et l'hémostase lors d'interventions chirurgicales majeures. Les patients ayant terminé l'étude principale ont été inclus dans une étude d'extension. Le critère d'efficacité primaire était le taux annualisé d'hémorragie (TAH).134 patients de sexe masculin préalablement traités (dont 13 patients âgés de 12 à 17 ans) ont reçu pendant une période de 36 semaines au moins une injection de Jivi en traitement prophylactique (n = 114) ou sous forme de traitement à la demande (n = 20). Au total, 121 patients ont été traités au cours de la phase d'extension de l'étude; la durée médiane de la participation à l'étude était de 3.2 ans (fourchette: 0.1 à 6.3 ans). 36 patients ont été traités pendant au moins 5 ans, 110 patients pendant au moins 100 jours d'exposition. Dans le groupe ayant subi une chirurgie, l'hémostase a été évaluée chez 17 patients dans le cadre de 20 interventions chirurgicales majeures.
Phase III (Enfants et adolescents, PROTECT Kids): Une étude multinationale, contrôlée, ouverte incluant 73 patients pédiatriques (âgés de moins de 12 ans) préalablement traités pendant une période de 50 jours d'exposition et d'au moins 6 mois a évalué la pharmacocinétique, la sécurité d'emploi et l'efficacité de Jivi administré dans le cadre de trois schémas thérapeutiques prophylactiques (deux fois par semaine, tous les 5 jours et tous les 7 jours) et dans le cadre du traitement des hémorragies intercurrentes. 61 (83.6%) patients ont terminé l'étude principale et 59 patients ont participé à l'étude d'extension facultative.
Une étude de phase III ouverte multinationale portant sur 35 enfants âgés de 7 à <12 ans (Alfa-PROTECT) avec un traitement prophylactique deux fois par semaine et un traitement des hémorragies intercurrentes a évalué la sécurité des injections de Jivi chez les enfants préalablement traités atteints d'hémophilie A grave. Ce faisant, le risque potentiel d'hypersensibilité et d'absence d'effets médicamenteux associées à une réaction immunitaire au PEG pendant les 4 premières expositions à Jivi chez les enfants de cette catégorie d'âge a été étudié. Les patients ont été traités à titre prophylactique sur une période de 6 mois et avaient la possibilité de participer à une étude d'extension de 18 mois.
Traitement prophylactique des patients à partir de 12 ans
Lors de l'étude principale, les patients ont reçu Jivi soit en traitement prophylactique deux fois par semaine (n = 24) soit après randomisation tous les 5 jours (n = 43) ou tous les 7 jours (n = 43) soit dans le cadre d'un traitement à la demande (n = 20). 99 des 110 patients (90%) ont poursuivi le schéma thérapeutique qui leur avait été attribué. Chez onze patients du bras de traitement comportant une administration de Jivi- tous les 7 jours, la fréquence des infections avait augmenté. La dose médiane administrée dans le cadre de tous les schémas thérapeutiques prophylactiques était de 46.9 UI/kg/injection. Le taux annualisé d'hémorragie médian (T1; T3) dans le bras de traitement prophylactique- était de 2.09 (0.0; 6.1) pour l'ensemble des hémorragies et de 0.0 (0.0; 4.2) pour les hémorragies spontanées en comparaison avec 23.4 (18; 37) pour le nombre total d'hémorragies dans le groupe de traitement à la demande. Chez 42 des 110 patients du bras recevant le traitement prophylactique (38.2%), aucun épisode hémorragique ne s'est produit.
Au cours de l'étude d'extension, 23 patients ont été traités deux fois par semaine, 33 patients tous les 5 jours et 23 patients tous les 7 jours, 28 patients ayant changé de schéma thérapeutique. La dose médiane dans le bras recevant le traitement prophylactique- était de 47.8 UI/kg/injection. Au total, le taux annualisé d'hémorragie total médian (T1; T3) était de 1.49 (0.4; 4.8) ou de 0.75 (0.0; 2.9) pour les hémorragies spontanées dans les groupes recevant le traitement prophylactique- réunis, alors que le taux annualisé d'hémorragie total était de 34.1 dans le groupe de traitement à la demande.
Il est à noter que le taux annualisé d'hémorragie est comparable avec les différents concentrés de facteurs- et dans les différentes études cliniques.
Traitement des hémorragies
Sur les 702 évènements hémorragiques traités par Jivi pendant l'étude principale, 636 (90.6%) ont été traités avec 1 ou 2 injections; 1 injection ayant été nécessaire chez 81.1%. La dose médiane (fourchette) par injection était de 31.7 (14; 62) UI/kg. 94.0% des 1902 hémorragies traitées par Jivi pendant l'étude d'extension ont pu être contrôlées avec 1 ou 2 injections, 1 seule injection ayant été nécessaire dans 84.9% des cas. La dose médiane (fourchette) par injection était de 37.9 (15; 64) UI/kg.
Prise en charge peropératoire
Au total, 20 interventions chirurgicales majeures ont été réalisées et évaluées chez 17 patients. La dose totale médiane lors des interventions majeures était de 219 UI/kg (fourchette: 50-1 500 UI/kg, comprenant la phase postopératoire d'une durée maximale de 3 semaines). Pour l'ensemble des interventions chirurgicales majeures, l'efficacité hémostatique dans le cadre de la prise en charge peropératoire a été qualifiée de bonne ou excellente.
Par ailleurs, 34 interventions mineures ont été effectuées chez 19 patients. Pour l'ensemble des cas présents, l'hémostase a été qualifiée de bonne ou excellente.
Enfants et adolescents âgés de moins de 12 ans
Jivi ne doit pas être utilisé chez les enfants âgés de moins de 12 ans (voir rubrique «Posologie pour des groupes de patients particuliers/Enfants et adolescents»).
Dans deux études pédiatriques incluant 108 patients pédiatriques <12 ans (44 PTP <6 ans, 64 PTP âgés de 6 à <12 ans) préalablement traités, des réactions indésirables liées à une réponse immunitaire contre le PEG ont été observées chez les enfants <6 ans et chez un enfant de plus de 7 ans. Chez 23% des patients de la catégorie d'âge <6 ans, une perte d'efficacité en raison d'anticorps IgM anti-PEG neutralisants a été observée durant les 4 premiers jours d'exposition. Chez 7% des patients, la perte d'efficacité était associée à des réactions d'hypersensibilité. La réponse immunitaire était transitoire. Des facteurs déclenchants ou prédictifs de la réponse immunitaire contre le PEG n'ont pas pu être identifiés. 11 patients dans la catégorie d'âge des moins de 6 ans ont arrêté l'étude en raison d'une réponse immunitaire contre le PEG associée à une perte d'efficacité et/ou une réaction d'hypersensibilité dans les quatre premiers jours d'exposition. Pour 59 patients qui ont participé à l'étude d'extension, le taux annualisé d'hémorragie médian total (Q1; Q3) pendant l'étude d'extension s'élevait à 1.64 (0.5; 3.1). Pour 30 patients ≥12 ans, le taux annualisé d'hémorragie médian (Q1; Q3) s'élevait à 1.76 (0.5; 3.3) à la fin de l'étude d'extension.
PharmacocinétiqueAbsorption
Non pertinent, car l'administration est effectuée par voie intraveineuse.
Distribution
Au cours d'une étude de phase I, la pharmacocinétique (PK) de Jivi a été évaluée dans deux cohortes chez 7 patients préalablement traités après l'administration pendant 8 semaines d'une seule dose de 25 UI/kg ou de 60 UI/kg ou après administration répétée de 25 UI/kg deux fois par semaine ou de 60 UI/kg une fois par semaine.. Le profil PK après 8 semaines d'administration répétée était comparable au profil PK après la première administration.
Au cours d'une étude de phase II/III, la PK de Jivi a été évaluée chez 22 patients (≥12 ans) atteints d'hémophilie A sévère préalablement traités après l'administration d'une seule dose de 60 UI/kg de Jivi (avant la mise en route d'un traitement prophylactique).
Le Tableau 2 résume les paramètres PK après l'administration d'une seule dose selon l'activité du facteur VIII mesurée par le test chromogénique et le test de coagulation en un temps.
Tableau 2: Paramètres pharmacocinétiques (moyenne arithmétique ± écart-type) de Jivi après l'administration d'une seule dose selon le test chromogénique et le test de coagulation en un temps
|
|
Test chromogénique
|
Test de coagulation en un temps
| |
Paramètre PK (unité)
|
25 UI/kg
|
60 UI/kg1
|
25 UI/kg
|
60 UI/kg1
| |
|
n=7
|
n=29
|
n=7
|
n=29
| |
AUC (UI*h/dL)
|
1640 ± 550
|
4060 ± 1420
|
1640 ± 660
|
4150 ± 1060
| |
Cmax (UI/dL)
|
64.2 ± 9.2
|
167 ± 30
|
69.4 ± 11.3
|
213 ± 71
| |
t½ (h)
|
18.6 ± 4.6
|
17.9 ± 4.0
|
21.4 ± 13.1
|
17.4 ± 3.8
| |
MRTIV (h)
|
26.7 ± 6.6
|
25.8 ± 5.9
|
29.0 ± 14.0
|
24.5 ± 5.4
| |
Vss (mL/kg)
|
42.8 ± 5.0
|
39.4 ± 6.3
|
44.7 ± 5.4
|
36.0 ± 6.5
| |
CL (mL/h/kg)
|
1.68 ± 0.39
|
1.63 ± 0.52
|
1.74 ± 0.54
|
1.52 ± 0.38
| |
Récupération [(UI/dL)/(UI/kg)]
|
2.13 ± 0.47
|
2.53 ± 0.432
|
2.21 ± 0.55
|
3.25 ± 0.842
|
AUC: Aire sous la courbe de l'activité du F VIII/temps; Cmax: concentration maximale du principe actif (activité) dans le plasma après l'administration d'une seule dose; t½: demi-vie terminale; MRTIV: temps de séjour moyen après l'administration par voie IV; VSS: volume de distribution apparent à l'état d'équilibre; CL: clairance
1 Données réunies des études de phase I et de phase II/III
2 La récupération n'a pas pu être calculée chez un patient.
Métabolisme
Voir Tableau 2.
Élimination
Voir les valeurs «CL» dans le Tableau 2.
Linéarité/Non-linéarité
Voir les valeurs «AUC» et «Récupération» dans le Tableau 2.
Cinétique pour certains groupes de patients
Il n'existe pas de données pharmacocinétiques pour certains groupes de patients.
Données précliniquesSur la base des études conventionnelles portant sur la pharmacologie de sécurité, la toxicité en cas d'administration répétée ainsi que la toxicité chez des rats et des lapins juvéniles, les données précliniques n'indiquent aucun danger particulier pour l'humain et ne révèlent aucun indice d'accumulation de PEG ou d'autres effets liés à l'utilisation de Jivi. Aucune étude portant sur la génotoxicité, la carcinogénicité et la toxicité sur la reproduction de Jivi n'a été menée. Une série standard d'études de génotoxicité in vivo et in vitro avec le PEG utilisé dans Jivi n'a indiqué aucun potentiel génotoxique.
Remarques particulièresIncompatibilités
Jivi ne doit pas être mélangé à d'autres médicaments ou à d'autres solutions injectables.
Stabilité
La date figurant sur l'emballage après la mention «EXP» ne peut en aucun cas être dépassée. La solution prête à l'emploi doit être administrée le plus rapidement possible. Si ceci n'est pas possible, la solution prête à l'emploi peut se conserver 3 heures au maximum à température ambiante.
Remarques particulières concernant le stockage
Conserver au réfrigérateur (2-8 °C). Ne pas congeler. Conserver dans l'emballage d'origine pour protéger le contenu de la lumière.
Pendant la durée de conservation, l'emballage peut être conservé jusqu'à 6 mois à une température ne dépassant pas 25 °C ou jusqu'à 3 mois à une température ne dépassant pas 30 °C.
Si Jivi est conservé hors du réfrigérateur, il faut noter la date à laquelle il a été sorti du réfrigérateur, et indiquer la nouvelle date de péremption sur l'emballage et le flacon. Dans ce cas, le produit sera périmé après 6 mois (à 25 °C) ou après 3 mois (à 30 °C). Cette nouvelle date de péremption ne peut cependant en aucun cas être postérieure à la date indiquée sur l'emballage après la mention «EXP». Si Jivi a été stocké à température ambiante, il ne peut pas être remis au réfrigérateur.
Tenir hors de portée des enfants.
Remarques concernant la manipulation
Si l'un des composants de l'emballage est ouvert ou endommagé, il ne faut pas l'utiliser.
Lors de la reconstitution de la solution et de son injection IV ., veillez au respect des conditions d'asepsie.
Avant l'emploi, il faut s'assurer que le médicament à utiliser par voie parentérale ne présente ni particules ni colorations. Ne pas utiliser Jivi si après la préparation de la solution, on remarque qu'elle contient des particules ou qu'elle est trouble.
Avant l'administration, il faut filtrer la solution prête à l'emploi en utilisant l'embout fourni à filtre intégré qui retient les particules éventuellement présentes.
Le dispositif d'injection fourni ne doit pas être utilisé pour effectuer des prises de sang, car il contient un filtre on-line. Si une prise de sang est nécessaire avant l'injection de Jivi, il convient d'utiliser un dispositif d'injection sans filtre.
Manipulation de l'embout et du dispositif d'injection (embout)
Toutes les étapes ne sont pas illustrées. Veuillez absolument tenir compte du texte.
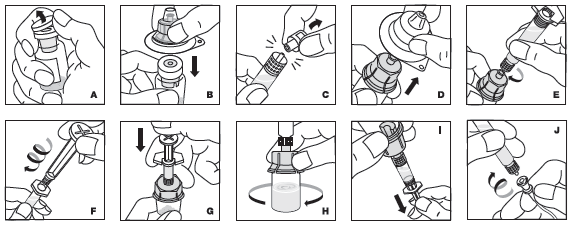
1.Se laver soigneusement les mains à l'eau et au savon. Travailler sur une surface propre.
2.Réchauffer le flacon du produit non ouvert et la seringue remplie de solvant entre les mains environ à la température du corps (37 °C au plus).
3.Retirer le capuchon du flacon de produit (A) et nettoyer le bouchon en caoutchouc avec un tampon imbibé d'alcool (ou utiliser un spray désinfectant) en prenant soin de ne pas y toucher.
4.Poser le flacon sur une surface stable et antidérapante. Enlever l'opercule de l'emballage de l'embout, mais ne pas l'extraire de l'emballage. Tenir fermement l'emballage de l'embout, le placer au-dessus du flacon contenant la poudre et bien enfoncer l'embout sur le flacon (B). L'embout s'enclenche sur le capuchon du flacon. À ce moment-là, il ne faut pas encore retirer l'emballage de l'embout.
5.Tenir la seringue au niveau du cylindre et retirer le capuchon protégeant la pointe de la seringue (C). Ne pas toucher la pointe de la seringue avec les mains ou une quelconque surface. Mettre la seringue de côté pour l'utiliser plus tard.
6.Retirer alors l'emballage de l'embout et le jeter (D).
7.Raccorder la seringue à l'embout fileté en vissant dans le sens des aiguilles d'une montre (E).
8.Saisir la tige du piston de la seringue au niveau de l'extrémité supérieure et l'extraire de la boîte. Ne pas toucher les côtés et le filetage de la tige du piston de la seringue. Sans tarder, visser fermement la tige du piston de la seringue dans le sens des aiguilles d'une montre sur le bouchon de caoutchouc fileté de la seringue (F).
9.Injecter le solvant lentement dans le flacon (G).
10.Dissoudre la poudre en effectuant des mouvements circulaires avec le flacon (H). Ne pas agiter le flacon! S'assurer que la poudre est complètement dissoute. Si la solution contient des particules visibles ou est trouble, ne pas l'utiliser.
11.Tenir le flacon, l'embout et la seringue dirigés vers le haut (I) et remplir la seringue en tirant doucement et lentement sur le piston. S'assurer que l'intégralité du contenu du flacon a été transférée dans la seringue. Faire sortir les bulles d'air de la seringue.
12.Si plus d'une dose est nécessaire, préparer la quantité de produit souhaitée. Pour cela, répéter les étapes 2 à 11. Les solutions préparées séparément selon les étapes 2 à 11 peuvent ensuite être dans ce cas mélangées dans une seringue de plus grande taille (non fournie).
13.Retirer la seringue raccordée à la tige du piston de l'embout (l'embout doit rester sur le flacon). Raccorder la seringue au dispositif d'injection fourni et administrer la solution par voie intraveineuse (J).
Numéro d’autorisation66882 (Swissmedic).
PrésentationJivi 1000 UI
1 flacon avec embout et poudre contenant 1000 UI de damoctocog alfa pégol.
1 seringue prête à l'emploi contenant un solvant (2.5 ml d'eau pour préparations injectables) et une tige de piston fournie séparément.
1 dispositif d'injection (B)
Jivi 2000 UI
1 flacon avec embout et poudre contenant 2000 UI de damoctocog alfa pégol.
1 seringue prête à l'emploi contenant un solvant (2.5 ml d'eau pour préparations injectables) et une tige de piston fournie séparément.
1 dispositif d'injection (B)
Jivi 3000 UI
1 flacon avec embout et poudre contenant 3000 UI de damoctocog alfa pégol.
1 seringue prête à l'emploi contenant un solvant (2,5 ml d'eau pour préparations injectables) et une tige de piston fournie séparément.
1 dispositif d'injection (B)
Titulaire de l’autorisationBayer (Schweiz) AG, 8045 Zurich.
Mise à jour de l’informationAvril 2025
|
|

