Propriétés/EffetsCode ATC
N02CD02
Mécanisme d'action
Le galcanezumab est un anticorps monoclonal IgG4 recombinant humanisé. Il se lie au peptide relié au gène de la calcitonine (calcitonin gene-related peptide, CGRP) et empêche ainsi son activité biologique, sans bloquer le récepteur du CGRP. Des concentrations sanguines élevées de CGRP ont été associées à la migraine. En outre, chez certaines personnes qui ont des antécédents de migraine, des perfusions de CGRP peuvent déclencher des crises de type migraineux.
Pharmacodynamique
Le galcanezumab se lie au CGRP avec une forte affinité (KD = 31 pM) et avec une spécificité élevée (> 10'000 fois comparé aux peptides apparentés tels que l'adrénomédulline, l'amyline, la calcitonine et l'intermédine).
Efficacité clinique
L'efficacité et la sécurité d'Emgality ont été démontrées dans trois études de phase III, randomisées, contrôlées versus placebo, en double aveugle chez des patients adultes (N = 2886). Les 2 études sur la migraine épisodique (EVOLVE-1 et EVOLVE-2) ont inclus des patients qui répondaient aux critères de diagnostic de migraine avec ou sans aura de la classification internationale des céphalées (International Classification of Headache Disorders, ICHD), avec 4 à 14 jours de migraine par mois. L'étude sur la migraine chronique (REGAIN) a inclus des patients qui répondaient aux critères ICHD de migraine chronique avec ≥15 jours de céphalées par mois, dont au moins 8 jours avec les caractéristiques d'une migraine. Les patients ayant présenté un événement cardiovasculaire aigu récent (y compris infarctus du myocarde, angor instable, pontage coronarien (CABG), accident vasculaire cérébral, thrombose veineuse profonde) et/ou ceux considérés comme présentant un risque cardiovasculaire grave ont été exclus des études cliniques évaluant le galcanezumab. Les patients âgés de plus de 65 ans ont également été exclus. Les études EVOLVE-1 et EVOLVE-2 comportaient une période de traitement de 6 mois, en double aveugle, contrôlée versus placebo; l'étude REGAIN comportait une période de traitement de 3 mois, en double aveugle, contrôlée versus placebo, suivie d'une période d'extension ouverte de 9 mois. Les patients ont reçu le placebo, Emgality 120 mg/mois (avec une dose de charge initiale de 240 mg le premier mois) ou Emgality 240 mg/mois et ont été autorisés à prendre des médicaments pour le traitement aigu de la migraine. Au début de l'étude, le nombre moyen de jours de migraine par mois était de 9.13 par mois dans les études EVOLVE-1 et EVOLVE-2 (migraine épisodique) et de 19.41 par mois dans l'étude REGAIN (migraine chronique), et il était similaire au sein de chaque étude dans tous les groupes de traitement. Dans l'étude REGAIN, environ 15 % des patients ont continué un traitement concomitant par topiramate ou propranolol (autorisé conformément au protocole de prophylaxie de la migraine), et 64 % présentaient au début de l'étude une consommation excessive de médicaments contre les céphalées aiguës. Environ un tiers des patients dans les études étaient en échec d'au-moins un traitement prophylactique antérieur pour des raisons d'efficacité et environ 16 % des patients étaient en échec d'au-moins deux traitements prophylactiques antérieurs pour des raisons d'efficacité.
Dans les 3 études, le critère principal d'efficacité était la variation moyenne du nombre de jours de migraine par mois (migraine headache days, MHD) par rapport aux valeurs initiales. Les deux groupes de traitement, Emgality 120 mg et 240 mg, ont montré des améliorations statistiquement significatives et cliniquement pertinentes par rapport aux valeurs initiales comparativement au groupe placebo (voir Tableau).
Tableau: Efficacité et critères fonctionnels dans les études de phase 3
|
Résultats
|
EVOLVE-1 – Migraine épisodique
|
EVOLVE-2 - Migraine épisodique
|
REGAIN – Migraine chronique
| |
Emgality
|
Placebo
N=425
|
Emgality
|
Placebo
N=450
|
Emgality
|
Placebo
N=538
| |
120 mg N=210
|
240 mg N=208
|
120 mg N=226
|
240 mg N=220
|
120 mg N=273
|
240 mg N=274
| |
Résultats d'efficacité (évaluées sur les mois 1 à 6 pour EVOLVE-1 et 2 et sur les mois 1 à 3 pour REGAIN)
| |
Réduction moyenne du nombre de jours par mois avec migraine par rapport à la valeur initiale
|
-4.73a
|
-4.57a
|
-2.81
|
-4.29a
|
-4.18a
|
-2.28
|
-4.83a
|
-4.62a
|
-2.74
| |
Pourcentage moyen de patients qui ont atteint un taux de réponse ≥50 %
|
62.3a
|
60.9a
|
38.6
|
59.3a
|
56.5a
|
36.0
|
27.6a
|
27.5a
|
15.4
| |
Réduction moyenne du nombre de jours par mois avec migraine au cours desquels une médication aiguë a été utilisée.
Variation par rapport à la valeur initiale
|
-3.96a
|
-3.76a
|
-2.15
|
-3.67a
|
-3.63a
|
-1.85
|
-4.74b
|
-4.25a
|
-2.23
| |
Résultats rapportés par les patients (évalués sur les mois 4 à 6 pour EVOLVE-1 et 2 et au mois 3 pour REGAIN)
| |
Influence fonctionnelle de la migraine sur les activités de tous les jours.
Amélioration moyenne par rapport à la valeur initiale
(MSQ Role Function- Restrictive)c
|
32.43a
|
32.09a
|
24.69
|
28.47a
|
27.04a
|
19.65
|
21.81b
|
23.05a
|
16.76
|
a p < 0.001 (statistiquement significatif versus placebo après ajustement pour comparaisons multiples)
b p < 0.001 (non statistiquement significatif versus placebo après ajustement pour comparaisons multiples)
c N = 189 pour Emgality 120 mg, N = 184 pour Emgality 240 mg et N = 377 pour le placebo dans EVOLVE-1
N = 213 pour Emgality 120 mg, N = 210 pour Emgality 240 mg et N = 396 pour le placebo dans EVOLVE-2
N = 252 pour Emgality 120 mg, N = 253 pour Emgality 240 mg et N = 494 pour le placebo dans REGAIN
Comparativement aux patients sous placebo, les patients sous Emgality 120 mg ou 240 mg dans les études EVOLVE-1 et -2 (migraine épisodique) ont présenté une diminution du nombre de jours de migraine par mois significativement plus importante, par rapport aux valeurs initiales, au 1er mois et tous les mois suivants jusqu'au 6ème mois et de même dans l'étude REGAIN (migraine chronique) au 1er mois et tous les mois suivants jusqu'au 3ème mois (voir Illustration 1). En outre, les patients sous Emgality (dose initiale de 240 mg) présentaient au mois 1 significativement moins de MHD par semaine, comparativement au placebo à la semaine 1 et toutes les semaines suivantes.
Illustration 1: Réduction des jours de migraine par mois au fil du temps
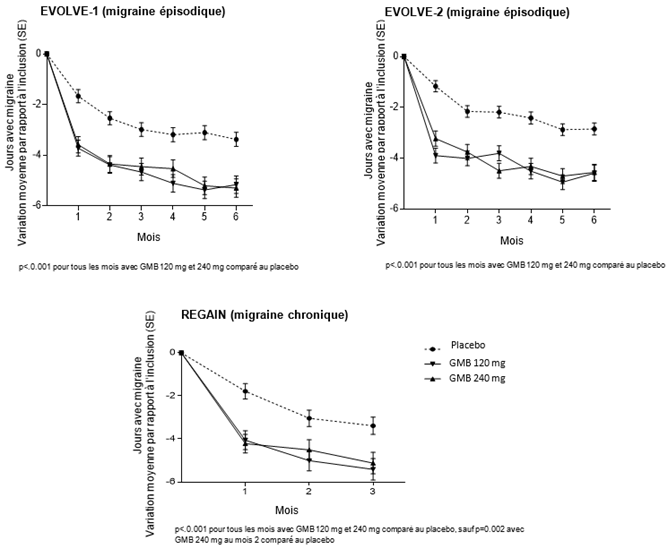
Les patients sous Emgality 120 mg et 240 mg ont présenté dans les trois études des taux de réponse plus élevés que les patients sous placebo. Le taux de réponse est le pourcentage moyen de patients atteignant un seuil défini en termes de réduction du nombre de jours de migraine par mois (≥50 %, ≥75 % et 100 %) pendant toute la durée de la période de traitement en double aveugle (voir Tableau ci-dessus).
Le nombre moyen de jours de migraine par mois lors desquels une médication aiguë a été utilisée était respectivement de 7.38 et 7.54 par mois au début de l'étude dans les études EVOLVE-1 et EVOLVE-2 (migraine épisodique), et de 15.16 par mois dans l'étude REGAIN (migraine chronique), et il était similaire dans tous les groupes de traitement au sein de chaque étude. Les deux groupes de traitement, Emgality 120 mg et 240 mg, ont présenté des réductions plus importantes, par rapport au groupe sous placebo, du nombre de jours de migraine par mois au cours desquels une médication aiguë a été utilisée (voir Tableau ci-dessus).
L'impact fonctionnel de la migraine a été évalué à l'aide du domaine Role Function-Restrictive du Migraine-Specific Quality of Life Questionnaire (MSQ) Version 2.1, qui mesure l'effet de la migraine sur le travail ou les activités de tous les jours, les rapports avec la famille et les amis, les loisirs, la productivité, la concentration, l'énergie et la fatigue. La valeur va de 0 à 100, les valeurs plus élevées indiquant une meilleure fonction.
Dans les trois études, les patients sous Emgality 120 mg et 240 mg ont présenté des améliorations plus importantes de la fonction comparativement aux patients sous placebo (voir Tableau ci-dessus). Au début de l'étude, le MSQ Role Function-Restrictive Score moyen était respectivement de 51.52 et de 51.72 dans les études EVOLVE-1 et 2 (migraine épisodique) et de 38.74 dans l'étude REGAIN (migraine chronique), et il était similaire dans tous les groupes de traitement au sein de chaque étude.
Dans les données consolidées des études EVOLVE-1 et EVOLVE-2, chez les patients en échec d'un ou plusieurs traitements prophylactiques pour des raisons d'efficacité, la différence entre les traitements sur la réduction du nombre moyen de jours de migraine par mois observé était de -2.69 jours (p < 0.001) entre galcanezumab 120 mg et placebo et de -2.78 jours (p < 0.001) entre galcanezumab 240 mg et placebo. Chez les patients en échec de deux ou plusieurs traitements prophylactiques, la différence entre les traitements a été de -2.64 jours (p <0.001) entre 120 mg et placebo et de -3.04 jours (p <0.001) entre 240 mg et placebo. Chez les patients en échec d'un ou plusieurs traitements prophylactiques pour des raisons d'efficacité, la différence de traitement sur la réduction du nombre moyen de jours de migraine par mois observé était de -3.54 jours (p < 0.001) entre galcanezumab 120 mg et placebo et de -1.37 jours (p < 0.05) entre galcanezumab 240 mg et placebo. Chez les patients en échec de deux ou plusieurs traitements prophylactiques, la différence de traitement était de -4.48 jours (p < 0.001) entre 120 mg et placebo et de -1.86 jours (p < 0.01) entre 240 mg et le placebo.
Dans l'étude REGAIN, 64 % des patients étaient en situation de consommation excessive de médicaments contre les céphalées aiguës à l'inclusion. Chez ces patients, la différence de traitement sur la réduction du MHD était de -2.53 jours (p < 0.001) entre galcanezumab 120 mg et placebo et de -2.26 jours (p < 0.001) entre galcanezumab 240 mg et placebo. Dans les données consolidées des études EVOLVE-1 et EVOLVE-2, près de 19 % des patients étaient en situation de consommation excessive de médicaments contre les céphalées aiguës au début de l'étude. Chez ces patients, la différence de traitement sur la réduction du MHD était de -3.55 jours (p < 0.001) entre galcanezumab 120 mg et placebo et de -3.07 jours (p < 0.001) entre galcanezumab 240 mg et placebo.
Etude clinique de phase III dans une population, dans laquelle 2 à 4 traitements prophylactiques de la migraine précédents ont montré une efficacité insuffisante ou n'ont pas été tolérés
L'étude clinique CONQUER a été menée chez des patients atteints de migraine chronique ou épisodique, chez lesquels, durant les 10 dernières années, 2 à 4 traitements prophylactiques de la migraine précédents ont montré une efficacité insuffisante ou n'ont pas été tolérés. Cette étude confirme les principales conclusions des précédentes études d'efficacité dans la migraine, c'est-à-dire que le traitement par galcanezumab a conduit à une réduction moyenne du nombre de jours de migraine par mois dans tout le groupe (4.1 jours par rapport à 1.0 jour dans le groupe placebo, p < 0.0001). Une réduction moyenne du nombre de jours de migraine par mois a également été observée dans la sous-population atteinte de migraine épisodique (2.9 jours dans le groupe galcanézumab par rapport à 0.3 jour dans le groupe placebo; p < 0.0001) et dans la sous-population atteinte de migraine chronique (5.9 jours dans le groupe galcanezumab par rapport à 2.2 jours dans le groupe placebo; p < 0.0001).
|

