Propriétés/EffetsCode ATC
N07XX07
Mécanisme d'action
Fampyra est un inhibiteur des canaux potassiques. En bloquant les canaux potassiques, Fampyra réduit le courant ionique à travers ces canaux, et par conséquent prolonge la repolarisation et améliore la formation du potentiel d'action dans les axones démyélinisés ainsi que la fonction neurologique. En améliorant la formation du potentiel d'action, Fampyra pourrait améliorer la conduction dans le système nerveux central.
Pharmacodynamique
Voir «Mécanisme d'action».
Efficacité clinique
L'efficacité des comprimés à libération prolongée de fampridine (10 mg deux fois par jour) pour améliorer la capacité de marche chez les patients présentant un handicap à la marche dans toutes les formes rémittentes-récurrentes et progressives de la SEP a été évaluée au cours de trois études confirmatoires de phase III, randomisées, en double aveugle, contrôlées contre placebo (MS-F203, MS-F204 et 218MS305). Le pourcentage de patients ayant présenté une amélioration de la capacité de marche était indépendant du traitement immunomodulateur concomitant (incluant interférons, acétate de glatiramère, fingolimod et natalizumab). Aucune différence en termes d'efficacité n'a été constatée en fonction de l'importance du handicap à la marche, de l'âge, du sexe ou de l'indice de masse corporelle. Les répondeurs/non-répondeurs ont généralement pu être identifiés dans un délai de 2 à 4 semaines après l'instauration du traitement.
Études MS-F203 et MS-F204
Le critère d'évaluation principal des études MS-F203 et MS-F204 était le taux de répondeurs pour la vitesse de marche, mesurée par l'épreuve chronométrée de marche sur 7,62 mètres (Timed 25-foot Walk - T25FW). Un répondeur était défini comme un patient dont la vitesse de marche était constamment augmentée lors d'au moins trois des quatre visites possibles effectuées durant la période en double aveugle, comparativement à la valeur maximale mesurée lors des cinq visites sans traitement.
Un pourcentage significativement plus important de patients traités par Fampyra (10 mg deux fois par jour) était répondeur au traitement, par rapport aux patients sous placebo (MS-F203: 34,8% contre 8,3%, p<0,001; MS-F204: 42,9% contre 9,3%, p<0,001).
La vitesse de marche des patients répondant à Fampyra était augmentée en moyenne de 26,3%, contre 5,3% dans le groupe sous placebo (p<0,001) (MS-F203) et de 25,3% contre 7,8% (p<0,001) (MS-F204).
L'amélioration est apparue rapidement (en quelques semaines) après l'instauration du traitement par Fampyra.
Des améliorations statistiquement et cliniquement significatives de la capacité de marche ont été observées, en utilisant l'échelle à 12 items évaluant la marche lors de sclérose en plaques (échelle MSWS-12).
Tableau 1: Études MS-F203 et MS-F204
|
ÉTUDE *
|
MS-F203
|
MS-F204
| |
|
Placebo
|
Fampyra
10 mg 2x/j.
|
Placebo
|
Fampyra
10 mg 2x/j.
| |
Nombre de patients
|
72
|
224
|
118
|
119
| |
Amélioration constante
|
8,3%
|
34,8%
|
9,3%
|
42,9%
| |
Différence
|
|
26,5%
|
|
33,5%
| |
IC à 95%
|
|
17,6%, 35,4%
|
|
23,2%, 43,9%
| |
Valeur de p
|
|
<0.001
|
|
<0.001
| |
Amélioration ≥20%
|
11,1%
|
31,7%
|
15,3%
|
34,5%
| |
Différence
|
|
20,6%
|
|
19,2%
| |
IC à 95%
|
|
11,1%, 30,1%
|
|
8,5%, 29,9%
| |
Valeur de p
|
|
<0,001
|
|
<0,001
| |
Vitesse de marche (pieds/s)
|
Pieds/s
|
Pieds/s
|
Pieds/s
|
Pieds/s
| |
Valeur initiale
|
2,04
|
2,02
|
2,21
|
2,12
| |
Valeur sous traitement
|
2,15
|
2,32
|
2,39
|
2,43
| |
Variation
|
0,11
|
0,30
|
0,18
|
0,31
| |
Différence
|
0,19
|
0,12
| |
Valeur de p
|
0,010
|
0,038
| |
Variation moyenne en %
|
5,24
|
13,88
|
7,74
|
14,36
| |
Différence
|
8,65
|
6,62
| |
Valeur de p
|
<0,001
|
0,007
| |
Score MSWS-12 (moyenne, erreur type de la moyenne)
| |
Valeur initiale
|
69,27 (2,22)
|
71,06 (1,34)
|
67,03 (1,90)
|
73,81 (1,87)
| |
Variation moyenne en %
|
-0,01 (1,46)
|
-2,84 (0,878)
|
0,87 (1,22)
|
-2,77 (1,20)
| |
Différence
|
2,83
|
3,65
| |
Valeur de p
|
0,084
|
0,021
| |
LEMMT (moyenne, erreur type de la moyenne)
(test manuel de la force musculaire des membres inférieurs)
| |
Valeur initiale
|
3,92 (0,070)
|
4,01 (0,042)
|
4,01 (0,054)
|
3,95 (0,053)
| |
Variation moyenne en %
|
0,05 (0,024)
|
0,13 (0,014)
|
0,05 (0,024)
|
0,10 (0,024)
| |
Différence
|
0,08
|
0,05
| |
Valeur de p
|
0,003
|
0,106
| |
Score d'Ashworth
(test de spasticité musculaire)
| |
Valeur initiale
|
0,98 (0,078)
|
0,95 (0,047)
|
0,79 (0,058)
|
0,87 (0,057)
| |
Variation moyenne en %
|
-0,09 (0,037)
|
-0,18 (0,022)
|
-0,07 (0,033)
|
-0,17 (0,032)
| |
Différence
|
0,10
|
0,10
| |
Valeur de p
|
0,021
|
0,015
|
Étude 218MS305
L'étude 218MS305 a été menée chez 636 patients atteints de sclérose en plaques et présentant un handicap à la marche. La durée du traitement en double aveugle était de 24 semaines, avec une période de suivi de 2 semaines après le traitement. Le critère d'évaluation principal était l'amélioration de la capacité de marche, mesurée comme le pourcentage de patients obtenant sur 24 semaines une amélioration moyenne ≥8 points au score MSWS-12 par rapport au score initial. Lors de cette étude, il a été observé une différence statistiquement significative entre les traitements, avec un pourcentage plus élevé de patients présentant une amélioration de la capacité de marche dans le groupe traité par Fampyra que dans le groupe témoin recevant le placebo (risque relatif de 1,38 [IC à 95%: 1,06, 1,70]). Les améliorations sont généralement apparues dans les deux à quatre semaines suivant l'instauration du traitement et ont disparu dans les deux semaines suivant l'arrêt du traitement.
Les patients traités par Fampyra ont également présenté une amélioration statistiquement significative du score au test chronométré de lever d'une chaise (Timed Up and Go (TUG), visant à évaluer l'équilibre statique et dynamique ainsi que la mobilité physique. Pour ce critère d'évaluation secondaire, le pourcentage de patients ayant obtenu sur une période de 24 semaines une amélioration moyenne ≥15% de la vitesse par rapport au test TUG réalisé lors de l'inclusion a été plus élevé dans le groupe traité par Fampyra que dans le groupe recevant le placebo. La différence sur l'échelle d'évaluation de l'équilibre de Berg (Berg Balance Scale (BBS), visant à mesurer l'équilibre statique) n'était pas statistiquement significative.
De plus, par rapport aux patients recevant le placebo, les patients traités par Fampyra ont présenté une amélioration moyenne statistiquement significative au score du domaine physique de l'échelle d'évaluation de l'impact de la sclérose en plaques (Multiple Sclerosis Impact Scale (MSIS-29)) par rapport au score initial (différence de la MMC: -3,31, p<0,001).
Tableau 2: Étude 218MS305
|
Sur 24 semaines
|
Placebo
N = 318*
|
Fampyra 10 mg
2x par jour
N = 315*
|
Différence (IC à 95%)
Valeur de p
| |
Pourcentage de patients présentant une amélioration moyenne ≥8 points au score MSWS-12 par rapport au score initial
|
34%
|
43%
|
Différence de risque: 10,4% (3%; 17,8%)
0,006
| |
Score MSWS-12
| |
Score initial
|
65,4
|
63,6
|
MMC: -4,14
(-6,22; -2,06)
<0,001
| |
Amélioration par rapport au score initial
|
-2,59
|
-6,73
| |
TUG
| |
Pourcentage de patients présentant une amélioration moyenne ≥15% de la vitesse au test TUG
|
35%
|
43%
|
Différence de risque: 9,2% (0,9%; 17,5%)
0,03
| |
TUG
| |
Score initial
|
27,1
|
24,9
|
MMC:-1,36
(-2,85; 0,12)
0,07
| |
Amélioration par rapport au score initial
|
-1,94
|
-3,3
| |
Score MSIS-29; domaine physique
| |
Score initial
|
55,3
|
52,4
|
MMC: -3,31
(-5,13; -1,50)
<0,001
| |
Amélioration par rapport au score initial
|
-4,68
|
-8,00
| |
Score BBS
| |
Score initial
|
40,2
|
40,6
|
MMC: 0,41
(-0,13; 0,95)
0,141
| |
Amélioration par rapport au score initial
|
1,34
|
1,75
|
*Population en intention de traiter (ITT) = 633; MMC = moyenne des moindres carrés
Figure 1: Variation du score MSWS-12 au cours du temps (MMC, population en ITT)
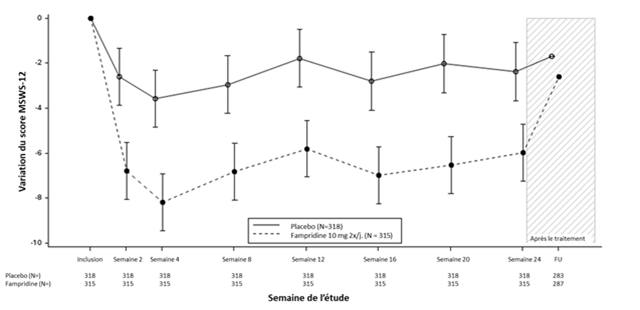
Une imputation multiple a été utilisée pour les données manquantes lors des visites post-inclusion, sauf lors du FU où les données observées ont été utilisées.
Remarques:
1.Le score initial (inclusion) est défini comme la moyenne du score lors de la sélection et du score lors de la visite au jour 1.
2.Les lignes continues indiquent l'erreur type pour la variation moyenne des MC lors de chaque visite. La moyenne a été mentionnée pour le FU.
3.La moyenne des MC et l'erreur type sont basées sur le modèle MMRM utilisant une matrice habituelle de variance-covariance d'un processus autorégressif d'ordre 1. Le traitement, le temps et le traitement d'après l'interaction du temps ont été inclus comme variables explicatives dans le modèle, en ajustant l'EDSS, le score MSWS-12 initial, la vitesse initiale au test TUG, l'âge et la prise antérieure d'aminopyridine comme covariables.
4.Une variation négative indique une amélioration de la marche.
Abréviations: MSWS-12 = échelle d'évaluation de la marche lors de sclérose en plaques (Multiple Sclerosis Walking Scale-12); MMRM = modèle mixte de mesures répétées (Mixed model for repeated measures); FU = suivi (follow-up) de 2 semaines; MC = moindres carrés.
Étude 218MS401
L'étude d'observation multinationale de phase IV 218MS401 a évalué la sécurité et l'efficacité de Fampyra dans la pratique médicale quotidienne. La population de l'étude comportait 4646 patients atteints de SEP (65,75% de femmes; âge médian de 52,6 ans).
Le profil de sécurité observé dans cette étude (sécurité à long terme sur une période allant jusqu'à 12 mois) a globalement correspondu au profil de sécurité connu de Fampyra et aucune nouvelle réserve concernant la sécurité n'est apparue.
L'analyse des données d'efficacité post-commercialisation issues de l'étude 218MS401 a montré que le traitement à long terme par Fampyra (sur une période allant jusqu'à 12 mois) apportait des améliorations constantes de l'auto-évaluation du bien-être physique et psychique par les patients à l'aide de l'échelle MSIS-29 ainsi que de l'évaluation par les médecins de la capacité à marcher, à l'aide de l'échelle CGI I.
|

