PharmacocinétiqueAprès utilisation de palipéridone sous forme retard, la pharmacocinétique de la palipéridone administré aux doses cliniques recommandées (entre 3 et 12 mg) a un comportement proportionnel à la dose.
Absorption
Après administration d'une dose unique de palipéridone sous forme retard, les concentrations plasmatiques de la palipéridone augmentent régulièrement jusqu'à ce que les concentrations plasmatiques maximales (Cmax) soient atteintes, environ 24 heures après la prise. Avec une administration quotidienne de palipéridone sous forme retard une fois par jour, les concentrations stabilisées ont été atteintes chez la plupart des patients au bout de 4–5 jours de traitement.
Contrairement à la rispéridone à libération immédiate, la palipéridone sous forme retard est associé à des fluctuations minimales entre la plus haute et la plus faible concentration, en raison des propriétés spécifiques de son mode de libération. Dans une étude comparant la pharmacocinétique stabilisée après administration une fois par jour de 12 mg de palipéridone (en comprimé à libération prolongée) ou de 4 mg de rispéridone (libération immédiate) chez les sujets schizophrènes étudiés, l'index de fluctuation dans le cas de la palipéridone à libération modifiée se situait autour de 38%, comparé à 125% dans le cas de la rispéridone à libération immédiate (voir figure 1).
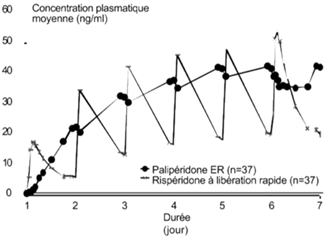
Figure 1: Profil des concentrations stabilisées après administration de 12 mg de palipéridone sous la forme de 6 comprimés à libération prolongée à 2 mg une fois par jour pendant 6 jours (les concentrations de palipéridone sont représentées) comparé à l'administration de la rispéridone à libération immédiate, administrée à une dose de 2 mg une fois par jour le premier jour et 4 mg une fois par jour du 2ème au 6ème jour (les concentrations de palipéridone et de rispéridone sont représentées).
Après utilisation de palipéridone sous forme retard, on observe une interconversion des énantiomères (+) et (–) de la palipéridone, alors qu'à la concentration stabilisée, un rapport AUC (+)/(–) d'environ 1,6 a été atteint. Après administration de palipéridone sous forme retard, la biodisponibilité orale absolue de la palipéridone se situe autour de 28%.
En cas d'administration des comprimés à libération prolongée de palipéridone en même temps qu'un repas riche standard à fort contenu en graisse et en calories, les valeurs Cmax et AUC de la palipéridone sont de 50 à 60% supérieures comparées aux valeurs obtenues à jeun.
Dans les études cliniques étudiant la sécurité et l'efficacité de la palipéridone, on n'a pas tenu compte de l'influence de la nourriture (voir «Posologie/Mode d'emploi»).
Distribution
La palipéridone est distribué rapidement. Le volume de distribution apparent est de 487 l. La liaison de la palipéridone aux protéines plasmatiques s'élève à 74%. Le principe actif se lie principalement à l'alpha 1 glycoprotéine et à l'albumine.
Métabolisme
Une semaine après administration orale d'une dose unique de 1 mg de palipéridone à libération immédiate marqué au 14C, 59% de la dose avait éliminée non modifiée dans les urines. Cela indique que la palipéridone n'est pas métabolisé de façon extensive dans le foie. Environ 80% de la radioactivité administrée a été retrouvée dans les urines, 11% dans les selles. In vivo, les voies métaboliques ont été identifiées, aucune n'est responsable de plus de 6,5% de la dose: Désalcalinisation, hydroxylation, déshydrogénisation et division du benzisoxazol. Bien que les études in vitro semblent indiquer une implication des CYP2D6 et CYP3A4 dans le métabolisme de la palipéridone, rien n'indique in vivo que ces isoenzymes jouent un rôle important dans le métabolisme de la palipéridone. Bien qu'il existe de grandes différences dans la population générale en ce qui concerne la capacité à métaboliser des substrats CYP2D6, les analyses de la pharmacocinétique de population ne montrent aucune différence nette entre la métabolisation rapide (extensive metabolisers) et la métabolisation lente (poor metabolisers) du CYP2D6 en ce qui concerne la clairance apparente de la palipéridone après utilisation de palipéridone sous forme retard. Les études in vitro, avec des systèmes de préparations microsomiales hétérologues, ont montré que les CYP1A2, CYP2A6, CYP2C9, CYP2C19 et CYP3A5 ne sont pas impliquées dans le métabolisme de la palipéridone. La demi-vie d'élimination terminale de la palipéridone se situe autour de 23 heures.
Élimination
Voir «Métabolisme».
Cinétique pour certains groupes de patients
Origine ethnique
Les analyses pharmacocinétiques de population n'ont montré aucune différence due à l'origine ethnique concernant la pharmacocinétique de la palipéridone après l'utilisation de palipéridone sous forme retard. Chez les personnes à la peau foncée, la clearance apparente de la palipéridone après l'administration de palipéridone sous forme retard a été approximativement de 38% inférieure à celle observée chez les personnes d'une autre origine ethnique. Cette différence n'a vraisemblablement pas de pertinence clinique. Les recommandations posologiques pour la palipéridone sous forme retard s'appliquent quelle que soit l'origine ethnique du patient, car les adaptations de la posologie après le début du traitement doivent reposer sur l'examen clinique.
Aucune différence de pharmacocinétique n'a été observée dans une étude menée chez des Japonais et des Caucasiens.
Sexe
Lors de l'utilisation de palipéridone sous forme retard, la clairance apparente de la palipéridone est inférieure d'environ 19% chez les femmes par rapport à celle chez les hommes. Cet écart s'explique largement par les différences spécifiques liées au sexe des sujets entre les masses corporelles non graisseuses et la clairance de la créatinine.
Tabagisme
Les études in vitro avec les enzymes hépatiques humaines permettent de conclure que la palipéridone n'est pas un substrat du CYP1A2; le tabagisme ne devrait donc avoir aucune influence sur la pharmacocinétique de la palipéridone. Une évaluation de pharmacocinétique de population a montré une exposition à la palipéridone légèrement inférieure chez les fumeurs par rapport aux non-fumeurs. Cette différence n'a toutefois vraisemblablement pas de pertinence clinique.
Troubles de la fonction hépatique
La palipéridone n'est pas métabolisée de façon extensive dans le foie. Dans une étude sur des sujets présentant une insuffisance hépatique moyenne (classe Child-Pugh B), les concentrations plasmatiques de la palipéridone libre étaient similaires à celles obtenues sur les volontaires sains. Il n'existe aucune connaissance concernant les patients présentant une insuffisance hépatique sévère (classe Child-Pugh C).
Troubles de la fonction rénale
L'élimination de la palipéridone diminue lorsque les fonctions rénales diminuent. La clairance totale de la palipéridone, chez les sujets insuffisants rénaux participant à l'étude, était inférieure de 32% en cas d'insuffisance rénale légère (CrCl = 50 à <80 ml/min), de 64% en cas d'insuffisance rénale modérée (CrCl = 30 à <50 ml/min) et de 71% en cas d'insuffisance rénale sévère (CrCl = 10 à <30 ml/min). La demi-vie d'élimination terminale moyenne de la palipéridone s'élevait à 24, 40 et 51 heures respectivement pour les sujets participant à l'étude et présentant une insuffisance rénale légère, modérée et sévère, comparé à 23 heures pour les sujets présentant des fonctions rénales normales (CrCl ≥80 ml/min).
Patients âgés
Il n'est pas recommandé de procéder à une adaptation de la dose en raison de l'âge du patient. Les données issues d'une étude de pharmacocinétique effectuée sur des patients âgés (≥65 ans, n= 26) ont montré que la clairance stabilisée apparente de la palipéridone après administration de palipéridone sous forme retard était diminuée de 20% par rapport à une utilisation sur des sujets adultes (18–45 ans, n= 28). Toutefois, dans les études de pharmacocinétique de population effectuées sur les patients schizophrènes après adaptation en fonction de la baisse de la CrCl liée à l'âge, aucun effet lié à l'âge n'a pu être démontré.
| 
