Propriétés/EffetsCode ATC
M09AX10
Mécanisme d'action
Le risdiplam est un modificateur d'épissage du pré-ARNm de SMN2 (Survival of Motor Neuron 2, survie du motoneurone 2) conçu pour traiter la SMA causée par un déficit de la protéine SMN dû à des mutations du chromosome 5q. Le déficit en protéine SMN fonctionnelle est le mécanisme physiopathologique à la base de toutes les formes de SMA. Le risdiplam corrige l'épissage de SMN2 et modifie l'équilibre entre l'exclusion de l'exon 7 et son inclusion dans le transcrit ARNm, conduisant à une augmentation de la production de protéine SMN fonctionnelle et stable. Ainsi, le risdiplam traite la SMA en augmentant et en maintenant la concentration de protéine SMN fonctionnelle.
Électrophysiologie cardiaque
L'effet du risdiplam sur l'intervalle QTc a été évalué dans une étude menée auprès de 47 sujets adultes sains. À l'exposition thérapeutique, le risdiplam n'a pas prolongé l'intervalle QTc.
Pharmacodynamique
Le risdiplam se distribue uniformément dans toutes les parties du corps, y compris le système nerveux central (SNC), car il traverse la barrière hémato-encéphalique, ce qui entraîne une augmentation de la concentration de protéine SMN dans le SNC et dans tout l'organisme. Les concentrations plasmatiques de risdiplam et les concentrations sanguines de protéine SMN reflètent sa distribution et ses effets pharmacodynamiques dans les tissus tels que le cerveau et les muscles.
Dans les études cliniques FIREFISH, SUNFISH et JEWELFISH menées chez des patients atteints de SMA infantile et chez des patients atteints de SMA d'apparition tardive, le risdiplam a entraîné une augmentation constante et persistante de la protéine SMN; une variation médiane supérieure à 2 fois la valeur initiale a été mesurée dans le sang dans les 4 semaines suivant le début du traitement. Cette augmentation de la protéine SMN a été maintenue durant toute la période de traitement d'au moins 24 mois (voir rubrique «Propriétés/Effets», Efficacité clinique).
Efficacité clinique
L'efficacité d'Evrysdi dans le traitement de patients atteints de SMA infantile (SMA de type 1) et de SMA d'apparition tardive (SMA de types 2 et 3) a été évaluée dans les deux études cliniques pivots, FIREFISH et SUNFISH, auxquelles s'ajoutent les données issues de l'étude JEWELFISH. L'efficacité d'Evrysdi dans le traitement de patients atteints de SMA présymptomatique a été évaluée dans l'étude RAINBOWFISH.
Les patients présentant un diagnostic clinique de SMA de type 4 n'ont pas été étudiés dans le cadre d'études cliniques.
Dans les études cliniques, l'efficacité à long terme a été démontrée pendant une durée de traitement d'au moins 24 mois. Il n'existe que des données limitées pour des durées supérieures à 2 ans.
SMA infantile
L'étude BP39056 (FIREFISH) est une étude ouverte, en deux parties, visant à évaluer l'efficacité, la sécurité, la PK et la pharmacodynamique (PD) d'Evrysdi chez des patients symptomatiques atteints de SMA de type 1 (tous les patients avaient une maladie génétiquement confirmée avec 2 copies du gène SMN2). La partie 1 de l'étude FIREFISH était conçue pour déterminer la dose. La partie 2 confirmatoire de l'étude FIREFISH a évalué l'efficacité d'Evrysdi à la dose thérapeutique sélectionnée à l'aide des résultats de la partie 1 (voir rubrique «Posologie/Mode d'emploi»). Les patients de la partie 1 n'ont pas participé à la partie 2.
Au total, 62 patients symptomatiques atteints de SMA de type 1 ont été inclus dans l'étude FIREFISH partie 1 (n = 21) et partie 2 (n = 41), 58 d'entre eux ayant reçu la dose thérapeutique. L'âge médian au moment de la première manifestation des signes et symptômes cliniques était de 1,5 mois (intervalle: de 0,9 à 3,0 mois). L'âge médian au moment de l'inclusion dans l'étude était de 5,6 mois (intervalle: de 2,2 à 6,9 mois). Le délai médian entre l'apparition des symptômes et la première dose était de 3,7 mois (intervalle: de 1,0 à 6,0 mois). Parmi ces patients, 60% étaient de sexe féminin, 57% d'origine caucasienne et 29% d'origine asiatique. À l'inclusion, le score CHOP-INTEND médian était de 23 (intervalle: de 8 à 37) et le score HINE-2 médian de 1 (intervalle: de 0 à 5). Les caractéristiques démographiques et les caractéristiques de la maladie à l'inclusion des patients dans la partie 1 étaient comparables à celles des patients de la partie 2.
Le critère d'évaluation principal de l'étude était la proportion de patients capables de se tenir assis sans soutien pendant au moins 5 secondes après 12 mois de traitement dans la partie 2 (échelle de motricité globale BSID-III, item 22). 29% des patients (n = 12/41, IC à 90%: 17,9%, 43,1%, p < 0,0001) ont atteint cette étape.
Les principaux critères d'efficacité des patients traités par Evrysdi dans l'étude FIREFISH (données regroupées des parties 1 et 2) sont présentés dans le Tableau 4.
Tableau 4: Résumé des principaux critères d'efficacité après 12 mois et 24 mois (FIREFISH partie 1 et partie 2)
|
Critères d'efficacité
|
Mois 12
|
Mois 24
| |
|
Proportion de patients (IC à 90%)
| |
Fonctions motrices et étapes de développement
|
n = 58a
| |
BSID-III: se tenir assis sans soutien pendant au moins 5 secondes
|
32,8%
(22,6%, 44,3%)
|
60,3%
(48,7%, 71,2%)
| |
Score CHOP-INTEND de 40 ou plus
|
56,9%
(45,3%, 68,0%)
|
74,1%
(63,0%, 83,3%)
| |
Augmentation du score CHOP-INTEND de ≥4 points par rapport à la valeur initiale
|
89,7%
(80,6%, 95,4%)
|
87,9%
(78,5%, 94,2%)
| |
HINE-2: répondeurs aux étapes motricesb
|
77,6%
(66,7%, 86,2%)
|
82,8%
(72,5%, 90,3%)
| |
Survie et survie sans événement
|
n = 62a
| |
Survie sans événementc
|
87,1%
(78,1%, 92,6%)
|
83,8%
(74,3%, 90,1%)
| |
Survie
|
91,9%
(83,9%, 96,1%)
|
90,3%
(81,9%, 94,9%)
| |
Prise d'aliments
|
n = 58a
| |
Capacité à se nourrir par voie oraled
|
84,5%
(74,5%, 91,7%)
|
82,8%
(72,5%, 90,3%)
|
Abréviations: BSID-III: Bayley Scales of Infant and Toddler Development – Third Edition; CHOP-INTEND: Children's Hospital of Philadelphia Infant Test of Neuromuscular Disorders; HINE-2: Module 2 of the Hammersmith Infant Neurological Examination.
a Pour la survie et la survie sans ventilation, les données de tous les patients ayant reçu une dose quelconque de risdiplam dans les parties 1 et 2 (n = 62) ont été regroupées. Les données de tous les patients ayant reçu la dose thérapeutique de risdiplam (tous les patients de la partie 2 et ceux de la cohorte à forte dose de la partie 1; n = 58) ont été regroupées pour les critères d'efficacité suivants: fonction motrice, étapes de développement et prise d'aliments.
b Définition de répondeur HINE-2: dans cette analyse, la réponse se définit par une augmentation de ≥2 points (ou score maximal) de la capacité à donner un coup de pied, OU une augmentation de ≥1 point dans les étapes motrices: contrôle de la tête, rouler, s'asseoir, ramper, se tenir debout ou marcher, ET un plus grand nombre d'étapes motrices présentant une amélioration qu'une aggravation.
c Un événement atteint le critère de ventilation permanente, définie par une trachéostomie ou une ventilation non invasive ≥16 heures par jour ou une intubation > 21 jours consécutifs en l'absence ou après la résolution d'un événement aigu réversible. Quatre patients ont atteint le critère de ventilation permanente avant le mois 24. Ces 4 patients ont atteint une augmentation d'au moins 4 points du score CHOP-INTEND par rapport à la valeur initiale.
d Comprend les patients qui ont été nourris exclusivement par voie orale (41 patients après 12 et 24 mois) et ceux qui ont été nourris par voie orale en combinaison avec une sonde d'alimentation (8 patients après 12 mois et 7 patients après 24 mois).
Au mois 24, 40% (23/58) des patients ayant reçu la dose thérapeutique ont atteint la station assise sans soutien pendant 30 secondes (BSID-III, item 26). En outre, les patients ont atteint d'autres étapes motrices, déterminées à l'aide du score HINE-2 au mois 24; 78% des patients ont pu se retourner (31% des patients ont pu se tourner sur le côté, 7% ont pu se tourner de la position ventrale à la position dorsale et 40% ont pu se tourner de la position dorsale à la position ventrale) et 28% des patients ont pu se tenir debout (16% position debout sans soutien et 12% debout avec soutien).
La proportion de patients ayant survécu sans ventilation permanente (survie sans événement) était de 84% à 24 mois pour l'ensemble des patients. Six nourrissons sont décédés (quatre dans les trois premiers mois suivant l'inclusion dans l'étude) et un autre patient a interrompu le traitement et est décédé 3,5 mois plus tard. Quatre patients ont nécessité une ventilation permanente au mois 24.
SMA d'apparition tardive
L'étude BP39055 (SUNFISH) est une étude multicentrique, en deux parties, visant à évaluer l'efficacité, la sécurité, la PK et la PD d'Evrysdi chez des patients atteints de SMA de type 2 ou 3 et âgés de 2 à 25 ans. La partie 1 était la partie de détermination de la dose de l'étude et la partie 2 était la partie confirmatoire randomisée, en double aveugle et contrôlée par placebo. Les patients de la partie 1 n'ont pas participé à la partie 2.
Le critère d'évaluation principal était la variation du score MFM32 (Motor Function Measure-32, mesure de fonction motrice-32) par rapport au score initial. La MFM32 permet d'évaluer un large spectre de fonctions motrices chez des patients très différents atteints de SMA. Le score total MFM32 est exprimé en pourcentage (de 0 à 100) du score maximum possible, les scores les plus élevés indiquant une meilleure fonction motrice. La MFM32 mesure les capacités fonctionnelles motrices qui sont importantes pour les principales activités quotidiennes. De petites modifications des fonctions motrices peuvent représenter de grands gains ou de grandes pertes des capacités fonctionnelles dans la vie quotidienne.
Partie 2 de l'étude SUNFISH
La partie 2 de l'étude SUNFISH est la partie randomisée, en double aveugle, contrôlée par placebo de l'étude SUNFISH menée chez 180 patients non aptes à marcher atteints de SMA de type 2 (71%) ou de SMA de type 3 (29%). Les patients ont été randomisés selon un rapport 2:1 pour recevoir soit Evrysdi à la dose thérapeutique (voir rubrique «Posologie/Mode d'emploi») soit le placebo. La randomisation était stratifiée par groupe d'âge (2 à 5 ans, 6 à 11 ans, 12 à 17 ans, 18 à 25 ans).
L'âge médian des patients au début du traitement était de 9,0 ans (intervalle: de 2 à 25 ans); le délai médian entre l'apparition des premiers symptômes de la SMA et le début du traitement était de 102,6 mois (intervalle: de 1 à 275 mois). Sur les 180 patients inclus dans l'étude, 51% étaient de sexe féminin, 67% étaient d'origine caucasienne et 19% d'origine asiatique. À l'inclusion, 67% des patients avaient une scoliose (32% des patients présentant une scoliose sévère). Les patients avaient un score MFM32 initial moyen de 46,1et un score RULM (Revised Upper Limb Module) moyen de 20,1. Les caractéristiques démographiques des patients à l'inclusion étaient globalement équilibrées entre les bras Evrysdi et placebo, à l'exception d'un déséquilibre chez les patients avec scoliose (63,3% des patients dans le bras Evrysdi et 73,3% des patients dans le bras placebo).
L'analyse principale de la partie 2 de l'étude SUNFISH, la variation du score total MFM32 au mois 12 par rapport au score initial, a montré une différence cliniquement pertinente et statistiquement significative entre les patients traités par Evrysdi et ceux ayant reçu le placebo. Les résultats de l'analyse principale et des critères clés d'évaluation secondaires sont résumés dans le Tableau 5 et la Figure 1.
Tableau 5: Résumé des résultats d'efficacité chez les patients atteints de SMA d'apparition tardive après 12 mois de traitement (partie 2 de l'étude SUNFISH)
|
Critère d'évaluation
|
Evrysdi
(n = 120)
|
Placebo
(n = 60)
| |
Critère d'évaluation principal
| |
Variation du score total MFM321 à 12 mois, par rapport à la valeur initiale
Moyenne des MC (IC à 95%)
|
1,36
(0,61; 2,11)
|
-0,19
(-1,22; 0,84)
| |
Différence par rapport au placebo
Valeur estimée (IC à 95%)
Valeur de p2
|
1,55
(0,30; 2,81)
0,0156
| |
Critères d'évaluation secondaires
| |
Proportion de patients avec une variation du score total MFM321 de 3 ou plus après 12 mois, par rapport à la valeur initiale (IC à 95%)
|
38,3%
(28,9; 47,6)
|
23,7%
(12,0; 35,4)
| |
Odds ratio pour la réponse globale (IC à 95%)
Valeur de p ajustée (non ajustée)3,4
|
2,35 (1,01; 5,44)
0,0469 (0,0469)
| |
Variation du score total RULM5 à 12 mois, par rapport à la valeur initiale
Moyenne des MC (IC à 95%)
|
1,61
(1,00; 2,22)
|
0,02
(-0,83; 0,87)
| |
Différence par rapport au placebo, valeur estimée (IC à 95%)
Valeur de p ajustée (non ajustée)2,4
|
1,59 (0,55; 2,62)
0,0469 (0,0028)
|
MC = moindres carrés.
1 Sur la base de la règle des données manquantes pour la MFM32, 6 patients ont été exclus de l'analyse (Evrysdi n = 115; contrôle placebo n = 59).2 Données analysées à l'aide d'un modèle mixte de mesures répétées: score total initial, traitement, visite, groupe d'âge, traitement par visite et valeur initiale par visite.3 Données analysées à l'aide de la régression logistique pour le score total initial, le traitement et le groupe d'âge.4 La valeur de p ajustée a été obtenue pour les critères d'évaluation inclus dans le test hiérarchique et a été dérivée sur la base de toutes les valeurs de p des critères d'évaluation dans l'ordre de la hiérarchie jusqu'au critère d'évaluation actuel. Les valeurs de p non ajustées ont été testées à un niveau de significativité de 5%.5 Sur la base de la règle des données manquantes pour le RULM, 3 patients ont été exclus de l'analyse (Evrysdi n = 119; contrôle placebo n = 58).
À la fin des 12 mois de traitement, 117 patients ont continué à recevoir Evrysdi. Au moment de l'analyse à 24 mois, ces patients traités pendant 24 mois ont présenté une nouvelle amélioration de leur fonction motrice entre le mois 12 et le mois 24. La variation moyenne du score MFM32 par rapport à la valeur initiale était de 1,83 (IC à 95%: 0,74–2,92) et celle du score RULM de 2,79 (IC à 95%: 1,94–3,64).
Figure 1: Variation moyenne (MC) du score total MFM32 par rapport à la valeur initiale sur 12 mois dans la partie 2 de l'étude SUNFISH
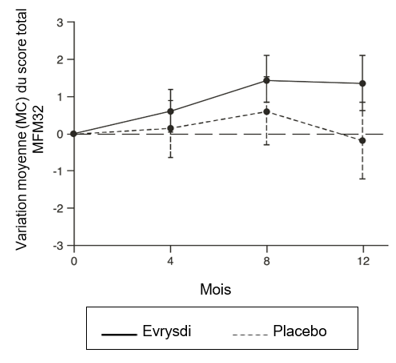
* Les barres d'erreur indiquent l'intervalle de confiance à 95%.
† Le score total MFM a été calculé selon le manuel de l'utilisateur et exprimé en pourcentage du nombre maximum de points possible pour l'échelle (c.-à-d. en divisant la somme des cotations des 32 items par 96 et en multipliant par 100).
Partie 1 de l'étude SUNFISH
L'efficacité d'Evrysdi chez les patients atteints de SMA d'apparition tardive est également soutenue par les résultats de la partie 1 de SUNFISH, la partie de détermination de la dose de l'étude. Dans la partie 1, 51 patients de 2 à 25 ans atteints de SMA de type 2 ou de type 3 (dont 7 patients aptes à marcher) ont été inclus. Après 1 an de traitement à la dose thérapeutique (dose sélectionnée pour la partie 2), une amélioration cliniquement significative de la fonction motrice mesurée à l'aide de la MFM32 a été observée, avec une variation moyenne de 2,7 points par rapport à la valeur initiale (IC à 95%: 1,5; 3,8). L'amélioration de la MFM32 a également été maintenue après 2 ans de traitement par Evrysdi (variation moyenne de 2,7 points [IC à 95%: 1,2; 4,2]).
Dans une analyse exploratoire, la fonction motrice évaluée à l'aide de la MFM a été comparée entre la partie 1 de l'étude SUNFISH et une cohorte historique avec une évolution naturelle de la maladie (pondérée selon des facteurs pronostiques importants). La variation totale de la MFM à 1 et 2 ans par rapport à la valeur initiale était plus élevée chez les patients ayant reçu Evrysdi que chez ceux de la cohorte avec l'évolution naturelle (à 1 an: différence de 2,7 points; p < 0,0001; à 2 ans: différence de 4,0 points; p < 0,0001). La cohorte avec l'évolution naturelle a présenté une diminution de la fonction motrice, comme attendu avec une progression naturelle de la SMA (variation moyenne à 1 an: -0,6 point; à 2 ans: -2,0 points).
SMA présymptomatique
L'étude BN40703 (RAINBOWFISH) est une étude clinique multicentrique, ouverte, à un bras, visant à évaluer l'efficacité, la sécurité, la pharmacocinétique et la pharmacodynamique d'Evrysdi chez des nourrissons de la naissance à l'âge de 6 semaines (à la première dose) présentant une SMA génétiquement confirmée mais encore asymptomatique.
L'efficacité chez les patients présymptomatiques atteints de SMA a été étudiée au mois 12 chez 26 patients [population en intention de traiter, ITT] traités par Evrysdi. L'âge médian de ces patients à la première dose était de 25 jours (intervalle: de 16 à 41 jours), 62% étaient de sexe féminin et 85% étaient d'origine caucasienne. Huit patients, 13 patients et 5 patients avaient respectivement 2, 3 et ≥4 copies du gène SMN2. À l'inclusion, le score CHOP-INTEND médian était de 51,5 (intervalle: de 35,0 à 62,0), le score HINE-2 médian était de 2,5 (intervalle: de 0 à 6,0), et l'amplitude médiane du potentiel d'action musculaire (CMAP, Compound Muscle Action Potential) du nerf cubital était de 3,6 mV (intervalle: de 0,5 à 6,7 mV).
La population évaluable pour l'efficacité principale (n = 5) incluait des patients avec 2 copies de SMN2 et une amplitude initiale du CMAP ≥1,5 mV. Chez ces patients, le score CHOP-INTEND médian était de 48,0 (intervalle: de 36,0 à 52,0), le score HINE-2 médian était de 2,0 (intervalle: de 1,0 à 3,0) et l'amplitude médiane du CMAP était de 2,6 mV (intervalle: de 1,6 à 3,8 mV) à l'inclusion.
Le critère d'évaluation principal était la proportion de patients dans la population d'efficacité principale ayant la capacité de se tenir assis sans soutien pendant au moins 5 secondes (item 22 de l'échelle de motricité globale BSID-III) au mois 12; une proportion statistiquement significative et cliniquement pertinente de patients a atteint cette étape par rapport au critère de performance prédéfini de 5%.
Les critères principaux d'évaluation de l'efficacité chez les patients traités par Evrysdi sont présentés dans les Tableaux 6 et 7 ainsi que dans la Figure 2.
Tableau 6: Position assise selon l'item 22 du BSID-III pour les patients présymptomatiques au mois 12
|
Critère d'efficacité
|
Population
| |
|
Efficacité principale
(n = 5)
|
Patients avec 2 copies de SMN2a
(n = 8)
|
ITT
(n = 26)
| |
Proportion de patients assis sans soutien pendant au moins 5 secondes (BSID-III, Item 22); (IC à 90%I)
|
80%
(34,3%, 99,0%)
p < 0,0001b
|
87,5%
(52,9%, 99,4%)
|
96,2%
(83,0%, 99,8%)
|
Abréviations: BSID-III = Bayley Scales of Infant and Toddler Development – Third Edition; IC = intervalle de confiance; ITT = Intent-to-Treat (en intention de traiter).
a Les patients avec 2 copies de SMN2 avaient une amplitude médiane du CMAP de 2,0 (intervalle: de 0,5 à 3,8) à l'inclusion.
b La valeur de p est basée sur un test binomial exact unilatéral. Le résultat est comparé à un seuil de 5%.
De plus, 80% (4/5) de la population d'efficacité principale, 87,5% (7/8) des patients avec 2 copies de SMN2 et 80,8% (21/26) des patients de la population ITT sont parvenus à rester assis sans soutien pendant 30 secondes (BSID-III, item 26).
Les patients de la population ITT ont également atteint des étapes motrices, mesurées à l'aide de l'échelle HINE-2 au mois 12 (n = 25). Dans cette population, 96,0% des patients ont pu s'asseoir [1 patient (1/8 patients avec 2 copies de SMN2) a pu se stabiliser en position assise et 23 patients (6/8, 13/13, 4/4 patients avec respectivement 2, 3 et ≥4 copies de SMN2) ont pu se retourner]. De plus, 84% des patients ont pu se tenir debout; 32% (n = 8) des patients ont pu se tenir debout avec de l'aide (3/8, 3/13 et 2/4 patients avec respectivement 2, 3 et ≥4 copies de SMN2) et 52% (n = 13) des patients ont pu se tenir debout sans aide (1/8, 10/13 et 2/4 des patients avec respectivement 2, 3 et ≥4 copies de SMN2). De plus, 72% des patients ont pu sauter, courir ou marcher; 8% (n = 2) des patients ont pu sauter (2/8 patients avec 2 copies de SMN2), 16% (n = 4) ont pu courir (3/13 et 1/4 patients avec respectivement 3 et ≥4 copies du gène SMN2) et 48% (n = 12) ont pu marcher de manière autonome (1/8, 9/13 et 2/4 patients avec respectivement 2, 3 et ≥4 copies de SMN2). Sept patients n'ont pas été testés pour la marche au mois 12.
Tableau 7: Résumé des principaux critères d'efficacité chez les patients présymptomatiques au mois 12
|
Critères d'efficacité
|
Population ITT (n = 26)
| |
Fonction motrice
| |
Proportion de patients atteignant un score total de 50 ou plus (IC à 90%) dans CHOP-INTEND
|
92%a
(76,9%, 98,6%)
| |
Proportion de patients atteignant un score total de 60 ou plus (IC à 90%) dans CHOP-INTEND
|
80%a
(62,5%, 91,8%)
| |
Prise d'aliments
| |
Proportion de patients ayant la capacité de s'alimenter par voie orale (IC à 90%)
|
96,2%b
(83,0%, 99,8%)
| |
Recours au système de santé
| |
Proportion de patients sans hospitalisationc (IC à 90%)
|
92,3%
(77,7%, 98,6%)
| |
Survie sans événementd
Proportion de patients avec une survie sans événement (IC à 90%)
|
100%
(100%, 100%)
|
Abréviations: CHOP-INTEND = Children's Hospital of Philadelphia Infant Test of Neuromuscular Disorders; IC = intervalle de confiance; ITT = Intent-to-Treat (en intention de traiter).
a Sur la base de n = 25.
b Un patient n'a pas été évalué.
c Les hospitalisations comprennent toutes les hospitalisations qui ont duré au moins deux jours et qui n'étaient pas dues aux exigences de l'étude.
d Un événement correspond au décès ou à une ventilation permanente; la ventilation permanente est définie par une trachéostomie ou une ventilation non invasive ≥16 heures par jour ou une intubation pendant > 21 jours consécutifs en l'absence ou après la résolution d'un événement aigu réversible.
Figure 2: Score total CHOP-INTEND médian par visite et nombre de copies de SMN2 (population ITT)
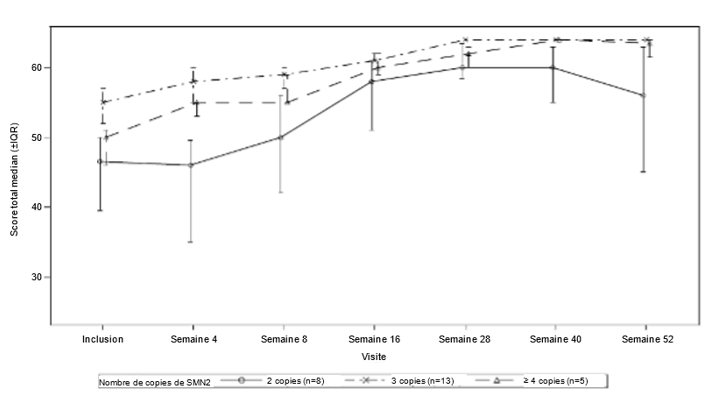
Abréviations: IQR = Inter-Quartile Range (écart interquartile); SMN2 = Survival Motor Neuron 2 (survie du motoneurone 2).
Administration chez les patients atteints de SMA précédemment traités par d'autres traitements modificateurs de la maladie
L'étude BP39054 (JEWELFISH) est une étude ouverte à un bras visant à évaluer la sécurité, la tolérance, la PK et la PD d'Evrysdi chez des patients atteints de SMA infantile ou de SMA d'apparition tardive âgés de 6 mois à 60 ans et ayant reçu auparavant d'autres traitements de la SMA (y compris le nusinersen et l'onasemnogène abéparvovec). Sur les 173 patients ayant reçu Evrysdi, 76 avaient été traités auparavant par le nusinersen (9 patients atteints de SMA de type 1, 43 patients atteints de SMA de type 2 et 24 patients atteints de SMA de type 3) et 14 patients avaient été traités auparavant par l'onasemnogène abéparvovec (4 patients atteints de SMA de type 1 et 10 patients atteints de SMA de type 2). L'âge médian des patients au début du traitement par Evrysdi était de 14 ans (intervalle: de 1 à 60 ans).
À l'inclusion, 83% des 168 patients âgés de 2 à 60 ans avaient une scoliose (39% des patients présentant une scoliose sévère) et 63% des patients avaient un score < 10 points sur l'échelle Hammersmith Functional Motor Scale Expanded (HFMSE). Quinze patients aptes à marcher (5 à 46 ans) ont également été inclus dans l'étude.
L'efficacité exploratoire a été évaluée à l'aide de paramètres de motricité adaptés à l'âge, dont les échelles MFM-32 et RULM chez les patients âgés de 2 à 60 ans, les échelles BSID III et HINE-2 chez les patients âgés de moins de 2 ans et le test de marche de 6 minutes (6MWT) chez les patients aptes à marcher âgés de 6 ans et plus. Lors de l'analyse primaire réalisée après 24 mois de traitement, les patients âgés de 2 à 60 ans ont présenté globalement une stabilisation de la motricité, mesurée à l'aide des échelles MFM-32 et RULM (respectivement, n = 137 et n = 133). Les patients de moins de 2 ans (n = 6) ont pu conserver ou acquérir des étapes motrices clés telles que contrôler de la tête, rouler de façon autonome et se tenir assis de façon autonome. Le 6MWT a montré une amélioration moyenne de 30,88 mètres (IC à 95%: -5,54; 67,29; n = 8). Tous les patients aptes à marcher ont conservé leur capacité à marcher.
|


