CompositionPrincipes actifs
Nératinib sous forme de nératinib maleate.
Excipients
Mannitol (E421), cellulose microcristalline, crospovidone, povidone K25, silice anhydre colloïdale, stéarate de magnésium, alcool polyvinylique, dioxyde de titane (E171), macrogol 3350, talc, oxyde de fer rouge (E172), eau purifiée.
Indications/Possibilités d’emploiNerlynx est indiqué dans le traitement adjuvant prolongé des patients adultes présentant un cancer du sein précoce à récepteurs hormonaux positifs caractérisé par une surexpression/amplification de HER2 et ayant terminé leur traitement adjuvant à base de trastuzumab et de chimiothérapie depuis moins d'un an (voir aussi la rubrique «Propriétés/Effets»).
Posologie/Mode d’emploiLe traitement par Nerlynx doit être instauré et supervisé par un médecin expérimenté dans l'administration de médicaments anticancéreux.
Posologie usuelle
La dose journalière recommandée de Nerlynx est de 240 mg (six comprimés de 40 mg) pris par voie orale une fois par jour. Nerlynx doit être pris avec un repas, de préférence le matin. Les patients doivent commencer le traitement dans l'année suivant la fin du traitement par trastuzumab.
Durée du traitement
La durée du traitement est d'un an sans interruption.
Prophylaxie de la diarrhée sous Nerlynx
Une prophylaxie de la diarrhée est recommandée durant les premiers 56 jours du traitement par Nerlynx. Cette prophylaxie doit commencer lors de la première dose de Nerlynx avec une dose de 4 mg de lopéramide trois fois par jour durant les deux premières semaines du traitement, puis 4 mg deux fois par jours (voir ajustements de la posologie en cas de diarrhée au tableau 3 ci-dessous).
Ajustement de la posologie du fait d'effets indésirables/d'interactions
Il est recommandé d'ajuster la dose de Nerlynx en fonction de la sécurité et de la tolérance de chaque patient. La prise en charge de certains effets indésirables peut nécessiter d'interrompre l'administration de la dose et/ou de la réduire conformément à ce qui est indiqué dans les tableaux 1, 2, 3 et 4.
Il convient d'interrompre l'administration de Nerlynx chez les patients:
·dont la toxicité liée au traitement ne s'améliore pas jusqu'au grade 0-1,
·pour lesquels les toxicités donnent lieu à un traitement différé >3 semaines, ou
·qui ne sont pas en mesure de tolérer une dose de 120 mg par jour.
D'autres situations cliniques peuvent donner lieu à des ajustements posologiques si cliniquement indiqué (toxicités intolérables, effets indésirables de grade 2 persistants, par exemple).
Tableau 1: Ajustements de la dose de Nerlynx en cas d'effets indésirables
|
Niveau de dose
|
Dose de Nerlynx
| |
Dose initiale recommandée
|
240 mg par jour
| |
Première réduction de dose
|
200 mg par jour
| |
Deuxième réduction de dose
|
160 mg par jour
| |
Troisième réduction de dose
|
120 mg par jour
|
Tableau 2: Ajustements de la dose de Nerlynx et prise en charge - toxicités générales*
|
Sévérité de la toxicité†
|
Action
| |
Grade 3
|
Interrompre le traitement par Nerlynx jusqu'au retour à un grade ≤1 ou l'état initial dans les trois semaines suivant l'interruption du traitement, puis reprendre le traitement par Nerlynx à la dose immédiatement inférieure. Si la toxicité de grade 3 n'est pas résolue dans les trois semaines, arrêter définitivement le traitement par Nerlynx.
| |
Grade 4
|
Arrêter définitivement le traitement par Nerlynx.
|
* Pour la prise en charge de la diarrhée et de l'hépatotoxicité, voir les tableaux 3 et 4 ci-dessous.
† Selon les critères CTCAE v4.0
Ajustement de la posologie en cas de diarrhée
La prise en charge de la diarrhée requiert l'utilisation adéquate d'un médicament anti-diarrhéique, des changements de régime alimentaire et des ajustements appropriés de la dose de Nerlynx. Des lignes directrices relatives à l'ajustement des doses de Nerlynx en cas de diarrhée sont fournies dans le tableau 3.
Tableau 3: Ajustements posologiques en cas de diarrhée
|
Sévérité de la diarrhée*
|
Action
| |
·Diarrhée de grade 1 [augmentation <4 selles par jour par rapport à la valeur de référence]
·Diarrhée de grade 2 [augmentation de 4 à 6 selles par jour par rapport à la valeur de référence] d'une durée <5 jours
·Diarrhée de grade 3 [augmentation ≥7 selles par jour par rapport à la valeur de référence; incontinence; hospitalisation indiquée; limitant les activités autonomes de la vie quotidienne] d'une durée ≤2 jours
|
·Ajuster le traitement anti-diarrhéique en fonction de la sévérité de la diarrhée.
·Changements de régime alimentaire
·Il convient de garantir un apport hydrique d'environ 2 litres/jour afin d'empêcher une déshydratation.
·Une fois l'événement retourné à un grade ≤1 ou à la valeur de référence, envisager la reprise du traitement prophylactique anti-diarrhéique, si nécessaire, en association avec chaque administration ultérieure de Nerlynx (voir la rubrique «Mises en garde et précautions»).
| |
·Tout grade s'accompagnant de complications†
·Diarrhée de grade 2 d'une durée supérieure ou égale à 5 jours‡
·Diarrhée de grade 3 d'une durée de 2 jours à 3 semaines‡
|
·Interrompre le traitement par Nerlynx.
·Changements de régime alimentaire
·Il convient de garantir un apport hydrique d'environ 2 litres/jour afin d'empêcher une déshydratation.
·En cas de retour de la diarrhée à un grade de ≤1 au maximum après une semaine, reprendre le traitement par Nerlynx à la même dose.
·En cas de retour de la diarrhée à un grade de ≤1 après plus d'une semaine, reprendre le traitement par Nerlynx à une dose inférieure (voir le tableau 1).
·Quand retour à un grade ≤1 ou à l'état initial, envisager la reprise du traitement prophylactique anti-diarrhéique, si nécessaire, en association avec chaque administration ultérieure de Nerlynx (voir la rubrique «Mises en garde et précautions»).
·Si la diarrhée de grade 3 dure plus de trois semaines, arrêter définitivement le traitement par Nerlynx.
| |
·Diarrhée de grade 4 [conséquences menaçant le pronostic vital, nécessitant une intervention urgente]
|
·Arrêter définitivement le traitement par Nerlynx.
| |
·Réapparition d'une diarrhée ≥ grade 2 à la dose de 120 mg par jour
|
·Arrêter définitivement le traitement par Nerlynx.
|
* Selon les critères CTCAE v4.0
† Parmi les complications, on retrouve notamment: déshydratation, fièvre, hypotension, insuffisance rénale ou neutropénie de grade 3 ou 4
‡ Malgré l'administration d'un traitement médicamenteux optimal
Ajustements posologiques en cas d'hépatotoxicité
Des lignes directrices relatives à l'ajustement de la dose de Nerlynx en cas de toxicité hépatique sont fournies dans le tableau 4 (voir la rubrique «Mises en garde et précautions»).
Tableau 4: Ajustements posologiques en cas d'hépatotoxicité
|
Sévérité de l'hépatotoxicité*
|
Action
| |
·ALAT de grade 3 (>5-20 x LSN)
OU
·Bilirubine de grade 3 (>3-10 x LSN)
|
·Arrêter le traitement par Nerlynx jusqu'au retour à un grade ≤1.
·Évaluer les autres causes.
·Reprendre le traitement par Nerlynx à la dose immédiatement inférieure si le retour à un grade ≤1 survient dans les trois semaines. Si la bilirubine ou l'ALAT de grade 3 survient à nouveau malgré une réduction posologique, arrêter définitivement le traitement par Nerlynx.
| |
·ALAT de grade 4 (>20 x LSN)
OU
·Bilirubine de grade 4 (>10 x LSN)
|
·Arrêter définitivement le traitement par Nerlynx.
·Évaluer les autres causes.
|
LSN = limite supérieure de la normale; ALAT = alanine aminotransférase
* Selon les critères CTCAE v4.0
Instructions posologiques particulières
Utilisation d'inhibiteurs du CYP3A4/de la Pgp
Si l'utilisation d'un inhibiteur ne peut être évitée, réduire la dose de Nerlynx:
·à 40 mg (un comprimé de 40 mg) pris une fois par jour avec un puissant inhibiteur du CYP3A4/de la Pgp.
·à 40 mg (un comprimé) pris une fois par jour en cas de prise concomitante d'un inhibiteur modéré du CYP3A4/de la Pgp. Si l'association est bien tolérée, augmenter à 80 mg pendant au moins 1 semaine, puis à 120 mg pendant au moins 1 semaine, et à 160 mg comme dose journalière maximale. Le patient doit faire l'objet d'une surveillance étroite, notamment de l'apparition d'effets gastro-intestinaux tels qu'une diarrhée et une hépatotoxicité.
Après l'interruption de l'administration d'un inhibiteur puissant ou modéré du CYP3A4/de la Pgp, reprendre l'administration de la dose précédente de 240 mg de Nerlynx (voir les rubriques «Mises en garde et précautions», «Interactions» et «Pharmacocinétique»).
Pamplemousse et grenade
L'administration concomitante de nératinib et de pamplemousse ou grenade/jus de pamplemousse ou de grenade n'est pas recommandée (voir les rubriques «Mises en garde et précautions» et «Interactions»).
Antagonistes des récepteurs H2 et antiacides
Si des antagonistes des récepteurs H2 sont utilisés, Nerlynx doit être pris au moins 2 heures avant ou 10 heures après la prise d'antagoniste des récepteurs H2. Il convient d'espacer d'au moins trois heures l'administration de Nerlynx et celle d'un antiacide (voir les rubriques «Mises en garde et précautions», «Interactions» et «Pharmacocinétique»).
Patients présentant des troubles de la fonction hépatique
Aucun ajustement posologique n'est nécessaire chez les patients présentant une insuffisance hépatique légère à modérée (classe A ou B de Child-Pugh) (voir la rubrique «Pharmacocinétique»).
Patients présentant des troubles de la fonction rénale
Aucun ajustement posologique n'est nécessaire chez les patients présentant une insuffisance rénale légère à modérée. Nerlynx n'a pas fait l'objet d'étude chez des patients présentant une insuffisance rénale sévère, y compris les patients sous dialyse. Le traitement des patients présentant une insuffisance rénale sévère ou des patients sous dialyse n'est pas recommandé (voir la rubrique «Pharmacocinétique»).
Patients âgés
Aucun ajustement posologique n'est nécessaire. Aucune donnée n'est disponible pour les patients âgés de 85 ans et plus.
Enfants et adolescents
Nerlynx n'est pas utilisé chez les enfants et les adolescents.
Oubli d'une prise
En cas d'oubli d'une prise, la dose oubliée ne devra pas être remplacée et la suivante sera prise comme prévu à la posologie journalière recommandée.
Mode d'administration
Nerlynx est destiné à une utilisation orale. Les comprimés doivent être avalés entiers, de préférence avec de l'eau, et ne doivent pas être écrasés ou dissous. Par ailleurs, il convient de les prendre avec un repas, de préférence le matin (voir la rubrique «Pharmacocinétique»).
Contre-indications·Hypersensibilité à la substance active ou à l'un des excipients.
·Administration concomitante des médicaments suivants qui sont de puissants inducteurs de l'isoforme CYP3A4/Pgp du cytochrome P450, tels que:
·carbamazépine, phénytoïne (antiépileptiques);
·millepertuis (Hypericum perforatum) (préparation à base de plantes);
·rifampicine (antimycobactérien).
·Insuffisance hépatique sévère (classe C de Child-Pugh).
Mises en garde et précautionsSeuls les patients avec un traitement préalable par trastuzumab et chimiothérapie ont été inclus dans l'étude d'enregistrement. Il n'y a actuellement aucune donnée disponible dans le cas où les patients ont été traités préalablement avec d'autres traitements néoadjuvants ou adjuvants.
Diarrhée
Des cas de diarrhée ont été rapportés pendant le traitement par Nerlynx (voir les rubriques «Posologie/Mode d'emploi» et «Effets indésirables»). Cette diarrhée peut être sévère et associée à une déshydratation.
Elle survient généralement au début, pendant la première ou la deuxième semaine de traitement par Nerlynx, et peut être récurrente.
Les patients doivent être informés qu'ils doivent débuter un traitement prophylactique par un médicament anti-diarrhéique avec leur première dose de Nerlynx et qu'ils devront continuer de prendre ce médicament anti-diarrhéique régulièrement pendant une période d'un à deux mois, à compter de l'instauration du traitement par Nerlynx, pour parvenir à une à deux selles par jour.
Patients âgés
Les patients âgés (65 ans et plus) présentent un risque plus élevé de développer une insuffisance rénale ou de souffrir de déshydratation, qui peuvent être des complications de la diarrhée; ces patients doivent par conséquent faire l'objet d'une surveillance étroite.
Patients présentant une affection gastro-intestinale chronique significative
Les patients présentant une affection gastro-intestinale chronique significative accompagnée d'un symptôme majeur de diarrhée n'ont pas été inclus dans l'étude pivot et doivent par conséquent faire l'objet d'une surveillance étroite.
Troubles de la fonction rénale
Les patients présentant une insuffisance rénale présentent un risque plus élevé de complications de déshydratation s'ils développent une diarrhée; ces patients doivent par conséquent faire l'objet d'une surveillance étroite (voir les rubriques «Posologie/Mode d'emploi» et «Pharmacocinétique»).
Fonction hépatique
Des cas d'hépatotoxicité ont été rapportés chez les patients traités par Nerlynx. Il convient de surveiller les tests de la fonction hépatique, y compris l'alanine aminotransférase (ALAT), l'aspartate aminotransférase (ASAT) et la bilirubine totale, après la première semaine, puis une fois par mois pendant les trois mois qui suivent, puis toutes les six semaines tant que cliniquement indiqué (voir la rubrique «Posologie/Mode d'emploi»).
Les patients présentant une diarrhée de grade ≥3 nécessitant un traitement par une réhydratation intraveineuse liquidienne ou présentant des signes et symptômes d'hépatotoxicité, tels qu'aggravation de la fatigue, nausée, vomissements, jaunisse, douleur ou sensibilité dans le quadrant supérieur droit de l'abdomen, fièvre, éruption cutanée ou éosinophilie, doivent faire l'objet d'une évaluation visant à détecter les changements dans les résultats des tests de la fonction hépatique. La bilirubine fractionnée et le temps de prothrombine doivent également être évalués dans le cadre de l'évaluation de l'hépatotoxicité.
Fonction ventriculaire gauche
Une dysfonction ventriculaire gauche a été associée à l'inhibition de HER2. Nerlynx n'a pas fait l'objet d'études chez les patients présentant une fraction d'éjection ventriculaire gauche (FEVG) en deçà de la limite inférieure à la normale ou chez ceux ayant des antécédents cardiaques significatifs. Chez les patients présentant des facteurs de risques cardiaques connus, réaliser une surveillance cardiaque incluant une évaluation de la FEVG, si cliniquement indiqué.
Inhibiteurs de la pompe à protons, antagonistes des récepteurs H2 et antiacides
Les traitements qui augmentent le pH gastro-intestinal peuvent diminuer l'absorption de nératinib et par conséquent diminuer l'exposition systémique. L'administration concomitante d'inhibiteurs de la pompe à protons (IPP) n'est pas recommandée. En cas de prise d'antagonistes des récepteurs H2 ou d'antiacides, les modalités d'administration doivent être adaptées (voir les rubriques «Mises en garde et précautions», «Interactions» et «Pharmacocinétique»).
Grossesse
Le nératinib peut être nocif pour le fœtus lorsqu'il est administré à une femme enceinte (voir la rubrique «Grossesse, Allaitement»).
Affections de la peau et du tissu sous-cutané
Nerlynx est associé à des affections de la peau et du tissu sous-cutané. Les patients présentant des symptômes d'affections de la peau et du tissu sous-cutané doivent faire l'objet d'une surveillance étroite (voir la rubrique «Effets indésirables»).
Traitement concomitant par inhibiteurs du CYP3A4 et de la Pgp
Les traitements concomitants par des inhibiteurs puissants ou modérés du CYP3A4 et de la Pgp ne sont pas recommandés en raison du risque d'exposition accrue au nératinib. Si l'inhibiteur ne peut être évité, il convient d'ajuster la dose de Nerlynx (voir les rubriques «Posologie/Mode d'emploi», «Mises en garde et précautions» et «Interactions»).
La consommation de jus de pamplemousse et de grenade doit être évitée au cours du traitement par Nerlynx (voir les rubriques «Mises en garde et précautions» et «Interactions»).
Traitement concomitant par des inducteurs modérés du CYP3A4 et de la Pgp
Le traitement concomitant avec des inducteurs modérés du CYP3A4 et de la Pgp n'est pas recommandé, car ils pourraient induire une perte d'efficacité du nératinib (voir les rubriques «Interactions» et «Pharmacocinétique»).
Traitement concomitant avec des substrats de la Pgp
Les patients recevant un traitement concomitant avec des principes actifs présentant une marge thérapeutique étroite et dont l'absorption implique des transporteurs de la Pgp dans les voies gastro-intestinales doivent faire l'objet d'une surveillance étroite (voir les rubriques «Interactions» et «Pharmacocinétique»).
InteractionsEffet de Nerlynx sur d'autres médicaments
Contraceptifs hormonaux
On ne sait pas actuellement si Nerlynx réduit l'efficacité des contraceptifs hormonaux systémiques. Par conséquent, les femmes utilisant des contraceptifs hormonaux systémiques doivent également utiliser une méthode de contraception mécanique (voir la rubrique «Grossesse, Allaitement»).
Substrats des transporteurs d'efflux glycoprotéine P
Des études in vitro ont démontré que le nératinib est un inhibiteur des transporteurs de la glycoprotéine P (Pgp). Chez les sujets sains, cette observation a été confirmée par une étude clinique utilisant la de tigoxine comme substrat de recherche et qui a mis en évidence une augmentation de 54% de la Cmax et de 32% de l'ASC lors d'une administration concomitante avec des doses multiples de 240 mg de nératinib par voie orale par rapport aux expositions de la digoxine administrée seule. Cela peut se révéler cliniquement pertinent pour les patients recevant un traitement concomitant par des principes actifs présentant une marge thérapeutique étroite et dont l'absorption implique des transporteurs de la Pgp dans les voies gastro-intestinales (digoxine, colchicine, dabigatran, phénytoïne, statines, cyclosporine, évérolimus, sirolimus, tacrolimus, par exemple). Ces patients doivent faire l'objet d'une surveillance étroite (voir la rubrique «Mises en garde et précautions»).
Substrats de la protéine de résistance au cancer du sein
Tel que suggéré par des études in vitro, le nératinib peut inhiber de manière modérée la protéine de résistance au cancer du sein (BCRP) dans l'intestin. Aucune étude clinique n'a été conduite avec des substrats de la BCRP. L'administration concomitante de nératinib avec des substrats de la BCRP pouvant conduire à une augmentation de leur exposition, les patients recevant un traitement par inhibiteurs de la BCRP (rosuvastatine, sulfasalazine et irinotécan, par exemple) doivent faire l'objet d'une surveillance étroite.
Autres transporteurs
Aucune inhibition cliniquement pertinente de l'activité du transporteur de l'efflux BSEP humain n'a été observée in vitro, avec une valeur de CI50 rapportée >10 μΜ.
Le nératinib n'a pas produit d'activité inhibitrice à l'égard des transporteurs d'absorption OATP1B1*1a, OATP1B3, OAT1, OAT3 et OCT2, avec des valeurs de CI50 rapportées >10 μM. Le nératinib a produit une activité inhibitrice à l'égard du transporteur d'absorption OCT1, avec une valeur de CI50 de 2,9 μM.
Effet du nératinib sur les substrats du CYP
Le nératinib et son métabolite M6 n'étaient pas de puissants inhibiteurs directs du CYP1A2, 2A6, 2B6, 2C8, 2C9, 2D6 ou 3A4 et aucune inhibition en fonction du temps n'est attendue.
Le nératinib n'a pas été un inducteur de CYP1A2, 2B6, 2C9 ou 3A4.
Effet d'autres médicaments sur Nerlynx
Inhibiteurs du CYP3A4/de la Pgp
L'administration concomitante d'une dose orale unique de 240 mg de nératinib en présence de kétoconazole (400 mg une fois par jour pendant 5 jours), un puissant inhibiteur du CYP3A4/de la Pgp, a augmenté l'exposition systémique au nératinib, la Cmax du nératinib étant 3,2 fois supérieure et l'ASC 4,8 fois supérieure, par rapport au nératinib administré seul.
Les prévisions en fonction de modèles suggéraient que l'administration concomitante d'une dose orale unique de 240 mg de nératinib en présence de fluconazole (200 mg une fois par jour pendant 8 jours), un inhibiteur modéré du CYP3A4, augmentait l'exposition systémique au nératinib, la Cmax étant 1,3 fois supérieure et l'ASC 1,7 fois supérieure, par rapport au nératinib administré seul.
Les prévisions en fonction de modèles suggéraient que l'administration concomitante d'une dose orale unique de 240 mg de nératinib en présence de vérapamil (120 mg deux fois par jour pendant 8 jours), un inhibiteur modéré du CYP3A4/puissant de la Pgp, augmentait l'exposition systémique au nératinib, la Cmax étant 3,0 fois supérieure et l'ASC 4,0 fois supérieure, par rapport au nératinib administré seul.
Des études cliniques et des prévisions en fonction de modèles ont démontré que l'utilisation concomitante d'inhibiteurs puissants ou modérés du CYP3A4/de la Pgp augmentait significativement l'exposition systémique au nératinib. Par conséquent, l'utilisation concomitante d'inhibiteurs puissants et modérés du CYP3A4/de la Pgp (atazanavir, indinavir [non autorisé en Suisse], néfazodone [non autorisé en Suisse], nelfinavir [non autorisé en Suisse], ritonavir, saquinavir, lopinavir, kétoconazole [non autorisé en Suisse], itraconazole, clarithromycine, troléandomycine, telithromycine [non autorisé en Suisse], voriconazole ou cobicistat, par exemple; inhibiteurs modérés: ciprofloxacine, cyclosporine, diltiazem, fluconazole, érythromycine, fluvoxamine et verapamil, par exemple) n'est pas recommandée. Si l'inhibiteur ne peut être évité, il convient d'ajuster la dose de Nerlynx.
Le pamplemousse et la grenade ou le jus de pamplemousse/grenade peuvent également augmenter les concentrations plasmatiques de nératinib et doivent par conséquent être évités (voir les rubriques «Posologie/Mode d'emploi» et «Mises en garde et précautions»).
Inhibiteurs de la pompe à protons, antagonistes des récepteurs H2 et antiacides
La solubilité in vitro du nératinib est dépendante du pH.
L'administration concomitante de lansoprazole ou de ranitidine (1 x 300 mg) avec une dose unique de 240 mg de nératinib chez des volontaires sains a conduit à une diminution de l'exposition au nératinib d'environ 70% et 50%, respectivement. L'importance de l'interaction de la ranitidine sur l'ASC du nératinib a été réduite d'environ 25% par fractionnement de la dose de ranitidine administrée (2 x 150 mg) 2 heures après l'administration de nératinib.
Les traitements concomitants avec des substances qui augmentent le pH gastrique ne sont pas recommandés étant donné qu'ils peuvent diminuer l'absorption du nératinib et par conséquent l'exposition systémique. L'administration concomitante avec des inhibiteurs de la pompe à protons (IPP) (oméprazole ou lansoprazole par exemple) n'est pas recommandée.
Nerlynx doit être pris au moins 2 heures avant ou 10 heures après la prise des antagonistes des récepteurs H2. Il convient d'espacer d'au moins trois heures l'administration de Nerlynx et celle d'antiacides (voir la rubrique «Mises en garde et précautions»).
Lopéramide antidiarrhéique
Des études cliniques ont démontré qu'il n'y avait pas de différence cliniquement significative d'exposition des sujets au nératinib, qu'il soit administré en concomitance ou non avec le lopéramide (voir la rubrique «Pharmacocinétique»).
Inducteurs du CYP3A4/de la Pgp
Après l'administration concomitante de 240 mg de nératinib avec des doses répétées de 600 mg de rifampicine, un puissant inducteur du CYP3A4/de la Pgp, les expositions au nératinib avaient significativement diminué de 76% et 87% pour la Cmax et l'ASC, respectivement, par rapport au nératinib administré seul.
Cette étude clinique a démontré que l'utilisation concomitante d'inducteurs puissants du CYP3A4/de la Pgp diminuait significativement l'exposition au nératinib. Par conséquent, l'utilisation concomitante de nératinib avec de puissants inducteurs du CYP3A4/de la Pgp (phénytoïne, carbamazépine, rifampicine ou préparations à base de plantes contenant du millepertuis [Hypericum perforatum], par exemple) est contre-indiquée. L'utilisation concomitante de nératinib avec des inducteurs modérés du CYP3A4/de la Pgp n'est pas recommandée, car elle peut également induire une perte d'efficacité du nératinib (inducteurs modérés: bosentan, éfavirenz, étravirine, phénobarbital, primidone, dexaméthasone, par exemple) (voir la rubrique «Contre-indications»).
Effet d'autres traitements sur le nératinib
Aucune interaction médicamenteuse cliniquement pertinente apparente n'a été observée pour le nératinib lorsqu'il était administré en concomitance avec la capécitabine, le paclitaxel, le trastuzumab, la vinorelbine ou des antidiarrhéiques (lopéramide) (voir la rubrique «Interactions»).
Grossesse, allaitementFemmes en âge de procréer/contraception chez les femmes et les hommes
Au vu des résultats chez l'animal, le nératinib peut être nocif pour le fœtus lorsqu'il est administré à une femme enceinte. Les femmes doivent éviter de tomber enceintes pendant la prise de Nerlynx et jusqu'à un mois après la fin du traitement. Par conséquent, les femmes en âge de procréer doivent utiliser des méthodes de contraception hautement efficaces pendant la prise de Nerlynx et pendant un mois après l'interruption du traitement.
On ne sait pas actuellement si le nératinib peut réduire l'efficacité des contraceptifs hormonaux systémiques; par conséquent, les femmes utilisant des contraceptifs hormonaux systémiques doivent également utiliser une méthode de contraception mécanique.
Les hommes doivent utiliser une méthode de contraception mécanique pendant le traitement et pendant trois mois après l'interruption de celui-ci.
Grossesse
Il n'existe pas de données suffisantes concernant l'emploi chez la femme enceinte.
Les études chez l'animal ont démontré une mortalité embryo-fœtale et des malformations morphologiques fœtales (voir la rubrique «Données précliniques»).
Le risque potentiel pour l'être humain n'est pas connu.
Le médicament ne doit pas être administré pendant la grossesse, sauf si la condition clinique de la femme concernée rend nécessaire un traitement par nératinib.
Si le nératinib est utilisé en cours de grossesse ou si la patiente tombe enceinte pendant la prise de Nerlynx, il conviendra d'informer la patiente du risque potentiel pour le fœtus.
Allaitement
On ne sait pas si le nératinib est excrété dans le lait maternel. Un risque pour les nourrissons allaités ne peut être exclu. Une décision doit être prise soit d'interrompre l'allaitement, soit d'interrompre Nerlynx, en tenant compte de l'importance de Nerlynx pour la mère et du bénéfice de l'allaitement pour l'enfant.
Fertilité
Aucune étude de fertilité n'a été réalisée chez la femme ou chez l'homme. Aucune modification significative des paramètres de fertilité chez les rats n'a été détectée. Chez le chien, il y avait une incidence accrue des hypoplasies testiculaires (voir la rubrique «Données précliniques»).
Effet sur l’aptitude à la conduite et l’utilisation de machinesNerlynx a une influence mineure ou modérée sur l'aptitude à la conduite ou l'utilisation de machines.
Une fatigue, des vertiges, une déshydratation et une syncope sont des effets indésirables ayant été rapportés avec le traitement par nératinib. L'état clinique du patient doit être pris en compte lors de l'évaluation de l'aptitude du patient à réaliser des tâches nécessitant des capacités de jugement, motrices ou cognitives.
Effets indésirablesRésumé du profil de sécurité
Les effets indésirables les plus fréquents, tous grades confondus, étaient les suivants: diarrhée (93,6%), nausée (42,5%), fatigue (27,3%), vomissements (26,8%), douleurs abdominales (22,7%), éruption cutanée (15,4%), perte d'appétit (13,7%), douleurs abdominales supérieures (13,2%), stomatite (11,2%) et spasmes musculaires (10,0%).
Les effets indésirables de grade 3 à 4 les plus fréquents étaient les suivants: diarrhée (grade 3, 36,9% et grade 4, 0,2%) et vomissements (grade 3, 3,4% et grade 4, 0,1%).
Les effets indésirables rapportés comme graves comprenaient les suivants: diarrhée (1,9%), vomissements (1,3%), déshydratation (1,1%), nausée (0,5%), augmentation de l'alanine aminotransférase (0,4%), augmentation de l'aspartate aminotransférase (0,4%), douleurs abdominales (0,3%), fatigue (0,3%) et perte d'appétit (0,2%).
Tableau récapitulatif des effets indésirables
Le tableau 5 énumère les effets indésirables observés pour le nératinib à partir de l'évaluation des données regroupées de 1 710 patients.
La base de données MedDRA des classes de systèmes d'organes et la convention MedDRA en matière de fréquence ont été utilisées pour le classement de la fréquence:
Très fréquents (≥1/10),
Fréquents (≥1/100, <1/10),
Occasionnels (≥1/1 000, <1/100),
Rares (≥1/10 000, <1/1 000),
Très rares (<1/10 000).
Fréquence inconnue (ne peut être estimée sur la base des données disponibles)
Les effets indésirables sont classés par ordre de gravité décroissant dans chaque catégorie de fréquence.
Tableau 5: Effets indésirables dus à l'administration en monothérapie de Nerlynx dans le cadre d'études portant sur le cancer du sein
|
Classe de système d'organes
|
Fréquence
|
Effet indésirable
| |
Infections et infestations
|
Fréquents
|
Infection des voies urinaires
| |
Troubles du métabolisme et de la nutrition
|
Très fréquents
|
Perte d'appétit
| |
Fréquents
|
Déshydratation
| |
Affections du système nerveux
|
Fréquents
|
Syncope
| |
Affections respiratoires, thoraciques et médiastinales
|
Fréquents
|
Épistaxis
| |
Affections gastro-intestinales
|
Très fréquents
|
Diarrhée, vomissements, nausée, douleurs abdominales, douleurs abdominales supérieures et stomatite1
| |
Fréquents
|
Distension abdominale, bouche sèche et dyspepsie
| |
Affections hépatobiliaires
|
Fréquents
|
Augmentation de l'alanine aminotransférase et augmentation de l'aspartate aminotransférase
| |
Occasionnels
|
Augmentation de la bilirubinémie
| |
Affections de la peau et du tissu sous-cutané
|
Très fréquents
|
Éruption cutanée2
| |
Fréquents
|
Troubles unguéaux3, fissures cutanées et sécheresse cutanée
| |
Affections musculo-squelettiques et du tissu conjonctif
|
Très fréquents
|
Spasmes musculaires
| |
Affections du rein et des voies urinaires
|
Fréquents
|
Augmentation de la créatininémie
| |
Occasionnels
|
Insuffisance rénale
| |
Troubles généraux et anomalies au site d'administration
|
Très fréquents
|
Fatigue
| |
Investigations
|
Fréquents
|
Perte de poids
| |
1
Inclut stomatite, stomatite aphteuse, ulcération buccale, vésicule sur la muqueuse buccale et inflammation des muqueuses.
2 Inclut éruption cutanée, éruption cutanée érythémateuse, éruption cutanée folliculaire, éruption cutanée généralisée, éruption cutanée prurigineuse et éruption cutanée pustuleuse.
3 Inclut trouble unguéal, périonyxis, onychoclasie et décoloration des ongles.
|
Description de certains effets indésirables
Diarrhée
Parmi les 1 660 patients traités par Nerlynx en monothérapie sans administration prophylactique de lopéramide, 94,6% ont connu au moins un épisode de diarrhée. Une diarrhée de grade 3 a été rapportée chez 37,5% des patients sous Nerlynx. 0,2% des patients ont présenté une diarrhée de grade 4. La diarrhée a conduit à une hospitalisation chez 1,9% des patients traités par Nerlynx.
La diarrhée survenait généralement au cours du premier mois avec 83,6% des patients ayant rapporté cette toxicité pendant la première semaine, 46,9% pendant la deuxième, 40,2% pendant la troisième et 43,2% pendant la quatrième (le délai médian de première survenue était de deux jours).
La durée médiane d'un épisode unique de diarrhée, tous grades confondus, était de deux jours. La durée cumulée médiane de la diarrhée, tous grades confondus, était de 59 jours et la durée cumulée médiane de la diarrhée de grade 3 était de cinq jours.
La diarrhée était également l'effet indésirable le plus fréquent entraînant une interruption du traitement; le traitement a été interrompu pour cause de diarrhée chez 14,4% des patients traités par Nerlynx sans administration prophylactique de lopéramide. 24,7% des patients traités par Nerlynx ont connu des réductions posologiques.
Éruption cutanée
Dans le groupe recevant Nerlynx en monothérapie, 16,7% des patients ont présenté une éruption cutanée. L'incidence des éruptions cutanées de grade 1 et de grade 2 était respectivement de 13,3 et de 2,9%; 0,4% des patients traités par Nerlynx ont présenté une éruption cutanée de grade 3.
Troubles unguéaux
Dans le groupe recevant Nerlynx en monothérapie, 7,8% des patients ont présenté des troubles unguéaux. L'incidence des troubles unguéaux de grade 1 et de grade 2 était respectivement de 6,2 et de 1,4%. 0,2% des patients traités par Nerlynx ont présenté un trouble unguéal de grade 3.
Tant les éruptions cutanées que les troubles unguéaux ont conduit à une interruption du traitement chez 0,6% des patients traités par Nerlynx.
Hépatotoxicité
Dans le cadre de l'étude pivot de phase III ExteNET (3004), des effets indésirables hépatiques ont été rapportés plus fréquemment dans le bras Nerlynx que dans le bras placebo (12,4% contre 6,6%); ceux-ci étaient principalement dus à une augmentation de l'alanine aminotransférase (ALAT) (8,5% contre 3,2%), une augmentation de l'aspartate aminotransférase (ASAT) (7,4% contre 3,3%) et une augmentation des phosphatases alcalines sanguines (2,1% contre 1,1%). En comparant les patients traités par Nerlynx versus placebo, des effets indésirables de grade 3 ont été rapportés respectivement chez 1,6 contre 0,5%, et des effets indésirables de grade 4 chez respectivement 0,2 contre 0,1% des patients. En comparant les patients traités par Nerlynx versus placebo, une augmentation de l'ALAT de grade 3 a été rapportée chez 1,1% contre 0,2%, et une augmentation de l'ALAT de grade 4 a été rapportée respectivement chez 0,2% et 0,0% des patients. En comparant les patients traités par Nerlynx versus placebo, une augmentation de l'ASAT de grade 3 a été rapportée respectivement chez 0,5% contre 0,3%, et une augmentation de l'ASAT de grade 4 a été rapportée respectivement chez 0,2% contre 0,0% des patients. Aucun effet indésirable d'augmentation de la bilirubinémie de grade 3 ou 4 n'a été rapporté.
Autres populations particulières
Patients âgés
Dans le cadre de l'étude pivot de phase III ExteNET (3004), la moyenne d'âge était de 52 ans dans le bras Nerlynx; 1 236 patients étaient âgés de moins de 65 ans, et 172 avaient 65 ans ou plus dont 25 patients d'au moins 75 ans.
La fréquence des interruptions de traitement dues à des effets indésirables a été supérieure dans le groupe d'âge des plus de 65 ans comparée à celle du groupe des moins de 65 ans; dans le bras Nerlynx, le pourcentage de ces interruptions s'élevait respectivement à 44,8 et 25,2%.
L'incidence des effets indésirables graves dans le bras Nerlynx contre le bras placebo était de 7,0% contre 5,7% pour les patients de moins de 65 ans, et de 9,9% contre 8,1% pour ceux ayant 65 ans ou plus. Les effets indésirables les plus fréquemment rapportés dans le groupe de patients âgés de 65 ans ou plus étaient les suivants: vomissements (2,3%), diarrhée (1,7%), déshydratation (1,2%) et insuffisance rénale (1,2%).
Les effets indésirables apparus sous traitement conduisant à une hospitalisation étaient de 6,3% dans le bras Nerlynx contre 4,9% dans le bras placebo dans le groupe de patients âgés de moins de 65 ans, et de 8,7 et 8,1% respectivement dans celui des patients âgés de 65 ans ou plus.
Groupes ethniques
Dans le cadre de l'étude pivot de phase III ExteNET (3004), la fréquence des événements indésirables émergents liés au traitement dans la classe de systèmes d'organes (CSO) «Affections de la peau et du tissu sous-cutané» chez les patients asiatiques traités par Nerlynx était supérieure à celle observée chez les patients caucasiens (56,4% contre 34,5%), alors qu'elle était comparable chez les patients sous placebo (24,9% contre 22,8%). Les données de sécurité regroupées de 1 710 patients traités par Nerlynx en monothérapie indiquaient une incidence supérieure des toxicités dermatologiques chez les patients asiatiques (57,1%) par rapport aux patients caucasiens (34,6%).
D'après l'analyse des données de sécurité groupées, la majorité des événements indésirables apparus sous traitement dans la CSO «Affections de la peau et du tissu sous-cutané» chez les patients asiatiques étaient de grade 1 (43,3%) et de grade 2 (12,3%); chez les patients caucasiens, l'incidence des effets de grade 1 et de grade 2 était respectivement de 25,6% et de 7,8%. La fréquence des effets de grade 3 était similaire entre les patients asiatiques et les patients caucasiens (1,6% contre 1,0%). Aucune différence de fréquence n'a été observée entre les sous-groupes asiatique et caucasien en ce qui concerne les effets indésirables graves dans la CSO «Affections de la peau et du tissu sous-cutané». Les événements indésirables les plus fréquents apparus sous traitement dans la CSO «Affections de la peau et du tissu sous-cutané» et qui sont survenus plus fréquemment chez les patients asiatiques que chez les patients caucasiens étaient les suivants: éruption cutanée (29,4% contre 13,5%), syndrome d'érythrodysesthésie palmo-plantaire (9,9% contre 1,0%) et dermatite acnéiforme (6,0% contre 1,0%).
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageEn cas de surdosage, il convient d'interrompre l'administration du médicament et de mettre en place des soins de support.
Signes et symptômes
Dans le cadre d'études cliniques, les effets indésirables associés au surdosage les plus fréquents étaient les suivants: diarrhée, avec ou sans nausée, vomissements et déshydratation.
Dans le cadre d'une étude d'escalade de dose réalisée auprès de volontaires sains, des doses uniques allant jusqu'à 800 mg de Nerlynx ont été administrées par voie orale. La fréquence et la sévérité des affections gastro-intestinales (diarrhée, douleurs abdominales, nausée et vomissements) se sont révélées dépendantes des doses. Il n'a pas été administré de doses uniques de Nerlynx supérieures à 800 mg dans le cadre d'études cliniques.
Traitement
Il n'existe pas d'antidote spécifique, et les bénéfices de l'hémodialyse dans le traitement du surdosage à Nerlynx ne sont pas connus.
Propriétés/EffetsCode ATC
L01EH02
Mécanisme d'action
Le nératinib se lie au récepteur HER2, réduit les voies de signalisation Akt, la PKAM en aval et l'autophosphorylation de l'EGFR et de HER2, et inhibe potentiellement la prolifération des cellules tumorales in vitro. Le nératinib a inhibé les lignées cellulaires de carcinomes avec expression de HER2 et/ou d'EGFR présentant une CI50<100 nM.
Pharmacodynamique
Le nératinib est un inhibiteur de tyrosine kinase (ITK) pan-HER (ErbB) irréversible homologue de l'oncogène viral de la leucémie qui bloque la transduction des signaux des facteurs de croissance mitogènes par une liaison covalente à forte affinité au site de liaison de l'ATP de trois récepteurs du facteur de croissance épidermique (EGFR), à savoir l'EGFR (codé par ErbB1), HER2 (codé par ErbB2) et HER4 (codé par ErbB4) ou leurs hétérodimères actifs avec HER3 (codé par ErbB3). Cela donne lieu à une inhibition durable de ces voies favorisant la croissance dans le cadre des cancers du sein caractérisés par une surexpression ou une amplification de HER2 ou par une mutation de HER2.
Efficacité clinique
Dans le cadre de l'étude pivot de phase III, multicentrique, randomisée, en double aveugle et contrôlée contre placebo ExteNET (3004), 2 840 femmes présentant un cancer du sein HER2 positif précoce (tel que confirmé localement par un test) qui avaient suivi un traitement adjuvant par trastuzumab et une chimiothérapiejusqu'à son terme ont été randomisées selon un rapport de 1:1 afin de recevoir soit Nerlynx soit le placebo une fois par jour pendant un an. L'âge médian au sein de la population en intention de traiter (ITT) était de 52 ans (59,9% des patients étaient âgés de 50 ans ou plus, 12,3% de 65 ans ou plus); 81,0% des patients étaient caucasiens, 2,6% étaient noirs ou afro-américains, 13,6% étaient asiatiques et 2,9% n'appartenaient à aucune de ces catégories. Lors de l'entrée dans l'étude, 57,4% des patients avaient des récepteurs hormonaux positifs (définis comme des récepteurs à l'œstrogène [ER] positifs et/ou des récepteurs à la progestérone [PgR] positifs), 23,6% ne présentaient pas d'envahissement ganglionnaire, 46,8% présentaient un à trois ganglions envahis et 29,6% présentaient au moins quatre ganglions envahis. Environ 10% des patients présentaient des tumeurs de stade I, environ 40% des tumeurs de stade II et environ 30% des tumeurs de stade III. Le délai médian entre le dernier traitement adjuvant par trastuzumab et la randomisation était de 4,5 mois.
Le critère principal d'évaluation de l'efficacité de l'étude était la survie sans maladie invasive (invasive disease-free survival, iDFS). Les critères secondaires d'évaluation de l'efficacité de l'étude comprenaient la survie sans maladie (disease-free survival, DFS), y compris la survie sans carcinome canalaire in situ (DFS-DCIS), le délai de survenue d'une récidive distante (time to distant recurrence, TTDR), la survie sans maladie à distance (SSMD), l'incidence cumulée d'une rechute du système nerveux central et la survie globale (overall survival, OS).
L'analyse primaire de l'étude réalisée deux ans après la randomisation a démontré que Nerlynx avait permis de réduire le risque de récurrence de maladie invasive ou de décès de 34% (RR = 0,66 avec IC à 95% [0,49; 0,90], valeur du p bilatéral = 0,008) au sein de la population ITT.
Tableau 6: Analyses primaires d'efficacité - population ITT et population à récepteurs hormonaux positifs HER2 ayant terminé un traitement adjuvant préalable à base de trastuzumab et de chimiothérapie depuis moins d'un an
|
Variable
|
Taux estimés de survie sans événement à 2 ans1 (en %)
|
Risque relatif
(IC à 95%)2
|
Valeur du p3
| |
|
Population ITT
| |
|
Nerlynx
(N = 1 420)
|
Placebo
(N = 1 420)
|
|
| |
Survie sans maladie invasive
|
94,2
|
91,9
|
0,66
(0,49; 0,90)
|
0,008
| |
Survie sans maladie, y compris la survie sans carcinome canalaire in situ
|
94,2
|
91,3
|
0,61
(0,45; 0,83)
|
0,001
| |
Survie sans maladie à distance
|
95,3
|
94,0
|
0,74
(0,52; 1,05)
|
0,094
| |
Délai de survenue d'une récidive distante
|
95,5
|
94,2
|
0,73
(0,51; 1,04)
|
0,087
| |
Rechute du SNC
|
0,92
|
1,16
|
–
|
0,548
| |
|
Population à récepteurs hormonaux positifs ayant terminé un traitement à base de trastuzumab depuis moins d'un an
| |
|
Nerlynx
(N = 670)
|
Placebo
(N = 664)
|
Risque relatif
(IC à 95%)4
|
Valeur du p5
| |
Survie sans maladie invasive
|
95,3
|
90,8
|
0,49
(0,30; 0,78)
|
0,002
| |
Survie sans maladie, y compris la survie sans carcinome canalaire in situ
|
95,3
|
90,0
|
0,45
(0,28; 0,71)
|
<0,001
| |
Survie sans maladie à distance
|
96,1
|
92,9
|
0,53
(0,31; 0,88)
|
0,015
| |
Délai de survenue d'une récidive distante
|
96,3
|
93,3
|
0,53
(0,30; 0,89)
|
0,017
| |
Rechute du SNC
|
0,34
|
1,01
|
–
|
0,187
|
SNC = système nerveux central.
1 Taux de survie sans événement pour tous les critères d'évaluation, sauf pour la rechute du SNC pour laquelle une incidence cumulée est rapportée.
2 Modèle de risques proportionnels de Cox stratifié
3 Test de log-rank bilatéral stratifié pour tous les critères d'évaluation, sauf pour la rechute du SNC pour laquelle la méthode de Gray a été utilisée.
4 Modèle de risques proportionnels de Cox non stratifié
5 Test de log-rank bilatéral non stratifié pour tous les critères d'évaluation, sauf pour la rechute du SNC pour laquelle la méthode de Gray a été utilisée.
Figure 1: Courbe de Kaplan-Meier de la survie sans maladie - population à récepteurs hormonaux positifs et ayant terminé un traitement adjuvant préalable à base de trastuzumab et de chimiothérapie depuis moins d'un an
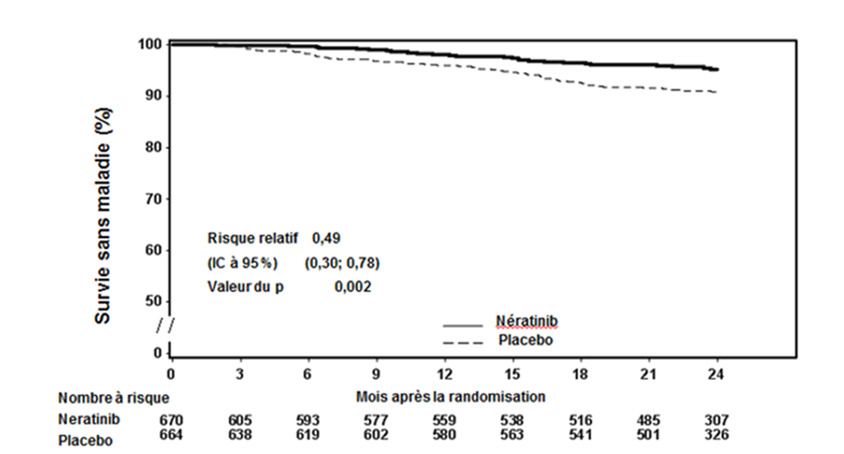
Environ 75% des patients ont fourni un nouveau consentement pour participer à un suivi s'étendant au-delà de 24 mois. Les observations comportant des données manquantes ont été censurées à la date de la dernière évaluation. Si le bénéfice du traitement par Nerlynx par rapport au placebo s'est poursuivi sur cinq ans, il n'est pas possible d'estimer de manière fiable l'ampleur de l'effet.
Chez les patients à récepteurs hormonaux négatifs, indépendamment du temps écoulé depuis le traitement par trastuzumab, le risque relatif d'IDFS à 2 ans était de 0,93, avec un IC à 95% (0,60; 1,43). L'efficacité n'a pas été démontrée pour cette population.
Seuls les patients avec un traitement préalable par trastuzumab et chimiothérapie ont été inclus dans l'étude pivot 3004.
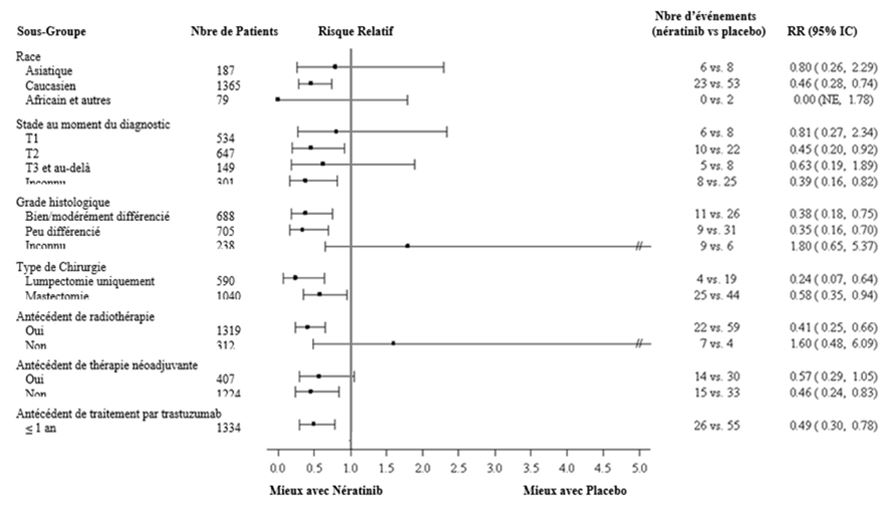
En ce qui concerne les patients à récepteurs hormonaux positifs, le bénéfice relatif de Nerlynx au sein des sous-groupes de patients prédéfinis est présenté à la figure 2.
Sur les graphiques ci-dessous le risque absolu de récidive doit être pris en compte pour décider le rapport risque/bénéfice et donc l'utilité d'un traitement par Nerlynx dans chaque sous-groupe de patients. Dans ces analyses par sous-groupes de patients, il convient de retenir le nombre d'évènements de récidive dans chaque sous-groupe de patients et non seulement la réduction relative du risque de récidive pour estimer le bénéfice que peuvent obtenir les patients par un traitement par Nerlynx.
Figure 2: Patients à récepteurs hormonaux positifs, survie sans maladie par sous-groupe de patients
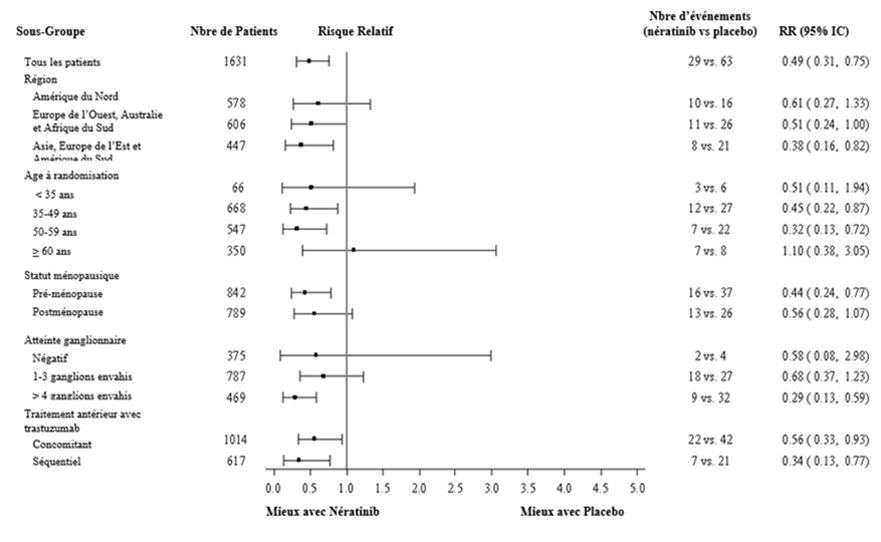
Figure 3: Patients à récepteurs hormonaux positifs, survie sans maladie par sous-groupe de patients (sous-groupes additionnels)
Aucune différence statistiquement significative de la survie globale n'a été observée entre les bras Nerlynx et placebo (RR 0,96 [IC à 95%: 0,75; 1,22]) dans la population ITT, à un suivi médian de 8,06 années.
Une tendance favorable au bras Nerlynx a été observée dans la population à récepteurs hormonaux positifs ayant terminé leur traitement à base de trastuzumab depuis moins d'un an (RR 0,79 [IC à 95%, 0,55; 1,13]).
PharmacocinétiqueAbsorption
Après l'administration par voie orale de 240 mg de nératinib, l'absorption était lente et les concentrations plasmatiques maximales de nératinib sont survenues environ sept heures après l'administration. Une dose unique de 240 mg de nératinib prise avec un repas donnait lieu à une augmentation de la Cmax et de l'ASC d'environ 17 et 13%, respectivement, par rapport à l'administration à jeun. Une dose unique de 240 mg de nératinib pris par voie orale avec un repas riche en graisses donnait lieu à une augmentation d'environ 100% tant de la Cmax que de l'ASC. Dans une étude de bilan de masse, la récupération totale (excrétion fécale et urinaire) du nératinib intact et de ses métabolites démontre que la fraction absorbée du nératinib est d'au moins 10% et probablement de plus de 20%. En outre, les prévisions en fonction de modèles suggéraient une fraction absorbée globale de 26% dans l'intestin.
La solubilité in vitro du nératinib est dépendante du pH. Les traitements qui augmentent le pH gastro-intestinal peuvent diminuer l'absorption du nératinib et par conséquent l'exposition systémique.
Distribution
La liaison du nératinib aux protéines plasmatiques humaines, y compris la liaison covalente à l'albumine sérique humaine (ASH), était supérieure à 98% et indépendante de la concentration. Le nératinib se liait principalement à l'ASH et à l'alpha-1 glycoprotéine acide humaine (α1GPA). Les études in vitro ont démontré que le nératinib est un substrat de la glycoprotéine P (Pgp). La liaison du principal métabolite M6 aux protéines plasmatiques humaines était supérieure à 99%, indépendante des concentrations de M6 testées. Les études in vitro ont démontré que le nératinib est un substrat de la glycoprotéine P (Pgp) et de la BCRP. Les études in vitro ont démontré que le nératinib et son principal métabolite M6 ne sont pas des substrats des transporteurs d'influx hépatiques OATP1B1*1a et OATP1B3, aux concentrations cliniques pertinentes.
Métabolisme
Le nératinib est principalement métabolisé par le CYP3A4 et, dans une moindre mesure, par la monooxygénase contenant de la flavine (FMO).
Le profilage préliminaire des métabolites dans le plasma humain indique qu'après une administration orale, le nératinib subit un métabolisme oxydatif via le CYP3A4. Les métabolites du nératinib en circulation comprennent les métabolites suivants: nératinib pyridine Noxide (M3), nératinib Ndiméthyl (M6), nératinib diméthylamine Noxide (M7) et traces d'hydroxyle nératinib Noxide et de nératinib bis-Noxide (M11). Le nératinib constitue le composant le plus présent dans le plasma chez les sujets sains et aucun des métabolites en circulation (M3, M6, M7 et M11) n'est supérieur à 8% de l'exposition totale au nératinib plus métabolites après l'administration orale de nératinib. Il est ressorti que les métabolites du nératinib M3, M6, M7 et M11 ainsi que le nératinib présentaient des puissances similaires dans le cadre de tests sur les enzymes menés in vitro (essais de liaison) et de tests basés sur les cellules exprimant ErbB1, ErbB2 (HER2) et ErbB4.
Sur la base des expositions à l'état d'équilibre (ASC), le nératinib offre la majorité de l'activité pharmacologique (73%), 20% étant assurée par l'exposition au métabolite M6, 6% par celle au métabolite M3 et la contribution de M7 et de M11 étant négligeable (<1%).
Élimination
Après l'administration de doses uniques de nératinib, la demi-vie plasmatique apparente moyenne du nératinib était de 17 heures chez les patients.
L'excrétion du nératinib s'effectue principalement par les selles.
Après l'administration d'une dose radiomarquée unique de 240 mg de solution orale de nératinib, 95,5% de la dose administrée a été retrouvée dans les selles et 0,96% dans les urines. L'excrétion était rapide et totale, la plupart de la dose étant retrouvée dans les selles après 48 heures et 96,5% de la radioactivité totale étant retrouvée dans les excrétas après 8 jours.
La forme la plus abondante dans les excrétas était le nératinib inchangé, représentant 62,1% de la dose totale qui y était retrouvée. Les métabolites les plus abondants dans les selles étaient le métabolite M6 (19,7% de la dose administrée), suivi par les métabolites M2, M3 et M7, tous inférieurs à 10% de la dose administrée.
Troubles de la fonction hépatique
Le nératinib est métabolisé essentiellement par le foie. Chez les patients présentant une insuffisance hépatique sévère préexistante (classe C de Child-Pugh) sans cancer, la clairance du nératinib était de 36% inférieure et l'exposition au nératinib était environ trois fois supérieure à celles des volontaires sains.
Troubles de la fonction rénale
Aucune étude pharmacocinétique n'a été réalisée auprès de patients présentant une insuffisance rénale ou sous dialyse. Selon la modélisation pharmacocinétique de population, la clairance de la créatinine n'expliquait pas la variabilité entre les patients; par conséquent, il n'est pas recommandé d'ajuster la dose pour les patients présentant une insuffisance rénale légère à modérée.
Enfants et adolescents
Aucune étude de pharmacocinétique n'a été conduite chez les enfants et les adolescents.
Données précliniquesToxicité après une administration répétée
Dans les études sur la toxicité chronique chez le rat et le chien, les organes cibles étaient le tractus gastro-intestinal, le foie et la peau. Chez le chien, l'exposition plasmatique au NOAEL était inférieure à l'exposition clinique.
Mutagénicité
Le nératinib n'était ni mutagène ni clastogène dans une batterie standard d'études de génotoxicité.
Les métabolites du nératinib M3, M6, M7 et M11 étaient négatifs dans la batterie standard d'étude de génotoxicité in vitro.
Carcinogénicité
Une étude de cancérogénicité de 6 mois réalisée auprès de souris transgéniques Tg.RasH2 et les données de deux ans sur les rats n'ont pas indiqué de potentiel cancérogène du nératinib.
Toxicité sur la reproduction
Aucune modification significative des paramètres de fertilité chez les rats mâles et femelles n'a été détectée lors d'une administration allant jusqu'à 12 mg/kg/jour (exposition plasmatique 29 fois supérieure à l'exposition clinique). Dans les études sur la toxicité chronique chez le chien, une incidence accrue d'hypoplasies testiculaires a été observée à une exposition plasmatique égale à 0,8 fois l'exposition clinique.
Chez les lapins, une mortalité embryo-fœtale et des malformations morphologiques fœtales (tête bombée, dilatation des ventricules cérébraux, défaut du septum ventriculaire, déformation des fontanelles antérieures et élargissement des fontanelles antérieures et/ou postérieures, par exemple) ont été observées à des doses qui sont considérées comme cliniquement pertinentes.
Remarques particulièresIncompatibilités
Non pertinent.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Stabilité après ouverture
Le flacon doit être utilisé dans les 2 mois suivant son ouverture.
Remarques particulières concernant le stockage
Conserver à température ambiante (15-25 °C).
Conserver le flacon fermé dans son carton pour le protéger de l'humidité.
Conserver hors de portée des enfants.
Remarques concernant la manipulation
Ne pas avaler le déshydratant.
Numéro d’autorisation67293 (Swissmedic).
PrésentationFlacon de 180 comprimés pelliculés avec un bouchon de sécurité enfants et un opercule scellé. (A)
Chaque flacon de comprimés contient une capsule de déshydratant en PEHD contenant 1 g de gel de silice.
Titulaire de l’autorisationPierre Fabre Pharma AG, Basel
Mise à jour de l’informationDécembre 2024
|



