CompositionPrincipe actif
Olodaterolum (ut Olodateroli hydrochloridum).
Excipients
Chlorure de benzalkonium (0,0011 mg à chaque bouffée), édétate disodique de calcium, acide citrique, eau.
Indications/Possibilités d’emploiStriverdi Respimat est un bronchodilatateur destiné au traitement symptomatique à long terme des patients atteints de BPCO (bronchopneumopathie chronique obstructive).
Posologie/Mode d’emploiPosologie usuelle
La dose recommandée chez l'adulte est de 5 microgrammes d'olodatérol. Ceci correspond à deux bouffées au moyen de l'inhalateur Respimat une fois par jour, au même moment de la journée.
Instructions posologiques particulières
Patients présentant des troubles de la fonction hépatique
Les patients souffrant d'une altération légère à modérée de la fonction hépatique peuvent utiliser Striverdi Respimat à la dose recommandée.
Aucune donnée relative à l'utilisation de Striverdi Respimat chez les patients souffrant d'une altération importante de la fonction hépatique n'est disponible.
Patients présentant des troubles de la fonction rénale
Les patients souffrant d'une altération de la fonction rénale peuvent utiliser Striverdi Respimat à la dose recommandée.
Un mode d'emploi précis relatif à la manipulation du Respimat est joint à l'emballage.
Personnes âgées
Les patients âgés peuvent utiliser Striverdi Respimat à la dose recommandée.
Enfants et adolescents
La BPCO est une maladie qui n'affecte généralement pas les enfants. L'innocuité et l'efficacité de Striverdi Respimat n'ont pas été étudiées chez les patients pédiatriques.
Contre-indicationsL'utilisation de Striverdi Respimat est déconseillée chez les patients souffrant d'hypersensibilité à l'olodatérol ou à un autre composant de ce médicament.
Mises en garde et précautions
|
Striverdi Respimat contient du chlorure de benzalkonium, ce composant est susceptible de provoquer une respiration sifflante ainsi que des difficultés respiratoires (bronchospasmes – contractions convulsives des voies respiratoires), notamment si vous souffrez d'asthme.
|
Asthme
Striverdi Respimat ne doit pas être administré en cas d'asthme. L'efficacité à long terme et l'innocuité de l'olodatérol n'ont pas été établies chez les patients asthmatiques.
Bronchospasme aigu
Striverdi Respimat n'est pas indiqué pour le traitement des épisodes aigus de bronchospasme, c'est-à-dire en traitement de secours.
Hypersensibilité
Comme tous les médicaments, des réactions d'hypersensibilité immédiate peuvent apparaître après l'utilisation de Striverdi Respimat.
Bronchospasme paradoxal
A l'instar d'autres traitements en inhalation, Striverdi Respimat peut déclencher un bronchospasme paradoxal susceptible de mettre en danger la vie du patient. Si un tel bronchospasme se produit, il convient de mettre fin immédiatement au traitement par Striverdi Respimat et de le remplacer par un autre traitement.
Actions systémiques
Les bêta2-agonistes à longue durée d'action doivent être administrés avec prudence aux patients atteints d'affections cardiovasculaires. Ceci s'applique en particulier aux patients souffrant d'insuffisance coronarienne, d'arythmie cardiaque, de myocardiopathie obstructive hypertrophique et d'hypertension, aux patients atteints de troubles convulsifs ou de thyrotoxicose, aux patients chez qui un allongement de l'intervalle QT est connu ou soupçonné et aux patients qui répondent de manière particulièrement marquée aux amines sympathomimétiques.
Les patients ayant des antécédents d'infarctus du myocarde anamnétique au cours de la dernière année, souffrant d'arythmie cardiaque instable ou menaçant la vie, ayant été hospitalisés pour une insuffisance cardiaque au cours de la dernière année ou ayant reçu un diagnostic de tachycardie paroxystique (>100 battements par minute) étaient exclus des études cliniques. Par conséquent, l'expérience chez ces groupes de patients est limitée. Striverdi Respimat doit être administré avec prudence chez ces groupes de patients.
Effets cardiovasculaires
L'olodatérol peut, comme d'autres bêta2-agonistes, provoquer chez certains patients des effets cardiovasculaires ayant une portée clinique, à savoir une augmentation de la fréquence cardiaque, une augmentation de la tension artérielle et/ou des symptômes correspondants. Ces manifestations peuvent imposer l'arrêt du traitement. En outre, on sait que les bêta-agonistes peuvent altérer le tracé de l'électrocardiogramme (ECG), p. ex., sous la forme d'un aplatissement de l'onde T et d'un sous-décalage du segment ST.
Avant de prescrire un traitement chronique à base de bêta-agonistes comme Striverdi Respimat, il convient d'examiner les patients souffrants de BPCO afin de détecter toute affection cardiovasculaire concomitante. Il convient également de réaliser un ECG portant sur l'allongement de l'intervalle QTc.
Hypokaliémie
Les bêta2-agonistes peuvent entraîner une hypokaliémie marquée chez certains patients, laquelle peut provoquer des effets cardiovasculaires indésirables. La diminution du taux de potassium sérique est généralement temporaire et ne nécessite pas l'administration de suppléments. En cas de BPCO grave, l'hypoxie et les traitements concomitants peuvent accentuer l'hypokaliémie (voir «Interactions») et, de ce fait, rendre le patient plus à risque d'arythmie cardiaque.
Hyperglycémie
L'inhalation de fortes doses de bêta2-agonistes peut provoquer une hausse de la glycémie.
Striverdi Respimat ne peut être utilisé concomitamment avec d'autres médicaments qui contiennent des bêta2-agonistes à longue durée d'action.
Les patients qui inhalent régulièrement des bêta2agonistes à longue durée d'action (4 fois par jour p. ex.) doivent être informés qu'ils ne doivent les utiliser que pour atténuer les symptômes en cas de difficulté respiratoire importante.
Faire preuve de prudence en cas de changement du traitement et de passage à une autre forme posologique et/ou un autre médicament contenant le même principe actif. Il convient de contrôler le patient de manière adéquate.
InteractionsMédicaments connus pour allonger l'intervalle QTc
L'olodatérol, tout comme les autres bêta2-agonistes, peut augmenter le risque d'arythmie ventriculaire chez les patients traités par des médicaments connus pour allonger l'intervalle QTc. De tels médicaments sont par exemple certains antihistaminiques (terfénadine, mizolastine p. ex.), certains antiarythmiques (chinidine p. ex.), la phénothiazine, l'érythromycine, le ritonavir et les antidépresseurs tricycliques. L'administration supplémentaire de sympathomimétiques peut renforcer des effets cardiovasculaires indésirables. Striverdi Respimat doit être administré avec prudence aux patients traités par des inhibiteurs de la monoamine-oxydase ou des antidépresseurs tricycliques, étant donné que l'effet des β2 stimulants sur le système cardiovasculaire peut être renforcé.
Sympathomimétiques
L'administration concomitante d'autres principes actifs adrénergiques peut potentialiser les effets indésirables de Striverdi Respimat.
Dérivés de la xanthine, stéroïdes et diurétiques
L'administration concomitante de dérivés de la xanthine, de stéroïdes ou de diurétiques non épargneurs de potassium peut potentialiser les éventuels effets hypokaliémiants des agonistes des récepteurs adrénergiques (voir «Mises en garde et précautions»).
Bêtabloquants
Les bêtabloquants peuvent affaiblir ou annuler l'effet de Striverdi Respimat. Par conséquent, Striverdi Respimat ne doit pas être administré en concomitance avec des bêtabloquants (y compris le collyre en solution), à moins que leur utilisation soit absolument nécessaire. Dans ce contexte, les bêtabloquants cardiosélectifs pourraient être envisagés, bien qu'ils doivent être administrés avec prudence.
Inhibiteurs de la monoamine-oxydase, antidépresseurs tricycliques, médicaments allongeant l'intervalle QTc
Les inhibiteurs de la monoamine-oxydase, les antidépresseurs tricycliques ou les autres substances connues pour allonger l'intervalle QTc renforcent les effets de Striverdi Respimat sur le système cardiovasculaire.
Interactions pharmacocinétiques
Dans une étude sur les interactions médicamenteuses utilisant le kétoconazole, un puissant inhibiteur à la fois du CYP et de la glycoprotéine P (P-gp), une augmentation de l'exposition systémique à l'olodatérol de 1,7 fois a été observée (voir «Pharmacocinétique»). Aucun problème relatif à l'innocuité n'a été mis en évidence dans des études cliniques d'une durée allant jusqu'à un an sur Striverdi Respimat à des doses pouvant atteindre le double de la dose thérapeutique recommandée. Aucun ajustement posologique n'est nécessaire.
Interactions en cas d'utilisation d'autres préparations administrées par voie inhalée
L'administration de Striverdi Respimat entraîne une bronchodilatation chez les patients souffrant de BPCO et peut ainsi accroître l'absorption pulmonaire et la disponibilité systémique d'une substance inhalée consécutivement. En raison de cet effet potentiel, l'administration concomitante d'autres substances par voie inhalée doit être considérée avec prudence et il convient de choisir précisément la dose efficace la plus faible.
Grossesse/AllaitementGrossesse
Il n'existe aucune donnée clinique sur l'exposition à Striverdi Respimat pendant la grossesse.
Les données précliniques ont révélé des effets typiques des bêta-agonistes à des multiples élevés des doses thérapeutiques (voir «Données précliniques»).
Striverdi Respimat ne doit pas être administré pendant la grossesse, à moins que son utilisation soit absolument nécessaire.
Il convient de prendre en compte l'effet inhibiteur des contractions de l'utérus des bêta-agonistes.
Allaitement
Il n'existe aucune donnée clinique sur l'exposition à l'olodatérol pendant l'allaitement.
Le principe actif et/ou ses métabolites ont été détectés dans le lait de rates en lactation. On ignore toutefois si l'olodatérol passe dans le lait maternel chez l'humain. Par conséquent, l'administration chez des femmes qui allaitent n'est pas recommandée.
Effet sur l’aptitude à la conduite et l’utilisation de machinesLes effets sur la capacité de conduire un véhicule ou de faire fonctionner des machines n'ont pas été étudiés.
Toutefois, les patients doivent être avisés que des vertiges ont été rapportés au cours des études cliniques. Par conséquent, la prudence est recommandée pour les utilisateurs de véhicules ou de machines. Si les patients ressentent des vertiges, ils devraient éviter les tâches potentiellement dangereuses, telles que conduire un véhicule ou utiliser des machines.
Effets indésirablesL'innocuité de Striverdi Respimat a été étudiée dans des études cliniques contrôlées contre agent actif et contre placebo, avec groupes parallèles ou croisés portant sur 4167 patients atteints de BPCO en tout. Au total, 1927 patients souffrant de BPCO ont reçu la dose cible de 5 microgrammes d'olodatérol.
Les données disponibles sur les effets secondaires de Striverdi Respimat proviennent essentiellement de patients atteints de BPCO ayant participé à 4 études cliniques à long terme (48 semaines) contrôlées contre placebo avec groupes parallèles. Deux de ces études comportaient un groupe de contrôle contre agent actif.
Infections
Occasionnels: rhinopharyngite.
Troubles du système nerveux
Occasionnels: vertiges.
Troubles vasculaires
Fréquence indéterminée*: hypertension.
Troubles cutanés
Occasionnels: éruption cutanée.
Troubles musculosquelettiques
Rares: arthralgie.
* Fréquence indéterminée, étant donné que l'effet indésirable n'apparaît pas dans les données relatives aux études cliniques sur 1035 patients.
Effets indésirables après commercialisation
La survenue d'une éruption cutanée peut être considérée comme une réaction d'hypersensibilité à Striverdi Respimat. Comme c'est le cas pour tous les médicaments topiques qui sont résorbés, d'autres réactions d'hypersensibilité peuvent survenir.
L'olodatérol fait partie de la classe des bêta2-agonistes à longue durée d'action. Il faut par conséquent s'attendre à ce que les effets indésirables de ce médicament soient semblables aux effets indésirables typiques des médicaments de cette classe, ils comprennent entre autres: la tachycardie, l'arythmie, les palpitations, l'ischémie myocardique, l'angine de poitrine, l'hypertension ou l'hypotension, les tremblements, les céphalées, la nervosité, l'insomnie, les vertiges, la sécheresse buccale, les nausées, les spasmes musculaires, la fatigue, les malaises, l'hypokaliémie, l'hyperglycémie et l'acidose métabolique.
Description de certains effets indésirables
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageSignes et symptômes
Une surdose d'olodatérol risque d'amplifier les effets typiques des bêta2-agonistes: ischémie myocardique, hypertension ou hypotension, tachycardie, arythmie, palpitations, vertiges, nervosité, insomnie, anxiété, céphalées, tremblements, sécheresse buccale, spasmes musculaires, nausées, fatigue, malaises, hypokaliémie, hyperglycémie et acidose métabolique.
Traitement
Le traitement par Striverdi Respimat doit être arrêté, un traitement supportif et symptomatique doit être instauré. Les cas graves nécessitent une hospitalisation. Le recours à un bêtabloquant cardiosélectif peut être envisagé, mais seulement avec une extrême prudence, étant donné que les bêtabloquants peuvent déclencher un bronchospasme.
Propriétés/EffetsCode ATC
R03AC19
Mécanisme d'action/Pharmacodynamique
L'olodatérol est doté d'une forte affinité et d'une sélectivité élevée pour les récepteurs bêta2-adrénergiques humains.
Des études in vitro ont montré que l'activité agoniste de l'olodatérol aux récepteurs bêta2-adrénergiques est plus de 219 fois plus élevée qu'aux récepteurs bêta1-adrénergiques et 1622 fois plus élevée qu'aux récepteurs bêta3-adrénergiques.
La substance exerce ses effets pharmacologiques par fixation et activation des récepteurs bêta2-adrénergiques après l'administration topique par inhalation.
L'activation de ces récepteurs dans les voies respiratoires se traduit par une stimulation de l'adénylcyclase intracellulaire, une enzyme qui intervient dans la synthèse de l'AMP cyclique (adénosine monophosphate 3',5' cyclique; AMPc). Des taux élevés d'AMPc induisent une bronchodilatation par relaxation des cellules musculaires lisses des voies respiratoires.
Des études précliniques ont montré que l'olodatérol a le profil d'un bêta2-agoniste sélectif à longue durée d'action (BALA) doté d'un début d'action rapide et d'une durée d'action d'au moins 24 heures.
Les récepteurs bêta-adrénergiques se divisent en trois sous-types: les récepteurs bêta1-adrénergiques principalement exprimés sur les cellules du muscle lisse cardiaque, les récepteurs bêta2-adrénergiques principalement exprimés sur les cellules musculaires des voies respiratoires et les récepteurs bêta3-adrénergiques principalement exprimés sur les cellules du tissu adipeux. Les bêta2-agonistes provoquent une bronchodilatation. Bien que le récepteur bêta2-adrénergique soit le principal récepteur adrénergique du muscle lisse des voies respiratoires, il est également présent à la surface de divers autres types de cellules, dont les cellules épithéliales et endothéliales pulmonaires et les cellules du cœur. La fonction précise des récepteurs bêta2-adrénergiques dans le cœur est inconnue, mais leur présence laisse supposer que même les bêta2-agonistes hautement sélectifs puissent avoir des effets cardiaques.
Efficacité clinique
Effets sur l'électrophysiologie cardiaque
L'effet de l'olodatérol sur l'intervalle QT/QTc de l'ECG a été évalué chez 24 volontaires hommes et femmes sains dans une étude randomisée, contrôlée contre placebo et contre agent actif (moxifloxacine). Il a été démontré que l'intervalle QT était plus fort en moyenne de 1,6 milliseconde (avec 10 microgrammes d'olodatérol) à 6,5 millisecondes (avec 50 microgrammes d'oladotérol) par rapport à la valeur initiale et au placebo entre 20 minutes et 2 heures suivant la première administration d'une seule dose d'olodatérol (10, 20, 30 et 50 microgrammes); cet effet est dose-dépendant, la limite supérieure de l'intervalle de confiance double à 90% pour tous les dosages était inférieure à 10 millisecondes.
Dans les études de phase 3 contrôlées contre placebo, sur 48 semaines, l'effet de 5 microgrammes et de 10 microgrammes de Striverdi Respimat sur la fréquence et le rythme cardiaque a été étudié à l'aide d'un monitorage par ECG continu de 24h (monitorage Holter) dans un sous-groupe de 772 patients. Aucune tendance dans l'ampleur des variations moyennes de la fréquence cardiaque ou des extrasystoles dose-dépendante ou dépendante du temps n'a été observée. Les variations des extrasystoles entre le début et la fin du traitement n'ont révélé aucune différence significative entre l'olodatérol à 5 microgrammes, l'olodatérol à 10 microgrammes et le placebo.
Le programme de développement clinique de phase III de Striverdi Respimat était composé de huit études en double aveugle, randomisées, contrôlées contre placebo. Ces huit études étaient identiques deux par deux. Parmi les 3533 participants atteints de BPCO, 1281 ont reçu la dose de 5 microgrammes et 1284 la dose de 10 microgrammes.
Ont été réalisées:
1.Deux études de 48 semaines contrôlées contre placebo et conçues de façon identique présentant des groupes parallèles [études 1 et 2]
2.Deux études de 48 semaines contrôlées contre placebo et contre agent actif conçues de façon identique présentant des groupes parallèles avec du formotérol 12 microgrammes deux fois par jour en thérapie comparative active [études 3 et 4]
3.Deux études de 6 semaines croisées contrôlées contre placebo et contre agent actif conçues de façon identique avec du formotérol 12 microgrammes deux fois par jour en thérapie comparative active [études 5 et 6]
4.Deux études de 6 semaines croisées contrôlées contre placebo et contre agent actif conçues de façon identique avec du tiotropium HandiHaler 18 microgrammes une fois par jour en thérapie comparative active [études 7 et 8].
Dans toutes les études, la fonction pulmonaire a été mesurée (volume expiratoire maximal par seconde, VEMS). En outre, les études de 48 semaines ont pmeris de mesurer la réponse de la fonction pulmonaire en phase de pointe (ASC0-3) et en phase de creux. En revanche, les études de 6 semaines comportaient la définition continue du profil de la fonction pulmonaire avec un intervalle posologique de 24 heures. Dans les deux études identiques de 48 semaines contrôlées contre placebo et contre agent actif, l'indice de dyspnée de transition (IDT) visant à évaluer la dyspnée et le questionnaire respiratoire du St George's Hospital (SGRQ) pour l'évaluation de la qualité de vie en considérant l'état de santé, ont été utilisés.
Des patients âgés de 40 ans ou plus présentant un diagnostique clinique d'une BPCO, des antécédents médicaux de fumeur d'au moins 10 paquets-années consécutives et une limitation modérée à très grave de la fonction pulmonaire (VEMS après utilisation d'un bronchodilatateur <80% de la valeur normale [stade GOLD II-IV]; quotient VEMS/CVF après utilisation d'un bronchodilatateur <70%) ont participé au programme de développement de la phase III.
Caractéristiques des patients
Les 3104 patients recrutés pour les études internationales de 48 semaines [études 1 et 2, études 3 et 4] étaient en grande partie des hommes (77%) et d'origine européenne (66%) ou asiatique (32%) d'un âge moyen de 64 ans. La VEMS moyenne après utilisation d'un bronchodilatateur s'élevait à 1,38 litre (GOLD II [50%], GOLD III [40%], GOLD IV [10%]). L'administration d'un bêta2-agoniste a conduit en moyenne à une modification de 15% de la valeur initiale (0,160 litre). Tous les médicaments de traitement pulmonaires (p.ex. tiotropium [24%], ipratropium [25%], stéroïdes par voie inhalée [45%], xanthines [16%]) étaient autorisés en traitement adjuvant, à l'exception des autres bêta2-agonistes à longue durée d'action. L'inclusion des patients a été réalisée par stratification après l'utilisation de tiotropium. Dans les quatre études, les critères d'efficacité principaux suivants ont été considérés pour évaluer l'effet sur la fonction pulmonaire: modification du volume forcé par seconde dans une période de 0 à 3 heures (VEMS ASC0-3 h) et dans la phase de creux (avant la dose suivante), respectivement par rapport à la valeur initiale avant le début du traitement (après 12 semaines pour les études 1 et 2, après 24 semaines pour les études 3 et 4).
Les études de 6 semaines [études 5 et 6, études 7 et 8] ont été réalisées en Europe et en Amérique du Nord. Les 199 patients recrutés pour les études 5 et 6 étaient en grande partie des hommes (53%) et d'origine européenne (93%) d'un âge moyen de 63 ans. Le VEMS moyen après utilisation d'un bronchodilatateur s'élevait à 1,43 litre (GOLD II [54%], GOLD III [39%], GOLD IV [7%]). L'administration d'un bêta2-agoniste a conduit en moyenne à une modification de 17% de la valeur initiale (0,187 litre). Tous les médicaments de traitement pulmonaires (p.ex. tiotropium [24%], ipratropium [16%], stéroïdes par voie inhalée [31%], xanthines [0,5%]) étaient autorisés en traitement adjuvant, à l'exception des autres bêta2-agonistes à longue durée d'action. Le titropium devait toutefois être arrêté respectivement 48 h avant les mesures des critères d'efficacité spirométriques. Les 230 patients recrutés pour les études 7 et 8 étaient également en grande partie des hommes (69%) et d'origine européenne (99,6%) d'un âge moyen de 62 ans. Le VEMS moyen après utilisation d'un bronchodilatateur s'élevait à 1,55 litre (GOLD II [57%], GOLD III [35%], GOLD IV [7%]), la modification moyenne par l'administration d'un bêta2-agoniste atteignant 18% de la valeur initiale (0,203 litre). Tous les médicaments de traitement pulmonaires (p.ex. stéroïdes par voie inhalée [49%], xanthines [7%]) étaient autorisés en traitement adjuvant, à l'exception des autres bêta2-agonistes à longue durée d'action et des anticholinergiques.
Fonction pulmonaire
Dans les études de 48 semaines, l'administration de 5 microgrammes de Striverdi Respimat une fois par jour le matin dans les 5 minutes suivant la première dose a démontré une amélioration significative (p<0,0001) de la fonction pulmonaire (augmentation moyenne du VEMS 0,130 litre avec une valeur initiale de 1,18 litre avant le traitement). L'amélioration significative de la fonction pulmonaire s'est maintenue 24 heures (augmentation moyenne de la VEMS ASC0-3h 0,162 litre par rapport au placebo, p<0,0001; augmentation moyenne de la valeur minimale du VEMS après 24 heures 0,071 par rapport au placebo, p<0,0001); l'amélioration des valeurs de la fonction pulmonaire était évidente à la fois pour les utilisateurs et pour les non-utilisateurs du tiotropium. L'amélioration de la VEMS ASC0-3 h et de la valeur minimale du VEMS était comparable à celle obtenue avec le formotérol deux fois par jour. Les effets bronchodilatateurs de Striverdi Respimat se sont maintenus jusqu'à la fin des 48 semaines de traitement. Striverdi Respimat a également amélioré les valeurs du DEP (débit expiratoire de pointe) mesurées le matin et le soir par rapport au placebo, ce qui fut constaté grâce aux notes quotidiennes des patients.
Dans les études de 6 semaines des valeurs VEMS, les patients traités par Striverdi Respimat ont répondu plus favorablement au traitement pendant la totalité de l'intervalle posologique de 24 heures par rapport aux patients sous placebo (p<0,0001) (illustration 1, illustration 2, tableau 1).
Illustration 1: Profil VEMS sous Striverdi Respimat 5 microgrammes et sous placebo mesuré de façon continue pendant l'intégralité de l'intervalle posologique de 24 heures (études 5 et 6; données combinées; les anticholinergiques étaient autorisés en traitement adjuvant)
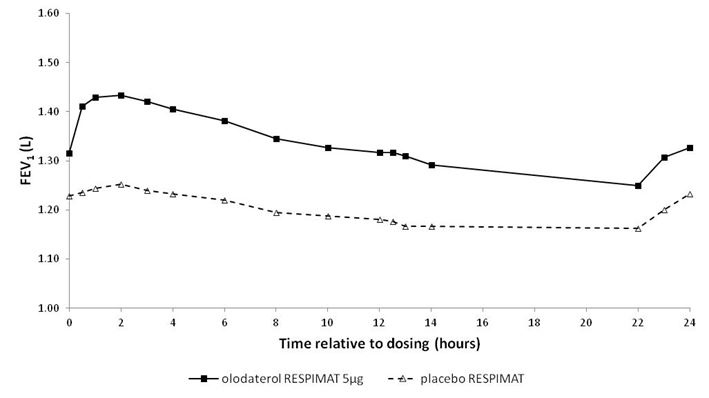
Illustration 2: Profil VEMS sous Striverdi Respimat 5 microgrammes et sous placebo mesuré de façon continue pendant l'intégralité de l'intervalle posologique de 24 heures (études 7 et 8; données combinées; les anticholinergiques n'étaient pas autorisés en traitement adjuvant)
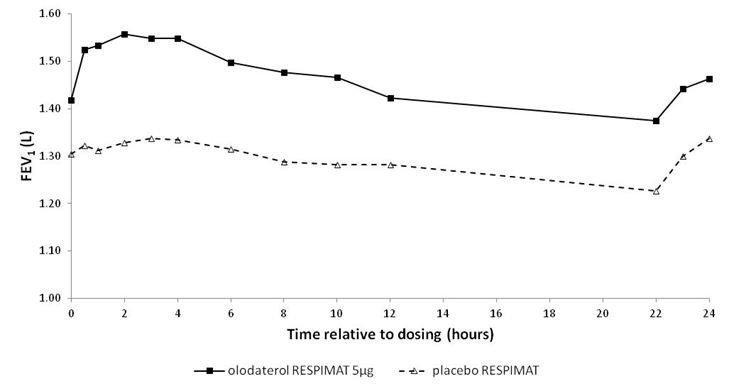
Tableau 1: Différences entre les valeurs de VEMS sous Striverdi Respimat 5 microgrammes et sous placebo mesurées de façon continue pendant l'intégralité de l'intervalle posologique de 24 heures après 6 semaines de traitement dans les études 5 et 6 (données combinées) et dans les études 7 et 8 (données combinées)
|
|
VEMS: différence vs placebo (litre)1
| |
|
Moyenne après 3 h
|
Moyenne après 12 h
|
Moyenne après 24 h
|
Valeur minimale
| |
Etudes 5 et 6
|
0,175
|
0,160
|
0,137
|
0,102
| |
Etudes 7 et 8
|
0,211
|
0,193
|
0,168
|
0,134
|
1 Valeurs initiales avant le début du traitement: VEMS = 1,26 litre (études 5 et 6) et 1,33 litre (études 7 et 8).
L'indice de dyspnée de transition (IDT) et le questionnaire respiratoire du St George's Hospital (SGRQ) ont également été utilisés dans les études de confirmation de 48 semaines contrôlées contre placebo et agent actif (études 1 et 2).
Après 24 semaines, l'analyse primaire du groupe placebo d'une étude (tableau 1) n'a démontré aucune différence significative entre Striverdi Respimat, le formotérol et le placebo en ce qui concerne la valeur de l'IDT; dans une analyse post-hoc, dans laquelle les abandons de l'étude par le patient étaient prises en compte, la différence entre Striverdi Respimat et le placebo était de p=0,027.
Tableau 2: Valeur de l'IDT après 24 semaines de traitement
|
|
|
Valeur moyenne du traitement
|
Différence par rapport au placebo
Valeur moyenne (p)
| |
Analyse primaire
|
Placebo
|
1,5 (0,2)
|
| |
|
Olodatérol 5 µg une fois par jour
|
1,9 (0,2)
|
0,3 (p=0,1704)
| |
|
Formotérol 12 μg deux fois par jour
|
1,8 (0,2)
|
0,2 (p=0,3718)
| |
Analyse post-hoc
|
Placebo
|
1,5 (0,2)
|
| |
|
Olodatérol 5 μg une fois par jour
|
2,0 (0,2)
|
0,5 (p=0,0270)
| |
|
Formotérol 12 μg deux fois par jour
|
1,8 (0,2)
|
0,4 (p=0,1166)
|
Exacerbations, qualité de vie, besoin de médicaments de secours, échelle PGR.
Dans les études identiques de 48 semaines contrôlées contre placebo et contre agent actif [études 3 et 4], les exacerbations et la qualité de vie évaluée à l'aide du questionnaire SGRQ (questionnaire respiratoire du St George's Hospital) furent considérées comme critères d'évaluation de l'efficacité secondaires.
L'olodatérol et le formotérol ont tous deux démontré des différences cohérentes par rapport au placebo en ce qui concerne la fréquence des exacerbations. Après 24 semaines, le score SGRQ total moyen des patients traités par Striverdi Respimat était significativement meilleur que celui des patients sous placebo (tableau 2); on peut observer une amélioration dans les 3 domaines SGRQ (troubles, activités, conséquences). Les patients sous Striverdi Respimat ont démontré une amélioration du score SGRQ global au-delà de la différence minimale cliniquement pertinente par rapport au placebo (MCID: 4 points) (50,2% vs 36,4%, p<0,0001).
Tableau 3: Scores globaux et scores SGRQ pour les différents domaines après un traitement de 24 semaines
|
|
|
Valeur moyenne du traitement
(modification par rapport à la valeur initiale)
|
Différence vs placebo
Valeur moyenne (p)
| |
Score total
|
Valeur initiale
|
44,4
|
| |
|
Placebo
|
41,6 (-2,8)
|
| |
|
Olodatérol 5 µg une fois par jour
|
38,8 (-5,6)
|
-2,8 (p=0,0034)
| |
|
Formotérol 12 μg deux fois par jour
|
40,4 (-4,0)
|
-1,2 (p=0,2009)
| |
Troubles
|
Placebo
|
46,0
|
| |
|
Olodatérol 5 µg une fois par jour
|
41,1
|
-4,8 (p=0,0004)
| |
|
Formotérol 12 μg deux fois par jour
|
43,7
|
-2,3 (p=0,0924)
| |
Activités
|
Placebo
|
55,3
|
| |
|
Olodatérol 5 µg une fois par jour
|
52,9
|
-2,4 (p=0,0455)
| |
|
Formotérol 12 μg deux fois par jour
|
55,0
|
-0,3 (p=0,7797)
| |
Répercussions
|
Placebo
|
32,3
|
| |
|
Olodatérol 5 µg une fois par jour
|
29,7
|
-2,6 (p=0,0157)
| |
|
Formotérol 12 μg deux fois par jour
|
30,8
|
-1,5 (p=0,1605)
|
Les patients traités par Striverdi Respimat avaient besoin de moins de salbutamol en médicament de secours aussi bien de jour que de nuit par rapport aux patients recevant le placebo.
Dans chaque étude de 48 semaines, les patients qui furent traités par Striverdi Respimat ont atteint une amélioration supérieure de leur fonction respiratoire par rapport aux patients du groupe placebo. Ceci a été mesuré grâce à l'échelle PGR (Patient's Global Rating Scale); ce résultat est un élément supplémentaire pour étayer l'effet positif sur les symptômes.
Tolérance à l'effort
L'effet de Striverdi Respimat sur la tolérance à l'effort limitée par la survenue de symptômes chez les patients atteints de BPCO a été étudié dans deux études croisées en double aveugle, identiques, randomisées, contrôlées contre placebo d'une durée de 6 semaines. Dans ces études, Striverdi Respimat a amélioré significativement la durée de tolérance à l'effort de 14,0% (p=0,0002) et de 11,8% (p=0,0018) par rapport au placebo. Striverdi Respimat a également réduit l'hyperinflation pulmonaire (capacité résiduelle fonctionnelle réduite, CRF) avec pour conséquence une augmentation de la capacité inspiratoire au repos et à l'effort par rapport au placebo.
PharmacocinétiqueLes informations disponibles sur les paramètres pharmacocinétiques de l'olodatérol ont été obtenues auprès de sujets sains, de patients atteints de BPCO et de patients asthmatiques après inhalation orale de doses égales ou supérieures à la dose thérapeutique.
L'olodatérol a affiché une pharmacocinétique linéaire et une augmentation proportionnelle à la dose de l'exposition systémique après des doses inhalées uniques de 5 à 70 microgrammes et des doses multiples de 2 à 20 microgrammes inhalées une fois par jour.
Avec l'inhalation répétée du médicament une fois par jour, les concentrations plasmatiques d'olodatérol avaient atteint l'état d'équilibre après 8 jours, et le degré d'exposition avait augmenté de 1,8 fois par rapport à une dose unique.
Absorption
L'olodatérol est rapidement résorbé sous inhalation. Les concentrations plasmatiques maximales sont généralement atteintes 10 à 20 minutes après l'inhalation du médicament. Chez des volontaires sains, la biodisponibilité absolue de l'olodatérol après inhalation a été estimée à environ 30%, tandis que la biodisponibilité absolue était inférieure à 1% lorsque le médicament était administré sous forme de solution orale. Ainsi, pour la disponibilité systémique de l'olodatérol après administration par inhalation, c'est la résorption dans les poumons qui est déterminante avant tout, alors qu'une partie de la dose probablement avalée ne contribue pas de façon significative à l'exposition systémique.
Distribution
L'olodatérol affiche une cinétique de distribution à multiples compartiments après l'inhalation ainsi qu'après l'administration par voie intraveineuse. Son volume de distribution est très élevé (1110 litres), ce qui semble indiquer une distribution importante dans les tissus. La liaison in vitro de l'olodatérol marqué au 14C avec les protéines plasmatiques humaines est indépendante de la concentration et est d'environ 60%.
Métabolisme
L'olodatérol est substantiellement métabolisé par glucoconjugaison et par O-déméthylation du groupe méthoxy suivie de conjugaison. Des six métabolites identifiés, seul le produit de déméthylation non conjugué (SOM 1522) se lie aux récepteurs bêta2; toutefois, ce métabolite n'est pas détectable dans le plasma après l'inhalation à long terme de la dose thérapeutique recommandée ou de doses jusqu'à 4 fois supérieures.
C'est pourquoi l'odolatérol est considéré comme étant seul à l'origine de l'effet pharmacologique.
Les isoenzymes du cytochrome P450 CYP2C9 et CYP2C8, et dans une très faible mesure le CYP3A4, interviennent dans l'O-déméthylation de l'olodatérol. En revanche, les isoformes de l'uridine diphospho-glycosyltransférase (UGT2B7, UGT1A1, 1A7 et 1A9) interviennent dans la formation des glucoconjugués d'olodatérol.
Elimination
La clairance totale de l'olodatérol est de 872 ml/min chez des volontaires sains, et la clairance rénale est de 173 ml/min.
La demi-vie terminale est de 22 heures suivant l'administration par voie intraveineuse. En revanche, la demi-vie terminale suivant l'inhalation est d'environ 45 heures, ce qui indique que cette dernière est déterminée par la résorption plutôt que par l'élimination.
Après administration par voie intraveineuse d'olodatérol marqué au 14C, 38% de la dose radioactive ont été récupérés dans l'urine et 53% dans les fèces. La quantité d'olodatérol inchangé récupérée dans l'urine après administration par voie intraveineuse était de 19%. Après administration par voie orale, seulement 9% de la radioactivité ont été récupérés dans l'urine, tandis que la majeure partie a été récupérée dans les fèces (84%). Plus de 90% de la dose ont été excrétés dans les 6 jours suivant l'administration par voie intraveineuse et dans les 5 jours suivant l'administration par voie orale. Après inhalation, l'olodatérol inchangé excrété dans l'urine à l'intérieur de l'intervalle posologique chez des volontaires sains à l'état d'équilibre représentait 5 à 7% de la dose.
Cinétique pour certains groupes de patients
Les données de deux études cliniques regroupant un total de 405 patients atteints de BPCO et 296 patients souffrants d'asthme traités par Striverdi Respimat ont été étudiées dans le cadre d'une méta-analyse pharmacocinétique.
Selon cette analyse, aucun ajustement posologique n'est nécessaire en fonction de l'âge, du sexe et du poids corporel en raison de l'exposition systémique suite à l'inhalation de Striverdi Respimat.
Origine ethnique
La comparaison des données pharmacocinétiques tant d'une même étude que d'une étude à l'autre a révélé une tendance à une exposition systémique plus élevée chez les Japonais et les autres Asiatiques que chez les sujets d'origine européenne.
Aucun problème de sécurité n'a été mis en évidence dans des études cliniques d'une durée allant jusqu'à un an sur des sujets d'origine européenne et asiatique sur Striverdi Respimat à des doses pouvant atteindre le double de la dose thérapeutique recommandée.
Troubles de la fonction hépatique
Chez les patients atteints de troubles de la fonction hépatique légers ou modérés, l'exposition systémique à l'olodatérol n'a pas été altérée. Les répercussions de troubles de la fonction hépatique graves sur l'exposition systémique à l'olodatérol n'ont pas été étudiées.
Troubles de la fonction rénale
Chez les sujets atteints d'insuffisance rénale grave (CLCR <30 ml/min), l'exposition systémique à l'olodatérol a augmenté en moyenne de 1,4 fois.
Sur base des résultats d'études cliniques sur la sécurité de Striverdi Respimat, au cours desquelles les participants ont reçu sur une période d'un an maximum des doses qui pouvaient être jusqu'à deux fois supérieures à la dose thérapeutique conseillée, il apparaît qu'une augmentation posologique de cet ordre de grandeur n'a aucune influence sur la sécurité.
Interactions médicamenteuses
Des études sur les interactions médicamenteuses ont été menées à l'aide du fluconazole comme modèle d'inhibiteur du CYP 2C9 et du kétoconazole comme puissant inhibiteur de la P-gp et du CYP.
Fluconazole: l'administration concomitante de 400 mg de fluconazole une fois par jour pendant 14 jours n'a eu aucune répercussion pertinente sur l'exposition systémique à l'olodatérol.
Kétoconazole: l'administration concomitante de 400 mg de kétoconazole une fois par jour pendant 14 jours a augmenté la Cmax de l'olodatérol de 66% et son ASC0-1 de 68%.
Tiotropium: l'administration concomitante de 5 microgrammes de bromure de tiotropium (comme combinaison posologique fixe avec 10 microgrammes d'olodatérol à l'aide de Respimat) pendant 21 jours n'a eu aucune répercussion pertinente sur l'exposition systémique à l'olodatérol ou inversement.
Données précliniquesLa toxicité aiguë après administration d'une dose unique par inhalation, par voie orale et par voie intraveineuse à des souris et des rats était faible.
Dans les études pharmacologiques sur l'innocuité après administration d'une dose unique, les effets observés sont ceux auxquels on peut s'attendre après la prise de bêta2-agonistes, à savoir entre autres une chute de la tension artérielle, une augmentation de la fréquence cardiaque et une augmentation de la force de contraction cardiaque.
Dans les études sur l'inhalation de doses répétées chez la souris, le rat et le chien, les effets étaient principalement liés aux propriétés bêta2-adrénergiques de l'olodatérol; il s'agissait entre autres de l'augmentation du poids corporel, de la masse musculaire et de l'ingestion de nourriture (rongeurs), d'une augmentation de la fréquence cardiaque, de variations de la distribution du glycogène dans le foie et la nécrose des muscles papillaires (chien).
Dans une étude sur les effets d'une inhalation répétée chez les jeunes chiens, des doses allant jusqu'à 1046 microgrammes/kg/jour ont été bien tolérées. Aucun signe d'entrave au développement pulmonaire ou cardiaque n'a été observé.
Chez le rat, après l'inhalation de doses allant jusqu'à 1054 microgrammes/kg/jour (ce qui correspond à environ 1600 fois la dose journalière maximale recommandée chez l'homme [Maximum Recommended Human Daily Inhalation Dose, MRHDID] de 5 microgrammes sur base du calcul mg/m²), aucun effet tératogène n'a été observé.
Une affinité de liaison de l'olodatérol et/ou de ses métabolites aux composants rétiniens contenant de la mélanine et également à la pigmentation cutanée a été observée chez le rat.
Les études cliniques menées sur l'humain et portant sur l'olodatérol n'ont toutefois montré aucun signe d'augmentation de la phototoxicité dermique ou oculaire.
Mutagénicité
Dans le test in vivo (test du micronoyau sur la moelle osseuse chez le rat) réalisé après inhalation (à des doses allant jusqu'à 2000 fois la dose journalière maximale recommandée chez l'homme sur base m2) ainsi que dans des tests in vitro (tests de mutagénicité: test d'Ames, analyse des mutations du lymphome de la souris), l'olodatérol s'est révélé dénué de tout pouvoir génotoxique jusqu'à des doses très élevées. Une augmentation de la fréquence des micro-noyaux observée chez le rat après une exposition intraveineuse à au moins 3500 fois la dose journalière maximale recommandée chez l'homme pourrait être liée à une érythropoïèse (compensatrice) potentialisée par le médicament.
Carcinogénicité
Les études sur la carcinogénicité de l'olodatérol inhalé chez la souris et le rat n'ont pas permis de déceler un quelconque potentiel cancérogène.
Le traitement à vie chez le rat à des expositions environ 2235 fois et environ 715 fois supérieures à celles obtenues à l'administration de la dose thérapeutique recommandée chez l'humain de 5 microgrammes une fois par jour (selon l'exposition systémique) a provoqué des léiomyomes du mésovarium propres à la classe et aux rongeurs. Le traitement à vie chez la souris à des expositions d'environ 477 à 3596 fois supérieures à celles obtenues à l'administration de la dose thérapeutique recommandée chez l'humain de 5 microgrammes une fois par jour (selon l'exposition systémique) a provoqué des tumeurs du muscle lisse (léiomyomes, léiomyosarcomes) de l'utérus et des foyers d'hyperplasie des cordons sexuels et du stroma gonadique, ainsi que des foyers d'hyperplasie lutéinique; dans ce cas également, les modifications observées étaient propres à la classe et aux rongeurs (exposition multiple).
Toxicité sur la reproduction
Chez des lapines blanches de Nouvelle-Zélande gestantes, une dose inhalée de 2489 microgrammes/kg/jour d'olodatérol (ce qui correspond à plus de 3500 fois la dose journalière maximale recommandée chez l'homme selon l'ASC0-24 h) a entraîné une toxicité fœtale résultant en une stimulation caractéristique des récepteurs bêta-adrénergiques; ces effets toxiques comprenaient des ossifications irrégulières, des os courts ou courbés, une ouverture partielle de l'œil, une fente palatine et des anomalies cardiovasculaires. Aucune conséquence significative n'a été observée en outre suite à l'inhalation de 974 microgrammes/kg (ce qui correspond à environ 1580 fois la dose journalière maximale recommandée chez l'adulte sur base du calcul m2).
Aucun trouble de la fertilité mâle ou femelle ou du développement embryonnaire précoce n'a été observé chez le rat à des doses pouvant atteindre 3068 microgrammes/kg (ce qui correspond à environ 3000 fois la dose journalière maximale recommandée chez l'adulte sur base du calcul m2).
Aucun effet n'a été observé sur l'accouplement, la fertilité ou le nombre d'implants vivants jusqu'au jour de gestation 14/15/16 chez la génération F1 chez le rat à des doses inhalées pouvant atteindre 3665 microgrammes/kg/jour (ce qui correspond à environ 2970 fois la dose journalière maximale recommandée chez l'adulte sur base du calcul m2).
Remarques particulièresIncompatibilités
Non pertinent.
Stabilité
Le médicament doit être impérativement utilisé avant la date «EXP» indiquée sur l'emballage.
L'inhalateur Striverdi Respimat doit être jeté au plus tard 3 mois après insertion de la cartouche.
Remarques particulières concernant le stockage
Médicament à conserver hors de portée des enfants.
Remarques concernant la manipulation
Voir le mode d'emploi de l'inhalateur Respimat (réutilisable) joint à l'emballage.
Numéro d’autorisation67399 (Swissmedic).
PrésentationEmballage individuel: 1 inhalateur Respimat réutilisable et 1 cartouche; correspond à 60 bouffées (30 doses thérapeutiques) [B]
Emballage triple: 1 inhalateur Respimat réutilisable et 3 cartouches de 60 bouffées (90 doses thérapeutiques) [B]
Titulaire de l’autorisationBoehringer Ingelheim (Schweiz) GmbH, Bâle.
Mise à jour de l’informationMars 2020.
|


