Remarques particulièresIncompatibilités
En l'absence d'études de compatibilité, ce médicament ne doit pas être mélangé à d'autres médicaments.
Stabilité
Ce médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Breyanzi est stable pendant 13 mois lorsque les flacons non ouverts sont conservés à une température ≤ -130 °C dans la phase de vapeur de l'azote liquide.
Après la décongélation
Le médicament doit être administré immédiatement après la décongélation. La durée de conservation et les conditions d'utilisation ne doivent pas dépasser 2 heures à température ambiante (de 15 °C à 25 °C).
Remarques particulières concernant le stockage
Conserver et transporter sous forme congelée (≤ -130 °C).
Conserver hors de portée des enfants.
Remarques concernant la manipulation
Précautions à prendre avant la manipulation ou l'administration du médicament
Breyanzi contient des cellules sanguines humaines qui ont été génétiquement modifiées par un vecteur lentiviral auto-inactivé non réplicatif. Les professionnels de santé qui manipulent Breyanzi doivent prendre les précautions nécessaires pour la manipulation et l'élimination (port de gants et de lunettes de protection) afin d'éviter une transmission potentielle des maladies infectieuses (voir rubrique « Précautions particulières concernant la manipulation et l'élimination »).
Préparation de Breyanzi pour la perfusion
Matériel nécessaire:
·Vêtements de protection (gants, lunettes de protection)
·Gants cryo
·Ciseaux
·Support de protection
·Seringue Luer-Lock
·Tampon imbibé d'alcool
·Aiguille 20 G de 1-1,5 pouce
·Chlorure de sodium 9 mg/ml (0,9 %) - Solution pour perfusion
Avant de décongeler les flacons
·Assurez-vous que l'identité du patient correspond aux informations concernant le patient figurant sur le conteneur d'expédition et sur l'emballage extérieur, à savoir la boîte en carton de Breyanzi.
·Lisez le certificat RFI (fixé à l'intérieur du conteneur de livraison) pour obtenir des informations sur le nombre de seringues nécessaires à l'administration des composants cellulaires CD8+ et CD4+ (les étiquettes des seringues sont fournies avec le certificat RFI). Il existe un certificat RFI séparé pour chaque composant cellulaire.
·Les flacons de Breyanzi ne doivent pas être retirés de la boîte en carton si les informations figurant sur l'étiquette spécifique au patient ne correspondent pas au patient prévu. En cas de divergence entre les étiquettes et les informations concernant le patient, le titulaire de l'autorisation doit être contacté immédiatement.
·Ouvrez chaque boîte en carton et vérifiez visuellement que le ou les flacon(s) n'est/ne sont pas endommagé(s). Si les flacons sont endommagés, adressez-vous au titulaire de l'autorisation.
·Confirmez au préalable à quel moment la perfusion doit être effectuée. Le temps de décongélation doit alors être adapté de manière à ce que Breyanzi soit disponible pour la perfusion dès que le patient est prêt.
·Remarque: une fois retirés du congélateur, les flacons contenant les cellules T viables CAR-positives (composants CD8+ et CD4+) doivent être entièrement décongelés et les cellules administrées dans les 2 heures.
·Retirez les flacons avec précaution des boîtes en carton, placez-les sur un support de protection et amenez-les à température ambiante. Décongelez tous les flacons en même temps. Veillez à séparer les composants cellulaires CD8+ et CD4+.
Préparation de la dose
·Sur la base de la concentration de cellules T viables CAR-positives, il peut être nécessaire pour chacun des composants cellulaires CD8+ et CD4+ d'utiliser plusieurs flacons pour atteindre la dose cible. Une seringue séparée doit être préparée pour chaque flacon de composant cellulaire CD8+ ou CD4+.Remarque: le volume à prélever et à perfuser peut varier d'un composant à l'autre.
·Chaque flacon perforable de 5 ml contient un volume extractible de 4,6 ml de composant cellulaire CD8+ ou CD4+. Le certificat RFI pour chaque composant cellulaire indique le volume (ml) qui doit être prélevé dans chaque seringue. Utilisez la plus petite seringue Luer-Lock nécessaire (1 ml à 5 ml) pour prélever le volume indiqué dans chaque flacon. Une seringue de 5 ml ne devrait pas être utilisée pour des volumes inférieurs à 3 ml.
·Préparez d'abord la ou les seringue(s) du composant cellulaire CD8+. Confirmez que les informations relatives au patient sur l'étiquette de la seringue du composant cellulaire CD8+ correspondent à celles figurant sur l'étiquette du flacon du composant cellulaire CD8+. Collez les étiquettes de seringue CD8+ sur la ou les seringue(s) avant de prélever le volume nécessaire dans la ou les seringue(s).
·Répétez le processus pour le composant cellulaire CD4+.Remarque: il est important de vérifier que le volume prélevé pour chaque composant correspond au volume indiqué dans le certificat RFI correspondant.
Le volume cellulaire nécessaire doit être prélevé de chaque flacon dans une seringue séparée, en respectant les instructions suivantes:
1. Maintenez le(s) flacon(s) de produit cellulaire décongelé en position verticale et retournez avec précaution le(s) flacon(s) afin de mélanger le produit cellulaire. Si des grumeaux sont visibles, tournez et retournez le(s) flacon(s) jusqu'à ce que les grumeaux soient dissous et que les cellules soient de nouveau en suspension uniforme.
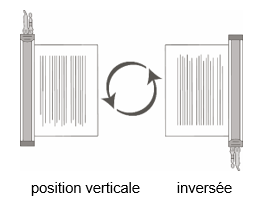
2. Vérifiez visuellement que le(s) flacon(s) décongelé(s) n'est/ne sont pas endommagé(s) ou ne présente(nt) pas de fuite. Ne pas utiliser si le flacon est endommagé ou si les grumeaux ne se dissolvent pas. Dans ce cas, contactez le titulaire de l'autorisation. Le liquide contenu dans les flacons doit être de légèrement trouble à trouble, incolore à jaune ou jaune brunâtre.
3. Retirez l'opercule en polyaluminium (le cas échéant) au bas du flacon et essuyez la membrane avec un tampon d'alcool. Avant de continuer, laissez sécher à l'air.
REMARQUE: l'absence d'opercule en polyaluminium n'a aucune influence sur la stérilité du flacon.
4. Tenez le(s) flacon(s) en position verticale, coupez le sceau sur la tubulure située sur le flacon, directement au-dessus du filtre, pour ouvrir l'orifice de tirage sur le flacon.
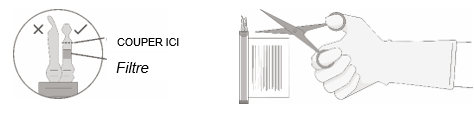
REMARQUE: Veillez à sélectionner la tubulure correcte, c'est-à-dire celle munie du filtre. Ne coupez que la tubulure avec un filtre.
5. Tenez une aiguille (=20G, 1-1,5 pouce) avec l'ouverture de la pointe de l'aiguille à l'écart de la membrane du port de prélèvement.
a.Introduisez l'aiguille dans la membrane selon un angle de 45 à 60° afin de la percer.
b.Augmentez progressivement l'angle de l'aiguille à mesure qu'elle pénètre dans le flacon.
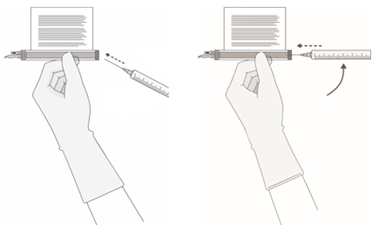
6. Prélever lentement le volume cible SANS laisser l'air entrer dans la seringue (comme indiqué dans le certificat RFI).
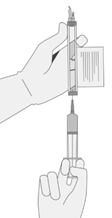
7. Avant de continuer, vérifiez soigneusement que la seringue ne présente aucun signe de dépôt. En cas de dépôts, adressez-vous au titulaire de l'autorisation.
8. Assurez-vous que le volume des composants cellulaires CD8+/CD4+ correspond au volume indiqué pour chaque composant dans le certificat RFI.
Une fois le volume vérifié, retirez la seringue/l'aiguille du flacon, détachez avec précaution l'aiguille de la seringue et fermez la seringue avec un capuchon protecteur. Conservez toujours le flacon à l'horizontale et replacez-le dans la boîte en carton afin d'éviter une fuite.

9. Éliminez en bonne et due forme les quantités de Breyanzi non utilisées (conformément aux directives locales en matière de biosécurité).
Administration
·N'utilisez PAS de filtre de leucodéplétion.
·Assurez-vous que le tocilizumab et un équipement d'urgence sont disponibles avant la perfusion et pendant la phase de récupération.
·Confirmez que l'identité du patient correspond aux informations relatives au patient figurant sur l'étiquette de la seringue.
·Dès que les composants de Breyanzi ont été prélevés dans les seringues, poursuivez l'administration dès que possible. Le temps total écoulé entre le retrait du congélateur et l'administration au patient ne doit pas dépasser 2 heures.
·Pour l'injection, utilisez une solution de chlorure de sodium à 9 mg/ml (0,9 %) pour rincer toutes les tubulures de perfusion avant et après chaque administration de CD8+ ou CD4+.
·En premier lieu, administrez le composant cellulaire CD8+. Le volume total de composant cellulaire CD8+ est administré par voie intraveineuse à un débit de perfusion d'environ 0,5 ml/min en utilisant le port le plus proche ou le cathéter en Y.
·Si plusieurs seringues sont nécessaires pour obtenir une dose cible complète du composant cellulaire CD8+, administrez le volume dans chaque seringue sans pause (à moins qu'il n'y ait une raison clinique d'arrêter la dose, par exemple une réaction liée à la perfusion). Une fois le composant cellulaire CD8+ administré, rincez la tubulure avec une solution de chlorure de sodium à 9 mg/ml (0,9 %).
·Administrez le composant cellulaire CD4+ immédiatement après l'administration du composant CD8 en suivant la procédure décrite pour le composant cellulaire CD8+. Après l'administration du composant cellulaire CD4+, rincez suffisamment la tubulure à l'aide d'une solution de chlorure de sodium à 9 mg/ml (0,9 %) afin de nettoyer la tubulure, ainsi que le cathéter intraveineux sur toute sa longueur.
·La durée de la perfusion varie et devrait généralement prendre moins de 15 minutes pour chaque composant.
Précautions particulières concernant la manipulation et l'élimination
Breyanzi contient des cellules humaines génétiquement modifiées. Il est préparé à partir de sang autologue du patient, qui est obtenu par leucaphérèse. Le matériel de leucaphérèse des patients et de Breyanzi peut comporter un risque de transmission de virus infectieux à des professionnels de santé qui manipulent le médicament. Par conséquent, les professionnels de santé doivent prendre les précautions appropriées (port de gants et de lunettes de protection) lors de la manipulation du matériel de leucaphérèse ou de Breyanzi afin d'éviter une éventuelle transmission d'agents infectieux.
Les surfaces de travail qui ont été ou auraient pu être en contact avec Breyanzi doivent être décontaminées avec un produit désinfectant approprié. Les directives locales relatives à la biosécurité pour les médicaments non utilisés ou les déchets devraient être respectées. Tous les matériels qui sont entrés en contact avec Breyanzi (déchets solides et liquides) doivent être manipulés et éliminés comme des déchets potentiellement infectieux, conformément aux directives locales en matière de biosécurité.
| 








