Propriétés/EffetsCode ATC
M09AX09
Mécanisme d'action
L'onasemnogène abéparvovec est une thérapie génique qui vise à introduire une copie fonctionnelle du gène codant pour la protéine de survie des motoneurones (SMN1) dans les cellules transduites pour traiter la cause monogénétique principale de la maladie. La mise à disposition d'une source alternative d'expression de la protéine SMN dans les motoneurones devrait favoriser la survie et le fonctionnement des motoneurones transduits.
L'onasemnogène abéparvovec est un vecteur AAV9 recombinant non réplicatif qui utilise une capside d'un AAV9 pour fournir un transgène SMN humain stable et pleinement fonctionnel. La capacité de la capside de l'AAV9 à traverser la barrière hémato-encéphalique et à transduire les motoneurones a pu être démontrée. Le gène SMN1 présent dans l'onasemnogène abéparvovec est conçu pour résider sous forme d'ADN épisomique dans le noyau des cellules transduites et il est attendu qu'il soit exprimé de manière stable dans les cellules post-mitotiques sur une longue période. Il existe une possibilité que les vecteurs AAV recombinants s'intègrent de manière aléatoire dans l'ADN humain avec une faible fréquence (voir la section «Mises en garde et précautions»).
Le virus AAV9 n'est pas connu pour être pathogène chez l'homme. Le transgène est introduit dans les cellules cibles sous la forme d'une molécule double brin autocomplémentaire. L'expression du transgène est induite par un promoteur constitutif (hybride de l'amplificateur du cytomégalovirus et du promoteur du gène de l'actine ß de poulet), ce qui conduit à une expression continue et soutenue de la protéine SMN. La preuve du mécanisme d'action est étayée par des études précliniques et des données sur la biodistribution chez l'être humain.
Pharmacodynamique
Non pertinent.
Efficacité clinique
Étude de phase 3 AVXS-101-CL-303 chez des patients atteints de SMA de type 1
AVXS-101-CL-303 (étude CL-303) est une étude de phase 3 à dose unique, en ouvert, à un seul bras, dans laquelle l'onasemnogène abéparvovec est administré par voie intraveineuse à la dose thérapeutique (1,1 × 1014 vg/kg). 22 patients atteints de SMA de type 1 et porteurs de deux copies du gène SMN2 ont été inclus. Avant le traitement par l'onasemnogène abéparvovec, aucun des 22 patients n'avait besoin d'une ventilation non invasive (VNI) et tous les patients pouvaient être alimentés par voie orale uniquement (c'est-à-dire qu'il n'y avait pas besoin de nutrition non orale). Le score moyen du CHOP-INTEND (Children's Hospital of Philadelphia Infant Test of Neuromuscular Disorders) au début de l'étude était de 32,0 (plage: 18 à 52). L'âge moyen des 22 patients au moment du traitement était de 3,7 mois (plage: 0,5 à 5,9 mois).
Sur les 22 patients inclus dans l'étude, 21 patients ont survécu jusqu'à ≥10,5 mois sans ventilation permanente (ceci étant désigné comme survie sans événement), 20 patients ont survécu jusqu'à ≥14 mois sans événement (co-critère d'évaluation principal de l'efficacité) et 20 patients ont survécu jusqu'à 18 mois.
Trois patients ont arrêté l'étude. Deux d'entre eux ont subi un événement (décès ou ventilation permanente), entraînant un taux de survie sans événement de 90,9% (IC à 95%: 79,7%; 100,0%) (patients en vie sans ventilation permanente) à l'âge de 14 mois, voir figure 1.
Figure 1: Temps (en mois) jusqu'au décès ou jusqu'à la mise en ventilation permanente, résumé des études sur l'onasemnogène abéparvovec IV (CL-101, CL-302, CL-303, cohorte 2 copies de l'étude CL-304)
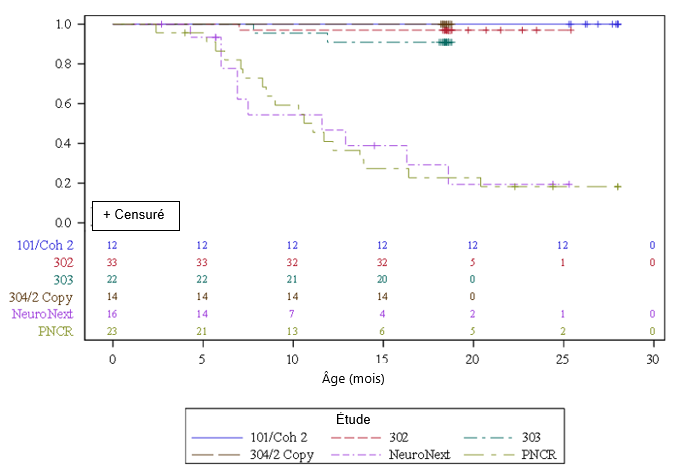
PNCR = Pediatric Neuromuscular Clinical Research, cohorte de l'évolution naturelle, sans intervention, de la maladie (Natural History).
NeuroNext = Réseau d'excellence pour les essais cliniques en neurosciences, cohorte de l'évolution naturelle de la maladie (Natural History).
Parmi les 14 patients de l'étude CL-303 qui ont atteint l'étape de «position assise autonome pendant au moins 30 secondes» à un moment quelconque de l'étude, l'âge médian lors de la première manifestation de cette étape était de 12,6 mois (plage: 9,2 à 18,6 mois).
Chez 13 patients (59,1%), l'étape de «position assise autonome pendant au moins 30 secondes» a été confirmée lors de la visite à 18 mois (co-critère d'évaluation principal, p < 0,0001). Un patient a atteint l'étape de «position assise autonome pendant 30 secondes» à l'âge de 16 mois, mais cela n'a pas pu être confirmé lors de la visite à 18 mois. Les étapes de développement confirmées par vidéo pour les patients de l'étude CL-303 sont résumées dans le tableau 4. Trois patients n'ont pas atteint d'étape de développement moteur (13,6%) et trois autres patients (13,6%) ont atteint le contrôle de la tête comme étape maximale du développement moteur avant la dernière visite de l'étude à l'âge de 18 mois.
Tableau 4: Délai médian jusqu'à l'atteinte des étapes du développement moteur documentée par vidéo, étude CL-303
|
Étape documentée par vidéo
|
Nombre de patients qui ont atteint l'étape
n/N (%)
|
Âge médian à l'atteinte de l'étape
(mois)
|
Intervalles de confiance à 95%
| |
Contrôle de la tête
|
17/20* (85,0)
|
6,8
|
(4,77; 7,57)
| |
Roule du dos sur le côté
|
13/22 (59,1)
|
11,5
|
(7,77; 14,53)
| |
Se tient assis sans assistance pendant 30 secondes (Bayley).
|
14/22 (63,6)
|
12,5
|
(10,17; 15,20)
| |
Position assise sans assistance pendant au moins 10 secondes (OMS)
|
14/22 (63,6)
|
13,9
|
(11,00; 16,17)
|
* 2 patients ont acquis un contrôle de la tête selon l'évaluation clinique effectuée au moment de l'inclusion.
Un patient (4,5%) a également été capable de marcher avec un soutien à 12,9 mois. En raison de l'évolution naturelle de la maladie, les patients qui répondaient aux critères d'inclusion de l'étude n'étaient pas censés pouvoir s'asseoir sans assistance. En outre, 18 des 22 patients étaient indépendants de toute assistance respiratoire à l'âge de 18 mois.
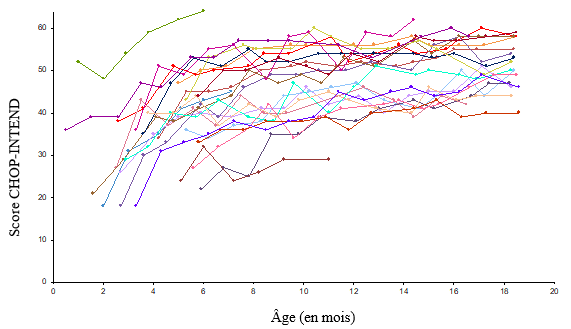
Une amélioration du développement moteur a également été observée, avec des mesures basées sur le test CHOP INTEND, voir figure 2. Vingt et un patients (95,5%) ont obtenu un score CHOP INTEND ≥40, 14 patients (63,6%) ont obtenu un score CHOP INTEND ≥50 et 9 patients (40,9%) ont obtenu un score CHOP INTEND ≥58. Les patients atteints de SMA de type 1 non traitée n'obtiennent presque jamais un score CHOP-INTEND ≥40. Malgré un niveau constant du score CHOP-INTEND, des étapes de développement moteur ont été atteintes chez certains patients. Aucune corrélation claire n'a été observée entre les scores CHOP-INTEND et l'atteinte des étapes de développement moteur.
Figure 2: Scores de développement moteur selon CHOP-INTEND, étude CL-303 (n = 22)
Étude de phase 3 AVXS-101-CL-302 chez des patients atteints de SMA
AVXS-101-CL-302 (étude CL-302) est une étude de phase 3 à dose unique, en ouvert, à un seul bras, dans laquelle l'onasemnogène-abéparvovec a été administré par voie intraveineuse à la dose thérapeutique (1,1 × 1014 vg/kg). 33 patients atteints de SMA de type 1 et porteurs de 2 copies du gène SMN2 ont été inclus dans l'étude. Avant le traitement par l'onasemnogène abéparvovec, 9 patients (27,3%) avaient besoin d'une assistance respiratoire et 9 patients (27,3%) avaient besoin d'une assistance à l'alimentation (alimentation par sonde). Le score moyen CHOP INTEND des 33 patients au début de l'étude était de 27,9 (plage: 14 à 55). L'âge moyen des 33 patients au moment du traitement était de 4,1 mois (plage: 1,8 à 6,0 mois).
Sur les 33 patients inclus («Efficacy Completers Population»), un patient (3%) ayant reçu une dose était en dehors de la tranche d'âge du protocole et n'a donc pas été inclus dans la population en intention de traiter (ITT). Sur les 32 patients inclus dans la population ITT, un patient (3%) est décédé au cours de l'étude en raison de la progression de la maladie.
Sur les 32 patients inclus dans la population ITT, 14 patients (43,8%) ont atteint l'étape de «position assise sans assistance pendant au moins 10 secondes» à l'une ou à l'autre des visites de l'étude jusqu'à la visite de l'étude à l'âge de 18 mois (inclus) (critère d'évaluation principal de l'efficacité). L'âge médian lors de l'atteinte de cette étape pour la première fois était de 15,9 mois (plage: 7,7 à 18,6 mois). 31 patients (96,9%) inclus dans la population ITT ont survécu sans ventilation permanente (c'est-à-dire une survie sans événement) jusqu'à l'âge de ≥14 mois (critère d'évaluation secondaire de l'efficacité).
Les étapes additionnelles du développement moteur confirmées par vidéo chez les patients faisant partie de l'«Efficacy Completers Population» de l'étude CL-302 à l'une ou l'autre des visites de l'étude jusqu'à la visite à 18 mois (inclus) sont résumées dans le tableau 5.
Tableau 5: Délai médian jusqu'à l'atteinte des étapes du développement moteur documentée par vidéo dans l'étude CL-302 («Efficacy Completers Population»)
|
Étape documentée par vidéo
|
Nombre de patients ayant atteint l'étape
n/N (%)
|
Âge médian à l'atteinte de l'étape
(mois)
|
Intervalle de confiance à 95%
| |
Contrôle de la tête
|
23/30* (76,7)
|
8,0
|
(5,8; 9,2)
| |
Roule du dos sur le côté
|
19/33 (57,6)
|
15,3
|
(12,5; 17,4)
| |
Se tient assis sans assistance pendant plus de 30 secondes
|
16/33 (48,5)
|
14,3
|
(8,3; 18,3)
|
*3 patients ont acquis un contrôle de la tête selon l'évaluation clinique effectuée au moment de l'inclusion.
Un patient (3%) a atteint les étapes de développement moteur, à savoir la capacité à ramper, à se tenir debout avec un soutien, à se tenir debout seul, à marcher avec une aide et à marcher seul, avant l'âge de 18 mois inclus.
Sur les 33 patients inclus, 24 patients (72,7%) ont obtenu un score CHOP-INTEND ≥40, 14 patients (42,4%) ont obtenu un score CHOP-INTEND ≥50 et 3 patients (9,1%) ont obtenu un score CHOP-INTEND ≥58 (voir figure 3). Les patients atteints de SMA de type 1 non traitée n'obtiennent presque jamais un score CHOP-INTEND ≥40.
Figure 3: Scores du développement moteur CHOP-INTEND dans l'étude CL-302 («Efficacy Completers Population»; N = 33)*

*Remarque: le score total calculé automatiquement pour un patient (
) au mois 7 (score total = 3) est considéré comme non valide. Tous les éléments n'ont pas été évalués et le score total aurait dû être défini comme manquant (c'est-à-dire non calculé).
Étude de phase 1 AVXS-101-CL-101 chez des patients atteints de SMA de type 1
Les résultats de l'étude CL-303 sont étayés par l'étude AVXS-101-CL-101 (étude CL-101), une étude de phase 1 menée chez des patients atteints de SMA de type 1 dans laquelle l'onasemnogène-abéparvovec a été administré en une seule perfusion intraveineuse à 12 patients dont le poids corporel variait entre 3,6 kg et 8,4 kg (âge: 0,9 mois à 7,9 mois). À l'âge de 14 mois, tous les patients traités étaient sans événement, c'est-à-dire qu'ils survivaient sans ventilation permanente, contre 25% dans la cohorte en évolution naturelle (Natural History). À la fin de l'étude (24 mois après l'administration), tous les patients traités étaient sans événement, contre moins de 8% en évolution naturelle (Natural History), voir figure 1.
Après 24 mois de suivi post-thérapeutique, 10 des 12 patients pouvaient se tenir assis sans assistance pendant ≥10 secondes, 9 patients pouvaient se tenir assis sans assistance pendant ≥30 secondes, et 2 patients pouvaient se tenir debout et marcher sans aide. Un des 12 patients n'a pas acquis le contrôle de la tête comme étape maximale du développement moteur avant l'âge de 24 mois. Dix des 12 patients de l'étude CL-101 continuent à être suivis dans une étude à long terme (jusqu'à 7,5 ans après l'administration du médicament) et ces 10 patients étaient en vie le 23 mai 2022 et n'avaient pas besoin de ventilation permanente. Les 10 patients ont soit maintenu les étapes atteintes précédemment, soit atteint de nouvelles étapes, notamment la capacité à se tenir assis avec une assistance, à se tenir debout avec une assistance et à marcher seuls. Un traitement concomitant par le nusinersen ou le risdiplam a été administré à six des 10 patients à un moment donné de l'étude à long terme. Par conséquent, le maintien de l'efficacité et l'atteinte des étapes ne peuvent pas être imputés uniquement à l'onasemnogène abéparvovec chez tous les patients. L'étape «se tenir debout avec assistance» a été atteinte récemment par deux patients qui ne recevaient pas le nusinersen ni le risdiplam.
Étude de phase 3 AVXS-101-CL-304 chez des patients atteints de SMA présymptomatique
L'étude CL-304 est une étude de phase 3 internationale, multicentrique, à dose unique, en ouvert, à un seul bras, dans laquelle l'AVXS-101 est administré par voie IV à des nouveau-nés pré-symptomatiques d'un âge allant jusqu'à 6 semaines et porteurs de 2 (cohorte 1, n = 14) ou 3 (cohorte 2, n = 15) copies du gène SMN2.
Cohorte 1
Les 14 patients traités porteurs de 2 copies du gène SMN2 ont été observés jusqu'à l'âge de 18 mois. Tous les patients ont survécu sans événement jusqu'à un âge d'au moins 14 mois sans ventilation permanente. Les 14 patients ont tous atteint à l'une ou l'autre des visites de l'étude et jusqu'à l'âge de 18 mois (critère d'évaluation principal de l'efficacité) l'étape de «position assise sans assistance pendant au moins 30 secondes», et ce, à un âge allant de 5,7 à 11,8 mois. Onze des 14 patients ont atteint l'étape de «position assise sans assistance» à l'âge de 279 jours ou avant, soit le 99e percentile pour l'atteinte de cette étape. Neuf patients ont atteint l'étape «marcher seul» (64,3%). Les 14 patients ont tous obtenu jusqu'à l'âge de18 mois un score CHOP-INTEND ≥58 à une visite ou l'autre de l'étude. Aucun des patients n'a eu besoin de ventilation de soutien ou d'une assistance à l'alimentation (alimentation par sonde) pendant l'étude.
Cohorte 2
Les 15 patients traités porteurs de 3 copies du gène SMN2 ont été observés jusqu'à l'âge de 24 mois. Tous les patients ont survécu sans événement jusqu'à l'âge de 24 mois sans ventilation permanente.
Les 15 patients étaient tous capables, de l'âge de 9,5 mois à 18,3 mois, de se tenir debout sans soutien pendant au moins 3 secondes (critère d'évaluation principal de l'efficacité). Quatorze patients sur 15 ont atteint l'étape «se tenir debout seul» à l'âge de 514 jours ou avant, soit le 99e percentile pour l'atteinte de cette étape. Quatorze patients (93,3%) étaient en mesure de faire au moins cinq pas seuls. Les 15 patients ont tous obtenu un score ≥4 dans la limite de 2 écarts types de la moyenne d'âge aux sous-tests de Bayley-III pour la motricité fine et globale, à chaque visite de suivi jusqu'à l'âge de 24 mois. Aucun des patients n'a eu besoin de ventilation de soutien ou d'une assistance à l'alimentation (alimentation par sonde) pendant l'étude.
Étude de phase 3 OAV101A12306 chez des patients atteints de SMA pesant entre ≥8,5 kg et ≤21 kg
L'étude OAV101A12306 était une étude de phase 3 terminée, multicentrique, en ouvert, à un seul bras, dans laquelle Zolgensma a été administré par voie intraveineuse à la dose thérapeutique (1,1 × 1014 vg/kg) à 24 patients pédiatriques atteints de SMA pesant entre ≥8,5 kg et ≤21 kg (poids médian: 15,8 kg). Au moment de l'administration, les patients étaient âgés de 1,5 à 9 ans. Un des 24 patients n'avait pas encore 2 ans au moment de l'administration (âge médian: 4,9 ans). Les patients étaient porteurs de 2 à 4 copies de SMN2. Avant d'être traités par Zolgensma, 21 patients avaient arrêté leur traitement précédent par nusinersen ou risdiplam.
Dans la semaine 52, la modification moyenne du score total de l'échelle Hammersmith Functional Motor Scale - Expanded (HFMSE) était de 3,7 par rapport à la valeur de référence (18/24 patients), ce qui est cliniquement significatif compte tenu des données relatives à l'évolution naturelle de la SMA. L'augmentation moyenne de l'échelle Revised Upper Limb Module (RULM) dans la semaine 52 était de 2,0 (17/24 patients).
Lors des essais cliniques, l'onasemnogène abéparvovec n'a pas été étudié chez les patients présentant une mutation biallélique dans le gène SMN1 et une seule copie du gène SMN2.
|