CompositionLyumjev 100 U.I./ml
Principes actifs
Insulinum Lisprum ([Lys (B28), Pro (B29)] humanum insulinum analogum*), 100 U.I. (3.5 mg).
Excipients
Treprostinilum natricum, natrii citras dihydricus, zinci oxidum, magnesii chloridum hexahydricum, metacresolum 3,15 mg, glycerolum, acidum hydrochloridum, natrii hydroxidum, aqua ad iniectabilia q.s. ad sol. pro 1 ml.
Contient 1,13 mg de sodium par 1 ml.
Lyumjev 200 U.I./ml
Principes actifs
Insulinum Lisprum ([Lys (B28), Pro (B29)] humanum insulinum analogum*), 200 U.I. (6.9 mg).
Excipients
Treprostinilum natricum, natrii citras dihydricus, zinci oxidum, magnesii chloridum hexahydricum, metacresolum 3,15 mg, glycerolum, acidum hydrochloridum, natrii hydroxidum, aqua ad iniectabilia q.s. ad sol. pro 1 ml.
Contient 1,32 mg de sodium par 1 ml.
* L'insuline lispro est un analogue de l'insuline humaine obtenu par génie génétique en utilisant Escherichia coli.
Indications/Possibilités d’emploiTraitement de patients adultes atteints de diabète sucré.
Posologie/Mode d’emploiLa posologie sera fixée par le médecin traitant en fonction du métabolisme du patient.
Lyumjev est une insuline à action rapide pour injection sous-cutanée.
D'une façon générale, Lyumjev doit être utilisé en association avec une insuline à action intermédiaire ou de longue durée.
Lyumjev convient pour l'insulinothérapie sous-cutanée continue par perfusion (CSII) et sert alors à couvrir les besoins en insuline en bolus et en basal.
En raison de son début d'action précoce, Lyumjev peut être administré immédiatement avant le repas et jusqu'à 20 minutes après le début du repas. Pour un contrôle glycémique optimal, on ne procèdera à l'administration en bolus après le début du repas que dans des cas exceptionnels.
Adaptation de la dose/Titration
En cas de passage d'une autre insuline prandiale à Lyumjev, le changement peut être effectué sur la base d'unité à unité. La concentration en insuline des analogues de l'insuline, y compris Lyumjev, est exprimée en unités. Une (1) unité de Lyumjev correspond à 1 unité internationale (UI) d'insuline humaine ou à 1 unité d'un autre analogue d'insuline à action rapide.
L'ajustement continu de la dose de Lyumjev doit se faire sur la base des besoins métaboliques du patient, des résultats de la surveillance de la glycémie et des valeurs cibles glycémiques. Des ajustements de la dose peuvent s'avérer nécessaires en cas de passage d'une autre insuline à Lyumjev, lors de modifications de l'activité physique, de changements de la médication concomitante, de modifications des habitudes alimentaires (c.-à-d. de la quantité et du type de nourriture, du moment des repas), de modifications de la fonction rénale ou hépatique ou en cas de maladie aiguë, afin de minimiser le risque d'hypoglycémie ou d'hyperglycémie.
Instauration du traitement
La posologie initiale doit tenir compte du poids du patient et de sa glycémie.
Posologie usuelle
La posologie sera fixée par le médecin traitant en fonction du métabolisme du patient.
Afin d'assurer la traçabilité des médicaments biologiques, le nom et le numéro de lot du produit administré doivent être clairement enregistrés lors de chaque traitement.
Instructions posologiques particulières
Les patients qui oublient leur dose au moment du repas doivent surveiller leur glycémie pour décider si une dose d'insuline est nécessaire, et reprendre leur schéma posologique habituel au repas suivant.
Lyumjev ne doit pas être utilisé par des personnes malvoyantes sans l'aide d'une personne formée.
Patients présentant des troubles de la fonction hépatique
Chez les patients présentant une insuffisance hépatique, les besoins en insuline peuvent être réduits, à cause de la diminution de la capacité de la gluconéogenèse et de la diminution de l'élimination de l'insuline.
Patients présentant des troubles de la fonction rénale
En présence d'une insuffisance rénale, les besoins en insuline peuvent être diminués.
Patients âgés
La sécurité et l'efficacité de Lyumjev chez les patients âgés de 65 à 75 ans ont été établies. Il est recommandé de surveiller attentivement la glycémie et d'ajuster la dose d'insuline de façon individuelle. L'expérience clinique chez les patients de 75 ans et plus est limitée.
Enfants et adolescents
La sécurité et l'efficacité de Lyumjev chez les enfants et les adolescents âgés de moins de 18 ans n'ont pas encore été établies.
Mode d'emploi
Les patients doivent être formés à l'utilisation et à la technique d'injection correcte avant le début du traitement avec Lyumjev. Les patients doivent être instruits à:
·Toujours vérifier l'étiquette de l'insuline avant l'emploi.
·Inspecter visuellement Lyumjev avant emploi et ne pas l'utiliser en présence de particules ou d'une coloration anormale.
·Comme pour toutes les insulines, il faut changer de site d'injection à chaque injection au sein d'une région d'injection pour réduire le risque de lipodystrophie ou d'amylose cutanée. Ne pas injecter dans une zone affectée par une lipodystrophie ou une amylose cutanée.
·Éliminer l'aiguille après chaque injection.
·Jeter le stylo prérempli si des parties de celui-ci semblent cassées ou endommagées.
·Prévoir un moyen d'administration de rechange ou alternatif en cas de défaillance du système d'administration utilisé.
Injection sous-cutanée
Lyumjev est injecté par voie sous-cutanée au début du repas dans l'abdomen, le bras, la cuisse ou la fesse.
Perfusion sous-cutanée continue d'insuline (pompe à insuline)
Uniquement pour Lyumjev 100 U.I./ml.
Lyumjev 100 U.I./ml peut être utilisé dans des pompes à perfusion d'insuline compatibles.
Lyumjev 100 U.I./ml doit être utilisé conformément aux instructions du fabricant de la pompe.
Lyumjev 200 U.I./ml ne doit PAS être utilisé avec une pompe à perfusion sous-cutanée continue d'insuline.
Utilisation intraveineuse
Uniquement pour Lyumjev 100 U.I./ml flacon perforable.
Lyumjev 100 U.I. /ml est disponible en flacon perforable, si une administration par voie intraveineuse est nécessaire.
Lyumjev 100 U.I./ml flacon perforable doit être dilué à une concentration de 1,0 U.I./ml; à cet effet, on utilisera du chlorure de sodium à 0,9% ou du glucose à 5% (voir sous la rubrique «Remarques particulières: utilisation intraveineuse»). La compatibilité avec le copolymère d'éthylène-polypropylène et avec la polyoléfine des poches de chlorure de polyvinyle a été démontrée.
L'utilisation intraveineuse de Lyumjev 100 U.I./ml flacon perforable doit se faire sous supervision médicale.
Lyumjev 200 U.I./ml ne doit PAS être administré par voie intraveineuse.
Lyumjev flacons perforables
Si une administration par voie sous-cutanée à l'aide d'une seringue est nécessaire, un flacon doit être utilisé.
La seringue doit être graduée à 100 unités/ml.
Les patients utilisant des flacons ne doivent jamais partager les aiguilles ou les seringues.
Ne pas mélanger avec d'autres solutions ou une autre insuline, à l'exception des solutions de perfusion contenant du chlorure de sodium à 0,9% ou du glucose à 5% dans l'eau.
Lyumjev cartouches
Les cartouches Lyumjev ont été développées et testées pour une utilisation avec des stylos de Lilly et elles ne doivent pas être utilisées avec tout autre stylo réutilisable car l'équivalence du dosage n'a pas été établie avec les autres stylos.
Ne pas mélanger avec d'autres solutions ou insulines.
Les instructions pour chaque stylo doivent être suivies pour charger la cartouche, fixer l'aiguille et administrer l'insuline.
Afin de prévenir la transmission éventuelle de maladies, chaque cartouche doit être utilisée uniquement par un seul patient, même si l'aiguille fixée sur le dispositif d'administration est changée.
Lyumjev KwikPen
Le Lyumjev KwikPen comvient uniquement pour des injections sous-cutanées.
Lyumjev existe en deux concentrations:
Lyumjev 100 U.I./ml KwikPen/Lyumjev 100 U.I./ml Junior KwikPen et Lyumjev 200 U.I./ml KwikPen.
Avec Lyumjev 100 U.I./ml et Lyumjev 200 U.I./ml KwikPen, 1 à 60 unités peuvent être administrées en une seule injection, par paliers de 1 unité. Lyumjev 100 U.I./ml Junior KwikPen permet d'administrer de 0,5 à 30 unités en une seule injection, par paliers de 0,5 unité. Le nombre d'unités d'insuline s'affiche dans la fenêtre de lecture du stylo indépendamment de la concentration et aucune conversion de dose ne doit être effectuée en cas de changement de la concentration administrée à un patient ou de changement de stylo avec un palier de dose différent.
Lyumjev 100 U.I./ml Junior KwikPen est adapté aux patients pour qui un ajustement plus fin de la dose d'insuline serait bénéfique.
Veuillez respecter le mode d'emploi du KwikPen.
Afin de prévenir la transmission éventuelle de maladies, chaque stylo doit être utilisé uniquement par un seul patient, même si l'aiguille est changée.
Contre-indicationsLyumjev est contre-indiqué pendant des épisodes d'hypoglycémie ainsi que chez les patients qui présentent une hypersensibilité connue à l'insuline lispro ou à l'un des autres composants de Lyumjev (voir sous la rubrique «Composition»).
Mises en garde et précautionsHypoglycémie
L'hypoglycémie est l'effet indésirable le plus fréquent de l'insulinothérapie, y compris avec Lyumjev. Le moment de l'apparition d'une hypoglycémie reflète généralement le profil de durée d'action de la formulation d'insuline administrée.
Une hypoglycémie peut survenir soudainement et les symptômes sont susceptibles de différer d'une personne à l'autre et d'évoluer au fil du temps chez une même personne. Une hypoglycémie sévère peut provoquer des convulsions, entraîner une perte de conscience, engager le pronostic vital ou entraîner la mort. Les symptômes annonciateurs de l'hypoglycémie peuvent être moins prononcés chez les patients ayant un diabète de longue date.
Hyperglycémie
L'administration de doses inadéquates ou l'arrêt du traitement, notamment chez des patients insulino-dépendants, sont susceptibles d'entraîner une hyperglycémie et une acidocétose diabétique, dont le pronostic peut potentiellement être fatal.
Modifications de l'insulinothérapie
Les changements d'insuline, de la concentration d'insuline, de fabricant, de type ou de mode d'administration de l'insuline peuvent avoir une incidence sur le contrôle glycémique et prédisposer à une hypoglycémie ou à une hyperglycémie. Ces changements doivent être effectués avec prudence sous contrôle médical strict et la fréquence de surveillance de la glycémie doit être augmentée. Pour les patients ayant un diabète de type 2, des ajustements posologiques dans le cadre d'un traitement antidiabétique concomitant peuvent être nécessaires.
Hyperglycémie et acidocétose dues à un dysfonctionnement de la pompe à insuline
Un dysfonctionnement de la pompe à insuline ou du kit de perfusion d'insuline peut rapidement entraîner une hyperglycémie et une acidocétose. Il est impératif d'identifier et de corriger rapidement la cause de l'hyperglycémie ou de la acidocétose. Des injections sous-cutanées provisoires de Lyumjev peuvent être nécessaires.
Utilisation de thiazolidinediones en association avec l'insuline
Les thiazolidinediones (TZD) peuvent provoquer une rétention hydrique liée à la dose, en particulier lorsqu'elles sont utilisées en association avec l'insuline. La rétention hydrique peut entraîner ou aggraver une insuffisance cardiaque. Les patients traités par insuline en association avec une TZD doivent être surveillés afin de détecter tout signe et symptôme d'insuffisance cardiaque. En cas d'apparition d'une insuffisance cardiaque, il convient d'envisager l'arrêt de la TZD.
Hypersensibilité et réactions allergiques
Des réactions allergiques sévères généralisées, y compris une réaction anaphylactique, mettant en jeu le pronostic vital, peuvent survenir avec les insulines, y compris Lyumjev. En cas de réactions d'hypersensibilité, Lyumjev doit être arrêté.
Erreurs d'utilisation
Afin d'éviter des erreurs d'utilisation entre Lyumjev et d'autres insulines, les patients doivent toujours vérifier l'étiquette de l'insuline avant chaque injection.
L'insuline de Lyumjev 200 U.I./ml KwikPen ne doit pas être aspirée dans une seringue. La graduation de la seringue d'insuline pourrait ne pas indiquer correctement la dose d'insuline, ce qui pourrait entraîner un surdosage et une hypoglycémie sévère.
Une attention particulière est nécessaire lors du passage d'un traitement à une autre formulation pharmaceutique et/ou à un autre médicament contenant la même substance active. Le patient doit faire l'object d'une surveillé adéquate.
Excipients
Ce médicament contient moins de 1 mmol de sodium (23 mg) par dose.
Les patients doivent être informés de changer continuellement de site d'injection dans la zone d'injection recommandée afin de réduire le risque de développer une lipodystrophie ou une amylose cutanée. L'injection dans une zone affectée par une lipodystrophie ou une amylose cutanée risque de retarder l'absorption de l'insuline. Un changement soudain du site d'injection (vers une zone non affectée) peut entraîner une hypoglycémie.
InteractionsLes substances suivantes peuvent diminuer les besoins en insuline: antidiabétiques (oraux ou injectables), salicylés, antibiotiques sulfonamides, certains antidépresseurs (inhibiteurs de la monoamine oxydase [inhibiteurs de MAO], inhibiteurs sélectifs de la recapture de sérotonine), inhibiteurs de l'enzyme de conversion de l'angiotensine (ECA), bloqueurs du récepteur de l'angiotensine II ou analogues de la somatostatine.
Les substances suivantes peuvent augmenter les besoins en insuline: contraceptifs oraux, corticostéroïdes, hormones thyroïdiennes, danazole, sympathicomimétiques, diurétiques ou hormone de croissance.
L'alcool peut renforcer ou atténuer l'effet hypoglycémiant de Lyumjev.
Les β-bloquants peuvent atténuer ou masquer les symptômes avertisseurs d'une hypoglycémie.
Grossesse, allaitementGrossesse
Les données cliniques sur l'utilisation pendant la grossesse ne sont pas disponibles.
Il n'existent pas d'informations sur le risque, lié au médicament, des effets malformatifs congénitaux à la naissance ou d'avortements sous Lyumjev chez la femme enceinte. Les études publiées sur l'utilisation d'insuline lispro pendant la grossesse n'ont pas rapporté de lien entre l'insuline lispro et de graves malformations congénitales, des avortements ou des critères indésirables maternels ou fœtaux. Un diabète mal contrôlé pendant la grossesse est associé à des risques pour la mère et le fœtus.
Il est essentiel de maintenir un bon équilibre glycémique chez la patiente traitée par insuline (diabète insulino-dépendant ou gestationnel) pendant toute la grossesse. Les besoins en insuline chutent généralement au cours du premier trimestre et augmentent au cours des deuxième et troisième trimestres. Les patientes ayant un diabète doivent informer leur médecin si elles sont enceintes ou si elles envisagent une grossesse. Une surveillance attentive de la glycémie ainsi qu'un bon état de santé général sont primordiaux pendant la grossesse chez le patientes ayant un diabète.
Allaitement
Les patientes ayant un diabète et qui allaitent peuvent nécessiter une adaption de la dose de l'insuline, de leur régime ou des deux.
Effet sur l’aptitude à la conduite et l’utilisation de machinesLes capacités de concentration et les réflexes peuvent être altérés en cas d'hypoglycémie. Ceci pourrait représenter un risque pour les patients dans des situations où ces facultés sont de première importance comme la conduite automobile ou l'utilisation de machines.
Les patients doivent être informés des précautions à prendre avant de conduire afin d'éviter une hypoglycémie. Cela est particulièrement important pour ceux chez qui les symptômes annonciateurs d'hypoglycémie sont absents ou diminués ou pour ceux qui ont des épisodes fréquents d'hypoglycémie. La capacité à conduire un véhicule devrait être mise en question dans ces circonstances.
Effets indésirablesL'effet indésirable le plus fréquemment rapporté pendant le traitement est l'hypoglycémie (voir sous la rubrique «Description d'une sélection d'effets indésirables», voir ci-dessous).
Les effets indésirables constatés dans les études cliniques ITRM (étude clinique de phase 3, diabète de type 1) et ITRN (étude clinique de phase 3, diabète de type 2) menées chez des patients traités avec Lyumjev sont présentés ci-après par classes de systèmes d'organes et termes privilégiés selon MedDRA et avec les fréquences suivantes: très fréquents: ≥1/10; fréquents: ≥1/100 à <1/10; occasionnels ≥1/1000 à <1/100; rares ≥1/10000 à <1/1 000; très rares: <1/10000.
Troubles du métabolisme et de la nutrition
Très fréquents: Hypoglycémie.
Troubles généraux et anomalies au site d'administration
Fréquents: Réactions au site d'injection.
Fréquents: Réaction allergique.
Affections de la peau et du tissu sous-cutané
Occasionnels: Lipodystrophie.
Occasionnels: Éruption cutanée.
Occasionnel: Prurit.
Inconnue: Amylose cutanée.
Description d'effets indésirables sélectionnés
Hypoglycémie
L'hypoglycémie est l'effet indésirable le plus fréquemment observé chez les patients traités par insuline, y compris Lyumjev.
Parmi toutes les études, il n'a été observé aucune différence cliniquement significative sur la fréquence des hypoglycémies entre l'administration de Lyumjev ou celle du Humalog (autre médicament contenant de l'insuline lispro). Dans les études où Lyumjev et Humalog ont été administrés à différents moments par rapport aux repas, aucune différence de fréquence des hypoglycémies, cliniquement pertinente, n'a été observée.
L'hypoglycémie peut survenir plus rapidement après une injection de Lyumjev par rapport à une autre insuline prandiale, en raison de son délai d'action plus précoce.
Réaction allergique
Des réactions allergiques sévères, généralisées, mettant en jeu le pronostic vital peuvent survenir avec n'importe quelle insuline, y compris Lyumjev. Cela inclut l'anaphylaxie, les réactions cutanées généralisées, l'angioedème, le bronchospasme, l'hypotension et le choc.
Réactions au site d'injection / de perfusion
Comme avec d'autres insulinothérapies, les patients peuvent présenter un rash, une rougeur, une inflammation, une douleur, des ecchymoses ou des démangeaisons au niveau du site d'injection ou de perfusion de Lyumjev. Ces réactions sont généralement légères et disparaissent habituellement avec la poursuite du traitement.
Dans les études PRONTO-T1D et PRONTO-T2D (administration des doses en multi-injections), des réactions au site d'injection sont survenues chez 2,7 % des patients traités par Lyumjev. Ces réactions étaient généralement légères et disparaissaient habituellement avec la poursuite du traitement. Parmi les 1 116 patients qui ont reçu Lyumjev, 1 a arrêté le traitement à cause de réactions au site d'injection (< 0,1 %).
Dans l'étude PRONTO-Pump-2, des réactions au site de perfusion ont été rapportées chez 38,8 % des patients traités par Lyumjev. La majorité de ces événements étaient d'intensité légère. Parmi les 215 patients traités par Lyumjev, 7 ont arrêté le traitement à cause de réactions au site de perfusion (3,3 %).
Immunogénicité
L'administration d'insuline peut provoquer la formation d'anticorps anti-insuline. La présence d'anticorps anti-médicament n'a pas eu d'effet cliniquement significatif sur la pharmacocinétique, l'efficacité ou la sécurité de Lyumjev.
Lipodystrophie
L'administration d'insuline, y compris Lyumjev, peut entraîner une lipodystrophie [lipohypertrophie (épaississement du tissu adipeux), lipoatrophie (amincissement du tissu adipeux)].
Amylose cutanée
Pendant l'insulinothérapie une amylose cutanée peut survenir au site d'injection. Des hyperglycémies ont été rapportées à la suite d'injections répétées dans un site d'injection affecté par l'amylose cutanée; des hypoglycémies ont été rapportées suite à un changement du site d'injection vers une zone non affectée par l'amylose cutanée.
Oedèmes
Des cas d'oedèmes ont été rapportés lors du traitement par insuline, en particulier si un ancien mauvais contrôle métabolique est amélioré par une insulinothérapie intensifiée.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageUn surdosage provoque une hypoglycémie.
Une hypoglycémie peut se produire à la suite d'une dose excessive d'insuline lispro par rapport à l'apport alimentaire, à la dépense énergétique ou aux deux.
Signes et symptômes
Les symptômes associés à une hypoglycémie incluent une apathie, une confusion, des palpitations, des sueurs, des vomissements et des céphalées.
Traitement
Les épisodes d'hypoglycémie légère se traitent généralement par l'administration orale de glucose. L'ajustement de la posologie du médicament, du régime alimentaire ou de l'activité physique pourra être nécessaire. Les épisodes d'hypoglycémie plus sévère avec coma, convulsions ou troubles neurologiques peuvent être traités par l'administration de glucagon ou par injection intraveineuse de glucose concentré. Il peut être nécessaire de maintenir un apport en glucides et une surveillance car une hypoglycémie peut récidiver après un rétablissement clinique apparent.
Propriétés/EffetsCode ATC
A10AB04
Mécanisme d'action
L'activité principale de Lyumjev est la régulation du métabolisme glucidique. Les insulines, y compris l'insuline lispro, la substance active de Lyumjev, exercent leur action spécifique en se liant aux récepteurs de l'insuline. L'insuline liée aux récepteurs abaisse la glycémie en stimulant absorption périphérique du glucose par les muscles squelettiques et le tissu adipeux et en inhibant la production de glucose hépatique. Les insulines inhibent la lipolyse et la protéolyse, et améliorent la synthèse des protéines.
Lyumjev est une formulation d'insuline lispro qui contient du citrate et du tréprostinil. Le citrate augmente la perméabilité vasculaire locale et le tréprostinil induit une vasodilatation locale, ce qui permet d'accélérer l'absorption de l'insuline lispro.
Pharmacodynamique
Action précoce et tardive de l'insuline
Une étude de clamp euglycémique a a été menée chez 40 patients ayant un diabète de type 1 et ayant reçu Lyumjev et Humalog par voie sous-cutanée en dose unique de 15 unités. Au même dosage, Lyumjev était equipuissant à Humalog mais son effet a été plus précoce et sa durée d'action courte durée (voir Figure 1).
Figure 1: Débit moyen de perfusion du glucose chez des patients ayant un diabète de type 1 après injection sous-cutanée de Lyumjev ou de Humalog (dose de 15 U.I.)
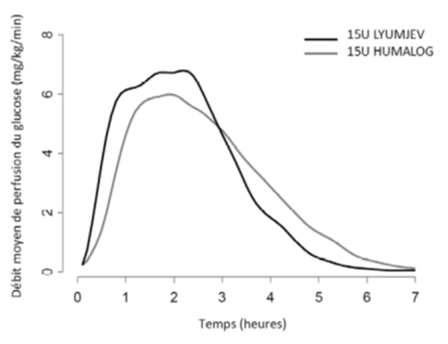
De même, une action précoce plus rapide et une action tardive réduite de l'insuline ont été observées avec Lyumjev chez des patients ayant un diabète de type 2.
Abaissement de la glycémie post-prandiale
Lors d'un repas test standardisé, Lyumjev a réduit la glycémie post-prandiale sur toute la durée de 5 heures de la phase de test du repas, en comparaison avec Humalog, chez des patients ayant un diabète de type 1 (respectivement 32% de réduction [bolus préprandial] et 18% de réduction [administration d'un bolus 20 minutes après le début du repas]) ou de diabète de type 2 (25% de réduction, indépendamment de moment de l'administration du bolus).
Figure 2: Glycémie moyenne après injection sous-cutanée de Lyumjev ou de Humalog (dose moyenne 12 U.I.) au début d'un repas test standardisé chez des patients ayant un diabète de type 1

Comparaison de Lyumjev 200 U.I./ml et Lyumjev 100 U.I./ml
L'effet hypoglycémiant maximal et l'effet hypoglycémiant total se sont avérés comparables pour Lyumjev 200 unités/mL et Lyumjev 100 unités/mL après administration sous-cutanée d'une dose unique de 15 unités à des volontaires sains.
Efficacité clinique
L'efficacité de Lyumjev a été évaluée dans deux études, l'une chez de patients ayant un diabète de type 1 (PRONTO-T1D) et l'autre chez de patients atteints de diabète de type 2 (PRONTO-T2D). Une étude additionnelle menée chez des patients ayant un diabète de type 1 (PRONTO-Pump) a examiné la compatibilité et la sécurité d'emploi de Lyumjev dans la perfusion sous-cutanée continue d'insuline (CSII).
Diabète de type 1 – Adultes
L'étude PRONTO-T1D a comparé l'efficacité hypoglycémiante de Lyumjev et de Humalog sur 26 semaines chez 1222 patients ayant un diabète de type 1, traités par multi-injections quotidiennes (MDI), avec un taux d HbA1c cible de 7%. Les patients, répartis en 3 bras de l'étude, ont reçu de manière randomisée un traitement avec injection préprandiale de Lyumjev (N=451; en aveugle), de Humalog (N=442; en aveugle) ou avec injection post-prandiale de Lyumjev (N=329; en ouvert). L'injection pré- ou postprandiale s'est faite de 0 à 2 minutes avant le repas ou jusqu'à 20 minutes après le début du repas. Tous les patients ont reçu en plus une insuline basale (insuline glargine [1 à 2 fois par jour] ou de l'insuline degludec [une fois par jour]).
La baisse du taux d'HbA1c due à Lyumjev injecté avant le repas a été numériquement légèrement plus importante que la baisse due à l'injection préprandiale de Humalog (voir tableau 1). Les taux de réponse correspondants (pourcentages des patients ayant atteint la valeur cible d'un taux d'HbA1c <7% ) se sont élevés à 37,4% (Lyumjev préprandial), 33,6% (Humalog préprandial) et 25,6% (Lyumjev postprandial). Dans le test de tolérance avec un repas mixte et chez 269 patients d'une sous-étude mésurant la glycémie en continu (CGM), une amélioration statistiquement significative du contrôle de la glycémie post-prandiale a été observé avec Lyumjev en comparaison avec Humalog (tous deux injectés avant le repas).
Tableau 1: Résultats de l'étude clinique de bolus basal sur 26 semaines chez des patients ayant un diabète de type 1
|
|
Lyumjev préprandial + insuline basale
|
Humalog préprandial + insuline basale
Bras de contrôle)
|
Lyumjev post-prandial + insuline basale
| |
Nombre de patients randomisés (N)
|
451
|
442
|
329
| |
HbA1c (%)
| |
Valeur initiale → Semaine 26
|
7,34 → 7,21
|
7,33 → 7,29
|
7,36 → 7,42
| |
Variation par rapport à la valeur initiale
|
-0.13
|
-0.05
|
0.08
| |
Différence entre traitements par rapport au bras de contrôle (95% IC)
|
-0,08 [-0,16, -0,00]B
|
|
0,13 [0,04, 0,22]C
| |
Élévation de la glycémie 2 heures après le repas (mmol/l) A
| |
Valeur initiale → Semaine 26
|
6,26 → 4,04
|
5,64 → 5,77
|
5,99 → 5,40
| |
Variation par rapport à la valeur initiale
|
-1.93
|
-0.20
|
-0.56
| |
Différence entre traitements
|
-1,73 [-2,28, -1,18]B,D
|
|
-0,37 [-0,98, -0,24]C
|
Les valeurs initiales et de fin de l'étude (semaine 26) reposent sur les moyennes des moindres carrés (moyennes ajustées).
L'intervalle de confiance à 95% est entre crochets ‹[ ]›.
A Repas test
B La différence se réfère à Lyumjev postprandial – Humalog préprandial.
C La différence se réfère à Lyumjev préprandial – Humalog préprandial.
D Statistiquement significatif en faveur de Lyumjev préprandial
Diabète de type 2 – Adultes
L'étude PRONTO-T2D a comparé l'efficacité hypoglycémiante de Lyumjev et Humalog sur 26 semaines chez 673 patients ayant un diabète de type 2. Les patients, répartis dans 2 bras de l'étude, ont reçu de manière randomisée un traitement avec injection préprandiale de Lyumjev (N=336; en aveugle) ou de Humalog (N=337; en aveugle). L'injection préprandiale s'est faite de 0 à 2 minutes avant le repas. Tous les patients ont reçu en plus une insuline basale (insuline glargine ou insuline degludec). Les patients pouvaient être sous un traitement antidiabétique oral d'accompagnement de metformine et/ou d'un inhibiteur de SGLT2.
La baisse du taux d'HbA1c due à l'injection préprandiale de Lyumjev n'a pas été inférieure à celle induite par l'injection préprandiale de Humalog (voir tableau 2). Les taux de réponse correspondants (pourcentages de patients qui ont atteint la valeur cible de HbA1c <7% ) se sont élevés à 58,2% (Lyumjev) et 52,5% (Humalog). Dans le test de tolérance avec un repas mixte, une amélioration significative du contrôle de la glycémie post-prandiale a été observé avec Lyumjev en comparaison avec Humalog
Tableau 2: Résultats de l'étude clinique de bolus basal chez des patients ayant un diabète de type 2
|
|
Lyumjev prandial + insuline basale
|
Humalog prandial + insuline basale
| |
Nombre de patients randomisés (N)
|
336
|
337
| |
HbA1c (%)
| |
Valeur initiale → Semaine 26
|
7,28 → 6,92
|
7,31 → 6,86
| |
Variation par rapport à la valeur initiale
|
-0.38
|
-0.43
| |
Différence entre traitements par rapport au bras Humalog (95% IC)
|
0,6 [-0,05, 0,16]
|
Les valeurs à la semaine 26 et la variation par rapport à la valeur initiale reposent sur les moyennes des moindres carrés (moyennes ajustées).
L'intervalle de confiance à 95% est indiqué entre crochets ‹[ ]›.
La différence se réfère à Lyumjev prandial – Humalog prandial.
Sécurité d'emploi et efficacité chez des patients âgés
Dans les deux études cliniques sur 26 semaines, 187 patients sur les 1116 (17%) patients sous Lyumjev ayant un diabète de type 1 ou de type 2 étaient âgés de ≥65 ans et 18 patients sur les 1116 (2%) étaient âgés de ≥75 ans. Globalement, aucune différence dans la sécurité ou dans l'efficacité n'a été observée entre ces patients âgés et des patients plus jeunes.
Perfusion sous-cutanée continue d'insuline (CSII)
Une étude croisée en double aveugle de 12 semaines (2 phases de 6 semaines) a évalué la compatibilité et la sécurité de Lyumjev et de Humalog avec un système de perfusion sous-cutanée continue d'insuline (PSCI) chez 49 patients adultes ayant un diabète de type , porteurs d'un capteur de glycémie en continu (CGM) tout au long de l'étude. Aucune différence statistiquement significative du taux ou de l'incidence des défaillances des kits de perfusion n'a été observée entre Lyumjev et Humalog.
PharmacocinétiqueAbsorption
L'absorption de l'insuline lispro a été accélérée et la durée d'exposition a été plus courte chez les volontaires sains et les patients ayant un diabète, après une injection de Lyumjev, par rapport à Humalog.
·L'insuline lispro est apparue dans la circulation environ 1 minute après l'injection de Lyumjev, soit cinq minutes plus vite qu'avec Humalog (figure 3).
·Le temps écoulé jusqu'à l'obtention de 50% de la concentration maximale était de 14 minutes plus court sous Lyumjev par rapport à Humalog.
·Après l'injection de Lyumjev, l'insuline lispro dans la circulation est huit fois plus importante durant les 15 premières minutes par rapport à Humalog et trois fois plus au cours des 30 premières minutes par rapport à Humalog.
·La concentration maximale d'insuline lispro a été atteinte en 57 minutes après l'administration de Lyumjev.
·Il a été observé 3 heures après l'injection de Lyumjev une diminution de 43% de l'insuline lispro dans la circulation, par rapport à Humalog.
·Sous Lyumjev, la durée de l'exposition à l'insuline lispro était raccourcie de 60 minutes par rapport à Humalog.
·L'exposition totale à l'insuline lispro et la concentration maximale étaient comparables entre Lyumjev et Humalog.
Parmi les volontaires sains, la variabilité au jour le jour [CV%] sous Lyumjev a été de 10% pour l'exposition totale (AUC0-10 h) et de 16% pour la concentration maximale d'insuline lispro (Cmax).
Figure 3: Insuline lispro dans le sérum après injection sous-cutanée de Lyumjev ou de Humalog (dose de 15 U.I)
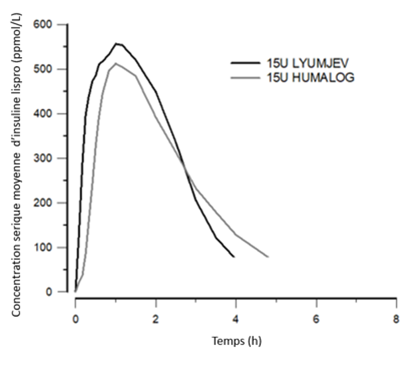
La biodisponibilité absolue de l'insuline lispro après administration sous-cutanée de Lyumjev dans l'abdomen, le haut du bras et la cuisse était d'environ 65%. L'absorption accélérée de l'insuline lispro est maintenue quel que soit le site d'injection (abdomen, haut du bras et cuisse).
La concentration maximale et le temps nécessaire pour atteindre la concentration maximale étaient comparables pour les injections dans l'abdomen et le haut du bras. Le temps nécessaire pour atteindre la concentration maximale était plus long et la concentration maximale était inférieure avec une injection dans la cuisse.
L'exposition totale à l'insuline lispro et la concentration maximale d'insuline lispro ont augmenté proportionnellement à l'augmentation des doses sous-cutanées de Lyumjev dans la plage de doses thérapeutiques.
Perfusion sous-cutanée continue d'insuline (CSII)
L'absorption de l'insuline lispro était accélérée si Lyumjev était administré par CSII à des patients ayant un diabète de type 2.
·Le temps écoulé jusqu'à l'obtention de 50% de la concentration maximale a été de 14 minutes, donc plus court de 9 minutes par rapport à Humalog.
·Après l'administration de Lyumjev, la quantité d'insuline lispro disponible durant les 30 premières minutes était 1,5 fois supérieure à celle disponible avec Humalog.
Comparaison de Lyumjev 200 U.I./ml et Lyumjev 100 U.I./ml
Les résultats d'une étude chez des sujets sains ont démontré que Lyumjev 200 unités/mL est bioéquivalent à Lyumjev 100 unités/mL après l'administration d'une dose unique de 15 unités d'après l'aire sous la courbe de la concentration sérique d'insuline lispro en fonction du temps(0-infini) et la concentration maximale d'insuline lispro. L'absorption accélérée d'insuline lispro après administration de Lyumjev 200 unités/mL s'est avérée similaire à celle observée avec Lyumjev 100 unités/mL.
Aucune conversion.
Distribution
La moyenne géométrique (coefficient de variation en % [CV%]) du volume de distribution (Vd) de l'insuline lispro était de 34 l (30%) après l'administration intraveineuse de Lyumjev en bolus d'une dose de 15 unités chez des volontaires sains.
Métabolisme
Aucune nouvelle donnée d'études sur l'insuline lispro.
Élimination
La moyenne géométrique (CV %) de la clairance de l'insuline lispro était de 32 L/heure (22%) et la demi-vie médiane de l'insuline lispro était de 44 minutes après l'administration intraveineuse de Lyumjev en bolus d'une dose de 15 unités chez des sujets sains.
Cinétique pour certains groupes de patients
L'âge, le sexe et l'origine ethnique n'ont pas eu d'incidence sur la pharmacocinétique et la pharmacodynamique de Lyumjev.
Troubles de la fonction hépatique
L'insuffisance hépatique n'est pas connue pour avoir un impact sur la pharmacocinétique de l'insuline lispro. En cas d'insuffisance hépatique, les besoins en insuline peuvent être réduits.
Troubles de la fonction rénale
L'insuffisances rénale n'est pas connue pour avoir un impact sur la pharmacocinétique de l'insuline lispro. En cas d'insuffisance rénale, les besoins en insuline peuvent être réduits.
Données précliniquesLes données non cliniques issues des études conventionnelles de pharmacologie de sécurité, toxicologie en administration répétée, cancérogenèse, et toxicité sur la reproduction et le développement, n'ont pas révélé de risque particulier pour l'homme après exposition à l'insuline lispro.
Remarques particulièresCe médicament ne soit pas être mélangé à d'autres insulines ou à d'autres médicaments.
Stabilité
Ce médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Conservation après ouverture
Se conserve 28 jours après l'ouverture (après perforation du disque d'étanchéité ou du bouchon).
Remarques particulières concernant le stockage
Avant l'ouverture, conserver au réfrigérateur (2-8°C).
Ne pas congeler.
Conserver le récipient dans le carton d'origine, pour protéger le contenu de la lumière du soleil.
Protéger de la chaleur directe, de la lumière directe ou de la lumière du soleil.
Conserver hors de la portée des enfants.
Flacon perforable
Après l'ouverture (après perforation du bouchon):
Conserver au réfrigérateur (2-8°C). Si cela n'est pas possible, conserver sans réfrigération à des températures pas supérieures à 30°C.
Cartouche
Après l'ouverture (après perforation du disque d'étanchéité):
Laissez le capuchon sur le stylo dès qu'une cartouche a été insérée, pour la protéger de la lumière.
Conserver sans réfrigération. Ne pas conserver à des températures supérieures à 30°C.
KwikPen
Après l'ouverture (après perforation du disque d'étanchéité):
Laissez le capuchon sur le stylo pour une protection contre la lumière.
Conserver sans réfrigération. Ne pas conserver à des températures supérieures à 30°C.
Remarques concernant la manipulation
Utilisation intraveineuse
La stabilité chimique et physique de la solution diluée a été démontrée sur 14 jours à une température de 2 à 8°C et de 20 heures à température ambiante. D'un point de vue microbiologique, la solution diluée doit être utilisée immédiatement. Si la solution n'est pas utilisée immédiatement, les conditions de conservation et la durée de conservation sont de la responsabilité de l'utilisateur et ne devraient normalement pas dépasser les 24 heures à 2 à 8°C, sauf si la dilution a été effectuée dans des conditions aseptiques contrôlées et validées.
Perfusion sous-cutanée continue d'insuline
Lyumjev 100 U.I./ml flacon perforable peut être utilisé dans une pompe à perfusion continue d'insuline jusqu'à 9 jours. Des tubulures dont les surfaces internes sont composées de polyéthylène ou de polyoléfine ont été testées et se sont avérées compatibles avec une utilisation dans une pompe.
Tout médicament non utilisé ou déchet doit être éliminé conformément aux exigences nationales.
Numéro d’autorisation67550, 67793, 67794 (Swissmedic).
PrésentationLyumjev solution injectable 100 U.I./ml:
Flacon perforable 10 ml: 1 (B)
Cartouches (3,0 ml) pour stylo de 3,0 ml: 5 (B)
Lyumjev 100 U.I./ml KwikPen (3,0 ml): 5 (B)
Lyumjev 100 U.I./ml KwikPen Junior (3,0 ml) 5 (B)
Lyumjev solution injectable 200 U.I./ml
Lyumjev 200 U.I./ml KwikPen (3,0 ml) 5 (B)
Titulaire de l’autorisationEli Lilly (Suisse) SA, 1214 Vernier/GE.
Mise à jour de l’informationAoût 2021.
|



