Propriétés/EffetsCode ATC
V03AB38
Mécanisme d'action
L'andexanet alfa est une forme recombinante de la protéine humaine Xa qui a été modifiée pour inhiber l'activité enzymatique du FXa. La sérine du site actif a été remplacée par de l'alanine, rendant la molécule incapable de se cliver et d'activer la prothrombine, et le domaine acide gamma-carboxyglutamique (Gla) a été retiré pour éliminer la capacité de la protéine à former le complexe prothrombinase, retirant ainsi tout effet anticoagulant.
L'andexanet alfa est un agent de réversion spécifique des inhibiteurs du FXa. Le principal mécanisme d'action est la liaison et la séquestration de l'inhibiteur du FXa, bien qu'il puisse y avoir une contribution mineure par l'inhibition de l'activité de l'inhibiteur de la voie du facteur tissulaire (TFPI) par liaison au TFPI. L'interaction entre l'andexanet alfa et le TFPI n'a pas été complètement décrite. L'andexanet alfa se lie directement aux inhibiteurs du FXa avec une haute affinité, rendant ces derniers incapables d'exercer leurs effets anticoagulants.
Pharmacodynamique
Les effets de l'andexanet alfa peuvent être mesurés à l'aide de tests quantifiant l'activité anti-FXa, la fraction libre de l'inhibiteur du FXa et la production de thrombine.
Les tests d'activité anti-FXa commercialisés ne sont pas adaptés pour mesurer l'activité anti-FXa après l'administration de l'andexanet alfa. Étant donné la liaison réversible de l'andexanet alfa à l'inhibiteur FXa, la forte dilution de l'échantillon utilisé dans ces tests conduit à dissocier l'inhibiteur de l'andexanet alfa, ce qui a pour résultat de détecter des niveaux d'activité anti-FXa faussement élevés, entraînant ainsi une sous-estimation importante de l'activité de réversion de l'andexanet alfa.
En plus de sa capacité à se lier aux inhibiteurs du FXa, le rivaroxaban et l'apixaban, à l'edoxaban et au complexe énoxaparine-ATIII, il est avéré que l'andexanet alfa inhibe l'activité du TFPI. La dose et le schéma posologique de l'andexanet alfa nécessaires pour inverser l'activité anti-FXa et pour rétablir la production de thrombine ont été déterminés au cours d'études d'évaluation de doses chez des sujets sains.
L'évolution de l'activité anti-FXa après l'administration de l'andexanet alfa était homogène dans les études menées chez des sujets sains et les études menées chez des patients hémorragiques.
L'administration d'andexanet alfa en bolus suivie d'une perfusion continue de deux heures a entraîné une diminution rapide de l'activité anti-FXa (dans les deux minutes suivant la fin de l'administration du bolus) qui est ensuite restée réduite pendant toute la durée de la perfusion continue. L'activité anti-FXa est revenue à des valeurs égales à celles observées avec le placebo environ deux heures après la fin de l'administration en bolus ou de la perfusion continue, tandis que l'activité TFPI dans le plasma est revenue aux valeurs précédant le traitement entre 72 et 93 heures après l'administration d'andexanet alfa.
Le rétablissement de la production de thrombine après l'administration d'andexanet alfa était fonction de la dose et du schéma posologique et ne correspondait pas à l'activité anti-FXa au-delà d'approximativement quatre heures (voir ci-dessous, «Rétablissement de la génération de thrombine»).
Une augmentation de la production de thrombine induite par le facteur tissulaire (FT) au-dessus de la valeur initiale (avant l'anticoagulation) s'est produite dans les 2 minutes suivant l'administration en bolus de l'andexanet alfa et s'est maintenue pendant toute la durée de la perfusion continue. La production de thrombine induite par le FT a été supérieure à celle observée avec le placebo pendant au moins 22 heures pour les inhibiteurs directs du FXa, le rivaroxaban, l'apixaban et l'edoxaban et pendant une durée maximale de 15 heures pour l'énoxaparine. L'augmentation soutenue de la production de thrombine au-dessus de la plage initiale et par rapport aux valeurs obtenues avec le placebo n'a pas été observée dans un test de production de thrombine activée par contact (un test qui n'est pas affecté par l'interaction entre le FT et le TFPI).
Modélisation et simulation pharmacocinétique/pharmacodynamique de la population (PK/PD)
La modélisation et les simulations PK/PD reposent sur l'interaction entre la pharmacocinétique de l'andexanet alfa et celle des inhibiteurs du FXa et sur les relations entre les biomarqueurs, ici l'activité anti-FXa, l'activité TFPI et l'ETP. Des incertitudes subsistent quant à la différence d'effet des anticoagulants apixaban ou rivaroxaban, à la durée de l'effet de réversion dépendant de l'effet anti-TFPI et à la nécessité d'une perfusion continue. Les simulations chez les patients hémorragiques sont moins précises que celles chez les volontaires sains en raison de la grande variabilité interindividuelle.
Des modèles PK/PD ont permis de caractériser l'effet anti-FXa de l'héparine de bas poids moléculaire (énoxaparine 40 mg) lorsqu'elle a été administrée pour obtenir une nouvelle anticoagulation après la réversion de l'inhibition du FXa induite par l'andexanet alfa. Dans ces simulations, indépendamment de la dose d'anticoagulant précédemment administrée, l'effet anti-FXa de l'énoxaparine n'était plus altéré par l'andexanet alfa au-delà de 4 heures après la fin de la perfusion (voir rubrique «Posologie/Mode d'emploi»). Ce délai correspond à la demi-vie de l'andexanet alfa (voir rubrique «Pharmacocinétique») et au retour à l'activité anti-FXa mesurée avant la perfusion qui a été mise en évidence dans les études cliniques ANNEXA-A et ANNEXA-R (voir Figure 1). La quantité restante d'andexanet alfa n'est pas suffisante pour réverser l'anticoagulation induite soit par l'inhibiteur oral du FXa initial, soit par un anticoagulant administré ultérieurement (indépendamment de l'inhibiteur oral du FXa ou de l'héparine de bas poids moléculaire).
Efficacité clinique
L'efficacité et la sécurité de l'andexanet alfa ont été évaluées dans trois études prospectives randomisées, contrôlées contre placebo, réalisées chez des sujets sains (étude 1: ANNEXA-A, étude 2: ANNEXA-R, étude 3: 16-512) et dans deux études prospectives réalisées chez des patients hémorragiques (étude 4: ANNEXA-4, étude 5: ANNEXA-I). La variation en pourcentage de l'activité anti-FXa a été examinée dans le cadre des études réalisées chez des sujets sains, et les critères d'évaluation ont été établis par le comité indépendant d'adjudication des critères.
La variation en pourcentage de l'activité anti-FXa de la situation initiale au nadir, pour le traitement à faible dose et le traitement à dose élevée avec une administration en bolus, suivi d'une perfusion continue a été examinée dans le cadre de ces études menées chez des sujets sains. Ondexxya à faible dose a été administré en bolus i.v. de 400 mg suivi d'une perfusion continue de 4 mg/min (480 mg) (dose totale du bolus et de la perfusion continue: 880 mg) pendant 120 minutes. Ondexxya à dose élevée a été administré en bolus i.v. de 800 mg suivi d'une perfusion continue de 8 mg/min (960 mg) (dose totale du bolus et de la perfusion continue: 1760 mg) pendant 120 minutes. Le nadir a été défini comme la plus petite valeur mesurée dans un délai de 5 minutes après la fin de la perfusion continue.
L'efficacité d'Ondexxya a été évaluée dans une étude multinationale, prospective, à un seul bras, ouverte, de phase 3b/4 (étude 4, ANNEXA-4) chez des patients souffrant d'une hémorragie majeure aiguë et ayant récemment reçu un inhibiteur du FXa. La variation en pourcentage de l'activité anti-FXa de la situation initiale au nadir sous traitement entre la fin de l'administration du bolus et la fin de la perfusion a été examinée dans cette étude. Par ailleurs, dans le cadre de l'étude, le taux d'hémostase efficace a été examiné dans les 12 heures après le traitement selon l'évaluation par un comité indépendant d'adjudication des critères (EAC) ignorant les taux d'activité anti-FXa. Des événements thrombotiques et des types d'hémorragies ont également été constatés par l'EAC.
ANNEXA-I (étude 5) était une étude de phase 4, randomisée, ouverte, avec détermination en aveugle des critères principaux d'évaluation de l'efficacité et de la sécurité, visant à déterminer l'efficacité et la sécurité de l'andexanet alfa par rapport au traitement habituel, chez des patients présentant une hémorragie intracrânienne (HIC) aiguë dans les 6 heures suivant le début des symptômes selon le scanner de référence et dans les 15 heures suivant la prise d'un inhibiteur oral du FXa.
Réversion des effets anticoagulants chez des sujets sains âgés de 50 à 75 ans (études 14-503 (ANNEXA-A) et 14-504 (ANNEXA-R))
Dans une étude prospective, randomisée et contrôlée contre placebo, des sujets sains d'un âge médian de 56,5 ans et recevant 5 mg d'apixaban deux fois par jour ont reçu de l'andexanet alfa (n = 24) en bolus IV de 400 mg, immédiatement suivi d'une perfusion IV de 4 mg par minute pendant 120 minutes (480 mg) ou un placebo (n = 8).
Dans une étude similaire, des sujets d'un âge médian de 57 ans recevant quotidiennement 20 mg de rivaroxaban ont reçu de l'andexanet alfa (n = 26) sous forme de bolus IV de 800 mg, immédiatement suivi d'une perfusion IV de 8 mg par minute pendant 120 minutes (960 mg) ou un placebo (n = 13).
Réduction de l'activité anti-FXa
Le critère principal d'évaluation des études 14-503 (apixaban) et 14-504 (rivaroxaban) était la variation en pourcentage de l'activité anti-FXa de la situation initiale au nadir après perfusion.
Parmi les sujets traités par l'apixaban dans l'étude 14-503, la variation en pourcentage de l'activité anti-FXa était de -92,34 % (± 2,809 %) pour le groupe andexanet alfa et de -32,70 % (± 5,578 %) pour le groupe placebo (p < 0,0001), ce dernier reflétant la clairance intrinsèque de l'anticoagulant.
Parmi les sujets traités par le rivaroxaban dans l'étude 14-504, la variation en pourcentage de l'activité anti-FXa était de -96,72 % (± 1,838 %) pour le groupe andexanet alfa et de -44,75 % (± 11,749 %) pour le groupe placebo (p < 0,0001), ce dernier reflétant la clairance intrinsèque de l'anticoagulant.
La figure 1 montre l'évolution de l'activité anti-FXa avant et après l'administration d'andexanet alfa. La réduction de l'activité anti-FXa est en corrélation avec le rétablissement de la production de thrombine. Les seuils d'activité anti-FXa pour la normalisation de la production de thrombine (définis par l'ETP moyenne et les écarts-types) ont été estimés à 44,2 ng/ml (dans les limites d'un écart-type de l'ETP normale) à partir des données regroupées des études 14-503 et 14-504, comme l'illustre la figure.
Figure 1: variation de l'activité anti-FXa (ng/ml) chez des sujets sains recevant un traitement anticoagulant par apixaban (A - étude 14-503) et rivaroxaban (B - étude 14-504)

(A)
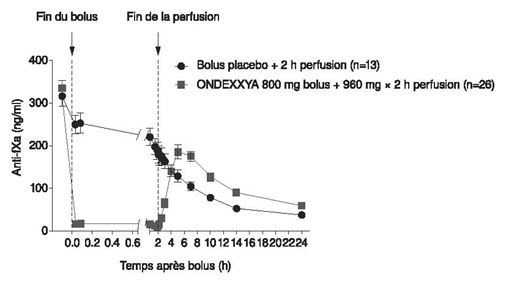
(B)
Rétablissement de la génération de thrombine
Dans les deux études 14-503 et 14-504, le traitement par l'andexanet alfa a également entraîné une augmentation statistiquement significative de la production de thrombine chez les sujets sains sous traitement anticoagulant par apixaban ou rivaroxaban comparativement au placebo (p < 0,0001). Le rétablissement de la production de thrombine à l'intérieur de la plage normale (définie comme un écart-type par rapport aux valeurs initiales) en deux minutes et maintenu pendant 20 heures a été obtenu avec le bolus seul et le bolus plus la perfusion pour les patients sous apixaban traités par l'andexanet alfa à faible dose. Chez les sujets sous rivaroxaban, l'administration d'andexanet alfa à haute dose (bolus plus perfusion) a entraîné une production augmentée de thrombine supérieure à deux écarts-types. Aucune évaluation clinique n'a été effectuée chez les sujets traités par apixaban et andexanet alfa à dose élevée et aucune évaluation n'a été effectuée chez les sujets traités par rivaroxaban et andexanet alfa à faible dose lors de ces études.
Variation par rapport aux valeurs initiales de la concentration d'inhibiteur libre du FXa au nadir
Les concentrations moyennes libres d'apixaban et de rivaroxaban étaient respectivement < 3,5 ng/ml et de 4 ng/ml après administration de l'andexanet alfa en bolus et ont été maintenues tout au long de la perfusion en continu. Ces niveaux d'inhibiteur libre du FXa génèrent peu ou pas d'effet anticoagulant.
Réversion de l'anticoagulation par l'inhibiteur du FXa chez les patients présentant une hémorragie majeure aiguë (étude 14-505 ANNEXA-4)
Dans une étude multinationale, prospective, à un bras, ouverte, Ondexxya a été administré à 477 patients traités par des inhibiteurs du FXa, dont 419 sous apixaban ou rivaroxaban, qui se sont présentés pour une hémorragie majeure aiguë. Les deux principaux co-critères d'évaluation étaient: a) la variation en pourcentage de l'activité anti-FXa de la situation initiale au nadir entre la fin de l'administration du bolus jusqu'à la fin de la perfusion, et b) le taux d'hémostase efficace dans les 12 heures suivant la perfusion, selon l'évaluation par un comité indépendant d'adjudication des critères ignorant les taux d'activité anti-FXa.
Au total, 431 patients (90 %) étaient âgés de 65 ans et plus, et 315 patients (66 %) étaient âgés de plus de 75 ans.
Sur les 477 patients ayant reçu Ondexxya, l'efficacité était évaluable chez 347 patients, ce qui se définissait par les patients qui 1) présentaient une activité anti-FXa initiale d'au moins 75 ng/ml sous traitement par l'apixaban ou le rivaroxaban, d'au moins 40 ng/ml sous traitement par l'edoxaban ou d'au moins 0,25 U.I./ml sous traitement par l'énoxaparine et qui 2) remplissaient les critères d'éligibilité pour une hémorragie majeure aiguë.
La diminution médiane (intervalle de confiance [IC] à 95 %) de l'activité anti-FXa observée entre la situation initiale et le nadir était de -93 % (-94 %, -92 %) pour l'apixaban et de -94 % (-95 %; -93 %) pour le rivaroxaban.
Au total, 128 patients de l'étude ANNEXA-4 étaient sous anticoagulants et présentaient des valeurs initiales élevées d'activité anti-FXa (> 150 ng/ml pour l'apixaban et > 300 ng/ml pour le rivaroxaban). Après l'administration d'Ondexxya, ces patients ont présenté une diminution de l'activité anti-FXa et obtenu des réductions médianes de 96 % pour le rivaroxaban et de 92 % pour l'apixaban.
Sur les 347 patients de la population d'efficacité, l'hémostase efficace était évaluable chez 340 patients selon le comité indépendant. Globalement, l'efficacité hémostatique était bonne ou excellente chez 80 % des 340 patients, chez 79 % des 169 patients recevant de l'apixaban et chez 80 % des 127 patients recevant du rivaroxaban.
Au cours de l'étude ANNEXA-4, 81 (17 %) des 477 patients de la population d'analyse de la sécurité sont décédés. Il y a eu 41 décès d'origine cardiovasculaire liés à des hémorragies, 20 décès d'origine cardiovasculaire non liés à des hémorragies, 15 décès d'origine non cardiovasculaire et 5 décès de cause incertaine ou inconnue. L'intervalle moyen avant le décès a été de 15 jours après le traitement. Parmi les 81 patients décédés, les types d'hémorragie étaient: hémorragie intracrânienne chez 60 patients (74 %), saignements gastro-intestinaux chez 15 patients (19 %) et autres types d'hémorragie chez 6 patients (7 %).
Étude 5 ANNEXA-I
ANNEXA-I était une étude de phase 4, randomisée, ouverte, avec détermination en aveugle des critères principaux d'évaluation de l'efficacité et de la sécurité, visant à déterminer l'efficacité et la sécurité d'Ondexxya par rapport au traitement habituel chez des patients présentant une hémorragie intracrânienne (HIC) aiguë avec un hématome d'un volume compris entre ≥0,5 et ≤60 ml dans les 6 heures suivant le début des symptômes selon le scanner de référence et dans les 15 heures suivant la prise d'un inhibiteur oral du FXa.
Le critère principal d'évaluation était l'évaluation de l'effet d'Ondexxya par rapport au traitement habituel sur le taux d'hémostase efficace défini comme une variation du score NIHSS par rapport à la valeur initiale < 7 après 12 heures ET une augmentation du volume de l'hématome de ≤35 % par rapport à la valeur initiale d'après une TDM ou une IRM répétée après 12 heures ET aucun traitement d'urgence administré entre 3 heures et 12 heures après la randomisation. Le critère secondaire d'évaluation était la variation en pourcentage de l'activité anti-FXa de la situation initiale au nadir pendant les 2 premières heures après la randomisation.
Dans l'étude ANNEXA-I, les patients éligibles ont été randomisés dans un rapport de 1:1 pour recevoir le traitement par Ondexxya ou le traitement habituel. La population d'efficacité primaire comprenait 452 patients, et la population élargie utilisée pour les analyses de sécurité et de sensibilité comprenait 530 patients. L'âge médian de la population élargie était de 80 ans; 53,8 % des patients étaient des hommes et 94 % des patients étaient d'origine caucasienne. Au total, 60,4 % des patients ont reçu de l'apixaban, 29,1 % ont reçu du rivaroxaban et 10,0 % ont reçu de l'edoxaban. Les indications les plus fréquentes des inhibiteurs du FXa étaient la fibrillation auriculaire (84,7 %), la prévention des thromboembolies veineuses (5,3 %) et le traitement des thromboembolies veineuses (4,7 %). Les caractéristiques démographiques et initiales de la population élargie correspondaient à celles de la population d'efficacité primaire et étaient équilibrées entre les groupes de traitement.
Dans le groupe Ondexxya, les patients ont reçu soit une dose faible soit une dose élevée d'Ondexxya en fonction de l'inhibiteur du FXa administré, de la dose de l'inhibiteur du FXa et du moment de la dernière prise de l'inhibiteur du FXa. Au total, respectivement 76,0 % et 22,1 % des patients du groupe Ondexxya ont reçu le traitement à faible dose et le traitement à forte dose. Dans le groupe recevant le traitement habituel, 85,4 % des patients ont été traités par PCC, 12,4 % des patients n'ont pas reçu de traitement hémostatique (les thrombocytes ou les concentrés érythrocytaires étaient autorisés) et 0,7 % des patients ont été traités par d'autres traitements.
Le type d'hémorragie la plus fréquente était l'hémorragie intracérébrale (92,2 %), la plupart des hémorragies étaient spontanées (87,7 %) et le volume médian initial de l'hématome était de 9,9 ml.
Au total, 17 patients (6,5 %) du groupe Ondexxya et 23 patients (8,7 %) du groupe sous traitement habituel ont subi au moins 1 intervention intracrânienne invasive. L'intervention intracrânienne invasive la plus fréquente dans les deux groupes de traitement était une trépanation du crâne pour implanter un cathéter ventriculaire.
Efficacité hémostatique
Dans la population d'efficacité primaire, Ondexxya était supérieur au traitement habituel en ce qui concerne l'obtention d'une hémostase efficace après 12 heures chez les patients souffrant d'une HIC aiguë et traités par un inhibiteur oral direct du FXa (67,0 % vs 53,1 %, différence de 13,4 % [IC à 95 % 4,6 %, 22,2 %], p = 0,0032). Une hémostase efficace a été obtenue respectivement chez 70,0 % vs 56,3 % des patients ayant pris de l'apixaban, et chez 56,3 % vs 46,2 % des patients ayant pris du rivaroxaban dans le groupe Ondexxya et dans le groupe sous traitement habituel.
L'effet du traitement était généralement homogène dans tous les sous-groupes prédéfinis sur la base des caractéristiques démographiques et des principales caractéristiques initiales.
Variation de l'activité anti-FXa de la situation initiale au nadir
Dans la population d'efficacité primaire, Ondexxya était supérieur au traitement habituel en ce qui concerne la réduction de l'activité anti-FXa de la situation initiale au nadir pendant les 2 premières heures après la randomisation chez les patients souffrant d'HIC aiguë sous traitement par un inhibiteur oral direct du FXa (réduction médiane de -94,4 % vs -27,5 %, p < 0,0001). Le nadir médian de l'activité anti-FXa sous traitement était de 5,1 ng/ml dans le groupe Ondexxya et de 80,9 ng/ml dans le groupe sous traitement habituel. La réduction médiane de l'activité anti-FXa entre la situation initiale et le nadir était respectivement de - 94,1 % vs -20,8 % pour les patients ayant pris de l'apixaban et de -96,4 % vs -46,8 % pour le rivaroxaban dans le groupe Ondexxya et dans le groupe sous traitement habituel.
Mortalité
Le nombre de patients décédés avant le 30e jour suivant la randomisation était globalement équilibré entre les groupes de traitement: 74 patients (28,2 %) dans le groupe Ondexxya et 70 patients (26,4 %) dans le groupe sous traitement habituel. Au total, 61 patients (23,3 %) du groupe Ondexxya et 57 patients (21,5 %) du groupe sous traitement habituel sont décédés à l'hôpital. Des décès liés à des hémorragies dans les 72 heures suivant la randomisation ont été rapportés chez 14 patients (5,3 %) du groupe Ondexxya et 19 patients (7,2 %) du groupe sous traitement habituel.
Immunogénicité
345 sujets sains traités par l'andexanet alfa ont été examinés pour la recherche d'anticorps à réaction croisée avec l'andexanet alfa et d'anticorps dirigés contre le facteur X et FXa. Des anticorps anti-andexanet alfa apparus au cours du traitement ont été détectés dans environ 10 % des cas (35/345). Ces anticorps étaient généralement à faible titre et aucune conséquence clinique n'a été observée. La fréquence des anticorps anti-andexanet alfa après le traitement chez les patients de l'étude ANNEXA-4 (8,0 % ou 25/314 patients) a été similaire à celle observée chez les sujets sains.
Aucun anticorps neutralisant dirigé contre l'andexanet alfa n'a été détecté dans l'étude 14-505. Dans l'étude 18-513, 2 patients du groupe andexanet alfa se sont révélés positifs aux anticorps anti-andexanet alfa au jour 30.
Aucun anticorps neutralisant ou anticorps dirigés contre le facteur X ou le FXa n'a été détecté.
Sécurité et efficacité en pédiatrie
Pas de données disponibles (voir rubrique «Posologie/Mode d'emploi» pour les informations concernant l'usage pédiatrique).
|
