CompositionPrincipes actifs
Miglustat.
Excipients
Contenu de la gélule: amidon prégélatinisé (maïs), stéarate de magnésium (E470b), cellulose microcristalline (E460i), sucralose (E955), dioxyde de silicium colloïdal.
Enveloppe de la gélule: gélatine, dioxyde de titane (E171), oxyde de fer noir (E172).
Encre d'impression: oxyde de fer noir (E172), hydroxyde de potassium (E525), propylène glycol (E1520), laque (E904), solution d'ammoniaque forte (E527).
Indications/Possibilités d’emploiOpfolda (miglustat) est un stabilisateur enzymatique de la cipaglucosidase alfa, traitement enzymatique substitutif à long terme des adultes atteints de la forme tardive de la maladie de Pompe (déficit en α-glucosidase acide [GAA]).
Posologie/Mode d’emploiLe traitement doit être supervisé par un médecin expérimenté dans la prise en charge des patients atteints de la maladie de Pompe ou d’autres maladies métaboliques ou neuromusculaires héréditaires.
Miglustat 65 mg, gélules doit être utilisé en association avec la cipaglucosidase alfa. Les informations destinées aux professionnels de santé concernant la cipaglucosidase alfa doivent être consultées avant de prendre le miglustat.
Posologie habituelle
La dose recommandée doit être prise par voie orale une fois toutes les deux semaines chez les adultes âgés de 18 ans et plus. La dose est calculée en fonction du poids corporel :
·Pour les patients pesant ≥ 50 kg, la dose recommandée est de 260 mg (4 gélules de 65 mg).
·Pour les patients pesant ≥ 40 à < 50 kg, la dose recommandée est de 195 mg (3 gélules de 65 mg).
Miglustat 65 mg, gélules doit être pris environ 1 heure avant le début de la perfusion de cipaglucosidase alfa, mais pas plus de 3 heures avant.
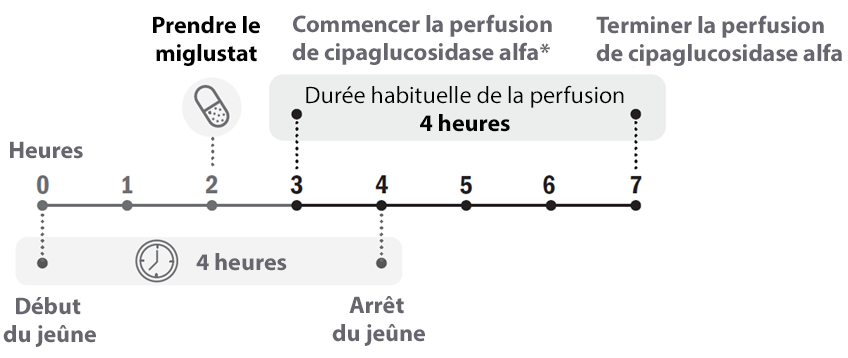
* Miglustat 65 mg, gélules doit être pris environ 1 heure avant le début de la perfusion de cipaglucosidase alfa, mais pas plus de 3 heures avant.
La réponse des patients au traitement doit être évaluée systématiquement sur la base d’une évaluation complète de toutes les manifestations cliniques de la maladie. En cas de réponse insuffisante ou d’effets secondaires intolérables, l’arrêt du miglustat 65 mg gélules en association avec le traitement par cipaglucosidase alfa doit être envisagé. La prise des deux médicaments doit être soit poursuivie, soit interrompue.
Dose manquée
Si la dose de miglustat est oubliée, le traitement doit être pris dès que possible. Si la dose n’est pas prise, ne commencez pas la perfusion de cipaglucosidase alfa. La perfusion de cipaglucosidase alfa peut commencer 1 heure après la prise de miglustat.
Instructions posologiques spéciales
Patients atteints de troubles hépatiques et rénaux
La sécurité d’emploi et l’efficacité du miglustat en association avec la cipaglucosidase alfa n’ont pas été évaluées chez les patients présentant une insuffisance rénale ou hépatique. Lors de l’administration toutes les deux semaines, l’augmentation de l’exposition plasmatique au miglustat résultant d’une insuffisance rénale ou hépatique modérée ou sévère ne devrait pas avoir d’impact appréciable sur les expositions à la cipaglucosidase alfa et ne devrait pas affecter l’efficacité et la sécurité d’emploi de la cipaglucosidase alfa de manière cliniquement significative. Aucun ajustement posologique n’est nécessaire chez les patients présentant une insuffisance rénale ou hépatique.
Patients âgés
L’expérience relative à l’utilisation du miglustat en association avec un traitement par cipaglucosidase alfa chez les patients âgés de plus de 65 ans est limitée. Aucun ajustement posologique n’est exigé chez les patients âgés.
Enfants et adolescents
La sécurité et l’efficacité du miglustat en association avec un traitement par la cipaglucosidase alfa n’ont pas encore été établies chez les patients pédiatriques âgés de moins de 18 ans. Aucune donnée n’est disponible.
Mode d’administration
Miglustat est destiné à une voie orale.
Miglustat, gélules comporte un sertissage empêchant l’ouverture de l’enveloppe de la gélule et doit être avalé en entier et pris à jeun.
Les patients doivent jeûner 2 heures avant et 2 heures après la prise de miglustat 65 mg, gélules (voir la rubrique « Pharmacocinétique »). Pendant cette période de jeûne de 4 heures, le patient peut consommer de l’eau, du lait de vache sans matières grasses (écrémé), du thé ou du café sans crème, sans sucre ni édulcorant. Le patient peut recommencer à manger et à boire normalement 2 heures après la prise de miglustat.
Contre-indications·Hypersensibilité au principe actif ou à l’un des excipients mentionnés à la rubrique « Composition ».
·Contre-indication à la cipaglucosidase alfa.
Mises en garde et précautionsDes effets secondaires au médicament peuvent survenir lors de l’utilisation de miglustat en association avec la cipaglucosidase alfa (voir la rubrique « Effets indésirables »).
InteractionsAucune étude d’interaction n’a été réalisée en lien avec l’utilisation du miglustat.
Le miglustat n’est pas un substrat de l’OAT1, de l’OAT3, de l’OATP1B1, de l’OATP1B3, de MATE1, de MATE2-K, de la BCRP ou de la BSEP. Le miglustat est un substrat faible de la P-glycoprotéine (P-gp) et un substrat des transporteurs d’absorption-OCT1 (exprimés dans le foie) et OCT2 (exprimés dans le rein). Le miglustat étant en grande partie excrété par voie rénale sans être métabolisé, les inhibiteurs de l’OCT1 ne devraient pas entraîner d’interaction cliniquement significative. Les inhibiteurs de l’OCT2 ne devraient pas avoir d’impact cliniquement significatif sur l’excrétion et l’exposition rénales du miglustat, d’après les données recueillies chez les patients atteints d’insuffisance rénale sévère. Les inhibiteurs de la P-glycoprotéine (P-gp) ne devraient pas entraîner d’interaction cliniquement significative avec le miglustat dans l’intestin, d’après les recommandations de jeûne et l’absorption rapide du miglustat (tmax de 2 heures).
Le miglustat n’est pas un substrat ou un inhibiteur connu des enzymes du cytochrome-P450 ; par conséquent, des interactions significatives sont peu probables avec les médicaments qui sont des substrats des enzymes du cytochrome-P450.
Selon une étude in vitro sur les transporteurs, le miglustat n’est pas un inhibiteur des transporteurs-OAT1, OAT3, OCT1, OCT2, OATP1B1, OATP1B3 ou BSEP. On n’attend pas d’interactions cliniquement significatives dans l’intestin avec les substrats de la P-gp et de la BCRP et dans le foie au niveau de la veine porte avec OCT1, OATP1B1 et OATP1B3 d’après les recommandations de jeûne et l’absorption rapide du miglustat.
Interactions alimentaires
Le miglustat est connu pour avoir un effet direct sur la fonction enzymatique des principales disaccharidases de l’épithélium intestinal. Plus précisément, le miglustat inhibe les disaccharidases avec des liaisons alfa-glycosidiques, incluant la sucrase, la maltase et l’isomaltase. L’impact des interactions potentielles pourrait être l’interférence immédiate avec l’activité digestive du saccharose, du maltose et de l’isomaltose, entraînant une mauvaise digestion, un afflux osmotique d’eau, une fermentation accrue et la production de métabolites irritants. Les patients doivent jeûner 2 heures avant et 2 heures après la prise de miglustat.
Grossesse, AllaitementContraception chez les femmes
Des mesures de contraception efficaces doivent être utilisées par les femmes en âge de procréer pendant le traitement par miglustat en association avec la cipaglucosidase alfa et pendant 4 semaines après l’arrêt du traitement (voir « Données précliniques »). L'utilisation du miglustat en association avec la cipaglucosidase alfa n'est pas recommandée chez les femmes en âge de procréer qui n'utilisent pas une contraception fiable.
Grossesse
Il n’existe pas de données cliniques sur l’utilisation du miglustat en association avec la cipaglucosidase alfa chez la femme enceinte.
Les études expérimentales effectuées chez l’animal avec le miglustat seul ainsi qu'avec la cipaglucosidase alfa en association avec le miglustat ont mis en évidence une toxicité sur la reproduction (voir « Données précliniques »).
Le risque potentiel pour les humains est inconnu. Le miglustat traverse le placenta. Le miglustat seul ou la cipaglucosidase alfa en association avec le miglustat ne doit pas être prise pendant la grossesse.
Allaitement
On ne sait pas si le miglustat et la cipaglucosidase alfa sont excrétés dans le lait maternel (voir « Données précliniques»). Les données animales indiquent la sécrétion de miglustat et l’excrétion de la cipaglucosidase alfa dans le lait. Un risque pour les nouveau-nés/nourrissons ne peut être exclu. Une décision doit être prise soit d’interrompre l’allaitement soit d’interrompre/de s’abstenir du traitement par le miglustat en association avec la cipaglucosidase alfa en prenant en compte le bénéfice de l’allaitement pour l’enfant au regard du bénéfice du traitement pour la femme.
Fertilité
Il n’existe pas de données cliniques sur les effets du traitement par le miglustat en association avec la cipaglucosidase alfa sur la fertilité.
Les données précliniques ont montré que le miglustat affecte négativement les caractéristiques du sperme (motilité et morphologie), réduisant ainsi la fertilité (voir « Données précliniques ». Cependant, aucun effet sur la concentration du sperme, la motilité ou la morphologie des spermatozoïdes n’a été observé chez 7 hommes adultes en bonne santé ayant reçu le miglustat 100 mg par voie orale deux fois par jour pendant 6 semaines.
Chez les rates, une augmentation des pertes préimplantatoires a été observée avec le miglustat en association avec la cipaglucosidase alfa ainsi qu’avec le miglustat seul (voir « Données précliniques»).
Effet sur l’aptitude à la conduite et l’utilisation de machinesLe miglustat n’a aucun effet ou un effet négligeable sur l’aptitude à conduire des véhicules et à utiliser des machines.
Effets indésirablesRésumé du profil de sécurité
Les effets secondaires les plus fréquemment signalés attribués à la combinaison de cipaglucosidase alfa et de miglustat étaient : maux de tête (céphalées) (7,3%), douleurs abdominales (4,0%), fatigue (4,0%), diarrhée (3,3%), spasmes musculaires (3,3%), nausées (2,6%), éruptions cutanées (2,0%), distension abdominale (2,0%), vomissements (2,0%), myalgie (2,0%), tachycardie (2,0%), dysgueusie (1,3%), pyrexie (1,3%), flatulences (1,3%), hyperhidrose (1,3%), faiblesse musculaire (1,3%), prurit (1,3%), tremblements (1,3%) et urticaire (1,3%).
Les effets secondaires les plus fréquemment rapportés attribués uniquement à la cipaglucosidase alfa étaient : maux de tête (céphalées) (6,6 %), fatigue (4,0 %), pyrexie (4,0 %), éruptions cutanées (3,3 %), frissons (3,3 %), nausées (3,3 %), urticaire (3,3 %), dyspnée (2,6 %), sensation de vertige (2,6 %), bouffées congestives (2,0 %), prurit (2,0 %), somnolence (2,0 %), douleurs abdominales (1,3 %), augmentation de la pression artérielle (1,3 %), gêne thoracique (1,3 %), toux (1,3 %), myalgies (1,3 %), douleur (1,3 %), et gonflement au site de perfusion (1,3 %).
Les effets secondaires les plus fréquemment rapportés attribués uniquement au miglustat 65 mg étaient : diarrhée (5,3 %), nausées (3,3 %), douleurs abdominales (2,0 %), distension abdominale (1,3 %), flatulences (1,3 %), spasmes musculaires (1,3 %), constipation (1,3 %), et tremblements (1,3 %).
Les effets secondaires graves rapportés attribués à la combinaison de cipaglucosidase alfa et de miglustat étaient : anaphylaxie (0,7 %), hypotension (0,7 %) et urticaire (0,7 %).
Les effets secondaires graves signalés uniquement attribués à la cipaglucosidase alfa étaient : urticaire (1,3%), anaphylaxie (0,7%), dyspnée (0,7%), fièvre (0,7%), respiration sifflante (0,7%), bouffées congestives (0,7%), toux (0,7%), œdème pharyngé (0,7%), présyncope (0,7%) et frissons (0,7%).
Aucun effet indésirable grave n'a été attribué au miglustat seul.
Liste des effets secondaires
L’évaluation des effets secondaires du miglustat a été réalisée à partir des effets secondaires rapportés par les patients traités par miglustat en association avec la cipaglucosidase alfa sur la base d’une analyse de sécurité groupée dans les 3 études cliniques. Au total, la durée moyenne de l’exposition était de 17,2 mois.
Les effets secondaires rapportés dans les études cliniques sont énumérés par classe de systèmes d’organes (MedDRA) dans le Tableau 1. Les catégories de fréquence correspondantes sont définies comme suit : très fréquent (≥ 1/10), fréquent (≥ 1/100 à < 1/10), peu fréquent (≥ 1/1 000 à < 1/100).
Tableau 1 : Résumé des effets secondaires issus des études cliniques menées chez des patients traités par miglustat/cipaglucosidase alfa
|
Classe de systèmes d’organes (CSO)
|
Fréquence
|
Effet indésirable (terme préférentiel)
| |
Affections du système immunitaire
|
Fréquent
|
Réaction anaphylactique1
| |
Peu fréquent
|
Hypersensibilité
| |
Affections du système nerveux
|
Très fréquent
|
Céphalées (12,6 %)
| |
Fréquent
|
Sensations de vertige *, tremblements, somnolence*, dysgueusie
| |
Peu fréquent
|
Troubles de l’équilibre, sensation de brûlure*, migraine4, paresthésie*, présyncope*
| |
Affections cardiaques
|
Fréquent
|
Tachycardie5
| |
Affections vasculaires
|
Fréquent
|
Bouffées congestives *, hypertension
| |
Peu fréquent
|
Hypotension, pâleur
| |
Affections respiratoires, thoraciques et médiastinales
|
Fréquent
|
Dyspnée, toux*
| |
Peu fréquent
|
Asthme, gêne oropharyngée*, œdème pharyngé*, respiration sifflante*
| |
Affections gastro-intestinales
|
Fréquent
|
Diarrhée, nausées, douleurs abdominales6, flatulences, distension abdominale, vomissements, constipation†
| |
Peu fréquent
|
Inconfort abdominal†, dyspepsie*, douleur œsophagienne*, spasmes œsophagiens, gêne buccale*, douleur buccale, gonflement de la langue*
| |
Affections de la peau et des tissus sous-cutanés
|
Fréquent
|
Urticaire3, rash2, prurit, hyperhidrose
| |
Peu fréquent
|
Altération de la couleur cutanée, œdème cutané*
| |
Affections musculo-squelettiques et systémiques
|
Fréquent
|
Spasmes musculaires, myalgie, faiblesse musculaire
| |
Peu fréquent
|
Arthralgie, douleur du flanc, fatigue musculaire, raideur musculo-squelettique
| |
Troubles généraux et anomalies au site d’administration
|
Fréquent
|
Fatigue, fièvre, frissons, gêne thoracique*, gonflement au site de perfusion*, douleur*
| |
Peu fréquent
|
Asthénie, douleur faciale, sentiments de confusion†, douleur au site de perfusion*†, malaise*, douleur thoracique non cardiaque, gonflement périphérique*, fluctuation de la température corporelle
| |
Troubles du système sanguin et lymphatique
|
Peu fréquent
|
Numération lymphocitaire diminué, thrombocytopénie†
| |
Lésions, intoxications et complications liées aux procédures
|
Peu fréquent
|
Abrasion cutanée*
|
* Rapportés avec la cipaglucosidase alfa uniquement
† Rapportés avec le miglustat uniquement
1 L’anaphylaxie, les réactions anaphylactiques et les réactions anaphylactoïdes sont regroupées sous « anaphylaxie ».
2 Les rash et rash érythémateux et rash maculeux sont regroupés sous « éruption cutanée ».
3 L’urticaire, le rash urticarien et l’urticaire mécanique sont regroupés sous « urticaire ».
4 La migraine et la migraine avec aura sont regroupées sous « migraine ».
5 La tachycardie et la tachycardie sinusale sont regroupées sous « tachycardie ».
6 Les douleurs abdominales, les douleurs abdominales hautes et les douleurs abdominales basses sont regroupées sous « douleurs abdominales ».
Déclaration des effets secondaires suspectés
L’annonce d’effets secondaires présumés après l’autorisation est d’une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d’effet secondaire nouveau ou grave via le portail d’annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageSignes et symptômes
Des cas de leucopénie, granulocytopénie, neutropénie, étourdissements, et paresthésie ont été observés chez des patients infectés par le VIH (virus de l’immunodéficience humaine) recevant du miglustat à une posologie d’au moins 800 mg/jour.
Traitement
En cas de surdosage, des soins médicaux de soutien doivent être prodigués immédiatement. Les hémogrammes doivent être surveillés pour détecter une éventuelle réduction de la numération leucocytaire.
Propriétés/EffetsCode ATC
A16AX06
Mécanisme d'action/Pharmacodynamique
Le miglustat est un stabilisateur enzymatique pharmacocinétique de la cipaglucosidase alfa.
Le miglustat se lie sélectivement à la cipaglucosidase alfa dans le sang pendant la perfusion, ce qui stabilise la conformation de la cipaglucosidase alfa et minimise la perte d’activité enzymatique dans la circulation. La liaison sélective entre la cipaglucosidase alfa et le miglustat est transitoire, elle se dissocie dans le lysosome. Le miglustat seul n’a aucun effet sur la réduction du glycogène.
Efficacité clinique
Voir les informations destinées aux professionnels de santé pour Pombiliti (voir la rubrique « Efficacité clinique »).
PharmacocinétiqueAbsorption
Le délai d'obtention de la concentration maximale (tmax) du miglustat était d’environ 2 à 3 heures. À la dose clinique de 260 mg, la concentration de miglustat plasmatique maximale (Cmax) est d’environ 3 000 ng/ml et l’ASC0-∞d’environ 25 000 ng h/ml.
Effet des aliments
Un effet significatif des aliments a été observé, avec une diminution de la Cmax de 36 % et un retard de l’absorption d’environ 2 heures (voir la rubrique « Posologie/Mode d’emploi »).
Distribution
Sans objet.
Métabolisme
Le miglustat est largement non métabolisé, < 5 % d’une dose radiomarquée étant retrouvée sous forme de glucuronides.
Élimination
La demi-vie d’élimination terminale était d’environ 6 heures pour le miglustat. La clairance orale était d’environ 10,5 l/h et le volume de distribution en phase terminale était d’environ 90 l.
Linéarité/non-linéarité
Le miglustat a démontré une cinétique proportionnelle à la dose.
Cinétique pour certains groupes de patients
Insuffisance hépatique
La pharmacocinétique du miglustat en association avec la cipaglucosidase alfa n’a pas été évaluée chez les patients présentant une insuffisance hépatique.
Insuffisance rénale
L’ASC0-24 h du miglustat a augmenté de 21 %, 32 % et 41 % chez les patients présentant une insuffisance rénale légère (clairance de la créatinine [ClCr] de 60 à 89 ml/minute, estimée par Cockcroft-Gault), modérée (ClCr de 30 à 59 ml/minute) et sévère. (ClCr de 15 à 29 ml/minute), respectivement, par rapport aux patients ayant une fonction rénale normale. L’effet de la maladie rénale au stade terminal sur la pharmacocinétique du miglustat est inconnu.
Sexe, âge et origine ethnique/ethnicité
D’après l’analyse pharmacocinétique de population groupée, le sexe, l’âge (18-74 ans) et l’origine ethnique/ethnique n’ont pas eu d’effet cliniquement significatif sur l’exposition au miglustat en association avec la cipaglucosidase alfa.
Données précliniquesLes données non cliniques ne révèlent aucun danger particulier pour l’homme sur la base des études conventionnelles de pharmacologie de sécurité, de toxicité à dose unique et répétée, et de génotoxicité.
Cancérogénicité
Chez la souris, des carcinomes du gros intestin se sont produits occasionnellement après un traitement oral par le miglustat à 210, 420 et 840/500 mg/kg/jour pendant une période de 2 ans. Ces doses correspondent à 8, 16 et 33/19 fois une dose humaine de 200 mg trois fois par jour. La pertinence de ces résultats chez l’homme pour la prise du miglustat n’est pas connue aux doses considérablement plus faibles étudiées de 195 à 260 mg toutes les deux semaines pour la maladie de Pompe.
L'administration par voie orale de miglustat à des rats Sprague Dawley mâles et femelles à des doses de 30, 60 et 180 mg/kg/jour (environ 1, 2 et 5 fois la dose maximale recommandée chez l'homme (MHRD) d'Opfolda 260 mg, respectivement, basée sur la surface corporelle) pendant 2 ans a entraîné une incidence accrue et indépendante de la dose, d'hyperplasie des cellules interstitielles testiculaires et d'adénomes des cellules interstitielles du testicule. Des études ont montré que la survenue de ces tumeurs résulte d'un mécanisme spécifique aux rats et est considérée comme ayant une faible pertinence pour les humains.
Toxicité sur la reproduction et le développement
Dans une étude chez des rats mâles, le traitement par le miglustat en association avec la cipaglucosidase alfa ou le miglustat seul n'a eu aucun effet sur la spermatogenèse. Dans une étude avec un autre produit contenant du miglustat chez les rats, le le miglustat administré par voie orale a entraîné une atrophie/dégénérescence du tube séminifère et des testicules à une exposition multipliée par 2,0, à la dose maximale recommandée chez l’homme (DMRH) en fonction de la surface corporelle (mg/m2). De plus, une diminution de la spermatogenèse avec altération de la morphologie et de la motilité du sperme, et une diminution de la fertilité ont été observées chez des rats ayant reçu une à des expositions multipliées par 0,6, d’après les comparaisons de la surface corporelle. La diminution de la spermatogenèse était réversible chez les rats 6 semaines après le retrait du principe actif.
Dans une étude du sur la fertilité et le développement embryonnaire précoce chez le rat, une augmentation de pertes préimplantatoires a été observée dans le groupe de miglustat seul et le groupe traitement combiné (et a été considérée comme liée au miglustat. Pour le traitement combiné, les marges à la DMRH de la cipaglucosidase alfa et du miglustat étaient respectivement de 27 fois et 4 fois, d’après l’exposition à l’ASC plasmatique. Il n’y a pas eu pour cet effet de dose sans effet indésirable observé (NOAEL) dans le groupe de combinaison.
Dans une étude de développement embryo-fœtal, aucun effet indésirable directement attribué à la cipaglucosidase alfa ou au miglustat n’a été observé chez les rates gravides ou leur progéniture.
Dans le cadre d'une étude sur un autre produit à base de miglustat, le miglustat a diminué la survie embryo-fœtale chez les rats et les lapins. Un travail prolongé, une augmentation des pertes post-implantatoires et des anomalies vasculaires ont été observés chez les lapins. Ces effets peuvent être partiellement liés à la toxicité maternelle. Des changements au niveau de la lactation ont été observés chez les rats femelles dans le cadre d'une étude d'un an.
Dans une étude embryo-fœtale menée chez les lapines, , les effets maternels, y compris la diminution de la consommation alimentaire et les gains de poids corporel, étaient évidents à la fois pour le miglustat seul et pour le groupe combiné. La combinaison de la cipaglucosidase alfa et du miglustat (mais pas avec la cipaglucosidase alfa sans miglustat) a entraîné une augmentation des malformations cardiovasculaires chez les fœtus de lapin (tronc pulmonaire atrétique, défaut du septum ventriculaire et dilatation de l’arc aortique) à des expositions 16 fois et 3 fois supérieures, respectivement, à la DMRH de la cipaglucosidase alfa et du miglustat, respectivement, sur la base d’une seule exposition, ou 112 fois et 21 fois supérieures à la DMRH, respectivement, basées sur l'exposition cumulée. Cependant, il n’est pas possible d’exclure que les effets indésirables embryo-fœtaux observés chez les lapins aient pu se produire après une seule exposition au traitement combiné. Une dose sans effet nocif observé (NOAEL) n’a pas pu être établie pour le groupe de traitement combiné, car une seule dose d’association a été testée.
Dans une étude de développement prénatal et postnatal réalisée chez le rat, aucun effet indésirable sur le développement maternel ou postnatal directement imputable à la cipaglucosidase alfa ou au miglustat n’a été observé. L’évaluation du lait des rates du groupe de traitement combiné a montré une sécrétion de miglustat et une excrétion de cipaglucosidase alfa dans le lait des rates. 2,5 heures après la prise, le rapport entre l’exposition à la cipaglucosidase alfa dans le lait des rates et dans le plasma était de 0,038.
Remarques particulièresIncompatibilités
En l’absence d’études de compatibilité, ce médicament ne doit pas être mélangé avec d’autres médicaments.
Durée de conservation
Ce médicament ne doit pas être utilisé après la date d'expiration « EXP » indiquée sur l'emballage.
Remarques particulières concernant le stockage
Ne pas conserver à des températures supérieures à 30°C.
Tenir hors de la portée des enfants.
Numéro d'autorisation67806 (Swissmedic)
PrésentationBouteilles de 4 et 24 gélules [B].
Titulaire de l’autorisationAmicus Therapeutics Switzerland GmbH
Seefeldstrasse 69
CH-8008 Zurich
Suisse
Mise à jour de l’informationAvril 2025
|

