CompositionPrincipe actif
Insulinum Aspartum 100 U/ml; analogue de l'insuline humaine à action rapide (B28 Asp) produit par génie génétique dans Saccharomyces cerevisiae.
Excipients
Phénol, métacrésol, glycérol, acétate de zinc, phosphate disodique dihydraté, chlorhydrate d'arginine, nicotinamide (vitamine B3), acide chlorhydrique (pour l'ajustement du pH), hydroxyde de sodium (pour l'ajustement du pH), eau pour préparations injectables pour 1 ml.
PumpCart
Une cartouche de 1,6 ml contient 6,15 mg de sodium.
Indications/Possibilités d’emploiDiabète sucré chez l'adulte, l'adolescent et l'enfant à partir de un an à condition qu'un traitement insulinique soit nécessaire.
Posologie/Mode d’emploiPosologie usuelle
La posologie de Fiasp ultra-fast-acting est flexible et doit être déterminée en fonction des besoins du patient. Pour cela, une surveillance régulière de la glycémie conformément aux directives est recommandée. Fiasp ultra-fast-acting est administré par injection sous-cutanée. Fiasp ultra-fast-acting peut également être utilisé pour la perfusion sous-cutanée continue d'insuline (PSCI) dans les systèmes de pompe.
Les besoins individuels d'insuline chez les adultes, les adolescents et les enfants se situent généralement entre 0,5 et 1,0 U/kg/jour. En cas de schéma thérapeutique basal-bolus par injection, 50 à 60% des besoins quotidiens sont couverts par l'insuline bolus, ce qui signifie qu'ils doivent être couverts par Fiasp ultra-fast-acting.
Lors d'un traitement basal-bolus par PSCI, seul Fiasp ultra-fast-acting à action rapide est utilisé, et sert à couvrir le besoin d'insuline bolus et basal.
Lors de hausse de l'activité physique, d'une modification des habitudes alimentaires ou de maladies concomitantes, une adaptation de la dose peut également être nécessaire. Dans ces situations, la glycémie doit faire l'objet d'une surveillance particulière.
Remplacement d'autres produits insuliniques par Fiasp ultra-fast-acting
Fiasp ultra-fast-acting a une entrée en action plus rapide que NovoRapid®, lequel a une entrée en action plus rapide que l'insuline humaine. En raison de l'entrée en action plus rapide, Fiasp ultra-fast-acting peut généralement être administré immédiatement avant un repas (0 à 2 minutes avant) et dans des cas exceptionnels, peu de temps après le début du repas. En cas de remplacement d'un autre type, d'une autre marque ou d'un autre fabricant d'insuline par Fiasp ultra-fast-acting, le patient devra faire l'objet d'un suivi médical, et un changement de posologie pourra être nécessaire.
En outre, il pourra être nécessaire d'ajuster les doses et les horaires d'administration des insulines à action prolongée ou intermédiaire ou des autres traitements antidiabétiques concomitants.
Instructions posologiques particulières
Patients présentant des troubles rénaux ou hépatiques
Les troubles rénaux ou hépatiques peuvent réduire les besoins en insuline du patient. Chez les patients présentant des troubles rénaux ou hépatiques, il est recommandé d'intensifier la surveillance glycémique et d'ajuster la dose de façon individuelle (voir sous «Pharmacocinétique»).
Enfants et adolescents
Fiasp ultra-fast-acting peut être utilisé chez les adolescents et les enfants à partir d'un an. Il est recommandé d'administrer Fiasp ultra-fast-acting immédiatement avant un repas (0 à 2 minutes). Une administration flexible de Fiasp ultra-fast-acting dans les 20 minutes suivant le début d'un repas (par exemple dans les situations où il y a une incertitude sur la prise du repas) est possible, mais cela nécessite une surveillance étroite du taux de sucre dans le sang (voir sous «Mises en garde et précautions» et «Effets indésirables»).
Mode d'administration
Injection sous-cutanée
Fiasp ultra-fast-acting est injecté par voie sous-cutanée dans la paroi abdominale, le haut du bras ou dans la cuisse. Une rotation des sites d'injection devra être effectuée au sein d'une même région afin de diminuer le risque de développer une lipodystrophie.
La durée d'action de Fiasp ultra-fast-acting varie en fonction de la dose, du site d'injection, du flux sanguin, de la température et de l'intensité de l'activité physique.
Fiasp ultra-fast-acting, FlexTouch® 100 unités/ml, solution injectable en stylo prérempli
Administration avec le stylo prérempli (FlexTouch®)
Fiasp ultra-fast-acting est disponible en stylo prérempli (FlexTouch®) conçu pour être utilisé avec les aiguilles NovoFine®, NovoFine® Autocover® ou NovoTwist®. Le stylo prérempli de 100 unités/ml permet d'injecter de 1 à 80 unités par paliers de 1 unité.
Fiasp ultra-fast-acting FlexTouch® a un code couleur et est accompagné d'une notice comportant des instructions d'utilisation détaillées à suivre.
Fiasp ultra-fast-acting, Penfill® 100 unités/ml, solution injectable en cartouche
Administration avec un système d'administration d'insuline
Fiasp ultra-fast-acting est disponible en cartouche (Penfill®) conçue pour être utilisée avec les systèmes d'administration d'insuline Novo Nordisk et les aiguilles NovoFine®, NovoFine® Autocover ou NovoTwist®.
Fiasp ultra-fast-acting 100 unités/ml, solution injectable en flacon perforable
Administration avec une seringue
Fiasp ultra-fast-acting est disponible en flacon perforable prévu pour être utilisé avec des seringues à insuline comportant une graduation en unités (U-100 ou 100 U/ml).
Fiasp ultra-fastacting PumpCart® 100 unités/ml, solution injectable en cartouche
Administration avec un système de pompe à perfusion d'insuline
Fiasp ultra-fast-acting est disponible dans une cartouche (PumpCart®) et est destiné à être utilisé avec un système de pompe à perfusion d'insuline conçu pour être utilisé avec cette cartouche. Fiasp ultra-fast-acting PumpCart® est livré avec une notice contenant des instructions détaillées à suivre.
Perfusion sous-cutanée continue d'insuline (PSCI)
Fiasp ultra-fast-acting peut être administré par perfusion sous-cutanée continue d'insuline (PSCI) à l'aide d'une pompe à perfusion d'insuline qui convient à la perfusion d'insuline. Fiasp ultra-fast-acting peut être administré selon les instructions fournies par le fabricant de la pompe, de préférence dans l'abdomen. Une rotation des sites de perfusion devra être effectuée au sein d'une même région afin de diminuer le risque de développer une lipodystrophie. En cas d'utilisation dans une pompe à perfusion d'insuline, Fiasp ultra-fast-acting ne doit pas être dilué ou mélangé à d'autres insulines.
Flacon perforable
Les patients traités par PSCI recevront des instructions sur l'utilisation de la pompe et utiliseront le réservoir et la tubulure adaptés à la pompe (voir sous «Informations supplémentaires»). Le matériel de perfusion (tubulure et canule) doit être remplacé conformément aux instructions données dans la notice d'information jointe au matériel de perfusion.
PumpCart®
Les patients traités par PSCI doivent recevoir des instructions sur l'utilisation du système de pompe et utiliser la tubulure adaptée pour la pompe (voir sous «Informations supplémentaires»). Le matériel de perfusion (tubulure et canule) doit être remplacé conformément aux instructions données dans la notice d'information jointe au matériel de perfusion.
Flacon perforable / PumpCart®
Lorsque Fiasp ultra-fast-acting est administré en PSCI, le patient doit avoir été formé à l'administration de l'insuline par injection et doit disposer d'un autre système d'administration d'insuline qu'il utilisera en cas de panne de la pompe.
Contre-indicationsHypersensibilité au principe actif ou à l'un des excipients conformément à la composition.
Mises en garde et précautionsHypoglycémie
Chez le diabétique traité à l'insuline, il existe en principe un risque d'hypoglycémie légère ou sévère.
Ces phénomènes se présentent en particulier au début du traitement, lors d'un changement de préparation, d'injections irrégulières, de repas irréguliers, ainsi que plus généralement lors de diabète mal ou non équilibré, pouvant causer de fortes variabilités de la glycémie, par exemple une hypoglycémie. En outre, les patients ayant déjà été atteints d'hypoglycémie sévère présentent un risque accru de récidive. Afin que le patient soit en mesure de prévenir suffisamment tôt une hypoglycémie, il y a lieu de lui recommander de se munir constamment de sucre de raisin, de sucre en morceaux ou d'un autre aliment équivalent. Il doit aussi porter sur lui sa carte de diabétique.
L'omission d'un repas ou un exercice physique non prévu peuvent conduire à une hypoglycémie.
Une hypoglycémie peut apparaître lorsque la dose d'insuline est trop élevée par rapport au besoin d'insuline (voir sous «Effets indésirables»).
Lorsque des patients changent de type d'insuline, les symptômes annonciateurs précoces d'une hypoglycémie peuvent être différents ou moins marqués qu'avec l'insuline utilisée précédemment.
Chez les patients présentant un état métabolique nettement amélioré (p.ex. en raison d'une insulinothérapie intensifée), certains ou tous les symptômes annonciateurs de l'hypoglycémie peuvent dans certaines circonstances rester silencieux. Ces patients doivent être prévenus de ce problème. Chez des patients présentant un diabète depuis longtemps, les symptômes d'alerte habituels pourraient disparaître.
Le moment d'apparition de l'hypoglycémie reflète généralement le profil d'action de la formulation d'insuline administrée.
Fiasp ultra-fast-acting a une efficacité spéciale (voir sous «Propriétés/Effets»), ce qui affecte le moment de l'hypoglycémie. Au cours des deux premières heures consécutives à l'injection, les propriétés pharmacodynamiques de Fiasp ultra-fast-acting engendrent plus d'hypoglycémies que d'autres insulines bolus.
L'entrée en action plus rapide de Fiasp ultra-fast-acting est un facteur dont il faut tenir compte dans le traitement des patients dont la vidange gastrique est retardée.
Les maladies concomitantes au niveau des reins, du foie ou des glandes surrénales, hypophysaire ou thyroïdienne peuvent nécessiter un ajustement de la dose d'insuline.
Enfants et adolescents
Une surveillance étroite du taux de sucre dans le sang est recommandée lorsque ce médicament est utilisé après le début du dernier repas de la journée afin d'éviter l'hypoglycémie nocturne (voir sous «Effets indésirables»).
Hyperglycémie
L'utilisation de doses inadaptées ou l'arrêt du traitement, en particulier pour le diabète de type 1, peut conduire à une hyperglycémie et à une acidocétose diabétique, situations qui sont potentiellement létales.
Perfusion sous-cutanée continue d'insuline (PSCI)
Le mauvais fonctionnement d'une pompe ou du matériel de perfusion peut entraîner l'apparition rapide d'une hyperglycémie et d'une cétose. Il est impératif d'identifier et de corriger rapidement la cause de l'hyperglycémie ou de la cétose. Un traitement provisoire par injection sous-cutanée pourra être nécessaire.
Association de Fiasp ultra-fast-acting et de pioglitazone
Il existe des rapports spontanés de cas d'insuffisance cardiaque apparus lorsque de la pioglitazone a été administrée en association avec de l'insuline, en particulier à des patients présentant des facteurs de risque de développement d'insuffisance cardiaque. Il faut en tenir compte lorsqu'un traitement avec l'association de pioglitazone et de préparations insuliniques est envisagé. Lorsque l'association est utilisée, les patients devraient être suivis quant à des signes et des symptômes d'insuffisance cardiaque, de prise de poids et d'œdèmes. La pioglitazone doit être arrêtée lors de chaque aggravation de symptômes cardiaques.
Risques associés à l'intensification du contrôle glycémique
L'initiation ou l'intensification du contrôle glycémique a été associée à des troubles oculaires (p.ex. à un trouble réversible et transitoire de la réfraction oculaire, une aggravation de la rétinopathie diabétique), à une neuropathie périphérique aiguë et douloureuse et à un œdème périphérique, en particulier lors d'une réduction trop rapide de la glycémie. Toutefois, un contrôle glycémique à long terme réduit le risque de rétinopathie diabétique et de neuropathie.
Anticorps anti-insuline
L'administration d'insuline peut induire la formation d'anticorps anti-insuline. Dans de rares cas, la présence d'anticorps anti-insuline peut nécessiter un ajustement de la dose d'insuline afin de corriger une tendance à l'hyperglycémie ou à l'hypoglycémie.
Excipients
Fiasp ultra-fast-acting contient du métacrésol qui, dans de rares cas, peut provoquer des réactions allergiques.
Voyages avec changement de fuseau horaire
Avant d'effectuer un voyage avec un changement de fuseau horaire, le patient doit demander l'avis d'un médecin, car cela peut vouloir dire qu'il est amené à administrer l'insuline et à prendre les repas à des heures différentes.
En prévention de confusions accidentelles/erreurs médicamenteuses
Les patients doivent avoir pour consigne de toujours vérifier l'étiquette de l'insuline avant chaque injection afin d'éviter les confusions accidentelles entre Fiasp ultra-fast-acting et les autres insulines.
Les patients doivent contrôler visuellement le nombre d'unités de la dose avant l'administration de Fiasp ultra-fast-acting. Pour pouvoir réaliser eux-mêmes leurs injections, les patients doivent donc être en mesure de lire le compteur de dose. Les patients aveugles ou malvoyants doivent avoir pour consigne de toujours demander l'aide d'une autre personne ayant une bonne vue et formée à l'administration des insulines.
Utilisation incorrecte de Fiasp PumpCart® PumpCart®.
Fiasp ultra-fast-acting PumpCart® est destiné à être utilisé uniquement avec un système de pompe à perfusion d'insuline conçu pour être utilisé avec cette cartouche. Il ne doit pas être utilisé avec un autre dispositif qui n'est pas conçu pour Fiasp ultra-fast-acting PumpCart® car cela pourrait entraîner un dosage incorrect de l'insuline et une hyper- ou hypoglycémie.
InteractionsUn certain nombre de médicaments sont connus pour interagir avec le métabolisme du glucose.
1. Le besoin d'insuline peut diminuer en présence de substances qui améliorent l'effet de l'insuline (augmentent la sensibilité à l'insuline), augmentent la sécrétion d'insuline, inhibent la gluconéogenèse hépatique ou influencent l'absorption intestinale de glucose. Avec une quantité constante d'insuline, le risque d'hypoglycémie est par conséquent augmenté lors de la prise simultanée de:
Agents hypoglycémiants oraux (AHO); alcool; inhibiteurs de l'ECA (p.ex. captopril et énalapril); substances antiarythmiques comme le disopyramide; alpha-bloquants et clonidine; ISRS; fenfluramine; inhibiteurs de la MAO; antidépresseurs tricycliques; salicylés et (dans de rares cas) d'autres AINS; fibrates; tétracyclines, pentamidine (hypoglycémie; occasionnellement suivie d'une hyperglycémie); antimalariens (quinine, chloroquine, méfloquine); sulfonamides (p.ex. cotrimoxazole); cimétidine et ranitidine; agonistes des récepteurs du GLP-1 et stéroïdes anabolisants.
2. Le besoin d'insuline peut augmenter lors de la prise/de l'application simultanée des substances ou des groupes de substances suivants:
Contraceptifs oraux et autres préparations estrogéniques ou progestatives; les corticostéroïdes et l'ACTH; la GH (somatotropine); le danazol; les hormones thyroïdiennes, les sympathicomimétiques (surtout les β2-sympathicomimétiques comme la ritodrine, le salbutamol, la terbutaline, mais également des sympathicomimétiques α-sélectifs ainsi que non sélectifs comme l'épinéphrine); le diazoxide; l'acide nicotinique et ses dérivés; la chlorpromazine (surtout à des doses élevées) et d'autres dérivés de la phénothiazine; les diurétiques (p.ex. les diurétiques thiazidiques, l'indapamide et le furosémide); les substances anti-rétrovirales; les substances immunosuppressives (ciclosporine, tacrolimus, sirolimus), les antipsychotiques atypiques.
3. L'emploi des substances ci-après peut renforcer ou affaiblir, selon la dose, l'effet de l'insuline:
Dérivés de l'octréotide, du lanréotide, de l'acide salicylique, des sels de lithium (rare).
Les bêta-bloquants peuvent entraîner un renforcement de la résistance à l'insuline mais également, dans certains cas, une hypoglycémie. En outre, les symptômes d'alerte de l'hypoglycémie peuvent être affaiblis ou masqués.
Grossesse, allaitementGrossesse
Il n'existe jusqu'à présent aucune donnée sur l'utilisation de Fiasp ultra-fast-acting pendant la grossesse.
Les données issues de deux études cliniques contrôlées randomisées avec 171 grossesses exposées à NovoRapid® ne laissent pas supposer que l'insuline asparte provoque des effets secondaires sur la grossesse ou la santé du foetus/du nouveau-né par comparaison avec l'insuline humaine.
Un contrôle intensif de la glycémie ainsi que des contrôles plus fréquents de la glycémie sont recommandés chez les femmes enceintes atteintes d'un diabète (diabète de type 1, diabète de type 2 ou diabète gestationnel) ainsi que chez les femmes diabétiques qui prévoient une grossesse.
Aussi bien l'hypoglycémie que l'hyperglycémie susceptibles d'apparaître lors d'un traitement du diabète insuffisamment contrôlé augmentent le risque de malformation et de mort fœtale in utéro. C'est pourquoi les femmes atteintes de diabète et qui planifient une grossesse ou qui sont déjà enceintes doivent faire l'objet d'une surveillance plus intense.
Au cours du premier trimestre, le besoin d'insuline baisse habituellement, mais il augmente ensuite au cours du deuxième et du troisième trimestre.
Après l'accouchement, le besoin d'insuline revient rapidement aux valeurs d'avant la grossesse.
Allaitement
L'insulinothérapie de la mère qui allaite son nouveau-né ne comporte aucun risque pour ce dernier. Il peut toutefois être nécessaire d'adapter la posologie de Fiasp ultra-fast-acting, les habitudes alimentaires ou les deux.
Effet sur l’aptitude à la conduite et l’utilisation de machinesUn épisode hypoglycémique peut modifier les facultés de concentration et de réaction du patient, pouvant constituer un risque potentiel dans des situations où ces facultés sont particulièrement importantes (par exemple lors de la conduite d'un véhicule ou l'utilisation d'une machine).
Il sera conseillé aux patients de prendre les précautions nécessaires afin d'éviter toute hypoglycémie pendant la conduite d'un véhicule, en particulier chez les patients souffrant de fréquents épisodes hypoglycémiques ou peu ou pas du tout familiarisés avec les signes précurseurs de l'hypoglycémie. Dans de telles circonstances, la capacité à la conduite de véhicules ou à l'utilisation de machines doit être évaluée.
Effets indésirablesRésumé du profil de sécurité
L'effet indésirable le plus fréquemment rapporté lors du traitement est l'hypoglycémie (voir sous «Description de certains effets indésirables» ci-dessous).
Effets indésirables lors des études cliniques
Les effets indésirables répertoriés ci-dessous sont issus des données d'essais cliniques comprenant six essais cliniques terminés chez des adultes. Dans cinq essais, Fiasp ultra-fast-acting a été comparé à NovoRapid® et dans un essai, il a été comparé à l'utilisation de l'insuline basale seule. Dans les six études, 2 163 patients ont été traités avec Fiasp ultra-fast-acting; 1 707 de ces patients avaient un diabète sucré de type 1, dont 261 ont utilisé une PSCI, et 456 patients avaient le diabète sucré de type 2. Voir sous «Propriétés/Effets» pour des informations détaillés concernant les études. Les effets indésirables sont classés selon les classes de systèmes d'organes MedDRA: les fréquences des effets secondaires ont été définies de la manière suivante: très fréquents (>1/10), fréquents (>1/100, <1/10), occasionnels (>1/1 000, <1/100), rares (≥1/10 000, <1/1 000), très rares (<1/10 000).
Tableau 1: Effets indésirables issus des essais cliniques
|
Classes de systèmes d'organes MedDRA
|
Très fréquents
|
Fréquents
|
Peu fréquents
| |
Affections du système immunitaire
|
|
|
Hypersensibilité
| |
Troubles du métabolisme et de la nutrition
|
Hypoglycémie
|
|
| |
Affections de la peau et du tissu sous-cutané
|
|
Manifestations allergiques cutanées*
|
Lipodystrophie
| |
Troubles généraux et anomalies au site d'administration
|
|
Réactions au site d'injection/de perfusion
|
|
* Les réactions allergiques cutanées comprennent les phénomènes suivants: eczéma, éruption cutanée, prurit, urticaire et dermatite.
Effets indésirables après la mise sur le marché
Aucun effet négatif supplémentaire n'a été observé après la mise sur le marché.
Description de certains effets secondaires
Troubles du système immunitaire
Réactions allergiques
Les manifestations allergiques cutanées rapportées avec Fiasp ultra-fast-acting (1,8% vs. 1,5% avec la préparation de comparaison) comprenaient de l'eczéma, un rash, un rash prurigineux, une urticaire et une dermatite.
Avec Fiasp ultra-fast-acting, des réactions d'hypersensibilité généralisée (se manifestant par un rash cutané généralisé et un œdème facial) ont été rapportées occasionnellement (0,2% vs. 0,3% avec la préparation de comparaison). Aucune réaction anaphylactique n'a été rapportée avec Fiasp ultra-fast-acting. D'après les données recueillies après la mise sur le marché, des formes graves d'allergies systémiques peuvent apparaître.
Des réactions allergiques de type immédiat, soit à l'insuline elle-même soit aux excipients, peuvent potentiellement engager le pronostic vital.
Troubles du métabolisme et de l'alimentation
Hypoglycémie
L'hypoglycémie peut survenir lorsque la dose d'insuline est trop importante par rapport aux besoins insuliniques. L'hypoglycémie sévère peut entraîner une perte de connaissance et/ou des convulsions et peut causer une altération transitoire ou définitive des fonctions cérébrales, voire le décès. Les symptômes de l'hypoglycémie surviennent habituellement de manière soudaine. Ils peuvent inclure: sueurs froides, pâleur et froideur cutanées, fatigue, nervosité ou tremblement, anxiété, asthénie ou faiblesse inhabituelles, confusion, difficulté de concentration, somnolence, sensation de faim excessive, troubles visuels, maux de tête, nausées et palpitations.
Lors des études cliniques, les taux d'hypoglycémies chez les patients traités à Fiasp ultra-fast-acting et à NovoRapid® étaient proches. Néanmoins, l'hypoglycémie peut survenir plus rapidement après une injection/perfusion de Fiasp ultra-fast-acting par rapport à NovoRapid® à la suite d'une injection/perfusion en raison de la pharmacodynamique de Fiasp ultra-fast-acting. Quant aux données issues d'études cliniques relatives aux taux d'hypoglycémie pendant les deux premières heures après les repas, voir sous «Propriétés/Effets».
Maladies de la peau et du tissu sous-cutané
Lipodystrophie
Des cas de lipodystrophie (notamment la lipohypertrophie, la lipoatrophie) ont été rapportés au site d'injection/de perfusion chez les patients traités par Fiasp ultra-fast-acting (0,5% vs. 0,2% pour la préparation de comparaison). Une rotation continue des sites d'injection dans une même région peut aider à diminuer le risque de développer ces réactions.
Troubles généraux et réactions au site d'administration
Réactions au site d'injection/de perfusion
Des réactions au site d'injection (notamment rash, rougeur, inflammation, douleurs et ecchymose) ont été rapportées chez les patients traités avec Fiasp (1,3% vs. 1,0% pour la préparation de comparaison). Des réactions au site de perfusion (notamment rougeur, inflammation, irritation, douleur, ecchymose et démangeaisons) ont été rapportées chez des patients traités avec Fiasp ultra-fast-acting (10,0% vs. 8,3% pour la préparation de comparaison).Ces réactions sont habituellement légères et transitoires et disparaissent généralement lors de la poursuite du traitement.
Enfants et adolescents
Fiasp ultra-fast-acting a été administré à des enfants et des adolescents âgés de 6 à 18 ans pour étudier les propriétés pharmacocinétiques du médicament (voir la rubrique «Propriétés/Effets»).
La sécurité et l'efficacité ont été étudiées dans une étude de confirmation chez des enfants et des adolescents atteints de diabète sucré de type 1 âgés de ≥1 à <18 ans. Dans cette étude, 519 patients ont été traités avec Fiasp ultra-fast-acting. Dans une étude clinique chez les enfants et les adolescents, l'administration post-prandiale de Fiasp ultra-fast-acting (20 minutes après le début d'un repas) comparée à l'administration préprandiale de NovoRapid® a montré une augmentation numérique du taux d'hypoglycémie grave (RR: 2,11 [0,63; 7,02]IC à 95%) et un taux accru d'hypoglycémie nocturne cliniquement significative (RR: 1,50 [1,09; 2,08]IC à 95%). Cette augmentation n'a pas été observée avec l'administration préprandiale de Fiasp ultra-fast-acting par rapport à NovoRapid® (RR: 0,77 [0,17; 3,45]IC à 95%).
Dans l'ensemble, la fréquence, le type et la gravité des effets indésirables dans la population pédiatrique n'ont pas indiqué de différence par rapport à l'expérience dans la population adulte diabétique. La lipodystrophie (y compris la lipohypertrophie, la lipoatrophie) au point d'injection a été signalée plus fréquemment dans cette étude chez les patients pédiatriques que dans les études chez les adultes (voir ci-dessus). La lipodystrophie a été signalée dans la population pédiatrique avec une fréquence de 2,1% pour Fiasp ultra-fast-acting contre 1,6% pour NovoRapid®.
Populations particulières
D'après les résultats des essais cliniques, la fréquence, le type et la sévérité des effets indésirables observés chez les patients âgés ou chez les patients présentant des troubles rénaux ou hépatiques ne montrent aucune différence avec l'expérience acquise plus largement dans la population générale. Fiasp ultra-fast-acting a été administré chez des patients âgés pour étudier ses propriétés pharmacocinétiques (voir sous «Pharmacocinétique»).
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageUn surdosage spécifique pour l'insuline ne peut pas être défini.
Une hypoglycémie peut toutefois se développer progressivement lorsque des doses d'insuline trop élevées par rapport aux besoins d'insuline sont administrées.
·Les hypoglycémies modérées peuvent être traitées par l'administration par voie orale de glucose ou d'autres aliments contenant du sucre. On recommande aux diabétiques d'avoir toujours sur eux quelques morceaux de sucre ou d'autres aliments contenant du sucre (p.ex. des biscuits).
·Lors d'épisodes hypoglycémiques sévères, entraînant la perte de connaissance du patient, 0,5 à 1 mg de glucagon peuvent être administrés par voie intramusculaire ou sous-cutanée par une personne expérimentée, ou du glucose peut être injecté par voie intraveineuse par un médecin. Si le patient ne réagit pas en l'espace des 10 à 15 minutes après l'administration de glucagon, il faut également administrer du glucose par voie intraveineuse.
Dès que le patient a repris connaissance, il est recommandé de lui administrer des hydrates de carbone, afin de prévenir une rechute.
Propriétés/EffetsCode ATC
A10AB05
Mécanisme d'action
L'effet hypoglycémiant de l'insuline repose sur la capacité de la molécule d'augmenter l'absorption de glucose en se fixant sur des récepteurs de l'insuline au niveau des cellules musculaires et adipeuses. En même temps, elle inhibe la libération de glucose par le foie.
Pharmacodynamique
Fiasp ultra-fast-acting est une formulation d'insuline asparte prandiale à laquelle l'ajout de nicotinamide (vitamine B3) comme excipient permet d'accélérer l'absorption initiale de l'insuline en comparaison à NovoRapid®, et qui entraîne un effet hypoglycémiant précoce plus intense.
Chez les patients atteints d'un diabète de type 1 (données poolées issues de 3 études), la durée moyenne jusqu'à l'entrée en action de l'effet hypoglycémiant de Fiasp ultra-fast-acting est inférieure de 4,9 minutes à celle de NovoRapid® (différence estimée entre les traitements: -4,9 minutes [-6,9; -3,0] IC à 95%) et le délai d'attente moyen de l'effet maximum de Fiasp ultra-fast-acting (délai GIRmax) est estimé à 10,5 minutes de moins que celui de NovoRapid® (différence estimée entre les traitements: -10,5 minutes [-17,0; -4,0]IC à 95%). Les effets hypoglycémiants au cours des 30 premières minutes (AUC GIR, 0-30min) de Fiasp ultra-fast-acting à un dosage de 0,2 Ukg se sont révélés significativement plus élevés (74%) que ceux de NovoRapid® (rapport estimé: 1,74 [1,47; 2,10]IC à 95%). Une accélération des effets hypoglycémiants a été constatée pour des dosages de 0,1 U/kg à 0,4 U/kg. Les effets hypoglycémiants moyens globaux (GIR 0-12h) et les effets hypoglycémiants maximaux (GIRmax) de Fiasp ultra-fast-acting et de NovoRapid® sont similaires. À l'intérieur de la fourchette des doses thérapeutiques, les deux paramètres augmentent proportionnellement avec la dose.
Au cours d'une étude de phase 3 (3'852) effectuée avec des patients atteints d'un diabète de type 1 (N=1'143), Fiasp ultra-fast-acting entraîne comparativement à NovoRapid® (administrés tous deux avant le début d'un repas standard) une réduction nettement supérieure de l'augmentation glycémique postprandiale (écart entre les traitements quant à l'augmentation du taux glycémique 2 heures après un repas par rapport à la base de référence: -0,67 mmol/l [-1,29; -0,04]IC à 95%). Une étude de phase 3 similaire (3'853) menée auprès de patients atteints d'un diabète de type 2 (N=689) a fait ressortir un écart numérique (-0,36 mmol/l [-0,81; 0,08]IC à 95%).
La variabilité d'un jour à l'autre des données pharmacodynamiques AUCGIR, 0-1h, AUCGIR, 0-12h et GIRmax sont comparables à celles constatées pour NovoRapid®.
Efficacité clinique
Fiasp ultra-fast-acting a été étudié au cours de trois essais à long terme sur l'efficacité et la sécurité (de 18 à 26 semaines de traitement) chez 2 068 patients adultes randomisés, dont 1 143 atteints de diabète de type 1 et 925 atteints de diabète de type 2.
En outre, Fiasp ultra-fast-acting a été étudié chez 777 patients pédiatriques atteints de diabète de type 1 dans le cadre d'un essai randomisé sur l'efficacité et la sécurité à long terme (26 semaines de traitement). Aucun enfant de moins de 2 ans n'a été randomisé dans l'essai.
Patients atteints de diabète de type 1
L'effet du traitement de Fiasp ultra-fast-acting sur le contrôle glycémique a été évalué lorsqu'il était administré au moment du repas ou après le repas. Lors d'administration prandiale de Fiasp ultra-fast-acting, la diminution de l'HbA1c était statistiquement significativement plus importante que lors de l'administration de NovoRapid® (Fig. 1, Tableau 2). Un meilleur contrôle glycémique global a été réalisé chez les patients diabétiques de type 1 traités avec Fiasp ultra-fast-acting.
Tableau 2: Résultats d'un essai clinique sur un schéma de type basal-bolus de 26 semaines chez des patients diabétiques de type 1
|
|
Administration prandiale de Fiasp ultra-fast-acting + insuline détémir
|
Administration post-prandiale de Fiasp ultra-fast-acting + insuline détémir
|
Administration prandiale de NovoRapid® + insuline détémir
| |
n
|
381
|
382
|
380
| |
HbA1c (%)
| |
Inclusion → Fin de l'essai
|
7,6 → 7,3
|
7,6 → 7,5
|
7,6 → 7,4
| |
Variation ajustée par rapport à l'inclusion
|
-0,32
|
-0,13
|
-0,17
| |
Différence estimée entre les traitements
|
-0,15 [-0,23; -0,07]CE
|
0,04 [-0,04; 0,12]D
|
| |
Patients (%) ayant atteint une HbA1c <7%
| |
Tous les patients
|
33,3
|
23,3
|
28,2
| |
Odds Ratio évalué
|
1,47 [1,02;2,13]CE
|
0,73 [0,49;1,07]D
|
| |
Hausse de la glycémie 2 heures après le repas (mmol/l)B
| |
Inclusion → Fin de l'essai
|
6,1 → 5,9
|
6,1 → 6,7
|
6,2 → 6,6
| |
Variation ajustée par rapport à l'inclusion
|
-0,29
|
0,67
|
0,38
| |
Différence estimée entre les traitements
|
-0,67 [-1,29; -0,04]CE
|
0,30 [-0,34; 0,93]D
|
| |
Taux observé d'hypoglycémies sévères ou confirmées par mesure glycémiqueB par patient-année d'exposition (pourcentage de patients)
|
59,0 (92,7)
|
54,4 (95,0)
|
58,7 (97,4)
| |
Taux estimé
|
1,01 [0,88; 1,15]C
|
0,92 [0,81; 1,06]D
|
| |
Taux observé d'hypoglycémiesB par patient-année d'exposition (pourcentage de patients)
|
0.25 (6.7)
|
0.26 (8.0)
|
0.27 (8.4)
| |
Taux estimé
|
0.87 [0.47; 1.62]C
|
0.93 [0.50;1.73]D
|
|
Les valeurs à l'inclusion et à la fin de l'essai correspondent à la moyenne des dernières valeurs disponibles observées. L'intervalle de confiance à 95% est indiqué entre crochets ‹[ ]›.
A Repas test
B Hypoglycémie sévère (épisode nécessitant l'intervention d'un tiers) ou hypoglycémie confirmée par mesure glycémique définie comme un épisode confirmé par une glycémie plasmatique <3,1 mmol/l, indépendamment des symptômes.
C Différence entre Fiasp ultra-fast-acting administré au moment du repas et NovoRapid® administré au moment du repas
D Différence entre Fiasp ultra-fast-acting administré après le repas et NovoRapid® administré au moment du repas
E Valeurs statistiquement significatives en faveur de Fiasp ultra-fast-acting administré au moment du repas
Chez les patients atteints d'un diabète de type 1, les taux observés dans les groupes de traitement d'épisodes d'hypoglycémie sévère ou d'épisodes d'hypoglycémie confirmées par mesure de la glycémie sont comparables (Fiasp ultra-fast-acting prandial, Fiast® ultra-fast-acting post-prandial et NovoRapid®, Tableau 2).
Au total, 6,7%, 8,0% et 8,4% des patients des groupes thérapeutiques traités avec Fiasp ultra-fast-acting prandial, Fiasp ultra-fast-acting postprandial et NovoRapid® ont subi au moins 1 épisode sévère d'hypoglycémie. Les taux s'élèvent à 0,25, 0,26 et 0,27 épisodes dans les trois groupes par patient-année d'exposition. Aucune différence statistiquement significative entre les traitements par Fiasp ultra-fast-acting prandial et postprandial et NovoRapid® n'a été observée (rapports estimés: Fiasp ultra-fast-acting prandial: NovoRapid®: 0,87 [0,47; 1,62]IC à 95%; Fiasp ultra-fast-acting postprandial: NovoRapid®: 0,93 [0,50; 1,73]IC à 95%).
Dans un intervalle de 2 heures après le début d'un repas, le taux observé d'hypoglycémies sévères ou d'hyperglycémies déterminées par mesure de la glycémie était plus élevé, mais sans présenter de différence statistiquement significative: 7,46 épisodes par patient-année d'exposition (66,8% des patients) sous Fiasp ultra-fast-acting prandial, contre 5,87 épisodes par patient-année d'exposition (66,1% des patients) sous NovoRapid®, données qui confirment les effets plus précoces et plus rapides de Fiasp ultra-fast-acting et son action sur la baisse de l'augmentation postprandiale de la glycémie constatés antérieurement.
Patients atteints d'un diabète sucré de type 2
Les patients atteints d'un diabète de type 2 sous traitement avec Fiasp ultra-fast-acting ont montré une efficacité comparable en matière de contrôle du taux glycémique à celle de NovoRapid® (différence entre les résultats concernant le changement intervenu de l'HbA1c: -0,02[-0,15;0,10]IC à 95%).
Les injections en bolus de Fiasp ultra-fast-acting au moment des repas principaux, en complément à un traitement à l'insuline basale et à la metformine, ont considérablement diminué l'HbA1c (différence entre les traitements: -0,94 [-1,17;-0,72]IC à 95%).
Patients âgés
Dans les trois études cliniques contrôlées, parmi les 1'219 patients diabétiques de type 1 ou de type 2 traités avec Fiasp ultra-fast-acting, 192 (16%) étaient âgés de 65 ans ou plus et 24 (2%) étaient âgés de 75 ans ou plus. Aucune différence n'a été observée entre les patients âgés et ceux plus jeunes en termes de sécurité ou d'efficacité.
La pharmacocinétique et la pharmacodynamique de Fiasp ultra-fast-acting ont été étudiées dans une étude croisée randomisée en double aveugle, chez des patients âgés (≥65 ans) atteints de diabète sucré de type 1. L'effet hypoglycémiant chez les patients âgés et chez les plus jeunes était similaire (Ratio ASCGIR, 0-12h 0,93 [0,73; 1,17] IC à 95%), bien que l'exposition à l'insuline asparte a été augmentée chez les patients âgés de 30% (rapport ASCIAsp, 0-12h 1,30 [1,07; 1,57]IC à 95%).
Enfants et adolescents
L'efficacité et la sécurité de Fiasp ultra-fast-acting ont été étudiées dans le cadre d'un essai clinique randomisé et contrôlé activement 1:1:1 chez des enfants et des adolescents atteints de diabète de type 1 âgés de 1 à 18 ans, sur une période de 26 semaines (n=777). Dans cet essai, l'efficacité et la sécurité de Fiasp ultra-fast-acting administré au moment du repas (0 à 2 minutes avant un repas) ou après le repas (20 minutes après le début d'un repas) et de NovoRapid® administré au moment du repas ont été comparées, chacun en combinaison avec l'insuline dégludec.
Le bras prandial Fiasp ultra-fast-acting comprenait 16 enfants âgés de 2 à 5 ans, 100 enfants âgés de 6 à 11 ans et 144 adolescents âgés de 12 à 17 ans. Le bras postprandial Fiasp ultra-fast-acting comprenait 16 enfants âgés de 2 à 5 ans, 100 enfants âgés de 6 à 11 ans et 143 adolescents âgés de 12 à 17 ans.
Fiasp ultra-fast-acting administré au moment du repas a montré un contrôle glycémique supérieur à celui de NovoRapid® prandial en termes de changement de l'HbA1c (différence de traitement estimée, DTE: -0,17% [-0,30; -0,03]IC à 95%). Fiasp ultra-fast-acting administré postprandial a montré un contrôle glycémique non inférieur à celui de NovoRapid® préprandial (DTE: 0,13% [-0,01; 0,26]IC à 95%).
Fiasp ultra-fast-acting administré au moment du repas a montré une amélioration statistiquement significative de l'augmentation moyenne de la glycémie postprandiale après 1 heure sur les trois principaux repas, par rapport à NovoRapid® (contrôle indépendant de la glycémie). Pour Fiasp ultra-fast-acting administré postprandial, cette comparaison était en faveur de NovoRapid® prandial. Aucune augmentation globale du risque d'hypoglycémie grave ou confirmée par la glycémie n'a été observée par rapport à NovoRapid®.
Les profils d'efficacité et de sécurité observés étaient comparables entre tous les groupes d'âge.
Plus d'informations
Perfusion sous-cutanée continue d'insuline (PSCI)
Fiasp ultra-fast-acting a montré un meilleur contrôle de la glycémie chez des patients atteints du diabète de type 1 par rapport à NovoRapid® au cours des 2 premières heures après un repas-test standardisé (différence entre les traitements concernant l'augmentation de la glycémie post-prandiale: -0,99 mmol/l [-1,95; -0,03]IC à 95%).
PharmacocinétiqueAbsorption
Comparé à NovoRapid®, Fiasp ultra-fast-acting se distingue par une exposition plus rapide et plus élévée au cours des 2 premières heures qui suivent l'injection/la perfusion.
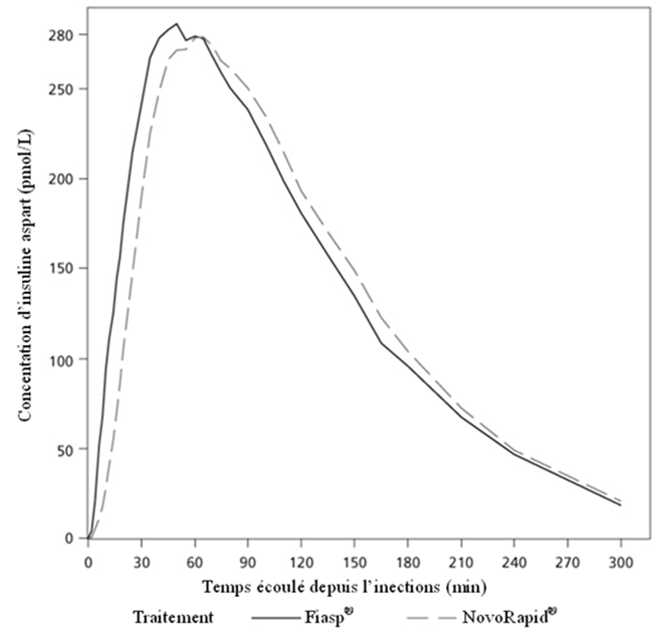
Lors d'une injection sous-cutanée de Fiasp ultra-fast-acting, l'insuline asparte était observée dans le système sanguin environ 4 minutes après son administration, soit près de 5 minutes plus vite qu'à la suite d'une injection sous-cutanée de NovoRapid®. L'obtention de 50% de la concentration maximale a pris 9 minutes de moins. L'exposition totale à l'insuline (Insuline asparte, 0–12 heures) et la concentration maximale d'insuline (Cmax) de Fiasp ultra-fast-acting et de NovoRapid® se sont révélées similaires (Tableau 3). À l'intérieur de la fourchette des doses thérapeutiques, ces niveaux de concentration totale et maximale augmentent proportionnellement aux doses sous-cutanées de Fiasp ultra-fast-acting administrées.
Tableau 3: Ratio du traitement (Fiasp ultra-fast-acting/NovoRapid®) de l'exposition à l'insuline après l'injection
|
Exposition précoce à l'insuline*
| |
ASCInsuline asparte, 0–15 min
|
3,83 [3,41; 4,29]
| |
ASCInsuline asparte, 0–30 min
|
2,01 [1,87; 2,17]
| |
ASCInsuline asparte, 0–1 h
|
1,32 [1,26; 1,39]
| |
ASCInsuline asparte, 0–1,5 h
|
1,16 [1,12; 1,21]
| |
ASCInsuline asparte, 0–2 h
|
1,10 [1,06; 1,14]
| |
Exposition totale à l'insuline*
| |
ASCInsuline asparte, 0–12 h
|
1,01 [0,98; 1,04]
| |
Cmax, Insuline asparte
|
1,04 [1,00; 1,08]
|
L'intervalle de confiance à 95% est indiqué entre cochets ‹[]›
* Basée sur l'insuline asparte libre dans le sérum; ASC = aire sous la courbe; Cmax = concentration maximale observée
Distribution
L'affinité de liaison de l'insuline asparte avec les protéines plasmatiques est faible (<10%), et similaire à celle observée avec l'insuline humaine de synthèse.
Métabolisme
La dégradation de l'insuline asparte est semblable à celle de l'insuline humaine. Tous les métabolites formés sont inactifs.
Elimination
Après administration sous-cutanée, la demi-vie de Fiasp ultra-fast-acting est de 57 minutes. Elle est comparable à celle de NovoRapid®.
Cinétique de groupes de patients particuliers
Troubles de la fonction hépatique
Une étude de pharmacocinétique à dose unique d'insuline asparte a été réalisée chez 24 sujets ayant une fonction hépatique normale à sévèrement altérée. Chez les sujets ayant une insuffisance hépatique, le taux d'absorption était diminué et plus variable.
Troubles de la fonction rénale
L'impact d'une insuffisance rénale sur l'exposition totale à l'insuline Fiasp ultra-fast-acting repose sur des résultats d'analyses pharmacocinétiques effectuées auprès de diverses populations de patients atteints d'un diabète de type 1. La fonction rénale a été définie comme suit au moyen de la clairance de la créatinine (CLcr): ≥90 ml/min (normal) (N=546), 60–89 ml/min (légère) (N=115), 30–59 ml/min (modérée) (N=21). Une exposition totale plus élevée à l'insuline Fiasp ultra-fast-acting a été constatée avec la diminution de la fonction rénale. Une certaine variabilité entre les patients diabètiques de type 1 atteints d'insuffisance rénale légère ou modérée a toutefois été constatée. Il convient alors d'intensifier les contrôles glycémiques et d'adapter la posologie de Fiasp ultra-fast-acting à chaque patient, comme pour toutes les insulines.
Patients âgés
Chez des patients âgés atteints du diabète de type 1, Fiasp ultra-fast-acting présentait un délai d'exposition plus rapide et une exposition précoce à l'insuline plus élevée que NovoRapid®, tout en assurant une exposition totale et une concentration maximale similaires à celles de NovoRapid®.
L'incidence de l'âge sur l'ensemble de l'exposition à l'insuline Fiasp ultra-fast-acting a été évaluée lors d'une analyse pharmacocinétique menée chez différentes populations de patients atteints de diabète de type 1. Aucune corrélation n'a été observée entre l'exposition totale à l'insuline et l'âge (tranche d'âge de 18 à 83 ans).
Enfants et adolescents
Le délai d'exposition et l'exposition précoce à l'insuline Fiasp ultra-fast-acting chez les enfants (de 6 à 11 ans) et les adolescents (de 12 à 18 ans) étaient similaires à ceux des adultes. L'exposition totale de Fiasp ultra-fast-acting était plus faible chez les enfants et les adolescents par rapport aux adultes, alors que les concentrations sériques maximales d'insuline asparte étaient similaires entre les groupes d'âge.
Données précliniquesLes données précliniques issues des études conventionnelles de pharmacologie de sécurité, toxicologie chronique, génotoxicité, et des fonctions de reproduction après exposition à l'insuline asparte n'ont pas révélé de risque particulier pour l'homme. Lors des essais in vitro évaluant à la fois la liaison aux récepteurs de l'insuline et de l'IGF-1 et les effets sur la croissance cellulaire, l'insuline asparte s'est comportée de façon très similaire à l'insuline humaine. Les études ont également montré que la dissociation de la liaison de l'insuline asparte sur le récepteur à l'insuline était identique à celle de l'insuline humaine.
Les études sur la reproduction animale n'ont mis en évidence aucune différence entre l'insuline asparte et l'insuline humaine en termes d'embryotoxicité ou d'effets tératogènes.
Remarques particulièresTenir hors de la portée et de la vue des enfants.
Incompatibilités
Les substances ajoutées à Fiasp ultra-fast-acting peuvent causer une dégradation de l'insuline asparte.
Fiasp ultra-fast-acting ne doit jamais être dilué et mélangé à d'autres médicaments, excepté avec les solutions de perfusion décrites sous «Posologie».
Durée de conservation
Avant la première ouverture: 30 mois. Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Remarques concernant le stockage
Fiasp ultra-fast-acting, FlexTouch® 100 unités/ml solution injectable en stylo prérempli
Avant la première ouverture: à conserver au réfrigérateur (entre 2 et 8°C). Ne pas congeler.
Après ouverture ou gardé sur soi en réserve: ne pas conserver au-dessus de 30°C. Peut être conservé au réfrigérateur (entre 2 et 8°C). Ne pas congeler. Utiliser dans les 4 semaines. Conserver le capuchon sur le stylo, à l'abri de la lumière.
Fiasp ultra-fast-acting, FlexTouch® 100 unités/ml, solution injectable en cartouche
Avant la première ouverture: à conserver au réfrigérateur (2-8°C). Ne pas congeler.
Après ouverture ou gardé sur soi en réserve: ne pas conserver au-dessus de 30°C. Ne pas congeler. Utiliser dans les 4 semaines. Conserver la cartouche dans l'emballage extérieur à l'abri de la lumière.
Fiasp ultra-fast-acting, FlexTouch® 100 unités/ml, solution injectable en flacon perforable
Avant la première ouverture: à conserver au réfrigérateur (2-8°C). Ne pas congeler.
Après ouverture ou gardé sur soi en réserve: ne pas conserver au-dessus de 30°C. Peut être conservé au réfrigérateur (2-8°C). Ne pas congeler. Utiliser dans les 4 semaines. Conserver le flacon perforable dans l'emballage extérieur à l'abri de la lumière.
Fiasp ultra-fast-acting PumpCart® 100 unités/ml solution injectable en flacon perforable
Avant la première ouverture: à conserver au réfrigérateur (2-8°C). Ne pas congeler.
Après ouverture ou gardé sur soi en réserve: le médicament peut être conservé à moins de 30°C pendant un maximum de 2 semaines, puis utilisé pendant un maximum de 7 jours s'il est conservé à moins de 37°C (période d'utilisation). Conserver la cartouche dans l'emballage extérieur jusqu'à son utilisation pour la protéger des dommages. Ne pas congeler.
Fiasp ultra-fast-acting ne doit pas être utilisé si la solution n'est pas limpide et incolore. Fiasp ultra-fast-acting ne doit pas être utilisé s'il a été congelé.
Remarques concernant la manipulation
Fiasp ultra-fast-acting, FlexTouch® 100 unités/ml solution injectable en stylo prérempli
Les aiguilles et Fiasp ultra-fast-acting, FlexTouch® ne doivent pas être partagés. Le stylo ne doit pas être rerempli.
Fiasp ultra-fast-acting, Penfill® 100 unités/ml, solution injectable en cartouche
Les aiguilles et Fiasp ultra-fast-acting Penfill® ne doivent pas être partagés. La cartouche ne doit pas être préremplie.
Perfusion sous-cutanée continue d'insuline (PSCI)
Fiasp ultra-fast-acting en flacon perforable
Les aiguilles et les seringues ne doivent pas être partagées.
Fiasp ultra-fast-acting peut être utilisé dans une pompe à perfusion (PSCI) pendant 9 jours, comme décrit dans la rubrique Posologie/Mode d'emploi. Les tubulures dont le revêtement interne est en polyéthylène ont été évaluées et sont compatibles avec l'utilisation d'une pompe.
Le patient doit jeter l'aiguille après chaque injection.
Fiasp ultra-fast-acting PumpCart®
Comme décrit dans la rubrique «Posologie/Mode d'emploi», Fiasp ultra-fast-acting PumpCart® est destiné à être utilisé uniquement avec un système PSCI conçu pour être utilisé avec cette cartouche, Fiasp ultra-fast-acting PumpCart® peut être utilisé jusqu'à 7 jours à une température inférieure à 37°C dans un système de pompe à perfusion. Les tubulures dont le revêtement interne est en polyéthylène ont été évaluées au cours de l'évaluation et sont compatibles. La cartouche est pré-remplie et peut être utilisée directement dans la pompe. Pour garantir un dosage correct, Fiasp ultra-fast-acting PumpCart® ne doit pas être utilisé dans un stylo à insuline.
Fiasp ultra-fast-acting, FlexTouch® 100 unités/ml solution injectable en stylo prérempli
En cas d'urgence survenant chez un utilisateur de Fiasp ultra-fast-acting (hospitalisation ou dysfonctionnement du stylo d'insuline), Fiasp ultra-fast-acting peut être prélevé du stylo prérempli à l'aide d'une seringue à insuline de 100 U.
Fiasp ultra-fast-acting, FlexTouch® 100 unités/ml, solution injectable en cartouche
En cas d'urgence survenant chez un utilisateur de Fiasp ultra-fast-acting (hospitalisation ou dysfonctionnement du stylo d'insuline), Fiasp ultra-fast-acting peut être prélevé de la cartouche à l'aide d'une seringue à insuline de 100 U.
Tout déchet doit être éliminé conformément à la réglementation en vigueur.
Numéro d’autorisation66200, 66201, 66202, 67809 (Swissmedic)
PrésentationFiasp ultra-fast-acting
Emballages unitaires avec flacons perforables à 10 ml (100 U/ml): 1 [B]
Fiasp ultra-fast-acting, Penfill®
Cartouches de 3 ml (100 U/ml; 300 U par Penfill®) destinées à l'emploi dans des appareils d'injection Novo Nodisk: 5 [B]
Fiasp ultra-fast-acting, FlexTouch®
Stylos préremplis de 3 ml (100 U/ml; 300 U par FlexTouch®): 5 [B]
Fiasp ultra-fast-acting PumpCart®
5 cartouches de 1,6ml de solution chacune avec un piston et un bouchon en caoutchouc [B].
Titulaire de l’autorisationNovo Nordisk Pharma AG, Zürich
Mise à jour de l’informationOctobre 2020.
|

