Propriétés/EffetsCode ATC:
C10AX16
Mécanisme d'action
L'inclisiran est un hypocholestérolémiant constitué d'un petit acide ribonucléique interférent (pARNi) double brin, conjugué sur le brin sens avec une Nacétylgalactosamine (GalNAc) tri-antennaire pour faciliter son absorption par les hépatocytes. Dans les hépatocytes, l'inclisiran utilise le mécanisme d'interférence de l'ARN et dirige la dégradation catalytique de l'ARN messager (ARNm) codant pour la proprotéine convertase subtilisine/kexine de type 9 (PCSK9). Ce phénomène augmente le recyclage des récepteurs du LDL-C et leur expression à la surface des hépatocytes, ce qui augmente l'absorption du LDL-C et diminue le taux de LDL-C dans le sang.
Pharmacodynamique
Une réduction du LDL-C a été mise en évidence dans les 14 jours suivant une administration sous-cutanée unique de 284 mg de Leqvio. 30 à 60 jours après l'administration, une diminution moyenne du taux de LDL-C de 49% à 51% a été observée. Au jour 180, les taux de LDL-C étaient toujours réduits d'environ 53%.
Dans les études de phase III, après quatre administrations de Leqvio les jours 1, 90, 270 et 450, le LDL-C, le cholestérol total, l'Apo-B, le cholestérol non HDL et la Lp(a) étaient réduits chez les patients atteints d'hypercholestérolémie et de dyslipidémie mixte.
Électrophysiologie cardiaque
Dans une étude croisée à 3 volets randomisée, en double aveugle, contrôlée par placebo, incluant une préparation de comparaison active (moxifloxacine), 48 participants sains ont reçu un traitement sous-cutané par 852 mg d'inclisiran (soit trois fois la dose maximale recommandée), moxifloxacine et placebo. À la dose suprathérapeutique d'inclisiran, on n'a pas observé d'allongement de l'intervalle QTc ni d'augmentation d'un autre paramètre à l'ECG.
Efficacité clinique
Efficacité clinique dans l'hypercholestérolémie et la dyslipidémie mixte
Dans les études cliniques et dans quelques publications, la dose de 284 mg d'inclisiran est équivalente et fait référence à 300 mg de sel de sodium d'inclisiran.
L'efficacité de l'inclisiran a été évaluée dans trois études de phase III chez des patients présentant une maladie cardiovasculaire athéroscléreuse (MCVAS) (maladie coronarienne, maladie vasculaire cérébrale ou artériopathie oblitérante périphérique), un risque équivalent à celui d'une MCVAS (diabète de type 2, hypercholestérolémie familiale ou un risque sur 10 ans d'événement cardiovasculaire d'au moins 20% selon le score de risque de Framingham ou un score de risque équivalent) et/ou une hypercholestérolémie familiale (HF). Les patients prenaient une dose maximale tolérée d'une statine avec ou sans autres traitements modificateurs des lipides, et ils avaient besoin d'une réduction supplémentaire du LDL-C. Environ 17% des patients présentaient une intolérance aux statines. Les patients ont reçu des injections sous-cutanées de 284 mg de Leqvio ou de placebo les jours 1, 90, 270 et 450. Les patients ont été suivis jusqu'au jour 540.
Dans l'analyse groupée de la phase III, Leqvio administré par voie sous-cutanée a réduit dès le jour 90 le taux de LDL-C de 50 à 55% (figure 1); cette diminution a été maintenue pendant le traitement à long terme. La réduction maximale du LDL-C a été atteinte le jour 150 après une deuxième administration. Des réductions faibles mais significativement plus élevées d'un point de vue statistique allant jusqu'à 65% ont été associées à des taux initiaux de LDL-C plus faibles (environ < 2 mmol/l [77 mg/dl]), à des taux initiaux de PCSK9 plus élevés et à des doses et à des intensités de statine plus élevées.
La réduction du LDL-C a été observée dans tous les sous-groupes: âge, couleur de peau, sexe, région, indice de masse corporelle, risque selon le programme américain national d'éducation sur le cholestérol (NCEP, National Cholesterol Education Program), tabagisme, facteurs de risque de coronaropathie à l'état initial, antécédents familiaux de coronaropathie, statut de tolérance au glucose (c'est-à-dire, diabète de type 2, syndrome métabolique ou aucun des deux), hypertension et taux de triglycérides à l'état initial.
L'inclisiran a aussi réduit le cholestérol non HDL, l'Apo-B, le cholestérol total et la Lp(a) chez les patients atteints d'hypercholestérolémie et de dyslipidémie mixte. Il n'y a pas eu de modifications cliniquement significatives du HDL-c ni des triglycérides.
Figure 1: Variation moyenne en pourcentage du taux de LDL-C par rapport à la valeur initiale chez les patients atteints d'hypercholestérolémie ou de dyslipidémie mixte traités par Leqvio vs sous placebo (analyse groupée)

MCVAS et risque équivalent à celui d'une MCVAS
Deux études ont été menées avec des patients atteints de MCVAS et présentant un risque équivalent à celui d'une MCVAS (ORION-10 et ORION-11). Les patients ont reçu une dose maximale tolérée d'une statine avec ou sans autre traitement modificateur des lipides, comme p.ex. l'ézétimibe, et avaient besoin d'une réduction supplémentaire du taux de LDL-C. Les patients ont reçu des injections sous-cutanées de 284 mg de Leqvio ou de placebo les jours 1, 90, 270 et 450. Les co-critères d'évaluation principaux, dans chaque étude, étaient la variation en pourcentage du taux de LDL-C entre l'état initial et le jour 510 comparativement au placebo et la variation en pourcentage ajustée en fonction du temps du taux de LDL-C entre l'état initial et les jours 90 et 540 afin d'évaluer l'effet intégré sur les taux de LDL-C dans le temps. Les critères d'évaluation secondaires importants étaient la variation absolue du taux de LDL-C entre l'état initial et le jour 510, la variation absolue ajustée en fonction du temps du taux de LDL-C entre l'état initial et les jours 90 et 540, ainsi que la variation en pourcentage de PCSK9, du cholestérol total, de l'Apo-B et du cholestérol non HDL entre l'état initial et le jour 510. D'autres critères d'évaluation secondaires étaient la réponse individuelle à Leqvio et la proportion de patients atteignant les taux lipidiques cibles globaux pour leur risque de MCVAS.
ORION-10 était une étude multicentrique, en double aveugle, randomisée, contrôlée par placebo, qui a duré 18 mois et a inclus 1561 patients atteints de MCVAS.
L'âge moyen des patients au début de l'étude était de 66 ans (tranche d'âge: 35 à 90 ans), 60% des patients étaient âgés de 65 ans ou plus, 31% étaient des femmes, 86% étaient caucasiens, 13% étaient afro-américains, 1% étaient asiatiques et 14% étaient d'origine espagnole ou latino-américaine. Le taux initial moyen de LDL-C était de 2,7 mmol/l (105 mg/dl). 69% des participants à l'étude prenaient des statines d'intensité élevée, 19% des statines d'intensité modérée, 1% des statines d'intensité faible et 11% ne prenaient pas de statine. Les statines les plus souvent administrées étaient l'atorvastatine et la rosuvastatine. Dans cette étude, Leqvio a été sûr et bien toléré; les événements indésirables n'ont entraîné l'arrêt du traitement que chez 2,4% des patients traités par Leqvio contre 2,2% des patients traités par placebo.
Leqvio a significativement réduit la variation moyenne en pourcentage du taux de LDL-C entre l'état initial et le jour 510 de 52% comparativement au placebo (IC à 95%: -56%, -49%; p < 0,0001) (tableau 1 et figure 2).
Leqvio a de plus, significativement réduit la variation en pourcentage ajustée en fonction du temps du taux de LDL-C de 54% par rapport à la valeur initiale entre le jour 90 et le jour 540 comparativement au placebo (IC à 95%: -56%, -51%; p < 0,0001). Pour plus de résultats, voir le tableau 1.
Tableau 1: Variation moyenne en pourcentage des paramètres lipidiques entre l'état initial et le jour 510 et différence comparativement au placebo dans l'étude ORION-10
|
Groupe de traitement
|
LDL-C
|
Cholestérol total
|
Cholestérol non HDL
|
Apo B
|
Lp(a)*
| |
Valeur initiale moyenne en mg/dl**
|
105
|
181
|
134
|
94
|
122
| |
Jour 510 (variation moyenne en pourcentage par rapport à la valeur initiale)
| |
Placebo (n = 780)
|
1
|
0
|
0
|
-2
|
4
| |
Leqvio (n = 781)
|
-51
|
-34
|
-47
|
-45
|
-22
| |
Différence avec le placebo (moyenne des moindres carrés)
(IC à 95%)
|
-52
(-56, -49)
|
-33
(-35, -31)
|
-47
(-50, -44)
|
-43
(-46, -41)
|
-26
(-29, -22)
|
* Au jour 540; variation médiane en pourcentage des taux de Lp(a)
** Valeur initiale moyenne en nmol/l pour la Lp(a)
Figure 2: Variation moyenne en pourcentage du taux de LDL-C par rapport à la valeur initiale chez les patients atteints d'hypercholestérolémie, de dyslipidémie mixte et de MCVAS traités par Leqvio vs sous placebo dans l'étude ORION-10
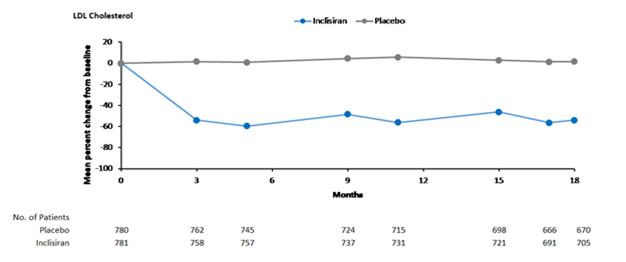
Au jour 510, le taux cible de LDL-C, soit < 1,8 mmol/l (70 mg/dl) a été atteint par 84% des patients atteints de MCVAS traités par Leqvio, contre 18% des patients traités par placebo.
Des réductions constantes et statistiquement significatives (p < 0,0001) de la variation en pourcentage du taux de LDL-C entre l'état initial et le jour 510 et des variations en pourcentage ajustées en fonction du temps du taux de LDL-C par rapport à la valeur initiale entre le jour 90 et le jour 540 ont été observées dans tous les sous-groupes, indépendamment des données démographiques et des caractéristiques de la maladie à l'état initial (incluant sexe, âge, indice de masse corporelle, couleur de peau et prise de statine à l'état initial), des comorbidités et de la région géographique.
L'étude ORION-11 était une étude internationale, multicentrique, en double aveugle, randomisée, contrôlée par placebo, durant 18 mois et incluant 1617 patients présentant une MCVAS ou un risque équivalent à celui d'une MCVAS (défini comme: patients avec diabète de type 2, hypercholestérolémie familiale ou risque d'événement cardiovasculaire dans les 10 ans de 20% ou plus évalué par le score de risque de Framingham ou un procédé comparable). Plus de 75% des patients recevaient un traitement de fond par statine de haute intensité, 87% des patients présentaient une MCVAS et 13% un risque comparable (risque équivalent à celui d'une MCVAS).
L'âge moyen des patients à l'état initial était de 65 ans (tranche d'âge: 20 à 88 ans), 55% des patients étaient âgés de 65 ans ou plus, 28% étaient des femmes, 98% étaient caucasiens, 1% étaient afro-américains, 1% étaient asiatiques et 1% étaient d'origine espagnole ou latino-américaine. Le taux initial moyen de LDL-C était de 2,7 mmol/l (105 mg/dl). 78% des participants à l'étude prenaient des statines d'intensité élevée, 16% des statines d'intensité modérée, 0,4% des statines d'intensité faible et 5% ne prenaient pas de statines. Les statines les plus souvent administrées étaient l'atorvastatine et la rosuvastatine. Des événements indésirables ont entraîné l'arrêt du traitement chez 2,8% des patients traités par Leqvio contre 2,2% des patients traités par placebo.
Leqvio a significativement réduit la variation moyenne en pourcentage du taux de LDL-C entre l'état initial et le jour 510 de 50% comparativement au placebo (IC à 95%: -53%, -47%; p < 0,0001) (tableau 2 et figure 3).
Leqvio a de plus significativement réduit la variation en pourcentage ajustée en fonction du temps du taux de LDL-C de 49% par rapport à la valeur initiale entre le jour 90 et le jour 540 comparativement au placebo (IC à 95%: -52%, -47%; p < 0,0001). Pour plus de résultats, voir le tableau 2.
Tableau 2: Variation moyenne en pourcentage des paramètres lipidiques entre l'état initial et le jour 510 et différence comparativement au placebo dans l'étude ORION-11
|
Groupe de traitement
|
LDL-C
|
Cholestérol total
|
Cholestérol non HDL
|
Apo B
|
Lp(a)*
| |
Valeur initiale moyenne en mg/dl**
|
105
|
185
|
136
|
96
|
107
| |
Jour 510 (variation moyenne en pourcentage par rapport à la valeur initiale)
| |
Placebo (n = 807)
|
4
|
2
|
2
|
1
|
0
| |
Leqvio (n = 810)
|
-46
|
-28
|
-41
|
-38
|
-19
| |
Différence avec le placebo (moyenne des moindres carrés)
(IC à 95%)
|
-50
(-53, -47)
|
-30
(-32, -28)
|
-43
(-46, -41)
|
-39
(-41, -37)
|
-19
(-21, -16)
|
* Au jour 540; variation médiane en pourcentage des taux de Lp(a)
** Valeur initiale moyenne en nmol/l pour la Lp(a)
Figure 3: Variation moyenne en pourcentage du taux de LDL-C par rapport à la valeur initiale chez les patients atteints d'hypercholestérolémie, de dyslipidémie mixte et de MCVAS/risque équivalent à celui d'une MCVAS traités par Leqvio vs sous placebo dans l'étude ORION-11
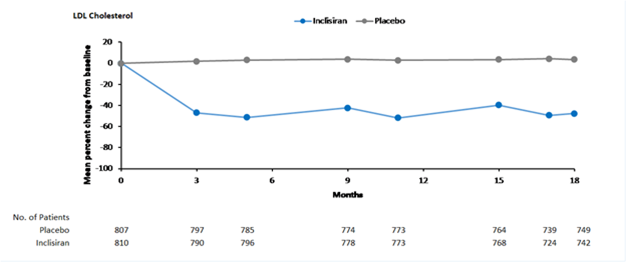
Au jour 510, le taux cible de LDL-C, soit < 1,8 mmol/l (70 mg/dl) a été atteint par 82% des patients atteints de MCVAS traités par Leqvio, contre 16% des patients traités par placebo. Chez les patients présentant un risque équivalent à celui d'une MCVAS, le taux cible de LDL-C, soit < 2,6 mmol/l (100 mg/dl) a été atteint par 78% des patients traités par Leqvio, contre 31% des patients traités par placebo.
Des réductions constantes et statistiquement significatives (p < 0,05) de la variation en pourcentage du taux de LDL-C entre l'état initial et le jour 510 et des variations en pourcentage ajustées en fonction du temps du taux de LDL-C par rapport à la valeur initiale entre le jour 90 et le jour 540 ont été observées dans tous les sous-groupes, indépendamment des données démographiques et des caractéristiques de la maladie à l'état initial (incluant sexe, âge, indice de masse corporelle, couleur de peau et prise de statine à l'état initial), des comorbidités et de la région géographique.
Hypercholestérolémie familiale hétérozygote
L'étude ORION-9 était une étude internationale, multicentrique, en double aveugle, randomisée, contrôlée par placebo, durant 18 mois et incluant 482 patients atteints d'hypercholestérolémie familiale hétérozygote (HFHe). Tous les patients prenaient une dose maximale tolérée de statine avec ou sans autre traitement modificateur des lipides, comme p.ex. l'ézétimibe, et avaient besoin d'une réduction supplémentaire du taux de LDL-C. Le diagnostic d'HFHe a été établi par génotypage ou sur la base de critères cliniques («HF certaine» d'après les critères de Simon Broome ou d'après les critères de l'OMS/du Dutch Lipid Network (DLNC)).
Les co-critères d'évaluation principaux étaient la variation en pourcentage du taux de LDL-C entre l'état initial et le jour 510 comparativement au placebo et la variation en pourcentage ajustée en fonction du temps du taux de LDL-C par rapport à la valeur initiale entre le jour 90 et le jour 540 afin d'évaluer l'effet intégré sur les taux de LDL-C dans le temps. Les critères d'évaluation secondaires importants étaient la variation absolue du taux de LDL-C entre l'état initial et le jour 510, la variation absolue ajustée en fonction du temps du taux de LDL-C par rapport à la valeur initiale entre le jour 90 et le jour 540, ainsi que la variation en pourcentage de PCSK9, du cholestérol total, de l'Apo-B et du cholestérol non HDL entre l'état initial et le jour 510. D'autres critères d'évaluation secondaires étaient la réponse individuelle à Leqvio et la proportion de patients atteignant les taux lipidiques cibles globaux pour leur risque de MCVAS.
L'âge moyen des patients au début de l'étude était de 55 ans (tranche d'âge: 21 à 80 ans), 22% des patients étaient âgés de 65 ans ou plus, 53% étaient des femmes, 94% étaient caucasiens, 3% étaient afro-américains, 3% étaient asiatiques et 3% étaient d'origine espagnole ou latino-américaine. Le taux initial moyen de LDL-C était de 4,0 mmol/l (153 mg/dl). Septante-quatre pour cent (74%) des participants à l'étude prenaient des statines d'intensité élevée, 15% des statines d'intensité modérée et 10% ne prenaient pas de statines. Cinquante-deux pour cent (52%) des patients étaient traités par l'ézétimibe. Les statines les plus souvent administrées étaient l'atorvastatine et la rosuvastatine. Dans cette étude, Leqvio a été sûr et bien toléré; des événements indésirables ont entraîné l'arrêt du traitement chez 1% des patients traités par Leqvio contre 0% des patients traités par placebo.
Leqvio a significativement réduit la variation moyenne en pourcentage du taux de LDL-C entre l'état initial et le jour 510 de 48% comparativement au placebo (IC à 95%: -54%, -42%; p < 0,0001) (tableau 3 et figure 4).
Leqvio a de plus significativement réduit la variation en pourcentage ajustée en fonction du temps du taux de LDL-C de 44% par rapport à la valeur initiale entre le jour 90 et le jour 540 comparativement au placebo (IC à 95%: -48%, -40%; p < 0,0001). Pour plus de résultats, voir le tableau 3.
Tableau 3: Variation moyenne en pourcentage des paramètres lipidiques entre l'état initial et le jour 510 et différence comparativement au placebo dans l'étude ORION-9
|
Groupe de traitement
|
LDL-C
|
Cholestérol total
|
Cholestérol non HDL
|
Apo B
|
Lp(a)*
| |
Valeur initiale moyenne en mg/dl**
|
153
|
231
|
180
|
124
|
121
| |
Jour 510 (variation moyenne en pourcentage par rapport à la valeur initiale)
| |
Placebo (n = 240)
|
8
|
7
|
7
|
3
|
4
| |
Leqvio (n = 242)
|
-40
|
-25
|
-35
|
-33
|
-13
| |
Différence avec le placebo (moyenne des moindres carrés)
(IC à 95%)
|
-48
(-54, -42)
|
-32
(-36, -28)
|
-42
(-47, -37)
|
-36
(-40, -32)
|
-17
(-22, -12)
|
* Au jour 540; variation médiane en pourcentage des taux de Lp(a)
** Valeur initiale moyenne en nmol/l pour la Lp(a)
Figure 4: Variation moyenne en pourcentage du taux de LDL-C par rapport à la valeur initiale chez les patients atteints d'hypercholestérolémie, de dyslipidémie mixte et d'hypercholestérolémie familiale hétérozygote traités par Leqvio vs sous placebo dans l'étude ORION-9
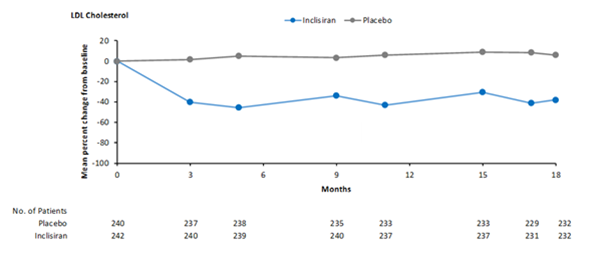
Au jour 510, 52,5% des patients atteints de MCVAS traités par Leqvio ont atteint leur taux cible de LDL-C, soit un taux < 1,8 mmol/l (70 mg/dl), contre 1,4% des patients atteints de MCVAS traités par placebo, tandis que 66,9% des patients présentant un risque équivalent à celui d'une MCVAS traités par Leqvio ont atteint leur taux cible de LDL-C, soit un taux < 2,6 mmol/l (100 mg/dl), contre 8,9% des patients présentant un risque équivalent à celui d'une MCVAS traités par placebo.
Des réductions constantes et statistiquement significatives (p < 0,05) de la variation en pourcentage du taux de LDL-C entre l'état initial et le jour 510 et des variations en pourcentage ajustées en fonction du temps du taux de LDL-C par rapport à la valeur initiale entre le jour 90 et le jour 540 ont été observées dans tous les sous-groupes, indépendamment des données démographiques et des caractéristiques de la maladie à l'état initial (incluant sexe, âge, indice de masse corporelle, couleur de peau et prise de statine à l'état initial), des comorbidités et de la région géographique.
Sécurité et efficacité chez les patients pédiatriques
La sécurité et l'efficacité de Leqvio n'ont pas été établies chez les enfants et les adolescents âgés de moins de 18 ans. Aucune donnée n'est disponible (voir «Posologie/Mode d'emploi» pour prendre connaissance des informations sur l'utilisation chez les enfants et les adolescents).
|




