CompositionPrincipes actifs
Propionate de fluticasone.
Salmétérol (sous forme de xinafoate de salmétérol).
Excipients
Lactose monohydraté (le lactose contient des lactoprotéines [au maximum 0.02% p/p]).
Indications/Possibilités d’emploiTraitement de longue durée de l'asthme bronchique chez les adultes et les adolescents à partir de 12 ans chez lesquels un traitement associé (bronchodilatateur et corticostéroïde inhalé) est indiqué. En cas de crise aiguë d'asthme, Seffalair Spiromax n'est pas le produit de premier choix. Un traitement associé par un agoniste β-adrénergique à longue durée d'action et un corticostéroïde inhalé ne devrait être instauré que lorsqu'un corticostéroïde inhalé n'entraîne pas à lui seul le succès thérapeutique souhaité.
Posologie/Mode d’emploiSeffalair Spiromax est réservé à l'inhalation (orale).
Il est possible que les patients ne sentent pas le goût ni la poudre sur la langue bien qu'ils aient utilisé correctement l'inhalateur.
Pour assurer un effet thérapeutique optimal, il faut utiliser Seffalair Spiromax régulièrement, même lorsque le patient ne présente pas de symptômes. La dose ne doit être augmentée que sur prescription médicale. Le médecin doit régulièrement évaluer l'état du patient.
Prescrire la dose la plus faible permettant d'assurer un contrôle efficace des symptômes.
Si l'asthme d'un patient n'est pas suffisamment contrôlé sous une monothérapie par des corticostéroïdes inhalés, un passage à Seffalair Spiromax à une dose thérapeutique équivalente du corticostéroïde peut améliorer le contrôle de l'asthme. Un traitement associé par un agoniste β-adrénergique à longue durée d'action et un corticostéroïde inhalé ne devrait être instauré que lorsqu'un corticostéroïde inhalé n'entraîne pas à lui seul le succès thérapeutique souhaité. Chez les patients dont l'asthme est bien contrôlé sous corticostéroïdes inhalés, le passage à Seffalair Spiromax permet de réduire la dose de corticostéroïdes tout en préservant le même contrôle de l'asthme (voir «Propriétés/Effets»).
Les patients reçoivent une dose de propionate de fluticasone contenu dans Seffalair Spiromax adaptée au degré de sévérité de la maladie. Les agonistes β-adrénergiques à longue durée d'action ne doivent pas être utilisés en cas de crise d'asthme aiguë.
Posologie usuelle
Adultes et adolescents à partir de 12 ans:
2 fois par jour, 1 dose unitaire de Seffalair Spiromax au dosage choisi (55, 113 ou 232 µg de propionate de fluticasone et toujours 14 µg de salmétérol).
La posologie initiale recommandée pour Seffalair Spiromax pour les patients de plus de 12 ans dépend de la sévérité de l'asthme. Le médecin prescripteur doit ainsi garder à l'esprit que, chez les patients asthmatiques, l'effet bronchodilatateur et l'exposition systémique d'une dose de 55 µg de propionate de fluticasone et de 14 µg de salmétérol sous la forme galénique de Seffalair Spiromax sont presque comparables à ceux observés après l'administration de 100 µg de propionate de fluticasone et 50 µg de salmétérol sous la forme galénique Seretide® Diskus disponible en Suisse (voir la rubrique «Propriétés/Effets»). Il n'existe pas de données suffisantes sur l'effet préventif de Seffalair Spiromax comparé à Seretide® Diskus contre les exacerbations d'asthme dangereuses.
Posologie initiale recommandée pour Seffalair Spiromax:
|
- dose faible
|
55/14 µg 2 fois par jour
| |
- dose moyenne
|
113/14 µg 2 fois par jour
| |
- dose élevée
|
232/14 µg 2 fois par jour
|
Enfants de moins de 12 ans: Les études disponibles à l'heure actuelle ne sont pas suffisantes pour que l'on puisse recommander l'utilisation de ce médicament chez les enfants de moins de 12 ans.
Instructions posologiques particulières
En cas d'asthme grave, il convient de répéter régulièrement les examens de contrôle car il peut apparaître des situations engageant le pronostic vital. Les patients atteints d'asthme sévère présentent des symptômes permanents, des exacerbations fréquentes, des valeurs du DEP (débit expiratoire de pointe) inférieures à 60% de la valeur normale et une variabilité du DEP de plus de 30%, phénomènes qui ne se normalisent pas malgré l'administration d'un bronchodilatateur. Chez ces patients, il convient d'utiliser une corticothérapie à forte dose, en inhalation ou par voie orale. Une aggravation soudaine des symptômes peut imposer une augmentation de la dose de corticoïde, qui doit être effectuée sous surveillance médicale.
Pour ce faire, il ne faut toutefois pas augmenter la fréquence d'administration de la préparation combinée. Si la situation est instable, envisager de passer à des préparations contenant un seul principe actif.
Il n'est pas nécessaire d'ajuster la posologie chez les personnes âgées ou en cas d'altération de la fonction rénale.
L'effet du salmétérol s'installe en l'espace de 10 à 20 minutes. C'est pourquoi, en cas de crise aiguë d'asthme, il convient d'administrer un agoniste β-adrénergique à action rapide.
Il faut dire aux patients de ne pas arrêter le traitement ou le réduire de leur propre initiative, même s'ils se sentent mieux sous traitement par Seffalair Spiromax.
Contre-indicationsHypersensibilité à l'un des composants (voir aussi «Composition»).
Allergie sévère aux protéines du lait.
Mises en garde et précautionsSeffalair Spiromax n'est pas adapté au traitement des crises aiguës d'asthme. Dans de telles situations, il convient d'utiliser un bronchodilatateur dont l'effet apparaît rapidement et est de courte durée (par exemple salbutamol).
Il faut surveiller la réponse au traitement en pratiquant des explorations fonctionnelles respiratoires.
Il faut dire au patient qu'en cas de dyspnée aiguë ou s'aggravant rapidement, il doit immédiatement consulter le médecin ou l'hôpital le plus proche si des inhalations supplémentaires d'un β2-stimulant d'effet rapide et de courte durée n'apportent pas une amélioration suffisante.
La nécessité d'augmenter la dose d'agoniste β2-adrénergique à courte durée d'action peut indiquer une aggravation de la maladie sous-jacente. Ces patients doivent être examinés par un médecin.
Une aggravation brusque et progressive de l'asthme peut engager le pronostic vital. C'est pourquoi, dans de tels cas, il convient de réexaminer le patient et d'envisager une augmentation de la posologie de la corticothérapie déjà existante. Le cas échéant, il faut passer à des produits contenant un seul principe actif.
Chez les patients asthmatiques, il ne faut pas arrêter brutalement le traitement par Seffalair Spiromax, mais diminuer progressivement la dose sous contrôle médical, faute de quoi une exacerbation est possible.
Chez les patients à risque, il est recommandé de mesurer quotidiennement le débit expiratoire de pointe.
Comme tous les médicaments qui contiennent des β2-stimulants, Seffalair Spiromax doit être utilisé avec prudence chez les patients hypertendus, de même qu'en cas de sténose sous-aortique hypertrophique idiopathique, de troubles cardiovasculaires accompagnés d'arythmies, d'infarctus du myocarde récent et de diabète.
Il faut également être prudent en cas d'hyperthyroïdie.
Des effets cardiovasculaires tels qu'une augmentation de la tension artérielle systolique et de la fréquence cardiaque peuvent occasionnellement survenir avec tous les médicaments sympathomimétiques, principalement à une posologie supérieure à celle thérapeutiquement recommandée. Pour cette raison, le salmétérol et le propionate de fluticasone doivent être utilisés avec précaution chez les patients souffrant de maladies cardiovasculaires préexistantes. Une diminution transitoire du potassium sérique peut survenir avec tous les médicaments sympathomimétiques à dose thérapeutique élevée. Par conséquent, le salmétérol et le propionate de fluticasone doivent être utilisés avec prudence chez les patients qui ont une prédisposition à présenter des taux sériques de potassium faibles.
Il faut être particulièrement prudent chez les patients atteints de tuberculose pulmonaire active ou latente ou de mycoses pulmonaires. Il ne faut pas utiliser Seffalair Spiromax quand un traitement tuberculostatique ou antifongique approprié ne peut pas être assuré en même temps.
Prudence en cas d'insuffisance hépatique: Étant donné que le salmétérol et le propionate de fluticasone sont essentiellement éliminés par le foie, leur accumulation est possible en cas d'insuffisance hépatique; les patients concernés doivent donc être étroitement surveillés.
Les corticoïdes administrés en inhalation, notamment en traitement prolongé à fortes doses, peuvent provoquer des effets secondaires systémiques. Toutefois, le risque d'apparition de tels effets est inférieur à celui encouru avec les corticoïdes oraux (voir «Surdosage»).
Outre un syndrome de Cushing et des symptômes cushingoïdes, les effets secondaires systémiques suivants sont possibles: inhibition de la fonction corticosurrénalienne, parfois associée à des épisodes hypoglycémiques, ralentissement de la croissance chez l'enfant et l'adolescent, diminution de la densité osseuse, cataracte, glaucome et choriorétinopathie séreuse centrale.
Des troubles visuels peuvent apparaître lors de l'utilisation systémique ou topique (y compris par voie intranasale, inhalée et intra-oculaire) de corticostéroïdes. Si un patient présente des symptômes tels qu'une vision floue ou des troubles de la vision, il convient d'envisager de l'adresser à un ophtalmologue pour clarifier les éventuelles causes des troubles visuels, entre autres cataracte, glaucome ou des maladies rares telles qu'une choriorétinopathie séreuse centrale (CRSC) dont des cas ont été décrits après l'administration systémique et topique de corticostéroïdes.
Chez l'asthmatique, il est donc important de choisir la dose de stéroïde inhalé la plus faible possible qui permette de maintenir un contrôle efficace.
Dans les cas d'urgence ou dans des situations liées au patient lui-même et susceptibles de provoquer un stress, il faut toujours penser à la possibilité d'une réduction de la réponse adrénergique et envisager une corticothérapie appropriée (voir «Surdosage»).
Chez l'adolescent, les effets à long terme des corticoïdes inhalés ne sont pas parfaitement connus. Par principe, le médecin doit soigneusement observer la croissance des enfants et des adolescents soumis à une corticothérapie prolongée.
Il faut tenir compte du fait que, lors du remplacement de la corticothérapie orale par des inhalations de propionate de fluticasone, la diminution de la capacité de réserve surrénalienne peut persister pendant un certain temps.
Chez les patients chez lesquels une corticothérapie prolongée par voie systémique ou par inhalation de fortes doses a déjà provoqué une diminution de la fonction corticosurrénalienne, il faut être très prudent lors de l'arrêt ou de la réduction de la dose du corticoïde.
Après le remplacement d'une corticothérapie générale par Seffalair Spiromax, il faut particulièrement surveiller les patients dont la fonction corticosurrénalienne est encore perturbée, afin qu'en cas de situations dangereuses, par exemple blessures, intervention chirurgicale ou infection grave, la fonction corticosurrénalienne soit suffisante. Chez certains patients, de telles circonstances exigent l'administration supplémentaire de corticoïdes systémiques; il est en outre recommandé de remettre au patient une carte de santé mentionnant qu'en cas de situation stressante, il aura besoin de corticoïdes systémiques.
Dans de rares cas, une corticothérapie inhalée peut révéler une affection sous-jacente s'accompagnant d'une éosinophilie (p.ex. syndrome de Churg-Strauss). Ces cas ont habituellement été mis en relation avec l'arrêt d'une corticothérapie systémique ou avec la réduction de sa posologie. Aucun lien de causalité direct n'a été établi.
De même, lors du remplacement d'une corticothérapie générale par des corticoïdes inhalés, il peut apparaître des allergies autres que bronchiques, qui étaient précédemment supprimées par la corticothérapie générale.
Il ne faut jamais arrêter brutalement un traitement par Seffalair Spiromax sans envisager de traitement de remplacement.
De très rares cas d'une augmentation de la glycémie (voir «Effets indésirables») ont été rapportés. Il faut en tenir compte avant d'instaurer un traitement chez des patients diabétiques.
Les résultats d'une étude d'interactions menée chez des sujets sains ont révélé que le ritonavir (un puissant inhibiteur du cytochrome P450 3A4) peut fortement augmenter les taux plasmatiques de propionate de fluticasone, ce qui peut entraîner une diminution des concentrations plasmatiques de cortisol. Depuis la mise sur le marché des médicaments contenant du propionate de fluticasone, on a signalé des interactions cliniquement notables chez les patients recevant à la fois du ritonavir et du propionate de fluticasone; ces interactions ont entraîné des effets secondaires systémiques typiques des corticoïdes, dont un syndrome de Cushing et une inhibition corticosurrénalienne. Il ne faut donc utiliser simultanément du ritonavir et du propionate de fluticasone que si le bénéfice thérapeutique escompté pour le patient l'emporte sur le risque d'effets secondaires systémiques dus aux corticoïdes (voir «Interactions»).
Il a été observé dans une étude d'interactions que l'administration simultanée de kétoconazole systémique augmente l'exposition au salmétérol. Ceci peut entraîner un allongement de l'intervalle QTc. L'administration simultanée d'inhibiteurs puissants du CYP3A4 (p.ex. kétoconazole) et de salmétérol est donc déconseillée (voir «Interactions» et «Pharmacocinétique»).
Comme dans le cadre d'autres traitements par inhalation, une survenue de bronchospasmes paradoxaux (caractérisés par des sifflements respiratoires immédiatement après l'administration) est possible. Si cela se produit, il faut administrer des bronchodilatateurs à inhaler à courte durée d'action. Le traitement par Seffalair Spiromax doit être interrompu et le patient doit être examiné. Au besoin, Seffalair Spiromax doit être remplacé par un autre traitement.
On a rapporté des effets indésirables pharmacologiques de l'agoniste β2-adrénergique, p.ex. des tremblements, des palpitations cardiaques et des céphalées. Ces effets sont généralement de nature transitoire et diminuent au cours du traitement régulier (voir «Effets indésirables»).
InteractionsLes patients traités par un agoniste β2-adrénergique (par exemple Seffalair Spiromax) ne doivent jamais recevoir de β-bloquants non sélectifs (par exemple propranolol). La prudence est également de rigueur lors de l'administration de β-bloquants cardiosélectifs.
Il n'existe pas d'études concernant les interactions entre Seffalair Spiromax et d'autres β2-stimulants ou des anticholinergiques.
Le principe actif salmétérol pourrait avoir des effets additifs avec les deux classes de substances.
Interactions avec des inhibiteurs puissants du CYP3A4:
Une étude dans laquelle des sujets sains ont reçu à plusieurs reprises des doses de salmétérol et d'érythromycine, n'a cependant révélé, avec l'érythromycine utilisée à une posologie de 500 mg trois fois par jour, aucune différence cliniquement significative en ce qui concerne les effets sur la pharmacodynamique.
En raison de son important métabolisme de premier passage et de sa clairance plasmatique élevée dans l'intestin et le foie, due au cytochrome P450 3A4, Seffalair Spiromax utilisé en inhalation entraîne normalement de faibles concentrations plasmatiques de propionate de fluticasone.
Les résultats d'une étude d'interactions menée chez des sujets sains ont toutefois révélé que le ritonavir (un puissant inhibiteur du cytochrome P450 3A4) peut fortement augmenter les taux plasmatiques de propionate de fluticasone, ce qui peut déboucher sur une diminution des concentrations plasmatiques de cortisol. Depuis la mise sur le marché des médicaments contenant du propionate de fluticasone, on a signalé des interactions cliniquement notables chez les patients recevant à la fois du ritonavir et du propionate de fluticasone; ces interactions ont entraîné des effets secondaires systémiques typiques des corticoïdes, dont un syndrome de Cushing et une inhibition corticosurrénalienne. Il ne faut donc utiliser simultanément du ritonavir et du propionate de fluticasone que si le bénéfice thérapeutique escompté pour le patient l'emporte sur le risque d'effets secondaires systémiques dus aux corticoïdes.
Des études ont montré que d'autres inhibiteurs du cytochrome P450 3A4 (l'érythromycine, le kétoconazole) ne provoquent qu'une faible augmentation des taux plasmatiques de propionate de fluticasone.
L'administration simultanée avec des inhibiteurs puissants du CYP3A4 (p.ex. kétoconazole, itraconazole, clarithromycine, ritonavir ou produits contenant du cobicistat) peut accroître l'exposition aux corticostéroïdes et ainsi augmenter le risque d'effets indésirables des corticostéroïdes systémiques. L'administration simultanée doit être évitée, à moins que le bénéfice l'emporte sur le risque accru d'effets indésirables systémiques des corticostéroïdes; dans ce cas, les patients doivent être surveillés quant aux effets indésirables des corticostéroïdes systémiques.
Les inhibiteurs de la MAO, les antidépresseurs tricycliques, la L-dopa, la L-thyroxine, l'ocytocine et certains antiarythmiques peuvent renforcer les effets indésirables cardiovasculaires des β-sympathomimétiques et, donc, ceux de Seffalair Spiromax. Avec les xanthines, il y a un risque d'hypokaliémie.
L'administration simultanée de kétoconazole et de salmétérol a entraîné une augmentation significative de l'exposition plasmatique au salmétérol (multiplication par 1,4 de la Cmax et par 15 de l'AUC). Ceci peut provoquer un allongement de l'intervalle QTc (voir «Mises en garde et précautions» et «Pharmacocinétique»).
Lors de l'administration simultanée de Seffalair Spiromax, les agonistes β2-adrénergiques à courte durée d'action sont efficaces et doivent être fournis aux patients à titre de «médicaments de secours».
Grossesse, allaitementGrossesse
L'expérience acquise en matière d'emploi de l'association de salmétérol et de propionate de fluticasone au cours de la grossesse est limitée. Une utilisation pendant la grossesse ne devrait être envisagée que si le bénéfice escompté pour la mère dépasse le risque potentiel pour le fœtus.
Par rapport à d'autres corticostéroïdes inhalés, une étude épidémiologique rétrospective n'a fourni aucun indice de risque accru de malformations congénitales significatives après une exposition au propionate de fluticasone pendant le premier trimestre de la grossesse (voir «Propriétés/Effets»).
Des expérimentations animales montrent que l'administration systémique de doses extrêmement élevées des deux composantes de l'association ou de l'association elle-même induit sur le fœtus les effets prévisibles pour les agonistes β2-adrénergiques et les corticoïdes.
Toutefois, des études plus approfondies, réalisées avec des substances de ces deux classes, ont révélé qu'aux doses thérapeutiques, il n'y a pas lieu de craindre ces effets. La prudence est donc de rigueur lors d'une utilisation de Seffalair Spiromax pendant la grossesse.
En clinique, on utilise les agonistes β2-adrénergiques par voie parentérale à fortes doses pour obtenir une relaxation de l'utérus et différer l'accouchement. Il n'existe pas d'études sur les effets du salmétérol pendant le travail ou l'accouchement. Chez des rates traitées par des doses orales élevées, un léger allongement de la durée de la gestation a été constaté. Il ne faut donc pas utiliser ce médicament pendant l'accouchement, sauf nécessité impérieuse.
Allaitement
Étant donné que les taux plasmatiques de salmétérol et de fluticasone sont très faibles après l'inhalation d'une dose thérapeutique, on peut supposer que les concentrations dans le lait maternel sont également très faibles. Néanmoins, faute d'expérience en ce domaine, il ne faut pas utiliser Seffalair Spiromax pendant l'allaitement, sauf si le bénéfice escompté pour la mère dépasse le risque potentiel pour l'enfant.
Fertilité
On ne dispose pas de données sur la fertilité humaine. Les expérimentations animales n'ont fourni aucun indice d'une influence du propionate de fluticasone ou du xinafoate de salmétérol sur la fertilité des femelles ou des mâles (voir «Données précliniques»).
Effet sur l’aptitude à la conduite et l’utilisation de machinesIl n'existe aucune étude portant spécifiquement sur l'influence de Seffalair Spiromax sur l'aptitude à conduire un véhicule ou à utiliser des machines; cependant, les propriétés pharmacologiques des deux substances ne suggèrent aucune perturbation à cet égard.
Effets indésirablesTous les effets indésirables associés aux composants individuels, le xinafoate de salmétérol et le propionate de fluticasone, sont listés ci-dessous.
Les effets indésirables sont classés ci-dessous par classe d'organes et par fréquence. Les fréquences des effets indésirables sont définies comme suit: «très fréquents» (>1/10), «fréquents» (≥1/100 et <1/10) «occasionnels» (≥1/1000 et <1/100), «rares» (≥1/10'000 et <1/1000) et «très rares» (<1/10'000). La plupart des fréquences ont été déterminées à partir des données cumulées des études cliniques. Les effets indésirables très rares ont été saisis sur la base de rapports spontanés. Les rapports spontanés ne permettent pas de conclusions formelles quant à l'incidence réelle des effets indésirables.
Infections et infestations
Fréquents: infection de la muqueuse bucco-pharyngée à Candida albicans.
Rare: infection œsophagienne à Candida albicans.
Affections du système immunitaire
Réactions d'hypersensibilité comme:
Occasionnels: réactions cutanées d'hypersensibilité, dyspnée.
Rares: réactions anaphylactiques.
Affections endocriniennes
Les effets indésirables systémiques possibles englobent (voir «Mises en garde et précautions»):
Occasionnels: cataracte.
Rares: glaucome.
Troubles du métabolisme et de la nutrition
Occasionnels: hyperglycémie.
Affections psychiatriques
Occasionnels: anxiété, troubles du sommeil.
Rares: modifications du comportement telles qu'hyperactivité ou irritabilité (surtout chez l'enfant).
Affections oculaires
Rares: vision floue.
Affections du système nerveux
Très fréquents: céphalées (voir «Mises en garde et précautions»).
Occasionnels: tremblements (voir «Mises en garde et précautions»).
Affections cardiaques
Occasionnels: palpitations cardiaques (voir «Mises en garde et précautions»), tachycardie, fibrillation auriculaire.
Rares: arythmies cardiaques, y compris tachycardie supraventriculaire et extrasystoles.
Affections respiratoires, thoraciques et médiastinales
Fréquents: enrouement, dysphonie.
Occasionnels: irritations de la muqueuse bucco-pharyngée.
Affections de la peau et du tissu sous-cutané
Occasionnels: ecchymose.
Affections musculosquelettiques et du tissu conjonctif
Fréquents: crampes musculaires, arthralgies.
Effets indésirables après commercialisation
Affections du système immunitaire
Réactions d'hypersensibilité telles que:
Angio-œdème (surtout œdèmes du visage et œdèmes bucco-pharyngés).
Affections endocriniennes
Les effets indésirables systémiques possibles englobent (voir «Mises en garde et précautions»):
Syndrome de Cushing, symptômes cushingoïdes, inhibition de la fonction corticosurrénalienne, retards de croissance chez les enfants et adolescents, diminution de la densité minérale osseuse.
Affections respiratoires, thoraciques et médiastinales
Bronchospasme paradoxal (voir «Mises en garde et précautions»).
Salmétérol:
Comme les autres β2-stimulants, le salmétérol peut provoquer un allongement en fonction de la dose de l'intervalle QTc. Des allongements de l'intervalle QTc dépassant le seuil de 0,45 s ne sont apparus qu'à des posologies supérieures à la plage thérapeutique recommandée. On a signalé des effets indésirables liés aux propriétés pharmacologiques des agonistes β2-adrénergiques, tels que tremblement ou céphalées. En général, ces effets indésirables ne sont que temporaires et s'atténuent au cours du traitement.
Propionate de fluticasone:
En cas de muguet, il est recommandé d'utiliser un antifongique local; le traitement par Seffalair Spiromax peut être poursuivi. On peut dans une large mesure éviter les effets indésirables tels que muguet ou enrouement en inhalant le médicament juste avant un repas ou en se rinçant la bouche à l'eau ou en effectuant des gargarismes à l'eau après l'utilisation.
Le remplacement d'une corticothérapie systémique par le propionate de fluticasone inhalé ou Seffalair Spiromax peut donner lieu à l'apparition d'allergies, p.ex. rhinite allergique ou eczémas, qui avaient été préalablement supprimés par la corticothérapie systémique. Il faut traiter ces allergies par des antihistaminiques et par des corticoïdes à effet local. Après l'arrêt de la corticothérapie systémique, certains patients ne se sentent pas bien, malgré une stabilité ou une amélioration de leur fonction respiratoire. Chez ces patients, il faut contrôler la fonction corticosurrénalienne.
D'une manière générale, les corticoïdes administrés en inhalation risquent de provoquer des effets indésirables systémiques, surtout s'ils sont utilisés à forte dose et pendant longtemps (voir aussi «Mises en garde et précautions», «Surdosage» et «Interactions»).
Association salmétérol/propionate de fluticasone:
Comme avec les autres traitements par inhalation, il ne faut pas oublier d'envisager l'éventualité d'un bronchospasme paradoxal. Si un tel phénomène se produit, il faut immédiatement faire inhaler des bronchodilatateurs à courte durée d'action, arrêter le traitement par Seffalair Spiromax, examiner le patient et au besoin passer à un autre traitement.
Dans des cas isolés, on a signalé l'apparition de réactions allergiques sévères, y compris un choc anaphylactique, après l'inhalation de médicaments à visée pulmonaire contenant du lactose/des lactoprotéines. La cause était une allergie sous-jacente aux lactoprotéines.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageLes informations actuellement disponibles concernant le surdosage de salmétérol et/ou propionate de fluticasone sont présentées ci-dessous:
Les symptômes et signes attendus d'un surdosage de salmétérol sont typiques d'une stimulation excessive des récepteurs β2-adrénergiques tels que tremblements des muscles squelettiques (en particulier, des mains), céphalées, augmentation de la fréquence cardiaque, élévation de la tension artérielle systolique et hypokaliémie.
L'inhalation aiguë de doses supérieures à la posologie autorisée peut provoquer une inhibition temporaire de l'axe hypothalamo-hypophyso-corticosurrénalien; celle-ci n'impose généralement pas de mesures d'urgence et disparaît en quelques jours.
Cependant, l'inhalation prolongée de doses supérieures à celles autorisées peut entraîner une inhibition significative de la fonction corticosurrénalienne. De très rares cas d'insuffisance corticosurrénalienne aiguë ont été signalés, surtout chez des enfants qui avaient inhalé pendant longtemps (plusieurs mois, voire des années) des doses supérieures à la posologie autorisée. Chez ces enfants, on a observé, entre autres, une hypoglycémie et, en conséquence, des troubles de la conscience et/ou des convulsions. Des situations telles qu'un traumatisme, une intervention chirurgicale, une infection ou une réduction rapide de la dose de propionate de fluticasone pourraient déclencher la survenue d'une insuffisance corticosurrénalienne aiguë.
Il est déconseillé de prescrire Seffalair Spiromax à des doses supérieures aux posologies autorisées. Il est important de contrôler régulièrement le traitement et de ramener la dose par paliers à la plus faible posologie autorisée permettant un contrôle efficace de la maladie à traiter (voir «Posologie/Mode d'emploi»).
Il n'existe aucun traitement spécifique du surdosage de Seffalair Spiromax. Dans le cas d'un surdosage, le patient doit recevoir un traitement de soutien et être surveillé si nécessaire.
La marche à suivre ultérieure dépendra des exigences cliniques ou des recommandations éventuelles du centre d'information toxicologique.
Propriétés/EffetsCode ATC
R03AK06
Mécanisme d'action/Pharmacodynamique
Seffalair Spiromax contient les principes actifs salmétérol et propionate de fluticasone, dont les mécanismes d'action sont différents.
Salmétérol: Le salmétérol stimule sélectivement les récepteurs β2-adrénergiques et procure, du fait de sa longue chaîne latérale qui se lie à l'exo-site du récepteur, une protection efficace contre la bronchoconstriction induite par l'histamine et entraîne une bronchodilatation de longue durée (plus de 12 heures).
Des tests effectués in vitro ont montré que le salmétérol, de même que d'autres substances ß-adrénergiques, inhibe la libération des médiateurs des mastocytes (comme l'histamine, les leucotriènes et la prostaglandine D2) dans le poumon humain.
Chez l'homme, le salmétérol inhibe la réaction immédiate et retardée aux allergènes inhalés; l'inhibition de la réaction retardée persiste plus de 30 heures, après l'utilisation d'une dose unique, lorsque l'effet bronchodilatateur n'est déjà plus décelable. Une dose unique suffit à diminuer l'hyperréactivité bronchique.
Propionate de fluticasone: Le propionate de fluticasone exerce une action anti-inflammatoire. Son administration par inhalation lui permet d'agir directement dans le poumon et de réduire la fréquence de survenue de symptômes et d'exacerbations de l'asthme. Utilisé en inhalation à la posologie usuelle, le propionate de fluticasone a l'avantage de maintenir la fonction corticosurrénalienne dans les limites physiologiques.
Utilisés de façon régulière dans l'asthme, le salmétérol diminue les symptômes de bronchoconstriction et le propionate de fluticasone améliore la fonction pulmonaire et prévient une exacerbation de la maladie.
Efficacité clinique
La sécurité et l'efficacité de Seffalair Spiromax ont été évaluées chez 3004 patients asthmatiques.
Le plan de développement comprenait 2 études confirmatoires d'une durée de 12 semaines, une étude de sécurité de 26 semaines et trois études de détermination des doses. Les résultats sur l'efficacité de Seffalair Spiromax reposent principalement sur les études de détermination de dose décrites ci-après et sur les études confirmatoires.
Études de détermination de dose
Dans 2 études randomisées, en double aveugle, contrôlées contre placebo de 12 semaines, 6 posologies de propionate de fluticasone allant de 16 µG à 434 µg (dose nominale) ont été administrées deux fois par jour par inhalateur pulvérulent multidoseur (IPM). L'étude 201 a été menée auprès de patients dont l'asthme n'était pas maîtrisé au début de l'étude et qui ont été traités par des agonistes β-2 adrénergiques à courte durée d'action uniquement ou en association avec des médicaments antiasthmatiques sans stéroïdes. Les patients qui ont reçu des glucocorticoïdes par inhalation de faibles doses pouvaient être inclus dans l'étude après une période de sevrage d'au moins 2 semaines. Dans cette étude, le propionate de fluticasone, 100 µg, en poudre pour inhalation, administré deux fois par jour, a servi de traitement de référence en mode ouvert. L'étude 202 a été menée auprès de patients dont l'asthme n'était pas maîtrisé au début de l'étude et qui ont été traités par un CSI à haute dose associé ou non à des agonistes β-2 adrénergiques à longue durée d'action.
Dans cette étude, le propionate de fluticasone, 250 µg, en poudre pour inhalation, administré deux fois par jour, a servi de traitement de référence en mode ouvert. Ces études ont servi à déterminer la dose du monocomposant propionate de fluticasone (appelé ci-après Fluticason Spiromax, disponible sous la dénomination de Armonair RespiClick Inhalator aux États-Unis).
Elles n'ont pas été conçues pour collecter les données comparatives sur l'efficacité et ne doivent pas être interprétées comme preuve de la supériorité/infériorité du propionate de fluticasone en IPM par rapport au propionate de fluticasone en poudre pour inhalation. Les doses nominales utilisées dans les études 201 et 202 pour la fluticasone en inhalateur pulvérulent multidoseur (16, 28, 59, 118, 225, 434 µg) (voir Illustration 1) diffèrent légèrement des doses nominales utilisées pour l'élaboration du traitement de référence (fluticasone en poudre pour inhalation) et du médicament expérimental de phase III, sur lesquelles les dosages et les recommandations posologiques du traitement disponible dans le commerce ont été établis (55, 113, 232 µg pour la fluticasone). Les modifications de posologie effectuées entre les phases II et III résultent de l'optimisation des processus de fabrication.
Illustration 1: Variation de la moyenne des moindres carrés ajustée par rapport à la valeur initiale de la variation du VEMS matinal de creux après 12 semaines (FAS)a
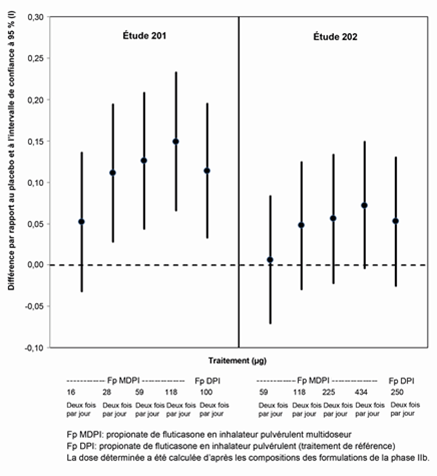
FAS: Full Analysis Set (ensemble d'analyses complet);
a Ces études n'ont pas été conçues pour collecter les données comparatives sur l'efficacité et ne doivent pas être interprétées comme preuve de la supériorité/infériorité du propionate de fluticasone en IPM par rapport au propionate de fluticasone en poudre pour inhalation.
L'efficacité et la sécurité de quatre posologies du xinafoate de salmétérol ont été étudiées dans un essai croisé de 6 phases en double aveugle chez les patients présentant un asthme persistant par rapport à un traitement de référence en mode ouvert composé d'une dose unique de propionate de fluticasone en IPM et d'une association de 100/50 µg de propionate de fluticasone/salmétérol en inhalateur pulvérulent. L'objectif de ces études était de déterminer la dose du composant salmétérol de Seffalair Spiromax. Ces études n'ont pas été conçues pour collecter les données comparatives sur l'efficacité et ne doivent pas être interprétées comme preuve de la supériorité/infériorité du salmétérol par rapport au propionate de fluticasone/salmétérol en poudre pour inhalation. L'étude portait sur des doses de salmétérol de 6,8 µg, 13,2 µg, 26,8 µg et 57,4 µg associées à 118 µg de propionate de fluticasone et administrées par IPM (doses nominales). Les doses nominales de salmétérol utilisées dans cette étude (6,8 µg, 13,2 µg, 26,8 µg, 57,4 µg) diffèrent légèrement des doses nominales utilisées pour l'élaboration du traitement de référence et du médicament expérimental de phase III sur lesquelles les dosages et les recommandations posologiques du traitement disponible dans le commerce ont été établis (55 µg, 113 µg, 232 µg pour la fluticasone et 14 µg pour le salmétérol). Les traitements de phase III et les produits commercialisés ont été optimisés pour que les dosages soient conformes aux traitements de référence. Pour chaque phase de dosage, du plasma a été prélevé pour établir les caractéristiques pharmacocinétiques. L'association de propionate de fluticasone/xinafoate de salmétérol (118/13,2 µg) en IPM présentait une efficacité clinique similaire à celle d'une dose de 50 µg de salmétérol contenue dans un inhalateur pulvérulent de propionate de fluticasone/salmétérol (100/50 µg) pour une exposition systémique plus faible (Illustration 2).
Illustration 2: VEMS (ml) moyen ajusté par rapport à la valeur initiale après 12 heures (FAS)a

FS MDPI: propionate de fluticasone/salmétérol en inhalateur pulvérulent multidoseur;
Fp MDPI: propionate de fluticasone en inhalateur pulvérulent multidoseur;
FS DPI: propionate de fluticasone/salmétérol en inhalateur pulvérulent;
FAS: Full Analysis Set (ensemble d'analyses complet);
VEMS: volume expiratoire maximal par seconde;
a Ces études n'ont pas été conçues pour collecter les données comparatives sur l'efficacité et ne doivent pas être interprétées comme preuve de la supériorité/infériorité du salmétérol par rapport au propionate de fluticasone/salmétérol en poudre pour inhalation.
Études sur le traitement d'entretien de l'asthme
Patients adultes et adolescents à partir de 12 ans:
Deux études cliniques de phase III ont été réalisées: ces 2 études visaient à comparer Seffalair Spiromax avec Fluticason Spiromax seul ou contre placebo (étude 1 et étude 2).
Études de comparaison de Seffalair Spiromax avec le propionate de fluticasone seul ou contre placebo
Deux études cliniques en double aveugle en groupes parallèles (étude 1 et étude 2) ont été menées avec Seffalair Spiromax: elles comprenaient 1375 patients adultes et adolescents âgés d'au moins 12 ans. Les patients souffraient d'asthme qui n'a pas pu être contrôlé de manière optimale par les traitements suivis jusqu'alors et une valeur initiale de VEMS de 40% à 85% de la valeur normale prévue. Tous les traitements ont été administrés par 1 inhalation deux fois par jour au moyen de l'inhalateur Spiromax et tous les autres traitements d'entretien ont été interrompus.
Étude 1: cette étude mondiale, randomisée, en double aveugle, contrôlée contre placebo de 12 semaines destinée à évaluer l'efficacité et la sécurité a comparé l'inhalation de 55 µg et de 113 µg de propionate de fluticasone en inhalateur pulvérulent multidoseur (Fluticason Spiromax) (1 inhalation deux fois par jour) et l'inhalation de l'association de 55/14 µg et 113/14 µg de fluticasone/salmétérol en inhalateur pulvérulent multidoseur (Seffalair Spiromax) (1 inhalation deux fois par jour) par rapport à un placebo chez des patients adolescents et adultes atteints d'asthme symptomatique persistant malgré l'inhalation de faibles ou moyennes doses d'une corticothérapie ou d'une association de corticostéroïdes/d'agonistes β-2 adrénergiques. Les patients ont reçu un placebo en IPM en simple aveugle puis sont passés à leur traitement de base composé de 40 µg de QVAR, un CSI, deux fois par jour, pendant la période de rodage. Les patients qui remplissaient tous les critères pour la randomisation ont été assignés aléatoirement à l'un des groupes de traitement suivants: 130 patients ont reçu le placebo, 129 patients ont reçu 55 µg de FLUTICASON SPIROMAX, 130 patients ont reçu 113 µg de FLUTICASON SPIROMAX, 129 patients ont reçu 55/14 µg de SEFFALAIR SPIROMAX et 129 patients ont reçu 113/14 µg de SEFFALAIR SPIROMAX. Les mesures de la valeur initiale du VEMS étaient similaires dans tous les groupes de traitement: pour FLUTICASON SPIROMAX 55 µg: 2,132 l, pour FLUTICASON SPIROMAX 113 µg: 2,166 l, pour SEFFALAIR SPIROMAX 55/14 µg: 2,302 l, pour SEFFALAIR SPIROMAX 113/14 µg: 2,162 l et pour le placebo: 2,188 l. Pour cette étude, les critères d'évaluation principaux étaient la variation par rapport à la valeur initiale du VEMS de creux à la semaine 12 pour tous les patients et l'aire normalisée sous la courbe de la période d'effet plasmatique ajustée par rapport à la valeur initiale sur 12 heures (ASCE0-12h) pour le VEMS à la semaine 12; cette ASCE a été analysée pour un sous-groupe de 312 patients qui a été soumis à des spirométries en série après administration de la dose. Les patients qui ont reçu 55/14 µg de SEFFALAIR SPIROMAX et 113/14 µg de SEFFALAIR SPIROMAX ont montré une amélioration nette et significative du VEMS de creux (55/14 µg de SEFFALAIR SPIROMAX: variation de la moyenne des MC de 0,319 l après 12 semaines et 113/14 µg de SEFFALAIR SPIROMAX variation de la moyenne des MC de 0,315 l après 12 semaines) par rapport aux patients ayant reçu 55 µg de FLUTICASON SPIROMAX (variation de la moyenne des MC de 0,172 l après 12 semaines) et 113 µg de FLUTICASON SPIROMAX (variation de la moyenne des MC de 0,204 l après 12 semaines) et par rapport au placebo (variation de la moyenne des MC de 0,053 l après 12 semaines). La différence des moyennes estimée entre 55/14 µg de SEFFALAIR SPIROMAX et 113/14 µg de SEFFALAIR SPIROMAX par rapport au placebo étaient de 0,266 l (IC à 95%: 0,172, 0,360) ou 0,262 l (IC à 95%: 0,168, 0,356).
La différence des moyennes estimée entre 55 µg de FLUTICASON SPIROMAX par rapport au placebo et 113 µg de FLUTICASON SPIROMAX par rapport au placebo était respectivement de 0,119 l (IC à 95%: 0,025, 0,212) ou 0,151 l (IC à 95%: 0,057, 0,244). La différence des moyennes estimée entre 113/14 µg de SEFFALAIR SPIROMAX et 113 µg de FLUTICASON SPIROMAX était de 0,111 l (IC à 95%: 0,017, 0,206). La différence des moyennes estimée entre 55/14 µg de SEFFALAIR SPIROMAX et 55 µg de FLUTICASON SPIROMAX était de 0,147 l (IC à 95%: 0,053, 0,242). En outre, les résultats de la moyenne du VEMS pour chaque visite sont donnés dans l'Illustration 3.
Illustration 3: Variation de la moyenne du VEMS de creux par rapport à la valeur initiale lors de chaque visite par groupe de traitement, étude 1 (FAS)
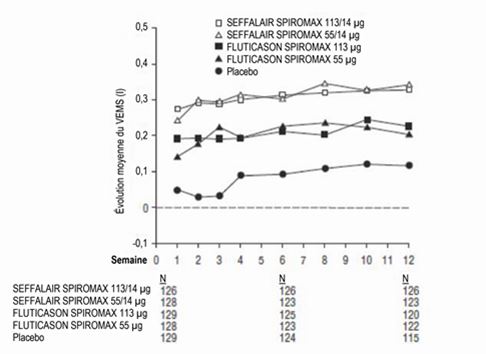
FAS: Full Analysis Set (ensemble d'analyses complet); VEMS: volume expiratoire maximal par seconde
En ce qui concerne les critères d'évaluation secondaires, des preuves certifiées d'efficacité de SEFFALAIR SPIROMAX par rapport au placebo ont été fournies, par exemple en ce qui concerne la valeur de creux matinal journalière du débit expiratoire de pointe et l'administration quotidienne totale des médicaments nécessaires. Dans l'étude 1, les patients âgés de plus de 18 ans ont rempli l'AQLQ (Asthma Quality of Life Questionnaire) et les patients âgés de 12 à 17 ans ont rempli l'AQLQ pédiatrique (PAQLQ). Le taux de répondeurs a été défini pour les deux instruments de mesure comme l'amélioration de la valeur du point de 0,5 ou plus par rapport à la limite de tolérance. Dans l'étude 1, le taux de répondeurs était de 51% ou 57% chez les patients ayant reçu respectivement 55/14 µg de SEFFALAIR SPIROMAX et 113/14 µg de SEFFALAIR SPIROMAX contre 40% chez les patients qui avaient reçu le placebo. Le rapport des cotes était égal à 1,53 (IC à 95%: 0,93, 2,55) ou 2,04 (IC à 95%: 1,23, 3,41).
La fonction pulmonaire s'est améliorée en l'espace de 15 minutes après administration de la première dose (15 minutes après la prise de la dose, la différence entre la variation de la moyenne des MC pour le VEMS par rapport à la valeur initiale était de 0,216 l ou 0,164 l par rapport au placebo pour respectivement 55/14 µg et 113/14 µg de SEFFALAIR SPIROMAX; la valeur p était de < 0,0001 pour les deux posologies par rapport au placebo. Voir l'Illustration 4).
L'amélioration maximale du VEMS a généralement été observée dans les 3 heures pour SEFFALAIR SPIROMAX 55/14 µg et dans les 6 heures pour SEFFALAIR SPIROMAX 113/14 µg. Elle s'est maintenue pendant la période de test de 12 heures aux Semaines 1 et 12 (Illustrations 4 et 5). Après la dose initiale, le VEMS déterminé avant la prise de la dose s'est nettement amélioré par rapport à la valeur initiale mesurée au Jour 1 au cours de la première semaine de traitement et l'amélioration s'est poursuivie pendant les 12 semaines de traitement que comptait l'étude. Après 12 semaines de traitement, aucune atténuation de l'effet bronchodilatateur sur 12 heures mesuré par le VEMS n'a été observée avec les différentes posologies de SEFFALAIR SPIROMAX.
Illustration 4: Spirométries en série: variation de la moyenne du VEMS par rapport à la valeur initiale (I) au Jour 1 selon l'heure et le groupe de traitement, étude 1 (FAS; sous-groupes avec spirométries en série)
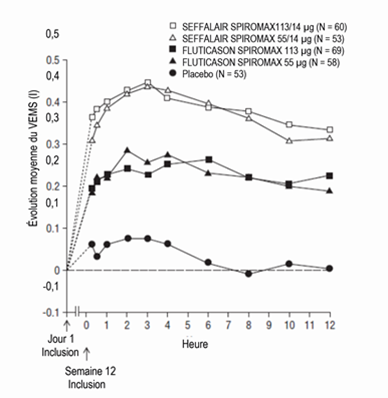
FAS: Full Analysis Set (ensemble d'analyses complet); VEMS: volume expiratoire maximal par seconde
Illustration 5: Spirométries en série: variation de la moyenne du VEMS par rapport à la valeur initiale (I) à la Semaine 12 selon l'heure et le groupe de traitement, étude 1 (FAS; sous-groupes avec spirométries en série)

FAS: Full Analysis Set (ensemble d'analyses complet); VEMS: volume expiratoire maximal par seconde
Étude 2: cette étude mondiale, randomisée, en double aveugle, contrôlée contre placebo de 12 semaines destinée à évaluer l'efficacité et la sécurité a comparé l'inhalation de 113 µg et de 232 µg de propionate de fluticasone en inhalateur pulvérulent multidoseur (FLUTICASON SPIROMAX) (1 inhalation deux fois par jour) et l'inhalation de l'association de 113/14 µg et 232/14 µg de fluticasone/salmétérol en inhalateur pulvérulent multidoseur (SEFFALAIR SPIROMAX) (1 inhalation deux fois par jour) par rapport à un placebo chez des patients adolescents et adultes atteints d'asthme symptomatique persistant malgré l'inhalation de faibles ou moyennes doses d'une corticothérapie ou d'une association de corticostéroïdes/d'agonistes β-2 adrénergiques. Les patients ont reçu un placebo en IPM en simple aveugle puis sont passés à leur traitement de base composé de 55 µg de FLUTICASON SPIROMAX, un CSI, deux fois par jour, pendant la période de rodage. Les patients qui remplissaient tous les critères pour la randomisation ont été assignés aléatoirement à l'un des groupes de traitement suivants: 145 patients ont reçu le placebo, 146 patients ont reçu 113 µg de FLUTICASON SPIROMAX, 146 patients ont reçu 232 µg de FLUTICASON SPIROMAX, 145 patients ont reçu 113/14 µg de SEFFALAIR SPIROMAX et 146 patients ont reçu 232/14 µg de SEFFALAIR SPIROMAX. Les mesures de la valeur initiale du VEMS étaient similaires dans tous les groupes de traitement: pour FLUTICASON SPIROMAX 113 µg: 2,069 l, pour FLUTICASON SPIROMAX 232 µg: 2,075 l, pour SEFFALAIR SPIROMAX 113/14 µg: 2,157 l, pour SEFFALAIR SPIROMAX 232/14 µg: 2,083 l et pour le placebo: 2,141 l. Pour cette étude, les critères d'évaluation principaux étaient la variation par rapport à la valeur initiale du VEMS de creux à la semaine 12 pour tous les patients et l'aire normalisée sous la courbe de la période d'effet plasmatique ajustée par rapport à la valeur initiale sur 12 heures (ASCE0-12h) pour le VEMS à la semaine 12; cette ASCE a été analysée pour un sous-groupe de 312 patients qui a été soumis à des spirométries en série après administration de la dose.
Dans cette étude, les résultats relatifs à l'efficacité étaient similaires à ceux observés dans l'étude 1. Les patients qui ont reçu 113/14 µg de SEFFALAIR SPIROMAX et 232/14 µg de SEFFALAIR SPIROMAX ont montré une amélioration nette et significative du VEMS de creux (113/14 µg de SEFFALAIR SPIROMAX: variation de la moyenne des MC de 0,271 l après 12 semaines et 232/14 µg de SEFFALAIR SPIROMAX variation de la moyenne des MC de 0,272 l après 12 semaines) par rapport aux patients ayant reçu 113 µg de FLUTICASON SPIROMAX (variation de la moyenne des MC de 0,119 l après 12 semaines) et 232 µg de FLUTICASON SPIROMAX (variation de la moyenne des MC de 0,179 l après 12 semaines) et par rapport au placebo (variation de la moyenne des MC de -0,004 l après 12 semaines). La différence des moyennes estimée entre 113/14 µg de SEFFALAIR SPIROMAX et 232/14 µg de SEFFALAIR SPIROMAX par rapport au placebo étaient de 0,274 l (IC à 95%: 0,189, 0,360) ou 0,276 l (IC à 95%: 0,191, 0,361).
La différence des moyennes estimée entre 113 µg de FLUTICASON SPIROMAX et 232 µg de FLUTICASON SPIROMAX par rapport au placebo étaient de 0,123 l (IC à 95%: 0,038, 0,208) ou 0,183 l (IC à 95%: 0,098, 0,268). La différence des moyennes estimée entre 232/14 µg de SEFFALAIR SPIROMAX et 232 µg de FLUTICASON SPIROMAX était de 0,093 l (IC à 95%: 0,009, 0,178). La différence des moyennes estimée entre 113/14 µg de SEFFALAIR SPIROMAX et 113 µg de FLUTICASON SPIROMAX était de 0,152 l (IC à 95%: 0,066, 0,237). En outre, les résultats de la moyenne du VEMS pour chaque visite sont donnés dans l'Illustration 6.
Illustration 6: variation de la moyenne du VEMS de creux par rapport à la valeur initiale à chaque visite selon le groupe de traitement, étude 2 (FAS)
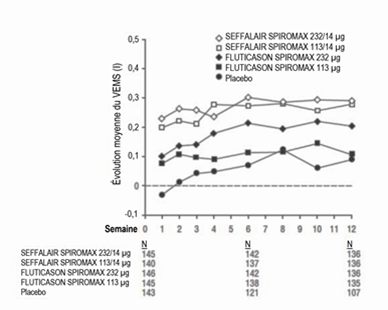
FAS: Full Analysis Set (ensemble d'analyses complet); VEMS: volume expiratoire maximal par seconde
En ce qui concerne les critères d'évaluation secondaires, des preuves certifiées d'efficacité de SEFFALAIR SPIROMAX par rapport au placebo ont été fournies, par exemple en ce qui concerne la valeur de creux matinal journalière du débit expiratoire de pointe et l'administration quotidienne totale des médicaments nécessaires. Une proportion plus faible de patients traités par SEFFALAIR SPIROMAX a quitté l'étude en raison d'une aggravation de leur asthme que de patients ayant reçu le placebo. Dans l'étude 2, les patients âgés de plus de 18 ans ont rempli l'AQLQ (Asthma Quality of Life Questionnaire) et les patients âgés de 12 à 17 ans ont rempli l'AQLQ pédiatrique (PAQLQ). Le taux de répondeurs a été défini pour les deux instruments de mesure comme l'amélioration de la valeur du point de 0,5 ou plus par rapport à la limite de tolérance. Dans l'étude 2, le taux de répondeurs était de 48% ou 41% chez les patients ayant reçu respectivement 113/14 µg de SEFFALAIR SPIROMAX et 232/14 µg DE SEFFALAIR SPIROMAX contre 27% chez les patients qui avaient reçu le placebo. Le rapport des cotes était égal à 2,59 (IC à 95%: 1,56, 4,31) ou 1,94 (IC à 95%: 1,16, 3,23).
La fonction pulmonaire s'est améliorée en l'espace de 15 minutes après administration de la première dose (15 minutes après la prise de la dose, la différence entre la variation de la moyenne des MC pour le VEMS par rapport à la valeur initiale était de 0,160 l ou 0,187 l par rapport au placebo pour respectivement 113/14 µg et 232/14 µg de SEFFALAIR SPIROMAX; la valeur p était de < 0,0001 pour les deux posologies par rapport au placebo). L'amélioration maximale du VEMS a généralement été observée dans les 3 heures pour les deux posologies de SEFFALAIR SPIROMAX. Elle s'est maintenue pendant la période de test de 12 heures aux Semaines 1 et 12 (Illustrations 7 et 8). Après la dose initiale, le VEMS déterminé avant la prise de la dose s'est nettement amélioré par rapport à la valeur initiale mesurée au Jour 1 au cours de la première semaine de traitement et l'amélioration s'est poursuivie pendant les 12 semaines de traitement que comptait l'étude. Après 12 semaines de traitement, aucune atténuation de l'effet bronchodilatateur sur 12 heures mesuré par le VEMS n'a été observée avec les différentes posologies de SEFFALAIR SPIROMAX.
Illustration 7: Spirométries en série: variation de la moyenne du VEMS par rapport à la valeur initiale (I) au Jour 1 selon l'heure et le groupe de traitement, étude 2 (FAS; sous-groupes avec spirométries en série)
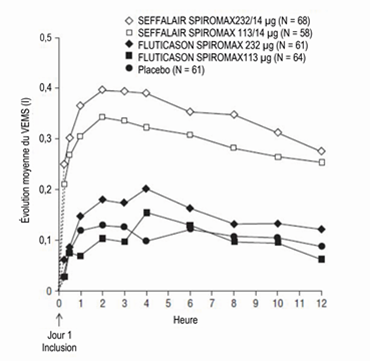
FAS: Full Analysis Set (ensemble d'analyses complet); VEMS: volume expiratoire maximal par seconde
Illustration 8: Spirométries en série: variation de la moyenne du VEMS par rapport à la valeur initiale (I) à la Semaine 12 selon l'heure et le groupe de traitement, étude 2 (FAS; sous-groupes avec spirométries en série)
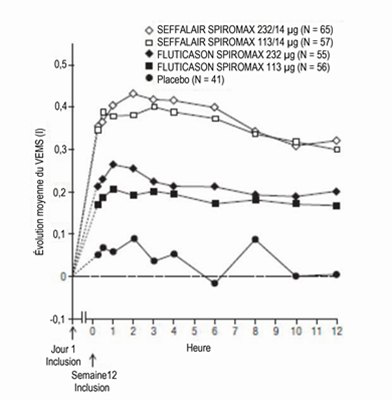
FAS: Full Analysis Set (ensemble d'analyses complet); VEMS: volume expiratoire maximal par seconde
Médicaments contenant du propionate de fluticasone (PF) dans le traitement de l'asthme pendant la grossesse
Une étude observationnelle épidémiologique de cohorte, réalisée de façon rétrospective à partir de dossiers électroniques de patients au Royaume-Uni, a analysé le risque de malformations congénitales majeures (MCM) après l'exposition, au cours du premier trimestre de la grossesse, à l'inhalation de PF seul ou l'inhalation d'une association de salmétérol/PF en comparaison avec un CSI (corticostéroïde inhalé) sans PF. Cette étude n'a inclus aucun groupe de comparaison sous placebo.
131 MCM diagnostiquées ont été identifiées sur 5362 grossesses avec exposition aux CSI au cours du premier trimestre de la grossesse dans la cohorte des asthmatiques. 1612 femmes (30%) avaient été exposées au PF ou au salmétérol/PF, avec 42 cas diagnostiqués de MCM. L'odds ratio ajusté pour une MCM diagnostiquée en l'espace d'un an sous exposition au PF versus CSI sans PF était de 1,1 (IC à 95%: 0,5 à 2,3) chez les femmes sous un traitement anti-asthmatique correspondant au 2e palier d'après la GINA, et de 1,2 (IC à 95%: 0,7 à 2,0) chez les femmes sous un traitement anti-asthmatique correspondant au palier 3 ou supérieur d'après la GINA. Aucune différence du risque de MCM n'a été constatée entre l'exposition au PF seul et l'exposition au salmétérol/PF dans le premier trimestre de la grossesse. Le risque absolu de MCM quel que soit le degré de sévérité de l'asthme était de 2,0 à 2,9 cas pour 100 grossesses avec exposition au PF. Ce taux est comparable à celui observé dans une étude portant sur 15'840 grossesses sans exposition aux médicaments anti-asthmatiques, documentées dans la «General Practice Research Database» (2,8 MCM pour 100 grossesses).
PharmacocinétiqueAprès inhalation de l'association médicamenteuse aux doses thérapeutiques, la pharmacocinétique de chacun des deux principes actifs, à savoir le salmétérol et le propionate de fluticasone, a été comparable à celle enregistrée après administration isolée de chacun des deux composants. C'est pourquoi la pharmacocinétique de ces deux substances est décrite séparément.
Dans une étude d'interactions avec plan d'étude croisé, contrôlée contre placebo, dans laquelle 15 volontaires sains ont été examinés, l'administration simultanée de salmétérol (50 μg 2× par jour; en inhalation) et de l'inhibiteur du CYP3A4, le kétoconazole (400 mg 1× par jour; voie orale) pendant une durée de 7 jours a entraîné une augmentation significative de l'exposition plasmatique au salmétérol (multiplication par 1,4 de la Cmax et par 15 de l'AUC). Aucune augmentation de l'accumulation du salmétérol n'a été constatée lors d'une administration de doses répétées. Chez 3 volontaires, l'administration simultanée de salmétérol et de kétoconazole a été arrêtée en raison d'un allongement de l'intervalle QTc accompagné d'une tachycardie sinusale. Chez les 12 autres volontaires, l'administration simultanée de salmétérol et de kétoconazole n'a pas entraîné d'effet statistiquement significatif sur le pouls, la kaliémie ou l'intervalle QTc (voir «Mises en garde et précautions» et «Interactions»).
Absorption
Salmétérol: Une bronchodilatation efficace (amélioration du VEMS ≥15%) est obtenue au bout de 10 à 20 minutes après l'inhalation; il faut s'attendre à l'effet maximal au bout de 3 heures environ et la durée d'action est d'au moins 12 heures.
Mis en solution, le xinafoate de salmétérol, un sel ionique, se dissocie de sorte que la fraction de salmétérol et celle d'acide 1-hydroxy-2-naphtoïque sont absorbées, distribuées, métabolisées et éliminées indépendamment l'une de l'autre. Le salmétérol agit localement dans le poumon. C'est pourquoi il n'existe pas de corrélation entre le taux plasmatique et l'effet thérapeutique.
Propionate de fluticasone: Chez les sujets sains, la biodisponibilité absolue du propionate de fluticasone administré en inhalation varie de 10 à 30% de la dose nominale, selon la forme galénique utilisée. L'absorption systémique de la substance est essentiellement pulmonaire, cette absorption étant assez rapide initialement, puis plus lente. Le reste de la dose inhalée peut être dégluti, mais ne contribue que très peu à l'exposition systémique en raison de la faible solubilité dans l'eau et de l'important effet de premier passage qui fait que la biodisponibilité orale est inférieure à 1%. L'exposition systémique augmente de façon linéaire avec la dose inhalée.
Distribution
Salmétérol: Il n'existe que peu d'études concernant la pharmacocinétique du salmétérol inhalé, car les concentrations plasmatiques atteintes aux doses thérapeutiques sont très faibles (inférieures à 200 pg/ml), ce qui rend un dosage techniquement difficile. Après l'administration chronique d'une dose inhalée de 50 µg de salmétérol (sous forme de poudre) deux fois par jour, du salmétérol a été décelé en l'espace de 5 à 45 minutes dans le plasma chez 7 asthmatiques. Les taux plasmatiques retrouvés étaient très faibles, les concentrations maximales moyennes, établies au bout de 20 minutes, étaient de 167 pg/ml environ; aucune accumulation de salmétérol n'a été constatée après l'administration de doses répétées. La liaison du salmétérol aux protéines plasmatiques humaines était en moyenne de 96% (in vitro), et ce sur un éventail de concentrations allant de 8 à 7722 ng/ml, c'est-à-dire à des concentrations nettement plus élevées que celles obtenues aux doses thérapeutiques.
Propionate de fluticasone: La distribution du propionate de fluticasone se caractérise par une clairance plasmatique élevée (1150 ml/min), par un volume de distribution important à l'état d'équilibre (environ 300 l) et une demi-vie terminale d'environ 8 heures. Le taux de liaison aux protéines plasmatiques est élevé (91%).
Salmétérol/propionate de fluticasone: Une analyse pharmacocinétique de population ayant utilisé des données de 350 sujets asthmatiques issues de neuf études cliniques contrôlées n'a montré aucune influence cliniquement pertinente de l'âge, du sexe, de la race, du poids, de l'indice de masse corporelle (IMC) ou du VEMS (% de la valeur prédite) sur la clairance apparente et sur le volume apparent de distribution du propionate de fluticasone et du salmétérol.
Dans des études cliniques d'une durée allant jusqu'à 12 semaines, aucune différence entre une association de salmétérol/propionate de fluticasone et une monothérapie par le propionate de fluticasone n'a été observée concernant les effets sur l'axe HHS.
Métabolisme
Salmétérol: Le salmétérol-base est métabolisé quasi intégralement par hydroxylation au moyen de l'enzyme cytochrome P450 CYP3A4 en α-hydroxysalmétérol. Une étude dans laquelle des sujets sains ont reçu à plusieurs reprises des doses de salmétérol et d'érythromycine n'a cependant révélé, à une posologie de 500 mg d'érythromycine trois fois par jour, aucune différence clinique significative au niveau des effets sur la pharmacodynamique.
Après l'administration d'une dose usuelle de salmétérol, de l'acide hydroxynaphtoïque (xinafoate) peut être décelé dans la circulation. Cependant, cette fraction n'a pas d'activité pharmacologique décelable. Le taux de liaison du xinafoate aux protéines plasmatiques est très élevé (plus de 99%) et la demi-vie est d'environ 12 jours.
Une étude d'interactions entre le salmétérol et le kétoconazole a révélé par contre une augmentation significative de l'exposition plasmatique au salmétérol (voir «Mises en garde et précautions» et «Interactions»).
Propionate de fluticasone: Le propionate de fluticasone est très rapidement éliminé de la circulation systémique, essentiellement en étant métabolisé, par l'intermédiaire de l'enzyme CYP3A4 du cytochrome P450, en un dérivé acide carboxylique inactif.
Élimination
Salmétérol: Le salmétérol-base hydroxylé est essentiellement éliminé dans les fèces. Une quantité notable de salmétérol-base sous forme inchangée n'a été démontrée ni dans les urines, ni dans les fèces. La demi-vie d'élimination terminale du salmétérol après inhalation de Seffalair Spiromax est d'environ 12,6 heures.
Propionate de fluticasone: La clairance rénale du propionate de fluticasone est négligeable (<0,2%) et celle de son métabolite inférieure à 5%. La demi-vie d'élimination terminale du propionate de fluticasone après inhalation de Seffalair Spiromax était d'environ 10,8 heures.
Cinétique pour certains groupes de patients
En raison de la faible biodisponibilité orale (<1%) et de l'élimination rénale minime (<0,2%), il n'y a pas lieu de craindre une augmentation significative de l'exposition systémique chez les patients souffrant d'asthme sévère ou de troubles de la fonction hépatique ou rénale.
Données précliniquesOn a mené des études approfondies, chez diverses espèces animales, pour évaluer la toxicité du xinafoate de salmétérol et du propionate de fluticasone. Des effets toxiques n'ont été observés qu'à des doses dépassant largement les doses recommandées chez l'homme. Il s'agissait des effets prévisibles des agonistes β2-adrénergiques puissants et des corticoïdes.
Ni le salmétérol ni le propionate de fluticasone n'ont de potentiel génotoxique.
Dans les études de longue durée, le salmétérol a induit des tumeurs bénignes de la musculature lisse du mésovarium chez la souris et de l'utérus chez la rate. Comme les rongeurs sont considérés comme fortement prédisposés au développement des tumeurs de ce type, le salmétérol n'est cependant pas considéré comme oncogène chez l'homme.
L'administration concomitante de salmétérol et de propionate de fluticasone à fortes doses a provoqué des interactions cardiovasculaires. Des rats ont présenté, temporairement, une myocardite auriculaire et une artérite coronaire focale, qui ont disparu après réduction des doses. Chez les chiens, l'augmentation de la fréquence cardiaque a été plus importante après l'administration concomitante des deux substances qu'après l'administration de salmétérol seul. Chez l'homme, on n'a pas observé d'effets indésirables cardiaques cliniquement significatifs, graves.
L'administration simultanée des deux substances n'a pas modifié les autres effets toxiques des classes de substances.
L'importante expérience acquise en clinique a montré que les effets toxiques décrits plus haut ne surviennent pas après l'utilisation des posologies recommandées.
Toxicité sur la reproduction
Le propionate de fluticasone administré par voie sous-cutanée à des doses allant jusqu'à 50 µg/kg/jour (jusqu'à 100 µg/kg/jour chez des rats mâles avant le jour 36) n'a influencé ni la fertilité, ni le comportement d'accouplement des rats des générations F0 et F1; le médicament a été administré pendant les périodes de gamétogenèse, d'accouplement, de gestation, de mise bas et d'allaitement.
Aucun effet sur la fertilité n'a été constaté chez des rats mâles et femelles traités pendant la période de gamétogenèse par des doses orales de xinafoate de salmétérol allant jusqu'à 2 mg/kg/jour. Une étude similaire sur la fertilité après administration orale de salmétérol-base à la dose élevée de 10 mg/kg/jour n'a pas non plus révélé une influence.
Remarques particulièresStabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Sortir l'inhalateur du sachet au dernier moment, juste avant la première utilisation. Après ouverture, vider l'inhalateur sous 60 jours.
Remarques particulières concernant le stockage
Conserver dans l'emballage d'origine, à l'abri de l'humidité et à température ambiante (15-25°C).
Conserver hors de la portée des enfants.
Remarques concernant la manipulation
Conserver Seffalair Spiromax en position fermée et n'ouvrir le clapet jaune permettant la libération d'une dose que juste avant utilisation.
L'inhalateur n'est pas réutilisable et ne doit pas être démonté en pièces détachées.
Un mode d'emploi précis est intégré dans l'information destinée aux patients.
Numéro d’autorisation67891 (Swissmedic).
PrésentationSeffalair Spiromax 55/14: Inhalateur pulvérulent multidoseur à 60 inhalations de 14 μg de salmétérol et 55 μg de propionate de fluticasone, B.
Seffalair Spiromax 113/14: Inhalateur pulvérulent multidoseur à 60 inhalations de 14 μg de salmétérol et 113 μg de propionate de fluticasone, B.
Seffalair Spiromax 232/14: Inhalateur pulvérulent multidoseur à 60 inhalations de 14 μg de salmétérol et 232 μg de propionate de fluticasone, B.
Titulaire de l’autorisationTeva Pharma AG, Basel.
Mise à jour de l’informationSeptembre 2022.
Numéro de version interne: 3.1
|








