Propriétés/EffetsCode ATC
A16AX16
Mécanisme d’action
Le givosiran est un petit acide ribonucléique interférent pARNi double brin qui provoque la dégradation de l’acide ribonucléique messager ARNm de l’acide aminolévulinique synthase ALAS1 dans les hépatocytes par interférence de l’ARN, entraînant une réduction de l’ARNm ALAS1 hépatique vers la normale. Cela entraîne une réduction des taux circulants d’acide aminolévulinique (ALA) et de porphobilinogène (PBG), principaux facteurs de causalité des crises et autres manifestations de la PHA.
Pharmacodynamique
Au cours de l’étude contrôlée contre placebo menée chez des patients présentant une PHA et recevant du givosiran à raison de 2,5 mg/kg une fois par mois (ENVISION), des réductions médianes des taux d’ALA et de PBG urinaires par rapport à l’inclusion de 83,7 % et 75,1 %, respectivement, ont été observées 14 jours après l’administration de la première dose. Les réductions maximales des taux d’ALA et de PBG ont été atteintes aux alentours du Mois 3 avec des réductions médianes par rapport à l’inclusion de 93,8 % pour l’ALA et de 94,5 % pour le PBG, et se sont maintenues avec l’administration répétée d’une dose mensuelle.
Les données observées et la modélisation ont démontré que l’administration de la dose de 2,5 mg/kg de givosiran une fois par mois a entraîné une réduction plus importante et une fluctuation moindre des taux d’ALA par rapport aux doses inférieures à 2,5 mg/kg ou à l’administration d’une dose tous les 3 mois.
Efficacité clinique
L’efficacité du givosiran a été évaluée dans le cadre d’une étude multinationale randomisée, en double aveugle et contrôlée contre placebo (ENVISION).
ENVISION
Au total, 94 patients présentant une PHA (89 patients présentant une porphyrie aiguë intermittente (PAI), 2 patients présentant une porphyrie variegata (PV), 1 patient présentant une coproporphyrie héréditaire (CH) et 2 patients sans mutation identifiée dans le gène lié à la porphyrie) ont été randomisés pour recevoir soit une injection sous-cutanée une fois par mois de givosiran 2,5 mg/kg soit le placebo pendant la période de double aveugle de 6 mois. Le groupe de patients randomisés pour recevoir du givosiran a inclus 46 patients présentant une PAI, 1 patient présentant une PV et 1 patient présentant une CH. Au cours de cette étude, les critères d’inclusion spécifiaient un minimum de 2 crises de porphyrie nécessitant une hospitalisation, une visite médicale urgente ou l’administration intraveineuse (IV) d’hémine à domicile dans les 6 mois précédant l’inclusion dans l’étude. L’utilisation d’hémine au cours de l’étude a été autorisée dans le cadre du traitement des crises aiguës de porphyrie. L’âge médian des patients de l’étude ENVISION était de 37,5 ans (19 à 65 ans); 89,4 % des patients étaient des femmes et 77,7 % étaient blancs. Les groupes de traitement étaient équilibrés en termes de taux annualisé de crises de porphyrie historique (taux médian global à l’inclusion de 8 par an), de prophylaxie antérieure par hémine, d’utilisation de médicaments opioïdes et des mesures des symptômes chroniques rapportées par les patients entre les crises.
La principale mesure de l’efficacité était le taux annualisé de crises (TAC) pour les crises de porphyrie composites survenant pendant la période de 6 mois en double aveugle dont les trois composantes sont: crises nécessitant une hospitalisation, une visite urgente chez le médecin ou l’administration d’hémine par voie IV à domicile. Cette mesure composite de l’efficacité a été évaluée comme critère d’évaluation principal chez les patients présentant une PAI et comme critère d’évaluation secondaire dans la population générale de patients présentant une PHA. Le traitement par ce médicament a entraîné une réduction significative du TAC pour les crises de porphyrie composites, comparativement au placebo, de 74 % chez les patients présentant une PAI (Tableau 1). Des résultats comparables ont été observés chez les patients présentant une PHA, avec une réduction de 73 %. Des résultats concordants ont été observés pour chacune des 3 composantes du critère d’évaluation de crise de porphyrie composite.
Les résultats observés sur 6 mois se sont maintenus jusqu’au Mois 12, avec un TAC médian (Q1, Q3) de 0,0 (0,0 ; 3,5) chez les patients ayant poursuivi l’administration du médicament pendant la période d’extension en ouvert.
Chez les patients présentant une PHA, le givosiran a réduit les crises de porphyrie, comparativement au placebo, pour tous les sous-groupes pré-spécifiés, notamment l’âge, le sexe, l’origine ethnique, la région, l’indice de masse corporelle (IMC) à l’inclusion, l’utilisation antérieure de prophylaxie par hémine, le taux de crises historique, l’utilisation antérieure chronique d’opioïdes sans crise et la présence de symptômes chroniques antérieurs en dehors des crises.
D’autres critères d’évaluation de l’efficacité clinique ont été étudiés chez des patients présentant une PAI et sont résumés dans le Tableau 1.
Tableau 1: Résultats de l’efficacité clinique chez les patients présentant une PAI au cours de la période de 6 mois en double aveugle de l’étude ENVISION
|
Critère d’évaluation
|
Placebo
|
Givosiran
| |
(N = 43)
|
(N = 46)
| |
Taux annualisé de crises pour les crises de porphyrie compositesa
| |
TAC moyen (IC à 95%)b
|
12,5 (9,4; 16,8)
|
3,2 (2,3; 4,6)
| |
Rapport de taux (IC à 95%)b (givosiran/placebo)
|
0,26 (0,16; 0,41)
| |
Valeur de pb
|
< 0,001
| |
TAC médian, (Q1, Q3)
|
10,7 (2,2; 26,1)
|
1,0 (0,0; 6,2)
| |
Nombre de patients avec 0 crise (%)
|
7 (16,3)
|
23 (50,0)
| |
Nombre annualisé de jours d’utilisation d’hémine
| |
Moyenne (IC à 95%)b
|
29,7 (18,4; 47,9)
|
6,8 (4,2; 10,9)
| |
Rapport (IC à 95 %)b (givosiran/placebo)
|
0,23 (0,11; 0,45)
| |
Valeur de pb
|
< 0,001
| |
Score quotidien de la douleur la plus intensec
| |
Inclusion, médiane (Q1, Q3)
|
3,3 (1,9; 5,6)
|
2,2 (1,2; 4,5)
| |
Médiane de la différence de traitement (95%) (givosiran-placebo)
|
−10,1 (−22,8; 0,9)
| |
Valeur de p
|
< 0,05
| |
SCP du SF-12d
| |
Inclusion, moyenne (ET)
|
38,4 (9,4)
|
39,4 (9,6)
| |
Changement par rapport à l’inclusion au Mois 6, moyenne des MC (IC à 95%)
|
1,4 (−1,0; 3,9)
|
5,4 (3,0; 7,7)
| |
Différence de la moyenne des MC (IC à 95%) (givosiran- placebo)
|
3,9 (0,6; 7,3)
| |
Valeur de p nominale
|
< 0,05
|
TAC: taux annualisé de crises; PAI: porphyrie aiguë intermittente; IC: intervalle de confiance; Q1: quartile 1; Q3: quartile 3; MC: moindres carrés; SCP: score composite physique; SF-12: questionnaire abrégé de l’enquête sur la santé en 12 items.
a Les crises de porphyrie composites comprennent trois composantes: les crises nécessitant une hospitalisation, les visites urgentes chez le médecin ou l’administration d’hémine par voie IV à domicile.
b D’après un modèle de régression binomiale négative. Un rapport de taux < 1 représente un résultat favorable pour le givosiran.
c Les patients ont fourni une auto-évaluation quotidienne de leur douleur la plus intense selon une échelle d’évaluation numérique (EEN) allant de 0 à 10. Un score plus faible indique moins de symptômes. La médiane de la différence thérapeutique et de l’IC ont été estimées à l’aide de la méthode de Hodges-Lehmann; la valeur de p était basée sur le test de Wilcoxon-Mann-Whitney, réalisé post-hoc, après que les données ont montré une déviation significative par rapport à la distribution normale.
d Un score plus élevé indique une amélioration de la qualité de vie liée à la santé, analysée à l’aide de la méthode du modèle mixte pour mesures répétées (MMRM). La significativité statistique du critère d’évaluation n’a pas été formellement étudiée; une valeur de p nominale a été rapportée.
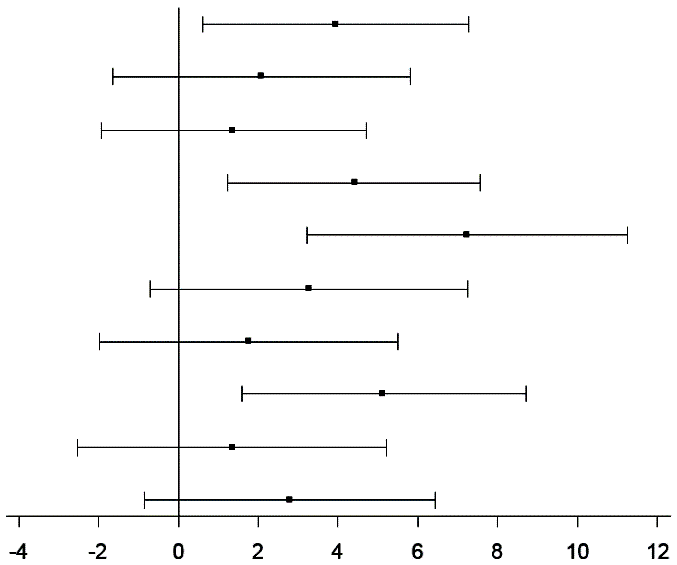
Outre une plus grande amélioration du SCP du SF-12 depuis l’inclusion par rapport aux patients sous placebo au Mois 6, des preuves cohérentes de l’effet en faveur de ce médicament ont été observées dans les domaines douleur physique, limitation physique et relations sociales, mais pas dans les domaines santé générale, fonction physique, limitation émotionnelle, vitalité et santé mentale (Figure 1).
Figure 1: Changement en matière de scores des domaines du SF-12, de l’inclusion au Mois 6, chez les patients présentant une PAI
|
Domaine du SF-12
|
Givosiran – Placebo
|
|
Pbo (n)
|
Givo (n)
|
Différence entre les moyennes des MC
|
IC à 95%
| |
Score composite physique (SCP)
|
|
|
42
|
45
|
3,9
|
(0,6 ; 7,3)
| |
Score composite mental (SCM)
|
42
|
45
|
2,1
|
(−1,7 ; 5,8)
| |
Fonction physique
|
43
|
46
|
1,4
|
(−2,0 ; 4,7)
| |
Limitation physique
|
43
|
46
|
4,4
|
(1,3 ; 7,5)
| |
Douleur physique
|
43
|
46
|
7,2
|
(3,2 ; 11,2)
| |
Santé générale
|
42
|
46
|
3,3
|
(−0,7 ; 7,2)
| |
Vitalité
|
42
|
45
|
1,7
|
(−2,0 ; 5,5)
| |
Relations sociales
|
42
|
45
|
5,1
|
(1,6 ; 8,7)
| |
Limitation émotionnelle
|
43
|
46
|
1,4
|
(−2,5 ; 5,2)
| |
Santé mentale
|
42
|
45
|
2,8
|
(−0,9 ; 6,4)
| |
|
|
|
|
| |
|
En faveur du placebo
|
En faveur du givosiran
|
|
|
|
|
|
PAI: porphyrie aiguë intermittente; IC: intervalle de confiance; Givo: givosiran; Pbo: placebo; MC: moindres carrés; SCM: score composite mental; SCP: score composite physique; SF-12: questionnaire abrégé de l’enquête sur la santé en 12 items version 2.
Dans une évaluation globale par le patient (perception globale de l’évolution par le patient — PGIC), une plus grande proportion de patients présentant une PAI traités par givosiran (61,1%) que de patients sous placebo (20 %) a évalué son état général comme «très fortement amélioré» ou «fortement amélioré» depuis le début de l’étude.
Sécurité et efficacité en pédiatrie
Swissmedic a accordé une dérogation à l’obligation de soumettre les résultats d’études réalisées avec ce médicament dans tous les sous-groupes de la population pédiatrique dans le traitement de la PHA (voir «Posologie/Mode d’emploi» et «Pharmacocinétique» pour les informations concernant l’usage pédiatrique).
|

