CompositionPrincipes actifs
Buprénorphine.
Excipients
Buvidal hebdomadaire: phosphatidylcholine de soja, dioléate de glycérol, éthanol anhydre (15.31 mg par 8 mg dose; 30.62 mg par 16 mg dose; 45.94 mg par 24 mg dose; 61.25 mg par 32 mg dose).
Buvidal mensuel: phosphatidylcholine de soja, dioléate de glycérol, N-méthylpyrrolidone.
Indications/Possibilités d’emploiTraitement de la dépendance aux opioïdes, dans le cadre d’une prise en charge médicale, sociale et psychologique. Le traitement est réservé aux adultes et aux adolescents âgés de16 ans ou plus.
Posologie/Mode d’emploiL’administration de Buvidal est exclusivement réservée aux professionnels de santé. Les précautions adéquates, telles qu’effectuer des visites de suivi avec surveillance clinique selon les besoins du patient, doivent être prises lors de la prescription et de la délivrance de buprénorphine. L’utilisation à domicile ou l’auto-administration du produit par les patients n’est pas autorisée.
Précautions à prendre avant l’instauration du traitement
Afin d’éviter de précipiter l’apparition d’un syndrome de sevrage, le traitement par Buvidal doit être instauré dès que des signes objectifs et manifestes de sevrage sont présents (voir « Mises en garde et précautions »). Il convient de prendre en compte le type d’opioïdes consommés (opioïdes à durée d’action longue ou courte), l’intervalle de temps écoulé depuis la dernière prise d’opioïdes et le niveau de dépendance aux opioïdes.
·Pour les patients dépendants à l’héroïne ou aux opioïdes à courte durée d’action, la dose initiale de Buvidal doit être administrée après un délai d’au moins 6 heures après la dernière prise d’opioïdes par le patient.
·Pour les patients recevant de la méthadone, la dose de méthadone doit être diminuée à une posologie maximum de 30 mg/jour, avant d’instaurer le traitement par Buvidal. La première dose de Buvidal ne doit être administrée qu’après un délai d’au moins 24 heures depuis la dernière prise de méthadone du patient. Buvidal peut induire l’apparition des symptômes de sevrage chez les patients dépendants à la méthadone.
Posologie
Instauration du traitement chez les patients non préalablement traités par la buprénorphine
Les patients qui n’ont jamais été traités par la buprénorphine doivent au préalable recevoir une dose de 4 mg de buprénorphine sublinguale et rester sous observation pendant une heure avant la première administration de Buvidal hebdomadaire afin de confirmer leur tolérance à la buprénorphine.
La dose initiale recommandée de Buvidal est de 16 mg, avec la possibilité d’ajouter au cours de la première semaine de traitement une ou deux doses supplémentaires de 8 mg à au moins 1 jour d’intervalle, jusqu’à une dose cible de 24 mg ou 32 mg. La dose recommandée pour la deuxième semaine de traitement est la dose totale administrée au cours de la semaine d’instauration du traitement.
Le traitement par Buvidal mensuel peut être débuté après l’instauration du traitement par Buvidal hebdomadaire, conformément à la conversion de doses indiquée dans le Tableau 2, et dès que les patients ont été stabilisés avec le traitement hebdomadaire (quatre semaines ou plus si besoin).
Passage de la buprénorphine sublinguale à Buvidal
Les patients traités par la buprénorphine sublinguale peuvent recevoir directement Buvidal hebdomadaire ou mensuel, à compter du lendemain de la prise de la dernière dose de buprénorphine sublinguale, conformément aux recommandations posologiques indiquées dans la Tableau 1. Une surveillance plus étroite des patients est recommandée au cours de la période de changement.
Tableau 1. Doses de buprénorphine sublinguale quotidiennes et doses correspondantes recommandées de Buvidal hebdomadaire et mensuel
|
Dose de buprénorphine sublinguale quotidienne
|
Dose de Buvidal hebdomadaire
|
Dose de Buvidal mensuelle
| |
2-6 mg
|
8 mg
|
| |
8-10 mg
|
16 mg
|
64 mg
| |
12-16 mg
|
24 mg
|
96 mg
| |
18-24 mg
|
32 mg
|
128 mg
|
La différence de dose en mg de buprénorphine d’un médicament sublingual à l’autre doit être prise en considération. Les propriétés pharmacocinétiques de Buvidal sont décrites à «Pharmacocinétique».
Traitement d’entretien et ajustements posologiques
Buvidal peut être administré chaque semaine ou chaque mois. Les doses peuvent être augmentées ou diminuées, et le traitement peut être interchangable entre une administration hebdomadaire et mensuelle, en fonction des besoins du patient et de l’avis clinique du médecin, conformément aux recommandations indiquées dans le Tableau 2. Après un changement, une surveillance plus étroite des patients peut être nécessaire. L’évaluation du traitement à long terme est basée sur les données à 48 semaines.
Tableau 2. Conversion de dose recommandée lors du passage d’une posologie hebdomadaire à mensuelle, ou d’une posologie mensuelle à hebdomadaire
|
Dose de Buvidal hebdomadaire
|
Dose de Buvidal mensuelle
| |
16 mg
|
64 mg
| |
24 mg
|
96 mg
| |
32 mg
|
128 mg
|
Dose supplémentaire
Une dose supplémentaire de 8 mg de Buvidal au maximum peut être administrée lors d’une visite non prévue entre les doses habituelles hebdomadaires et mensuelles, en fonction des besoins du patient. La dose hebdomadaire maximale pour les patients traités par Buvidal hebdomadaire est de 32 mg avec une dose supplémentaire de 8 mg. La dose mensuelle maximale pour les patients traités par Buvidal mensuel est de 128 mg avec une dose supplémentaire de 8 mg.
Doses manquées
Pour éviter les doses manquées, la dose hebdomadaire peut être administrée au maximum 2 jours avant ou après la date habituelle d’administration ; et la dose mensuelle peut être administrée au maximum 1 semaine avant ou après la date habituelle d’administration.
En cas d’oubli d’une dose, la dose suivante doit être administrée dès que possible.
Arrêt du traitement
Si le traitement par Buvidal est arrêté, ses propriétés à libération prolongée et tout symptôme de sevrage présenté par le patient doivent être pris en compte, voir « Mises en garde et précautions ». Un changement de traitement pour la buprénorphine sublinguale doit se faire une semaine après la dernière dose hebdomadaire ou un mois après la dernière dose mensuelle de Buvidal conformément aux recommandations indiquées dans le Tableau 1.
Instructions posologiques particulières
Patients âgés
La sécurité et l’efficacité de la buprénorphine chez les patients âgés de plus de 65 ans n’ont pas été établies. Aucune recommandation sur la posologie ne peut être donnée.
De façon générale, la posologie recommandée pour les personnes âgées ayant une fonction rénale normale est la même que pour les patients adultes plus jeunes ayant une fonction rénale normale. Toutefois, les personnes âgées pouvant avoir une fonction rénale/hépatique diminuée, un ajustement posologique peut être nécessaire (voir « Patients présentant des troubles de la fonction hépatique » et « Patients présentant des troubles de la fonction rénale », ci-dessous).
Patients présentant des troubles de la fonction hépatique
La buprénorphine doit être utilisée avec précaution chez les patients présentant d’insuffisance hépatique modérée (voir « Pharmacocinétique »). Chez les patients présentant une insuffisance hépatique sévère, l’utilisation de buprénorphine est contre-indiquée (voir « Contre-indications »).
Patients présentant des troubles de la fonction rénale
La modification de la dose de buprénorphine n’est pas nécessaire chez les patients présentant une insuffisance rénale. La prudence est recommandée lors de l’administration aux patients présentant une insuffisance rénale sévère (clairance de la créatinine < 30 ml/min) (voir « Mises en garde et précautions » et « Pharmacocinétique »).
Enfants et adolescents
La sécurité et l’efficacité de la buprénorphine chez les enfants et adolescents âgés de moins de 16 ans n’ont pas été établies (voir « Mises en garde et précautions »). Aucune donnée n’est disponible.
Mode d’administration
Buvidal s’administre par voie sous-cutanée exclusivement. Il doit être injecté lentement et intégralement dans le tissu sous-cutané de différentes régions (fesse, cuisse, abdomen ou bras), à condition qu’il y ait suffisamment de tissu sous-cutané. Chacune de ces régions peut avoir plusieurs sites d’injection. Il convient d’alterner les sites des injections, qu’elles soient mensuelles ou hebdomadaires. Un minimum de 8 semaines doit s’écouler avant de réinjecter dans un site préalablement utilisé pour la dose hebdomadaire. Il n’y a pas de données cliniques étayant la reinjection de la dose mensuelle au même site. Il est peu probable que la réinjection du produit mensuel au même site pose un problème de sécurité. La décision de réinjecter au même site doit également être guidée par le jugement clinique du médecin traitant. Chaque injection doit être administrée par un professionnel de santé. La dose doit être administrée en une seule injection et ne doit pas être fractionnée. La dose ne doit pas être administrée par voie intravasculaire (intraveineuse), intramusculaire ou intradermique (dans la peau) (voir « Mises en garde et précautions »). Voir « Remarques particulières » pour les consignes d’administration.
Contre-indications·Hypersensibilité à la substance active ou à l’un des excipients
·Insuffisance respiratoire sévère
·Insuffisance hépatique sévère
·Alcoolisme aigu ou delirium tremens
Mises en garde et précautionsAdministration
Des précautions doivent être prises pour éviter toute injection accidentelle de Buvidal. La dose ne doit pas être administrée par voie intravasculaire (intraveineuse), intramusculaire ou intradermique.
Une injection par voie intravasculaire, par exemple intraveineuse, présente un risque grave du fait qu’au contact avec les fluides corporels Buvidal forme localement une masse solide qui potentiellement pourrait entrainer au niveau des vaisseaux sanguins une lésion ou une occlusion ou des événements thromboemboliques.
Afin de réduire le risque de mésusage, d’abus ou de détournement, les précautions adéquates doivent être prises lors de la prescription et de la délivrance de buprénorphine. Les professionnels de santé doivent administrer Buvidal directement au patient. L’utilisation à domicile ou l’autoadministration du produit par les patients n’est pas autorisée. Il convient de s’assurer pendant toute la durée du traitement que le patient n’essaie pas d’extraire le dépôt.
Propriétés à libération prolongée
Les propriétés de libération prolongée du médicament doivent être prises en compte pendant le traitement, y compris à l’instauration et lors de l’arrêt du traitement. En particulier, les patients recevant des médicaments concomitants et/ou qui présentent des comorbidités doivent faire l’objet d’une surveillance des signes et symptômes de toxicité, de surdosage ou de sevrage causés par une augmentation ou une diminution des concentrations en buprénorphine.
Pour les propriétés pharmacocinétiques, voir « Pharmacocinétique », et pour l’arrêt du traitement, voir « Posologie/Mode d’emploi ».
Dépression respiratoire
Comme pour tous les opioïdes, l’utilisation de Buvidal comporte un risque de dépression respiratoire cliniquement significative. Si elle n’est pas détectée et traitée immédiatement, une dépression respiratoire peut conduire à un arrêt respiratoire et au décès. En fonction de l’état clinique du patient, le traitement d’une dépression respiratoire peut inclure une surveillance étroite, des mesures de soutien et l’administration d’antagonistes des opioïdes. Une dépression respiratoire grave, engageant le pronostic vital ou d’issue fatale peut survenir à tout moment du traitement, mais le risque est maximal au début du traitement et après une augmentation posologique.
Des cas de décès en raison d’une dépression respiratoire ont été rapportés chez des patients traités par la buprénorphine, en particulier lorsque la buprénorphine a été utilisée en association avec des benzodiazépines (voir « Interactions ») ou lorsqu’elle n’avait pas été utilisée conformément à la prescription. Des décès ont également été rapportés après la prise concomitante de buprénorphine et d’autres dépresseurs du système nerveux central, tels que l’alcool, les gabapentinoïdes (prégabaline et gabapentine) (voir « Interactions ») ou d’autres opioïdes.
La buprénorphine doit être utilisée avec précaution chez les patients présentant d’insuffisance respiratoire (telle qu’une maladie pulmonaire obstructive chronique, asthme, cœur pulmonaire, diminution de la capacité respiratoire, hypoxie, hypercapnie, dépression respiratoire préexistante ou cyphoscoliose).
Exposition accidentelle
L’administration de Buvidal est exclusivement réservée aux professionnels de santé. Buvidal contient un principe actif dans une concentration qui peut être fatale, notamment pour les enfants.
Utilisation concomitante de substances ayant un effet dépresseur sur le système nerveux central
L’utilisation concomitante d’opioïdes et de benzodiazépines ou d’autres substances ayant un effet dépresseur sur le système nerveux central (SNC) peut entraîner une sédation importante, une dépression respiratoire, un coma ou le décès. Étant donné ces risques, il ne faut administrer de manière concomitante des opioïdes et des benzodiazépines ou d’autres médicaments ayant un effet dépresseur sur le SNC que chez les patients pour lesquels aucune autre option de traitement n’est envisageable. Si l’on décide de prescrire Buvidal en même temps que des benzodiazépines ou d’autres médicaments ayant un effet dépresseur sur le SNC, il convient d’opter pour la posologie minimale efficace et la plus courte durée possible de traitements concomitants. Les patients doivent faire l’objet d’une surveillance étroite afin de détecter les signes et symptômes de dépression respiratoire et de sédation (voir rubrique « Interactions »).
Dépendance médicamenteuse et potentiel d’abus
La buprénorphine est un agoniste partiel du récepteur opioïde µ. L’utilisation répétée d’opioïdes peut entraîner le développement d’une tolérance et d’une dépendance physique et/ou psychique. On peut observer l’apparition d’une dépendance iatrogène après l’utilisation d’opioïdes. Comme d’autres opioïdes, Buvidal peut faire l’objet d’abus et il convient de surveiller les signes d’abus et de dépendance chez tous les patients recevant des opioïdes. Les patients présentant un risque accru d’abus d’opioïdes peuvent cependant être adéquatement traités par des opioïdes, mais doivent faire l’objet d’une surveillance complémentaire pour détecter les signes de mésusage, d’abus ou de dépendance. L’utilisation répétée de Buvidal peut induire un trouble de l’usage d’opioïdes (TUO). L’abus ou le mésusage intentionnel de Buvidal peut conduire à un surdosage et/ou au décès. Le risque de développer un TUO est accru chez les patients ayant des antécédents personnels ou familiaux (parents ou frères et sœurs) de troubles de l’usage de substances (y compris l’alcool), chez les fumeurs ou chez les patients présentant d’autres affections psychiques (p. ex. dépression majeure, troubles anxieux et troubles de la personnalité) dans l’anamnèse. Il convient de surveiller les signes d’un comportement addictif (drug-seeking behaviour) (p. ex. demandes prématurées de renouvellement d’ordonnance). Cela inclut le contrôle de l’utilisation concomitante d’opioïdes et de médicaments psychoactifs (comme les benzodiazépines). Pour les patients présentant des signes et symptômes de troubles de l’usage d’opioïdes, la consultation d’un spécialiste des addictions doit être envisagée.
Syndrome sérotoninergique
L’administration concomitante de Buvidal et d’autres agents sérotoninergiques, tels que les inhibiteurs de la monoamine oxydase (MAO), les inhibiteurs sélectifs de la recapture de la sérotonine (ISRS), les inhibiteurs de la recapture de la sérotonine et de la noradrénaline (IRSN) ou les antidépresseurs tricycliques, peut engendrer un syndrome sérotoninergique, qui est une maladie potentiellement mortelle (voir « Interactions »). Si un traitement concomitant avec d’autres agents sérotoninergiques est justifié sur le plan clinique, il est conseillé d’observer attentivement le patient, tout particulièrement pendant l’instauration du traitement et les augmentations de dose.
Les symptômes du syndrome sérotoninergique peuvent comprendre des modifications de l’état mental, une instabilité autonome, des anomalies neuromusculaires et/ou des symptômes gastro-intestinaux.
En cas de suspicion de syndrome sérotoninergique, une réduction de dose ou un arrêt du traitement devra être envisagé(e) en fonction de la gravité des symptômes.
Hépatite et atteintes hépatiques
Un bilan hépatique et la recherche d’hépatite virale sont recommandés avant l’instauration du traitement. Les patients atteints d’hépatite virale, sous traitement médical concomitant (voir « Interactions ») et/ou qui présentent une altération de la fonction hépatique ont un risque accru d’atteinte du foie. Une surveillance régulière de la fonction hépatique est recommandée.
Des cas d’atteinte hépatique aiguë ont été signalés chez des patients dépendants aux opioïdes prenant des médicaments contenant de la buprénorphine, tant dans les études cliniques que dans des rapports d’effets indésirables de pharmacovigilance. Les anomalies observées vont d’une élévation transitoire asymptomatique des transaminases hépatiques à des cas d’hépatite cytolytique, d’insuffisance hépatique, de nécrose hépatique, de syndrome hépatorénal, d’encéphalopathie hépatique et de décès. Dans de nombreux cas, la présence préexistante d’anomalies enzymatiques hépatiques, de maladie génétique, d’infection par le virus de l’hépatite B ou de l’hépatite C, d’abus d’alcool, d’anorexie, d’utilisation concomitante d’autres médicaments potentiellement hépatotoxiques et la persistance d’injection de drogues pourraient être responsables d’atteinte hépatique ou y contribuer. Ces facteurs sous-jacents doivent être pris en compte avant la prescription de buprénorphine et pendant le traitement. En cas de suspicion d’atteinte hépatique, une évaluation biologique et étiologique est nécessaire. En fonction des résultats, il peut être nécessaire d’arrêter le traitement par Buvidal. La surveillance au-delà de la période de traitement hebdomadaire ou mensuel peut être nécessaire. Si le traitement est poursuivi, la fonction hépatique doit être étroitement surveillée.
Précipitation du syndrome de sevrage aux opioïdes
Lors de l’instauration d’un traitement par buprénorphine, il est important de prendre en compte le profil agoniste partiel de la buprénorphine. La buprénorphine peut précipiter l’apparition des symptômes de sevrage chez les patients dépendants aux opioïdes lorsqu’elle est administrée avant la disparition des effets agonistes dus à un récent usage ou mésusage d’opioïdes. Afin d’éviter la précipitation des symptômes de sevrage, le traitement doit être instauré lorsque des signes et symptômes objectifs de sevrage léger à modéré sont évidents (voir « Posologie/Mode d’emploi »).
L’arrêt du traitement peut entraîner un syndrome de sevrage d’apparition tardive.
Insuffisance hépatique
La buprénorphine est largement métabolisée par le foie. Les patients présentant une insuffisance hépatique modérée doivent faire l’objet d’une surveillance pour détecter des signes et symptômes de sevrage d’opioïdes, de toxicité ou de surdosage causé par une augmentation des taux de buprénorphine. La buprénorphine doit être utilisée avec précaution chez les patients atteints d’insuffisance hépatique modérée (voir « Posologie/Mode d’emploi » et « Pharmacocinétique »). La fonction hépatique doit être contrôlée régulièrement au cours du traitement. L’utilisation de buprénorphine est contre-indiquée chez les patients présentant d’insuffisance hépatique sévère (voir « Contre-indications »).
Insuffisance rénale
Les métabolites de la buprénorphine s’accumulent chez les patients présentant d’insuffisance rénale. La prudence est recommandée chez les patients présentant d’insuffisance rénale sévère (clairance de la créatinine < 30 ml/min), voir rubriques « Posologie/Mode d’emploi » et « Pharmacocinétique ».
Allongement de l’intervalle QT
La prudence est recommandée en cas d’administration conjointe de Buvidal et d’autres médicaments qui allongent l’intervalle QT, ainsi que chez les patients ayant des antécédents de syndrome du QT long ou d’autres facteurs de risque d’allongement du QT.
Prise en charge de la douleur aiguë
Pour la prise en charge de la douleur aiguë pendant l’utilisation continue de Buvidal, l’utilisation d’antalgiques opioïdes forts avec une haute affinité au récepteur opioïde µ (p. ex. fentanyl), d’antalgiques non opioïdes et d’anesthésie loco-régionale peut être nécessaire. Une augmentation posologique des antalgiques opioïdes de durée d’action courte (morphine à libération immédiate, oxycodone ou fentanyl), par voie orale ou intraveineuse, jusqu’à l’obtention de l’effet antalgique souhaité chez les patients traités par Buvidal, peut être nécessaire. Les patients doivent faire l’objet d’une surveillance pendant le traitement.
Utilisation chez les enfants et adolescents
La sécurité et l’efficacité de la buprénorphine chez les enfants et adolescents âgés de moins de 16 ans n’ont pas été établies (voir « Posologie/Mode d’emploi »). En raison du manque de données chez les adolescents (âgés de 16 ou 17 ans), les patients de cette tranche d’âge doivent être étroitement surveillés durant le traitement.
Syndrome de sevrage des opioïdes chez le nouveau-né
L’utilisation prolongée de Buvidal pendant la grossesse peut entraîner un syndrome de sevrage des opioïdes chez le nouveau-né qui peut engager le pronostic vital s’il n’est pas détecté et traité en temps opportun. Le traitement doit être mené selon les protocoles mis en place par les spécialistes de néonatologie. S’il est nécessaire d’utiliser des opioïdes chez une femme enceinte pendant une période prolongée, il convient d’informer la patiente du risque de syndrome de sevrage des opioïdes chez le nouveau-né et de s’assurer que le traitement adapté est disponible, le cas échéant.
Effets de classe
Les opioïdes peuvent provoquer une hypotension orthostatique.
Les opioïdes peuvent augmenter la pression du liquide céphalorachidien, ce qui peut être à l’origine de crises d’épilepsie. Par conséquent, ils doivent être utilisés avec précaution chez les patients atteints de traumatisme crânien, de lésions intracrâniennes, dans d’autres circonstances où la pression du liquide céphalorachidien peut être augmentée, ou en cas d’antécédents de crise d’épilepsie.
Les opioïdes doivent être utilisés avec précaution chez les patients atteints d’hypotension, d’hypertrophie prostatique ou de sténose urétrale.
Un myosis induit par les opioïdes, des altérations du niveau de conscience ou de la perception de la douleur en tant que symptôme d’une maladie peuvent interférer avec l’évaluation des patients ou compliquer le diagnostic ou l’évolution clinique d’une maladie concomitante.
Il a été démontré que les opioïdes augmentent la pression du canal cholédoque et doivent être utilisés avec précaution chez les patients présentant un dysfonctionnement des voies biliaires.
Les opioïdes doivent être utilisés avec précaution chez les patients atteints de myxœdème, d’hypothyroïdie ou d’insuffisance corticosurrénale (p. ex., la maladie d’Addison).
Insuffisance surrénale
Les opioïdes peuvent provoquer une insuffisance surrénale réversible nécessitant une surveillance et un traitement de substitution par glucocorticoïdes. Les symptômes d’une insuffisance surrénale peuvent notamment inclure des nausées, des vomissements, une perte d’appétit, de la fatigue, une faiblesse, des vertiges ou une pression artérielle basse.
Troubles respiratoires liés au sommeil
Les opioïdes peuvent provoquer des troubles respiratoires liés au sommeil, notamment une apnée centrale du sommeil (ACS) et une hypoxémie liée au sommeil. L’utilisation d’opioïdes majore le risque d’ACS de façon dose-dépendante. Chez les patients souffrant d’ACS, une réduction de la dose totale d’opioïdes doit être envisagée.
Diminution des hormones sexuelles et augmentation de la prolactine
L’utilisation à long terme d’opioïdes peut être associée à une diminution des taux d’hormones sexuelles et à une augmentation du taux de prolactine. Les symptômes incluent une baisse de la libido, une impuissance ou une aménorrhée.
Buvidal hebdomadaire
Ce médicament contient 61,25 mg d'alcool (éthanol) par 32 mg dose équivalent à 95,7 mg/ml (9.75% p/v). La quantité en 32 mg dose de ce médicament équivaut à moins de 2 ml de bière ou 1 ml de vin.
La faible quantité d'alcool contenue dans ce médicament n'est pas susceptible d'entraîner d'effet notable.
InteractionsAucune étude d’interaction n’a été réalisée avec Buvidal.
L’utilisation concomitante d’autres médicaments ayant un effet sur le SNC, p. ex. d’autres opioïdes, les sédatifs comme les benzodiazépines ou les hypnotiques, les anesthésiques généraux, la phénothiazine, les tranquillisants, les myorelaxants, les antihistaminiques avec effet sédatif, les gabapentinoïdes (gabapentine et prégabaline) et l’alcool, peut avoir des effets dépresseurs additifs qui peuvent conduire à une dépression respiratoire, une hypotension, une sédation importante ou un coma, et même parfois être d’issue fatale (voir rubrique « Mises en garde et précautions »).
La buprénorphine doit être utilisée avec précaution en cas d’administration concomitante avec :
·Benzodiazépines: cette association peut provoquer le décès par dépression respiratoire d’origine centrale. Par conséquent, les posologies doivent être étroitement surveillées, et cette association doit être évitée dans les cas où il existe un risque d’abus. Les patients doivent être avertis qu’il est extrêmement dangereux de s’auto-administrer des benzodiazépines non prescrites tout en prenant ce produit, et doivent également être avertis que l’utilisation de benzodiazépines en concomitance avec ce produit doit se faire uniquement selon les indications de leur médecin (voir « Mises en garde et précautions »).
·Gabapentinoïdes: cette association peut provoquer le décès par dépression respiratoire. Par conséquent, les posologies doivent être étroitement surveillées, et cette association doit être évitée dans les cas où il existe un risque d’abus. Les patients doivent être avertis que l’utilisation de gabapentinoïdes (p. ex. prégabaline et gabapentine) en concomitance avec ce produit doit se faire exclusivement selon les indications de leur médecin (voir « Mises en garde et précautions »).
·Boissons alcoolisées ou médicaments contenant de l’alcool, puisque l’alcool augmente l’effet sédatif de la buprénorphine (voir « Effet sur l’aptitude à la conduite et l’utilisation de machines »).
·Autres dépresseurs du système nerveux central: autres dérivés opioïdes (p. ex. méthadone, antalgiques et antitussifs), certains antidépresseurs, les antihistaminiques H1 sédatifs, les barbituriques, les anxiolytiques autres que les benzodiazépines, les antipsychotiques, la clonidine et les substances apparentées. Ces associations augmentent la dépression du système nerveux central. La baisse du niveau de vigilance peut rendre dangereuse la conduite et l’utilisation de machines (voir « Effet sur l’aptitude à la conduite et l’utilisation de machines »).
·Antalgiques opioïdes: une antalgie adéquate peut être difficile à atteindre lorsque l’on administre un agoniste opioïde complet à des patients recevant de la buprénorphine. Le risque de surdosage existe également avec un agoniste complet, en particulier lorsque l’on essaye de surmonter les effets agonistes partiels de la buprénorphine, ou lorsque les concentrations plasmatiques de la buprénorphine diminuent (voir « Mises en garde et précautions »).
·Naltrexone et nalméfène: ce sont des antagonistes opioïdes suceptibles de bloquer les effets pharmacologiques de la buprénorphine. Pour les patients dépendants aux opioïdes recevant un traitement par la buprénorphine, la naltrexone peut précipiter l’apparition soudain de symptômes prolongés et intenses de sevrage aux opioïdes. Pour les patients qui reçoivent un traitement par naltrexone, les effets thérapeutiques souhaités de l’administration de buprénorphine peuvent être bloqués par la naltrexone.
·La buprénorphine est métabolisée en norbuprénorphine essentiellement par le CYP3A4. Les effets de l’exposition à la buprénorphine des patients traités par Buvidal n’ont pas été étudiés. Des interactions ont été établies lors de l’administration conjointe avec des inducteurs ou des inhibiteurs, dans des études utilisant la buprénorphine par voie transmuqueuse ou transdermique. La buprénorphine est aussi métabolisée en buprénorphine-3βglucuronide par UGT1A1.
oLes inhibiteurs du CYP3A4 peuvent inhiber le métabolisme de la buprénorphine entraînant une augmentation de la Cmax et de l’ASC de la buprénorphine et de la norbuprénorphine. Buvidal évite les effets du premier passage hépatique, donc les inhibiteurs du CYP3A4 (p. ex. les inhibiteurs de la protéase tels que ritonavir, nelfinavir ou indinavir, ou les antifongiques azolés tels que kétoconazole ou itraconazole, ou les antibiotiques macrolides) devraient avoir moins d’effets sur le métabolisme de la buprénorphine lorsqu’ils sont administrés avec Buvidal que lorsqu’ils sont administrés avec la buprénorphine sublinguale. Lors du passage de la buprénorphine sublinguale à Buvidal, il peut être nécessaire de surveiller les patients afin de s’assurer que les concentrations plasmatiques de buprénorphine sont correctes.
Les patients qui reçoivent déjà Buvidal et commencent un traitement par inhibiteurs du CYP3A4 doivent être traités par Buvidal hebdomadaire et être surveillés pour détecter d’éventuels signes et symptômes de surtraitmement. À l’inverse, si un patient qui est traité en même temps par Buvidal et par un inhibiteur du CYP3A4 arrête le traitement par inhibiteur du CYP3A4, il devra être surveillé pour détecter des symptômes de sevrage.
oLes inducteurs du CYP3A4 peuvent induire le métabolisme de la buprénorphine entraînant une diminution des taux de buprénorphine. Buvidal évite les effets du premier passage hépatique, donc les inducteurs du CYP3A4 (p. ex., phénobarbital, carbamazépine, phénytoïne, ou rifampicine) devraient avoir moins d’effets sur le métabolisme de la buprénorphine lorsqu’ils sont administrés avec Buvidal que lorsqu’ils sont administrés avec la buprénorphine sublinguale. Lors du passage de la buprénorphine sublinguale à Buvidal, il peut être nécessaire de surveiller les patients afin de s’assurer que les concentrations plasmatiques de buprénorphine sont correctes. Les patients qui reçoivent déjà Buvidal et commencent un traitement par inducteurs du CYP3A4 doivent être traités par Buvidal hebdomadaire et être surveillés pour détecter d’éventuels signes et symptômes de sevrage. A l’inverse, si un patient qui est traité en même temps par Buvidal et par un inducteur du CYP3A4 arrête le traitement par inducteur du CYP3A4, il devra être surveillé pour détecter des symptômes de surdosage.
oLes inhibiteurs de UGT1A1 peuvent influencer l’exposition systémique à la buprénorphine.
·Inhibiteurs de la monoamine oxydase (IMAO): renforcement de l'effet des opioïdes, sur la base de l'expérience avec la morphine.
·Un syndrome sérotoninergique peut survenir en cas d’administration concomitante d’opioïdes avec des inhibiteurs de la monoamine oxydase (IMAO) ou des principes actifs sérotoninergiques comme les inhibiteurs sélectifs de la recapture de la sérotonine (ISRS), les inhibiteurs de la recapture de la sérotonine et de la noradrénaline (IRSN) ou les antidépresseurs tricycliques. Parmi les symptômes d’un syndrome sérotoninergique figurent les modifications de l’état de conscience, l’instabilité du système nerveux autonome, les anomalies neuromusculaires et/ou les symptômes gastro-intestinaux. (voir « Mises en garde et précautions »).
Grossesse, AllaitementGrossesse
Il n’existe pas de données ou il existe des données limitées sur l’utilisation de la buprénorphine chez la femme enceinte. Les études effectuées chez l’animal n’ont pas mis en évidence de toxicité sur la reproduction (voir « Données précliniques »). La buprénorphine ne doit être utilisée pendant la grossesse que si le bénéfice potentiel est supérieur au risque potentiel pour le fœtus.
L’utilisation prolongée de Buvidal pendant la grossesse peut entraîner un syndrome de sevrage des opioïdes chez le nouveau-né qui peut engager le pronostic vital s’il n’est pas détecté et traité en temps opportun. Le traitement doit être mené selon les protocoles mis en place par les spécialistes de néonatologie. S’il est nécessaire d’utiliser des opioïdes chez une femme enceinte pendant une période prolongée, il convient d’informer la patiente du risque de syndrome de sevrage des opioïdes chez le nouveau-né et de s’assurer que le traitement adapté est disponible, le cas échéant (voir également rubrique « Mises en garde et précautions »).
En fin de grossesse, la buprénorphine peut provoquer une dépression respiratoire chez le nouveau-né même après une courte période d’administration.
En raison de la longue demi-vie de la buprénorphine, une surveillance néonatale pendant plusieurs jours après la naissance doit être envisagée pour prévenir le risque de dépression respiratoire ou le syndrome de sevrage chez le nouveau-né.
Allaitement
La buprénorphine et ses métabolites sont excrétés dans le lait maternel. Buvidal doit être utilisé avec précaution pendant l’allaitement.
Fertilité
Il n’existe pas de données ou il existe des données limitées sur les effets de la buprénorphine sur la fertilité humaine.
Les études effectuées chez l’animal n’ont pas mis en évidence d’effets délétères de la buprénorphine sur la fertilité (voir « Données précliniques »).
Effet sur l’aptitude à la conduite et l’utilisation de machinesLa buprénorphine a une influence mineure à modérée sur l’aptitude à la conduite des véhicules et à l’utilisation de machines lorsqu’elle est administrée à des patients dépendants aux opioïdes. La buprénorphine peut provoquer une somnolence, des vertiges ou une confusion mentale, en particulier pendant l’induction du traitement et l’adaptation posologique. En cas d’utilisation concomitante avec de l’alcool ou des dépresseurs du système nerveux central, l’effet risque d’être majoré (voir « Mises en garde et précautions » et « Interactions »).
Il faut recommander au patient de ne pas conduire et de ne pas utiliser de machine dangereuse pendant qu’il prend ce médicament tant que l’effet du médicament sur le patient n’est pas connu. Une recommandation individuelle doit être faite par le professionnel de santé en charge du traitement.
Effets indésirablesRésumé du profil de sécurité
Les effets indésirables signalés le plus fréquemment avec la buprénorphine sont les céphalées, les nausées, l’hyperhidrose, l’insomnie, le syndrome de sevrage et la douleur.
Liste des effets indésirables
Les termes et les fréquences ci-dessous sont utilisés : très fréquents (≥1/10), fréquents (≥1/100 à <1/10), occasionnels (≥1/1000 à <1/100) et inconnus (ne peut être estimée sur la base des données disponibles).
Les effets indésirables signalés avec la buprénorphine, y compris le Buvidal, sont les suivants :
Infections et infestations
Fréquents: infection, grippe, pharyngite, rhinite
Occasionnels: cellulite au site d’injection
Affections hématologiques et du système lymphatique
Fréquents: lymphadénopathie
Affections du système immunitaire
Fréquents: hypersensibilité
Troubles du métabolisme et de la nutrition
Fréquents: diminution de l’appétit
Troubles psychiatriques
Très fréquents: insomnie
Fréquents: anxiété, agitation, dépression, hostilité, nervosité, pensées anormales, paranoïa, dépendance
Inconnus: hallucinations, euphorie
Affections du système nerveux
Très fréquents: céphalées
Fréquents: somnolence, étourdissements, migraine, paresthésie, syncope, tremblement, hypertonie, trouble de l’élocution
Affections oculaires
Fréquents: trouble lacrymal, mydriase, myosis
Affections de l’oreille et du labyrinthe
Occasionnels: vertiges
Affections cardiaques
Fréquents: palpitations
Affections vasculaires
Fréquents: vasodilatation, hypotension
Affections respiratoires, thoraciques et médiastinales
Fréquents: toux, dyspnée, bâillement, asthme, bronchite
Fréquence inconnue : dépression respiratoire, syndrome d’apnée centrale du sommeil
Affections gastro-intestinales
Très fréquents: nausées
Fréquents: constipation, vomissements, douleurs abdominales, flatulence, dyspepsie, sécheresse buccale, diarrhée, affection gastro-intestinale
Affections hépatobiliaires
Occasionnels: élévation de l’alanine aminotransférase, élévation de l’aspartate aminotransférase, élévation des enzymes hépatiques
Affections de la peau et du tissu sous-cutané
Fréquents: éruption cutanée, prurit, urticaire
Occasionnels: éruption maculaire
Inconnus: érythème
Affections musculo-squelettiques et systémiques
Fréquents: arthralgie, dorsalgie, myalgie, spasmes musculaires, douleur cervicale, douleur osseuse
Affections du rein et des voies urinaires
Inconnus: rétention urinaire
Affections des organes de reproduction et du sein
Fréquents: dysménorrhée
Troubles généraux et anomalies au site d’administration
Très fréquents: hyperhidrose, syndrome de sevrage de drogue ou de médicament, douleur
Fréquents: douleur au site d’injection, prurit au site d’injection, érythème au site d’injection, œdème au site d’injection, réaction au site d’injection, induration au site d’injection, masse au site d’injection, œdème périphérique, asthénie, malaise, fièvre, frissons, syndrome de sevrage néonatal, douleur thoracique
Occasionnels: inflammation au site d’injection, hématome au site d’injection, urticaire au site d’injection
Inconnus: abcès au site d’injection, ulcération au site d’injection, nécrose au site d’injection
Investigations
Fréquents: tests hépatiques anormaux
Lésions, intoxications et complications liées aux procédures
Occasionnels: étourdissements lors des injections
Description de certains effets indésirables
Réactions au site d’injection
Dans l’étude d’efficacité de phase 3, en double aveugle, des effets indésirables au site d’injection ont été observés chez 36 (16,9%) des 213 patients (5% des injections administrées) dans le groupe de traitement par Buvidal. Les effets indésirables les plus fréquents étaient la douleur au site d’injection (8,9%), le prurit au site d’injection (6,1%) et l’érythème au site d’injection (4,7%). Les réactions au site d’injection étaient toutes d’intensité légère à modérée, et la majorité des événements étaient transitoires.
Dans le cadre de l’application postmarketing de Buvidal des abscès, des ulcérations et des nécroses au site d’injection ont été observés.
L’annonce d’effets secondaires présumés après l’autorisation est d’une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d’effet secondaire nouveau ou grave via le portail d’annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageSignes et symptômes
Le principal symptôme nécessitant une intervention médicale en cas de surdosage par la buprénorphine est la dépression respiratoire consécutive à une dépression du système nerveux central, puisqu’elle peut conduire à un arrêt respiratoire et au décès. Les autres signes précoces de surdosage peuvent être une transpiration excessive, une somnolence, une amblyopie, un myosis, une hypotension, des nausées, des vomissements et/ou des troubles de l’élocution.
Traitement
Une prise en charge globale, comprenant notamment une surveillance étroite de la fonction respiratoire et cardiaque du patient, doit être instaurée. Un traitement symptomatique de la dépression respiratoire après les mesures habituelles de soins intensifs doit être mis en place. Des voies respiratoires libres et une ventilation assistée ou contrôlée doit être assurée. Le patient doit être transféré dans une unité disposant de tous les moyens de réanimation nécessaires. Si le patient vomit, des précautions doivent être prises pour éviter l’aspiration. L’utilisation d’un antagoniste opioïde (c.-à-d., la naloxone) est recommandée, malgré l’effet modeste qu’elle peut avoir dans la suppression des symptômes respiratoires induits par la buprénorphine comparé à ses effets sur les opioïdes agonistes complets.
La longue durée d’action de la buprénorphine et la libération prolongée de Buvidal doivent être prises en considération lors de la détermination de la durée du traitement nécessaire pour neutraliser les effets du surdosage (voir « Mises en garde et précautions »). La naloxone peut être éliminée plus rapidement que la buprénorphine, de ce fait les symptômes du surdosage de la buprénorphine préalablement contrôlés par la naloxone peuvent réapparaître.
Des cas de leucoencéphalopathie toxique ont été observés en cas de surdosage d’opioïdes.
Propriétés/EffetsCode ATC
N07BC01
Mécanisme d’action
La buprénorphine est un opioïde agoniste partiel/antagoniste partiel qui se lie aux récepteurs opioïdes cérébraux μ (mu) et κ (kappa). Son activité dans le traitement de substitution aux opioïdes est attribuée à sa liaison lentement réversible aux récepteurs opioïdes μ qui, sur une période prolongée, peut minimiser le besoin en opioïdes illicites chez les patients dépendants aux opioïdes.
Les effets plafond de l’agoniste opioïde ont été observés au cours des études de pharmacologie clinique chez des personnes dépendantes aux opioïdes.
Pharmacodynamique
Voir « Mécanisme d'action ».
Efficacité clinique
L’efficacité et la sécurité d’emploi de Buvidal dans le traitement de substitution aux opioïdes ont été démontrés dans une étude pivot de phase 3, randomisée, en double aveugle, double placebo, avec comparateur actif, à dose flexible, menée chez des patients présentant une dépendance aux opioïdes modérée à sévère. Dans cette étude, 428 patients ont été randomisés dans l’un des deux groupes de traitement. Les patients dans le groupe Buvidal (n = 213) ont reçu des injections hebdomadaires (16 mg à 32 mg) pendant les 12 premières semaines, suivies d’injections mensuelles (64 mg à 160 mg) pendant les 12 dernières semaines, plus des doses quotidiennes de comprimés placebo sublinguaux pendant l’ensemble de la période de traitement. Les patients dans le groupe buprénorphine/naloxone sublinguale (n = 215) ont reçu des injections hebdomadaires de placebo pendant les 12 premières semaines et des injections mensuelles de placebo pendant les 12 dernières semaines, plus des comprimés sublinguaux de buprénorphine/naloxone chaque jour pendant l’ensemble de la période de traitement (8 mg à 24 mg pendant les 12 premières semaines et 8 mg à 32 mg pendant les 12 dernières semaines). Au cours des 12 semaines d’injections mensuelles, les patients des deux groupes pouvaient recevoir, mensuellement, une dose supplémentaire de 8 mg de Buvidal hebdomadaire, si nécessaire. Les patients ont eu 12 visites hebdomadaires pendant les 12 premières semaines et 6 visites pendant les 12 dernières semaines (3 visites mensuelles prévues et 3 visites pour toxicologie urinaire aléatoires). À chaque visite, des mesures des résultats d’efficacité et de sécurité d’emploi ont été réalisées.
Sur les 428 patients randomisés, 69,0% (147/213) des patients dans le groupe de traitement par Buvidal et 72,6% (156/215) des patients dans le groupe de traitement par buprénorphine/naloxone sublinguale ont achevé la période de traitement de 24 semaines.
L’étude a atteint le critère d’évaluation principal de non-infériorité mesuré en pourcentage moyen d’échantillons urinaires négatifs aux opioïdes illicites pendant les semaines de traitement 1 à 24 pour le groupe Buvidal par rapport au groupe buprénorphine/naloxone sublinguale (Tableau 3).
La supériorité de Buvidal par rapport à buprénorphine/naloxone sublinguale a été démontrée (analyse définie à priori) pour le critère d’évaluation secondaire de fonction de distribution cumulative (cumulative distribution function, CDF) par le pourcentage d’échantillons urinaires négatifs aux opioïdes pendant les semaines de traitement 4 à 24 (Tableau 3).
Tableau 3. Variables d’efficacité dans l’étude pivot de phase 3, randomisée, en double aveugle, à double placebo, avec comparateur actif, à dose flexible, menée chez des patients présentant une dépendance aux opioïdes modérée à sévère
|
Variable d’efficacité
|
Statistique
|
Buvidal
|
BPN/NX SL
|
Différence entre les traitements (%)a (IC à 95 %)
|
Valeur de p
| |
Pourcentage d’échantillons urinaires négatifs aux opioïdes illicites
|
N
|
213
|
215
|
|
| |
Moyenne des MM (%) (ET)
|
35,1 (2,48)
|
28,4 (2,47)
|
6,7
|
< 0,001
| |
IC à 95 %
|
30,3-40,0
|
23,5-33,3
|
-0,1-13,6
|
| |
CDF du pourcentage d’échantillons urinaires négatifs aux opioïdes illicites sur les semaines 4 à 24
|
N
|
213
|
215
|
|
| |
Médiane
|
26,7
|
6.7
|
-
|
0,008b
|
CDF = fonction de distribution cumulative, IC = intervalle de confiance, MM = moindres carrés, ET = erreur type, BPN/NX SL = buprénorphine/naloxone sublinguale
a Différence = Buvidal – BPN/NX SL
b La valeur de p concernait la supériorité
Une étude de phase 3, à long terme, en ouvert, avec dose flexible, évaluant la sécurité d’emploi de Buvidal hebdomadaire et mensuel pendant 48 semaines a été menée. L’étude a recruté un total de 227 patients présentant une dépendance aux opioïdes modérée à sévère, dont 190 étaient sous buprénorphine sublinguale (avec ou sans naloxone) et 37 patients étaient naïfs de traitement par buprénorphine. Pendant la période de traitement de 48 semaines, les patients pouvaient changer de modalité de traitement entre des injections hebdomadaires et des injections mensuelles de Buvidal et entre différentes doses (8 mg à 32 mg pour Buvidal hebdomadaire et 64 mg à 160 mg pour Buvidal mensuel), selon l’avis clinique du médecin.
Pour les patients traités auparavant par la buprénorphine sublinguale, la valeur initiale du pourcentage de patients ayant des échantillons urinaires négatifs aux opioïdes illicites était de 78,8% et de 84,0% à la fin de la période de traitement de 48 semaines. Pour les patients naïfs de traitement, la valeur initiale du pourcentage de patients ayant des échantillons urinaires négatifs aux opioïdes illicites était de 0,0% et de 63,0% à la fin de la période de traitement de 48 semaines. Dans l’ensemble des groupes, 156 patients (68,7%) ont achevé la période de traitement de 48 semaines.
PharmacocinétiqueBuvidal hebdomadaire
Absorption
Après injection, la concentration plasmatique de buprénorphine augmente avec un délai médian pour atteindre la concentration plasmatique maximale (tmax) d’environ 24 heures. Buvidal a une biodisponibilité absolue complète. L’exposition à l’état d’équilibre est atteinte à la quatrième dose hebdomadaire.
On observe des augmentations de l’exposition proportionnelles à l’intervalle de dose de 8 mg à 32 mg.
Distribution
Le volume de distribution apparent de la buprénorphine est d’environ 1900 l. La buprénorphine se lie aux protéines à environ 96%, principalement aux globulines alpha et bêta.
Métabolisme
La buprénorphine est métabolisée par oxydation par 14-N-désalkylation en Ndésalkyl-buprénorphine (également appelée norbuprénorphine) via le cytochrome P450 CYP3A4 et par glucuronoconjugaison de la molécule parente et du métabolite désalkylé. La norbuprénorphine est un agoniste opioïde μ ayant une faible activité intrinsèque.
L’administration sous-cutanée de Buvidal donne des concentrations plasmatiques du métabolite norbuprénorphine significativement plus basses que l’administration de buprénorphine sublinguale, du fait que le métabolisme du premier passage hépatique a été évité.
Élimination
L’élimination de la buprénorphine de Buvidal est limitée par la vitesse de libération, avec une demi-vie terminale allant de 3 à 5 jours.
La buprénorphine est principalement éliminée dans les selles par excrétion biliaire des métabolites glucuronoconjugués (70%), le reste étant éliminé dans l’urine. La clairance totale de buprénorphine est d’environ 68 l/h.
Buvidal mensuel
Absorption
Après injection, la concentration plasmatique de buprénorphine augmente avec un délai médian pour atteindre la concentration plasmatique maximale (tmax) de 6 à 10 heures. Buvidal a une biodisponibilité absolue complète. L’exposition à l’état d’équilibre est atteinte à la quatrième dose mensuelle.
On observe des augmentations de l’exposition proportionnelles à l’intervalle de dose de 64 mg à 128 mg.
Distribution
Le volume de distribution apparent de la buprénorphine est d’environ 1900 l. La buprénorphine se lie aux protéines à environ 96%, principalement aux globulines alpha et bêta.
Métabolisme
La buprénorphine est métabolisée par oxydation par 14-N-désalkylation en Ndésalkyl-buprénorphine (également appelée norbuprénorphine) via le cytochrome P450 CYP3A4 et par glucuronoconjugaison de la molécule parente et du métabolite désalkylé. La norbuprénorphine est un agoniste opioïde μ ayant une faible activité intrinsèque.
L’administration sous-cutanée de Buvidal donne des concentrations plasmatiques du métabolite norbuprénorphine significativement plus basses que l’administration de buprénorphine sublinguale, du fait que le métabolisme du premier passage hépatique a été évité.
Élimination
L’élimination de la buprénorphine de Buvidal est limitée par la vitesse de libération, avec une demi-vie terminale allant de 19 à 25 jours.
La buprénorphine est principalement éliminée dans les selles par excrétion biliaire des métabolites glucuronoconjugués (70%), le reste étant éliminé dans l’urine. La clairance totale de buprénorphine est d’environ 68 l/h.
Cinétique pour certains groupes de patients
Patients âgés
Aucune donnée pharmacocinétique chez les patients âgés (> 65 ans) n’est disponible.
Troubles de la fonction rénale
L’élimination rénale joue un rôle relativement faible (»30 %) dans l’ensemble de la clairance de la buprénorphine. Aucune modification de la posologie basée sur la fonction rénale n’est requise, mais la prudence est recommandée lors de l’administration du produit à des patients présentant une insuffisance rénale sévère (voir « Posologie/Mode d’emploi » et « Mises en garde et précautions »).
Troubles de la fonction hépatique
Le Tableau 4 résume les résultats d’une étude clinique dans laquelle l’exposition à la buprénorphine a été déterminée après l’administration de buprénorphine/naloxone à 2.0/0.5 mg en comprimé sublingual, chez des sujets sains et chez les sujets atteints de divers degrés d’insuffisance hépatique.
Tableau 4. Effet de l’insuffisance hépatique (variation par rapport aux sujets sains) sur les paramètres pharmacocinétiques de la buprénorphine après administration sublinguale de buprénorphine/naloxone (2.0/0.5 mg) à des sujets sains et à des sujets atteints de divers degrés d’insuffisance hépatique
|
Paramètre pharmacocinétique
|
Insuffisance hépatique légère
(Child-Pugh de
Classe A)
(n=9)
|
Insuffisance hépatique modéré
(Child-Pugh de
Classe B)
(n=8)
|
Insuffisance hépatique sévère
(Child-Pugh de
Classe C)
(n=8)
| |
Buprénorphine
| |
Cmax
|
Augmentation de 1,2 fois
|
Augmentation de 1,1 fois
|
Augmentation de 1,7 fois
| |
ASCdéfinie
|
Identique à la valeur de contrôle
|
Augmentation de 1,6 fois
|
Augmentation de 2,8 fois
|
Globalement, l’exposition plasmatique à la buprénorphine a été multipliée par environ 3 chez les sujets ayant une insuffisance hépatique sévère (voir « Posologie/Mode d’emploi », « Contre-indications » et « Mises en garde et précautions »).
Enfants et adolescents
Aucune donnée pharmacocinétique n’est disponible chez les enfants et adolescents (âgés de moins de 18 ans). Les données de simulation d’exposition à la buprénorphine chez des adolescents âgés de 16 ans montrent une Cmax et une ASC plus faibles que les valeurs observées chez l’adulte traités par Buvidal hebdomadaire et mensuel.
Données précliniquesLa toxicité aiguë de la buprénorphine a été déterminée chez la souris et le rat après une administration orale et parentérale (intraveineuse, intrapéritonéale). Les effets indésirables étaient basés sur l’activité pharmacologique connue de la buprénorphine.
La buprénorphine a montré une faible toxicité tissulaire et biologique chez des chiens qui ont reçu le produit par voie sous-cutanée pendant un mois, chez des macaques rhésus qui l’ont reçu par voie orale pendant un mois et chez des rats et des babouins qui l’ont reçu par voie intramusculaire pendant six mois.
Des études de tératologie et de toxicité sur la reproduction menées chez le rat et le lapin en administration intramusculaire ont conclu que la buprénorphine n’est pas embryotoxique et n’a pas d’effet sensible sur le potentiel de sevrage de la progéniture. Chez le rat, aucun effet indésirable n’a été observé sur la fertilité de la fonction reproductrice générale.
Des études de toxicité chronique chez le rat et le chien de l’excipient utilisé pour Buvidal n’ont révélé aucun risque particulier pour l’homme.
Remarques particulièresInformation
La buprénorphine ne peut pas être décelée dans l'urine avec les tests habituels. Il est cependant possible d'obtenir dans le commerce un kit de test urinaire spécifique pour la buprénorphine.
Incompatibilités
Ce médicament ne doit pas être mélangé avec d’autres médicaments.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Remarques particulières concernant le stockage
Ne pas conserver au-dessus de 30°C.
Ne pas conserver au réfrigérateur.
Ne pas congeler.
Conserver hors de portée des enfants.
Remarques concernant la manipulation
Informations importantes
·L’administration doit se faire dans le tissu sous-cutané.
·Toute administration intravasculaire, intramusculaire et intradermique doit être évitée.
·Le produit ne doit pas être utilisé si la seringue sécurisée est cassée ou si l’emballage est endommagé.
·Le protège-aiguille de la seringue peut contenir du latex qui peut provoquer des réactions allergiques chez les personnes sensibles au latex.
·Manipuler la seringue sécurisée avec précaution afin d’éviter toute piqûre accidentelle. La seringue sécurisée comprend un dispositif de sécurité de protection de l’aiguille, qui s’active à la fin de l’injection. Ne pas retirer le bouchon de la seringue sécurisée tant que vous n’êtes pas prêt à réaliser l’injection. Une fois le bouchon retiré, n’essayez jamais de le replacer sur l’aiguille.
·Jeter la seringue sécurisée usagée immédiatement après utilisation. Ne pas réutiliser la seringue sécurisée.
Avant l’administration
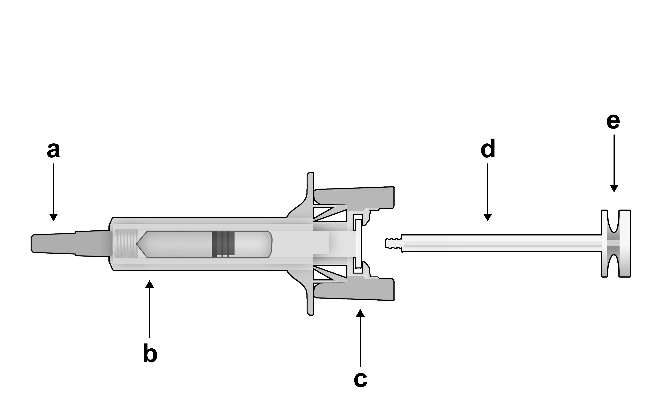
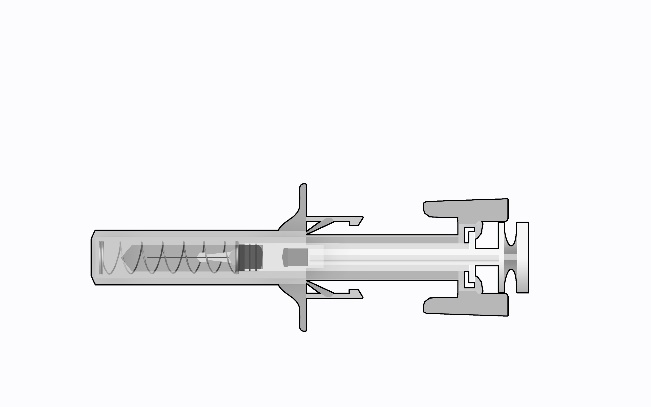
Éléments de la seringue sécurisée :
|
|
|
|
|
|
Figure 1 :
|
Seringue sécurisée : Avant utilisation
a) protège-aiguille, b) corps de protection de la seringue, c) ailettes de protection de la seringue, d) piston,
e) tête du piston
|
Seringue sécurisée : Après utilisation
(avec le mécanisme de protection de l’aiguille activé)
|
Veuillez noter que le plus petit volume d’injection est à peine visible dans la fenêtre de visualisation, puisque le ressort du dispositif de sécurité « masque » une partie du cylindre en verre près de l’aiguille.
Administration (voir aussi « Posologie/Mode d’emploi »)
-Sortez la seringue de la boîte en carton : saisissez la seringue par son corps de protection.
-Pendant que vous tenez la seringue par le protège-aiguille, insérez la tige du piston dans le bouchon de piston en faisant tourner délicatement la tige du piston dans le sens des aiguilles d’une montre jusqu’à ce qu’elle soit bien fixée (voir Figure 2).
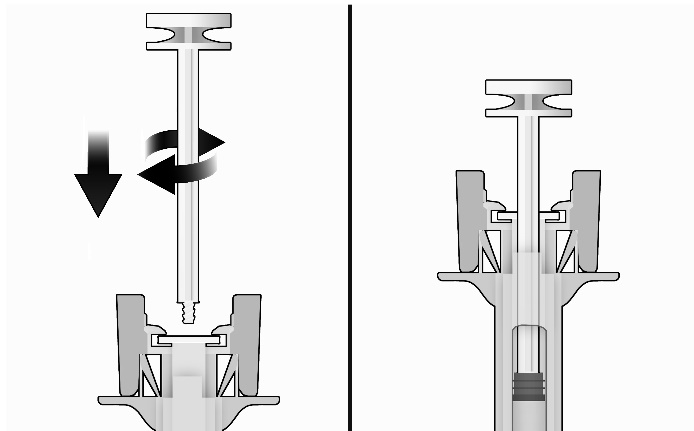
-Inspectez attentivement la seringue sécurisée :
oN’utilisez pas la seringue sécuriseé au-delà de la date de péremption indiquée sur le carton ou sur l’étiquette de la seringue.
oUne petite bulle d’air peut être visible. C’est normal.
oLe liquide doit être limpide. N’utilisez pas la seringue sécuriseé si le liquide contient des particules visibles ou s’il est trouble.
-Choisissez le site d’injection. Il convient d’alterner les sites d’injection, entre la fesse, la cuisse, l’abdomen et le bras (voir Figure 3), avec un intervalle minimum de 8 semaines avant de réinjecter dans un site d’injection déjà utilisé au préalable. Les injections au niveau de la taille ou à moins de 5 cm du nombril doivent être évitées.

Figure 3 :
-Mettez des gants et nettoyez le site d’injection en mouvements circulaires à l’aide d’une lingette imbibée d’alcool (non fournie dans le carton). Ne touchez plus la peau nettoyée avant de réaliser l’injection.
-Tout en maintenant la seringue sécurisée par le corps de protection de la seringue, comme indiqué (voir Figure 4), retirez délicatement le protège-aiguille. Jetez immédiatement le protègeaiguille (n’essayez jamais de le replacer sur l’aiguille). Il se peut qu’une goutte de liquide apparaisse au bout de l’aiguille. C’est normal.

Figure 4 :
-Pincez la peau au site d’injection entre le pouce et l’index, comme indiqué (voir Figure 5).
-Tenez la seringue sécurisée comme indiqué et introduisez doucement l’aiguille à un angle d’environ 90° (voir Figure 5). Enfoncez l’aiguille jusqu’au bout.
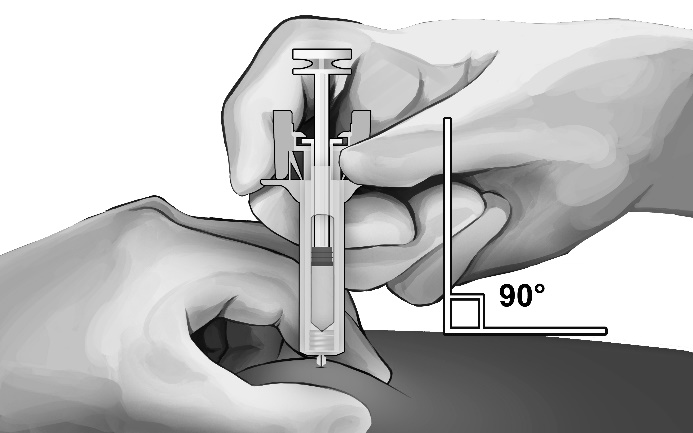
Figure 5 :
-Tout en tenant la seringue comme indiqué (voir Figure 6), enfoncez lentement le piston jusqu’à ce que sa tête soit bloquée entre les ailettes de protection de la seringue et que la solution soit intégralement injectée.

Figure 6 :
-Retirez délicatement l’aiguille de la peau. Il est recommandé que le piston reste entièrement enfoncé lorsque vous retirez délicatement l’aiguille du site d’injection (voir Figure 7).

Figure 7 :
-Dès que l’aiguille est entièrement retirée de la peau, soulevez lentement votre pouce du piston et laissez la protection de seringue recouvrir automatiquement l’aiguille exposée (voir Figure 8). Il peut y avoir une petite quantité de sang au site d’injection. Si nécessaire, essuyez à l’aide d’un tampon de coton ou d’une compresse.

Figure 8 :
Élimination de la seringue
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation locales.
Numéro d’autorisation67941 (Swissmedic)
Présentation8 mg Buvidal: 1 seringue préremplie (0,16 ml) avec un bouchon, une aiguille, un protège-aiguille, un dispositif de sécurité et 1 tige de piston [A].
16 mg Buvidal: 1 seringue préremplie (0,32 ml) avec un bouchon, une aiguille, un protège-aiguille, un dispositif de sécurité et 1 tige de piston [A].
24 mg Buvidal: 1 seringue préremplie (0,48 ml) avec un bouchon, une aiguille, un protège-aiguille, un dispositif de sécurité et 1 tige de piston [A].
32 mg Buvidal: 1 seringue préremplie (0,64 ml) avec un bouchon, une aiguille, un protège-aiguille, un dispositif de sécurité et 1 tige de piston [A].
64 mg Buvidal: 1 seringue préremplie (0,18 ml) avec un bouchon, une aiguille, un protège-aiguille, un dispositif de sécurité et 1 tige de piston [A].
96 mg Buvidal: 1 seringue préremplie (0,27 ml) avec un bouchon, une aiguille, un protège-aiguille, un dispositif de sécurité et 1 tige de piston e [A].
128 mg Buvidal: 1 seringue préremplie (0,36 ml) avec un bouchon, une aiguille, un protège-aiguille, un dispositif de sécurité et 1 tige de piston [A].
Une seringue préremplie d’1 ml (verre de type I) avec bouchon de piston (caoutchouc bromobutyle revêtu de fluoropolymère) avec aiguille (½ pouce, 23 G, 12 mm) et protège-aiguille (caoutchouc styrène-butadiène). La seringue préremplie est assemblée dans un dispositif de sécurité en prévention des piqûres d’aiguille post-injection. Le protège-aiguille de la seringue sécurisée peut contenir du latex qui peut provoquer des réactions allergiques chez les personnes sensibles au latex.
Titulaire de l’autorisationFuture Health Pharma GmbH, 8620 Wetzikon
Mise à jour de l’informationMars 2024
|









