Propriétés/EffetsCode ATC
C03DA05
Mécanisme d'action
La finérénone est un antagoniste sélectif non stéroïdien du récepteur des minéralocorticoïdes (RM) et atténue efficacement l'inflammation et la fibrose induites par une hyperactivation du RM. Le RM est exprimé dans les reins, le cœur et les vaisseaux sanguins, où la finérénone agit également contre la rétention de sodium et les processus hypertrophiques. Compte tenu de sa structure non stéroïdienne et de son mode de liaison massif, la finérénone est très puissante et a une haute sélectivité pour le RM. La finérénone n'a aucune affinité pertinente pour les récepteurs des androgènes, de la progestérone, des œstrogènes et des glucocorticoïdes et n'occasionne par conséquent aucun effet secondaire lié aux hormones sexuelles (gynécomastie p. ex.). Sa liaison au RM donne lieu à un complexe récepteur-ligand spécifique qui bloque le recrutement des coactivateurs de transcription qui participent à l'expression des médiateurs pro-inflammatoires et profibrotiques.
Pharmacodynamique
Effets chez les sujets sains
Les schémas à doses multiples (doses journalières de 20 mg ou 40 mg de finérénone pendant 10 jours) ont entraîné une activation du système rénine-angiotensine-aldostérone (SRAA), c.-à-d. des hausses réversibles de l'activité rénine plasmatique et des concentrations sériques d'aldostérone, avec un retour aux valeurs de départ dans les 48 heures suivant l'administration de la dernière dose.
Après l'activation du RM par son agoniste fludrocortisone, des doses uniques de finérénone allant jusqu'à 20 mg ont mis en évidence des effets natriurétiques dose-dépendants et une excrétion de potassium diminuée dans les urines par rapport au placebo.
Des doses multiples ou uniques de finérénone n'ont pas eu d'effets sur les signes vitaux chez les sujets sains.
Effets chez les patients présentant une néphropathie chronique et un diabète de type 2
Dans les deux études de phase III FIDELIO-DKD et FIGARO-DKD, la réduction relative du rapport albuminurie/créatininurie (RAC) corrigée par rapport au placebo chez les patients qui avaient été affectés par randomisation au groupe finérénone était de respectivement 31 % et 32 % après 4 mois. La diminution du RAC a persisté dans les deux études.
Dans l'étude ARTS DN, une étude de phase IIb de détermination de la dose randomisée, en double aveugle, contrôlée contre placebo, multicentrique menée chez des patients adultes présentant une néphropathie chronique et un diabète de type 2, la réduction relative du RAC corrigée par rapport au placebo après 90 jours était respectivement de 25 % et 38 % chez les patients traités par 10 mg et 20 mg de finérénone une fois par jour.
Électrophysiologie cardiaque
Une étude QT approfondie portant sur 57 sujets sains n'a mis en évidence aucun indice d'effet d'allongement de l'intervalle QT/QTc de la finérénone après des doses uniques de 20 mg (doses thérapeutiques) ou de 80 mg (doses suprathérapeutiques), ce qui indique que la finérénone n'a aucun effet sur la repolarisation cardiaque.
Efficacité clinique
La finérénone a été évaluée dans les deux études de phase III randomisées, en double aveugle, contrôlées contre placebo, multicentriques FIDELIO-DKD et FIGARO-DKD.
L'étude FIDELIO-DKD portait sur l'effet de la finérénone par rapport au placebo sur les événements rénaux et cardiovasculaires chez des patients adultes présentant un diabète de type 2 et une néphropathie chronique (critères d'inclusion: a) albuminurie modérée [RAC ≥30 à < 300 mg/g] et DFGe 25 à 60 ml/min/1.73 m2 avec présence concomitante d'une rétinopathie diabétique OU b) d'albuminurie sévère [RAC ≥300 mg/g] et DFGe 25 à 75 ml/min/1.73 m2). Les patients inclus dans l'étude devaient présenter un taux de potassium sérique ≤4.8 mmol/l et avoir reçu un traitement préalable par une thérapie standard, y compris une dose maximale tolérée d'un inhibiteur de l'enzyme de conversion de l'angiotensine (inhibiteur de l'ECA [34 %]) ou d'un antagoniste des récepteurs de l'angiotensine (ARA [66 %]). L'indication d'un traitement par un ARM selon les directives (telle qu'une insuffisance cardiaque chronique symptomatique à fraction d'éjection réduite) était un critère d'exclusion.
Le critère d'évaluation primaire de l'étude FIDELIO-DKD était un critère composite constitué du délai jusqu'à la survenue d'une défaillance rénale (définie par une dialyse chronique, une transplantation rénale ou une baisse du DFGe à < 15 ml/min/1.73 m2 pendant au moins 4 semaines), de la baisse du DFGe de ≥40 % par rapport à la valeur de départ pendant au moins 4 semaines ou du décès d'origine rénale. Le critère d'évaluation secondaire était un critère cardiovasculaire composite constitué du délai jusqu'à la survenue d'un décès cardiovasculaire (CV), d'un infarctus du myocarde (IM) non mortel, d'un accident vasculaire cérébral (AVC) non mortel ou d'une hospitalisation pour insuffisance cardiaque.
L'étude évaluait 5662 patients qui ont été randomisés selon un rapport de 1/1 en vue de recevoir la finérénone une fois par jour (n = 2 824) ou le placebo (n = 2 838). La dose initiale était soit de 10 mg [si DFGe compris entre 25 et < 60 ml/min/1.73 m2], soit de 20 mg [si DFGe ≥60 ml/min/1.73 m2]. Le dosage a été ajusté à 10 mg ou 20 mg une fois par jour au cours de l'étude, principalement en raison du taux de potassium sérique. La durée de suivi médiane était de 2.6 années. La population de l'étude était composée à 63 % de Blancs, à 25 % d'Asiatique et à 5 % de Noirs. L'âge moyen au moment du recrutement était de 66 ans, et 70 % des patients étaient de sexe masculin. Le DFGe moyen à l'inclusion était de 44.4 ml/min/1.73 m2 et 55 % des patients avaient un DFGe < 45 ml/min/1.73 m2. Le RAC médian était de 853 mg/g, le taux moyen d'hémoglobine glyquée A1c (HbA1c) était de 7.7 %. Environ 46 % des participants de l'étude présentaient une athérosclérose cardiovasculaire préexistante, 30 % une coronaropathie et 8 % des antécédents d'insuffisance cardiaque. La tension artérielle moyenne était de 138/76 mmHg. Le délai moyen écoulé entre le diagnostic de diabète de type 2 et l'inclusion dans l'étude était de 16.6 années et, au début de l'étude, la quasi-totalité des participants (97 %) recevait un ou plusieurs antidiabétiques (insuline [64 %], biguanides [44 %], agonistes du récepteur du glucagon-like-peptide-1 [GLP-1] [7 %], inhibiteurs du cotransporteur sodium-glucose de type 2 [SGLT2] [5 %]). De plus, au début de l'étude, respectivement 47 % et 26 % des patients présentaient une rétinopathie diabétique préexistante et une neuropathie diabétique préexistante. La majorité des patients avaient reçu en complément une statine (74 %) et/ou un antagoniste du calcium (63 %).
L'étude FIDELIO-DKD a mis en évidence une supériorité du traitement par la finérénone par rapport au placebo pour le critère d'évaluation primaire (rénal) composite (HR 0.82, IC à 95 % 0.73 à 0.92, p = 0.0009; voir Tableau 3 et Figure 1).
De plus, la finérénone a réduit significativement le risque pour le critère d'évaluation secondaire (cardiovasculaire) composite (HR 0.86, IC à 95 % 0.75 à 0.99, p = 0.0344; voir Tableau 3 et Figure 2). Dans le bras finérénone, les taux d'incidence de l'insuffisance cardiaque, de l'IM non mortel et du décès d'origine cardiovasculaire étaient inférieurs à ceux du bras placebo. Des AVC non mortels sont survenus dans les deux bras de traitement à une incidence comparable (voir Tableau 3).
Tableau 3: Analyse du critère d'évaluation primaire et des principaux critères d'évaluation secondaire (et de ses composantes) de l'étude de phase III FIDELIO-DKD
|
|
Patients atteints de
néphropathie chronique et de diabète de type 2
| |
|
Finérénone*
10 ou 20 mg 1x par jour
n = 2824
|
Placebo*
n = 2838
|
Effet du traitement
Finérénone/placebo
| |
Critères d'évaluation primaire et secondaires de l'étude
|
n (%)
|
Taux d'événements
(100 pat.-an.)
|
n (%)
|
Taux d'événements
(100 pat.-an.)
|
Hazard ratio
(IC à 95 %)
|
Valeur p
| |
Critère d'évaluation primaire composite «Défaillance rénale, baisse durable du DFGe ≥40 % ou décès d'origine rénale»
|
498 (17.6 %)
|
7.53
|
600 (21.1 %)
|
9.09
|
0.82
[0.73; 0.92]
|
0.0009
| |
Défaillance rénale
|
205 (7.3 %)
|
2.96
|
235 (8.3 %)
|
3.39
|
0.86
[0.72; 1.05]
|
-
| |
Baisse durable du DFGe ≥40 %
|
473 (16.7 %)
|
7.15
|
577 (20.3 %)
|
8.74
|
0.81
[0.72; 0.91]
|
-
| |
Décès d'origine rénale
|
2 (< 0.1 %)
|
-
|
2 (< 0.1 %)
|
-
|
-
|
-
| |
Critère d'évaluation secondaire composite «Décès CV, IM non mortel, AVC non mortel ou hospitalisation pour insuffisance cardiaque»
|
366 (13.0 %)
|
5.11
|
420 (14.8 %)
|
5.93
|
0.86
[0.75; 0.99]
|
0.0344
| |
Décès CV
|
128 (4.5 %)
|
1.70
|
150 (5.3 %)
|
1.99
|
0.86
[0.68; 1.09]
|
-
| |
IM non mortel
|
70 (2.5 %)
|
0.94
|
87 (3.1 %)
|
1.18
|
0.80
[0.58; 1.09]
|
-
| |
AVC non mortel
|
90 (3.2 %)
|
1.22
|
87 (3.1 %)
|
1.18
|
1.03
[0.77; 1.38]
|
-
| |
Hospitalisation pour insuffisance cardiaque
|
138 (4.9 %)
|
1.88
|
162 (5.7 %)
|
2.22
|
0.85
[0.68; 1.07]
|
-
| |
* Traitement en plus de doses maximales tolérées autorisées d'inhibiteur de l'ECA ou d'ARA.
|
Figure 1: Délai jusqu'à la survenue d'une défaillance rénale, d'une baisse durable du DFGe ≥40 % vs valeur de départ ou d'un décès d'origine rénale dans l'étude FIDELIO-DKD
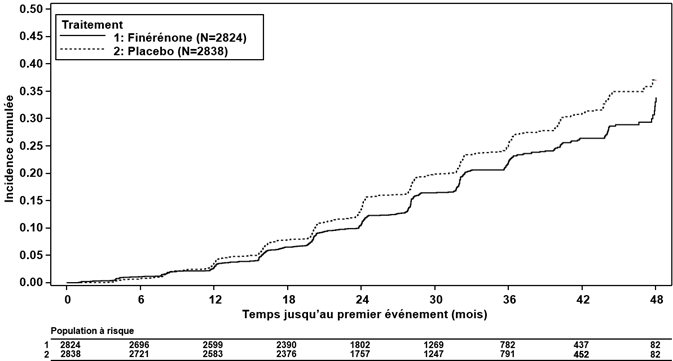
Figure 2: Délai jusqu'à la survenue d'un décès CV, d'un IM non mortel, d'un AVC non mortel ou d'une hospitalisation pour insuffisance cardiaque dans l'étude FIDELIO-DKD
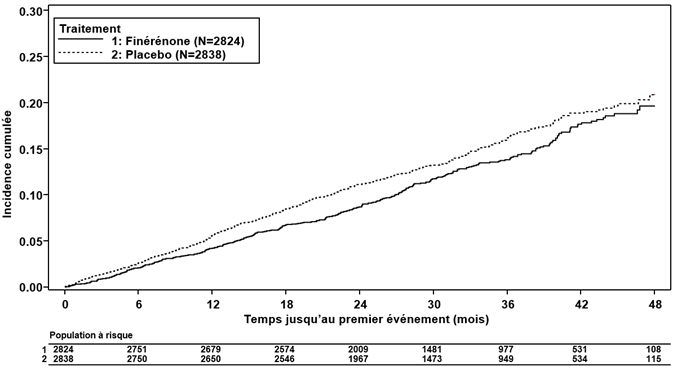
L'étude FIGARO-DKD portait sur l'effet de la finérénone par rapport au placebo sur la survenue d'événements cardiovasculaires et rénaux chez des patients adultes présentant un diabète de type 2 et une néphropathie chronique (critères d'inclusion: a) albuminurie modérée [RAC ≥30 à < 300 mg/g] et DFGe de 25 à 90 ml/min/1.73 m2 OU b) albuminurie sévère [RAC ≥300 mg/g] et DFGe de 60 ml/min/1.73 m2). Pour être inclus dans l'étude, les patients devaient présenter, en outre, un taux de potassium sérique ≤4.8 mmol/l et avoir déjà reçu un traitement préalable par une thérapie standard, y compris une dose maximale tolérée d'un inhibiteur de l'enzyme de conversion de l'angiotensine (inhibiteur de l'ECA [43 %]) ou d'un antagoniste des récepteurs de l'angiotensine (ARA [57 %]). L'indication d'un traitement par un ARM selon les directives (telle qu'une insuffisance cardiaque chronique symptomatique à fraction d'éjection réduite) était un critère d'exclusion.
Le critère d'évaluation primaire de l'étude FIGARO-DKD était un critère cardiovasculaire (CV) composite constitué du délai jusqu'à la survenue d'un décès CV, d'un IM non mortel, d'un accident vasculaire cérébral (AVC) non mortel ou d'une hospitalisation pour insuffisance cardiaque. Le critère d'évaluation secondaire clé était un critère rénal composite constitué du délai jusqu'à la défaillance rénale, de la baisse du DFGe de ≥40 % par rapport à la valeur de départ pendant au moins 4 semaines ou du décès d'origine rénale.
L'étude évaluait 7328 patients qui ont été randomisés selon un rapport de 1/1 en vue de recevoir la finérénone (n = 3674) ou le placebo (n = 3654). La dose initiale était soit de 10 mg [si DFGe compris entre 25 et < 60 ml/min/1.73 m2], soit de 20 mg [si DFGe ≥60 ml/min/1.73 m2]. Le dosage a été ajusté à 10 mg ou 20 mg une fois par jour au cours de l'étude, principalement en raison du taux de potassium sérique. La durée de suivi médiane était de 3.4 années. La population de l'étude était composée à 72 % de Blancs, à 20 % d'Asiatiques et à 4 % de Noirs. L'âge moyen au moment du recrutement était de 64 ans, et 69 % des patients étaient de sexe masculin. Le DFGe moyen à l'inclusion était de 67.8 ml/min/1.73 m2 et 62 % des patients avaient un DFGe ≥60 ml/min/1.73 m2. Le RAC médian était de 309 mg/g, le taux moyen d'hémoglobine glyquée A1c (HbA1c) était de 7.7 %. Environ 45 % des participants de l'étude avaient des antécédents d'athérosclérose cardiovasculaire et 8 % des antécédents d'insuffisance cardiaque. La tension artérielle moyenne était de 136/77 mmHg. La durée moyenne du diabète de type 2 à l'inclusion dans l'étude était de 14.5 années et, au début de l'étude, la quasi-totalité des participants (98 %) recevait un ou plusieurs antidiabétiques (insuline [54 %], biguanides [69 %], agonistes du récepteur GLP-1 [8 %], inhibiteurs du SGLT2 [8 %]). De plus, au début de l'étude, respectivement 31 % et 28 % des patients présentaient une rétinopathie diabétique préexistante et une neuropathie diabétique préexistante. La majorité des patients avaient reçu en complément une statine (71 %).
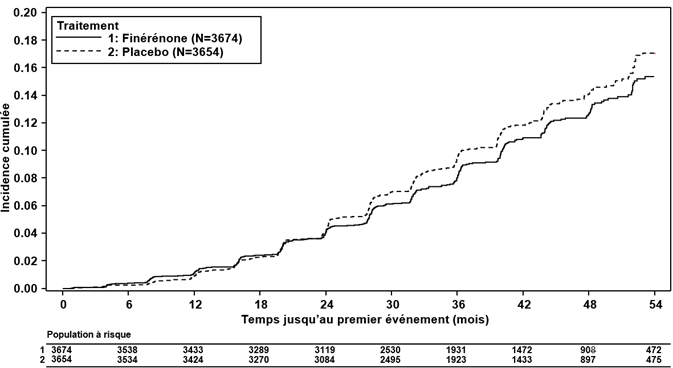
La finérénone a réduit significativement le risque pour le critère d'évaluation primaire (cardiovasculaire) composite (HR 0.87, IC à 95 % 0.76 à 0.98, p = 0.0254) (voir Figure 3 et Tableau 4). L'effet du traitement pour le critère d'évaluation primaire était homogène dans tous les sous-groupes, dont les sous-groupes région, DFGe, RAC, pression artérielle systolique et HbA1c à l'inclusion. Dans le bras finérénone, le taux d'incidence du critère d'évaluation secondaire (rénal) composite constitué de la défaillance rénale, de la baisse durable du DFGe de ≥40 % ou du décès d'origine rénale était inférieur à celui du bras placebo; cette différence n'atteignait toutefois pas le seuil de signification statistique (HR 0.87, IC à 95 % 0.75 à 1.01, p = 0.0635) (voir Figure 4 et Tableau 4).
Tableau 4: Analyse du critère d'évaluation primaire et des critères d'évaluation secondaire (et de ses composantes) de l'étude de phase III FIGARO-DKD
|
|
Patients atteints de
néphropathie chronique et de diabète de type 2
| |
|
Finérénone*
10 ou 20 mg 1x par jour
n = 3674
|
Placebo*
n = 3654
|
Effet du traitement
Finérénone/placebo
| |
Critères d'évaluation primaire et secondaire de l'étude:
|
n (%)
|
Taux d'événements
(100 pat.-an.)
|
n (%)
|
Taux d'événements
(100 pat.-an.)
|
Hazard ratio
(IC à 95 %)
|
Valeur p
| |
Critère d'évaluation primaire composite «Décès CV, IM non mortel, AVC non mortel ou hospitalisation pour insuffisance cardiaque»
|
457 (12.4 %)
|
3.88
|
518 (14.2 %)
|
4.46
|
0.87
[0.76; 0.98]
|
0.0254
| |
Décès CV
|
193 (5.3 %)
|
1.56
|
214 (5.9 %)
|
1.75
|
0.89
[0.73; 1.08]
|
-
| |
IM non mortel
|
103 (2.8 %)
|
0.85
|
101 (2.8 %)
|
0.84
|
1.00
[0.76; 1.32]
|
-
| |
AVC non mortel
|
108 (2.9 %)
|
0.89
|
111 (3.0 %)
|
0.93
|
0.97
[0.74; 1.26]
|
-
| |
Hospitalisation pour insuffisance cardiaque
|
117 (3.2 %)
|
0.97
|
163 (4.5 %)
|
1.36
|
0.71
[0.56; 0.90]
|
-
| |
Critère d'évaluation composite
«Défaillance rénale, baisse durable du DFGe ≥40 % ou décès d'origine rénale»
|
350 (9.5 %)
|
3.17
|
395 (10.8 %)
|
3.59
|
0.87
[0.75; 1.01]
|
0.0635**
| |
Défaillance rénale
|
46 (1.3 %)
|
0.40
|
62 (1.7 %)
|
0.55
|
0.72
[0.49; 1.05]
|
-
| |
Baisse durable du DFGe ≥40 %
|
338 (9.2 %)
|
3.06
|
385 (10.5 %)
|
3.50
|
0.86
[0.74; <1.00]
|
-
| |
Décès d'origine rénale
|
0
|
-
|
2 (<0.1 %)
|
-
|
-
|
-
| |
* Traitement en plus de doses maximales tolérées autorisées d'inhibiteur de l'ECA ou d'ARA.
** Non significative.
|
Figure 3: Délai jusqu'à la survenue d'un décès CV, d'un IM non mortel, d'un AVC non mortel ou d'une hospitalisation pour insuffisance cardiaque dans l'étude FIGARO-DKD
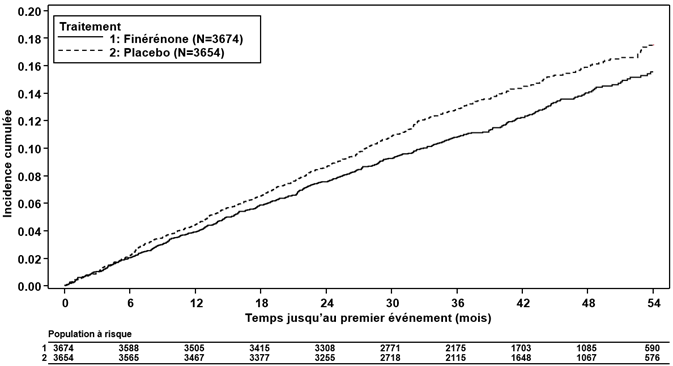
Figure 4: Délai jusqu'à la survenue d'une défaillance rénale, d'une baisse durable du DFGe ≥40 % vs valeur de départ ou d'un décès d'origine rénale dans l'étude FIGARO-DKD
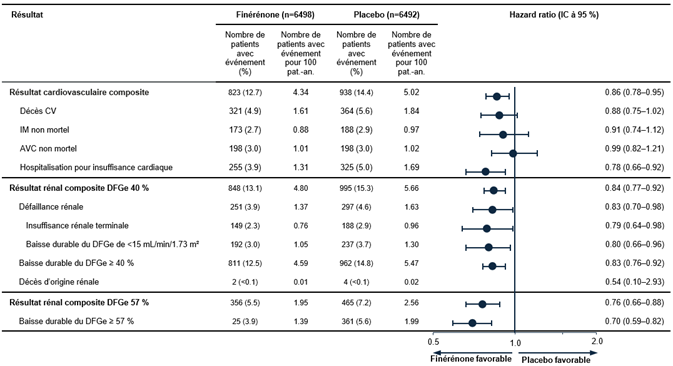
Dans le cadre d'une analyse combinée prédéfinie des études FIDELIO-DKD et FIGARO-DKD, la finérénone a réduit le risque pour le critère d'évaluation cardiovasculaire composite constitué du «délai jusqu'à la survenue d'un décès CV, d'un IM non mortel, d'un AVC non mortel ou d'une hospitalisation pour insuffisance cardiaque» par rapport au placebo (HR 0.86 [IC à 95 % 0.78; 0.95]) (voir Figure 5). Le risque pour le critère rénal composite constitué du «délai jusqu'à la survenue d'une défaillance rénale, de la baisse du DFGe de ≥40 % par rapport à la valeur de départ ou le décès d'origine rénale» était également réduit avec la finérénone par rapport au placebo (HR 0.84 [IC à 95 % 0.77; 0.92]), tout comme le critère d'évaluation composite constitué du délai jusqu'à la survenue d'une défaillance rénale, de la baisse du DFGe de ≥57 % (correspondant environ à un doublement du taux de créatinine sérique) par rapport à la valeur de départ ou du décès d'origine rénale (HR 0.76 [IC à 95 % 0.66; 0.88]) (voir Figure 5).
Figure 5: Critères d'évaluation cardiovasculaire et rénal composites dans l'analyse combinée des études FIDELIO-DKD et FIGARO-DKD
|





