Propriétés/EffetsCode ATC
D11AH08
Mécanisme d'action
L'abrocitinib est un inhibiteur de Janus kinase (JAK)1. Les JAK sont des enzymes intracellulaires qui transmettent les signaux provenant des interactions avec la cytokine ou les récepteurs des facteurs de croissance sur la membrane cellulaire et qui influencent les processus cellulaires d'hématopoïèse et le fonctionnement des cellules immunitaires. Les JAK phosphorylent et activent les protéines faisant office de transducteur de signal et activateur de transcription (STAT) qui modulent l'activité intracellulaire, y compris l'expression des gènes. L'inhibition des JAK1 module les voies de signalisation et empêche ainsi la phosphorylation et l'activation des protéines STAT.
Dans les tests biochimiques, l'abrocitinib est plus sélectif vis-à-vis de JAK1 que des trois autres isoformes de JAK: JAK2 (28 fois), JAK3 (>340 fois) et tyrosine kinase 2 (TYK2, 43 fois). Dans l'environnement cellulaire, il inhibe de préférence la phosphorylation STAT induite par les cytokines par le biais de paires de signaux dans lesquelles JAK1 est impliqué et laisse la transmission du signal par les paires JAK2/JAK2 ou JAK2/TYK2. L'importance de l'inhibition enzymatique sélective de certaines enzymes JAK pour l'effet clinique n'est actuellement pas connue.
Pharmacodynamique
L'utilisation d'abrocitinib a été associée à une réduction dose-dépendante des biomarqueurs sériques de l'inflammation dont la protéine C-réactive hautement sensible (hsCRP), l'interleukine-31 (IL-31), et la chimiokine régulée par activation exprimée dans le thymus (TARC). Ces changements sont revenus à des valeurs proches de la valeur initiale dans les 4 semaines suivant l'arrêt du médicament.
Le nombre absolu moyen de lymphocytes est passé de 1'785/mm3 au début du traitement à 1'876/mm3 2 semaines après le début du traitement par abrocitinib 100 mg 1x/j, puis est revenu à sa valeur initiale au 9e mois de traitement. Chez la plupart des patients, la NAL est restée dans la fourchette de référence. Le traitement par abrocitinib a été associé à une augmentation du nombre de cellules B de 250.5/mm3 au début du traitement à 320.0/mm3 à la semaine 16 ainsi qu'à une diminution du nombre de cellules NK de 157.5/mm3 au début du traitement à 125.7/mm3 à la semaine 4 avec l'abrocitinib 100 mg 1x/j. La signification clinique de ces modifications du nombre de cellules B et NK n'est pas connue.
Électrophysiologie cardiaque
L'effet de l'abrocitinib sur l'intervalle QTc a été examiné chez des sujets ayant reçu une dose unique de 600 mg d'abrocitinib dans le cadre d'une étude approfondie sur l'intervalle QT contrôlée par placebo et contrôle positif. Dans une analyse QTc de concentration, l'abrocitinib n'a pas entraîné d'allongement de l'intervalle QTc aux concentrations plasmatiques thérapeutiques et suprathérapeutiques étudiées.
Efficacité clinique
L'efficacité et la sécurité de l'abrocitinib en monothérapie et en association avec des traitements topiques médicamenteux de fond pendant 12 à 16 semaines ont été étudiées chez 1'616 patients au cours de 3 études pivot de phase III randomisées, en double aveugle et contrôlées par placebo (MONO-1, MONO-2 et COMPARE). En outre, l'efficacité et la sécurité de l'abrocitinib en monothérapie ont été étudiées pendant 52 semaines (avec l'option d'un traitement de secours chez les patients présentant des poussées) chez 1'233 patients au cours d'une étude de phase III d'induction randomisée, en double aveugle et contrôlée par placebo (REGIMEN). Les patients de ces 4 études présentaient une dermatite atopique modérée à sévère définie par un score Investigator's Global Assessment (IGA) ≥3, un score Eczema Area and Severity Index (EASI) ≥16, une atteinte de la surface corporelle (BSA) ≥10% et une estimation selon la Peak Pruritus Numerical Rating Scale (PP-NRS) de ≥4 depuis l'examen initial jusqu'à la randomisation. Les patients qui avaient déjà présenté une réponse insuffisante ou pour lesquels les traitements topiques étaient médicalement déconseillés, ou qui avaient reçu des traitements systémiques étaient éligibles à l'inclusion.
Tous les patients ayant terminé les études principales étaient éligibles au recrutement dans l'étude d'extension à long terme EXTEND.
Caractéristiques initiales
Au cours des études contrôlées versus placebo (MONO-1, MONO-2, COMPARE) et de l'étude d'induction en ouvert et d'interruption randomisée (REGIMEN), dans tous les groupes de traitement, 41.4% à 51.1% étaient des femmes, 59.3% à 77.8% étaient caucasiens, 15.0% à 33.0% étaient asiatiques et 4.1% à 8.3% étaient noirs, et l'âge moyen était de 32.1 à 37.7 ans. Dans ces études, 32.2% à 40.8% des patients avaient un IGA de 4 à l'inclusion (dermatite atopique sévère) et 41.4% à 59.5% des patients avaient déjà reçu un traitement systémique pour la dermatite atopique. Le score EASI moyen à l'inclusion était compris entre 28.5 et 30.9, le score PP-NRS à l'inclusion était compris entre 7.0 et 7.3 et l'indice de qualité de vie en dermatologie (DLQI) à l'inclusion était compris entre 14.4 et 16.0.
Réponse clinique
Études de 12 semaines en monothérapie (MONO-1, MONO-2) et de 16 semaines en association (COMPARE)
Une proportion significativement plus importante de patients a atteint les deux critères d'évaluation principaux IGA 0 ou 1 et/ou EASI-75 en ayant reçu 100 mg d'abrocitinib une fois par jour par rapport au placebo à la semaine 12 ou à la semaine 16 (voir Tableau 5).
Parmi les patients ayant reçu 100 mg d'abrocitinib une fois par jour, une proportion significativement plus importante d'entre eux a obtenu une amélioration d'au moins 4 points du score PP-NRS 4 (définie comme une amélioration de la sévérité du PP-NRS de ≥4 points) (%, IC à 95% à la semaine 12: MONO-1: 37.3% (29.2, 46.3) vs 15.3% (6.6, 24.0); MONO-2: 45.2% (37.1, 53.3) vs 11.5% (4.1, 19.0); COMPARE: 47.5% (40.9, 54.1) vs 28.9% (20.8, 37.0)). Cette amélioration a été observée dès la semaine 2 et a persisté jusqu'à la semaine 12 (figure 1). Une proportion plus élevée de patients a atteint le PP-NRS4 au jour 6 avec 100 mg d'abrocitinib une fois par jour en comparaison du placebo (%, IC à 95%: COMPARE: 15.0% (10.2, 19.8) vs 10.9% (5.3, 16.5)).
Les effets du traitement dans les sous-groupes (par ex. en fonction du poids, de l'âge, du sexe, de l'ethnie et du traitement immunosuppresseur systémique antérieur) dans les études MONO-1, MONO-2 et COMPARE concordaient avec les résultats obtenus dans le collectif global de l'étude.
|
Tableau 5. Résultats d'efficacité de Cibinqo en monothérapie à la semaine 12
| |
|
MONO-1c
|
MONO-2c
| |
Semaine 12
|
Semaine 12
| |
CBQ en monothérapie
|
PBO
N=77
|
CBQ en monothérapie
|
PBO
N=78
| |
100 mg 1x/j
N=156
|
100 mg 1x/j
N=158
| |
|
% de répondeurs (IC à 95%)
| |
IGA 0 ou 1a
|
23.7d
(17.0; 30.4)
|
7.9
(1.8; 14.0)
|
28.4d
(21.3; 35.5)
|
9.1
(2.7; 15.5)
| |
EASI-75b
|
39.7d
(32.1; 47.4)
|
11.8
(4.6; 19.1)
|
44.5d
(36.7; 52.3)
|
10.4
(3.6; 17.2)
| |
PSAADe
|
-2.2d
(-2.6; -1.9)
|
-1.1
(-1.7; -0.6)
|
-3.0d
(-3.3; -2.7)
|
-2.4d
(-2.8; -2.1)
|
-0.8
(-1.3; -0.3)
| |
Abréviations: CBQ = Cibinqo; IC = intervalle de confiance; EASI = Eczema Area and Severity Index (Indice de surface et de sévérité de l'eczéma); IGA = Investigator Global Assessment (Évaluation globale par l'investigateur); N = nombre de patients randomisés; PBO = placebo; PP-NRS = Peak Pruritus Numerical Rating Scale (Échelle d'évaluation numérique du prurit maximal); PSAAD = Pruritus and Symptoms Assessment for Atopic Dermatitis (Évaluation du prurit et des symptômes de la dermatite atopique); 1x/j = une fois par jour.
a. Les répondeurs de l'IGA étaient des patients dont le score IGA était «blanchi» (0) ou «presque blanchi» (1) (sur une échelle de 5 points) et qui présentaient une réduction de ≥2 points par rapport à l'inclusion.
b. Les répondeurs de l'EASI-75 étaient des patients présentant une amélioration ≥75% de l'EASI par rapport à l'inclusion.
c. Cibinqo en monothérapie.
d. Statistiquement significatif avec ajustement pour la multiplicité par rapport au placebo.
e. Les résultats présentés sont la variation des moyennes ajustées (méthode des moindres carrés) par rapport à la valeur initiale.
|
|
Tableau 6. Résultats d'efficacité de Cibinqo en association avec un traitement topique à la semaine 12 et à la semaine 16
| |
|
COMPAREc
| |
Semaine 12
|
Semaine 16
| |
CBQ + agents topiques
|
PBO + agents topiques
N=131
|
DUP + agents topiques
N=243
|
CBQ + agents topiques
|
PBO + agents topiques
N=131
|
DUP + agents topiques
N=243
| |
100 mg
N=238
|
100 mg
N=238
| |
|
% de répondeurs (IC à 95%)
| |
IGA 0 ou 1a
|
36.6d
(30.4; 42.8)
|
14.0
(8.0; 19.9)
|
36.5
(30.4; 42.6)
|
34.8d
(28.6; 40.9)
|
12.9
(7.0; 18.8)
|
38.8
(32.5; 45.1)
| |
EASI-75b
|
58.7d
(52.4; 65.0)
|
27.1
(19.5; 34.8)
|
58.1
(51.9; 64.3)
|
60.3d
(53.9; 66.6)
|
30.6
(22.5; 38.8)
|
65.5
(59.4; 71.6)
| |
Abréviations: CBQ = Cibinqo; IC = intervalle de confiance; DUP = duplilumab; EASI = Eczema Area and Severity Index (Indice de surface et de sévérité de l'eczéma); IGA = Investigator Global Assessment (Évaluation globale par l'investigateur); N = nombre de patients randomisés; PBO = placebo; PP-NRS = Peak Pruritus Numerical Rating Scale (Échelle d'évaluation numérique du prurit maximal); PSAAD = Pruritus and Symptoms Assessment for Atopic Dermatitis (Évaluation du prurit et des symptômes de la dermatite atopique).
a. Les répondeurs de l'IGA étaient des patients dont le score IGA était «blanchi» (0) ou «presque blanchi» (1) (sur une échelle de 5 points) et qui présentaient une réduction de ≥2 points par rapport à l'inclusion.
b. Les répondeurs de l'EASI-75 étaient des patients présentant une amélioration ≥75% de l'EASI par rapport à l'inclusion.
c. Cibinqo en association avec un traitement topique.
d. Statistiquement significatif avec ajustement pour la multiplicité par rapport au placebo.
|
La figure 1 révèle la proportion de patients ayant atteint le score PP-NRS4 au cours du temps dans les études MONO-1, MONO-2 et COMPARE.
|
Figure 1. Proportion de patients ayant atteint la PP-NSR4 au cours du temps dans les études MONO-1, MONO-2 et COMPARE
|
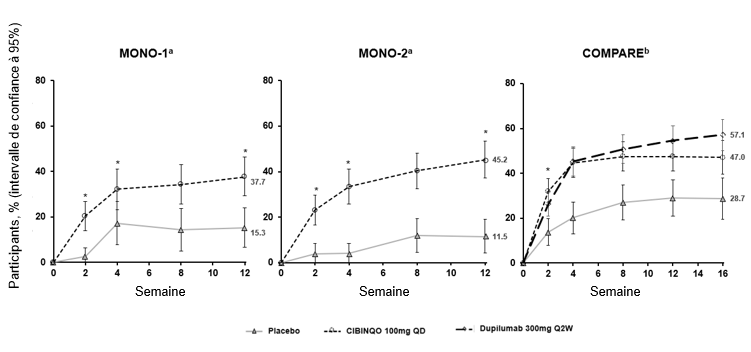
| |
Abréviations: PP-NRS = Peak Pruritus Numerical Rating Scale (Échelle d'évaluation numérique du prurit maximal); 1x/j = une fois par jour.
Les répondeurs de PP-NRS4 étaient des patients présentant une amélioration ≥4 points sur l'échelle d'évaluation numérique du prurit maximal (PP-NRS) par rapport à l'inclusion.
a. Cibinqo utilisé en monothérapie.
b. Cibinqo utilisé en association avec un traitement topique médicamenteux.
* Statistiquement significatif avec ajustement pour la multiplicité par rapport au placebo.
|
Efficacité à long terme
Dans l’étude d’extension à long terme EXTEND, les patients ont reçu Cibinqo avec ou sans traitement médicamenteux topique de fond concomitant. Les patients qui avaient déjà été randomisés pour recevoir 100 mg ou 200 mg de Cibinqo une fois par jour dans les études qualifiantes ont reçu dans EXTEND la même dose que dans l’étude principale et l’aveugle a été maintenu. Parmi les patients qui ont présenté une réponse à un traitement par 100 mg d’abrocitinib une fois par jour à la semaine 12 d’une étude principale qualifiante (par exemple MONO-1, MONO 2, COMPARE) et ont été inclus dans l’étude EXTEND, la proportion de patients ayant maintenu leur réponse à la semaine 96 du traitement cumulatif était de 47% pour la réponse IGA (0 ou 1), 59% pour l’EASI-75 et 50% pour le score PP-NRS4 (sur la base d’une analyse NRI [Non Responder Imputation]).
Les patients qui ont reçu du dupilumab dans l’étude COMPARE et qui ont ensuite été admis dans l’étude EXTEND ont été randomisés pour recevoir 100 mg ou 200 mg d’abrocitinib une fois par jour lors de leur inclusion dans l’étude EXTEND. Une proportion importante des patients n’ayant pas répondu au dupilumab dans l’étude COMPARE et ayant été randomisés pour recevoir 100 mg d’abrocitinib une fois par jour a obtenu une réponse 12 semaines après le passage à l’abrocitinib [34% pour l’IGA (0 ou 1) et 68% pour l’EASI-75] (sur la base d’une analyse NRI [Non Responder Imputation]).
| 
