Propriétés/EffetsCode ATC
L01EX19
Mécanisme d’action
Le riprétinib est un inhibiteur de kinase. Sa dénomination chimique est 1-(4-Brom-5-[1-éthyl-7-(méthylamino)-2-oxo-1,2-dihydro-1,6-naphthyridin-3-yl]-2-fluorophényl)-3-phénylurée. Sa formule moléculaire est C24H21BrFN5O2 et son poids moléculaire est de 510,36 g/mol. La structure chimique du riprétinib est présentée cidessous:
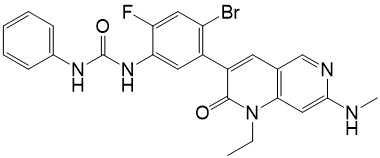
Le riprétinib est un solide cristallin blanc à blanc cassé. Le riprétinib est un composé lipophile, faiblement basique, pratiquement insoluble en milieu aqueux.
Le riprétinib est un inhibiteur de la tyrosine kinase qui inhibe la tyrosine kinase du récepteur proto-oncogène KIT (KIT) et la Platelet-Derived-Growth-Factor-Receptor-A-Kinase (PDGFRA kinase), y compris le type sauvage et les mutations de type primaires et secondaires. In vitro, le riprétinib inhibe également d’autres kinases, telles que PDGFRB, TIE2, VEGFR2 et BRAF.
Pharmacodynamique
Relations exposition-réponse
Les relations exposition-réponse et l’évolution dans le temps de la pharmacodynamique du riprétinib n’ont pas encore été entièrement caractérisées.
Électrophysiologie cardiaque
Après le traitement par QINLOCK à la dose recommandée de 150 mg une fois par jour par voie orale, aucun allongement cliniquement significatif de l’intervalle QTc (c’est-à-dire > 20 ms) n’a été observé.
Efficacité clinique
L’efficacité de QINLOCK a été évaluée dans INVICTUS, une étude internationale multicentrique, randomisée (2:1), en double aveugle et contrôlée contre placebo (NCT03353753). Les patients inclus dans l’étude étaient atteints de tumeurs stromales gastro-intestinales (GIST) inopérables, localement avancées ou métastatiques. Les patients inclus présentaient une progression ou une intolérance à l’imatinib, au sunitinib et au régorafénib. La randomisation a été stratifiée selon les lignes de traitement antérieures (3 versus ≥4) et selon le statut de performance de l’Eastern Cooperative Oncology Group (ECOG) (0 versus 1 ou 2). Les patients ont reçu 150 mg de QINLOCK ou un placebo une fois par jour par voie orale jusqu’à progression de la maladie ou une toxicité inacceptable. La réponse tumorale a été évaluée tous les 28 jours pendant les 4 premiers mois, puis tous les 56 jours par la suite. Le critère principal d’efficacité était la survie sans progression (PFS) basée sur une évaluation en aveugle, indépendante et centralisée (BICR) de la maladie au moyen des critères RECIST 1.1 modifiés dans lesquels les ganglions lymphatiques et les lésions osseuses n’étaient pas des lésions cibles et les nodules tumoraux à croissance progressive au sein d’une masse tumorale préexistante devaient répondre à des critères spécifiques pour être considérés comme une preuve définitive de la progression de la maladie. Les autres critères d’efficacité comprenaient le taux de réponse objective (ORR) selon le BICR et la survie globale (OS). Les patients ayant été randomisés dans le groupe placebo pouvaient être traités par QINLOCK en cas de progression de la maladie.
Au total, 129 patients ont été randomisés, 85 dans le groupe QINLOCK et 44 dans le groupe placebo.
Les caractéristiques des patients de la population en intention de traiter (ITT) de l’étude INVICTUS étaient les suivantes: âge médian de 60 ans (fourchette: 29 à 83 ans), avec 39% de ³65 ans; 57% d’hommes; 75% de Caucasiens; 92% avec un statut de performance ECOG de 0 ou 1. 63% des patients avaient reçu 3 traitements antérieurs et 37% en avaient reçu 4 ou plus. 66% des patients randomisés dans le groupe placebo sont passés à QINLOCK après la progression de leur maladie.
Les patients du groupe QINLOCK ont eu une PFS médiane de 6,3 mois (IC à 95%: 4,6 ; 6,9) contre 1,0 mois (IC à 95%: 0,9 ; 1,7) dans le groupe placebo, réduisant ainsi significativement le risque de progression de la maladie ou de décès de 85% (rapport de risque de 0,15, p<0,0001).
Un ORR a été observé chez 8 patients dans le groupe riprétinib (9,4%) contre 0% dans le groupe placebo (p=0,0504). QINLOCK a montré une OS médiane de 15,1 mois (IC à 95%: 12,3 ; 15,1) contre 6,6 mois (IC à 95%: 4,1 ; 11,6) dans le groupe placebo avec un rapport de risque de 0,36 (IC à 95%: 0,21 ; 0,62).
| 
