Propriétés/EffetsCode ATC
A10BJ06
Mécanisme d'action
Le sémaglutide est un analogue du GLP-1 présentant une homologie de séquence de 94 % avec le GLP-1 humain. Le sémaglutide agit comme un agoniste du récepteur du GLP-1 qui se lie sélectivement au récepteur du GLP-1, la cible du GLP-1 natif, et l'active.
Comparé au GLP-1 natif, le sémaglutide présente une demi-vie prolongée d'environ une semaine, ce qui le rend approprié pour une administration sous-cutanée une fois par semaine. Le principal mécanisme de retard est la liaison à l'albumine qui entraîne une diminution de la clairance rénale et une protection contre la dégradation métabolique. Le sémaglutide est par ailleurs stabilisé contre la dégradation par l'enzyme DDP-4.
Le GLP-1 est une hormone physiologique qui agit dans la régulation de l'appétit et de l'apport calorique; le récepteur du GLP-1 est présent dans différentes zones du cerveau impliquées dans la régulation de l'appétit. Le sémaglutide a des effets directs sur les régions du cerveau impliquées dans la régulation homéostatique de la consommation alimentaire dans l'hypothalamus et le tronc cérébral. Le sémaglutide influence le système de récompense hédonique par des effets directs et indirects sur des régions du cerveau comme le septum, le thalamus et les amygdales.
Des études cliniques montrent que le sémaglutide réduit l'absorption d'énergie, augmente la perception de la satiété, la sensation de réplétion et le contrôle de l'alimentation, atténue la sensation de faim et réduit la fréquence et l'intensité des fringales.
Des études cliniques ont par ailleurs montré que le sémaglutide réduit la glycémie en fonction du glucose en stimulant la sécrétion d'insuline et en réduisant la sécrétion de glucagon lorsque la glycémie est élevée. Le mécanisme de réduction de la glycémie s'accompagne également d'un léger ralentissement de la vidange gastrique au début de la phase postprandiale. Le sémaglutide réduit la sécrétion d'insuline pendant une hypoglycémie, mais ne diminue pas la sécrétion de glucagon.
Les récepteurs GLP-1 sont également exprimés dans le cœur, les vaisseaux sanguins, le système immunitaire et les reins.
Le mécanisme d'action du sémaglutide pour réduire le risque cardiovasculaire est probablement multifactoriel et n'est pas complètement élucidé, en partie par les effets sur les facteurs de risque cardiovasculaire connus (y compris la réduction de la tension artérielle, l'amélioration du profil lipidique et les effets anti-inflammatoires).
Pharmacodynamique
Appétit, apport énergétique et choix alimentaire
Le sémaglutide réduit l'appétit en augmentant les sensations de satiété et de réplétion et en diminuant la faim et la prise alimentaire prospective. Après 20 semaines de traitement, l'apport énergétique d'un repas ad libitum était 35 % plus faible sous Wegovy que sous placebo. Cela s'est accompagné d'un meilleur contrôle de l'alimentation, de moins de fringales (de produits laitiers et d'aliments salés), de moins d'envies de sucré et d'une préférence relativement moins marquée pour les aliments riches en graisses.
Électrophysiologie cardiaque (QTc)
L'effet du sémaglutide sur la repolarisation cardiaque a été étudié dans une étude détaillée de QTc. Le sémaglutide n'a pas prolongé l'intervalle QTc à des doses allant jusqu'à 1.5 mg à l'état d'équilibre.
L'exposition au sémaglutide chez les sujets en surpoids ou obèses traités par Wegovy est comparable à l'exposition étudiée chez les sujets sains dans l'étude QTc sur le sémaglutide.
Efficacité clinique
L'efficacité et la sécurité de Wegovy pour la régulation du poids en association avec un régime hypocalorique et une activité physique accrue ont été évaluées dans quatre études de phase 3a, randomisées, en double aveugle et contrôlées par placebo d'une durée de 68 semaines (STEP 1-4). Au total, 4684 patients (2652 randomisés pour recevoir Wegovy) ont été inclus dans les études. L'efficacité et la sécurité du sémaglutide ont par ailleurs été étudiées dans une étude de phase 3b en double aveugle, randomisée et contrôlée par placebo sur une durée de deux ans (STEP 5) chez 304 patients (152 traités avec du sémaglutide) par rapport au placebo.
Le traitement par Wegovy a permis d'obtenir une perte de poids supérieure, cliniquement pertinente et durable par rapport au placebo chez les patients souffrant d'obésité (IMC ≥30 kg/m2) ou de surpoids (IMC ≥27 kg/m2 à < 30 kg/m2) et d'au moins une maladie concomitante liée au poids.
En outre, dans l'ensemble des essais, une proportion plus élevée de patients a obtenu une perte de poids ≥5 %, ≥10 %, ≥15 % et ≥20 % sous sémaglutide par rapport au placebo.
Le traitement par Wegovy a également montré des améliorations statistiquement significatives du tour de taille et de la pression artérielle systolique par rapport au placebo. Le sémaglutide 2.4 mg a par ailleurs eu un effet globalement favorable sur les lipides plasmatiques et la CRP (marqueurs de l'inflammation) par rapport au placebo (cf. Tableaux 4 et 5).
L'efficacité de la perte de poids s'est avérée indépendante de l'âge, du sexe, de l'appartenance ethnique, des valeurs initiales du poids corporel et de l'IMC, de la présence d'un diabète de type 2 et du degré de la fonction rénale.
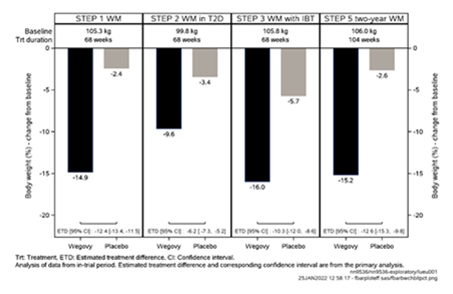
Figure 1 Changement du poids corporel (%) entre le début de l'étude et les semaines 68 et 104
STEP 1: gestion du poids
Dans le cadre d'une étude en double aveugle de 68 semaines, 1 961 patients souffrant d'obésité (IMC ≥30 kg/m2) ou de surpoids (IMC ≥27 kg/m2 à < 30 kg/m2) et présentant au moins une pathologie associée liée au poids ont été randomisés pour recevoir un traitement par Wegovy ou par placebo. Tous les patients ont suivi un régime hypocalorique et augmenté leur activité physique tout au long de l'étude. La majorité des patients avaient au moins une maladie concomitante liée au poids. Il s'agissait notamment du prédiabète (43.7 %), de la dyslipidémie (37.0 %), de l'hypertension (36.0 %), de l'ostéoarthrose du genou ou de la hanche (15.9 %), de l'apnée obstructive du sommeil (11.7 %), de l'asthme/la bronchopneumopathie chronique obstructive (BPCO) (11.6 %), de la maladie du foie (stéatose hépatique non alcoolique (NAFLD) ou stéatohépatite non alcoolique (NASH)) (8.6 %) et le syndrome des ovaires polykystiques (SOPK) (6.6 %).
La perte de poids est apparue tôt et s'est poursuivie pendant l'étude. À la fin du traitement (semaine 68), la perte de poids était supérieure et cliniquement significative par rapport au placebo (cf. Tableau 4 et Figure 2).
À la suite de l'étude de 68 semaines, une prolongation de 52 semaines sans traitement a été effectuée, qui comprenait 327 patients ayant terminé la période d'étude principale avec la dose d'entretien de sémaglutide ou de placebo. Pendant la période sans traitement de la semaine 68 à la semaine 120, le poids corporel moyen a augmenté dans les deux groupes de traitement. Le poids est cependant resté inférieur de 5.6 % à la valeur initiale chez les patients traités par du sémaglutide pendant la période d'étude principale, contre 0.1 % chez les patients du groupe ayant reçu le placebo.
Tableau 4: Résultats d'une étude de 68 semaines comparant Wegovy à un placebo chez des patients souffrant d'obésité ou de surpoids et d'au moins une maladie associée au poids (STEP 1)
|
|
Wegovy
|
Placebo
| |
Full analysis set (N)
|
1 306
|
655
| |
Poids corporel
| |
Valeur initiale (kg)
|
105.4
|
105.2
| |
Variation (%) par rapport à la valeur initiale1.2
|
-14.9
|
-2.4
| |
Différence (%) par rapport au placebo1
[IC à 95 %]
|
-12.4
[-13.4; -11.5]*
|
-
| |
Variation (kg) par rapport au placebo
|
-15.3
|
-2.6
| |
Différence (kg) par rapport au placebo1
[IC à 95 %]
|
-12.7
[-13.7; -11.7]
|
-
| |
Patients (%) avec perte de poids ≥5 %3
|
83.5*
|
31.1
| |
Patients (%) avec perte de poids ≥10 %3
|
66.1*
|
12.0
| |
Patients (%) avec perte de poids ≥15 %3
|
47.9*
|
4.8
| |
Patients (%) avec perte de poids ≥
20 %3
|
30.2
|
1.7
| |
Tour de taille (cm)
| |
Valeur initiale
|
114.6
|
114.8
| |
Variation par rapport à la valeur initiale1
|
-13.5
|
-4.1
| |
Différence par rapport au placebo1
[IC à 95 %]
|
-9.4
[-10.3; -8.5]*
|
-
| |
Facteurs cardiométaboliques
| |
Pression artérielle systolique (mmHg)
| |
Valeur initiale
|
126
|
127
| |
Variation par rapport à la valeur initiale1
|
-6.2
|
-1.1
| |
Différence par rapport au placebo1
[IC à 95 %]
|
-5.1
[-6.3; -3.9]*
|
-
| |
Pression artérielle diastolique (mmHg)
| |
Valeur initiale
|
80
|
80
| |
Variation par rapport à la valeur initiale
|
-2.8
|
-0.4
| |
Différence par rapport au placebo
[IC à 95 %]
|
-2.4
[-3.3; -1.6]
|
-
| |
Lipides
| |
Cholestérol total
| |
Valeur initiale (mmol/l)4
|
4.9
|
5.0
| |
Variation (%) par rapport à la valeur initiale1
|
-3.3
|
0.1
| |
Différence relative (%) par rapport au placebo [IC à 95 %]1
|
-3.3
[-4.8; -1.8]
|
-
| |
Cholestérol LDL
| |
Valeur initiale (mmol/l)
|
2.9
|
2.9
| |
Variation (%) par rapport à la valeur initiale1
|
-2.5
|
1.3
| |
Différence relative (%) par rapport au placebo1
[IC à 95 %]
|
-3.8
[-5.9; -1.5]
|
-
| |
Cholestérol HDL
| |
Valeur initiale (mmol/l)4
|
1.3
|
1.3
| |
Variation (%) par rapport à la valeur initiale1
|
5.2
|
1.4
| |
Différence relative (%) par rapport au placebo1
[IC à 95 %]
|
3.8
[2.2; 5.4]
|
-
| |
Triglycérides
| |
Valeur initiale (mmol/l)4
|
1.4
|
1.4
| |
Variation (%) par rapport à la valeur initiale1
|
-21.9
|
-7.3
| |
Différence relative (%) par rapport au placebo1
[IC à 95 %]
|
-15.8
[-18.8; -12.7]
|
-
| |
CRP
| |
Valeur initiale (mg/l)
|
3.9
|
3.9
| |
Variation (%) par rapport à la valeur initiale1
|
-52.6
|
-15.0
| |
Différence relative (%) par rapport au placebo1
[IC à 95 %]
|
-44.3
[-49.5; -38.5]
|
-
| |
Statut glycémique
| |
Patients (%) atteints de prédiabète à la valeur initiale
|
43.7
| |
Patients (%) avec statut normoglyclémique à la fin du traitement
|
84.1
|
47.8
| |
*
p < 0.0001 (non corrigé bilatéralement) pour la supériorité.
1 Estimé à l'aide d'un modèle ANCOVA avec imputation multiple basé sur toutes les données, indépendamment de l'arrêt du traitement randomisé ou du début d'un autre traitement médicamenteux contre l'obésité ou de la chirurgie bariatrique.
2 Au cours de l'étude, le traitement randomisé a été interrompu par 17.1 % et 22.4 % des patients randomisés pour recevoir respectivement Wegovy et un placebo. En supposant que tous les patients randomisés ont continué le traitement et n'ont pas reçu de traitement supplémentaire contre l'obésité, les changements estimés du poids corporel entre la randomisation et la semaine 68, basés sur un modèle mixte de mesures répétées incluant toutes les observations jusqu'au premier arrêt, étaient de -16.9 % pour 2.4 mg de sémaglutide et de -2.4 % pour le placebo.
3 Estimé à l'aide d'un modèle de régression binaire basé sur la même procédure d'imputation que celle utilisée pour l'analyse primaire.
4 Moyenne géométrique.
|
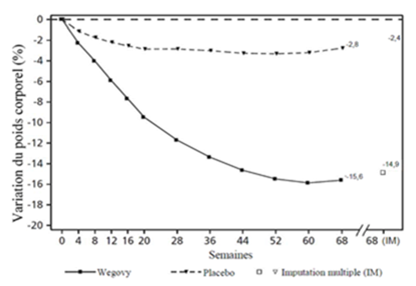
Valeurs observées pour les patients ayant effectué chaque visite prévue et estimations avec imputations multiples (MI) pour les abandons avec examen final («retrieved dropouts»).
Figure 2 STEP 1: variation moyenne du poids corporel (%) de la ligne de base à la semaine 68
STEP 2: Gestion du poids chez les patients atteints de diabète de type 2
Dans une étude en double aveugle de 68 semaines, 1 210 patients souffrant de surpoids ou d'obésité (IMC ≥27 kg/m2) et de diabète de type 2 ont été randomisés pour recevoir Wegovy, le sémaglutide 1 mg une fois par semaine ou un placebo. L'étude a porté sur des patients dont le diabète était insuffisamment contrôlé (HbA1c 7-10 %) et traités soit par un régime et de l'exercice physique seuls, soit par 1 à 3 antidiabétique(s) oral(ux). Tous les patients ont suivi un régime hypocalorique et augmenté leur activité physique tout au long de l'étude. La majorité des patients présentaient au moins deux maladies concomitantes liées au poids. Outre le diabète de type 2, il s'agissait notamment d'hypertension (69.8 %), de dyslipidémie (68.0 %), d'ostéoarthrose du genou ou de la hanche (19.6 %), de maladie du foie (NAFLD ou NASH) (22.6 %), d'apnée obstructive du sommeil (15.1 %), d'asthme/BPCO (8.4 %) et de SOPK (4.1 %).
Le traitement par Wegovy pendant 68 semaines a entraîné une réduction supérieure et cliniquement significative du poids corporel et de l'HbA1c par rapport au placebo (cf. Tableau 5 et Figure 3).
Tableau 5: Résultats d'une étude de 68 semaines comparant Wegovy à un placebo chez des patients souffrant d'obésité ou de surpoids et de diabète de type 2 (STEP 2)
|
|
Wegovy
|
Placebo
| |
Full analysis set (N)
|
404
|
403
| |
Poids corporel
| |
Valeur initiale (kg)
|
99.9
|
100.5
| |
Variation (%) par rapport à la valeur initiale1.2
|
-9.6
|
-3.4
| |
Différence (%) par rapport au placebo1
[IC à 95 %]
|
-6.2
[-7.3; -5.2]*
|
-
| |
Variation kg) par rapport à la valeur initiale
|
-9.7
|
-3.5
| |
Différence (kg) par rapport au placebo1
[IC à 95 %]
|
-6.1
[-7.2; -5.0]
|
-
| |
Patients (%) avec perte de poids ≥5 %3
|
67.4*
|
30.2
| |
Patients (%) avec perte de poids ≥10 %3
|
44.5*
|
10.2
| |
Patients (%) avec perte de poids ≥15 %3
|
25.0*
|
4.3
| |
Patients (%) avec perte de poids ≥20 %3
|
12.8
|
2.3
| |
Tour de taille (cm)
| |
Valeur initiale
|
114.5
|
115.5
| |
Variation par rapport à la valeur initiale1
|
-9.4
|
-4.5
| |
Différence par rapport au placebo1
[IC à 95 %]
|
-4.9
[-6.0; -3.8]*
|
-
| |
Facteurs cardiométaboliques
| |
Pression artérielle systolique (mmHg)
| |
Valeur initiale
|
130
|
130
| |
Variation par rapport à la valeur initiale1
|
-3.9
|
-0.5
| |
Différence par rapport au placebo1 [IC à 95 %]
|
-3.4
[-5.6; -1.3]**
|
-
| |
Pression artérielle diastolique (mmHg)
| |
Valeur initiale
|
80
|
80
| |
Variation par rapport à la valeur initiale
|
-1.6
|
-0.9
| |
Différence par rapport au placebo
[IC à 95 %]
|
-0.7
[-2.0; 0.6]
|
-
| |
Lipides
| |
Cholestérol total
| |
Valeur initiale (mmol/l)4
|
4.4
|
4.4
| |
Variation (%) par rapport à la valeur initiale1
|
-1.4
|
-0.5
| |
Différence relative (%) par rapport au placebo1
[IC à 95 %]
|
-0.9
[-3.6; 2.0]
|
-
| |
Cholestérol LDL
| |
Valeur initiale (mmol/l)4
|
2.3
|
2.3
| |
Variation (%) par rapport à la valeur initiale1
|
0.5
|
0.1
| |
Différence relative (%) par rapport au placebo1
[IC à 95 %]
|
0.4
[-4.0; 4.9]
|
-
| |
Cholestérol HDL
| |
Valeur initiale (mmol/l)4
|
1.2
|
1.1
| |
Variation (%) par rapport à la valeur initiale1
|
6.9
|
4.1
| |
Différence relative (%) par rapport au placebo1
[IC à 95 %]
|
2.7
[0.3; 5.1]
|
-
| |
Triglycérides
| |
Valeur initiale (mmol/l)4
|
1.7
|
1.8
| |
Variation (%) par rapport à la valeur initiale1
|
-22.0
|
-9.4
| |
Différence relative (%) par rapport à un placebo1
[IC à 95 %]
|
-13.9
[-19.0; -8.4]
|
-
| |
CRP
| |
Valeur initiale (mg/l)
|
3.5
|
3.4
| |
Variation (%) par rapport à la valeur initiale1
|
-48.9
|
-16.7
| |
Différence relative (%) par rapport au placebo1
[IC à 95 %]
|
-38.7
[-46.5; -29.8]
|
-
| |
Facteurs glycémiques
| |
HbA1c (mmol/mol (%)
| |
Valeur initiale
|
65.3 (8.1)
|
65.3 (8.1)
| |
Variation par rapport à la valeur initiale1.2
|
-17.5 (-1.6)
|
-4.1 (-0.4)
| |
Différence par rapport au placebo1
[IC à 95 %]
|
-13.5
[-15.5; -11.4]
[-1.2 (-1.4; -1.1)]*
|
-
-
| |
Patients (%) qui ont atteint un taux d'HbA1c < 7 %
|
77.4
|
26.0
| |
Patients (%) ayant atteint un taux d'HbA1c ≤6.5 %3
|
65.9
|
15.1
| |
* p < 0.001 (non corrigé bilatéralement) pour la supériorité; ** p < 0.05 (non corrigé bilatéralement) pour la supériorité.
1 Estimé à l'aide d'un modèle ANCOVA avec imputation multiple basé sur toutes les données, indépendamment de l'arrêt du traitement randomisé ou du début d'un autre traitement médicamenteux contre l'obésité ou de la chirurgie bariatrique.
2 Au cours de l'étude, le traitement randomisé de 11.6 % et 13.9 % des patients randomisés sur Wegovy ou placebo a été interrompu. En supposant que tous les patients randomisés aient continué le traitement et n'aient pas reçu de traitement complémentaire contre l'obésité, les variations estimées du poids corporel depuis la randomisation jusqu'à la semaine 68 sur la base d'un modèle mixte de mesures répétées incluant toutes les observations effectuées jusqu'au premier sevrage étaient de -10.6 % pour 2.4 mg de sémaglutide et de -3.1 % pour le placebo.
3 Estimé à l'aide d'un modèle de régression binaire basé sur la même procédure d'imputation que celle utilisée pour l'analyse primaire.
4 Moyenne géométrique
|
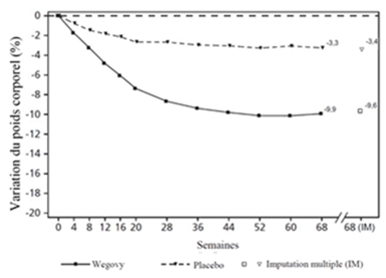
Valeurs observées pour les patients ayant effectué chaque visite prévue et estimations avec imputations multiples (MI) pour les abandons avec examen final («retrieved dropouts»).

HbA1c: hémoglobine A1c
Valeurs observées pour les patients ayant effectué chaque visite prévue et estimations avec imputations multiples (MI) pour les abandons avec examen final («retrieved dropouts») (RD-MI).
Figure 3 STEP 2: Variation moyenne du poids corporel (kg) et du taux d'HbA1c (%) entre le début de l'étude et la semaine 68
STEP 3: Gestion du poids avec une thérapie comportementale intensive
Dans le cadre d'une étude en double aveugle de 68 semaines, 611 patients souffrant d'obésité (IMC ≥30 kg/m2) ou de surpoids (IMC ≥27 kg/m2 à < 30 kg/m2) et d'au moins une pathologie associée liée au poids ont été randomisés pour recevoir un traitement par Wegovy ou par placebo. Pendant l'étude, tous les patients ont suivi une thérapie comportementale intensive (TCI), consistant en un régime très restrictif, une augmentation de l'activité physique et des conseils comportementaux.
La majorité des patients avaient au moins une maladie concomitante liée au poids. Il s'agissait notamment du prédiabète (49.8 %), de l'hypertension (34.7 %), de la dyslipidémie (34.7 %), de l'ostéoarthrose du genou ou de la hanche (18.7 %), de l'asthme/la BPCO (15.1 %), de l'apnée obstructive du sommeil (12.6 %), d'une maladie hépatique (NAFLD ou NASH) (6.1 %) et du SOPK (5.5 %).
Le traitement par Wegovy et IBT pendant 68 semaines a entraîné une réduction du poids corporel supérieure et cliniquement pertinente par rapport au placebo (cf. Tableau 6).
Tableau 6: Résultats d'une étude de 68 semaines comparant Wegovy à un placebo chez des patients souffrant d'obésité ou de surpoids et d'au moins une maladie concomitante liée au poids sous thérapie comportementale intensive (STEP 3)
|
|
Wegovy
|
Placebo
| |
Full analysis set (N)
|
407
|
204
| |
Poids corporel
| |
Valeur initiale (kg)
|
106.9
|
103.7
| |
Variation (%) par rapport à la valeur initiale1,2
|
-16.0
|
-5.7
| |
Différence (%) par rapport au placebo1
[IC à 95 %]
|
-10.3
[-12.0; -8.6]*
|
-
| |
Variation (kg) par rapport à la valeur initiale
|
-16.8
|
-6.2
| |
Différence (kg) par rapport au placebo1
[IC à 95 %]
|
-10.6
[-12.5; -8.8]
|
-
| |
Patients (%) avec perte de poids ≥5 %3
|
84.8*
|
47.8
| |
Patients (%) avec perte de poids ≥10 %3
|
73.0*
|
27.1
| |
Patients (%) avec perte de poids ≥15 %3
|
53.5*
|
13.2
| |
Patients (%) avec perte de poids ≥20 %3
|
33.9
|
3.5
| |
Tour de taille (cm)
| |
Valeur initiale
|
113.6
|
111.8
| |
Variation par rapport à la valeur initiale1
|
-14.6
|
-6.3
| |
Différence par rapport au placebo1
[IC à 95 %]
|
-8.3
[-10.1; -6.6]*
|
-
| |
* p < 0.0001 (non corrigé bilatéralement) pour la supériorité.
1 Estimé à l'aide d'un modèle ANCOVA avec imputation multiple basé sur toutes les données, indépendamment de l'arrêt du traitement randomisé ou du début d'un autre traitement médicamenteux contre l'obésité ou de la chirurgie bariatrique.
2 Au cours de l'étude, le traitement randomisé a été interrompu par 16.7 % et 18.6 % des patients randomisés pour recevoir respectivement Wegovy et un placebo. En supposant que tous les patients randomisés aient conservé le traitement et n'aient pas reçu de traitement complémentaire contre l'obésité, les variations estimées du poids corporel depuis la randomisation jusqu'à la semaine 68 sur la base d'un modèle mixte de mesures répétées incluant toutes les observations effectuées jusqu'au premier sevrage étaient de -17.6 % pour 2.4 mg de sémaglutide et de -5.0 % pour le placebo.
3 Estimé à l'aide d'un modèle de régression binaire basé sur la même procédure d'imputation que celle utilisée pour l'analyse primaire.
|
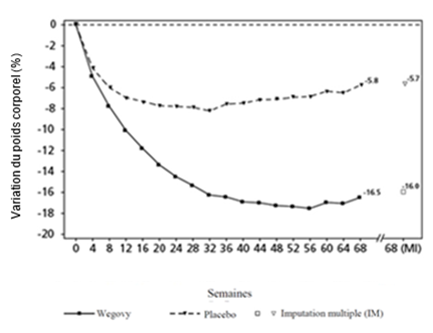
Valeurs observées pour les patients ayant effectué chaque visite prévue et estimations avec imputations multiples (MI) des dropouts
Figure 4 STEP 3: variation moyenne du poids corporel (%) de la ligne de base à la semaine 68
STEP 4: gestion du poids à long terme
Dans le cadre d'une étude en double aveugle de 68 semaines, 902 patients souffrant d'obésité (IMC ≥30 kg/m2) ou de surpoids (IMC ≥27 kg/m2 à < 30 kg/m2) et d'au moins une maladie associée liée au poids ont été inclus. Tous les patients ont suivi un régime hypocalorique et augmenté leur activité physique tout au long de l'étude. De la semaine 0 à la semaine 20 (phase de run-in) tous les patients ont reçu Wegovy. À la semaine 20 (valeur de référence), 803 patients ayant atteint la dose d'entretien de 2.4 mg ont été randomisés pour poursuivre le traitement ou passer au placebo pour les 48 semaines restantes.
La majorité des patients avaient au moins une maladie concomitante liée au poids. Il s'agissait notamment du prédiabète (46.8 %), de l'hypertension (37.1 %), de la dyslipidémie (35.9 %), de l'ostéoarthrose du genou ou de la hanche (13.3 %), de l'apnée obstructive du sommeil (11.7 %), de l'asthme/de la BPCO (11.5 %), des hépatites (NAFLD ou NASH) (7.3 %) et du SOPK (3.9 %).
Les patients ayant atteint la dose d'entretien de 2.4 mg à la semaine 20 (valeur de référence) et ayant continué à recevoir Wegovy pendant 48 semaines (semaines 20 à 68) ont continué à perdre du poids et obtenu une réduction supérieure et cliniquement significative de leur poids corporel par rapport à ceux qui étaient passés au placebo (cf. Tableau 7 et Figure 5). En revanche, chez les patients passés au placebo à la semaine 20 (valeur de référence), le poids corporel a de nouveau augmenté régulièrement entre les semaines 20 et 68. Néanmoins, le poids corporel observé à la semaine 68 est resté inférieur à celui observé au début de la phase de run-in (semaine 0) (cf. Figure 5). Les patients traités par Wegovy de la semaine 0 (initiation) à la semaine 68 (fin du traitement) ont obtenu une variation moyenne du poids corporel de 17.4 %, une perte de poids de ≥5 %, ≥10 % ≥15 % ou ≥20 % ayant été atteinte par 87.8 %, 78.0 %, 62.2 % et 38.6 % de ces patients, respectivement.
Tableau 7: résultats de la période randomisée de 48 semaines (semaine 20 à semaine 68) de l'étude comparant Wegovy à un placebo chez des patients souffrant d'obésité ou de surcharge pondérale et d'au moins une maladie associée liée au poids (STEP 4)
|
|
Wegovy
|
Placebo
| |
Full analysis set (N)
|
535
|
268
| |
Poids corporel
| |
Valeur initiale1 (kg)
|
96.5
|
95.4
| |
Variation (%) par rapport à la valeur initiale1,2,3
|
-7.9
|
6.9
| |
Différence (%) par rapport au placebo2
[IC à 95 %]
|
-14.8
[-16.0; -13.5]*
|
-
| |
Variation (kg) par rapport à la valeur initiale1
|
-7.1
|
6.1
| |
Différence (kg) par rapport au placebo2
[IC à 95 %]
|
-13.2
[-14.3; -12.0]
|
-
| |
Tour de taille (cm)
| |
Valeur initiale1
|
105.5
|
104.7
| |
Variation par rapport à la valeur initiale1,2
|
-6.4
|
3.3
| |
Différence par rapport au placebo2
[IC de 95 %]
|
-9.7
[-10.9; -8.5]*
|
-
| |
* p < 0.0001 (non corrigé des bilatéralement) pour la supériorité.
1 Valeur initiale = semaine 20.
2 Estimé à l'aide d'un modèle ANCOVA avec imputation multiple basé sur toutes les données, indépendamment de l'arrêt du traitement randomisé ou du début d'un autre traitement médicamenteux contre l'obésité ou de la chirurgie bariatrique.
3 Au cours de l'étude, le traitement randomisé a été interrompu par 5.8 % et 11.6 % des patients randomisés pour recevoir respectivement Wegovy et un placebo. En supposant que tous les patients randomisés aient continué le traitement et n'aient pas reçu de traitement complémentaire contre l'obésité, les variations estimées du poids corporel depuis la randomisation jusqu'à la semaine 68 sur la base d'un modèle mixte de mesures répétées incluant toutes les observations effectuées jusqu'au premier sevrage étaient de -8.8 % pour 2.4 mg de sémaglutide et de 6.5 % pour le placebo.
|
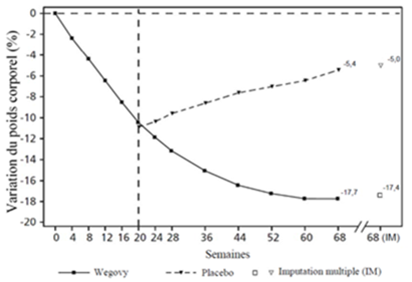
Valeurs observées pour les patients ayant effectué chaque visite prévue et estimations avec imputations multiples (MI) pour les abandons avec examen final («retrieved dropouts»).
Figure 5 STEP 4: Valeur moyenne du poids corporel (%) entre la semaine 0 et la semaine 68
STEP 5: Données sur 2 ans
Dans une étude en double aveugle de 104 semaines, 304 patients présentant une obésité (IMC ≥30 kg/m2) ou un surpoids (IMC ≥27 à moins de 30 kg/m2) et au moins une maladie concomitante liée au poids ont été randomisés pour recevoir du sémaglutide ou un placebo. Tous les patients ont reçu un régime hypocalorique avait une activité physique accrue pendant la durée de l'étude.
Au début de l'étude, les patients avaient un IMC moyen de 38.5 kg/m2 et un poids corporel moyen de 106.0 kg.
Le traitement par Wegovy pendant 104 semaines a entraîné une réduction du poids corporel supérieure et cliniquement pertinente par rapport au placebo (cf. Tableau 8 et Figure 6). Le poids corporel moyen a diminué sous Wegovy dès le début de l'étude et jusqu'à la semaine 68, puis a atteint un plateau. Le poids corporel moyen a diminué moins fortement diminué sous placebo et un plateau a été atteint après environ 20 semaines de traitement. Les patients traités par sémaglutide ont atteint une variation moyenne du poids corporel de -15.2 %, avec une perte de poids de 5 % chez 74.7 % des patients, de 10 % chez 59.2 % et de 15 % chez 49.7 %.
Tableau 8: Résultats d'une étude de 104 semaines comparant Wegovy à un placebo chez des patients présentant une obésité ou un surpoids et atteint d'au moins une maladie concomitante liée au poids (STEP 5)
|
|
Wegovy
|
Placebo
| |
Full analysis set (N)
|
152
|
152
| |
Poids corporel
| |
Valeur initiale1 (kg)
|
105.6
|
106.5
| |
Variation (%) par rapport à la valeur initiale1,2
|
-15.2
|
-2.6
| |
Différence (%) par rapport au placebo1
[IC à 95 %]
|
-12.6
[-15.3; -9.8]*
|
-
| |
Variation (kg) par rapport à la valeur initiale
|
-16.1
|
-3.2
| |
Différence (%) par rapport au placebo1
[IC à 95 %]
|
-12.9
[-16.1; -9.8]
|
-
| |
Patients (%) avec perte de poids ≥5 %3
|
74.7*
|
37.3
| |
Tour de taille (cm)
| |
Valeur initiale
|
115.8
|
115.7
| |
Variation (%) par rapport à la valeur initiale1
|
-14.4
|
-5.2
| |
Différence par rapport au placebo1
[IC à 95 %]
|
-9.2
[-12.2; -6.2]*
|
-
| |
* p < 0.0001 (non corrigé bilatéralement) pour la supériorité.
1 Estimé à l'aide d'un modèle ANCOVA avec imputation multiple basé sur toutes les données, indépendamment de l'arrêt du traitement randomisé ou du début d'un autre traitement médicamenteux contre l'obésité ou de la chirurgie bariatrique.
2 Au cours de l'étude, le traitement randomisé de 13.2 % et 27.0 % des patients randomisés sur sémaglutide ou placebo a été interrompu. En supposant que tous les patients randomisés aient continué le traitement et n'aient pas reçu de traitement complémentaire contre l'obésité, les variations estimées du poids corporel depuis la randomisation jusqu'à la semaine 68 sur la base d'un modèle mixte de mesures répétées incluant toutes les observations effectuées jusqu'au premier sevrage étaient de -16.7 % pour 2.4 mg de sémaglutide et de -0.6 % pour le placebo.
3 Estimé à l'aide d'un modèle de régression binaire basé sur la même procédure d'imputation que celle utilisée pour l'analyse primaire.
|
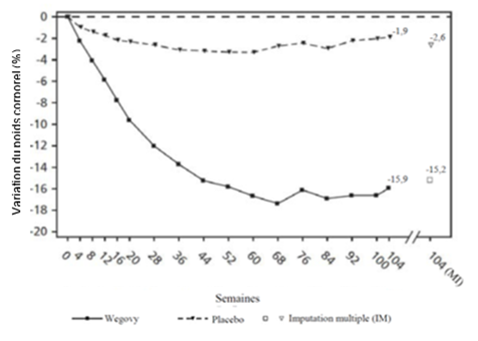
Valeurs observées pour les patients ayant effectué chaque visite planifiée et estimations avec imputations multiples (IM) pour les personnes ayant abandonné l'examen final (« retrieved dropouts »).
Figure 6 STEP 5 - Variation moyenne du poids corporel (%) entre la semaine 0 et la semaine 104
STEP 8: sémaglutide par rapport au liraglutide
Dans une étude de 68 semaines, randomisée, non aveugle, contrôlée par placebo, par paires, 338 patients présentant une obésité (IMC ≥30 kg/m2) ou un surpoids (IMC ≥27 à < 30 kg/m2) et au moins une maladie concomitante liée au poids ont été randomisés pour recevoir Wegovy une fois par semaine, du liraglutide 3 mg une fois par jour ou un placebo. Les groupes Wegovy une fois par semaine et liraglutide 3 mg n'étaient pas aveugles, mais chaque groupe de traitement actif était doublement aveugle par rapport au placebo administré à la même fréquence posologique. Tous les patients ont reçu un régime hypocalorique avec une activité physique accrue pendant la durée de l'étude.
Au début de l'étude, les patients avaient un IMC moyen de 37.5 kg/m2 et un poids corporel moyen de 104.5 kg.
Le poids corporel moyen a diminué sous Wegovy depuis le début de l'étude jusqu'à la semaine 68. Avec le liraglutide, la réduction du poids corporel moyen était plus faible (cf. Tableau 9). 37.4 % des patients traités par sémaglutide ont perdu 20 % de poids contre 7.0 % avec liraglutide.
Tableau 9: STEP 8: Résultats d'une étude de 68 semaines comparant le semaglutide et le liraglutide
|
|
Wegovy
|
Liraglutide 3 mg
| |
Full analysis set (N)
|
126
|
127
| |
Poids corporel
| |
Valeur initiale (kg)
|
102.5
|
103.7
| |
Variation (%) par rapport à la valeur initiale1,2,3
|
-15.8
|
-6.4
| |
Différence (%) par rapport au placebo1
[IC à 95 %]
|
-9.4
[-12.0;-6.8]*
|
-
| |
Variation (kg) par rapport à la valeur initiale
|
-15.3
|
-6.8
| |
Différence (%) par rapport au liraglutide1
[IC à 95 %]
|
-8.5
[-11.2;-5.7]
|
-
| |
* p < 0.005 (non corrigé bilatéralement) pour la supériorité.
1 Estimé à l'aide d'un modèle ANCOVA avec imputation multiple basé sur toutes les données, indépendamment de l'arrêt du traitement randomisé ou du début d'un autre traitement médicamenteux contre l'obésité ou de la chirurgie bariatrique.
2 Au cours de l'étude, le traitement randomisé de 13.5 % et 27.6 % des patients randomisés pour recevoir du sémaglutide ou du liraglutide a été interrompu. En supposant que tous les patients randomisés aient continué le traitement et n'aient pas reçu de traitement complémentaire contre l'obésité, les variations estimées du poids corporel depuis la randomisation jusqu'à la semaine 68 sur la base d'un modèle mixte de mesures répétées incluant toutes les observations effectuées jusqu'au premier sevrage étaient de -16.7 % pour le sémaglutide et de -6.7 % pour le liraglutide.
3 La variation (%) par rapport à la valeur initiale dans les groupes de placebo regroupés était de -1.9 %.
|
STEP 9: Gestion du poids chez les patients souffrant d'ostéoarthrose du genou – sémaglutide
Dans une étude en double aveugle de 68 semaines, 407 patients (âge moyen 56 ans) souffrant d'obésité et d'ostéoarthrose modérée du genou dans un ou les deux genoux ont été randomisés pour recevoir Wegovy (n=271) ou un placebo (n=136). Au début de l'étude, le poids corporel moyen était de 108.6 kg pour un IMC moyen de 40.3 kg/m². Conformément aux résultats d'études antérieures, une différence cliniquement significative de la perte de poids entre les groupes de traitement a été observée en faveur de Wegovy (différence par rapport au placebo [IC 95 %]: -10.5 % [-12.3, -8.6]). Parallèlement, l'indice Western Ontario and McMaster Universities Osteoarthritis 3.1 (WOMAC), une mesure de la douleur liée à l'ostéoarthrose du genou, s'est amélioré de manière significativement plus importante dans le groupe Wegovy que dans le groupe placebo (différence [IC 95 %]: -14.1 [-20.0, -8.3]), 59 % des patients du groupe Wegovy ayant obtenu une amélioration cliniquement significative, contre 35 % dans le groupe placebo.
Effet sur le taux de graisse corporelle
Une sous-étude de STEP 1 (n=140) a montré, à l'aide de l'absorptiométrie à double rayon X (DEXA), que le traitement par Wegovy entraînait une réduction plus importante de la masse graisseuse que de la masse maigre, ce qui correspond à une amélioration du pourcentage de graisse corporelle après 68 semaines par rapport au placebo. De plus, cette réduction de la masse grasse totale s'est accompagnée d'une réduction de la graisse viscérale.
Résultats cardiovasculaires
SELECT: Étude des résultats cardiovasculaires chez des patients en surpoids ou atteints d'obésité
SELECT était une étude randomisée, en double aveugle, contrôlée par placebo et basée sur des événements, incluant 17 604 patients ayant une maladie cardiovasculaire établie (67.6 % avec un infarctus du myocarde antérieur, 17.8 % avec un accident cérébral vasculaire antérieur et 4.4 % avec une maladie artérielle périphérique (PAD); 8.2 % avec 2 événements cardiovasculaires antérieurs ou plus) et un IMC ≥27 kg/m2. Les patients ayant des antécédents de diabète de type 1 et de type 2 ont été exclus. La durée moyenne de séjour dans l'étude était de 41.8 mois. La population étudiée était composée de 27.7 % de femmes et 72.3 % d'hommes, avec une moyenne d'âge de 61.6 ans, dont 38.2 % de patients ≥65 ans (n=6728) et 7.8 % de patients ≥75 ans (n=1366). L'IMC moyen était de 33.3 kg/m2 et le poids corporel moyen était de 96.7 kg.
Les patients ont été randomisés et ont reçu soit du sémaglutide à une dose maximale à atteindre de 2.4 mg par semaine (n=8803), soit du placebo (n=8801) en complément d'un traitement standard pour la maladie cardiovasculaire antérieure. Au début de l'étude, 92.0 % des patients recevaient des médicaments cardiovasculaires (70.2 % des bêtabloquants, 45.0 % des inhibiteurs de l'enzyme de conversion de l'angiotensine (ECA), 29.5 % des inhibiteurs du récepteur de l'angiotensine et 26.9 % des inhibiteurs du canal calcique), 90.1 % de hypolipidémiants (essentiellement des statines 87.6 %), et 86.2 % de médicaments antiplaquettaires.
La plupart des patients présentaient initialement une maladie cardiovasculaire concomitante, dont 66.4 % avec HbA1c ≥5.7 % et < 6.5 % comme indice de prédiabète, 24.3 % avec insuffisance cardiaque chronique, 81.8 % avec hypertension, 46.8 % avec inflammation (hsCRP ≥2 mg/L) et des patients ayant une insuffisance rénale légère (48.7 %), modérée (10.4 %) ou sévère (0.4 %).
Le critère d'évaluation principal était la période entre la randomisation et la première apparition d'événements cardiovasculaires graves (MACE), définie comme un critère composite de décès cardiovasculaire, d'infarctus du myocarde non fatal ou d'accident vasculaire cérébral non mortel. La supériorité de sémaglutide 2.4 mg sur le placebo a été confirmée avec un Hazard Ratio de 0.80 [0.72; 0.90] [IC à 95 %], ce qui correspond à une réduction relative du risque de 20 % (cf. Figures 7 et 8). Les trois composantes ont contribué à la réduction de MACE (Tableau 10). La réduction du risque cardiovasculaire est apparue largement indépendante de la perte de poids.
L'effet du traitement sur la réduction des risques de MACE était comparable dans les sous-groupes principaux définis par âge, sexe, race, origine ethnique, type de maladie cardiovasculaire antérieure, IMC, normoglycémie/prédiabète et fonction rénale.
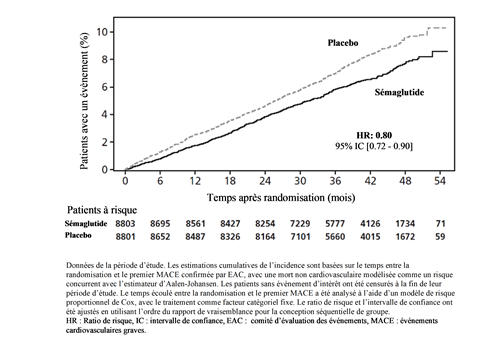
Figure 7 Représentation cumulative de la fonction d'incidence: temps entre la randomisation et le premier MACE
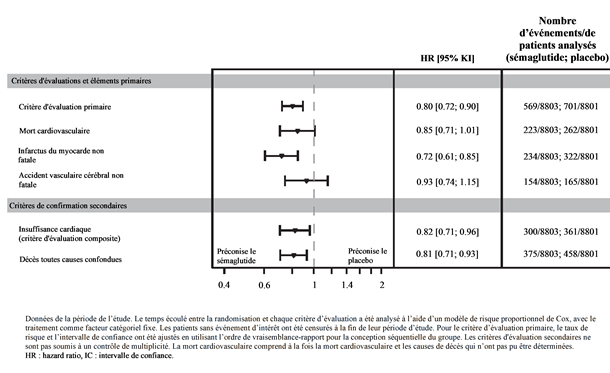
Figure 8 Forest Plot de temps depuis la randomisation jusqu'au premier MACE, composants MACE et critères d'évaluation secondaires
Tableau 10: Temps écoulé entre la randomisation et le premier MACE et ses composants, critère d'évaluation secondaire, mort cardiovasculaire.
|
|
HR [IC de 95 %]
|
Valeur p
(bilatérale)
|
Nombre d'événements/ Patients analysés (Séma 2.4 mg)
|
Nombre d'événements/ Patients analysés (Placebo)
| |
Critère composite primaire d'évaluation (MACE)
|
0.80 [0.72; 0.90]
|
<0.0001
|
569/8803
|
701/8801
| |
Mort cardiovasculaire
|
0.85 [0.71; 1.01]
|
0.0653
|
223/8803
|
262/8801
| |
Infarctus du myocarde non fatal
|
0.72 [0.61; 0.85]
|
|
234/8803
|
322/8801
| |
Accident vasculaire cérébral non fatal
|
0.93 [0.74; 1.15]
|
|
154/8803
|
165/8801
| |
Critères d'évaluation secondaires
| |
Mort cardiovasculaire1
|
0.85 [0.71; 1.01]
|
0.0653
|
223/8803
|
262/8801
| |
Insuffisance cardiaque (critère composite)1
|
0.82 [0.71; 0.96]
|
|
300/8803
|
361/8801
| |
Décès toutes causes confondues1
|
0.81 [0.71; 0.93]
|
|
375/8803
|
458/8801
| |
Sous-groupes:
| |
Maladie cardiovasculaire
| |
Maladie cardiovasculaire: infarctus du myocarde uniquement
|
0.78 [0.68; 0.90]
|
0.4803
|
362/5962
|
455/5944
| |
Maladie cardiovasculaire: accident vasculaire cérébral uniquement
|
0.98 [0.75; 1.27]
|
|
109/578
|
109/1556
| |
Maladie cardiovasculaire: PAD uniquement
|
0.74 [0.36; 1.48]
|
|
13/376
|
19/401
| |
Maladie cardiovasculaire: 2 maladies cardiovasculaires ou plus
|
0.75 [0.55; 1.00]
|
|
76/718
|
100/719
| |
Sexe
| |
Sexe féminin
|
0.84 [0.66; 1.07]
|
0.6324
|
126/2448
|
147/2424
| |
Sexe masculin
|
0.79 [0.70; 0.90]
|
|
443/6355
|
554/6377
|
Remarque: le temps écoulé entre la randomisation et chaque critère a été analysé à l'aide d'un modèle de risque proportionnel de Cox, avec le traitement comme facteur catégoriel fixe. Les sujets sans événement d'intérêt ont été censurés à la fin de leur période d'étude. Pour le critère d'évaluation primaire, l'HR, l'intervalle de confiance et la valeur p ont été ajustés en utilisant l'ordre de vraisemblance-ratio pour les conceptions de séquençage de groupe. Les analyses de sous-groupes pour le critère d'évaluation primaire ont été analysées dans un modèle de risque proportionnel de Cox avec une interaction entre le groupe traité et le sous-groupe pertinent comme facteur fixe. La mort cardiovasculaire comprend à la fois la mort cardiovasculaire et les causes de décès qui n'ont pas pu être déterminées.
1Critère d'évaluation secondaire. Non statistiquement significatif selon la hiérarchie des tests prédéfinie.
HR: Ratio de risque, IC: intervalle de confiance, valeur p: valeur p bilatérale pour le test sans différence. Pour les analyses de sous-groupes, la valeur p fait référence au test d'absence d'effet d'interaction. MACE: événements cardiovasculaires graves.
Tableau 11: SELECT – Évaluation des facteurs de risque cardiovasculaire à la semaine 104
|
|
Sémaglutide
|
Placebo
| |
Full analysis set (N)
|
8803
|
8801
| |
Facteurs cardiométaboliques:
| |
Pression artérielle systolique (mmHg)
| |
Valeur initiale
moyenne (SD)
|
131.0 (15.6)
|
130.9 (15.3)
| |
Variation par rapport à la valeur initiale1
|
-3.82
|
-0.51
| |
Différence par rapport au placebo [IC à 95 %]1
|
-3.1 [-3.75; -2.88]
|
-
| |
Pression artérielle diastolique (mmHg)
| |
Valeur initiale
moyenne (SD)
|
79.4 (10.0)
|
79.2 (9.9)
| |
Variation par rapport à la valeur initiale1
|
-1.02
|
-0.47
| |
Différence par rapport au placebo [IC à 95 %]1
|
-0.55 [-0.83; -0.27]
|
-
| |
Fréquence cardiaque
| |
Valeur initiale
moyenne (SD)
|
68.9 (10.6)
|
68.6 (10.7)
| |
Variation par rapport à la valeur initiale1
|
3.79
|
0.69
| |
Différence par rapport au placebo [IC à 95 %]1
|
3.10 [2.80; 3.39]
|
-
| |
Lipides:
| |
Total Cholestérol
| |
Valeur initiale (mmol/L)
Moyenne géométrique (CV)
|
4.03 (25.82)
|
4.04 (25.41)
| |
Variation (%) par rapport à la valeur initiale1
|
-4.63
|
-1.92
| |
Différence relative (%) par rapport au placebo1
|
-2.77 [-3.37; -2.16]
|
-
| |
LDL Cholestérol
| |
Valeur initiale (mmol/L)
Moyenne géométrique (CV)
|
2.03 (43.70)
|
2.03 (43.56)
| |
Variation (%) par rapport à la valeur initiale1
|
-5.25
|
-3.14
| |
Différence relative (%) par rapport au placebo [IC à 95 %]1
|
-2.18 [-3.22; -1.12]
|
-
| |
HDL Cholestérol
| |
Valeur initiale (mmol/L)
Moyenne géométrique (CV)
|
1.14 (25.52)
|
1.15 (25.02)
| |
Variation (%) par rapport à la valeur initiale1
|
4.86
|
0.59
| |
Différence relative (%) par rapport au placebo [IC à 95 %]1
|
4.24 [3.70; 4.79]
|
-
| |
Triglycérides
| |
Valeur initiale (mmol/L)
Moyenne géométrique (CV)
|
1.56 (51.75)
|
1.57 (50.84)
| |
Variation (%) par rapport à la valeur initiale1
|
-18.34
|
-3.20
| |
Différence relative (%) par rapport au placebo [IC à 95 %]1
|
-15.64 [-16.7; -14.6]
|
-
| |
Facteurs de risque cardiovasculaires liés au poids:
| |
Poids corporel (%)
| |
Valeur initiale
moyenne (SD) (kg)
|
96.53 (17.52)
|
96.82 (17.80)
| |
Variation par rapport à la valeur initiale1
|
-9.39
|
-0.88
| |
Différence (%) par rapport au placebo [IC à 95 %]1
|
-8.51 [-8.75; -8.27]
|
-
|
1Les réponses ont été analysées à l'aide d'une ANCOVA, le traitement étant considéré comme un facteur fixe et la valeur initiale comme une covariable. Avant l'analyse, les données manquantes ont été imputées à plusieurs reprises. Le modèle d'imputation (régression linéaire) a été réalisé séparément pour chaque groupe de traitement et comprenait la valeur initiale sous forme de covariables ainsi que tous les participants ayant des mesures, quel que soit leur statut de traitement à la semaine 104. Le modèle ajusté a été utilisé pour imputer les valeurs des participants sans mesures à la semaine 104. Les estimations moyennes ont été ajustées en fonction de la distribution initiale observée.
STEP TEENS: Régulation du poids chez les patients adolescents
Dans une étude en double aveugle de 68 semaines, 201 adolescents âgés de 12 à 18 ans révolus et présentant une obésité (n=200) ou une surcharge pondérale et présentant au moins une comorbidité liée au poids (n=1) ont été randomisés 2:1 sur sémaglutide ou placebo pendant la puberté. Tous les patients ont reçu un régime hypocalorique et avaient une activité physique accrue pendant la durée de l'étude.
À la fin du traitement (semaine 68), l'amélioration de l'IMC était supérieure avec le sémaglutide et cliniquement significative par rapport au placebo (cf. Tableau 12 et Figure 9). Une plus grande proportion de patients a par ailleurs perdu 5 %, 10 % et 15 % de son poids en prenant du sémaglutide par rapport au placebo (cf. Tableau 12).
Tableau 12: STEP TEENS: Résultats à la semaine 68
|
|
Wegovy
|
Placebo
| |
Full analysis set (N)
|
134
|
67
| |
IMC
| |
Valeur initiale (IMC)
|
37.7
|
35.7
| |
Variation (%) par rapport à la valeur initiale de l'IMC1, 3
|
-16.1
|
0.6
| |
Différence (%) par rapport au placebo1 [IC à 95 %]
|
-16.7 [-20.3; -13.2]*
|
-
| |
Valeur initiale (IMC SDS)
|
3.4
|
3.1
| |
Modification de la valeur initiale en IMC SDS1
|
-1.1
|
-0.1
| |
Différence avec le placebo1 [IC à 95 %]
|
-1.0 [-1.3; -0.8]
|
-
| |
Poids corporel
| |
Valeur initiale (kg)
|
109.9
|
102.6
| |
Variation (%) par rapport à la valeur initiale1
|
-14.7
|
2.8
| |
Différence (%) par rapport au placebo1 [IC à 95 %]
|
-17.4 [-21.1; -13.8]
|
-
| |
Variation (kg) par rapport à la valeur initiale1
|
-15.3
|
2.4
| |
Différence (kg) par rapport au placebo1 [IC à 95 %]
|
-17.7 [-21.8; -13.7]
|
-
| |
Patients (%) avec une perte de masse corporelle ≥5 %4
|
72.5*
|
17.7
| |
Patients (%) avec une perte de masse corporelle ≥10 %4
|
61.8
|
8.1
| |
Patients (%) avec une perte de masse corporelle ≥15 %4
|
53.4
|
4.8
| |
Patients (%) avec une perte de masse corporelle ≥20 %4
|
37.4
|
3.2
| |
Tour de taille (cm)
| |
Valeur initiale
|
111.9
|
107.3
| |
Variation (%) par rapport à la valeur initiale1
|
-12.7
|
-0.6
| |
Différence avec le placebo1 [IC à 95 %]
|
-12.1 [-15.6; -8.7]
|
-
|
* p < 0.005 (non corrigé bilatéralement) pour la supériorité.
1 Estimé à l'aide d'un modèle ANCOVA avec imputation multiple basé sur toutes les données, indépendamment de l'arrêt du traitement randomisé ou du début d'un autre traitement médicamenteux contre l'obésité ou de la chirurgie bariatrique.
2 Les chiffres se réfèrent aux patients ne souffrant pas de diabète de type 2.
3 Au cours de l'étude, le traitement randomisé a été interrompu de manière permanente par 10.4 % des patients ayant reçu 2.4 mg de sémaglutide et 10.4 % de patients randomisés sur placebo. En supposant que tous les patients randomisés ont continué le traitement et n'ont pas reçu de traitement supplémentaire de l'obésité, les modifications de l'IMC depuis la randomisation jusqu'à la semaine 68 étaient de -17.9 % pour 2.4 mg de sémaglutide et -0.6 % pour le placebo, sur la base d'un modèle mixte de mesures répétées, incluant toutes les observations jusqu'au premier arrêt.
4 Estimation à l'aide d'un modèle de régression logistique basé sur la même méthode d'imputation que dans l'analyse primaire.
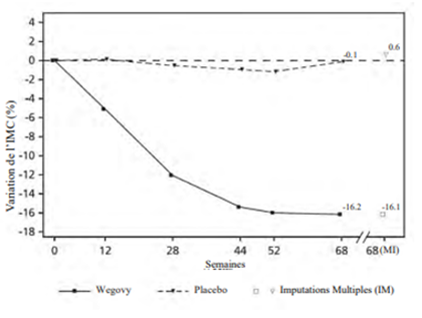
Valeurs observées pour les patients ayant effectué chaque visite planifiée et estimations avec imputations multiples (IM) pour les personnes ayant abandonné l'examen final
Figure 9 STEP TEENS: Variation moyenne de l'IMC (%) de la valeur initiale à la semaine 68
|










