Propriétés/EffetsCode ATC
A16AX18
Mécanisme d’action
Le lumasiran est un petit acide ribonucléique interférent (pARNi) double brin qui réduit les niveaux de l’enzyme glycolate oxydase (GO) en ciblant l’acide ribonucléique messager (ARNm) du gène de l’hydroxyacide oxydase 1 (HAO1) dans les hépatocytes par interférence ARN. La diminution des taux de l’enzyme GO réduit la quantité de glyoxylate disponible, un substrat pour la production d’oxalate. Cela entraîne une réduction des taux (élevés) d’oxalate urinaires et plasmatiques, la cause sous-jacente des manifestations de la maladie chez les patients atteints de HP1. L’enzyme GO étant en amont de l’enzyme déficiente alanine glyoxylate aminotransférase (AGT) à l’origine de la HP1, le mécanisme d’action du lumasiran est indépendant de la mutation du gène AGXT sous-jacente.
Pharmacodynamique
Sans objet.
Efficacité clinique
L’efficacité du lumasiran a été étudiée dans une étude clinique randomisée, contrôlée contre placebo, menée en double aveugle chez des patients de 6 ans et plus atteints de HP1 (ILLUMINATE-A), dans une étude clinique à bras unique chez des patients de moins de 6 ans atteints de HP1 (ILLUMINATE-B) et dans une étude clinique à bras unique chez des patients pédiatriques et adultes atteints de HP1 présentant une maladie rénale de stade avancé, y compris des patients sous hémodialyse (ILLUMINATE-C).
ILLUMINATE-A
En tout, 39 patients atteints de HP1 ont été randomisés selon un rapport 2:1 pour recevoir des doses sous-cutanées de lumasiran ou de placebo pendant la période contrôlée contre placebo en double aveugle de 6 mois. Des patients de 6 ans et plus avec un débit de filtration glomérulaire estimé (DFGe) ³ 30 ml/min/1,73 m2 ont été inclus et ont reçu 3 doses d’attaque de 3 mg/kg de lumasiran ou de placebo administrées une fois par mois, suivies de doses d’entretien trimestrielles de 3 mg/kg de lumasiran ou de placebo (voir «Posologie/Mode d’emploi»). Après la période de traitement en double aveugle de 6 mois, les patients, y compris ceux initialement affectés au groupe placebo, sont entrés dans une période d’extension avec l’administration de lumasiran pendant une durée allant jusqu’à 54 mois. L’exposition totale au lumasiran était de 165,7 patientannées.
Pendant la période contrôlée contre placebo en double aveugle de 6 mois, 26 patients ont reçu le lumasiran et 13 le placebo. L’âge médian des patients à la première dose était de 14,9 ans (6,1 à 61,0 ans); 66,7% étaient de sexe masculin et 76,9% étaient d’origine caucasienne. L’excrétion urinaire médiane sur 24 heures de l’oxalate corrigée en fonction de la surface corporelle (SC) à l’inclusion était de 1,72 mmol/24 h/1,73 m2, le ratio médian oxalate urinaire/créatinine urinaire à l’inclusion était de 0,21 mmol/mmol et le niveau médian d’oxalate plasmatique à l’inclusion était de 13,1 µmol/l. Dans l’ensemble, 33,3% des patients avaient une fonction rénale normale (DFGe ³ 90 ml/min/1,73 m2), 48,7% présentaient une insuffisance rénale légère (DFGe de 60 à < 90 ml/min/1,73 m2) et 18% présentaient une insuffisance rénale modérée (DFGe de 30 à < 60 ml/min/1,73 m2). Parmi les patients inclus dans l’étude, 84,6% ont rapporté des antécédents de calculs rénaux symptomatiques et 53,8% ont rapporté des antécédents de néphrocalcinose à l’inclusion. Les bras de traitement étaient équilibrés à l’inclusion en termes d’âge, de niveau d’oxalate urinaire et de DFGe.
Le critère d’évaluation principal était le pourcentage de réduction par rapport à l’inclusion de l’excrétion urinaire d’oxalate sur 24 heures corrigée en fonction de la SC et moyennée sur les mois 3 à 6. Le lumasiran était associé à une réduction statistiquement significative de 65,4% de l’oxalate urinaire sur 24 heures corrigé en fonction de la SC, contre 11,8% dans le groupe placebo, ce qui correspond à une différence de 53,5% (IC à 95%: 44,8 – 62,3; p < 0,0001). Conformément au critère d’évaluation principal, une réduction de 60,5% du ratio oxalate urinaire/créatinine urinaire a été observée à 6 mois dans le bras lumasiran, contre une augmentation de 8,5% dans le bras placebo. En outre, les patients traités par lumasiran présentaient une réduction rapide et durable de l’oxalate urinaire sur 24 heures corrigé en fonction de la SC, comme indiqué dans la figure 1.
Figure 1: ILLUMINATE-A: variation relative par rapport à l’inclusion de l’oxalate urinaire sur 24 heures corrigé en fonction de la SC par mois (période en double aveugle contrôlée contre placebo de 6 mois)
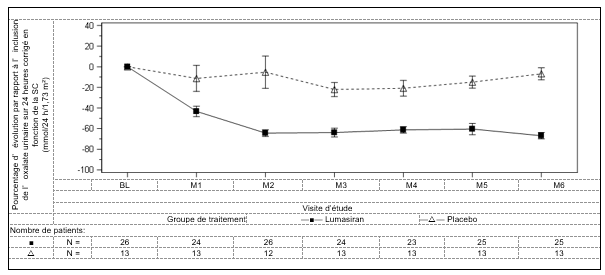
Abréviations: BL = inclusion (baseline); M = mois; ESM = erreur standard de la moyenne.
Les résultats sont représentés sous forme de moyenne (± ESM) de la variation relative par rapport à l’inclusion.
À 6 mois, une proportion plus élevée de patients traités par lumasiran présentait des niveaux normaux ou quasi normaux d’oxalate urinaire sur 24 heures corrigés en fonction de la SC (£ 1,5 × LSN) par rapport aux patients sous placebo, comme indiqué dans le tableau 3.
Tableau 3: ILLUMINATE-A: résultats des critères d’évaluation secondaires sur la période contrôlée de 6 mois, contre placebo, menée en double aveugle
|
Critères d
’évaluation
|
Lumasiran
(N = 26)
|
Placebo
(N = 13)
|
Différence thérapeutique
(IC à 95%)
|
Valeur de p
| |
Proportion de patients avec des niveaux d’oxalate urinaire sur 24 heures ≤ LSN‡
|
0,52 (0,31; 0,71)§
|
0 (0; 0,25)§
|
0,52 (0,23; 0,70)¶
|
0,001#
| |
Proportion de patients avec des niveaux d’oxalate urinaire sur 24 heures ≤ 1,5 × LSN‡
|
0,84 (0,64; 0,95)§
|
0 (0; 0,25)§
|
0,84 (0,55; 0,94)¶
|
0,0001#
| |
Pourcentage de réduction de l’oxalate plasmatique par rapport à l’inclusion*Þ
|
39,8 (2,9)†
|
0,3 (4,3)†
|
39,5 (28,9; 50,1)
|
< 0,0001
|
Abréviations: LSN = limite supérieure de la normale (Upper Limit of Normal), ESM = erreur standard de la moyenne
Les résultats se basent sur le dosage par chromatographie liquide couplée à la spectrométrie de masse en tandem (LC-MS/MS).
* Estimation basée sur la moyenne de la moyenne des moindres carrés du pourcentage de réduction à 3, 4, 5 et 6 mois à l’aide d’un modèle mixte pour mesures répétées.
† Moyenne des MC (ETM).
‡ LSN = 0,514 mmol/24 h/1,73 m² pour l’oxalate urinaire sur 24 heures corrigé en fonction de la SC.
§ IC à 95 % basé sur l’intervalle de confiance de Clopper Pearson Exact.
¶ Calculé à l’aide de la méthode de Newcombe basée sur le score Wilson.
# La valeur de p repose sur le test de Cochran–Mantel–Haenszel stratifié selon l’oxalate urinaire sur 24 heures corrigé en fonction de la SC (£ 1,70 vs > 1,70 mmol/24 h/1,73 m2).
Þ Analysé chez 23 patients sous lumasiran et 10 patients sous placebo qui présentaient des niveaux initiaux permettant une réduction.
La réduction de l’oxalate urinaire sur 24 heures corrigé en fonction de la SC par rapport à l’inclusion chez les patients atteints de HP1 sous lumasiran et sous placebo était comparable dans tous les sous-groupes pré-spécifiés, notamment pour l’âge, le sexe, la race, l’insuffisance rénale, la prise de pyridoxine (vitamine B6) à l’inclusion et les antécédents de calculs rénaux symptomatiques (figure 2).
Figure 2: ILLUMINATE-A: variation relative par rapport à l’inclusion de l’oxalate urinaire sur 24 heures corrigé en fonction de la SC, analyse de sous-groupe
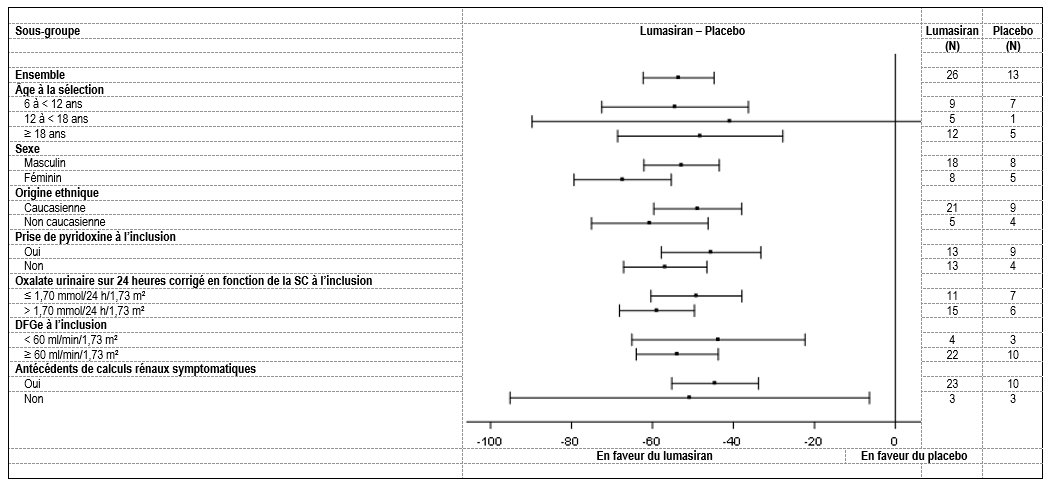
Les niveaux réduits d’oxalate observés pendant la période en double aveugle ont été maintenues avec la poursuite du traitement par lumasiran pendant une durée allant jusqu’à 60 mois dans la période d’extension de l’étude. Le DFGe, les événements de calculs rénaux (rapportés en événements par personne-année) et la néphrocalcinose médullaire ont été évalués au cours des périodes en double aveugle de 6 mois et d’extension pendant un total allant jusqu’à 60 mois.
Le DFGe est resté stable chez les patients sous lumasiran. La variation annuelle moyenne au cours du traitement par lumasiran pendant une durée allant jusqu’à 60 mois par rapport à la valeur initiale était de 0,63 ml/min/1,73 m² par an.
Les taux d’événements de calculs rénaux par personne-année rapportés chez les patients randomisés pour recevoir le lumasiran ou le placebo dans l’étude ILLUMINATE-A sont présentés dans le Tableau 4.
Tableau 4 : taux d’événements de calculs rénaux par personne-année rapportés dans les groupes lumasiran et placebo
|
Période
|
Lumasiran
Taux (IC à 95 %)
|
Placebo
Taux (IC à 95 %)
| |
1 Période de 12 mois précédant le consentement
|
3,19 (2,57 – 3,96)
|
0,54 (0,26 – 1,13)
| |
Période de 6 mois en double aveugles
|
1,09 (0,63 – 1,88)
|
0,66 (0,25 – 1,76)
|
Pendant le traitement par lumasiran pendant une durée allant jusqu’à 60 mois dans la période d’extension en ouvert, le taux d’événements de calculs rénaux était de 0,49 par personneannée et 53,8 % des patients n’ont pas présenté d’événements de calculs rénaux.
Les résultats de la néphrocalcinose médullaire, évalués par échographie rénale, au mois 6 par rapport à l’inclusion sont présentés dans le Tableau 5.
Tableau 5 : ILLUMINATE-A : patients atteints de néphrocalcinose médullaire au mois 6 de la période en double aveugle contrôlée contre placebo par rapport à l’inclusion*
|
Échéance
|
Traitement
(n)
|
Amélioration
|
Aucun changement
|
Aggravation
| |
Mois 6
|
Lumasiran
(n = 22)
|
3
|
19
|
0
| |
Placebo
(n = 12)
|
0
|
11
|
1
|
* Les patients ayant subi des échographies rénales à l’inclusion et à l’échéance pertinente ont été évalués.
La néphrocalcinose médullaire n’a été évaluée que chez une partie de la population de l’étude (évaluée chez 17 des 26 patients sous lumasiran/lumasiran et 6 des 13 patients sous placebo/lumasiran à l’inclusion et à la fin de la période d’extension de 54 mois). Dans ce sousgroupe, une tendance générale à une amélioration au cours du temps a été démontrée.
ILLUMINATE-B
En tout, 18 patients ont été inclus et traités avec du lumasiran dans une étude multicentrique en cours à bras unique menée chez des patients atteints de HP1 (ILLUMINATE-B). L’étude incluait des patients de moins de 6 ans avec un DFGe > 45 ml/min/1,73 m2 pour les patients de 12 mois et plus, et une créatininémie normale chez les patients de moins de 12 mois. Dans l’analyse intermédiaire primaire sur 6 mois, à la première dose, 3 patients pesaient moins de 10 kg, 12 pesaient entre 10 kg et moins de 20 kg et 3 pesaient 20 kg ou plus. L’âge médian des patients à la première dose était de 51,4 mois (4,0 à 74,0 mois); 55,6% étaient de sexe féminin et 88,9% étaient d’origine caucasienne. Le ratio oxalate urinaire/créatinine urinaire à l’inclusion était de 0,47 mmol/mmol.
À 6 mois, les patients traités par lumasiran avaient obtenu une réduction de 72,0% (IC à 95%: 66,4 – 77,5) du ratio oxalate urinaire/créatinine urinaire par rapport à l’inclusion (pondéré de 3 mois à 6 mois), le critère d’évaluation principal de l’étude. Le lumasiran était associé à des réductions rapides et durables du ratio oxalate urinaire/créatinine urinaire (figure 4), qui étaient similaires dans tous les groupes de poids. Le pourcentage de réduction de l’excrétion urinaire d’oxalate s’est maintenu avec la poursuite du lumasiran jusqu’au mois 12 et était cohérent avec les données d’ILLUMINATE-A.
Figure 3: ILLUMINATE-B: variation relative par rapport à l’inclusion du ratio oxalate/créatinine urinaire par mois
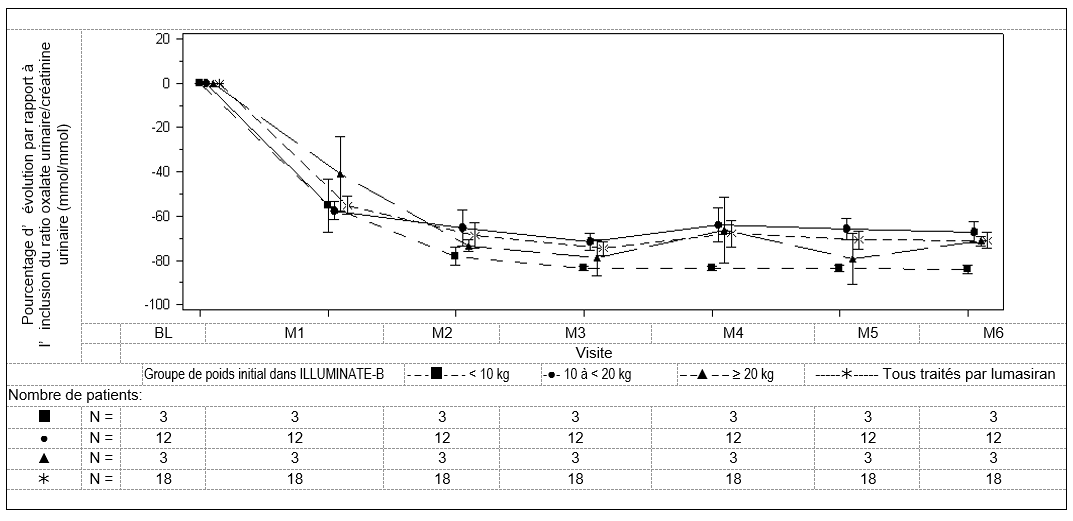
À 6 mois, neuf patients sur 18 ont obtenu une quasi normalisation (≤ 1,5 × LSN), dont 1 patient ayant obtenu une normalisation (≤ LSN) du ratio oxalate urinaire/créatinine urinaire. À 12 mois, dix patients sur 18 ont obtenu une quasi-normalisation (≤ 1,5 × LSN), dont 2 patients ayant obtenu une normalisation (≤ LSN) du ratio oxalate urinaire/créatinine urinaire.
En outre, entre l’inclusion et le mois 6 (moyenne de 3 mois à 6 mois), une réduction moyenne de l’oxalate plasmatique de 31,7% (IC à 95% : 23,9 – 39,5) a été observée. Les niveaux réduits d’oxalate plasmatique observés au cours de la période d’analyse primaire ont été maintenus avec la poursuite du traitement par lumasiran. Le DFGe est resté stable chez tous les patients poursuivant le traitement.
Le taux d’événements de calculs rénaux par personne-année rapporté au cours de la période de 12 mois précédant le consentement et au cours de la période d’analyse primaire de 6 mois était respectivement de 0,24 (IC à 95 % : 0,09 – 0,63) et 0,24 (IC à 95 % : 0,06 – 0,96). Le taux d’événements entre le mois 6 et le mois 12 était de 0,12 (IC à 95 % : 0,02 – 0,84).
Les résultats de la néphrocalcinose médullaire, évalués par échographie rénale, au mois 6 et au mois 12 par rapport à l’inclusion sont présentés dans le Tableau 6.
Tableau 6 : ILLUMINATE-B : patients atteints de néphrocalcinose médullaire au mois 6 et au mois 12 par rapport à l’inclusion*
|
Échéance
|
Amélioration (n)
|
Aucun changement
|
Aggravation
| |
Mois 6
(n = 18)
|
8
|
10
|
0
| |
Mois 12
(n = 17)
|
11
|
6
|
0
|
* Les patients ayant subi une échographie rénale à l’inclusion et à l’échéance pertinente ont été évalués.
ILLUMINATE-C
Au total, 21 patients ont été recrutés et traités par lumasiran dans le cadre d’une étude multicentrique à un seul bras en cours chez des patients atteints de HP1 et d’une maladie rénale de stade avancé (DFGe ≤ 45 ml/min/1,73 m2 chez les patients âgés de 12 mois et plus et créatinine sérique élevée chez les patients âgés de moins de 12 mois), y compris des patients sous hémodialyse. ILLUMINATE-C comprend 2 cohortes : la cohorte A est constituée de 6 patients qui ne nécessitaient pas de dialyse au moment de l’inclusion dans l’étude et la cohorte B est constituée de 15 patients qui étaient sous schéma d’hémodialyse stable. Les patients ont reçu le schéma posologique recommandé de lumasiran en fonction du poids corporel (voir rubrique 4.2).
L’âge médian des patients à la première dose était de 8,9 ans (intervalle de 0 à 59 ans), 57,1 % étaient de sexe masculin et 76,2 % étaient d’origine caucasienne. Pour les patients de la Ccohorte A, le taux médian d’oxalate plasmatique était de 57,94 µmol/L. Pour les patients de la cohorte B, le taux médian d’oxalate plasmatique était de 103,65 µmol/L.
Le critère d’évaluation principal de l’étude était le pourcentage d’évolution du taux d’oxalate plasmatique entre l’inclusion et le mois 6 (moyenne du mois 3 au mois 6) pour la cohorte A (N = 6) et le pourcentage d’évolution du taux d’oxalate plasmatique avant dialyse entre l’inclusion et le mois 6 (moyenne du mois 3 au mois 6) pour la cohorte B (N = 15).
Au cours de la période d’analyse primaire de 6 mois, les patients des deux cohortes ont vu leur taux d’oxalate plasmatique diminuer dès le premier mois. Le pourcentage d’évolution du taux d’oxalate plasmatique entre l’inclusion et le mois 6 (moyenne du mois 3 au mois 6) pour la cohorte A était une différence moyenne des moindres carrés de -33,3 % (IC à 95 % : -81,82 – 15,16) et pour la cohorte B, la différence moyenne des moindres carrés était de -42,4 % (IC à 95 % : -50,71 – -34,15).
Figure 4 : ILLUMINATE-C : variation relative par rapport à l’inclusion de l’oxalate plasmatique (µmol/L) lors de chaque visite pendant la période d’analyse principale
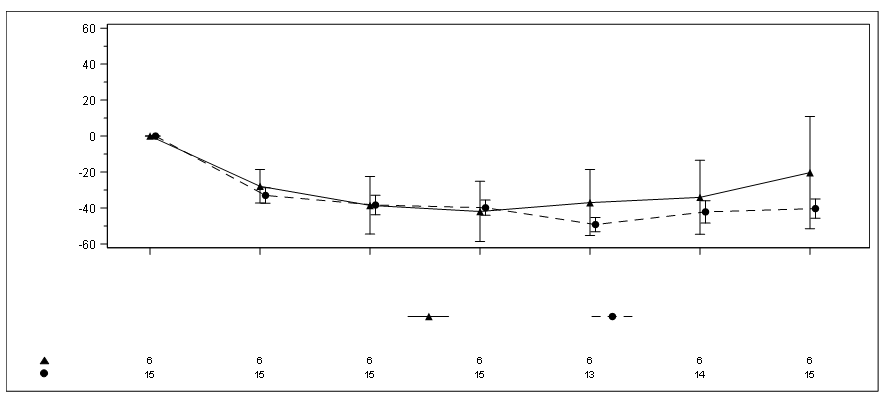
Les résultats sont représentés sous forme de moyenne (± ESM) de la variation relative par rapport à l’inclusion.
Abréviations : BL = inclusion ; M = mois ; ESM = erreur standard de la moyenne.
Pour la cohorte A, l’inclusion est définie comme la moyenne de tous les échantillons d’oxalate plasmatique prélevés avant la première dose de lumasiran ; pour la cohorte B, l’inclusion est définie comme les quatre derniers échantillons d’oxalate plasmatique prédialyse prélevés avant la première dose de lumasiran. Dans la cohorte B, seuls les échantillons prédialyse sont utilisés.
Dans la cohorte A, le DFGe moyen (ET) était de 19,85 (9,6) mL/min/1,73 m2 à l’inclusion et de 16,43 (9,8) mL/min/1,73 m2 au mois 6.
Le taux d’événements de calculs rénaux par personne-année rapporté pendant la période de 12 mois précédant le consentement pour la cohorte A et pendant la période d’analyse primaire de 6 mois était respectivement de 3,20 (IC à 95 % : 1,96 – 5,22) et 1,48 (IC à 95 % : 0,55 – 3,92).
Pédiatrie
Swissmedic a accordé une exemption pour ce médicament de l’obligation de présenter les résultats d’études dans toutes les tranches d’âge pédiatriques pour le traitement de la PHA.
|




