CompositionPrincipes actifs
Sécukinumab*.
*fabriqué à partir de cellules CHO (Chinese Hamster Ovary) génétiquement modifiées
Excipients
Poudre pour solution injectable
Saccharose, L-histidine, chlorhydrate de L-histidine monohydraté, polysorbate 80, pro vitro.
Solution injectable dans une seringue ou un stylo prérempli(e)
Tréhalose dihydraté, L-histidine/chlorhydrate de L-histidine monohydraté, Lméthionine, polysorbate 80, eau pour préparations injectables q.s. ad solutionem par 1 ml ou 2 ml.
Indications/Possibilités d’emploiPsoriasis en plaques
Cosentyx/- SensoReady/- UnoReady est indiqué dans le traitement du psoriasis en plaques modéré à sévère chez les patients adultes et pédiatriques à partir de 6 ans qui n'ont pas répondu aux autres traitements systémiques (y compris le traitement par ciclosporine ou par méthotrexate, ainsi que la puvathérapie) ou qui ne peuvent pas les suivre en raison de contre-indications ou d'intolérance.
Arthrite psoriasique
Cosentyx/- SensoReady/- UnoReady, seul ou en association avec le méthotrexate, est indiqué dans le traitement de patients adultes atteints d'arthrite psoriasique active qui ont répondu insuffisamment à un traitement précédent par des antirhumatismaux modificateurs de la maladie (disease-modifying anti-rheumatic drugs, DMARD). Cosentyx/- SensoReady/- UnoReady ralentit la progression des lésions structurelles et améliore la fonction physique.
Spondylarthrite axiale (axSpA)
Spondylarthrite ankylosante (SA, maladie de Bechterew)
Cosentyx/- SensoReady est indiqué dans le traitement de patients adultes atteints d'une spondylarthrite ankylosante active sévère qui ont répondu insuffisamment à un traitement conventionnel (par exemple des AINS).
Spondylarthrite axiale non radiographique (nr-axSpA)
Cosentyx/- SensoReady est indiqué dans le traitement de la spondylarthrite axiale non radiographique active sévère présentant des signes objectifs d'inflammation avec hausse du taux de protéine Créactive (CRP) et diagnostic par imagerie par résonance magnétique (IRM) chez des adultes qui ont répondu insuffisamment à un traitement par anti-inflammatoires non stéroïdiens (AINS).
Posologie/Mode d’emploiCosentyx/- SensoReady/- UnoReady est destiné à être utilisé sous la conduite et la surveillance d'un médecin expérimenté dans le diagnostic et le traitement des maladies pour lesquelles un traitement par Cosentyx/Cosentyx SensoReady/- UnoReady est indiqué.
Avant le début du traitement, le médecin doit vérifier ce qui suit:
Cosentyx est administré en injection sous-cutanée (concernant la biodisponibilité, voir «Pharmacocinétique»). Les zones cutanées présentant des signes de psoriasis doivent être évitées comme sites d'injection.
Après une formation adaptée à la technique de l'auto-injection sous-cutanée, les patients peuvent s'injecter eux-mêmes Cosentyx/- SensoReady/- UnoReady ou se le faire injecter par un soignant si un médecin juge cela approprié. Le médecin doit toutefois s'assurer d'un suivi adapté du patient. Les patients et/ou les soignants doivent être informés de la nécessité d'injecter la quantité totale de Cosentyx/- SensoReady/- UnoReady conformément aux indications figurant sur la notice.
Afin d'assurer la traçabilité des médicaments biotechnologiques, il convient de documenter pour chaque traitement le nom commercial et le numéro de lot.
Posologie usuelle
Psoriasis en plaques
Patients adultes
La dose recommandée est de 300 mg en injection sous-cutanée, administrée aux semaines 0, 1, 2, 3 et 4 en traitement initial, puis tous les mois en traitement d'entretien. Chaque dose de 300 mg est administrée en une injection sous-cutanée de 300 mg ou en deux injections sous-cutanées de 150 mg.
Patients pédiatriques
La dose recommandée dépend du poids corporel (tableau 1) et elle est administrée en injection sous-cutanée avec des doses initiales aux semaines 0, 1, 2, 3 et 4, suivies de doses d'entretien mensuelles. Chaque dose de 75 mg est administrée sous forme d'une injection sous-cutanée de 75 mg. Chaque dose de 150 mg est administrée sous forme d'une injection sous-cutanée de 150 mg.
Tableau 1: Posologie recommandée pour le psoriasis en plaques chez les enfants et les adolescents
|
Poids corporel au moment de l'administration
|
Dose recommandée
| |
< 50 kg
|
75 mg
| |
≥50 kg
|
150 mg
|
Arthrite psoriasique
La dose recommandée est de 150 mg en injection sous-cutanée avec des doses initiales aux semaines 0, 1, 2, 3 et 4, suivies de doses d'entretien mensuelles. La dose peut être augmentée à 300 mg en fonction de la réponse clinique.
Pour les patients qui répondent insuffisamment aux anti-TNF-alpha (inadequate responders, IR), la dose recommandée est de 300 mg en injection sous-cutanée avec des doses initiales aux semaines 0, 1, 2, 3 et 4, suivies de doses d'entretien mensuelles. Chaque dose de 300 mg est administrée en une injection sous-cutanée de 300 mg ou en deux injections sous-cutanées de 150 mg chacune.
Pour les patients atteints d'un psoriasis en plaques concomitant modéré à sévère, voir les recommandations de posologie et d'utilisation pour le psoriasis en plaques.
Spondylarthrite axiale (axSpA)
Spondylarthrite ankylosante (SA, maladie de Bechterew)
La dose recommandée est de 150 mg en injection sous-cutanée avec des doses initiales aux semaines 0, 1, 2, 3 et 4, suivies de doses d'entretien mensuelles.
Spondylarthrite axiale non radiographique (nr-axSpA)
La dose recommandée est de 150 mg en injection sous-cutanée avec des doses initiales aux semaines 0, 1, 2, 3 et 4, suivies de doses d'entretien mensuelles.
Les données disponibles concernant l'arthrite psoriasique et la spondylarthrite axiale semblent indiquer qu'une réponse clinique est obtenue en règle générale en l'espace de 16 semaines de traitement. Chez les patients n'ayant pas répondu au traitement après 16 semaines, il faut envisager d'arrêter celui-ci. Des améliorations peuvent être observées en poursuivant le traitement au-delà de 16 semaines chez certains patients qui ont présenté initialement une réponse partielle.
Ajustement de la posologie du fait d'effets indésirables / d'interactions
Psoriasis en plaques
En cas d'effets indésirables graves (voir «Mises en garde et précautions»), une interruption temporaire du traitement doit être envisagée jusqu'à leur disparition. Dans la mesure où les candidoses mucocutanées, globalement rares, sont plus souvent survenues dans les études cliniques avec une posologie de 300 mg, une réduction de la dose à 150 mg est à envisager pour les cas graves.
Patients présentant des troubles de la fonction hépatique / des troubles de la fonction rénale
Cosentyx/- SensoReady/- UnoReady n'a pas été spécifiquement étudié chez ces groupes de patients.
Patients âgés
Une quantité limitée de données concernant l'utilisation de Cosentyx chez des patients atteints d'arthrite psoriasique âgés de plus de 75 ans et des patients atteints de spondylarthrite axiale âgés de plus de 65 ans est disponible. Il n'existe toutefois aucun indice portant à penser que les patients âgés nécessiteraient une posologie différente de celle qui est nécessaire chez des patients adultes plus jeunes.
Enfants et adolescents
La sécurité et l'efficacité de Cosentyx pour les enfants de moins de 6 ans atteints de psoriasis en plaques n'ont pas été étudiées. La sécurité et l'efficacité pour les patients âgés de moins de 18 ans n'ont pas été étudiées dans d'autres indications à ce jour.
Contre-indicationsGraves réactions d'hypersensibilité au principe actif ou à l'un des excipients (voir «Composition», «Mises en garde et précautions» ainsi que la rubrique «Effets indésirables»).
Infections actives sévères (p.ex. tuberculose active, sepsis, infections opportunistes sévères).
Mises en garde et précautionsInfections
Cosentyx/- SensoReady/- UnoReady est susceptible d'accroître le risque d'infections. Lors des études cliniques, des infections ont été observées chez les patients sous Cosentyx (voir «Effets indésirables»). La plupart des infections étaient de gravité légère ou modérée. L'expérience chez des patients présentant des infections actives connues par le VIH, le VHB ou le VHC est limitée. Pour cette raison, il convient d'évaluer le rapport entre le bénéfice et les risques possibles du traitement chez ces patients avant d'utiliser Cosentyx/- SensoReady/- UnoReady.
Dans les études cliniques, des candidoses dépendantes de la dose ont été observées, y compris la candidose œsophagienne. Toutefois, aucune progression systémique n'a été observée, les infections ont pu être maitrisées par un traitement standard et n'ont nécessité aucun arrêt du traitement. Les données des études cliniques jusqu'à un an n'indiquent aucun risque élevé d'infections opportunistes graves. Les données actuelles ne permettent aucune estimation du risque à long terme d'infections opportunistes graves.
L'utilisation de Cosentyx/- SensoReady/- UnoReady chez les patients ayant une infection chronique ou des antécédents d'infections récidivantes doit être envisagée avec précaution.
Les patients doivent être informés de la nécessité de demander conseil à un médecin si des signes ou des symptômes indiquant une infection apparaissent. Si un patient développe une infection grave, il doit être placé sous surveillance étroite; Cosentyx/- SensoReady/- UnoReady ne doit pas être administré tant que l'infection n'a pas disparu.
Dans les études cliniques, aucune augmentation de la sensibilité à la tuberculose n'a été rapportée pendant un an. Toutefois, Cosentyx/- SensoReady/- UnoReady ne doit pas être administré aux patients atteints de tuberculose active. Un traitement antituberculeux doit être envisagé avant le début d'un traitement par Cosentyx/- SensoReady/- UnoReady chez les patients atteints de tuberculose latente.
Maladies inflammatoires chroniques de l'intestin
Des cas isolés de maladies inflammatoires chroniques de l'intestin ont été observés lors des études cliniques. Dans certains cas, ces maladies se sont aggravées. Dans la plupart des cas, il s'agissait d'exacerbations d'une maladie de Crohn préexistante. Face à de tels cas, il convient de réévaluer attentivement le traitement et d'envisager son arrêt (voir «Posologie/Mode d'emploi»). Dans une étude de phase 2, le sécukinumab n'a démontré aucune efficacité chez les patients atteints de la maladie de Crohn active. Dans la mesure où il existe un risque élevé inhérent de maladies inflammatoires chroniques de l'intestin chez les patients atteints de psoriasis, il n'est pas possible d'évaluer de manière concluante un lien de causalité avec le Cosentyx/- SensoReady/- UnoReady avec les données actuelles.
Apparition d'une maladie inflammatoire de l'intestin
Des cas d'apparition de maladies inflammatoires de l'intestin (incluant la maladie de Crohn et la colite ulcéreuse) ont été signalés après l'autorisation de mise sur le marché.
Maladies malignes
Les études cliniques jusqu'à un an n'ont montré aucune augmentation du risque de maladies malignes avec le traitement par Cosentyx/- SensoReady/- UnoReady. Les résultats des études concernant la sécurité à long terme ne sont pas encore disponibles.
Les patients psoriasiques ayant reçu auparavant un traitement par UV doivent être examinés pour dépister d'éventuelles tumeurs cutanées avant et pendant le traitement par Cosentyx/- SensoReady/- UnoReady.
Réactions d'hypersensibilité
Dans les études cliniques, des réactions anaphylactiques ont été observées dans de rares cas chez des patients ayant reçu Cosentyx. En cas d'apparition d'une réaction anaphylactique ou d'une autre réaction allergique grave, l'administration de Cosentyx/- SensoReady/- UnoReady doit être immédiatement arrêtée et des mesures thérapeutiques appropriées doivent être prises.
Aggravation du psoriasis en cas d'arrêt du traitement («rebond»)
En cas d'arrêt du traitement chez les patients qui y ont répondu en premier lieu, le risque d'aggravation du psoriasis est à prendre en compte. Dans une étude d'extension chez des patients ayant répondu en premier lieu au traitement, une aggravation du psoriasis a été observée après l'arrêt aussi bien du traitement par 150 mg que de celui par 300 mg: jusqu'à 8 semaines après l'arrêt du traitement, une aggravation a été observée chez 4% des patients traités par 300 mg et chez 4,7% de ceux traités par 150 mg. L'aggravation sous forme de psoriasis pustuleux a affecté 1,1% des patients traités préalablement par 300 mg et 0,7% de ceux traités préalablement par 150 mg.
Vaccinations
Les données disponibles concernant la réponse à une vaccination avec des vaccins vivants ou avec des vaccins inactivés chez des patients sous traitement par Cosentyx/- SensoReady sont limitées. En l'état actuel des données, il n'est pas possible d'évaluer dans quelle mesure Cosentyx/- SensoReady inhibe la réponse immunitaire aux néoantigènes et/ou aux antigènes de rappel. L'utilisation de vaccins vivants atténués n'est pas recommandée pendant ou immédiatement avant un traitement par Cosentyx/- SensoReady. Avant l'instauration d'un traitement par Cosentyx/- SensoReady, il est recommandé de mettre à jour le statut vaccinal du patient conformément aux directives vaccinales en vigueur, y compris, selon la situation de chaque patient, la vaccination contre la varicelle/le zona.
Association avec d'autres médicaments biologiques
L'administration concomitante de Cosentyx/- SensoReady/- UnoReady avec d'autres médicaments biologiques n'a pas été étudiée et n'est pas recommandée.
Personnes sensibles au latex (concerne seulement la seringue préremplie ou le stylo prérempli)
Le capuchon de l'aiguille de la seringue préremplie peut contenir du caoutchouc sec (latex). Il n'existe aucune documentation quant à l'utilisation en toute sécurité de la seringue préremplie ou du stylo prérempli chez les patients présentant une hypersensibilité au latex.
InteractionsInteractions avec des vaccins, voir «Mises en garde et précautions».
Lors d'une étude menée chez des patients adultes atteints de psoriasis en plaques, aucune interaction n'a été observée entre le sécukinumab et le midazolam (substrat du CYP3A4). Lors d'études sur l'arthrite psoriasique et la spondylarthrite axiale, Cosentyx/- SensoReady/- UnoReady a été administré de manière concomitante avec du méthotrexate et/ou des corticoïdes. Aucune interaction n'a alors été observée.
L'expression des enzymes hépatiques CYP450 est réprimée par les cytokines qui stimulent les inflammations chroniques. De ce fait, l'expression des CYP450 pourrait changer si une inhibition des cytokines par sécukinumab était engagée.
Effet de Cosentyx/- SensoReady/- UnoReady sur d'autres médicaments
Les patients prenant des médicaments dont la dose est déterminée de manière individuelle et qui sont métabolisés par les enzymes CYP450 3A4, 1A2 ou 2C9 (par exemple, atorvastatine, inhibiteurs des canaux calciques, théophylline, acénocoumarol, phénprocoumone, phénytoïne, ciclosporine ou benzodiazépines) doivent faire l'objet d'un contrôle au début et à la fin d'un traitement par sécukinumab et la dose de ces substances doit être ajustée si besoin. Compte tenu de sa longue demi-vie d'élimination, l'effet du sécukinumab sur l'activité des enzymes CYP450 peut persister plusieurs semaines après la fin du traitement.
Grossesse, allaitementGrossesse
Il n'existe pas de données suffisantes sur l'utilisation de Cosentyx/- SensoReady/- UnoReady pendant la grossesse. On sait que l'IgG1 humaine passe la barrière placentaire; le sécukinumab est un anticorps monoclonal IgG1. Il est donc possible que le sécukinumab passe de la mère au fœtus. Les femmes en âge de procréer doivent utiliser une méthode de contraception efficace pendant le traitement par Cosentyx/- SensoReady/- UnoReady. Il convient d'informer les patientes de la nécessité d'utiliser des méthodes de contraception efficaces pendant au moins 20 semaines après le dernier traitement par Cosentyx/- SensoReady/- UnoReady. Les études réalisées sur les animaux n'indiquent aucun effet néfaste direct ou indirect sur la grossesse, le développement embryonnaire, le développement fœtal, la naissance ou le développement postnatal (voir «Données précliniques»). Dans la mesure où des études de reproduction menées sur les animaux ne permettent pas toujours de prévoir la réaction chez l'homme, Cosentyx/- SensoReady/- UnoReady ne doit être utilisé durant une grossesse que si son bénéfice pour la mère l'emporte clairement sur les risques éventuels.
Allaitement
On ignore si le sécukinumab passe dans le lait maternel. Étant donné que de nombreux médicaments, dont les anticorps, sont excrétés dans le lait maternel, un risque pour le nouveau-né ou l'enfant en bas âge ne peut pas être exclu. En raison des lésions possibles pour le nourrisson allaité, il est recommandé de ne pas allaiter pendant le traitement par Cosentyx/- SensoReady/- UnoReady et pendant au moins 20 semaines après la dernière dose. La décision d'arrêter l'allaitement ou l'administration de Cosentyx/- SensoReady/- UnoReady chez la mère doit donc être prise en évaluant les avantages de l'allaitement pour l'enfant et ceux du traitement pour la mère.
Fertilité
L'effet de Cosentyx sur la fertilité de l'homme n'a pas été étudié. Les études réalisées sur les animaux n'indiquent aucun effet néfaste direct ou indirect sur la fertilité (voir «Données précliniques»).
Effet sur l’aptitude à la conduite et l’utilisation de machinesCosentyx/- SensoReady/- UnoReady n'a aucune influence ou a une influence négligeable sur l'aptitude à la conduite ou l'utilisation de machines.
Effets indésirablesRésumé du profil de sécurité
Au total, plus de 18 000 patients ont été traités par Cosentyx dans le cadre d'études cliniques réalisées en aveugle ou en ouvert portant sur diverses indications (psoriasis en plaques, arthrite psoriasique, spondylarthrite axiale et autres maladies auto-immunes), ce qui correspond à une exposition de 30 565 patients-années. Parmi ces patients, 11 500 ont été exposés à Cosentyx pendant au moins un an.
Quatre études de phase III contrôlées contre placebo portant sur les patients adultes atteints de psoriasis en plaques ont été regroupées afin d'évaluer la sécurité de Cosentyx comparativement au placebo jusqu'à 12 semaines après le début du traitement. Au total, 2076 patients ont été évalués (692 patients ayant reçu 150 mg, 690 patients ayant reçu 300 mg et 694 patients ayant reçu le placebo).
La sécurité de Cosentyx a été étudiée dans deux études de phase III incluant des patients pédiatriques atteints de psoriasis en plaques. La première étude était une étude en double aveugle, contrôlée contre placebo, incluant 162 patients âgés de 6 ans à < 18 ans atteints de psoriasis en plaques sévère. La deuxième étude était une étude ouverte incluant 84 patients âgés de 6 ans à < 18 ans atteints de psoriasis en plaques modéré à sévère. Le profil de sécurité rapporté en un total de 287,4 patients-années dans ces deux études correspondait au profil de sécurité rapporté pour des patients adultes atteints de psoriasis en plaques.
L'évaluation de la sécurité de Cosentyx chez les patients atteints d'arthrite psoriasique repose sur cinq études contrôlées contre placebo menées auprès de 2754 patients (1871 patients traités par Cosentyx et 883 traités par placebo), la phase contrôlée contre placebo ayant duré jusqu'à 24 semaines, avec une exposition globale de 4478 patients-années. Le profil de sécurité observé chez les patients atteints d'arthrite psoriasique traités par Cosentyx correspond à celui observé chez les patients psoriasiques.
L'évaluation de la sécurité de Cosentyx chez les patients atteints de spondylarthrite ankylosante repose sur deux études contrôlées contre placebo menées auprès de 590 patients (394 patients traités par Cosentyx et 196 traités par placebo), la phase contrôlée contre placebo ayant duré jusqu'à 24 semaines, avec une exposition globale de 755 patients-années (durée moyenne de l'exposition pour les patients traités par sécukinumab: 469 jours dans l'étude AS1 et 460 jours dans l'étude AS2).
L'évaluation de la sécurité de Cosentyx chez les patients atteints de spondylarthrite axiale non radiographique (nr-axSpA) repose sur une étude contrôlée contre placebo menée auprès de 555 patients (369 patients traités par Cosentyx et 186 ayant reçu le placebo). La période contrôlée contre placebo a duré jusqu'à 52 semaines et l'exposition totale pendant l'étude a été de 588 patients-années (durée moyenne d'exposition des patients traités par sécukinumab: 395 jours).
Le profil de sécurité observé chez les patients atteints de spondylarthrite axiale (spondylarthrite ankylosante et spondylarthrite axiale non radiographique) traités par Cosentyx correspond à celui observé chez les patients psoriasiques.
Les effets indésirables les plus fréquemment rapportés étaient des infections des voies respiratoires supérieures (rhinopharyngite ou rhinite dans la plupart des cas). La plupart de ces événements étaient de gravité légère ou modérée. Dans les phases contrôlées contre placebo des études pivots de phase III, la proportion de patients ayant arrêté le traitement à cause des événements indésirables s'est élevée à environ 1,5% dans le groupe avec Cosentyx et à 2,4% dans le groupe avec placebo.
Les effets indésirables observés lors des études cliniques sont répertoriés dans le tableau ci-dessous par classe de système d'organes de la classification MedDRA. Au sein de chaque classe de système d'organes, les effets indésirables sont classés par ordre décroissant de fréquence. Dans chaque groupe de fréquence, les effets indésirables sont présentés selon un ordre décroissant de gravité. Les catégories de fréquence sont définies comme suit: «très fréquents» (≥1/10), «fréquents» (< 1/10, ≥1/100), «occasionnels» (< 1/100, ≥1/1000), «rares» (< 1/1000, ≥1/10 000), «très rares» (< 1/10 000).
Infections
Très fréquents: infections des voies respiratoires supérieures (17,7%).
Fréquents: herpès oral, pied d'athlète (tinea pedis).
Occasionnels: candidose orale, candidose œsophagienne, infection des voies respiratoires inférieures.
Systèmes sanguin et lymphatique
Occasionnels: neutropénie.
Affections du système nerveux
Fréquents: céphalées.
Yeux
Occasionnels: conjonctivite.
Organes respiratoires
Fréquents: rhinorrhée.
Troubles gastro-intestinaux
Fréquents: diarrhée, nausées.
Occasionnels: maladies inflammatoires de l'intestin (incluant la maladie de Crohn et la colite ulcéreuse).
Affections hépatobiliaires
Occasionnels: enzymes hépatiques élevées, bilirubine élevée.
Peau
Occasionnels: urticaire.
Rares: dermite exfoliative (des cas ont été rapportés chez des patients chez lesquels un psoriasis a été diagnostiqué), vascularite d'hypersensibilité.
Affections du système immunitaire
Rares: réactions anaphylactiques.
Troubles généraux et anomalies au site d'administration
Fréquents: fatigue.
Effets indésirables identifiés après la commercialisation
Les effets indésirables suivants sont survenus après la commercialisation de Cosentyx et sont décrits dans des rapports de cas spontanés et dans la littérature scientifique. Comme il s'agit d'informations volontaires issues d'une population de taille inconnue, il n'est pas possible de donner une estimation fiable de leur fréquence, c'est pourquoi ils sont classés dans la catégorie «fréquence inconnue». Les effets indésirables sont répertoriés par classe de système d'organes de la classification MedDRA. Au sein de chaque classe de système d'organes, les effets indésirables sont classés par ordre décroissant de gravité.
Infections et infestations
Candidose muqueuse et cutanée
Description de certains effets indésirables
Infections
Dans les phases contrôlées contre placebo des études cliniques sur le psoriasis en plaques (au total, 1382 patients traités par Cosentyx et 694 patients traités par placebo sur une période allant jusqu'à 12 semaines), des infections ont été signalées chez 28,7% des patients traités par Cosentyx et chez 18,9% des patients traités par placebo. La plupart de ces infections étaient de gravité légère ou modérée. Des candidoses sont survenues chez 1,2% des patients traités par 300 mg de Cosentyx, chez 0,4% des patients traités par 150 mg de Cosentyx et chez 0,3% des patients traités par placebo. Des infections graves sont survenues chez 0,14% des patients traités par Cosentyx et chez 0,3% des patients traités par placebo (voir «Mises en garde et précautions»).
Sur l'ensemble de la phase de traitement (au total, 3430 patients traités par Cosentyx sur une période allant jusqu'à 52 semaines pour la plupart), des infections ont été signalées chez 47,5% des patients traités par Cosentyx (0,9 par patient-année de suivi). Des infections graves ont été rapportées chez 1,2% des patients traités par Cosentyx (0,015 par patient-année de suivi).
Les taux d'infections observés lors des études cliniques sur l'arthrite psoriasique, la spondylarthrite axiale (spondylarthrite ankylosante et spondylarthrite axiale non radiographique) étaient similaires à ceux observés dans les études sur le psoriasis.
Enzymes hépatiques élevées, bilirubine élevée
Durant la phase contrôlée contre placebo des études cliniques sur le psoriasis en plaques, 14,5% des patients sous Cosentyx contre 11,6% de ceux sous placebo ont connu des élévations isolées et transitoires des transaminases hépatiques jusqu'à 3 fois la valeur supérieure de la norme. Des élévations identiques de bilirubine ont été rapportées chez 5% des patients sous Cosentyx contre 2,5% de ceux sous placebo. Les fréquences sous sécukinumab et étanercept étaient similaires.
Neutropénie
Une neutropénie a été plus fréquemment observée avec le sécukinumab qu'avec le placebo. La plupart des cas étaient légers, transitoires et réversibles. Une neutropénie < 1,0–0,5 × 109/l (CTCAE grade 3) a été rapportée chez 18 des 3430 (0,5%) patients sous sécukinumab, indépendamment de la dose et sans relation temporelle avec des infections chez 15 de ces 18 cas. Aucun cas de neutropénie plus grave n'a été rapporté. Chez les trois autres cas, il a été rapporté des infections non graves ayant répondu à un traitement standard et n'ayant pas nécessité l'arrêt de Cosentyx.
La fréquence des neutropénies dans l'arthrite psoriasique et la spondylarthrite axiale (spondylarthrite ankylosante et spondylarthrite axiale non radiographique) était semblable à celle observée dans le psoriasis.
Réactions d'hypersensibilité
Sur l'ensemble des études cliniques, de l'urticaire et de rares cas de réactions anaphylactiques à Cosentyx ont été observés.
Maladies inflammatoires chroniques de l'intestin
Sur l'ensemble des études cliniques, des cas isolés de maladies inflammatoires chroniques de l'intestin ont été observés chez les patients à risque sous sécukinumab (voir «Mises en garde et précautions»). Un lien de causalité avec le sécukinumab ne peut être exclu sur la base des données actuelles.
Immunogénicité
Lors d'études cliniques sur le psoriasis, l'arthrite psoriasique et la spondylarthrite axiale (spondylarthrite ankylosante et spondylarthrite axiale non radiographique), durant un traitement allant jusqu'à 52 semaines, moins de 1% des patients traités par Cosentyx a développé des anticorps dirigés contre le sécukinumab. Environ la moitié des anticorps dirigés contre le médicament apparus au cours du traitement étaient neutralisants. Toutefois, leur présence n'a pas été associée à une perte d'efficacité ou à des variations des paramètres pharmacocinétiques.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageAucun cas de surdosage n'a été rapporté lors des études cliniques.
Dans le cadre des études cliniques, des doses allant jusqu'à 30 mg/kg (c'est-à-dire environ 2000 à 3000 mg) ont été administrées par voie intraveineuse sans apparition d'une toxicité limitant la dose.
Traitement
En cas de surdosage, il est recommandé de surveiller tout signe ou symptôme d'effet indésirable chez le patient et d'instaurer immédiatement un traitement symptomatique approprié.
Propriétés/EffetsCode ATC
L04AC10
Mécanisme d'action
Le sécukinumab est un anticorps IgG1 entièrement humain qui se lie de manière sélective à l'interleukine 17A (IL-17A), une cytokine pro-inflammatoire, et la neutralise. Le sécukinumab agit de manière ciblée sur l'IL-17A et inhibe son interaction avec le récepteur de l'IL-17, qui est exprimé à la surface de diverses cellules, dont les kératinocytes. Par conséquent, le sécukinumab inhibe la libération de cytokines pro-inflammatoires, de chimiokines et de médiateurs des lésions tissulaires. Il réduit les effets induits par l'IL-17A dans les maladies inflammatoires et auto-immunes. Des taux cliniquement significatifs de sécukinumab atteignent la peau et réduisent les marqueurs locaux de l'inflammation. Le traitement par sécukinumab a donc pour conséquence directe d'atténuer l'érythème, l'induration et la desquamation observés dans les lésions du psoriasis en plaques. Chez les patients atteints de psoriasis en plaques, la production d'IL-17A dans les zones cutanées lésées est sensiblement régulée à la hausse par rapport aux zones cutanées non touchées. Par ailleurs, des cellules productrices d'IL-17 ont été observées plus fréquemment dans le liquide synovial des patients atteints d'arthrite psoriasique. En outre, les cellules productrices d'IL-17 étaient aussi nettement plus nombreuses dans la moelle osseuse sous-chondrale des articulations facettaires chez les patients atteints de spondylarthrite axiale. Une augmentation du nombre de lymphocytes produisant de l'IL-17A a également été constatée chez les patients atteints de spondylarthrite axiale non radiographique.
De plus, l'IL-17A stimule la réaction inflammatoire tissulaire, l'infiltration de neutrophiles, la destruction tissulaire et osseuse, ainsi que le remodelage des tissus, y compris l'angiogenèse et la fibrose.
Pharmacodynamique
Dans une étude portant sur le sécukinumab, les taux de neutrophiles infiltrants et divers marqueurs associés aux neutrophiles qui sont élevés dans les zones cutanées lésées des patients atteints de psoriasis en plaques ont diminué de manière significative après une à deux semaines de traitement.
Il a été démontré que le sécukinumab (sur une période de traitement d'une à deux semaines) réduit le taux de protéine C-réactive; la protéine C-réactive est un marqueur de l'inflammation dans l'arthrite psoriasique et la spondylarthrite axiale.
Efficacité clinique
Psoriasis
Patients adultes
La sécurité et l'efficacité de Cosentyx ont été évaluées au cours de quatre études cliniques de phase III randomisées, en double aveugle et contrôlées contre placebo [ERASURE, FIXTURE, FEATURE, JUNCTURE], menées durant un an chez des patients atteints de psoriasis en plaques modéré à sévère n'ayant pas répondu à une photothérapie ou à un traitement systémique ou n'ayant pas toléré de tels traitements. L'efficacité et la sécurité de Cosentyx 150 mg et 300 mg ont été évaluées versus placebo ou étanercept. En outre, une étude [SCULPTURE] a évalué un schéma de traitement continu par rapport à un schéma avec une interruption de traitement en semaine 12 suivie d'une reprise du retraitement «à la demande» en cas d'aggravation clinique. Dans ces études, chaque dose de 300 mg a été administrée sous la forme de deux injections sous-cutanées de 150 mg.
Afin d'éviter des biais dans l'évaluation de l'efficacité du sécukinumab dans le traitement du psoriasis, l'utilisation concomitante d'un médicament antipsoriasique systémique ou topique ou d'une photothérapie n'était pas autorisée pendant les études.
Parmi les 2403 patients inclus dans les études contrôlées contre placebo, 79% n'avaient jamais été traités par biothérapie; 45% étaient en échec d'un traitement non biologique, 8% en échec d'une biothérapie, 6% en échec d'un traitement anti-TNF et 2% en échec d'un traitement antip40 (anti-IL-12/IL-23). Les caractéristiques de la maladie en situation initiale étaient généralement similaires sur l'ensemble des groupes de traitement: la valeur médiane du score «Psoriasis Area and Severity Index» (PASI) en situation initiale variait entre 19 et 20, le score de l'évaluation globale du médecin (IGA, version 2011) au moment de l'inclusion se situait entre «modéré» (62%) et «sévère» (38%), la valeur médiane de la surface corporelle atteinte (SCA) était ≥27 à l'état initial et la valeur médiane de l'indice de qualité de vie en dermatologie (DLQI) était comprise entre 10 et 12. Environ 15 à 25% des patients inclus dans les études de phase III étaient atteints d'une arthrite psoriasique (APs) à l'inclusion.
L'étude 1 sur le psoriasis (ERASURE) a évalué 738 patients. Les patients randomisés dans le groupe avec Cosentyx ont reçu des doses de 150 mg ou de 300 mg aux semaines 0, 1, 2, 3 et 4, puis la même dose chaque mois. Les patients randomisés dans le groupe avec placebo et étant non répondeurs en semaine 12 ont ensuite été randomisés pour recevoir Cosentyx (150 ou 300 mg) aux semaines 12, 13, 14 et 15, puis la même dose chaque mois en débutant à la semaine 16.
L'étude 2 sur le psoriasis (FIXTURE) a évalué 1306 patients. Outre le groupe avec placebo, un groupe avec étanercept a servi de comparateur actif. Le traitement par Cosentyx et placebo correspondait à l'étude 1. Les patients randomisés dans le groupe avec étanercept ont reçu des doses de 50 mg deux fois par semaine pendant 12 semaines, puis 50 mg par semaine.
Les études 3 (FEATURE) et 4 (JUNCTURE) sur le psoriasis ont comparé à un placebo 177 patients traités par seringue préremplie et 182 traités par stylo prérempli après un traitement de 12 semaines, afin d'évaluer la sécurité, la tolérance et la praticabilité de l'auto-injection de Cosentyx au moyen d'une seringue préremplie. Le traitement par Cosentyx et placebo correspondait à l'étude 1. L'étude 5 sur le psoriasis (SCULPTURE) a évalué 966 patients. Tous les patients ont reçu 150 mg ou 300 mg de Cosentyx aux semaines 0, 1, 2, 3, 4, 8 et 12 et ont ensuite été randomisés pour recevoir soit la même dose en continu chaque mois en traitement d'entretien, soit après interruption du traitement un schéma de reprise du traitement «à la demande» en cas d'aggravation clinique. S'agissant du maintien de la réponse, les patients ayant interrompu le traitement puis repris le traitement «à la demande» étaient inférieurs aux patients ayant reçu un traitement d'entretien mensuel fixe.
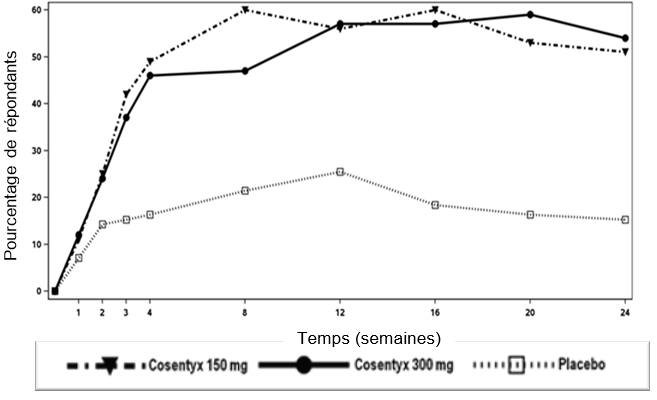
Les critères d'évaluation principaux dans les études contrôlées contre placebo et contrôlées activement étaient la proportion de patients ayant obtenu une réponse PASI 75 et une réponse IGA (évaluation globale du médecin, version 2011) de type «blanchi» ou «presque blanchi» à la 12e semaine en comparaison avec le groupe placebo (voir les tableaux 2 et 3). Le taux de réponse maximal a été atteint en semaine 16, et la dose de 300 mg était supérieure pour l'ensemble des études.
Tableau 2: Résumé des réponses cliniques PASI 50/75/90/100 et IGA⃰ (version 2011) de type «blanchi» ou «presque blanchi» obtenues dans les études 1, 3 et 4 sur le psoriasis (ERASURE, FEATURE et JUNCTURE)
|
|
Semaine 12
|
Semaine 16
|
Semaine 52
| |
|
Placebo
n (%)
(IC à 95%)
|
150 mg
n (%)
(IC à 95%)
|
300 mg
n (%)
(IC à 95%)
|
150 mg
n (%)
(IC à 95%)
|
300 mg
n (%)
(IC à 95%)
|
150 mg
n (%)
(IC à 95%)
|
300 mg
n (%)
(IC à 95%)
| |
Étude 1
| |
Nombre de patients
|
246
|
244
|
245
|
244
|
245
|
244
|
245
| |
Réponse PASI 50
|
22 (8,9%)
(5,8; 13,4)
|
203 (83,5%)
(78,1; 87,9)
|
222 (90,6%)
(86,1; 93,8)
|
212 (87,2%)
(82,2; 91,0)
|
224 (91,4%)
(87,0; 94,5)
|
187 (77%)
(71,0; 82,0)
|
207 (84,5%)
(79,2; 88,7)
| |
Réponse PASI 75
|
11 (4,5%) (2,4; 8,1)
|
174 (71,6%)**
(65,4; 77,1)
|
200 (81,6%)**
(76,1; 86,2)
|
188 (77,4%)
(71,5; 82,4)
|
211 (86,1%)
(81,0; 90,1)
|
146 (60,1%)
(53,6; 66,2)
|
182 (74,3%)
(68,3; 79,5)
| |
Réponse PASI 90
|
3 (1,2%)
(0,3; 3,8)
|
95 (39,1%)**
(33,0; 45,6)
|
145 (59,2%)**
(52,7; 65,3)
|
130 (53,5%)
(47,0; 59,9)
|
171 (69,8%)
(63,6; 75,4)
|
88 (36,2%)
(30,2; 42,6)
|
147 (60,0%)
(53,6; 66,1)
| |
Réponse PASI 100
|
2 (0,8%)
(0,1; 3,2)
|
31 (12,8%)
(9,0; 17,8)
|
70 (28,6%)
(23,1; 34,7)
|
51 (21,0%)
(16,2; 26,8)
|
102 (41,6%)
(35,4; 48,1)
|
49 (20,2%)
(15,4; 25,9)
|
96 (39,2%)
(33,1; 45,6)
| |
Réponse IGA (version 2011) de type «blanchi» ou «presque blanchi»
|
6 (2,40%)
(1,0; 5,5)
|
125 (51,2%)**
(44,8; 57,6)
|
160 (65,3%)**
(58,9; 71,2)
|
142 (58,2%)
(51,7; 64,4)
|
180 (73,5%)
(67,4; 78,8)
|
101 (41,4%)
(35,2; 47,9)
|
148 (60,4%)
(54,0; 66,5)
| |
Étude 3
| |
Nombre de patients
|
59
|
59
|
58
|
-
|
-
|
-
|
-
| |
Réponse PASI 50
|
3 (5,1%)
(1,3; 15,1)
|
51 (86,4%)
(74,5; 93,6)
|
51 (87,9%)
(76,1; 94,6)
|
-
|
-
|
-
|
-
| |
Réponse PASI 75
|
0 (0,0%)
(0,0; 7,6)
|
41 (69,5%)**
(56,0; 80,5)
|
44 (75,9%)**
(62,5; 85,7)
|
-
|
-
|
-
|
-
| |
Réponse PASI 90
|
0 (0,0%)
(0,0; 7,6)
|
27 (45,8%)
(32,9; 59,2)
|
35 (60,3%)
(46,6; 72,7)
|
-
|
-
|
-
|
-
| |
Réponse PASI 100
|
0 (0,0%)
(0,0; 7,6)
|
5 (8,5%)
(3,2; 19,4)
|
25 (43,1%)
(30,4; 56,7)
|
-
|
-
|
-
|
-
| |
Réponse IGA (version 2011) de type «blanchi» ou «presque blanchi»
|
0 (0,0%)
(0,0; 7,6)
|
31 (52,5%)**
(39,2; 65,5)
|
40 (69,0%)**
(55,3; 80,1)
|
-
|
-
|
-
|
-
| |
Étude 4
| |
Nombre de patients
|
61
|
60
|
60
|
-
|
-
|
-
|
-
| |
Réponse PASI 50
|
5 (8,2%)
(3,1; 18,8)
|
48 (80,0%)
(67,3; 88,8)
|
58 (96,7%)
(87,5; 99,4)
|
-
|
-
|
-
|
-
| |
Réponse PASI 75
|
2 (3,3%)
(0,6; 12,4)
|
43 (71,7%)**
(58,4; 82,2)
|
52 (86,7%)**
(74,9; 93,7)
|
-
|
-
|
-
|
-
| |
Réponse PASI 90
|
0 (0,0%)
(0,0; 7,4)
|
24 (40,0%)
(27,8; 53,5)
|
33 (55,0%)
(41,7; 67,7)
|
-
|
-
|
-
|
-
| |
Réponse PASI 100
|
0 (0,0%)
(0,0; 7,4)
|
10 (16,7%)
(8,7; 29,0)
|
16 (26,7%)
(16,5; 39,9)
|
-
|
-
|
-
|
-
| |
Réponse IGA (version 2011) de type «blanchi» ou «presque blanchi»
|
0 (0,0%)
(0,0; 7,4)
|
32 (53,3%)**
(40,1; 66,1)
|
44 (73,3%)**
(60,1; 83,5)
|
-
|
-
|
-
|
-
| |
* L'IGA (version 2011) est une échelle à 5 catégories: «0 = blanchi», «1 = presque blanchi», «2 = léger», «3 = modéré» et «4 = sévère». Cette échelle indique l'évaluation globale de la sévérité du psoriasis par le médecin concernant l'induration, l'érythème et la desquamation. Le succès thérapeutique de type «blanchi» ou «presque blanchi» était défini comme l'absence de signes d'un psoriasis ou une coloration des lésions normale à rosée, l'absence d'épaississement des plaques et une desquamation localisée absente à minimale.
** valeurs de p versus placebo et ajustées pour tenir compte de la multiplicité: p < 0,0001
|
Tableau 3: Résumé de la réponse clinique obtenue dans l'étude 2 sur le psoriasis (FIXTURE)
|
|
Semaine 12
|
Semaine 16
|
Semaine 52
| |
|
Placebo
n (%)
(IC à 95%)
|
150 mg
n (%)
(IC à 95%)
|
300 mg
n (%)
(IC à 95%)
|
Étanercept
n (%)
(IC à 95%)
|
150 mg
n (%)
(IC à 95%)
|
300 mg
n (%)
(IC à 95%)
|
Étanercept
n (%)
(IC à 95%)
|
150 mg
n (%)
(IC à 95%)
|
300 mg
n (%)
(IC à 95%)
|
Étanercept
n (%)
(IC à 95%)
| |
Nombre de patients
|
324
|
327
|
323
|
323
|
327
|
323
|
323
|
327
|
323
|
323
| |
Réponse PASI 50
|
49 (15,1%)
(11,5; 19,6)
|
266 (81,3%)
(76,6; 85,3)
|
296 (91,6%)
(87,9; 94,3)
|
226 (70,0%)
(64,6; 74,9)
|
290 (88,7%)
(84,6; 91,8)
|
302 (93,5%)
(90,1; 95,8)
|
257 (79,6%)
(74,7; 83,7)
|
249 (76,1%)
(71,1; 80,6)
|
274 (84,8%)
(80,3; 88,5)
|
234 (72,4%)
(67,2; 77,2)
| |
Réponse PASI 75
|
16 (4,9%)
(2,9; 8,1)
|
219 (67,0%)**
(61,5; 72,0)
|
249 (77,1%)**
(72,0; 81,5)
|
142 (44,0%)
(38,5; 49,6)
|
247 (75,5%)
(70,4; 80,0)
|
280 (86,7%)
(82,4; 90,1)
|
189 (58,5%)
(52,9; 63,9)
|
215 (65,7%)**
(60,3; 70,8)
|
254 (78,6%)**
(73,7; 82,9)
|
179 (55,4%)
(49,8; 60,9)
| |
Réponse PASI 90
|
5 (1,5%)
(0,6; 3,8)
|
137 (41,9%)
(36,5; 47,5)
|
175 (54,2%)
(48,6; 59,7)
|
67 (20,7%)
(16,5; 25,7)
|
176 (53,8%)
(48,3; 59,3)
|
234 (72,4%)
(67,2; 77,2)
|
101 (31,3%)
(26,3; 36,7)
|
147 (45,0%)
(39,5; 50,5)
|
210 (65,0%)
(59,5; 70,2)
|
108 (33,4%)
(28,4; 38,9)
| |
Réponse PASI 100
|
0 (0%)
(0,0; 1,5)
|
47 (14,4%)
(10,8; 18,8)
|
78 (24,1%)
(19,7; 29,3)
|
14 (4,3%)
(2,5; 7,3)
|
84 (25,7%)
(21,1; 30,8)
|
119 (36,8%)
(31,6; 42,4)
|
24 (7,4%)
(4,9; 11,0)
|
65 (19,9%)
(15,8; 24,7)
|
117 (36,2%)
(31,0; 41,8)
|
32 (9,9%)
(7,0; 13,8)
| |
Réponse
IGA (version 2011) de type «blanchi» ou «presque blanchi»
|
9 (2,8%)
(1,4; 5,4)
|
167 (51,1%)**
(45,5; 56,6)
|
202 (62,5%)**
(57,0; 67,8)
|
88 (27,2%)
(22,5; 32,5)
|
200 (61,2%)
(55,6; 66,4)
|
244 (75,5%)
(70,4; 80,1)
|
127 (39,3%)
(34,0; 44,9)
|
168 (51,4%)**
(45,8; 56,9)
|
219 (67,8%)**
(62,4; 72,8)
|
120 (37,2%)
(31,9; 42,7)
| |
** valeurs de p ajustées versus étanercept: p = 0,0250
|
Une étude supplémentaire sur le psoriasis (CLEAR) a évalué 676 patients. Le sécukinumab 300 mg a atteint les critères d'évaluation principaux et secondaires grâce à sa supériorité par rapport à l'ustékinumab concernant l'importance de la réponse PASI 90 à la semaine 16 (critère d'évaluation principal) et la réponse PASI 90 de longue durée à la semaine 52. Une efficacité supérieure du sécukinumab par rapport à l'ustékinumab pour les critères d'évaluation de réponse PASI 75/90/100 et de réponse IGA version 2011- 0 ou 1 (de type «blanchi» ou «presque blanchi») a été rapidement visible et s'est prolongée jusqu'à la semaine 52.
Dans cette étude, chaque dose de 300 mg a été administrée sous la forme de deux injections sous-cutanées de 150 mg.
Tableau 4: Résumé de la réponse clinique obtenue dans l'étude CLEAR
|
|
Semaine 16
|
Semaine 52
| |
|
Sécukinumab 300 mg
|
Ustékinumab*
|
Sécukinumab 300 mg
|
Ustékinumab*
| |
Nombre de patients
|
334
|
335
|
334
|
335
| |
Réponse PASI 75 n (%)
|
311 (93,1%)
|
276 (82,4%)
|
306 (91,6%)
|
262 (78,2%)
| |
Réponse PASI 90 n (%)
|
264 (79,0%)**
|
192 (57,3%)
|
250 (74,9%)***
|
203 (60,6%)
| |
Réponse PASI 100 n (%)
|
148 (44,3%)
|
95 (28,4%)
|
150 (44,9%)
|
123 (36,7%)
| |
Réponse IGA (version 2011) de type «blanchi» ou «presque blanchi» n (%)
|
278 (83,2%)
|
226 (67,5%)
|
261 (78,1%)
|
213 (63,6%)
| |
* Les patients traités par le sécukinumab ont reçu une dose de 300 mg aux semaines 0, 1, 2, 3 et 4, suivie de la même dose tous les mois jusqu'à la semaine 52. Les patients traités par l'ustékinumab ont reçu 45 mg ou 90 mg aux semaines 0 et 4, puis toutes les 12 semaines jusqu'à la semaine 52 (dosé en fonction du poids et de la posologie autorisée)
** valeurs de p versus ustékinumab: p < 0,0001 pour le critère d'évaluation principal PASI 90 à la semaine 16
*** valeurs de p versus ustékinumab: p = 0,0001 pour le critère d'évaluation secondaire PASI 90 à la semaine 52
|
Cosentyx a été efficace chez les patients n'ayant pas été traités par biothérapie, chez les patients ayant déjà reçu un traitement biologique, ainsi que chez les patients en échec de traitement par un médicament biologique. Les taux de réponse concernant les critères d'évaluation principaux, PASI 75 et IGA 0 ou 1, avec 300 mg de Cosentyx étaient respectivement de 67,7% et 54,1% chez les patients après un échec d'un traitement antérieur par anti-TNF contre 78,5% et 56,9% chez les patients sans prétraitement par anti-TNF.
À une posologie de 300 mg, Cosentyx a été associé à un effet rapide avec une diminution de 50% du score PASI moyen en semaine 3.
Environ 15 à 25% des patients inclus dans l'ensemble des études de phase III sur le psoriasis en plaques présentaient de manière concomitante une arthrite psoriasique dès l'inclusion. Les améliorations du score PASI 75 chez ce groupe de patients étaient similaires à celles de l'ensemble du groupe de patients atteints de psoriasis en plaques.
Localisations et formes spécifiques du psoriasis en plaques
Dans une étude supplémentaire contrôlée contre placebo, une amélioration du psoriasis unguéal (TRANSFIGURE, 198 patients) a été observée. Dans l'étude TRANSFIGURE, le sécukinumab a présenté une efficacité statistiquement supérieure au placebo à la semaine 16 (46,1% pour 300 mg, 38,4% pour 150 mg contre 11,7% pour le placebo) concernant l'amélioration du Nail Psoriasis Severity Index (réponse NAPSI, indice de sévérité du psoriasis unguéal) chez des patients atteints de psoriasis en plaques modéré à sévère avec atteinte des ongles.
Dans d'autres études cliniques, des améliorations du psoriasis unguéal, de l'atteinte du cuir chevelu et de l'atteinte palmo-plantaire ont également été observées.
Dans ces études, chaque dose de 300 mg a été administrée sous la forme de deux injections sous-cutanées de 150 mg.
Qualité de vie/résultats rapportés par les patients
Des améliorations statistiquement significatives du score DLQI (indice de qualité de vie en dermatologie) ont été démontrées entre l'inclusion et la 12e semaine (études 1 à 4). Ces améliorations se sont maintenues pendant 52 semaines (études 1 et 2).
Des améliorations statistiquement significatives des signes et symptômes de prurit, de douleurs et de desquamation rapportés par les patients ont été démontrées entre l'inclusion et la 12e semaine en comparaison avec le placebo (études 1 et 2) grâce au carnet de suivi des symptômes du psoriasis (Psoriasis Symptom Diary©).
Des améliorations statistiquement significatives du score DLQI ont été constatées entre l'inclusion et la 4e semaine chez les patients traités par sécukinumab par rapport aux patients traités par ustékinumab (CLEAR), et ces améliorations se sont maintenues jusqu'à 52 semaines.
Dans le carnet de suivi des symptômes du psoriasis, des améliorations statistiquement significatives des signes et symptômes de prurit, de douleurs et de desquamation rapportés par les patients ont été observées à la semaine 16 et à la semaine 52 (CLEAR) chez les patients traités par sécukinumab par rapport aux patients traités par ustékinumab.
Patients pédiatriques
Psoriasis en plaques sévère
Dans une étude de phase III de 52 semaines, randomisée, en double aveugle, contrôlée contre placebo et étanercept, 162 patients pédiatriques de 6 ans à < 18 ans atteints de psoriasis en plaques sévère (défini par un score PASI ≥20, un score IGA (version 2011) de 4 et une surface corporelle atteinte ≥10 %) pour lesquels un traitement systémique était envisageable ont été étudiés. Environ 43% des patients avaient été auparavant traités par photothérapie, 53% avaient reçu un traitement systémique classique et 3% un traitement biologique. 9% des patients souffraient également d'arthrite psoriasique.
Les patients ont été randomisés dans un des quatre groupes de traitement suivants:
·Dose faible de sécukinumab (75 mg pour un poids corporel < 50 kg ou 150 mg pour un poids corporel ≥50 kg) aux semaines 0, 1, 2, 3 et 4, suivie de la même dose toutes les 4 semaines
·Dose élevée de sécukinumab (75 mg pour un poids corporel < 25 kg, 150 mg pour un poids corporel compris entre ≥25 kg et < 50 kg ou 300 mg pour un poids corporel ≥50 kg) aux semaines 0, 1, 2, 3 et 4, suivie de la même dose toutes les 4 semaines
·Placebo aux semaines 0, 1, 2, 3 et 4, suivi de la même dose toutes les 4 semaines
·Étanercept (0,8 mg/kg) une fois par semaine (jusqu'à une dose maximale de 50 mg)
Les patients randomisés pour recevoir le placebo et n'ayant pas répondu à la semaine 12 ont été placés dans le groupe recevant la dose faible de sécukinumab ou la dose élevée de sécukinumab (en fonction du groupe de poids corporel) et ils ont reçu le médicament à l'étude aux semaines 12, 13, 14 et 15, puis la même dose toutes les 4 semaines à partir de la semaine 16.
Les co-critères d'évaluation principaux étaient la proportion de patients ayant obtenu, entre l'état initial et la semaine 12, une amélioration du score PASI d'au moins 75% (réponse PASI 75) ou un score IGA (version 2011) de type «blanchi» ou «presque blanchi» (0 ou 1), avec une amélioration d'au moins 2 points.
Pendant la période de 12 semaines contrôlée contre placebo, l'efficacité de la dose faible et de la dose élevée de sécukinumab en ce qui concerne les co-critères d'évaluation principaux a été comparable. Les évaluations du rapport des cotes (odds ratio) en faveur des deux doses de sécukinumab ont été cliniquement pertinentes et statistiquement significatives pour la réponse PASI 75 et pour la réponse IGA (version 2011) de type «blanchi» ou «presque blanchi» (0 ou 1).
L'efficacité et la sécurité ont été surveillées chez tous les patients pendant 52 semaines après la première dose. La proportion de patients ayant obtenu une réponse PASI 75 et une réponse IGA (version 2011) de type «blanchi» ou «presque blanchi» (0 ou 1) présentait déjà une différence entre les groupes traités par le sécukinumab et ceux traités par placebo à la semaine 4, et la différence était plus importante à la semaine 12. La réponse s'est maintenue pendant toute la période de 52 semaines. Les scores PASI 50, PASI 90 et PASI 100 et la proportion de patients ayant des scores CDLQI (index de qualité de vie en dermatologie chez l'enfant) de 0 ou 1 se sont aussi améliorés et se sont maintenus pendant toute la période de 52 semaines.
Après la semaine 12, l'efficacité de la dose faible et de la dose élevée de sécukinumab était comparable, bien que l'efficacité de la dose élevée ait été plus importante pour les patients pesant ≥50 kg. Les profils de sécurité de la dose faible et de la dose élevée étaient comparables.
Les résultats d'efficacité à la semaine 12 sont présentés dans le tableau 5.
Tableau 5: Résumé de la réponse clinique chez des enfants et des adolescents atteints de psoriasis sévère à la semaine 12*
|
Critère de réponse
|
Comparaison des traitements
|
«Test»
|
«Contrôle»
|
Estimateur du rapport des cotes
|
| |
«Test» vs «Contrôle»
|
n/m** (%)
|
n/m** (%)
|
(odds ratio) (IC 95%)
|
Valeur de p
| |
à la semaine 12***
| |
PASI 75
|
Dose faible de sécukinumab vs placebo
|
32/40 (80,0)
|
6/41 (14,6)
|
25,78 (7,08; 114,66)
|
< 0,0001
| |
|
Dose élevée de sécukinumab vs placebo
|
31/40 (77,5)
|
6/41 (14,6)
|
22,65 (6,31; 98,93)
|
< 0,0001
| |
IGA 0/1
|
Dose faible de sécukinumab vs placebo
|
28/40 (70,0)
|
2/41 (4,9)
|
51,77 (10,02; 538,64)
|
< 0,0001
| |
|
Dose élevée de sécukinumab vs placebo
|
24/40 (60,0)
|
2/41 (4,9)
|
32,52 (6,48; 329,52)
|
< 0,0001
| |
PASI 90
|
Dose faible de sécukinumab vs placebo
|
29/40 (72,5)
|
1/41 (2,4)
|
133,67 (16,83; 6395,22)
|
<0,0001
| |
|
Dose élevée de sécukinumab vs placebo
|
27/40 (67,5)
|
1/41 (2,4)
|
102,86 (13,22; 4850,13)
|
< 0,0001
| |
* En cas de données manquantes, il y a eu imputation comme non-répondeur
** n = nombre de répondeurs, m = nombre de patients évaluables
*** Fenêtre temporelle prolongée pour les visites à la semaine 12
Le rapport des cotes (odds ratio), l'intervalle de confiance à 95% et la valeur de p sont issus d'un modèle de régression exact avec le groupe de traitement, la catégorie de poids corporel à l'état initial et la classe d'âge comme facteurs
|
Une proportion plus élevée des patients pédiatriques traités par le sécukinumab ont rapporté une amélioration de la qualité de vie liée à la santé, mesurée par un score CDLQI de 0 ou 1, comparativement aux patients sous placebo, à la semaine 12.
Psoriasis en plaques modéré à sévère
Dans une étude de phase III ouverte, à deux groupes parallèles, multicentrique, 84 patients pédiatriques âgés de 6 ans à < 18 ans atteints de psoriasis en plaques modéré à sévère (défini par un score PASI ≥12, un score IGA (version 2011 ≥3 et une surface corporelle atteinte ≥10%) pour lesquels un traitement systémique était envisageable ont été étudiés.
Ces patients ont été randomisés pour recevoir un traitement par le sécukinumab aux semaines 0, 1, 2, 3 et 4, puis la même dose toutes les 4 semaines, comme suit:
·Dose faible de sécukinumab (75 mg pour un poids corporel < 50 kg ou 150 mg pour un poids corporel ≥50 kg)
·Dose élevée de sécukinumab (75 mg pour un poids corporel < 25 kg, 150 mg pour un poids corporel compris entre ≥25 kg et < 50 kg ou 300 mg pour un poids corporel ≥50 kg)
Les co-critères d'évaluation principaux étaient la proportion de patients ayant obtenu, entre l'état initial et la semaine 12, une amélioration du score PASI d'au moins 75% (réponse PASI 75) et un score IGA (version 2011) de type «blanchi» ou «presque blanchi» (0 ou 1), avec une amélioration d'au moins 2 points.
L'efficacité de la dose faible et de la dose élevée de sécukinumab était comparable et a montré une amélioration cliniquement pertinente pour les co-critères d'évaluation principaux par comparaison historique avec le placebo.
L'efficacité a été surveillée chez tous les patients pendant au moins 24 semaines après la première administration. Une efficacité (définie par une réponse PASI 75 et une réponse IGA (version 2011) de type «blanchi» ou «presque blanchi» [0 ou 1]) a été observée dès la semaine 2. La proportion de patients ayant obtenu une réponse PASI 75 et une réponse IGA (version 2011) de type «blanchi» ou «presque blanchi» (0 ou 1) a augmenté pendant la période entière de 24 semaines. Des améliorations des scores PASI 90 et PASI 100 ont aussi été observées à la semaine 12 et ont augmenté pendant toute la période de 24 semaines.
Après la semaine 12, l'efficacité de la dose faible et de la dose élevée de sécukinumab était comparable. Les profils de sécurité de la dose faible et de la dose élevée étaient également comparables.
Les résultats d'efficacité à la semaine 12 et à la semaine 24 sont présentés dans le tableau 6.
Tableau 6: Résumé de la réponse clinique dans le psoriasis pédiatrique modéré à sévère aux semaines 12* et 24*
|
|
Semaine 12
|
Semaine 24
| |
|
Sécukinumab
dose faible
|
Sécukinumab
dose élevée
|
Sécukinumab
dose faible
|
Sécukinumab
dose élevée
| |
Nombre de patients
|
42
|
42
|
42
|
42
| |
Réponse PASI 75 n (%)
|
39 (92,9%)
|
39 (92,9%)
|
40 (95,2%)
|
40 (95,2%)
| |
Réponse IGA (version 2011) de type «blanchi» ou «presque blanchi» n (%)
|
33 (78,6%)
|
35 (83,3%)
|
37 (88,1%)
|
39 (92,9%)
| |
Réponse PASI 90 n (%)
|
29 (69,0%)
|
32 (76,2%)
|
37 (88,1%)
|
37 (88,1%)
| |
Réponse PASI 100 n (%)
|
25 (59,5%)
|
23 (54,8%)
|
28 (66,7%)
|
28 (66,7%)
| |
* En cas de données manquantes, il y a eu imputation comme non-répondeur
|
Arthrite psoriasique
Chez les patients adultes atteints d'arthrite psoriasique active, il a été démontré que Cosentyx améliore les signes et symptômes, la fonction physique et la qualité de vie liée à la santé et réduit par ailleurs le taux de progression des lésions articulaires périphériques.
La sécurité et l'efficacité de Cosentyx ont été démontrées dans trois études de phase III randomisées, en double aveugle, contrôlées contre placebo, menées auprès de 1999 patients présentant une arthrite psoriasique active (≥3 articulations enflées et ≥3 articulations douloureuses à la pression) malgré un traitement par des anti-inflammatoires non stéroïdiens (AINS), par corticoïdes ou par antirhumatismaux modificateurs de la maladie (disease-modifying anti-rheumatic drugs, DMARD). Le diagnostic d'APs remontait à au moins 5 ans chez les patients inclus dans ces études. La majorité des patients avaient en outre une lésion cutanée en raison d'un psoriasis actif ou un psoriasis documenté dans l'anamnèse. Afin d'obtenir une évaluation non biaisée de l'efficacité de Cosentyx dans le traitement du psoriasis, l'utilisation concomitante d'une thérapie par corticoïdes topiques ou à base d'UV n'était pas autorisée pendant les études. À l'inclusion, plus de 61% des patients atteints d'APs présentaient une enthésite et plus de 42% une dactylite. Le nombre de patients atteints d'APs ayant une atteinte axiale était trop faible pour établir une évaluation pertinente.
L'efficacité et la sécurité de Cosentyx à des doses de 75 mg, 150 mg et 300 mg ont été évaluées par rapport au placebo, avec une dose initiale intraveineuse ou sous-cutanée. Dans l'étude Arthrite psoriasique 1 (PsA1) et l'étude Arthrite psoriasique 2 (PsA2), ainsi que dans l'étude Arthrite psoriasique 3 (PsA3), respectivement 29%, 35% et 30% des patients avaient été traités auparavant par des médicaments anti-TNF-alpha, ce traitement ayant été arrêté en raison de l'absence de réponse ou d'une intolérance (patients anti-TNF-alpha-IR).
L'étude PsA1 (FUTURE 1) a évalué 606 patients; 60,7% d'entre eux recevaient en complément du MTX. Des patients de tous les sous-groupes d'APs ont été inclus, y compris ceux atteints d'arthrite polyarticulaire sans détection de nodules rhumatoïdes (76,7%), de spondylite accompagnée d'arthrite périphérique (18,5%), d'arthrite périphérique asymétrique (60,2%), ceux avec une atteinte interphalangienne distale (59,6%) et ceux atteints d'arthrite mutilante (7,9%). Les patients randomisés pour recevoir Cosentyx ont reçu 10 mg/kg IV aux semaines 0, 2 et 4, puis 75 mg ou 150 mg SC par mois à compter de la semaine 8. Les patients randomisés pour recevoir le placebo et n'ayant pas répondu au traitement sont passés à la semaine 16 au traitement par 75 mg ou 150 mg de Cosentyx SC une fois par mois. À la semaine 24, les derniers patients sous placebo sont passés au traitement par 75 mg ou 150 mg de Cosentyx SC. Le critère d'évaluation principal était la réponse ACR20 selon l'American College of Rheumatology (ACR) à la semaine 24.
L'étude PsA2 (FUTURE 2) a évalué 397 patients, dont 46,6% recevaient un traitement concomitant par MTX. Des patients de tous les sous-groupes d'APs ont été inclus, y compris ceux atteints d'arthrite polyarticulaire sans détection de nodules rhumatoïdes (85,9%), de spondylite accompagnée d'arthrite périphérique (21,7%), d'arthrite périphérique asymétrique (64,0%), ceux avec une atteinte interphalangienne distale (57,9%) et ceux atteints d'arthrite mutilante (6,3%). Les patients randomisés pour recevoir Cosentyx ont reçu 75 mg, 150 mg ou 300 mg SC aux semaines 0, 1, 2, 3 et 4, puis la même dose mensuellement. Les patients randomisés pour recevoir le placebo et n'ayant pas répondu au traitement jusqu'à la semaine 16 sont passés à la semaine 16 au traitement par 150 mg ou 300 mg de Cosentyx SC une fois par mois. À la semaine 24, les derniers patients sous placebo sont passés au traitement par 150 mg ou 300 mg de Cosentyx SC. Le critère d'évaluation principal était la réponse selon le critère ACR20 à la semaine 24.
L'étude PsA3 (FUTURE 5) a évalué 996 patients, dont 50,1% ont reçu un traitement concomitant par MTX. Des patients de tous les sous-groupes d'arthrite psoriasique ont été inclus, y compris ceux atteints d'arthrite polyarticulaire sans détection de nodules rhumatoïdes (78,7%), de spondylite accompagnée d'arthrite périphérique (19,8%), d'arthrite périphérique asymétrique (65,0%), ceux avec une atteinte interphalangienne distale (56,7%) et ceux atteints d'arthrite mutilante (6,8%). Les patients ont été affectés par randomisation aux groupes suivants: Cosentyx 150 mg, Cosentyx 300 mg ou placebo, respectivement SC aux semaines 0, 1, 2, 3 et 4, puis la même dose mensuellement, ou Cosentyx 150 mg une fois par mois sans dose de saturation initiale. Les patients initialement placés dans le groupe placebo et n'ayant pas répondu au traitement jusqu'à la semaine 16 sont ensuite passés au traitement par Cosentyx (soit 150 mg, soit 300 mg SC) une fois par mois à la semaine 16. À la semaine 24, les derniers patients sous placebo sont passés au traitement par Cosentyx (soit 150 mg, soit 300 mg) une fois par mois. Le critère d'évaluation principal était la réponse selon le critère ACR20 à la semaine 16, et le critère d'évaluation secondaire le plus important était la différence dans le score total de Sharp modifié (mTSS) à la semaine 24 par rapport à la situation initiale.
L'étude PsA4 (FUTURE 3) a évalué 414 patients, dont 47,6% ont reçu un traitement concomitant par MTX. Les patients affectés par randomisation au groupe de Cosentyx ont reçu 150 mg ou 300 mg SC aux semaines 0, 1, 2, 3 et 4, puis la même dose mensuellement. Les patients affectés par randomisation dans le groupe placebo et n'ayant pas répondu au traitement jusqu'à la semaine 16 sont ensuite passés à la semaine 16 au traitement par 150 mg ou 300 mg de Cosentyx SC une fois par mois. À la semaine 24, les derniers patients sous placebo sont passés au traitement par 150 mg ou 300 mg de Cosentyx SC. Le critère d'évaluation principal était la réponse selon le critère ACR20 à la semaine 24.
Réponse clinique
Signes et symptômes
Par rapport au placebo, le traitement par Cosentyx a entraîné aux semaines 16, 24 et 52 une amélioration significative au niveau de l'ampleur de l'activité de la maladie. Ces mesures ont inclus la réponse de la symptomatologie articulaire par rapport à ACR20, ACR50, ACR70, la réponse de la symptomatologie cutanée (Psoriasis Area and Severity Index, PASI) 75, PASI 90, ainsi que d'autres scores de mesure de l'activité de la maladie et de l'état de santé (Disease Activity Score, DAS28-CRP, Short Form Health Survey – Physical Component Summary; SF-36 PCS), Health Assessment Questionnaire – Disability Index, HAQ-DI) (voir tableau 7).
Tableau 7: réponse clinique dans les études PsA2 et PsA3 aux semaines 16, 24 et 52
|
|
PsA2
|
PsA3
| |
Placebo
|
150 mg1
|
300 mg1
|
Placebo
|
150 mg1
|
300 mg1
| |
Nombre de patients randomisés
|
98
|
100
|
100
|
332
|
220
|
222
| |
Réponse ACR20 n (%)
| |
Semaine 16
|
18
(18,4%)
|
60
(60,0%***)
|
57
(57,0%***)
|
91◊
(27,4%)
|
122◊
(55,5%***)
|
139◊
(62,6%***)
| |
Semaine 24
|
15◊
(15,3%)
|
51◊
(51,0%***)
|
54◊
(54,0%***)
|
78
(23,5%)
|
117
(53,2%***)
|
141
(63,5%***)
| |
Semaine 52
|
-
|
64
(64,0%)
|
64
(64,0%)
|
NA
|
NA
|
NA
| |
Réponse ACR50 n (%)
| |
Semaine 16
|
6
(6,1%)
|
37
(37,0%***)
|
35
(35,0%***)
|
27
(8,1%)
|
79
(35,9%***)
|
88
(39,6%***)
| |
Semaine 52
|
-
|
39
(39,0%)
|
44
(44,0%)
|
NA
|
NA
|
NA
| |
Réponse ACR70 n (%)
| |
Semaine 16
|
2
(2,0%)
|
17
(17,0%**)
|
15
(15,0%**)
|
14
(4,2%)
|
40
(18,2%***)
|
45
(20,3%***)
| |
Semaine 52
|
-
|
20
(20,0%)
|
24
(24,0%)
|
NA
|
NA
|
NA
| |
DAS28-CRP
| |
Semaine 16
|
-0,50
|
-1,45***
|
-1,51***
|
-0,63
|
-1,29***
|
-1,49***
| |
Semaine 52
|
-
|
-1,69
|
-1,78
|
NA
|
NA
|
NA
| |
Réponse PASI 75 n (%)
| |
Semaine 16
|
3
(7,0%)
|
33
(56,9%***)
|
27
(65,9%***)
|
20
(12,3%)
|
75
(60,0%***)
|
77
(70,0%***)
| |
Semaine 52
|
-
|
33
(56,9%)
|
30
(73,2%)
|
-
|
-
|
-
| |
Réponse PASI 90 n (%)
| |
Semaine 16
|
3
(7,0%)
|
22
(37,9%***)
|
18
(43,9%***)
|
15
(9,3%)
|
46
(36,8%***)
|
59
(53,6%***)
| |
Semaine 52
|
-
|
25
(43,1%)
|
23
(56,1%)
|
-
|
-
|
-
| |
Disparition des dactylites n (%)†
| |
Semaine 16
|
10
(37%)
|
21
(65,6%*)
|
26
(56,5%)
|
40
(32,3%)
|
46
(57,5%***)
|
54
(65,9%***)
| |
Semaine 52
|
-
|
21
(65,6%)
|
32
(69,6%)
|
NA
|
NA
|
NA
| |
Disparition des enthésites n (%)‡
| |
Semaine 16
|
17
(26,2%)
|
32
(50,0%**)
|
32
(57,1%***)
|
68
(35,4%)
|
77
(54,6%***)
|
78
(55,7%***)
| |
Semaine 52
|
-
|
31
(48,4%)
|
30
(53,6%)
|
NA
|
NA
|
NA
| |
* p < 0,05, ** p < 0,01, *** p < 0,001; par rapport au placebo
Toutes les valeurs de p sont présentées sans correction pour les tests multiples.
Les patients dont les critères d'évaluation binaires sont manquants ont été comptés comme non répondeurs («Nonresponder Imputation»).
NA: non disponible (Not Available); ACR: American College of Rheumatology; PASI: Psoriasis Area and Severity Index; DAS: Disease Activity Score; BSA: surface corporelle (Body Surface Area, BSA)
◊ Critère d'évaluation principal
1 Cosentyx 150 mg ou 300 mg SC aux semaines 0, 1, 2, 3 et 4, puis la même dose mensuellement.
† Chez les patients atteints de dactylite en situation initiale (respectivement n = 27, 32 et 46 dans PsA2 et n = 124, 80 et 82 dans PSA3) Une disparition complète de la dactylite a été évaluée dans le sous-groupe des patients atteints de dactylite en situation initiale et est exprimée comme proportion de patients avec une valeur de Leeds Dactylitis Index (LDI) de 0.
‡ Chez les patients atteints d'enthésite en situation initiale (respectivement n = 65, 64 et 56 dans PsA2 et n = 192, 141 et 140 dans PsA3) Une disparition complète de l'enthésite a été évaluée dans le sous-groupe des patients atteints d'enthésite en situation initiale et est exprimée comme proportion de patients avec une valeur de Leeds Enthesitis Index (LEI) de 0.
|
L'effet de Cosentyx s'est déclaré à la semaine 2. Une différence statistiquement significative au niveau de l'ACR20 par rapport au placebo a été obtenue à la semaine 3. Dans l'étude PsA2, l'efficacité a été maintenue jusqu'à la semaine 104 (64,4% et 69,4% pour 150 mg et 300 mg respectivement).
À la semaine 16, les patients traités par Cosentyx ont présenté une amélioration significative des signes et symptômes, notamment une réponse significativement supérieure au niveau de l'ACR20 (60,0% et 57,0% pour respectivement 150 mg et 300 mg) par rapport au placebo (18,4%).
Le pourcentage de patients par consultation présentant une réponse ACR20 est représenté à la figure 1.
Figure 1: Réponse ACR20 dans l'étude PsA2 au fil du temps jusqu'à la semaine 24
Pour le critère d'évaluation principal et les critères secondaires importants, on a observé chez les patients atteints d'APs une réponse similaire indépendamment du fait qu'ils aient reçu en même temps du MTX ou pas.
Les patients non traités par anti-TNF-alpha comme les patients anti-TNF-alpha-IR traités par Cosentyx ont présenté aux semaines 16 et 24, par rapport au placebo, une réponse ACR20 significativement plus élevée, la réponse étant cependant numériquement plus élevée dans le groupe n'ayant pas été traité par anti-TNF-alpha (non traités par anti-TNF-alpha dans PsA2: 64% et 58% sous respectivement 150 mg et 300 mg, par rapport à 15,9% pour le placebo; Anti-TNF-alpha-IR: 30% et 46% sous respectivement 150 mg et 300 mg par rapport à 14,3% pour le placebo).
Par rapport aux patients sous placebo, les patients anti-TNF-alpha-IR traités par une dose de 300 mg ont présenté un taux de réponse ACR20 supérieur (p < 0,05) et un bénéfice cliniquement significatif par rapport au groupe à 150 mg pour ACR50, PASI 75, PASI 90, HAQ-DI, la dactylite et l'enthésite.
La proportion de patients dans PsA2 ayant obtenu une réponse modifiée selon les critères PsA Response Criteria (PsARC) à la semaine 24 était plus élevée dans le groupe traité par Cosentyx (59,0% et 61,0% sous respectivement 150 mg et 300 mg) que dans celui traité par placebo (26,5%).
Les résultats des composantes des critères ACR de la réponse sont présentés dans le tableau 8.
Tableau 8: Différence des moyennes des composantes du score ACR par rapport à la situation initiale dans l'étude PsA2 à la semaine 24
|
|
Placebo
(N = 98)
|
150 mg
(N = 100)
|
300 mg
(N = 100)
| |
Nombre d'articulations enflées
| |
Situation initiale
|
12,1
|
11,9
|
11,2
| |
Différence
|
-5,14
|
-6,32
|
-7,28*
| |
Nombre d'articulations sensibles à la pression
| |
Situation initiale
|
23,4
|
24,1
|
20,2
| |
Différence
|
-4,28
|
-11,42***
|
-10,84**
| |
Évaluation de la douleur par le patient
| |
Situation initiale
|
55,4
|
58,9
|
57,7
| |
Différence
|
-11,71
|
-23,39**
|
-22,35**
| |
Évaluation globale par le patient
| |
Situation initiale
|
57,6
|
62,0
|
60,7
| |
Différence
|
-10,14
|
-25,78***
|
-26,70***
| |
Évaluation globale par le médecin
| |
Situation initiale
|
55,0
|
56,7
|
55,0
| |
Différence
|
-25,23
|
-32,97*
|
-38,52***
| |
Indice d'incapacité (HAQ)
| |
Situation initiale
|
1,1684
|
1,2200
|
1,2828
| |
Différence
|
-0,31
|
-0,48*
|
-0,56**
| |
CRP (mg/dl)
| |
Situation initiale
|
7,71
|
14,15
|
10,69
| |
hsCRP, (rapport post-BSL/BSL)
|
0,75
|
0,55*
|
0,55*
| |
* p < 0,05, ** p < 0,01, *** p < 0,001 sur la base de la valeur p nominale, mais non ajustée
|
Dans l'étude PsA1, les patients traités par Cosentyx ont présenté à la semaine 24 des signes et symptômes d'APs significativement améliorés pour une réponse similaire à celle de l'étude PsA2. L'efficacité s'est maintenue jusqu'à la semaine 104.
Réponse radiographique
Dans l'étude PsA3, les lésions structurelles ont été évaluées par radiographie et exprimées sous la forme du score total de Sharp modifié (mTSS) et de ses composantes, le score d'érosion (Erosion score, ES) et le score de pincement articulaire (Joint Space Narrowing, JSN). Des radiographies des mains, des poignets et des pieds ont été effectuées en situation initiale, à la semaine 16 et/ou à la semaine 24, et évaluées indépendamment les unes des autres par au moins deux évaluateurs qui étaient aveugles en termes de groupe de traitement et de numéro de la visite.
Le traitement par Cosentyx 150 mg et 300 mg a entraîné une réduction significative du taux de progression des lésions articulaires périphériques, évalué au moyen de la modification du mTSS à la semaine 24 par rapport à la situation initiale, par rapport au traitement par placebo (tableau 9).
Le pourcentage des patients sans progression de la maladie (défini comme une modification du mTSS de ≤0,5) de la randomisation jusqu'à la semaine 24 était de 79,8%, 88,0% et 73,6% pour Cosentyx 150 mg, 300 mg et placebo, respectivement. Une inhibition des lésions structurelles a été constatée indépendamment d'une éventuelle utilisation concomitante du MTX ou du statut de TNF.
Grâce au traitement par Cosentyx 150 mg, un taux significativement réduit de progression des lésions articulaires périphériques a été obtenu jusqu'à la semaine 24 par rapport au traitement par placebo. Celui-ci a été évalué au moyen de la modification du mTSS par rapport à la situation initiale (voir tableau 9). L'inhibition des lésions structurelles a été maintenue jusqu'à la semaine 52 sous le traitement par Cosentyx.
Tableau 9: Modification du score total de Sharp modifié dans les études PsA3 et PsA1
|
|
PsA3
| |
|
Placebo
n = 296
|
150 mg1
n = 213
|
300 mg1
n = 217
| |
Score total
| |
Situation initiale
|
15,0
|
13,6
|
12,9
| |
(SD)
|
(38,2)
|
(25,9)
|
(23,7)
| |
Modification moyenne à la semaine 24
|
0,5
|
0,17*
|
0,08*
| |
* p < 0,05, sur la base de la valeur de p nominale qui n'a pas été corrigée en termes de multiplicité des tests.
1 Cosentyx 150 mg ou 300 mg SC aux semaines 1, 2, 3 et 4, puis même dose mensuellement.
|
Manifestations axiales dans l'APs
Une étude randomisée, en double aveugle et contrôlée contre placebo (MAXIMISE) a évalué l'efficacité du sécukinumab chez 485 patients atteints d'APs présentant une manifestation axiale, qui n'avaient pas été traités précédemment par des médicaments biologiques et qui avaient présenté une réponse insuffisante aux anti-inflammatoires non stéroïdiens (AINS). La variable principale d'une amélioration des critères ASAS 20 (Assessment of Spondyloarthritis International Society, ASAS) d'au moins 20% à la semaine 12 a été atteinte (voir tableau 10).
Tableau 10: Réponse clinique dans l'étude MAXIMISE à la semaine 12
|
|
Placebo
(n = 164)
|
150 mg
(n = 157)
|
300 mg
(n = 164)
| |
Réponse ASAS 20, % (IC à 95%)
|
31,2 (24,6; 38,7)
|
66,3 (58,4; 73,3)*
|
62,9 (55,2; 70,0)*
| |
* p < 0,0001; par rapport au placebo et en utilisant l'imputation multiple.
ASAS: Assessment of SpondyloArthritis International Society Criteria.
|
Une amélioration de la réponse ASAS 20 pour les deux doses de sécukinumab a été observée à la semaine 4 et a été maintenue jusqu'à la semaine 52
Fonction physique et qualité de vie liée à la santé
Dans l'étude PsA2 et dans l'étude PsA3, les patients traités par Cosentyx 150 mg et 300 mg ont montré respectivement à la semaine 24 et à la semaine 16 une amélioration de la fonction physique par rapport aux patients traités par placebo, mesurée au moyen du Health Assessment Questionnaire – Disability Index (HAQ-DI). Les améliorations des résultats du HAQ-DI ont été observées indépendamment d'une exposition précédente aux anti-TNF-alpha. Des résultats similaires ont été observés dans l'étude PsA1.
Les patients traités par Cosentyx ont fait état d'améliorations sensibles de la qualité de vie liée à la santé, mesurée au moyen du Short Form (36) Health Survey – Physical Component Summary (SF-36 PCS) (p < 0,001). Il y a aussi eu des améliorations statistiquement significatives au niveau du score FACIT-F (Functional Assessment of Chronic Illness Therapy – Fatigue) pour 150 mg et 300 mg par rapport au placebo à la semaine 24 (p < 0,01), et ces améliorations ont été maintenues dans l'étude PsA2 jusqu'à la semaine 104.
Augmentation de la dose à 300 mg chez les patients présentant une réponse insatisfaisante à 150 mg.
Les études PsA1, PsA2 et PsA4 ont généré des données pouvant être évaluées concernant l'augmentation de la dose de 150 mg à 300 mg de 159 patients qui avaient répondu de manière insatisfaisante après 92 à 156 semaines. Cela correspond à 21,1% des patients qui font encore partie des études. Après l'augmentation de la dose de sécukinumab de 150 mg à 300 mg, une amélioration des taux de réponse ACR et PASI et une réduction de la proportion des patients non répondants (< ACR20; < PASI 75) ont été observées.
Spondylarthrite axiale (axSpA)
Spondylarthrite ankylosante (maladie de Bechterew)
La sécurité et l'efficacité de Cosentyx ont été démontrées dans deux études de phase III randomisées, en double aveugle et contrôlées contre placebo menées auprès de 590 patients qui, malgré un traitement par des anti-inflammatoires non stéroïdiens (AINS), corticoïdes ou antirhumatismaux modificateurs de la maladie (disease-modifying anti-rheumatic drugs, DMARD), présentaient une spondylarthrite ankylosante (SA) active, l'activité de la maladie étant définie comme un indice Bath Ankylosing Spondylitis Disease Activity Index (BASDAI) ≥4. La SA des patients participant à ces études était diagnostiquée en moyenne depuis 2,7 à 5,8 ans. Les patients présentant une ankylose complète étaient exclus.
Pour les deux études, le critère d'évaluation principal était une amélioration d'au moins 20% selon les critères de l'Assessment of Spondyloarthritis International Society (réponse ASAS 20) à la semaine 16.
Dans les études 1 et 2 sur la spondylarthrite ankylosante (études AS1 et AS2), respectivement 27,0% et 38,8% des patients avaient été traités auparavant par des anti-TNF-alpha, le traitement ayant été arrêté en raison de l'absence de réponse ou d'une intolérance (patients anti-TNF-alpha-IR).
L'étude AS1 (MEASURE 1) a évalué 371 patients; parmi eux, 14,8%, 33,4% et 13,5% ont reçu en même temps respectivement du MTX, de la sulfasalazine ou des corticoïdes. Les patients randomisés pour recevoir Cosentyx ont reçu 10 mg/kg IV aux semaines 0, 2 et 4, puis 75 mg ou 150 mg SC une fois par mois. Les patients randomisés pour recevoir le placebo et n'ayant pas répondu à la semaine 16, ainsi que, à la semaine 24, tous les autres patients sous placebo, sont passés au traitement par 75 mg ou 150 mg de Cosentyx SC une fois par mois.
L'étude AS2 (MEASURE 2) a évalué 219 patients, dont 11,9%, 14,2% et 8,2% recevaient respectivement un traitement concomitant par MTX, sulfasalazine ou corticoïdes. Les patients randomisés pour recevoir Cosentyx ont reçu 75 mg ou 150 mg SC aux semaines 0, 1, 2, 3 et 4, puis la même dose mensuellement. Les patients randomisés initialement pour recevoir le placebo ont été randomisés à nouveau à la semaine 16 pour recevoir Cosentyx SC une fois par mois (75 mg ou 150 mg).
Réponse clinique
Signes et symptômes
Dans l'étude AS2, c'est à la semaine 16 que le traitement par Cosentyx 150 mg a entraîné l'amélioration la plus notable des paramètres de mesure de l'activité de la maladie par rapport au placebo (voir tableau 8).
Tableau 11: Réponse clinique dans l'étude AS2 à la semaine 16
|
Résultat (valeur de p par rapport au placebo)
|
Placebo
(n = 74)
|
75 mg
(n = 73)
|
150 mg
(n = 72)
| |
Efficacité à la semaine 16
| |
Réponse ASAS 20, %
|
28,4
|
41,1
|
61,1***
| |
Réponse ASAS 40, %
|
10,8
|
26,0
|
36,1***
| |
hsCRP, (rapport post-BSL/BSL)#
|
1,13
|
0,61
|
0,55***
| |
ASAS 5/6, %
|
8,1
|
34,2
|
43,1***
| |
BASDAI, variation moyenne des MC depuis valeur initiale†
|
-0,85
|
-1,92
|
-2,19***
| |
ASAS, rémission partielle, %
|
4,1
|
15,1
|
13,9
| |
BASDAI 50, %
|
10,8
|
24,7*
|
30,6**
| |
ASDAS-CRP «major improvement»ˆ
|
4,1
|
15,1*
|
25,0***
| |
* p < 0,05; ** p < 0,01; *** p < 0,001 par rapport au placebo
Toutes les valeurs de p ont été ajustées pour la multiplicité des tests sur la base d'une hiérarchie prédéfinie, à l'exception de BASDAI 50 et ASDAS-CRP.
Les patients non répondeurs ont été ajoutés pour le critère d'évaluation binaire manquant.
ASAS: Assessment of SpondyloArthritis International Society Criteria; BASDAI: Bath Ankylosing Spondylitis Disease Activity Index; hsCRP: high sensitivity C-reactive protein (dosage de la CRP ultrasensible); ASDA: Ankylosing Spondylitis Disease Activity Score; BSL: baseline (inclusion); MC: moindres carrés
# Les moyennes initiales de hsCRP sont 8,30, 5,30 et 8,40
† Les moyennes initiales de BASDAI sont 6,78, 6,57 et 6,59
ˆ ASDAS-CRP «major improvement» définie comme une amélioration ≥2 unités
|
À la semaine 16, le traitement par Cosentyx 150 mg a entraîné des améliorations cliniquement pertinentes de toutes les composantes des critères de réponse ASAS 20 (évaluation globale par le patient, douleurs globales de la colonne vertébrale, BASFI et inflammation spinale) par rapport à la situation initiale.
Dans l'étude AS2, le traitement par Cosentyx 150 mg a déjà entraîné une amélioration significative de l'ASAS 20 1 semaine après le début du traitement, par rapport au placebo. La proportion de patients présentant une réponse ASAS 20 par visite est présentée à la figure 2.
Figure 2: Réponse ASAS 20 dans l'étude AS2 jusqu'à la semaine 16
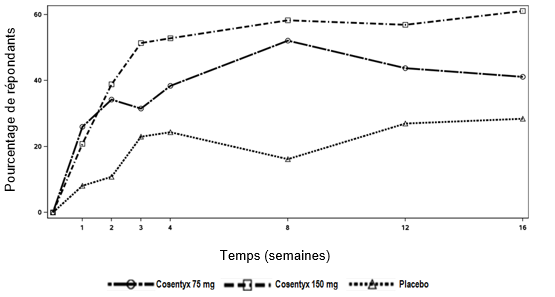
La réponse ASAS 20 à la semaine 16 chez les patients naïfs d'anti-TNFalpha (68,2% contre 31,1%; p < 0,05) comme chez les patients anti-TNF-alpha-IR (50,0% contre 24,1%; p < 0,05) était supérieure sous Cosentyx 150 mg par rapport au placebo. La réponse ASAS 20 au niveau du statut HLA-B27 a été analysée dans l'étude AS2. 57/72 patients (79%) sous 150 mg et 58/74 patients (78%) sous placebo étaient HLA-B27 positifs. HLA-B27 n'était pas disponible pour 3 patients du groupe 150 mg et 5 patients du groupe placebo.
Parmi les patients présentant des valeurs ASAS 20 mesurables, l'ASAS 20 pour la cohorte 150 mg à la semaine 16 était de 37/54 (68,5%) pour les patients HLA-B27 positifs et de 5/9 (55,6%) pour les patients HLA-B27 négatifs. Pour le placebo, l'ASAS 20 à la semaine 16 était de 18/51 (35,3%) pour les patients HLA-B27 positifs et de 3/8 (37,5%) pour les patients HLA-B27 négatifs.
La réponse s'est maintenue jusqu'à la semaine 52 dans un ordre de grandeur comparable dans les deux études sous Cosentyx/- SensoReady. Sur les 72 patients randomisés pour recevoir Cosentyx 150 mg dans l'étude AS2, 61 (84,7%) suivaient encore le traitement à la semaine 52. Respectivement 45 et 35 patients présentaient une réponse ASAS 20/40.
Mobilité spinale
La mobilité de la colonne vertébrale a été évaluée au moyen de l'indice BASMI (Bath Ankylosing Spondylitis Metrology Index) jusqu'à la semaine 52. Dans les études AS2 (150 mg) et AS1 (75 mg et 150 mg), chaque composante de BASMI chez les patients traités par Cosentyx, par rapport à ceux traités par placebo, a présenté des améliorations numériques aux semaines 4, 8, 12 et 16 (à l'exception de la flexion lombaire latérale aux semaines 4, 8 et 12 chez les patients traités à une dose de 75 mg après une dose initiale intraveineuse).
Fonction physique et qualité de vie liée à la santé
Dans les études AS1 et AS2, les patients traités par Cosentyx 150 mg ont présenté une amélioration de la qualité de vie liée à la santé, mesurée au moyen de l'ASQoL (Ankylosing Spondylitis Quality of Life questionnaire) (p < 0,001) et du SF-36 Physical Component Summary (SF-36 PCS) (p < 0,001). Par rapport au placebo, les patients traités par Cosentyx 150 mg ont aussi présenté des améliorations significatives au niveau des critères d'évaluation exploratoires en ce qui concerne la fonction physique mesurée au moyen de l'indice BASFI (Bath Ankylosing Spondylitis Functional Index), en ce qui concerne les douleurs mesurées au moyen de l'échelle des douleurs dorsales globales et nocturnes (Total and Nocturnal Back Pain) ainsi qu'en ce qui concerne l'épuisement mesuré au moyen de l'échelle FACIT-F (Functional Assessment of Chronic Illness Therapy – Fatigue). Toutes ces améliorations de la fonction physique se sont maintenues jusqu'à la semaine 52.
Spondylarthrite non radiographique (nr-axSpA)
La sécurité et l'efficacité du sécukinumab ont été analysées dans le cadre d'une étude de phase III randomisée, en double aveugle, contrôlée contre placebo portant sur 555 patients atteints de spondylarthrite axiale non radiographique (nr-axSpA) active répondant aux critères de classification de l'ASAS (Assessment of SpondyloArthritis international Society) concernant la spondylarthrite axiale (axSpA) sans preuve radiographique de modifications de l'articulation sacro-iliaque conformes aux critères de New York modifiés de la spondylarthrite ankylosante (SA). Les patients inclus dans l'étude présentaient une activité de la maladie ≥4 telle que définie par l'indice BASDAI (Bath Ankylosing Spondylitis Disease Activity Index), un niveau de douleur total sur l'échelle visuelle analogique (EVA) ≥40 pour la dorsalgie (sur une échelle de 0–100 mm), malgré un traitement actuel ou antérieur par des anti-inflammatoires non stéroïdiens (AINS), une élévation du taux de protéine C-réactive (CRP) et/ou des signes de sacro-iliite à l'imagerie par résonance magnétique (IRM). Chez les patients de cette étude, le diagnostic d'axSpA avait été posé en moyenne 2,1 à 3,0 ans auparavant et 54% des participants à l'étude étaient des femmes.
Dans l'étude nr-axSpA 1, 9,7% des patients avaient précédemment déjà été traités par un inhibiteur du TNFα qui avait été arrêté en raison d'un manque d'efficacité ou d'une intolérance (patients anti-TNFα-IR).
Dans l'étude nr-axSpA 1 (PREVENT), 555 patients ont été évalués, dont 9,9% et 14,8% respectivement étaient traités par MTX ou sulfasalazine en concomitance. Pendant la phase en double aveugle, les patients ont reçu un placebo ou du sécukinumab pendant 52 semaines. Les patients randomisés dans le groupe sécukinumab ont reçu 150 mg par voie sous-cutanée aux semaines 0, 1, 2, 3 et 4, puis la même dose à intervalles mensuels ou une injection mensuelle de 150 mg de sécukinumab. Le critère d'évaluation principal consistait en une amélioration d'au moins 40% selon les critères de l'Assessment of Spondyloarthritis International Society (réponse ASAS 40) à la semaine 16 chez les patients naïfs de TNFα.
Signes cliniques
Signes et symptômes:
Dans l'étude nr-axSpA 1, le traitement par 150 mg de sécukinumab a entraîné à la semaine 16 une amélioration significative des paramètres d'activité de la maladie par rapport au placebo. Ces paramètres englobent la réponse ASAS 40, ASAS 5/6, l'indice BASDAI, BASDAI 50, la CRP ultrasensible (hsCRP), la réponse ASAS 20 et la rémission partielle selon l'ASAS en comparaison avec le placebo à la semaine 16 (tableau 12).
Tableau 12: Réponse clinique dans le cadre de l'étude nr-axSpA 1 à la semaine 16
|
Résultat (valeur de p par rapport au placebo)
|
Placebo
|
150 mg1
| |
Nombre de patients naïfs de l'anti-TNFα randomisés
|
171
|
164
| |
Réponse ASAS 40, %
|
29,2%
|
41,5%*
| |
Nombre total de patients randomisés
|
186
|
185
| |
Réponse ASAS 40, %
|
28,0%
|
40,0%*
| |
ASAS 5/6, %
|
23,7%
|
40,0%**
| |
BASDAI, variation moyenne des MC par rapport à la valeur initiale
|
-1,46
|
-2,35**
| |
BASDAI 50, %
|
21,0%
|
37,3%**
| |
hsCRP (rapport post-BSL/BSL)
|
0,91
|
0,64**
| |
Réponse ASAS 20, %
|
45,7%
|
56,8%*
| |
ASAS, rémission partielle, %
|
7,0%
|
21,6%**
| |
* p < 0,05; ** p < 0,001 par rapport au placebo
Toutes les valeurs de p ont subi un ajustement pour la multiplicité des tests sur la base d'une hiérarchie prédéfinie. En cas de données manquantes pour un critère d'évaluation binaire, les patients ont été imputés comme non répondeurs.
1 Dose de 150 mg de sécukinumab SC aux semaines 0, 1, 2, 3 et 4, puis dose identique à intervalles mensuels
ASAS: Assessment of SpondyloArthritis International Society Criteria; BASDAI: Bath Ankylosing Spondylitis Disease Activity Index; hsCRP: high sensitivity C-reactive protein (dosage de la CRP ultrasensible); BSL: baseline (inclusion); MC: moindres carrés
|
Lors d'une analyse exploratoire, les patients qui présentaient un taux de CRP anormal et des signes d'inflammation à l'IRM au début de l'étude ont tiré le plus grand bénéfice du sécukinumab.
Dans l'étude nr-axSpA 1, l'effet d'une dose de 150 mg de sécukinumab a été observé dès la semaine 3 chez les patients naïfs de l'anti-TNF-alpha en ce qui concerne la réponse ASAS 40 (supérieure par rapport au placebo). Le pourcentage de patients naïfs de l'anti-TNF-alpha obtenant une réponse ASAS 40 est présenté à la figure 3 au fil des visites. Les patients traités par sécukinumab ont continué à montrer, en comparaison avec le placebo, une réponse jusqu'à la semaine 52.
Figure 3: Réponse ASAS 40 de patients naïfs de l'anti-TNFα dans l'étude nr-axSpA 1 au fil du temps jusqu'à la semaine 16
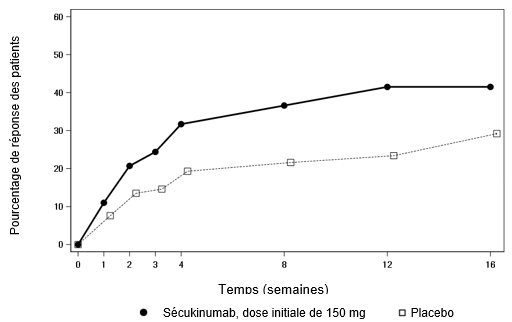
Lors d'une analyse exploratoire des 54 patients ayant reçu un traitement anti-TNF antérieur, une réponse a été observée chez 6 patients sur 21 sous Cosentyx et chez 2 patients sur 15 sous placebo à la semaine 16.
Fonction physique et qualité de vie liée à la santé:
Les patients traités par 150 mg de sécukinumab ont présenté des améliorations statistiquement significatives par rapport au groupe placebo jusqu'à la semaine 16 en ce qui concerne la fonction physique, évaluée à l'aide de l'indice BASFI (semaine 16: -1,75 vs -1,01, p < 0,01). Les patients traités par sécukinumab ont rapporté des améliorations significatives de la qualité de vie liée à la santé, mesurées à l'aide du questionnaire ASQoL (variation moyenne des MC: semaine 16: -3,45 vs -1,84, p < 0,001) et du score global de la composante physique du SF-36 (SF-36 PCS) (variation moyenne des MC: semaine 16: 5,71 vs 2,93, p < 0,001), à la semaine 16 par rapport au groupe placebo. Ces améliorations se sont maintenues jusqu'à la semaine 52.
Inhibition de l'inflammation à l'imagerie par résonance magnétique (IRM):
Les signes d'inflammation ont été évalués par IRM à l'inclusion et à la semaine 16 et exprimés comme la variation du score de Berlin de l'œdème de l'articulation SI pour l'articulation sacro-iliaque ainsi que du score ASspiMRI-a et du score de Berlin de la colonne vertébrale pour la colonne. Chez les patients traités par sécukinumab, on a observé une réduction des signes d'inflammation, tant dans l'articulation sacro-iliaque que dans la colonne vertébrale. La variation moyenne par rapport à l'inclusion du score de Berlin de l'œdème de l'articulation SI était de -1,68 chez les patients traités par 150 mg de sécukinumab (n = 180) contre -0,39 chez ceux traités par le placebo (n = 174) (p < 0,0001).
PharmacocinétiqueAbsorption
Les données citées dans cette rubrique sont basées sur une analyse pharmacocinétique de population.
Après administration sous-cutanée d'une dose unique de 150 mg ou de 300 mg sous forme de 2 injections de 150 mg à des patients atteints de psoriasis en plaques, le sécukinumab a atteint des pics de concentrations sériques de 13,7 ± 4,8 µg/ml pour la dose de 150 mg et 27,3 ± 9,5 µg/ml pour la dose de 300 mg, et ce, 5 à 6 jours après l'administration.
Après l'instauration d'une dose hebdomadaire durant le premier mois, le temps requis pour atteindre une concentration maximale était de 31 à 34 jours.
Les concentrations maximales à l'état d'équilibre (Cmax,ss) après administration sous-cutanée de 150 mg ou de 300 mg s'élevaient respectivement à 27,6 µg/ml et 55,2 µg/ml. Avec un schéma d'administration mensuelle, l'état d'équilibre est atteint après 20 semaines.
Après administration mensuelle répétée durant la phase d'entretien, les patients présentaient une augmentation de pics de concentrations sériques deux fois supérieure à celle observée après administration d'une dose unique.
Après injection sous-cutanée au niveau du ventre, le sécukinumab est absorbé avec une biodisponibilité absolue moyenne de 73%. L'absorption du sécukinumab après injection sous-cutanée dans le bras ou la cuisse n'a pas été étudiée.
Chez les patients atteints de psoriasis en plaques, l'exposition systémique au sécukinumab après une injection sous-cutanée unique de 300 mg de solution injectable en seringue préremplie était similaire à l'exposition observée précédemment après deux injections de 150 mg.
Distribution
Le volume de distribution moyen durant la phase finale (Vz) après administration d'une dose unique par intraveineuse chez les patients atteints de psoriasis en plaques variait entre 7,10 et 8,60 litres, ce qui laisse supposer que le sécukinumab est soumis à une distribution limitée dans les compartiments périphériques.
Une et deux semaines après l'administration sous-cutanée d'une dose unique de 300 mg de sécukinumab (sous forme de deux injections de 150 mg), les concentrations de sécukinumab dans le liquide interstitiel de la peau chez les patients atteints de psoriasis en plaques se situaient entre 28% et 39% de la concentration sérique.
Métabolisme
Aucune information.
Élimination
La clairance systémique moyenne chez les patients atteints de psoriasis en plaques s'élevait à 0,19 l/jour. Comme on pouvait s'y attendre avec un anticorps IgG1 monoclonal thérapeutique qui interagit avec une cytokine cible soluble telle que l'IL-17A, la clairance était indépendante de la dose et du temps.
La demi-vie d'élimination moyenne estimée chez les patients atteints de psoriasis en plaques est de 27 jours. Chez certains patients atteints de psoriasis en plaques, la demi-vie estimée se situait entre 17 et 41 jours.
Linéarité/non-linéarité
La pharmacocinétique (PK) du sécukinumab après administration unique et multiple chez des patients atteints de psoriasis en plaques a été déterminée dans le cadre de plusieurs études avec des doses administrées par intraveineuse allant de 1 × 0,3 mg/kg à 3 × 10 mg/kg, ainsi que des doses administrées par voie sous-cutanée allant de 1 × 25 mg à des doses multiples de 300 mg. L'exposition était proportionnelle à la dose pour tous les schémas de posologie.
Les propriétés PK du sécukinumab observées chez des patients atteints d'arthrite psoriasique et de spondylarthrite axiale (spondylarthrite ankylosante et spondylarthrite axiale non radiographique) étaient similaires à celles observées chez les patients atteints de psoriasis en plaques.
Troubles de la fonction hépatique / Troubles de la fonction rénale
Aucune donnée pharmacocinétique n'est disponible chez les patients atteints d'insuffisance rénale ou hépatique.
Patients âgés
Parmi les 3430 patients atteints de psoriasis en plaques ayant été exposés au sécukinumab dans le cadre d'études cliniques, 230 patients au total étaient âgés de 65 ans ou plus et 32 patients avaient 75 ans ou plus.
Parmi les 2536 patients atteints d'arthrite psoriasique ayant été exposés à Cosentyx dans le cadre d'études cliniques, 236 patients au total étaient âgés de 65 ans ou plus et 25 patients avaient 75 ans ou plus.
Parmi les 571 patients atteints de spondylarthrite ankylosante ayant été exposés à Cosentyx dans le cadre d'études cliniques, 24 patients au total étaient âgés de 65 ans ou plus et 3 patients avaient 75 ans ou plus.
Parmi les 524 patients atteints de spondylarthrite axiale non radiographique ayant reçu Cosentyx dans le cadre d'études cliniques, 9 patients étaient âgés de 65 ans ou plus et 2 patients avaient 75 ans ou plus.
Selon une analyse pharmacocinétique de population, la clairance chez les patients âgés était similaire à celle des patients de moins de 65 ans.
Patients pédiatriques
Dans le cadre du regroupement des deux études pédiatriques, les patients atteints de psoriasis en plaques modéré à sévère (âgés de 6 à < 18 ans) ont reçu du sécukinumab selon le schéma posologique pédiatrique recommandé. À la semaine 24, les patients ayant un poids corporel ≥25 et < 50 kg présentaient une concentration minimale à l'état d'équilibre moyenne (± écart type) de 19,8 ± 6,96 µg/ml (n = 24) après administration de 75 mg de sécukinumab. Les patients ayant un poids corporel ≥50 kg présentaient une concentration minimale à l'état d'équilibre moyenne de 27,3 ± 10,1 µg/ml (n = 36) après administration de 150 mg de sécukinumab. La concentration minimale à l'état d'équilibre moyenne (± écart type) pour les patients pesant < 25 kg (n = 8) était de 32,6 ± 10,8 µg/ml à la semaine 24 après administration de la dose de 75 mg. La biodisponibilité du sécukinumab chez les patients pédiatriques est supérieure d'environ 26% à celle des adultes.
Données précliniquesLes données précliniques issues de tests de réactivité croisée tissulaire, d'études de pharmacologie de sécurité, de toxicologie en administration répétée et de toxicité sur la reproduction réalisés avec le sécukinumab ou avec un anticorps murin dirigé contre l'IL-17A murine n'ont révélé aucun risque particulier pour l'homme.
Dans la mesure où le sécukinumab se lie à l'IL-17A du singe cynomolgus et de l'homme, sa sécurité d'emploi a été étudiée chez des singes cynomolgus.
Toxicité à long terme (ou toxicité en cas d'administration répétée)
Aucun effet indésirable n'a été observé après administration sous-cutanée du sécukinumab à des singes cynomolgus pendant une période allant jusqu'à 13 semaines et après administration par intraveineuse jusqu'à 26 semaines (y compris lors des évaluations pharmacocinétiques, pharmacodynamiques, de l'immunogénicité et de l'immunotoxicité [par exemple: réponse immunitaire dépendante des cellules T et activité des cellules NK]). Les concentrations sériques moyennes observées chez les singes après l'administration sous-cutanée de 13 doses hebdomadaires de 150 mg/kg sont 48 fois plus élevées que les concentrations sériques moyennes supposées attendues chez les patients atteints de psoriasis à la dose clinique la plus élevée. Le facteur d'accroissement de l'exposition est encore plus élevé si l'on prend en compte la concentration sérique moyenne de l'étude toxicologique réalisée par intraveineuse durant 26 semaines chez des singes cynomolgus. Des anticorps dirigés contre le sécukinumab ont été décelés chez un seul des 101 animaux. Aucune réactivité croisée tissulaire non spécifique n'a été démontrée après application du sécukinumab sur des tissus humains sains.
Mutagénicité/Carcinogénicité
Aucune étude préclinique n'a été réalisée pour évaluer le potentiel carcinogène ou mutagène du sécukinumab.
Toxicité sur la reproduction
Une étude du développement embryo-fœtal menée chez le singe cynomolgus a démontré que le sécukinumab n'avait aucun effet maternotoxique, embryotoxique ou tératogène lorsqu'il était administré durant l'organogenèse et à la dernière phase de gestation.
Lors des études de fertilité, de développement embryonnaire précoce et de développement pré- et postnatal réalisées chez la souris, aucun effet indésirable n'a été observé après administration d'un anticorps murin dirigé contre l'IL-17A de souris. La dose élevée utilisée dans ces études était supérieure à la dose maximale efficace en termes d'inhibition et d'activité de l'IL-17A.
Remarques particulièresIncompatibilités
Poudre pour solution injectable:
Cosentyx ne doit pas être mélangé à d'autres médicaments ou solvants que de l'eau stérile pour préparations injectables.
Solution injectable (seringue et stylo préremplis):
Ces médicaments ne doivent pas être mélangés à d'autres médicaments.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Remarques particulières concernant le stockage
Conserver hors de portée des enfants.
Conserver au réfrigérateur (2–8 °C).
Conserver dans l'emballage d'origine pour protéger le contenu de la lumière.
Seulement pour la seringue préremplie et le stylo prérempli:
Ne pas congeler.
Si nécessaire, Cosentyx/- SensoReady/- UnoReady peut être stocké non réfrigéré à température ambiante (pas au-dessus de 30 °C) pendant une période unique de 4 jours maximum. S'ils ne sont pas conservés au frais, la seringue préremplie et le stylo prérempli doivent être éliminés au bout de 4 jours.
Concernant la poudre pour solution injectable:
La préparation ne contient pas de conservateur. Sa stabilité chimique et physique «in use» a été démontrée pendant 24 heures à une température comprise entre 2 et 8 °C. Pour des raisons microbiologiques, la préparation prête à l'emploi doit être utilisée immédiatement après ouverture.
Remarques concernant la manipulation
La poudre est un lyophilisat solide blanc. La solution en seringue préremplie et en stylo prérempli est incolore à légèrement jaunâtre.
Après l'injection, la solution restante dans le flacon, dans la seringue préremplie ou dans le stylo prérempli ne doit pas être utilisée et doit être éliminée conformément aux exigences locales. Le flacon, la seringue préremplie et le stylo prérempli ne sont destinés qu'à un usage unique.
Vous trouverez ci-dessous des instructions d'utilisation détaillées concernant la poudre pour solution injectable.
Numéro d’autorisation63295, 65225, 65226, 68324 (Swissmedic)
PrésentationCosentyx poudre pour solution injectable en flacon de 150 mg: 1 [B].
Cosentyx solution injectable dans une seringue préremplie de 150 mg: 1 et 2 [B].
Cosentyx solution injectable dans une seringue préremplie de 300 mg: 1 [B].
Cosentyx SensoReady solution injectable en stylo prérempli de 150 mg: 1 et 2 [B].
Cosentyx UnoReady solution injectable en stylo prérempli de 300 m g: 1 [B].
Titulaire de l’autorisationNovartis Pharma Schweiz AG, Risch; domicile: 6343 Rotkreuz
Mise à jour de l’informationFévrier 2022
Instructions d'utilisation de Cosentyx, poudre pour solution injectable
Les informations suivantes sont destinées exclusivement aux médecins ou aux professionnels de santé.
Le flacon à usage unique contient 150 mg de Cosentyx à reconstituer avec 1 ml d'eau stérile pour préparations injectables (eau ppi). La préparation de la solution pour injection sous-cutanée doit être réalisée sans interruption et dans des conditions d'asepsie. Le temps de préparation, entre le moment où le bouchon est percé et la fin de la reconstitution, est de 20 minutes en moyenne et ne doit pas dépasser 90 minutes.
Pour préparer Cosentyx, poudre pour solution injectable, veuillez suivre les instructions suivantes:
Instructions de reconstitution de Cosentyx, poudre pour solution injectable:
1.Amenez le flacon contenant la poudre pour solution injectable Consentyx à température ambiante et assurez-vous que l'eau stérile pour préparations injectables (eau ppi) est également à température ambiante.
2.Prélevez un peu plus de 1,0 ml d'eau stérile pour préparations injectables (eau ppi) dans une seringue jetable graduée de 1 ml et ajustez le volume à 1,0 ml.
3.Retirez le capuchon en plastique du flacon.
4.Insérez l'aiguille de la seringue dans le flacon contenant la poudre lyophilisée Cosentyx en perçant le centre du bouchon en caoutchouc. Reconstituez la poudre lyophilisée en injectant lentement 1,0 ml d'eau ppi dans le flacon. Le jet d'eau ppi doit être dirigé directement sur la poudre lyophilisée.

5.Inclinez le flacon jusqu'à un angle d'environ 45° et faites-le tourner précautionneusement entre vos doigts pendant environ une minute. N'agitez pas et ne retournez pas le flacon.
6.Laissez le flacon en position verticale et à température ambiante pendant au moins 10 minutes pour permettre au lyophilisat de se dissoudre. Il est possible que de la mousse se forme à la surface de la solution.
7.Inclinez le flacon à un angle d'environ 45° et faites-le tourner précautionneusement entre vos doigts pendant environ une minute. N'agitez pas et ne retournez pas le flacon.
8.Laissez le flacon en position verticale et à température ambiante pendant environ 5 minutes. La solution obtenue doit être limpide. La solution peut être incolore à légèrement jaunâtre. N'utilisez pas la solution si la poudre lyophilisée n'est pas complètement dissoute ou si le liquide présente des particules clairement visibles, un aspect trouble ou une coloration nettement brune.
9.Préparez le nombre de flacons nécessaires (un flacon de 150 mg pour la dose de 75 mg, 1 flacon de 150 mg pour la dose de 150 mg, deux flacons de 150 mg pour la dose de 300 mg).
Une fois préparée, la solution pour injection sous-cutanée doit être immédiatement utilisée, car elle ne contient aucun agent conservateur. Ne pas congeler.
Instructions pour l'administration de la solution de Cosentyx
1.Inclinez le flacon à un angle d'environ 45° et positionnez l'extrémité de l'aiguille tout au fond de la solution contenue dans le flacon lorsque vous aspirez la solution dans la seringue. NE retournez PAS le flacon.

2.Pour les doses de 150 mg et de 300 mg, prélevez précautionneusement à l'aide d'une aiguille appropriée (par exemple, 21G × 2") un peu plus de 1,0 ml de solution pour injection sous-cutanée du flacon dans une seringue jetable graduée de 1 ml. Cette aiguille est utilisée uniquement pour prélever Cosentyx dans la seringue jetable. Préparez le nombre de seringues nécessaires (une seringue pour la dose de 150 mg, deux seringues pour la dose de 300 mg). Pour un enfant recevant une dose de 75 mg, prélevez précautionneusement un peu plus de 0,5 ml de solution pour injection sous-cutanée et jetez immédiatement le reste de solution.
3.L'aiguille pointée vers le haut, tapotez légèrement la seringue afin de faire remonter les éventuelles bulles d'air à la surface.
4.Remplacez l'aiguille fixée par une aiguille de 27G × ½".
5.Éliminez les bulles d'air présentes dans la seringue. Pour la dose de 150 mg, poussez le piston jusqu'au repère correspondant à 1,0 ml. Pour la dose de 75 mg, poussez le piston jusqu'au repère correspondant à 0,5 ml.
6.Nettoyez le site d'injection avec une compresse d'alcool.
7.Le site recommandé pour une injection sous-cutanée de la solution Cosentyx est la région du bas du ventre (mais pas dans un rayon de 5 cm autour du nombril).
Vous pouvez également injecter la solution dans la partie antérieure des cuisses ou dans la partie supérieure externe des bras, si le site d'injection recommandé ne convient pas (voir rubrique Pharmacocinétique).
Choisissez un site d'injection différent à chaque injection. N'injectez pas la solution dans des zones où la peau est sensible, lésée, rouge, pelée ou dure. Évitez les zones présentant des cicatrices ou des vergetures.

8.Toute solution restante dans le flacon ne doit pas être utilisée et doit être éliminée conformément aux exigences locales. Les flacons sont destinés à un usage unique. Jetez la seringue usagée dans un collecteur pour seringues. Les aiguilles et les seringues usagées ne doivent pas être réutilisées.
|











