Posologie/Mode d’emploiLe traitement par mavacamten doit être instauré sous la surveillance d'un médecin expérimenté dans la prise en charge de patients atteints de cardiomyopathie.
Examen avant le début du traitement
Avant le début du traitement, la fraction d'éjection ventriculaire gauche (FEVG) du patient doit être évaluée par échocardiographie (voir «Mises en garde et précautions»). L'instauration du traitement n'est pas recommandée en cas de FEVG < 55 %.
Instauration, maintien et interruption du traitement
La posologie initiale recommandée est de 5 mg par voie orale une fois par jour avec ou sans nourriture. Les doses suivantes autorisées sont de 2,5 mg, 5 mg, 10 mg ou 15 mg une fois par jour.
La dose quotidienne maximale est de 15 mg.
L'instauration du traitement par Camzyos ou l'augmentation progressive de la dose ne sont pas recommandées chez les patients présentant une FEVG < 55 %.
Les patients sous traitement par Camzyos peuvent développer une insuffisance cardiaque. Une évaluation régulière de la FEVG et du gradient de la chambre de chasse ventriculaire gauche (CCVG) par manœuvre de Valsalva est nécessaire pour une titration méticuleuse, afin d'atteindre un gradient-cible de CCVG par manœuvre de Valsalva adéquat et en même temps maintenir une FEVG ≥50 % et éviter les symptômes d'une insuffisance cardiaque (voir Figure 1 et Figure 2).
Lors de l'instauration ou de la titration de Camzyos, il faut d'abord prendre en compte la FEVG, puis le gradient de CCVG évalué par manœuvre de Valsalva et l'état clinique du patient, afin de déterminer la dose de Camzyos appropriée. Respectez les algorithmes de dosage approprié de Camzyos ainsi que les rendez-vous de contrôle pour l'instauration (Figure 1) et le maintien (Figure 2) du traitement.
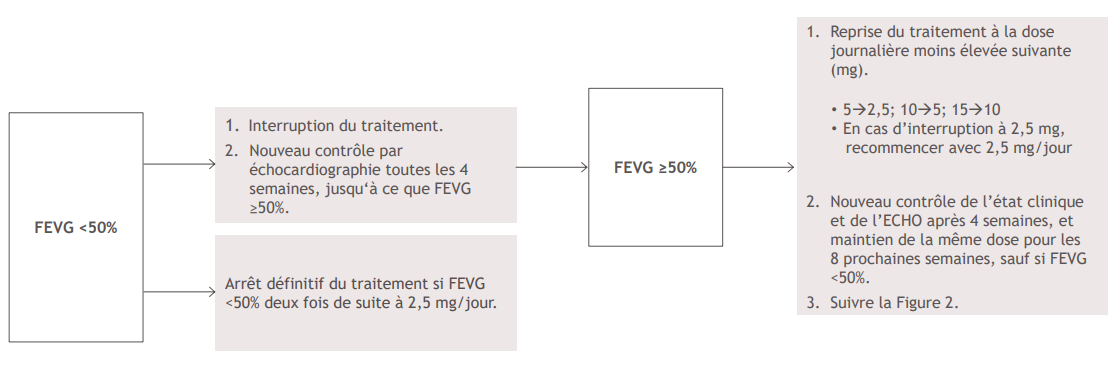
En cas de FEVG < 50 % pendant la prise de Camzyos, le traitement doit être interrompu. Respectez l'algorithme d'interruption (Figure 3) pour les instructions concernant l'interruption du traitement, la reprise du traitement ou l'arrêt de Camzyos. Si le traitement est interrompu à la dose de 2,5 mg, soit il doit être repris à 2,5 mg, soit être définitivement arrêté.
Figure 1: Phase d'instauration
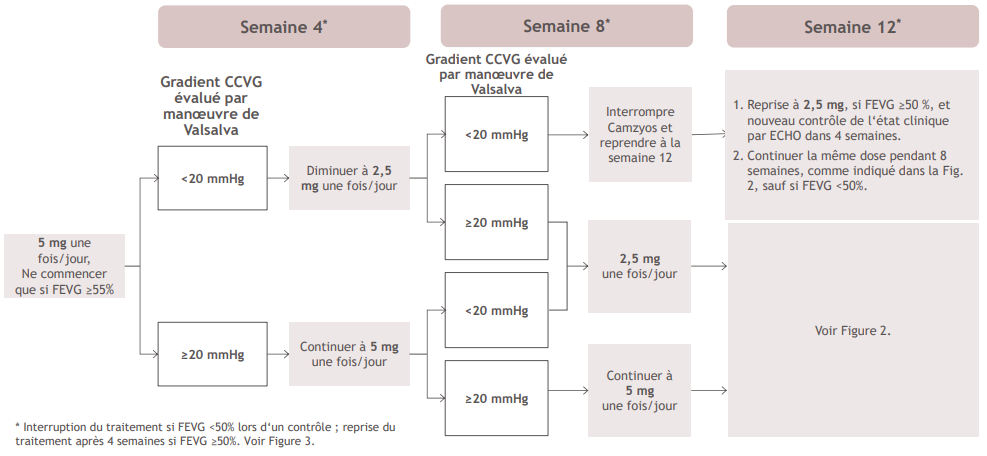
Figure 2: Phase de maintien
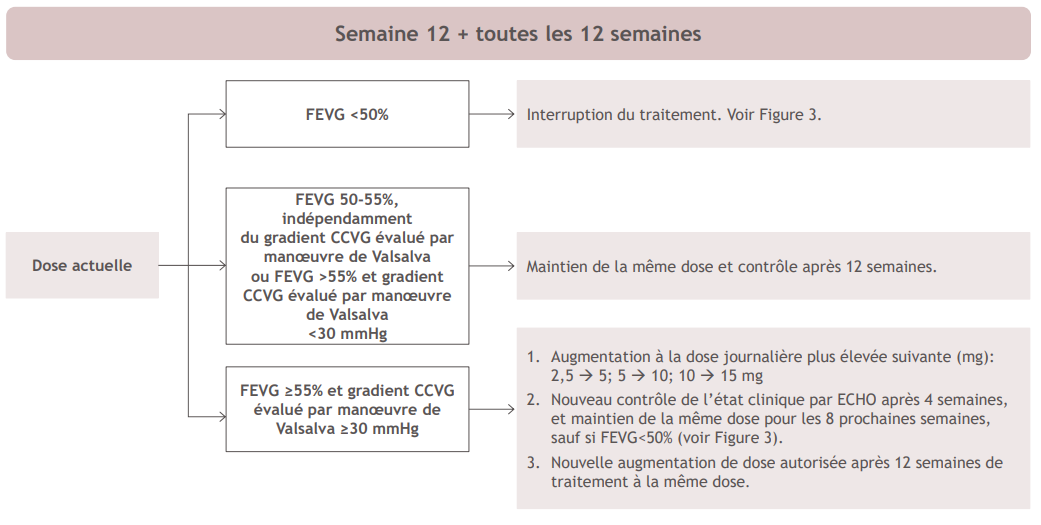
Les augmentations de dose doivent être effectuées au maximum toutes les 12 semaines. Après toute augmentation de dose, il convient d'évaluer la FEVG et le gradient CCVG par manœuvre de Valsalva après 4 semaines. Le patient doit ensuite revenir en visite de contrôle après 8 semaines (puis reprendre les visites de contrôle toutes les 12 semaines). Chez les patients présentant des affections intercurrentes telles que les infections ou l'arythmie (y compris une fibrillation atriale ou d'autres tachyarythmies non contrôlées) susceptibles d'altérer la fonction systolique, les augmentations de dose ne sont pas recommandées.
Il faut envisager d'arrêter le traitement chez les patients qui n'ont montré aucune réponse (p.ex. aucune amélioration des symptômes, de la qualité de vie, de la capacité à faire de l'exercice physique ou du gradient CCVG) après 4 à 6 mois à la dose maximale tolérée.
Figure 3. Arrêt du traitement lorsque la FEVG < 50 % lors d'un examen de contrôle
Surveillance pendant le traitement
Les patients doivent faire l'objet d'une surveillance régulière afin de contrôler les symptômes de la cardiomyopathie hypertrophique obstructive (CMHo), le gradient de la chambre de chasse ventriculaire gauche (CCVG) par manœuvre de Valsalva et la fraction d'éjection ventriculaire gauche (FEVG) par échocardiographie.
Une fois la dose d'entretien individualisée atteinte, les patients doivent faire l'objet d'une évaluation toutes les 12 semaines. Si, lors d'une visite, le patient présente une FEVG < 50 %, le traitement devra être interrompu pendant 4 semaines et jusqu'à ce que la FEVG revienne à ≥50 %.
Si l'état clinique évolue ou dans le cas des patients présentant une affection intercurrente grave telle qu'une infection ou une arythmie (y compris une fibrillation atriale ou une autre tachyarythmie non contrôlée), une évaluation de la FEVG est recommandée (voir «Mises en garde et précautions»).
Modification de la posologie avec des médicaments concomitants
Chez les patients recevant un traitement stable par un inhibiteur du CYP2C19 ou un inhibiteur du CYP3A4, ou par un inducteur du CYP2C19 ou un inducteur du CYP3A4, le traitement par mavacamten doit être commencé à la posologie initiale recommandée de 5 mg par voie orale une fois par jour.
Suivez les instructions du tableau 1 chez les patients recevant un traitement concomitant par un inhibiteur du CYP2C19 ou un inhibiteur puissant ou modéré du CYP3A4, ou par un inducteur puissant du CYP2C19 ou un inducteur puissant du CYP3A4.
|
Tableau 1: Modification de la posologie avec des médicaments concomitants
| |
Médicament concomitant
|
Modification de la posologie / surveillance
| |
Inhibiteurs
| |
·Instauration ou augmentation posologique d'un:
·inhibiteur puissant du CYP2C19
|
·Réduire la dose de mavacamten d'un niveau ou interrompre le traitement si la dose est de 2,5 mg
·Évaluer la FEVG après 4 semaines, puis reprendre la surveillance du patient et le schéma de titration
| |
·Instauration ou augmentation posologique d'un:
·inhibiteur modéré ou faible du CYP2C19
·inhibiteur puissant ou modéré du CYP3A4
|
·Envisager une surveillance supplémentaire de la FEVG
·Ajuster la dose du mavacamten en fonction de l’évaluation clinique
| |
·Arrêt ou diminution posologique d'un:
·inhibiteur puissant du CYP2C19
·inhibiteur modéré ou faible du CYP2C19
·inhibiteur puissant ou modéré du CYP3A4
|
·Envisager une surveillance supplémentaire de la FEVG après 4 semaines
·Ajuster la dose du mavacamten en fonction de l'évaluation clinique
| |
Inducteurs
| |
·Instauration ou augmentation posologique d'un:
·inducteur puissant du CYP2C19
·inducteur puissant du CYP3A4
|
·Envisager une surveillance supplémentaire de la FEVG après 4 semaines
·Ajuster la dose du mavacamten en fonction de l'évaluation clinique
| |
·Arrêt ou diminution posologique d'un:
·inducteur puissant du CYP2C19
·inducteur puissant du CYP3A4
|
·Surveiller la FEVG après 4 semaines, puis reprendre le calendrier de suivi du patient et le schéma de titration
|
Doses oubliées ou retardées
Si une dose est oubliée, elle doit être prise dès que possible. La prochaine dose programmée doit être prise à l'heure habituelle le jour suivant. Ne pas prendre deux doses le même jour.
Patients âgés
Aucun ajustement posologique n'est requis pour les patients âgés de 65 ans et plus (voir «Pharmacocinétique»).
Patients présentant des troubles de la fonction rénale
Aucun ajustement posologique n'est requis chez les patients présentant une insuffisance rénale légère (débit de filtration glomérulaire estimé [DFG estimé] de 60-89 mL/min/1,73 m2) à modérée (DFG estimé de 30-59 mL/min/1,73 m2). La prudence est de rigeur chez les patients présentant une insuffisance rénale sévère (DFG estimé < 30 mL/min/1,73 m2) car Camzyos n'a pas été étudié dans cette population (voir «Pharmacinétique»).
Patients présentant des troubles de la fonction hépatique
Aucun ajustement posologique n'est requis chez les patients présentant une insuffisance hépatique légère (classe A de Child Pugh) à modérée (classe B de Child Pugh). La prudence est de rigueur chez les patients présentant une insuffisance hépatique sévère (classe C de Child-Pugh), car Camzyos n'a pas été étudié dans cette population (voir «Pharmacinétique»).
Enfants et adolescents
La sécurité et l'efficacité de Camzyos n'ont pas été établies chez les enfants et les adolescents de moins de 18 ans. Aucune donnée n'est disponible.
Mode d'administration
Voie orale.
Camzyos doit être pris une fois par jour avec ou sans nourriture. La gélule doit être avalée entière avec de l'eau.
| 


