CompositionPrincipes actifs
Clozapinum.
Excipients
Lactosum monohydricum 48 mg (25 mg comprimés) resp. 192 mg (100 mg comprimés), maydis amylum, povidonum K 30, silica colloidalis anhydrica, magnesii stearas, talcum.
Indications/Possibilités d’emploiA. Schizophrénie résistante à la thérapie
Clozapin Viatris est indiqué uniquement chez les schizophrènes qui soit ne répondent pas soit présentent une intolérance aux neuroleptiques conventionnels, conformément aux définitions ci-après:
L'absence de réponse est définie comme l'absence d'amélioration clinique satisfaisante malgré l'utilisation de doses suffisantes, pendant une durée appropriée, des neuroleptiques conventionnels.
On parle d'intolérance lorsque l'apparition d'effets indésirables neurologiques graves et incontrôlables, sous la forme de réactions extrapyramidales ou de dyskinésie tardive, ne permet pas une thérapie efficace avec des neuroleptiques conventionnels.
B. Réduction (à long terme) du comportement suicidaire récurrent lors de schizophrénie ou en cas de trouble schizoaffectif
Clozapin Viatris est indiqué pour diminuer à long terme le risque de comportement suicidaire récurrent chez les patients schizophréniques ou présentant un désordre schizoaffectif, chez qui un tel risque, sur la base de l'anamnèse et le tableau clinique du moment, est présent.
C. Psychose au cours de l'évolution de la maladie de Parkinson
Clozapin Viatris est indiqué lors de psychose liée à la maladie de Parkinson en cas d'échec de la thérapie conventionnelle.
L'échec de la thérapie conventionnelle est défini comme échec du contrôle des symptômes psychotiques et/ou lorsque une péjoration fonctionnelle inacceptable des symptômes moteurs apparaît après instauration des mesures suivantes:
·arrêt des anticholinergiques y compris des antidépresseurs tricycliques;
·tentative de réduction posologique des médicaments contre le Parkinson avec effet dopaminergique.
Posologie/Mode d’emploiLa posologie doit être adaptée à chaque cas particulier. Dans chaque cas, la dose efficace la plus faible sera administrée.
Une titration prudente de la dose et un schéma répartissant bien les prises sont nécessaires pour minimiser le risque d'hypotension, de crises convulsives et de sédation. La dose quotidienne peut être fractionnée en doses uniques inégales, la dose la plus élevée devant cependant être administrée le soir au coucher.
Les posologies suivantes sont recommandées.
A. Schizophrénie résistante à la thérapie
Dose initiale
Le premier jour, 1 ou 2× 12,5 mg (un demi comprimé à 25 mg), puis 1 ou 2 comprimés à 25 mg le deuxième jour. Si cette posologie est bien tolérée, elle peut être augmentée graduellement de 25-50 mg/j en 2 à 3 semaines, jusqu'à 300 mg/j. Après quoi, si nécessaire, la posologie peut de nouveau être augmentée à intervalles bihebdomadaires ou de préférence hebdomadaires par paliers de 50 à 100 mg.
Marge thérapeutique
Chez la plupart des patients, l'effet antipsychotique se manifeste à une dose journalière de 300-450 mg fractionnée en 2-4 prises. Certains sujets nécessitent des doses quotidiennes moins élevées, d'autres au contraire des doses atteignant 600 mg.
Dose maximale
Une dose plus élevée est parfois nécessaire pour obtenir un effet thérapeutique optimum chez quelques patients; dans ces cas-là, il est admissible d'augmenter jusqu'à 900 mg/j maximum, mais l'augmentation doit se faire par paliers de 100 mg au maximum. Aux doses quotidiennes supérieures à 450 mg, une augmentation d'effets indésirables est possible (notamment convulsions).
Traitement d'entretien
Une fois que l'effet thérapeutique maximum est atteint, il est en général possible d'entretenir cet effet à une dose plus faible. C'est pourquoi il est conseillé de réduire alors la posologie graduellement. Le traitement doit être poursuivi pendant 6 mois au minimum. Aux doses égales ou inférieures à 200 mg, une prise journalière unique, au coucher, peut être envisagée.
Arrêt du traitement
En cas d'arrêt planifié de la thérapie, il est recommandé de réduire la dose progressivement sur une période de 1-2 semaines. Si le médicament doit être arrêté brusquement, p.ex. en raison d'une leucopénie, le patient doit être surveillé attentivement concernant la réapparition de la psychose ainsi que les symptômes d'un rebond cholinergique (p.ex. augmentation de la sudation, céphalées, nausées, vomissements et diarrhée).
Reprise du traitement
Si la dernière prise de Clozapin Viatris remonte à plus de 2 jours, le traitement sera rétabli à raison de 12,5 mg (un demi comprimé à 25 mg), 1 à 2× le premier jour. Si cette posologie est bien tolérée, elle peut être portée plus rapidement au niveau thérapeutique que lors de l'instauration initiale du traitement. Toutefois, chez les patients ayant subi un arrêt respiratoire ou cardiaque lors de la première utilisation du médicament (voir «Autres précautions»), même si une dose thérapeutique avait pu être définie alors avec succès, la réinstauration du traitement exige une extrême prudence.
Passage d'un autre neuroleptique à Clozapin Viatris
Il est généralement déconseillé d'associer Clozapin Viatris à d'autres neuroleptiques. Si un patient utilisant un neuroleptique oral doit être placé sous Clozapin Viatris, on recommande de supprimer préalablement l'autre neuroleptique, le cas échéant, par doses dégressives en l'espace d'une semaine environ. Dès que le neuroleptique a été supprimé depuis 24 h au minimum, le traitement avec Clozapin Viatris peut être instauré comme décrit plus haut.
Chez les patients présentant des convulsions dans l'anamnèse ou des maladies cardiovasculaires, hépatiques ou rénales, il est recommandé d'initier la thérapie avec des doses plus faibles et d'augmenter la posologie lentement.
Une adaptation posologique est recommandée chez les patients recevant des médicaments qui interagissent avec Clozapin Viatris comme p.ex. benzodiazépines, carbamazépine, inhibiteurs sélectifs du recaptage de la sérotonine (voir «Interactions»).
B. Réduction (à long terme) du risque de comportement suicidaire récurrent chez les patients schizophréniques ou présentant un trouble schizoaffectif
Les recommandations de posologie et d'utilisation décrites ci-dessus concernant les patients schizophréniques réfractaires à la thérapie conventionnelle sont également valables lorsque Clozapin Viatris est administré à des patients schizophréniques ou présentant un trouble schizoaffectif, chez qui un risque de comportement suicidaire récurrent est présent à long terme.
C. Psychose au cours de l'évolution de la maladie de Parkinson après échec du traitement standard
Dose initiale
La dose initiale ne doit pas excéder 12,5 mg par jour (un demi comprimé à 25 mg), administrés en une dose unique le soir. Par la suite, la posologie journalière doit être augmentée par palier de 12,5 mg avec un maximum de deux augmentations par semaine, pour atteindre un maximum de 50 mg, dose qui ne doit pas être atteinte avant la fin de la deuxième semaine. La dose journalière totale doit de préférence être administrée en une fois, le soir.
Traitement d'entretien
La dose efficace moyenne usuelle est de 25-37,5 mg/j. Si le traitement par une dose de 50 mg/j pendant une semaine au moins ne procure pas d'efficacité suffisante, la posologie peut être augmentée prudemment par paliers de 12,5 mg/semaine.
La dose de 50 mg/j ne doit être dépassée qu'exceptionnellement. La dose maximale de 100 mg/j ne doit jamais être dépassée.
Les augmentations de posologie doivent être limitées ou différées lors d'apparition d'hypotension orthostatique, de sédation excessive ou d'état de confusion. La pression artérielle devrait être surveillée pendant les premières semaines de traitement.
Après rémission complète des symptômes psychotiques après un traitement d'au moins 2 semaines, une augmentation de la posologie du traitement antiparkinsonien peut être tentée, si l'état moteur du patient le nécessite. Si une réapparition des symptômes psychotiques s'ensuit, la posologie de Clozapin Viatris peut être augmentée par paliers de 12,5 mg/semaine jusqu'à la dose maximale de 100 mg/j, administrés en une ou deux prises (voir ci-dessus).
Arrêt du traitement
Une réduction progressive de la dose par paliers de 12,5 mg sur une semaine (ou mieux, sur 2 semaines) est recommandée.
Le traitement doit être interrompu immédiatement si une neutropénie ou une agranulocytose survient, conformément aux instructions décrites dans le chapitre «Mises en garde et précautions». Dans ce cas, une étroite surveillance psychiatrique du patient est indiquée car les symptômes peuvent réapparaître rapidement.
Instructions posologiques particulières
Patients présentant une insuffisance hépatique
Chez les patients présentant une insuffisance hépatique, Clozapin Viatris ne doit être utilisé qu'avec prudence et sous surveillance régulière de la fonction hépatique (voir «Mises en garde et précautions»).
Patients présentant une insuffisance rénale
Chez les patients présentant une insuffisance rénale légère à modérée, il convient de commencer le traitement avec une dose plus basse (1× 12,5 mg le premier jour). La dose doit être augmentée lentement et par paliers de faible amplitude.
Patients âgés
Chez les patients âgés (≥60 ans) il est recommandé d'initier le traitement avec une posologie particulièrement faible (1× 12,5 mg le premier jour) et de limiter ensuite l'augmentation de la dose à 25 mg/j.
Enfants et adolescents
Aucune étude n'a été conduite concernant la sécurité d'emploi et l'efficacité de Clozapin Viatris chez l'enfant et l'adolescent.
Patients atteints d'autres maladies sous-jacentes
Patients atteints de cardiopathies
Pour les patients atteints de cardiopathies, il convient de commencer le traitement avec une dose plus basse (1× 12,5 mg le premier jour). La dose doit être augmentée lentement et par paliers de faible amplitude. Le traitement est contre-indiqué chez les patients atteints de cardiopathies sévères (voir «Contre-indications»).
Contre-indications·Hypersensibilité connue ou soupçonnée à la clozapine ou à l'un des excipients selon la composition de Clozapin Viatris.
·Patients ne pouvant pas être soumis à des analyses de sang régulières.
·Granulocytopénie ou agranulocytose connue dans l'anamnèse (à l'exception de granulocytopénie ou agranulocytose due à des chimiothérapies précédentes).
·Troubles de la fonction de la moelle osseuse.
·Épilepsie non contrôlée.
·Psychoses alcooliques, psychoses toxiques, intoxications médicamenteuses, état comateux.
·Collapsus vasculaire et/ou dépression du SNC de toute étiologie.
·Grave affection rénale ou cardiaque, myocardite.
·Affections hépatiques aiguës accompagnées de nausées, anorexie ou ictère; maladies hépatiques progressives, atteinte hépatique.
·Iléus paralytique.
·Un traitement par Clozapin Viatris ne doit pas être entrepris lorsque d'autres médicaments susceptibles de causer une agranulocytose sont administrés en même temps; l'administration concomitante de neuroleptiques à action prolongée (dépôt) n'est pas recommandée.
Mises en garde et précautionsAvertissement
Les effets indésirables potentiellement graves dus à la thérapie avec Clozapin Viatris sont la granulocytopénie et l'agranulocytose dont l'incidence est estimée à 3%, resp. 0,7%. Dans le cas de l'agranulocytose, l'évolution peut mettre la vie du patient en danger.
L'incidence et la létalité des agranulocytoses ont diminué de manière marquante depuis l'introduction de la surveillance de la numération des leucocytes et des granulocytes neutrophiles. C'est pourquoi les mesures de précaution qui suivent sont absolument nécessaires.
L'utilisation de Clozapin Viatris est par conséquent uniquement indiquée pour les patients schizophréniques ou les patients qui présentent une psychose au cours de l'évolution de la maladie de Parkinson, qui ne répondent manifestement pas aux autres neuroleptiques, ou du moins pas de manière satisfaisante, ou qui réagissent aux autres neuroleptiques par de graves troubles extrapyramidaux, en particulier des dyskinésies tardives.
En outre, Clozapin Viatris peut être utilisé chez les patients schizophréniques ou présentant un désordre schizoaffectif, chez qui, sur la base de l'anamnèse ou du tableau clinique du moment, un risque récurrent de comportement suicidaire est présent à long terme.
Pour tous les groupes de patients mentionnés, les conditions d'utilisation de Clozapin Viatris sont
·un hémogramme normal et une formule leucocytaire normale [nombre de leucocytes ≥3,5× 109/l (3500/mm³)] en début du traitement et
·un contrôle régulier du nombre total de leucocytes, et si possible du nombre absolu de granulocytes neutrophiles, pendant toute la durée du traitement et encore un mois après l'arrêt complet de Clozapin Viatris (hebdomadairement pendant les 18 premières semaines et au moins mensuellement par la suite).
Les patients ayant des antécédents de troubles iatrogéniques de l'hématopoïèse ne doivent en aucun cas être traités avec Clozapin Viatris (voir «Contre-indications»).
Les médecins qui prescrivent Clozapin Viatris sont tenus d'appliquer à la lettre les directives de sécurité.
A chaque consultation, le médecin rappellera à son patient que le moindre signe d'infection doit lui être signalé dans les plus brefs délais. Il sera particulièrement attentif aux troubles de type grippal ainsi qu'aux symptômes tels que fièvre et mal de gorge (angine), qui sont souvent les signes avant-coureurs d'une infection. Dans pareils cas, il convient de procéder sans délai à un contrôle de la formule sanguine.
Mise en gardes particulières
Hématologie
Compte tenu du risque d'agranulocytose, les précautions suivantes doivent être observées impérativement.
Des médicaments potentiellement fortement myélosuppresseurs ne doivent pas être administrés en association avec Clozapin Viatris. De plus, il faut éviter d'administrer des neuroleptiques à action prolongée (sous forme dépôt) en combinaison avec Clozapin Viatris car dans les situations d'urgence, comme p.ex. une granulocytopénie, ces produits potentiellement myélotoxiques ne sont éliminés que lentement de l'organisme.
Les patients dont l'anamnèse a mis en évidence des troubles primaires de la moelle osseuse ne doivent être traités avec Clozapin Viatris que si le bénéfice attendu est plus grand que le risque encouru. Ils devraient être examinés par un hématologue avant le traitement.
Chez les patients qui présentent un nombre de leucocytes abaissé en raison d'une neutropénie bénigne d'origine ethnique, le traitement ne devrait être initié qu'après avoir reçu l'approbation d'un hématologue.
Surveillance des granulocytes neutrophiles/leucocytes
Afin de s'assurer que seuls des patients présentant des valeurs leucocytaires normales [nombre de leucocytes ≥3,5× 109/l (3500/mm³) et nombre absolu des granulocytes neutrophiles ≥2,0× 109/l (2000/mm3)] reçoivent un traitement par Clozapin Viatris, il faut déterminer le nombre de leucocytes et établir une formule sanguine dans les 10 jours précédant le début du traitement. Pendant les 18 premières semaines de traitement, il faut effectuer une numération hebdomadaire des leucocytes et si possible compter le nombre absolu des granulocytes neutrophiles. Par la suite, et cela pendant toute la durée du traitement, un contrôle doit être effectué au moins une fois par mois, et encore pendant un mois après l'arrêt complet de Clozapin Viatris. A chaque consultation, on rappellera au patient qu'il doit contacter sans attendre son médecin traitant au moindre signe de fièvre, de mal de gorge, de symptômes d'allure grippale et surtout d'une infection susceptible de suggérer une neutropénie. Un contrôle de la formule sanguine différentielle sera effectué immédiatement.
Interruption du traitement pour des raisons autres qu'hématologiques
Chez les patients traités avec Clozapin Viatris depuis plus de 18 semaines dont le traitement a été interrompu plus de 3 jours mais moins de 4 semaines, le contrôle des leucocytes doit être effectué hebdomadairement pendant les 6 semaines suivantes. Si aucune anomalie de la formule sanguine n'apparaît, les contrôles peuvent être espacés de 4 semaines au maximum. Dans le cas où le traitement aurait été interrompu plus de 4 semaines, il est nécessaire d'effectuer des contrôles hebdomadaires pendant les 18 semaines suivantes.
Valeurs basses des leucocytes/granulocytes neutrophiles
Si au cours des 18 premières semaines d'un traitement avec Clozapin Viatris le nombre des leucocytes chute à 3,5-3,0× 109/l (3500-3000/mm3) et/ou le nombre absolu des granulocytes neutrophiles à 2,0-1,5× 109/l (2000-1500/mm3), des contrôles hématologiques doivent être effectués au moins 2 fois par semaine. C'est aussi le cas lorsque, après les 18 semaines, les valeurs chutent à 3,0-2,5× 109/l (3000-2500/mm3) resp. 1,5-1,0× 109/l (1500-1000/mm3).
De plus, une nouvelle numération leucocytaire et un contrôle de la formule sanguine différentielle doivent également être effectués lorsque le nombre des leucocytes chute sensiblement au-dessous de la valeur de départ. Par chute sensible on entend une baisse unique de 3,0× 109/l (3000/mm3) ou plus de la numération leucocytaire ou une baisse cumulative de 3,0× 109/l (3000/mm3) ou plus en l'espace de 3 semaines.
Arrêt immédiat du traitement avec Clozapin Viatris:
Une interruption est impérative si, dans les 18 premières semaines, le nombre des leucocytes chute au-dessous de 3,0× 109/l (3000/mm3) et les granulocytes neutrophiles au-dessous de 1,5× 109/l (1500/mm3). C'est aussi le cas après 18 semaines lorsque les valeurs sont inférieures à 2,5× 109/l (2500/mm3) resp. 1,0× 109/l (1000/mm3). Il convient alors de contrôler quotidiennement la numération leucocytaire et la formule sanguine et de veiller aux moindres symptômes de type grippal ou à tout autre signe d'infection apparaissant chez le patient. Les contrôles hématologiques sont à poursuivre après l'arrêt du traitement avec Clozapin Viatris jusqu'à ce que les valeurs de départ soient de nouveau atteintes.
Si, malgré l'arrêt de Clozapin Viatris, le nombre de leucocytes tombe au-dessous de 2,0× 109/l (2000/mm3) et/ou le nombre de granulocytes neutrophiles au-dessous de 1,0× 109/l (1000/mm3), la suite du traitement doit être confiée à un hématologue expérimenté.
Si possible, le patient doit être transféré dans une clinique d'hématologie, où son isolement à titre préventif et l'administration de GM-CSF (facteur stimulant les colonies de granulocytes/macrophages) ou de G-CSF (facteur stimulant les colonies de granulocytes) peuvent être indiqués. Il est recommandé d'interrompre le traitement par les facteurs de stimulation lorsque la numération des neutrophiles est remontée au-dessus de 1,0× 109/l (1000/mm3).
En cas d'infection, une antibiothérapie précoce est indispensable en raison du risque de choc septique.
Clozapin Viatris ne doit plus être administré à des patients qui ont dû interrompre leur traitement à la suite de mauvaises valeurs leucocytaires (voir ci-dessus). Une confirmation des résultats hématologiques en procédant à une détermination sur 2 jours consécutifs est recommandée. Clozapin Viatris devra toutefois être arrêté après le premier test.
Lorsque le médecin rédige une ordonnance pour Clozapin Viatris, il doit y apposer la mention «CFS» (CFS=contrôle de la formule sanguine).
Lorsque le nombre des granulocytes éosinophiles s'élève à plus de 3,0× 109/l (3000/mm3) (voir «Effets indésirables»), le traitement avec Clozapin Viatris doit être interrompu. Ce traitement ne peut être repris que lorsque les valeurs mesurées sont inférieures à 1,0× 109/l (1000/mm3).
Au cas où une thrombocytopénie apparaît (voir «Effets indésirables»), le traitement avec Clozapin Viatris doit être interrompu lorsque les valeurs sont inférieures à 50× 109/l (50'000/mm3).
Autres précautions
Toxicité cardiaque
Chez les patients atteints de cardiopathies, il convient de commencer le traitement avec une dose plus basse (1× 12,5 mg le premier jour). La dose doit être augmentée lentement et par paliers de faible amplitude. Le traitement est contre-indiqué chez les patients atteints de cardiopathies sévères (voir «Contre-indications»).
Les patients qui ont présenté une pathologie cardiaque dans leur anamnèse ou présentant des résultats anormaux à l'issue de l'auscultation devraient être dirigés vers un spécialiste aux fins de clarification, lesquelles devraient également comprendre un ECG (voir «Contre-indications»). Ces patients ne devraient être traités que lorsque le bénéfice attendu l'emporte nettement sur le risque. Le médecin traitant devrait envisager la nécessité d'effectuer un ECG avant d'instituer le traitement.
Le traitement avec Clozapin Viatris peut induire une hypotension orthostatique avec ou sans syncope. Un collapsus, parfois marqué, avec arrêt cardiaque et/ou respiratoire, et issue fatale, a été rapporté dans de rares cas (environ 1 cas sur 3000 sujets traités avec Clozapin Viatris). Ces réactions risquent d'apparaître surtout pendant la phase d'ajustement initial de la posologie lorsque l'augmentation des doses est rapide. Dans des cas isolés, elles ont été observées dès la première prise. Ces complications semblent plutôt apparaître lors d'utilisation concomitante de benzodiazépines ou d'autres psychotropes (voir «Interactions»). Une surveillance médicale rigoureuse du patient est donc impérative lors de l'instauration d'un traitement avec Clozapin Viatris.
Les patients chez qui on a diagnostiqué une cardiomyopathie durant le traitement par Clozapin Viatris, sont à risque de développer une insuffisance mitrale. Il a été rapporté une insuffisance mitrale dans des cas de cardiomyopathie en relation avec un traitement par Clozapin Viatris. Dans ces cas-là, il s'agissait d'une insuffisance de grade léger à modéré, qui avait été détectée par échocardiographie à 2 dimensions (Echo 2D).
Chez les patients souffrant de la maladie de Parkinson, la pression artérielle doit être contrôlée en position décubitus et orthostatique pendant les premières semaines de traitement.
Myocardite et cardiomyopathie
Une tachycardie de repos accompagnée d'arythmie, de dyspnée ou de symptômes d'insuffisance cardiaque peut apparaître rarement pendant les deux premiers mois de traitement et apparaître très rarement ensuite (voir «Effets indésirables»). En cas d'apparition de ces symptômes, des mesures diagnostiques doivent être entreprises au plus vite afin d'exclure une myocardite. En particulier lorsque ces symptômes apparaissent pendant la phase d'augmentation de la dose de Clozapin Viatris. Les symptômes de la myocardite induite par la clozapine peuvent aussi ressembler aux troubles apparaissant lors d'un infarctus du myocarde ou à la grippe. Des cas de myocardite ont été signalés durant la période suivant la commercialisation, y compris certains ayant eu une issue fatale. Des cas fatals d'infarctus du myocarde ont également été observés. En raison des cardiopathies sévères préexistantes, l'évaluation de la relation de causalité était toutefois très difficile.
En cas de soupçon de myocardite ou de cardiomyopathie, le traitement par Clozapin Viatris doit être interrompu immédiatement et le patient doit être adressé au plus vite à un cardiologue.
Ces mêmes signes et symptômes peuvent aussi apparaître dans les phases tardives du traitement et peuvent alors être en relation avec une cardiomyopathie. Une clarification de la situation doit alors être entreprise et au cas où le diagnostic d'une cardiomyopathie était confirmé, le traitement doit être interrompu. Les patients qui ont présenté une myocardite ou une cardiomyopathie induite par la clozapine ne doivent pas être re-traités par Clozapin Viatris.
Une éosinophilie, dans quelques cas en relation avec une myocardite (env. 14%) et une péricardite ou épanchement péricardique, a été rapportée. Cependant, on ne sait pas si l'éosinophilie constitue un paramètre de pronostic fiable pour une cardite.
Allongement de l'intervalle QT
Comme avec d'autres neuroleptiques, la prudence est de rigueur chez les patients connus pour une affection cardiovasculaire ou pour une anamnèse familiale d'allongement de l'intervalle QT.
Comme avec d'autres neuroleptiques, Clozapin Viatris doit être prescrit avec prudence en association avec des médicaments connus pour allonger l'intervalle QTc.
Evénements cérébrovasculaires
Dans la population atteinte de démence, un risque d'événements cérébrovasculaires env. trois fois plus élevé a été observé avec certains neuroleptiques atypiques. La cause de ce risque accru est inconnue. Une augmentation de ce risque ne peut être exclue avec d'autres neuroleptiques ou chez d'autres groupes de patients. Clozapin Viatris doit donc être utilisé avec une prudence particulière chez les patients présentant des facteurs de risque d'accident vasculaire cérébral.
Épilepsie
Clozapin Viatris peut abaisser le seuil pour les convulsions. Les patients présentant une épilepsie dans l'anamnèse doivent être surveillés étroitement lors d'un traitement par Clozapin Viatris car des convulsions en rapport avec la dose ont été rapportées (voir «Interactions»). Dans de tels cas, la dose doit être réduite et un traitement anticonvulsivant doit être institué si nécessaire.
Chez les patients présentant des antécédents de convulsions, le traitement doit être instauré à raison de 1× 12,5 mg le premier jour et la posologie doit ensuite être augmentée lentement par petits paliers (voir «Posologie/Mode d'emploi»).
Fièvre
Des poussées fébriles transitoires supérieures à 38 °C peuvent s'observer sous Clozapin Viatris, notamment lors des 3 premières semaines de traitement. Ces réactions sont généralement bénignes. Occasionnellement, elles peuvent être associées à une augmentation ou à une diminution du nombre des leucocytes. L'origine de tout état fébrile doit être identifiée soigneusement afin d'exclure une infection sous-jacente ou une agranulocytose. En cas de fièvre élevée, envisager l'éventualité d'un syndrome neuroleptique malin (SNM). Lorsque le diagnostic de SNM est posé, le traitement par Clozapin Viatris doit être immédiatement interrompu et les mesures thérapeutiques nécessaires doivent être mises en œuvre.
Clozapin Viatris pouvant provoquer une sédation et une prise de poids qui augmentent le risque thromboembolique, une immobilisation du patient est à éviter.
Chutes
Clozapin Viatris peut provoquer des convulsions, une somnolence, une hypotonie posturale, une instabilité motrice et sensorielle, qui peuvent conduire à des chutes et, de fait, à des fractures osseuses, ou à d'autres blessures. Chez les patients exposés en raison de maladies, d'états ou de médicaments pouvant aggraver ces effets, il convient d'effectuer une évaluation globale du risque de chutes lors de l'instauration d'une thérapie antipsychotique. Une telle évaluation doit être répétée régulièrement chez les patients suivant une thérapie antipsychotique de longue durée.
Effets anticholinergiques
Clozapin Viatris possède des propriétés anticholinergiques ce qui peut conduire à l'apparition d'effets indésirables sur le corps entier. C'est pourquoi, en présence d'une hypertrophie de la prostate ou d'un glaucome à angle fermé, une surveillance étroite du patient s'impose. En raison probablement de ses propriétés anticholinergiques, Clozapin Viatris peut, dans des mesures variables, diminuer le péristaltisme intestinal et provoquer des symptômes tels que constipation, coprostase et occlusion intestinale jusqu'à l'iléus paralytique, au mégacôlon, à l'infarctus intestinal/ischémie intestinale. Dans de rares cas, ces évènements ont eu une issue fatale (voir «Effets indésirables»).
Pour éviter les complications, une surveillance attentive est recommandée pendant le traitement par Clozapin Viatris afin de pouvoir détecter une constipation au stade précoce et la traiter alors de façon efficace.
Une attention particulière est de rigueur chez les patients qui reçoivent une médication concomitante ayant des effets constipants (en particulier ayant des propriétés anticholinergiques comme certains neuroleptiques, antidépresseurs et antiparkinsoniens) et chez les patients ayant des antécédents de colopathie ou d'intervention chirurgicale abdominale basse qui risqueraient d'aggraver la situation. La détection et le traitement actif d'une constipation est d'une importance déterminante.
Lorsque l'administration concomitante de benzodiazépines (ou d'autres substances à action centrale) est envisagée, des mesures de précaution particulières (voir «Interactions») doivent être observées.
Modifications métaboliques
Les médicaments de la classe des antipsychotiques atypiques, y compris Clozapin Viatris, ont été associés à des modifications métaboliques pouvant augmenter le risque cardiovasculaire et cérébrovasculaire. Ces modifications métaboliques peuvent inclure l'hyperglycémie, la dyslipidémie et la prise pondérale. Alors que les antipsychotiques atypiques peuvent provoquer certaines modifications métaboliques, chaque médicament possède au sein de sa classe son propre profil de risque spécifique.
Hyperglycémie
Des cas de diabète sucré et d'hyperglycémies sévères pouvant aller jusqu'à l'acidocétose ou à un coma hyperosmolaire ont été rapportés, même chez des patients sans anamnèse d'hyperglycémie ou de diabète. La relation causale avec Clozapin Viatris n'est pas certaine mais néanmoins la plupart des patients ont présenté une normalisation de la glycémie après l'arrêt de Clozapin Viatris. Dans quelques cas, la réexposition s'est avérée positive. Il n'existe aucune étude concernant les effets de Clozapin Viatris sur le métabolisme glucidique chez les patients présentant un diabète sucré préexistant. La glycémie doit être régulièrement contrôlée chez les patients atteints de diabète sucré chez lesquels un traitement par des antipsychotiques atypiques est commencé. Chez les patients présentant un facteur de risque de diabète sucré (p.ex. surcharge pondérale, anamnèse familiale de diabète) et chez lesquels un traitement par un antipsychotique atypique est instauré, les glycémies à jeun doivent être régulièrement mesurées avant et pendant le traitement.
Chez les patients traités par Clozapin Viatris et chez lesquels une hyperglycémie survient, accompagnée de symptômes tels que polydipsie, polyurie, polyphagie ou état de faiblesse, la possibilité d'une détérioration de la tolérance au glucose doit être envisagée. La glycémie à jeun doit être mesurée chez les patients qui développent des symptômes d'hyperglycémie pendant le traitement par un antipsychotique atypique. Dans certains cas, la glycémie a pu être normalisée après l'arrêt du traitement par un antipsychotique atypique, mais dans d'autres cas il a été nécessaire de poursuivre le traitement de l'hyperglycémie malgré l'arrêt de l'antipsychotique atypique. L'arrêt de Clozapin Viatris doit être envisagé chez les patients présentant une hyperglycémie significative liée au traitement.
Dyslipidémie
Des modifications indésirables des lipides ont été observées chez les patients traités par des antipsychotiques atypiques, y compris par Clozapin Viatris. Une surveillance clinique, y compris au début du traitement, incluant des examens de suivi réguliers est recommandée.
Prise pondérale
Une prise de poids a été observée chez les patients traités par des antipsychotiques atypiques, y compris par Clozapin Viatris. Une surveillance clinique du poids est recommandée.
Groupes de patients particuliers
Troubles de la fonction hépatique
Les patients présentant une hépatopathie préexistante stable peuvent recevoir Clozapin Viatris mais la fonction hépatique doit être régulièrement contrôlée. Chez les patients qui développent, pendant le traitement par Clozapin Viatris, des symptômes d'une possible perturbation de la fonction hépatique tels que nausées, vomissements ou anorexie, des tests de la fonction hépatique doivent immédiatement être effectués. Si l'augmentation des paramètres hépatiques est cliniquement pertinente ou si des signes d'ictère apparaissent, Clozapin Viatris doit être arrêté. Le traitement par Clozapin Viatris ne peut être repris qu'après la normalisation des paramètres hépatiques. Une surveillance étroite est indiquée dans de tels cas.
Troubles de la fonction rénale
Le traitement doit être commencé avec une dose plus basse (1× 12,5 mg le premier jour) chez les patients présentant une insuffisance rénale légère à modérée (voir «Posologie/Mode d'emploi»).
Patients âgés (≥60 ans)
Chez les patients âgés, il est recommandé de commencer le traitement avec une dose plus faible (voir «Posologie/Mode d'emploi»).
Un traitement par Clozapin Viatris peut provoquer une hypotonie orthostatique. De rares cas de tachycardie pouvant persister ont été rapportés. Les patients âgés (≥60 ans), en particulier ceux qui présentent une insuffisance cardio-vasculaire, peuvent réagir à ces effets de façon plus sensible.
Les patients âgés peuvent aussi en partie se montrer plus sensibles aux effets anticholinergiques de Clozapin Viatris (p.ex. rétention urinaire et constipation).
Psychose/trouble du comportement chez les patients âgés atteints de démence
Des patients âgés (≥60 ans) atteints de psychose/trouble du comportement associés à une démence ont présenté un risque de mortalité accru lors de la prise de neuroleptiques atypiques par rapport au placebo. Des analyses de 17 études contrôlées contre placebo ont montré une augmentation d'un facteur 1,6 à 1,7 du risque de mortalité dans ce groupe de patients par rapport au placebo. Les facteurs de risque d'une mortalité accrue sous neuroleptiques sont: sédation, maladies cardiovasculaires (p.ex. arythmies, mort subite d'origine cardiaque) ou maladies pulmonaires (p.ex. pneumonie avec ou sans aspiration). Clozapin Viatris n'est pas autorisé pour le traitement de psychoses/troubles du comportement chez les patients âgés (≥60 ans) atteints de démence.
Symptômes de rebond/de sevrage
Lorsqu'un arrêt brusque du traitement par Clozapin Viatris est nécessaire (p.ex. en cas de leucopénie), les patients doivent être étroitement surveillés à la recherche de la réapparition de symptômes psychotiques et de symptômes associés à un rebond cholinergique tels que des accès de sudation, des céphalées, des nausées, des vomissements et des diarrhées.
Lactose
Les patients présentant des problèmes héréditaires rares d'intolérance au galactose, un déficit total en lactase ou un syndrome de malabsorption du glucose et du galactose ne doivent pas prendre ce médicament.
InteractionsInteractions pharmacocinétiques
La clozapine est un substrat pour beaucoup d'isoenzymes du CYP450; les plus importantes étant 3A4, 1A2 et 2D6. Ceci devrait réduire le risque d'interactions métaboliques dues à l'influence d'une seule isoforme. Chez les patients recevant un traitement concomitant avec des médicaments ayant une affinité pour une ou plusieurs de ces enzymes, le taux plasmatique de clozapine devrait cependant être contrôlé étroitement.
L'administration concomitante de substances influençant ces isoenzymes peut conduire à une baisse ou augmentation des taux plasmatiques de clozapine et/ou de ceux de la substance administrée conjointement.
Théoriquement il est possible que le taux plasmatique des antidépresseurs tricycliques, de la phénothiazine et des anti-arythmiques de type lC, qui sont connus pour se lier au cytochrome P450 2D6, soit augmenté par la clozapine ce qui pourrait nécessiter une réduction posologique. Toutefois, aucune interaction à signification clinique n'a été rapportée à ce jour.
La combinaison de Clozapin Viatris avec des substances connues pour influencer l'activité des isoenzymes CYP450 peut conduire à une augmentation ou une diminution des taux plasmatiques de clozapine:
Inhibiteurs
·L'administration concomitante d'inhibiteurs enzymatiques comme la cimétidine (inhibiteur du CYP1A2, 3A4 et 2D6), d'érythromycine (inhibiteur du CYP3A4), de clarithromycine, d'azithromycine, de fluvoxamine (1A2), de pérazine (1A2), de ciprofloxacine (1A2) ou d'un contraceptif oral (1A2, 3A4, 2C19) lors d'une thérapie par Clozapin Viatris à fortes doses a été corrélée avec une élévation du taux sanguin de clozapine et l'apparition d'effets indésirables.
·Une élévation des taux plasmatiques de clozapine a été signalée chez des patients qui avaient reçu ce médicament en association avec de la fluvoxamine (inhibiteur du CYP3A4 et CYP1A2; taux augmenté jusqu'à dix fois) ou d'autres inhibiteurs sélectifs du recaptage de la sérotonine (SSRI) comme la paroxétine (inhibiteur du CYP1A2, 2D6), la sertraline (inhibiteur du CYP2C8/9, 2D6) ou la fluoxétine (inhibiteur du CYP2D6, taux augmenté jusqu'à deux fois) ou le citalopram (probablement un inhibiteur faible du CYP1A2 présentant probablement le potentiel le plus faible parmi les SSRIs d'une interaction cliniquement significative). Pourtant des cas d'interaction cliniquement significative lors de comédication de citalopram et de clozapine ont été rapportés. Une élévation des taux sanguins de clozapine a également été observée lors de combinaison avec la venlafaxine.
·Les antimycotiques azolés ainsi que les inhibiteurs de la protéase sont des inhibiteurs/inducteurs puissants du CYP3A4. Il est à prévoir que ces médicaments puissent également conduire à des interactions à signification clinique. Toutefois, jusqu'à ce jour aucune interaction n'a été rapportée.
Substrats
·La caféine (substrat du CYP1A2) peut augmenter les taux plasmatiques de la clozapine. Après 5 jours sans absorption de caféine, les taux plasmatiques de clozapine diminue d'env. 50%. Ceci devrait être pris en considération lors de modifications de la consommation de café/thé. Lors d'administration concomitante de 2× 250 mg de ciprofloxacine, une augmentation significative de clozapine et de N-déméthyl-clozapine a été observée. De même, des cas d'interaction avec la norfloxacine et l'enoxacine ont été rapportés.
Inducteurs
·Les médicaments qui induisent le P450 CYP3A (p.ex. la carbamazépine et la rifampicine), peuvent diminuer les taux plasmatiques de clozapine. L'interruption d'un traitement par la carbamazépine a conduit à une augmentation des taux plasmatiques de clozapine.
·Lors d'administration concomitante de phénytoïne une diminution des taux plasmatiques de clozapine ayant conduit à une diminution de l'efficacité la dose de Clozapin Viatris auparavant efficace a été constatée.
·La fumée de tabac induit le CYP1A2, c'est pourquoi une abstinence subite chez les gros fumeurs peut provoquer une augmentation des taux plasmatiques de clozapine et par là des effets indésirables.
·L'oméprazole est un inducteur du CYP1A2 et du CYP3A4 ainsi qu'un inhibiteur du CYP2C19. Des cas isolés d'interaction avec les inhibiteurs de la pompe à protons ont été rapportés (faibles concentrations de clozapine sous oméprazole et pantoprazole resp. sous combinaison de lanzoprazole avec la paroxétine).
Interactions pharmacodynamiques
Les médicaments connus pour leur potentiel myélosuppresseur élevé ne doivent pas être associés à Clozapin Viatris. Les neuroleptiques (potentiellement myélosuppresseurs) à durée d'action prolongée (dépôt), ne devraient pas être administrés en même temps que Clozapin Viatris car ces substances ne peuvent pas être éliminées rapidement de l'organisme en cas de nécessité, p.ex. en cas de neutropénie (voir «Mises en garde et précautions, Précautions particulières»).
Clozapin Viatris peut renforcer les effets centraux de l'alcool et des IMAO sur le SNC ainsi que l'effet dépresseur des narcotiques, des antihistaminiques et des benzodiazépines. Des cas de décès lors de combinaison de clozapine avec ces substances y compris la méthadone ont été observés.
Une prudence particulière s'impose lors de l'administration simultanée d'une benzodiazépine ou d'autres psychotropes, ainsi que chez les patients qui ont reçu récemment des médicaments de cette catégorie, cela en raison d'un risque accru de collapsus cardiovasculaire, lequel peut s'avérer profond dans de rares cas et entraîner un arrêt cardiaque ou respiratoire. Il n'est pas certain qu'un ajustement posologique puisse prévenir l'apparition d'un collapsus cardiovasculaire ou respiratoire.
L'utilisation concomitante de lithium ou d'autres médicaments agissant au niveau central peut augmenter le risque de syndrome neuroleptique malin.
En raison d'effets cumulatifs possibles, une grande prudence s'impose lors de l'administration concomitante de médicaments ayant des propriétés anticholinergiques, hypotensives ou de dépression respiratoire.
En raison de ses propriétés anti-alpha-adrénergiques Clozapin Viatris peut diminuer l'effet hémopresseur de la noradrénaline ou d'autres produits à effet alpha-adrénergique prépondérant et peut également inverser l'effet presseur de l'adrénaline.
Comme Clozapin Viatris peut abaisser le seuil convulsif, l'adaptation de la médication anti-épileptique est nécessaire. De rares cas de crises épileptiques graves, y compris l'apparition de novo de convulsions, ainsi que des cas isolés de delirium ont été décrits lorsque Clozapin Viatris est administré en même temps que l'acide valproïque. Cet effet repose probablement sur une interaction pharmacodynamique dont le mécanisme n'est pas connu.
Clozapin Viatris peut augmenter la concentration plasmatique de substances se liant fortement aux protéines (p.ex. la warfarine et la digoxine) en raison de leur déplacement à partir des protéines plasmatiques. Si nécessaire, la posologie de la substance liée aux protéines devra être corrigée.
Comme avec d'autres neuroleptiques, Clozapin Viatris doit être prescrit avec prudence en association avec des médicaments connus pour allonger l'intervalle QTc ou pour entraîner un déséquilibre électrolytique.
Grossesse, allaitementGrossesse
Il n'existe pas de données cliniques concernant l'emploi chez la femme enceinte.
Étant donné que l'on ne dispose d'aucune étude contrôlée chez l'être humain, l'innocuité de Clozapin Viatris n'est pas démontrée pendant la grossesse. Il est donc indiqué de bien peser les avantages et les risques du traitement avant de prescrire Clozapin Viatris à une femme enceinte.
Le fait de remplacer un autre neuroleptique par Clozapin Viatris peut entraîner une normalisation du cycle menstruel. C'est pourquoi les femmes en âge de procréer doivent adopter des mesures contraceptives adéquates.
Les nouveau-nés dont les mères ont pris des médicaments antipsychotiques pendant le troisième trimestre de la grossesse sont exposés à un risque de symptômes moteurs extrapyramidaux et/ou de symptômes de sevrage après la naissance. Une agitation, une augmentation ou une diminution inhabituelle du tonus musculaire, des tremblements, une somnolence, une détresse respiratoire et des troubles alimentaires ont été rapportés. Le degré de sévérité de ces complications a été variable: alors que dans certains cas, les symptômes étaient auto-limitants, dans d'autres cas, les nouveau-nés ont été pris en charge en service de soins intensifs et hospitalisés pendant une période prolongée.
Les médicaments antipsychotiques, dont Clozapin Viatris, ne devraient pas être administrés pendant la grossesse, sauf en cas de nécessité absolue. Si un arrêt du traitement s'avère nécessaire pendant la grossesse, il ne doit pas être brutal.
Allaitement
L'expérimentation animale a montré que ce médicament passe dans le lait maternel. Comme Clozapin Viatris exerce des effets sur le nourrisson, les femmes traitées avec Clozapin Viatris ne doivent pas allaiter.
Fertilité
Certains effets toxiques ont été observés dans des études chez l'animal (voir «Données précliniques»).
Effet sur l’aptitude à la conduite et l’utilisation de machinesClozapin Viatris entrave la capacité de réaction, l'aptitude à la conduite et l'aptitude à l'utilisation de véhicules et de machines.
Étant donné que Clozapin Viatris a un effet sédatif et qu'il peut abaisser le seuil convulsif, le patient devrait renoncer à des activités telles que la conduite d'un véhicule ou l'utilisation de machines, surtout pendant les premières semaines de traitement.
Non pertinent.
Effets indésirablesRésumé du profil de sécurité
Les réactions indésirables les plus graves causées par la clozapine sont l'agranulocytose, les crises convulsives, les événements cardiovasculaires et la fièvre (voir «Mises en garde et précautions»). Les effets indésirables les plus fréquents sont la somnolence/sédation, les vertiges, la tachycardie, la constipation et l'hypersécrétion salivaire.
Les données provenant des études cliniques montrent qu'une proportion variable des patients traités par la clozapine (de 7,1 à 15,6%) ont arrêté le traitement en raison de ses effets indésirables. Les effets indésirables les plus fréquents qui ont provoqué un arrêt du traitement étaient la leucopénie, la somnolence, les vertiges légers (mais pas les vertiges intenses) et les maladies psychotiques.
Les effets indésirables sont classés par classe d'organe du système MedDRA et par fréquence selon la convention suivante: très fréquent (≥1/10), fréquent (≥1/100, <1/10), occasionnel (≥1/1000, <1/100), rare (≥1/10'000, <1/1000), très rare (<1/10'000), fréquence inconnue (ne peut pas être estimée sur la base des données disponibles).
Affections hématologiques et du système lymphatique
Fréquent: Leucopénie, diminution des leucocytes, neutropénie.
Occasionnel: Agranulocytose.
Rare: Lymphopénie.
Très rare: Thrombocytopénie, thrombocytose, anémie.
Un risque inhérent au traitement avec Clozapin Viatris est le développement d'une granulocytopénie ou d'une agranulocytose. Bien que généralement réversible après l'arrêt de Clozapin Viatris, l'agranulocytose peut entraîner une septicémie qui peut s'avérer fatale.
La plupart des cas d'agranulocytose (env. 70%) dus à Clozapin Viatris, survient au cours des 18 premières semaines de traitement.
L'interruption immédiate du traitement étant indispensable pour prévenir le développement d'une agranulocytose éventuellement fatale, la numération leucocytaire doit donc absolument être contrôlée régulièrement (voir «Précautions particulières»).
Une éosinophilie et/ou une leucocytose inexplicables peuvent survenir sous Clozapin Viatris, en particulier au cours des premières semaines de traitement.
Troubles du métabolisme et de la nutrition
Fréquent à très fréquent: Prise de poids (4-31%), importante dans certains cas.
Rare: Tolérance au glucose diminuée, diabète sucré même chez les patients qui ne présentaient pas d'hyperglycémie resp. de diabète sucré dans leur anamnèse.
Très rare: Hyperglycémie sévère allant jusqu'à la cétoacidose resp. jusqu'au coma hyperosmolaire, ceci aussi chez les patients qui ne présentaient pas d'hyperglycémie resp. de diabète sucré dans leur anamnèse, hypertriglycéridémie, hypercholestérolémie.
Affections psychiatriques
Fréquent: Troubles de l'élocution.
Occasionnel: Bégaiement (dysphémie).
Rare: Excitation, agitation.
Très rare: Trouble compulsif obsessionnel.
Affections du système nerveux
Très fréquent: Somnolence et sédation (39-46%), vertiges (19-27%), avec ou sans obnubilation).
Fréquent: Céphalées, tremblements, rigidité, acathésie, symptômes extrapyramidaux, convulsions, contractions myocloniques.
Rare: Confusion, délire.
Clozapin Viatris peut modifier l'EEG, en particulier l'apparition de complexes pointes-ondes (Spike-and-wave). Il abaisse le seuil convulsif proportionnellement à la posologie et peut provoquer des convulsions myocloniques ou généralisées. L'éventualité de l'apparition de tels symptômes est plus élevée lorsque l'augmentation de la dose est rapide et chez les patients épileptiques. Dans ces cas, la dose doit être réduite et, si nécessaire, un traitement anticonvulsivant doit être instauré. La carbamazépine est déconseillée en raison de son potentiel myélodépresseur. Avec les autres médicaments anticonvulsivants, une éventuelle interaction pharmacocinétique doit être prise en compte. Des cas mortels de convulsions ont été rapportés.
Les symptômes extrapyramidaux sont moins prononcés et moins fréquents que ceux observés lors de traitements avec des neuroleptiques conventionnels. La dystonie aiguë n'est pas un effet indésirable avéré de Clozapin Viatris.
De très rares cas de dyskinésies tardives ont été signalés chez des patients sous Clozapin Viatris qui avaient reçus d'autres neuroleptiques auparavant, ce qui ne permet pas d'établir une relation de causalité. Chez les patients qui avaient développé une dyskinésie tardive avec d'autres neuroleptiques une amélioration sous Clozapin Viatris a été observée.
Occasionnellement, des cas de syndrome neuroleptique malin ont été rapportés chez des patients traités avec Clozapin Viatris administré seul ou associé au lithium ou à d'autres médicaments à action centrale. Cette manifestation nécessite l'arrêt immédiat du médicament et l'instauration de soins intensifs. Le syndrome neuroleptique malin se manifeste par les principaux symptômes suivants: rigidité, hyperthermie, modifications psychiques, labilité végétative.
Affections oculaires
Fréquent: Vision trouble.
Affections cardiaques
Très fréquent: Tachycardie (25%) (en particulier durant les premières semaines de traitement par Clozapin Viatris).
Très rare: Arrêt cardiaque.
Des modifications de l'ECG (abaissement du segment ST, aplatissement et inversion de l'onde T, troubles de la conduction) peuvent fréquemment se produire et des troubles du rythme, une péricardite avec ou sans épanchement péricardique, des cardiomyopathies et des myocardites (avec ou sans éosinophilie) ont été rapportées dans des cas isolés, parfois avec issue fatale. Les symptômes cliniques peuvent ressembler à ceux d'un infarctus du myocarde ou à une grippe. C'est pourquoi lorsqu'une tachycardie de repos, accompagnée d'arythmies, de dyspnée ou de symptômes d'une insuffisance cardiaque, apparaît chez des patients sous Clozapin Viatris, le diagnostic d'une myocardite doit être envisagé. Lorsque le diagnostic est confirmé, le traitement avec Clozapin Viatris doit être interrompu.
De très rares cas de cardiomyopathie ont été rapportés. Lorsqu'une cardiomyopathie est diagnostiquée, le traitement par Clozapin Viatris doit être interrompu.
Affections vasculaires
Fréquent: Hypertension, hypotension orthostatique, syncope.
Rare: Thromboembolie, y compris cas mortels, et combinée à des nécroses d'organe (p.ex. intestins), collapsus cardiovasculaire comme issue d'une hypotension sévère, liée en particulier à une titration agressive de la dose, et qui peut évoluer vers des conséquences graves telles que l'arrêt cardiaque ou respiratoire. La prévalence et la gravité de l'hypotonie sont influencées par la rapidité et l'ampleur de l'augmentation de la posologie.
Affections respiratoires, thoraciques et médiastinales
Rare: Aspiration de nourriture ingérée (conséquence d'une dysphagie).
Très rare: Dépression respiratoire, arrêt respiratoire. Des pneumonies et des infections des voies respiratoires inférieures pouvant avoir une issue fatale ont été rapportées pendant le traitement par Clozapin Viatris.
Affections gastro-intestinales
Très fréquent: Constipation (14-25%), hypersécrétion salivaire (31-48%).
Fréquent: Nausées, vomissements, perte d'appétit, sécheresse buccale.
Rare: Dysphagie.
Très rare: Augmentation de la parotide, occlusion intestinale, iléus paralytique, coprostase.
Affections hépatobiliaires
Fréquent: Élévation des enzymes hépatiques.
Rare: Hépatite, ictère, pancréatite aiguë.
Très rare: Nécrose hépatique fulminante.
En cas d'ictère, l'arrêt immédiat de Clozapin Viatris s'impose (voir «Mises en garde et précautions/Autres précautions»).
Affections de la peau et du tissu sous-cutané
Très rare: Réaction cutanée.
Affections du rein et des voies urinaires
Fréquent: Incontinence urinaires, rétention urinaire.
Très rare: Néphrite tubulo-interstitielle, insuffisance rénale, défaillance rénale.
Affections des organes de reproduction et du sein
Très rare: Priapisme, impuissance, troubles de l'éjaculation, dysménorrhée.
Troubles généraux et anomalies au site d'administration
Fréquent: Fatigue, fièvre, hyperthermie bénigne, troubles de la régulation de la température et de la sudation.
Investigations
Rare: Élévation des taux de créatinine phosphokinase (CPK).
Très rare: Hyponatrémie.
De très rares cas de tachycardie ventriculaire, d'arrêt cardiaque et d'allongement de l'intervalle QT, éventuellement en rapport avec des torsades de pointes ont été rapportés, mais aucun lien de causalité probant avec le médicament n'a été établi.
Décès sous traitement
Il est connu que des cas de mort subite inexpliquée peuvent survenir chez des patients psychiatriques, aussi bien chez ceux qui reçoivent un traitement antipsychotique traditionnel que chez ceux qui ne reçoivent pas de traitement médicamenteux.
Des cas de mort subite, également chez de jeunes patients, ont été observés sous Clozapin Viatris; ils pourraient être en relation avec les effets indésirables cardiovasculaires (modifications de l'ECG, arythmies, cardiomyopathies et myocardites).
Liste des effets indésirables issus de l'expérience acquise après la commercialisation et émanant des rapports spontanés de cas individuels (fréquence inconnue (ne peut pas être estimée sur la base des données disponibles))
Infections et infestations
Septicémie.
Affections du système immunitaire
Syndrome d'hypersensibilité médicamenteuse avec éosinophilie et symptômes systémiques (DRESS, drug rash with eosinophilia and systemic symptoms), angio-œdème, vascularite leucocytoclastique.
Affections endocriniennes
Pseudo-phéochromocytome.
Troubles du métabolisme et de la nutrition
Adipositas.
Affections du système nerveux
Syndrome cholinergique, modifications de l'EEG, pleurothotonus (syndrome de Pise), syndrome des jambes sans repos (Restless-Legs-Syndrome).
Affections cardiaques
Infarctus du myocarde (parfois d'issue fatale), myocardite (parfois d'issue fatale), douleurs thoraciques/angine de poitrine, palpitations, fibrillation auriculaire, insuffisance mitrale en rapport avec une cardiomyopathie associée au Clozapin Viatris.
Affections vasculaires
Hypotension.
Affections respiratoires, thoraciques et médiastinales
Bronchoconstriction, épanchement pleural, syndrome d'apnées du sommeil, embarras de la respiration nasale.
Affections gastro-intestinales
Mégacôlon et infarctus intestinal/ischémie intestinale (parfois d'issue fatale), nécrose intestinale, ulcération et perforation de l'intestin pouvant avoir une issue fatale, diarrhées, douleurs abdominales, brûlures d'estomac, troubles digestifs, colite.
Affections hépatobiliaires
Stéatose hépatique, nécrose hépatique, toxicité hépatique, fibrose hépatique, cirrhose hépatique, lésions hépatiques et les conséquences potentiellement fatales y étant reliées, telles que défaillance hépatique, transplantation hépatique voir décès.
Affections de la peau et du tissu sous-cutané
Troubles de la pigmentation.
Affections musculo-squelettiques et du tissu conjonctif
Rhabdomyolyse, faiblesse musculaire, crampes musculaires, douleurs musculaires, lupus érythémateux disséminé.
Affections du rein et des voies urinaires
Insuffisance rénale, énurésie nocturne.
Affections des organes de reproduction et du sein
Ejaculation rétrograde.
Troubles généraux et anomalies au site d'administration
Polysérite.
Lésions, intoxications et complications liées aux procédures
Chutes (en rapport avec des convulsions induites par la clozapine, une somnolence, une hypotonie posturale, une instabilité motrice et sensorielle).
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageUn surdosage massif - que ce soit par inadvertance ou dans une intention suicidaire - met le malade dans une situation extrêmement critique!
Dans les cas de surdosage aigu intentionnel ou accidentel par Clozapin Viatris, sur l'issue desquels l'information est disponible, la mortalité se situe actuellement à environ 12%. La plupart des décès étaient associés à une insuffisance cardiaque ou une pneumonie causée par aspiration et ont été provoqués par des doses supérieures à 2000 mg. On a signalé des patients ayant récupéré après un surdosage supérieur à 10'000 mg. Toutefois, chez quelques adultes, en particulier lorsqu'ils n'étaient pas antérieurement exposés à Clozapin Viatris, l'ingestion de doses de seulement 400 mg a provoqué des états comateux graves et même le décès dans un cas. Chez le jeune enfant, la prise de 50 à 200 mg a entraîné une forte sédation ou un coma mais n'a pas été fatale.
Signes et symptômes
Somnolence, léthargie, coma, aréflexie, confusion, hallucinations, agitation, délire, symptômes extrapyramidaux, hyperréflexie, convulsions, ptyalisme, mydriase, thermolabilité (une hypothermie profonde peut se produire); hypotension, collapsus; tachycardie, troubles du rythme cardiaque (notamment bloc AV, extrasystoles), troubles de la conduction, pneumonie par aspiration, dyspnée, dépression ou insuffisance respiratoire.
Traitement
On ne connaît pas d'antidote spécifique. Les mesures générales suivantes sont indiquées:
lavage gastrique immédiat et répété, puis administration de charbon actif dans les 6 h suivant l'ingestion du médicament. Une dialyse péritonéale ou une hémodialyse est peu efficace.
Surveillance intensive, assistance respiratoire et circulatoire (ECG, surveillance électronique par moniteur).
Contrôle continu de l'équilibre hydro-électrolytique et acido-basique.
En cas d'oligurie ou d'anurie, dialyse péritonéale ou hémodialyse (les mesures de dialyse ne permettent toutefois pas d'éliminer le médicament beaucoup plus vite en raison de la forte liaison de la clozapine aux protéines plasmatiques).
Certains symptômes peuvent être influencés par des médicaments. Sont efficaces:
·Contre les manifestations anticholinergiques: les parasympathomimétiques, surtout la physostigmine (passe dans le SNC), sinon la pyridostigmine ou la néostigmine.
·Contre les troubles du rythme cardiaque: selon le tableau clinique; potassium, bicarbonate de sodium ou digitaliques; sont contre-indiqués quinidine et procaïnamide.
·Contre l'hypotension: perfusions (albumine, succédanés du plasma). Comme substances agissant sur la circulation, la dopamine ou l'angiotensine se sont montrées les plus efficaces; sont contre-indiqués adrénaline et autres sympathomimétiques à action bêta-adrénergique (induisent une vasodilatation supplémentaire).
·Contre les convulsions: diazépam i.v., phénytoïne en injection i.v. lente; sont contre-indiqués barbituriques à longue durée d'action.
Un effet tardif étant possible, le malade doit rester sous surveillance pendant au moins 5 jours.
Propriétés/EffetsCode ATC
N05AH02
Mécanisme d'action/Pharmacodynamique
Clozapin Viatris, un dérivé tricyclique de la dibenzodiazépine, est un antipsychotique qui sous les aspects pharmacologiques, thérapeutiques et cliniques se différencie des neuroleptiques conventionnels.
En expérimentation pharmacologique, la clozapine n'induit pas de catalepsie et n'inhibe pas les stéréotypies induites par l'apomorphine ou l'amphétamine. Elle possède une faible activité inhibitrice sur les récepteurs dopaminergiques D1, D2, D3 et D5, et, en plus de ses effets anti-alpha-adrénergiques, anticholinergiques, antihistaminiques et inhibiteurs des réactions d'éveil puissants, elle exerce une activité très forte en relation avec le récepteur D4. Elle possède également des propriétés antisérotoninergiques.
Efficacité clinique
En clinique, Clozapin Viatris exerce une action sédative rapide et intense et des effets antipsychotiques puissants, notamment chez les patients qui ne répondent pas aux autres traitements médicamenteux. Dans de pareils cas, Clozapin Viatris a permis de lever à la fois les symptômes schizophréniques positifs (productifs) et déficitaires. Une amélioration cliniquement significative a été observée chez près d'un tiers des patients au cours des 6 premières semaines de traitement, et chez environ 60% des patients qui ont continué le traitement jusqu'à 12 mois. En outre, une amélioration a été décrite dans quelques types de troubles de la perception.
Une étude d'une durée de 2 ans comparant l'utilisation chronique de Clozapin Viatris directement à un d'autres neuroleptiques atypiques a montré que Clozapin Viatris réduisait de manière significative le risque de comportement suicidaire chez les patients schizophréniques ou présentant un trouble schizoaffectif. Un effet aigu sur le comportement suicidaire dans l'utilisation à court terme ou un effet anti-suicidaire dans d'autres affections psychiatriques n'a pas été étudié et c'est pourquoi Clozapin Viatris ne doit pas être utilisé dans ces dernières indications. Clozapin Viatris ne doit pas être utilisé lors de dépressions avec symptômes psychotiques.
Dans cette étude, 980 patients ont reçu de manière randomisée soit le traitement avec Clozapin Viatris soit celui avec la substance active de contrôle. 62% des patients présentaient une schizophrénie, 38% un trouble schizoaffectif. Pour des raisons statistiques, le risque de comportement suicidaire a été mesuré au moyen de deux types d'évènements (Type 1 et type 2). Après deux ans de traitement, la probabilité cumulative d'apparition d'un événement de type 1 (i.e. tentative évidente de suicide, suicide avéré ou hospitalisations afin d'éviter un suicide) était plus faible chez les patients traités par Clozapin Viatris (24%) que chez ceux traités par un autre neuroleptique atypique (32%):
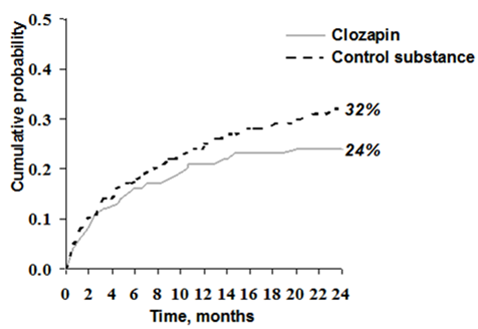
Fig.: Estimation Kaplan-Meier de la probabilité cumulative d'une tentative évidente de suicide, d'un suicide avéré ou d'hospitalisations afin d'éviter un suicide (évènements de type 1).
Les évènements de type 2 (en plus des évènements de type 1, le risque de comportement suicidaire a été mesuré à l'aide de plusieurs échelles) sont apparus chez 28% des patients sous clozapine et chez 37% des patients sous un autre neuroleptique atypique. Un suicide abouti a été observé chez 5 patients sous clozapine et chez 3 patients sous médication active de contrôle, cette différence n'était pas statistiquement significative.
Des études épidémiologiques chez des patients traités avec Clozapin Viatris ont de plus montré une diminution du taux de suicide et des tentatives de suicide d'environ 7 fois en comparaison avec des schizophrènes qui ne recevaient pas Clozapin Viatris.
Clozapin Viatris ne provoque pratiquement pas de troubles extrapyramidaux majeurs tels que dystonies aiguës ou syndrome parkinsonien patent. Les effets secondaires de type parkinsonien et l'acathésie sont rares. Contrairement aux neuroleptiques conventionnels, Clozapin Viatris n'augmente pas, ou à peine, le taux de prolactine de sorte que les effets indésirables tels que gynécomastie, aménorrhée, galactorrhée ou impuissance ne sont à prévoir que dans une moindre mesure.
PharmacocinétiqueAbsorption
L'absorption de Clozapin Viatris administré par voie orale est de 90-95%. Les aliments n'influencent ni la vitesse ni l'ampleur de l'absorption. La substance active de Clozapin Viatris, la clozapine, subit un important métabolisme de premier passage; la biodisponibilité absolue est de 50-60%. Suite à l'administration 2×/j les pics plasmatiques à l'état d'équilibre sont atteints en moyenne après 2,1 h (extrêmes 0,4-4,2 h).
Des augmentations de doses de 37,5 à 75 et 150 mg 2×/j en conditions d'équilibre ont produit une augmentation linéaire, proportionnelle à la dose, de l'AUC ainsi que les concentrations plasmatiques maximales et minimales.
Distribution
Le volume de distribution est de 1,6 l/kg.
La clozapine se lie à près de 95% aux protéines plasmatiques.
Métabolisme
La clozapine est métabolisée presque entièrement, par CYP1A2 et 3A4 et en partie aussi par CYP2C19 et 2D6, avant l'élimination. Parmi les métabolites principaux, seule la desméthylclozapine est pharmacologiquement active. Son effet est semblable à celui de la clozapine, cependant sensiblement plus faible et de plus courte durée.
Élimination
La clozapine est éliminée en deux phases; la demi-vie de la phase d'élimination terminale est de 12 h (entre 6 et 26 h).
Après administration de 75 mg, la demi-vie terminale moyenne était de 7,9 h; suite à l'administration de doses quotidiennes de 75 mg pendant au moins 7 jours en la demi-vie terminale moyenne était de 14,2 h en moyenne.
Dans l'urine et les selles, on ne retrouve que des traces de la substance inchangée. Environ 50% de la dose administrée sont éliminés sous forme métabolisée par voie rénale et 30% par les fèces.
Cinétique pour certains groupes de patients
Malgré l'absence d'études pharmacocinétiques et à en juger d'après le métabolisme et l'élimination de Clozapin Viatris, il convient d'être particulièrement prudent en présence d'une affection hépatique, biliaire ou rénale. Clozapin Viatris est contre-indiqué dans les formes graves de ces affections en raison du risque d'accumulation.
Données précliniquesMutagénicité
Des tests in vitro et in vivo n'ont montré aucun indice d'un potentiel mutagène pour la clozapine qui soit déterminant pour l'homme.
Carcinogénicité
Suite à l'administration de doses maximales tolérées (35 mg/kg/j) à des rats, aucun potentiel carcinogène n'a été observé pour la clozapine. De même aucune évidence d'un effet tumorigène n'a été observée chez la souris.
Toxicité sur la reproduction
Les études au sujet de la fertilité et du développement embryonnaire précoce réalisées chez le rat ont montré des effets sur les implantations et la croissance des fœtus jusqu'à une dose de 40 mg/kg. L'exposition chez le rat était environ 6 fois supérieure à celle observée chez l'être humain à une dose de 0,74 mg/kg. Chez le lapin, à une dose de 20 mg/kg, des avortements ont été observés chez 5 animaux; des effets postnataux ont été observés, mais leur pertinence en ce qui concerne le risque chez l'être humain est inconnue.
Lactation/développement post-natal: Chez les descendants de rates qui avaient reçu des doses allant jusqu'à 40 mg/kg/j de clozapine pendant la dernière phase de la grossesse et pendant la lactation, une réduction du taux de survivants a été observée et les jeunes étaient hyperactifs. Cependant, aucune incidence sur le développement n'a été constatée après le sevrage et la pertinence de ces observations pour l'homme n'est pas claire.
Remarques particulièresStabilité
Le médicament ne peut être utilisé que jusqu'à la date indiquée par «EXP» sur l'emballage.
Remarques particulières concernant le stockage
Ne pas conserver au-dessus de 30 °C.
Conserver hors de portée des enfants.
Numéro d’autorisation68560 (Swissmedic).
PrésentationComprimés à 25 mg (sécables, avec rainure de fragmentation): 50. [A]
Comprimés à 100 mg (sécables, avec rainure de fragmentation): 50. [A]
Titulaire de l’autorisationViatris Pharma GmbH, 6312 Steinhausen.
Mise à jour de l’informationAvril 2023.
[Version 102 F]
|

