Propriétés/EffetsCode ATC
L04AC21
Mécanisme d'action
Le bimekizumab est un anticorps monoclonal IgG1/κ humanisé qui se lie de manière sélective aux cytokines IL-17A, IL-17F et IL-17AF avec une affinité élevée, bloquant leur interaction avec le complexe récepteur IL-17RA/IL-17RC. Des concentrations élevées d'IL-17A et d'IL-17F ont été impliquées dans la pathogenèse de plusieurs maladies inflammatoires à médiation immunitaire, dont le psoriasis en plaques. Le bimekizumab inhibe ces cytokines pro-inflammatoires, ce qui entraîne la normalisation de l'inflammation cutanée et par conséquent une amélioration des symptômes cliniques associés au psoriasis. À partir de modèles in vitro, il a été démontré que le bimekizumab inhibe l'expression du gène lié au psoriasis et la production de cytokines dans une plus grande mesure que l'inhibition de l'IL-17A seule.
Pharmacodynamique
Aucune étude formelle sur la pharmacodynamique du bimekizumab n'a été menée.
Efficacité clinique
La sécurité d'emploi et l'efficacité du bimekizumab ont été évaluées chez 1 480 patients atteints de psoriasis en plaques modéré à sévère dans trois études de phase III multicentriques, randomisées, contrôlées par placebo et/ou par comparateur actif. Les patients étaient âgés d'au moins 18 ans, avaient un score PASI (indice d'étendue et de sévérité du psoriasis [Psoriasis Area and Severity Index]) ≥12 et un score d'évaluation globale des investigateurs (Investigators Global Assessment, IGA) ≥3 sur une échelle de 5 points, une surface corporelle (BSA, Body Surface Area) affectée par le psoriasis (PSO) ≥10 %, et étaient candidats pour un traitement systémique du psoriasis et/ou une photothérapie. L'efficacité et la sécurité d'emploi du bimekizumab ont été évaluées versus placebo et ustékinumab (BE VIVID – PS0009), versus placebo (BE READY –PS0013) et versus adalimumab (BE SURE – PS0008).
L'étude BE VIVID a évalué 567 patients pendant 52 semaines. Les patients y ont été randomisés afin de recevoir du bimekizumab (320 mg toutes les 4 semaines), de l'ustékinumab (en fonction du poids du patient 45 mg ou 90 mg à l'inclusion, à la semaine 4, puis toutes les 12 semaines) ou un placebo pendant une période initiale de 16 semaines, puis du bimekizumab (320 mg toutes les 4 semaines).
L'étude BE READY a évalué 435 patients pendant 56 semaines. Les patients ont été randomisés afin de recevoir du bimekizumab 320 mg toutes les 4 semaines ou un placebo. À la semaine 16, les patients ayant obtenu une réponse PASI 90 sont entrés dans une période randomisée de 40 semaines permettant un retrait. Les patients initialement randomisés pour recevoir du bimekizumab 320 mg toutes les 4 semaines ont été de nouveau randomisés afin de recevoir du bimekizumab 320 mg toutes les 4 semaines, du bimekizumab 320 mg toutes les 8 semaines ou un placebo (c'est-à-dire, retrait du bimekizumab). Les patients initialement randomisés pour recevoir un placebo ont continué à recevoir le placebo s'ils étaient répondeurs PASI 90. Les patients n'ayant pas obtenu une réponse PASI 90 à la semaine 16 sont entrés dans un bras d'échappement en ouvert et ont reçu du bimekizumab 320 mg toutes les 4 semaines pendant 12 semaines. Les patients en rechute (qui n'ont pas obtenu de réponse PASI 75) pendant la période randomisée permettant un retrait sont également entrés dans le bras d'échappement de 12 semaines.
L'étude BE SURE a évalué 478 patients pendant 56 semaines. Les patients ont été randomisés pour recevoir du bimekizumab 320 mg toutes les 4 semaines jusqu'à la semaine 56, du bimekizumab 320 mg toutes les 4 semaines jusqu'à la semaine 16 puis du bimekizumab 320 mg toutes les 8 semaines jusqu'à la semaine 56 ou de l'adalimumab selon la recommandation autorisée jusqu'à la semaine 24 puis du bimekizumab 320 mg toutes les 4 semaines jusqu'à la semaine 56.
Les caractéristiques à l'inclusion étaient homogènes sur l'ensemble des 3 études. La surface corporelle BSA médiane à l'inclusion était de 20 %, le score PASI médian à l'inclusion était de 18 et le score IGA à l'inclusion était sévère chez 33 % des patients. Les scores médians à l'inclusion des éléments douleur, démangeaisons et desquamation du Journal des Symptômes du patient (JSP) étaient compris entre 6 et 7 sur une échelle de 0 à 10 points et le score total médian de l'Indice de qualité de vie en dermatologie (Dermatology Life Quality Index, DLQI) était de 9.
Dans les 3 études, 38 % des patients avaient reçu un traitement biologique antérieur; 23 % avaient reçu au moins un agent anti-IL17 et 13 % avaient reçu au moins un anti-TNF. 22 % étaient naïfs de tout traitement systémique (biologique et non biologique) et 39 % des patients avaient précédemment reçu une photothérapie ou une photochimiothérapie.
L'efficacité du bimekizumab a été évaluée en termes d'impact sur la maladie cutanée globale, au niveau de régions corporelles spécifiques (cuir chevelu, ongles, paumes des mains et plantes des pieds), de symptômes rapportés par les patients et d'impact sur la qualité de vie. Les deux co-critères d'évaluation principaux dans les 3 études étaient la proportion de patients ayant obtenu 1) une réponse PASI 90 et 2) une réponse IGA « blanchi ou quasiment blanchi » (IGA 0/1 avec au moins deux points d'amélioration par rapport à l'inclusion) à la semaine 16. La réponse PASI 100, IGA 0 à la semaine 16 ainsi que la réponse PASI 75 à la semaine 4 étaient les critères d'évaluation secondaires les plus importants dans les 3 études.
Maladie cutanée globale
Le traitement par bimekizumab a entraîné une amélioration significative de tous les paramètres d'activité de la maladie par rapport au placebo, à l'ustékinumab ou à l'adalimumab à la semaine 16. Les principaux résultats d'efficacité sont présentés dans le Tableau 2.
Tableau 2: Résumé des réponses cliniques dans les études BE VIVID, BE READY et BE SURE
|
|
BE VIVID
|
BE READY
|
BE SURE
| |
|
Placebo
(n = 83)
n (%)
|
Bimekizumab 320 mg/4 sem.
(n = 321)
n(%))
|
Ustékinumab
(n = 163)
n (%)
|
Placebo
(n = 86)
n (%)
|
Bimekizumab 320 mg/4 sem.
(n = 349)
n (%)
|
Bimekizumab 320 mg/4 sem.
(n = 319)
n (%)
|
Adalimumab
(n = 159)
n (%)
| |
PASI 100
Semaine 16
|
0 (0,0)
|
188 (58,6)a
|
34 (20,9)
|
1 (1,2)
|
238 (68,2)a
|
194 (60,8)a
|
38 (23,9)
| |
PASI 90
Semaine 16
|
4 (4,8)
|
273 (85,0)a, b
|
81 (49,7)
|
1 (1,2)
|
317 (90,8)a
|
275 (86,2)a
|
75 (47,2)
| |
PASI 75
Semaine 4
Semaine 16
|
2 (2,4)
6 (7,2)
|
247 (76,9)a, b
296 (92,2)
|
25 (15,3)
119 (73,0)
|
1 (1,2)
2 (2,3)
|
265 (75,9)a
333 (95,4)
|
244 (76,5)a
295 (92,5)
|
50 (31,4)
110 (69,2)
| |
IGA 0
Semaine 16
|
0 (0,0)
|
188 (58,6)a
|
36 (22,1)
|
1 (1,2)
|
243 (69,6)a
|
-
|
-
| |
IGA 0/1
Semaine 16
|
4 (4,8)
|
270 (84,1)a, b
|
87 (53,4)
|
1 (1,2)
|
323 (92,6)a
|
272 (85,3)a
|
91 (57,2)
| |
PASI absolu ≤2
Semaine 16
|
3 (3,6)
|
273 (85,0)
|
84 (51,5)
|
1 (1,2)
|
315 (90,3)
|
280 (87,8)
|
86 (54,1)
| |
Douleurs JSP (n)
Semaine 16
|
(n = 54)
9 (16,7)
|
(n = 229)
177 (77,3)a
|
(n = 107)
73 (68,2)
|
(n = 67)
6 (9,0)
|
(n = 255)
201 (78,8)a
|
-
|
-
| |
Démangeaisons JSP (n)
Semaine 16
|
(n = 61)
8 (13,1)
|
(n = 244)
187 (76,6)a
|
(n = 117)
77 (65,8)
|
(n = 72)
4 (5,6)
|
(n = 278)
210 (75,5)a
|
-
|
-
| |
Desquamation JSP (n)
Semaine 16
|
(n = 63)
8 (12,7)
|
(n = 246)
193 (78,5)a
|
(n = 116)
69 (59,5)
|
(n = 70)
4 (5,7)
|
(n = 286)
223 (78,0)a
|
-
|
-
|
Bimekizumab 320 mg /4 sem. = bimekizumab toutes les 4 semaines. L'imputation des non-répondeurs (NRI) a été utilisée.
La réponse IGA 0/1 était définie comme Blanchi (0) ou Quasiment blanchi (1) avec une amélioration d'au moins 2 catégories entre l'inclusion et la semaine 16. La réponse IGA 0 était définie comme Blanchi (0) avec une amélioration d'au moins 2 catégories entre l'inclusion et la semaine 16.
JSP est un Journal des symptômes du patient. La réponse JSP est définie comme une évolution de l'inclusion à la semaine 16 ≥ un seuil défini (1,98, 2,39 et 2,86 respectivement pour les douleurs, les démangeaisons et la desquamation).
a) p < 0,001 versus placebo (BE VIVID et BE READY), versus adalimumab (BE SURE), ajusté pour la multiplicité.
b) p < 0,001 versus ustékinumab (BE VIVID), ajusté pour la multiplicité.
Le traitement par bimekizumab a été associé à une apparition rapide de l'efficacité. Dans l'étude BE VIVID, aux semaines 2 et 4, les taux de réponse PASI 90 étaient significativement plus élevés chez les patients traités par bimekizumab (12,1 % et 43,6 % respectivement) par rapport à ceux traités par placebo (1,2 % et 2,4 % respectivement) et par ustékinumab (1,2 % et 3,1 % respectivement).
Figure 1: Taux de répondeurs PASI 90 au fil du temps dans l'étude BE VIVID
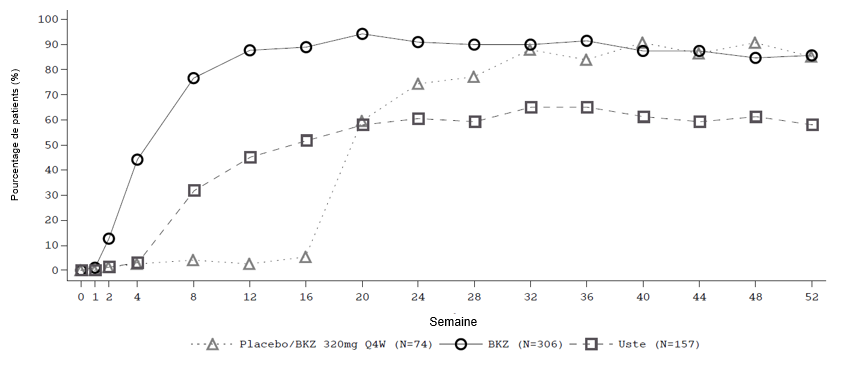
BKZ = Bimekizumab, Usté = Ustékinumab; la NRI est utilisée.
Remarque: Les patients du groupe placebo/BKZ sont passés du placebo au BKZ lors de la période d'entretien à partir de la semaine 16.
Dans l'étude BE VIVID, à la semaine 52, les patients traités par bimekizumab ont obtenu des taux de réponse significativement plus élevés que ceux traités par ustékinumab pour les critères d'évaluation PASI 90 (81,6 % sous bimekizumab vs 55,8 % sous ustékinumab, p < 0,001), de l'IGA 0/1 (77,9 % sous bimekizumab vs 60,7 % sous ustékinumab, p < 0,001) et du PASI 100 (64,2 % sous bimekizumab vs 38,0 % sous ustékinumab).
Dans l'étude BE SURE à la semaine 24, un pourcentage plus élevé de patients traités par bimekizumab ont obtenu des réponses PASI 90 et IGA 0/1 par rapport à l'adalimumab (85,6 % et 86,5 % respectivement vs 51,6 % et 57,9 % respectivement, p < 0,001). Parmi les 65 non-répondeurs à l'adalimumab à la semaine 24 (PASI < 90), 78,5 % ont obtenu une réponse PASI 90 après 16 semaines de traitement par bimekizumab. Chez les patients qui sont passés de l'adalimumab au bimekizumab, le profil de sécurité d'emploi est resté semblable. À la semaine 56, 70,2 % des patients traités par bimekizumab ont obtenu une réponse PASI 100.
Figure 2: Taux de répondeurs PASI 90 au fil du temps dans l'étude BE SURE
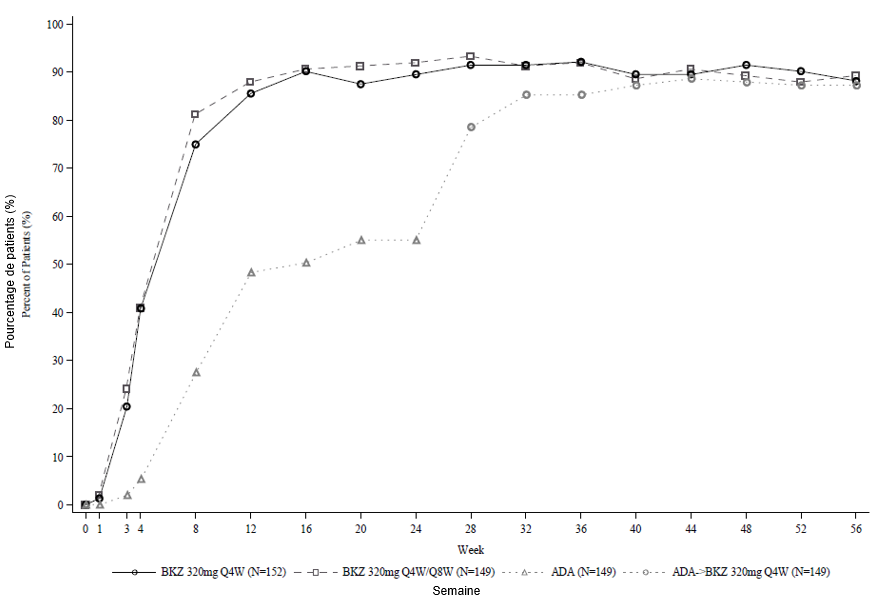
BKZ 320 mg /4 sem. = bimekizumab toutes les 4 semaines; BKZ 320 mg /8 sem. = bimekizumab toutes les 8 semaines; ADA = adalimumab.Remarque: Ce graphique ne contient que les patients ayant reçu du bimekizumab à la semaine 24 ou ultérieurement. Les patients du groupe BKZ /4 sem./8 sem. sont passés d'une administration /4 sem. à /8 sem. à la semaine 16. Les patients du groupe ADA/BKZ 320 mg /4 sem. sont passés de l'ADA au BKZ /4 sem. à la semaine 24. La NRI est utilisée.
L'efficacité du bimekizumab a été démontrée indépendamment de l'âge, du sexe, de l'origine ethnique, de la durée de la maladie, du poids corporel, de la sévérité PASI à l'inclusion et d'un traitement antérieur par un agent biologique. Le bimekizumab a été efficace chez les patients exposés à un agent biologique antérieur, notamment un anti-TNF/anti-IL-17 ainsi que chez les patients naïfs de traitement systémique. Compte-tenu des analyses PK/PD de population étayées par les données cliniques, les patients avec un poids corporel élevé (≥120 kg) qui n'avaient pas obtenu un blanchiment cutané complet à la semaine 16 ont bénéficié de la poursuite du bimekizumab 320 mg toutes les quatre semaines (/4 sem.) après les 16 premières semaines de traitement.
Dans l'étude BE SURE, les patients ont reçu du bimekizumab 320 mg /4 sem. jusqu'à la semaine 16, puis une administration /4 sem. ou toutes les huit semaines (/8 sem.) jusqu'à la semaine 56, indépendamment du statut de répondeur à la semaine 16. Les patients du groupe ≥120 kg (N = 37) traités par le schéma d'entretien /4 sem. ont présenté une amélioration plus importante du PASI 100 entre la semaine 16 (23,5 %) et la semaine 56 (70,6 %) par rapport à ceux traités par le schéma d'entretien 8 sem. (semaine 16: 45,0 % vs. semaine 56: 60,0 %).
Maintien de la réponse
Tableau 3: Maintien des réponses à la semaine 52 chez les répondeurs à la semaine 16*
|
PASI 100
|
PASI 90
|
IGA 0/1
|
PASI absolu ≤2
| |
BKZ 320 mg/4 sem./4 sem.
(N = 355)
n (%)
|
BKZ 320 mg/4 sem./8 sem.
(N = 182)
n (%)
|
BKZ 320 mg/4 sem./4 sem.
(N = 516)
n (%)
|
BKZ 320 mg/4 sem./8 sem.
(N = 237)
n (%)
|
BKZ 320 mg/4 sem./4 sem.
(N = 511)
n (%)
|
BKZ 320 mg/4 sem./8 sem.
(N = 234)
n (%)
|
BKZ 320 mg/4 sem. /4 sem.
(N = 511)
n (%)
|
BKZ 320 mg/4 sem./8 sem.
(N = 238)
n (%)
| |
295 (83,1)
|
161 (88,5)
|
464 (89,9)
|
214 (90,3)
|
447 (87,5)
|
214 (91,5)
|
460 (90,0)
|
215 (90,3)
|
* Analyse intégrée des études BE VIVID, BE READY et BE SURE. La NRI est utilisée.
BKZ 320 mg /4 sem.: bimekizumab 320 mg toutes les 4 semaines, puis bimekizumab 320 mg toutes les 4 semaines à partir de la semaine 16. BKZ 320 mg /8 sem.: bimekizumab 320 mg toutes les 4 semaines, puis bimekizumab 320 mg toutes les 8 semaines à partir de la semaine 16.
Durabilité de la réponse PASI 90 (après l'arrêt du bimekizumab)
Figure 3: Taux de répondeurs PASI 90 au fil du temps – Période randomisée permettant un retrait de l'étude BE READY
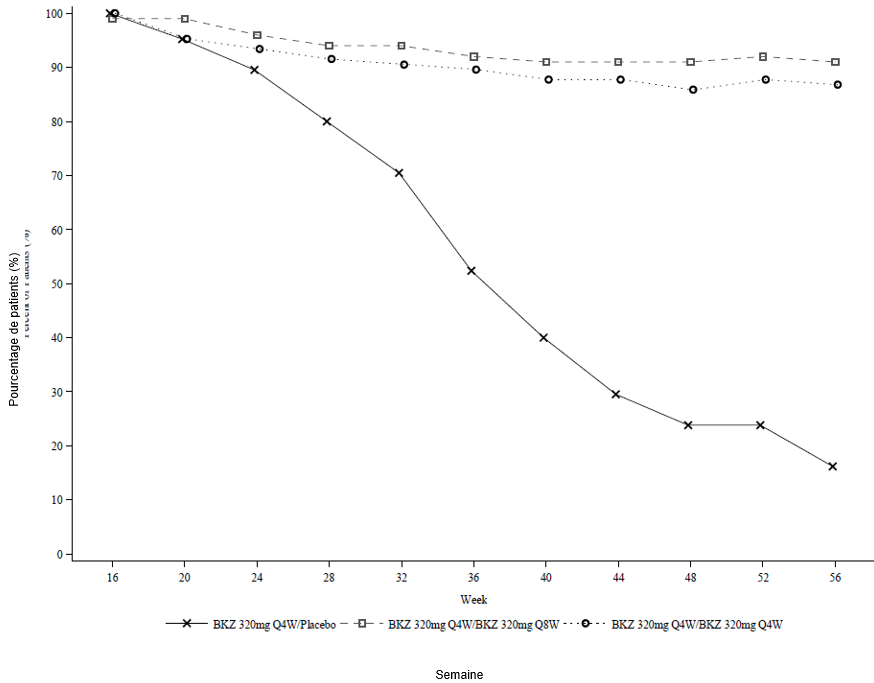
La NRI est utilisée.
Dans l'étude BE READY, pour les répondeurs PASI 90 à la semaine 16 qui ont été à nouveau randomisés afin de recevoir le placebo et de retirer le bimekizumab, le délai médian jusqu'à la rechute, définie comme une perte de réponse PASI 75, était d'environ 28 semaines (32 semaines après la dernière dose de bimekizumab). Parmi ces patients, 88,1 % ont de nouveau obtenu une réponse PASI 90 dans les 12 semaines suivant la reprise du traitement par bimekizumab 320 mg toutes les 4 semaines.
Régions corporelles spécifiques
Au cours des études BE VIVID et BE READY, des améliorations du psoriasis du cuir chevelu, des ongles, de la paume des mains et de la plante des pieds ont été observées chez les patients traités par bimekizumab vs. placebo à la semaine 16 (voir Tableau 4).
Tableau 4: Réponses des régions corporelles spécifiques dans les études BE VIVID et BE READY à la semaine 16
|
|
BE VIVID
|
BE READY
| |
|
Placebo
|
BKZ 320 mg /4 sem.
|
Ustékinumab
|
Placebo
|
BKZ 320 mg /4 sem.
| |
IGA cuir chevelu (n)a
IGA cuir chevelu 0/ 1, n(%)
|
(72)
11 (15,3)
|
(285)
240 (84,2)b
|
(146)
103 (70,5)
|
(74)
5 (6,8)
|
(310)
286 (92,3)b
| |
IGA-pp (n)a
IGA-pp 0/1, n (%)
|
(29)
7 (24,1)
|
(105)
85 (81,0)
|
(47)
39 (83,0)
|
(31)
10 (32,3)
|
(97)
91 (93,8)
| |
mNAPSI 100 (n)a
mNAPSI 100, n(%)
|
(51)
4 (7,8)
|
(194)
57 (29,4)
|
(109)
15 (13,8)
|
(50)
3 (6,0)
|
(210)
73 (34,8)
|
La NRI est utilisée.
a) Comprend uniquement les patients avec une évaluation globale de l'investigateur (IGA) du cuir chevelu de 2 ou plus, une IGA palmo-plantaire de 2 ou plus et un score de l'Indice modifié de gravité du psoriasis unguéal (modified Nail Psoriasis Severity Index, mNAPSI) > 0 à l'inclusion. Les réponses IGA 0/1 pour le cuir chevelu et palmo-plantaire (IGA-pp 0/1) ont été définies comme Blanchi (0) ou Quasiment blanchi (1) avec une amélioration d'au moins 2 catégories par rapport à l'inclusion.
b) p < 0,001 versus placebo, ajusté pour la multiplicité.
Les réponses IGA du cuir chevelu et palmo-plantaire se sont maintenues jusqu'à la semaine 52/56. Le psoriasis unguéal a continué à s'améliorer au-delà de la semaine 16. Dans l'étude BE VIVID, à la semaine 52, une plus grande proportion de patients traités par bimekizumab a obtenu une disparition complète du psoriasis unguéal (mNAPSI 100) que chez les patients traités par ustékinumab (60,3 % contre 40,4 %). Dans l'étude BE READY, à la semaine 56, 67,7 % et 69,8 % des répondeurs PASI 90 à la semaine 16 ont obtenu une disparition complète du psoriasis unguéal sous respectivement bimekizumab 320 mg toutes les 8 semaines et bimekizumab 320 mg toutes les 4 semaines.
Qualité de vie / Résultats rapportés par le patient
Dans les 3 études, à la semaine 16, le psoriasis ne présentait plus aucun impact sur la qualité de vie, mesurée par l'Indice de la qualité de vie en dermatologie (DLQI) chez une plus grande proportion de patients traités par bimekizumab.
Dans l'étude BE READY, le taux de réponse DLQI 0/1 (pas d'impact du psoriasis sur la qualité de vie) à la semaine 16 était de 75,6 % dans le groupe bimekizumab contre 5,8 % dans le groupe placebo.
Dans l'étude BE VIVID, les taux de réponse DLQI 0/1 à la semaine 16 étaient de 67,3 %, 42,3 % et 12,0 % respectivement dans les groupes bimekizumab, ustékinumab- et placebo. Les réponses DLQI 0/1 ont continué à augmenter au-delà de la semaine 16, puis se sont maintenues jusqu'à la semaine 52 (74,8 % chez les patients traités par bimekizumab 320 mg toutes les 4 semaines).
Dans l'étude BE SURE, les taux de réponse DLQI 0/1 à la semaine 16 étaient de 63,0 % et 46,5 % respectivement dans les groupes bimekizumab et adalimumab. Le taux de réponse DLQI 0/1 à la semaine 56 était de 78,9 % et de 74,1 % chez les patients traités par bimekizumab 320 mg toutes les 8 semaines et par bimekizumab 320 mg toutes les 4 semaines, respectivement.
|



