Propriétés/EffetsATC-Code
Code ATC : V03AX04
Mécanisme d’action
La difélikéfaline est un agoniste sélectif des récepteurs opioïdes kappa, à faible pénétration dans le SNC.
Les récepteurs opioïdes sont connus pour moduler les signaux de démangeaison et l’inflammation, l’activation des récepteurs opioïdes kappa réduisant les démangeaisons et produisant des effets immunomodulateurs.
Pharmacodynamique
Le rapport exposition/effet de la difélikéfaline et l’évolution dans le temps de la réponse pharmacodynamique ne sont pas connus.
Influence sur l’électrocardiogramme
À une posologie correspondant à 6 fois la dose recommandée, la difélikéfaline ne produit pas d’allongement cliniquement significatif de l’intervalle QTc.
Efficacité clinique
Études contrôlées par placebo
Dans deux études cliniques pivots de phase III de conception similaire, en double aveugle, randomisées et contrôlées par placebo (KALM 1 et KALM 2), des patients atteints de maladie rénale chronique sous hémodialyse et présentant un prurit modéré à sévère ont reçu soit un placebo, soit 0,5 microgramme/kg de difélikéfaline par voie intraveineuse 3 fois par semaine après la session d’hémodialyse, pendant 12 semaines. Un maximum de 4 doses était autorisé chez les patients nécessitant une dialyse supplémentaire dans une même semaine. Cette phase de traitement en double aveugle a été suivie d’une phase de prolongation ouverte de 52 semaines avec traitement actif uniquement. Le critère d’évaluation principal des deux études était le pourcentage de patients qui, après 12 semaines, atteignaient une réduction d’au moins 3 points sur l’échelle Worst Itching Numerical Rating Scale (les valeurs WI-NRS se situent entre 0 et 10, les valeurs plus élevées représentant une plus forte intensité de la démangeaison) par rapport à la valeur initiale. Les critères d’évaluation secondaires les plus importants, qui étaient cohérents dans les deux études, étaient le pourcentage de patients présentant une amélioration du score WI-NRS d’au moins 4 points après 12 semaines, et les changements de la sévérité des démangeaisons et de la qualité de vie (QdV) liée aux démangeaisons, mesurés par le Skinindex-10 total et l’échelle de démangeaison 5-D. Les critères d’inclusion les plus importants étaient la maladie rénale chronique avec hémodialyse trois fois par semaine depuis au moins 3 mois, un prurit modéré à sévère (WI-NRS >4 à l’inclusion) et une hémodialyse appropriée. Les principaux critères d’exclusion étaient le prurit d’origine autre que la maladie rénale chronique ou des complications associées, les démangeaisons sur la paume des mains et les démangeaisons survenant uniquement lors des séances d’hémodialyse.
Les 2 études combinées ont recruté 851 patients. L’âge moyen était de 59 ans, 33,1 % étaient âgés de 65 ans ou plus, 60 % des patients étaient des hommes. Les caractéristiques de la maladie au début de l’étude, comme l’administration de médicaments pour soulager le prurit, le délai depuis l’établissement du diagnostic de la maladie rénale chronique et la durée du prurit, étaient comparables dans les bras sous traitement actif et sous placebo. La valeur moyenne du WI-NRS à l’inclusion était de 7,18 dans les deux bras; la valeur moyenne du score WI-NRS à l’inclusion était de 7,13 (intervalle de 4,2 à 10) dans le groupe difélikéfaline et de 7,13 (intervalle de 4,1 à 10) dans le groupe placebo. Au total, 38 % des patients avaient déjà utilisé des médicaments pour traiter le prurit auparavant. Dans toutes les études, la difélikéfaline a significativement amélioré la sévérité des démangeaisons et la qualité de vie liée aux démangeaisons sur 12 semaines, comme le montre le tableau 2.
Tableau 2 : Résumé des critères d’évaluation principaux et secondaires les plus importants des études KALM-1 et KALM-2 et de la base de données groupée après la semaine 12
|
Critère d’évaluation à la
fin de la semaine 12
|
KALM-1 (n = 378)
|
KALM-2 (n = 473)
| |
Difélikéfaline
(n = 189)
|
Placebo
(n = 189)
|
Difélikéfaline
(n = 237)
|
Placebo
(n = 236)
| |
Critère d’évaluation principal
|
|
|
|
| |
WI-NRS
|
|
|
|
| |
Patients avec une amélioration de ≥ 3 points (%)
|
51,0 %
(p < 0,001)
|
27,6 %
|
54,0 %
(p = 0,02)
|
42,2 %
| |
Critère d’évaluation secondaire
|
|
|
|
| |
WI-NRS
Patients avec une amélioration de ≥ 4 points (%)
|
38,9 %
(p < 0,001)
|
18,0 %
|
41,2 %
(p = 0,01)
|
28,4 %
| |
Skindex-10
Changement par rapport à l’inclusion
[Points]
|
-17,2
(p < 0,001)
|
-12,0
|
-16,6
(p = 0,171)
|
-14,8
| |
Prurit 5-D
Changement par rapport à l’inclusion
[Points]
|
-5,0
(p < 0,001)
|
-3,7
|
-4,9
(p = 0,002)
|
-3,8
|
La figure 1 illustre le pourcentage moyen de patients des études KALM-1 et KALM-2 présentant une amélioration du score WI-NRS de ≥ 3 points par rapport à la valeur initiale par semaine d’étude. Sur la base des rapports de cotes, des améliorations statistiquement significatives en faveur du groupe difélikefaline ont été observées à la semaine 3 dans l’étude KALM-1 et à la semaine 2 dans l’étude KALM-2, se poursuivant chaque semaine suivante jusqu’à la semaine 12 dans les deux études.
Figure 1 : Pourcentage de patients avec une amélioration de ≥ 3 points du score WI-NRS par semaine dans les études KALM-1 et KALM-2 (population ITT)
KALM-1
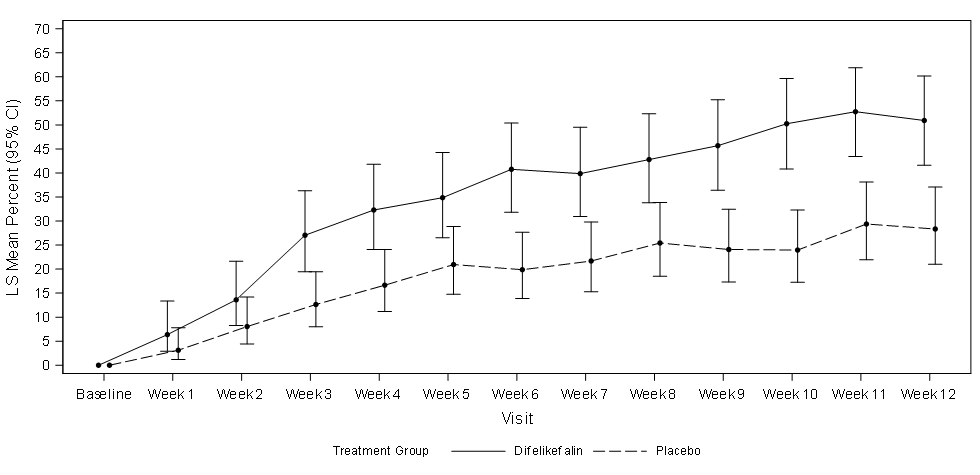
IC = intervalle de confiance ; ITT = Intention To Treat (intention de traiter) ; MC = moindres carrés ; WI-NRS = Worst Itching-Numerical Rating Scale (échelle d’évaluation numérique des pires démangeaisons)
KALM-2
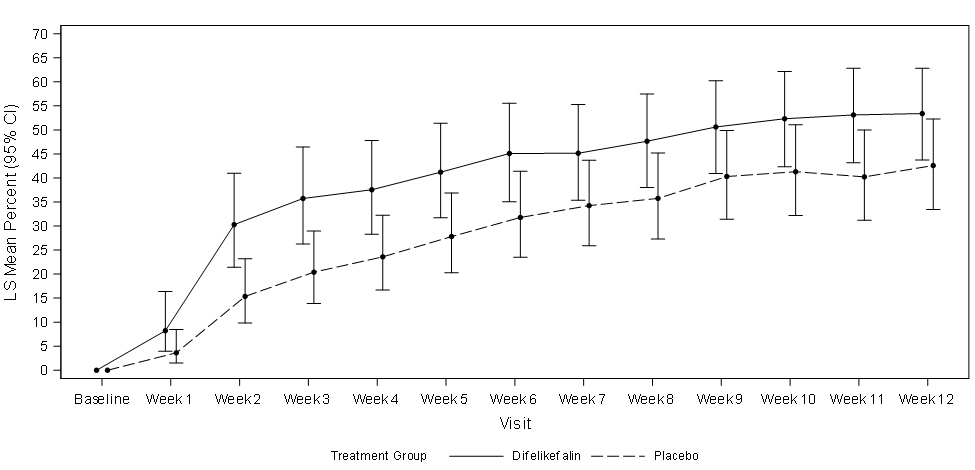
IC = intervalle de confiance ; ITT = Intention To Treat (intention de traiter) ; MC = moindres carrés ; WI-NRS = Worst Itching-Numerical Rating Scale (échelle d’évaluation numérique des pires démangeaisons)
Études de prolongation en phase ouverte
Chez les patients qui sont passés du placebo à la difélikefaline à la fin de la période de traitement en double aveugle, une amélioration sur l’échelle des démangeaisons 5-D a été observée après une période de traitement de 4 semaines, avec une moyenne des moindres carrés (écart-type) de la modification par rapport à l’inclusion semblable à celle des patients qui ont reçu de la difélikefaline depuis le début de l’essai : -6,0 (0,22) contre -5,7 (0,23). L’amélioration sur l’échelle des démangeaisons 5-D a été maintenue dans les deux groupes de traitement pendant la période de traitement de 52 semaines.
|


