CompositionPrincipes actifs
Pegcétacoplan
Excipients
Sorbitol (E420), acide acétique glacial (E260), acétate de sodium trihydraté (E262), hydroxyde de sodium (pour ajustement du pH, E524), eau pour préparations injectables.
Contient 41 mg/ml de sorbitol (820 mg/flacon) et au maximum 0,37 mg/ml de sodium (7,4 mg/flacon).
Indications/Possibilités d’emploiAspaveli est indiqué en monothérapie pour le traitement de l’hémoglobinurie paroxystique nocturne (HPN) chez les patients adultes qui présentent une anémie hémolytique (voir Posologie/Mode d’emploi et Efficacité clinique).
Posologie/Mode d’emploiAspaveli est administré en perfusion sous-cutanée.
Le traitement doit être instauré sous la surveillance d’une personne exerçant une profession médicale qui est expérimentée en matière de prise en charge des affections hématologiques.
Aspaveli est destiné à être administré par voie sous-cutanée à l’aide d’une pompe à perfusion avec seringue disponible dans le commerce. Une auto-administration est possible. Aspaveli doit être administré dans l’abdomen, les cuisses, les hanches ou le haut des bras.
L’auto-administration et la perfusion à domicile devront être envisagées pour les patients qui ont bien toléré le traitement dans des centres de traitement expérimentés. Une éventuelle auto-administration et une perfusion à domicile doivent être décidées après évaluation et sur recommandation du médecin du patient.
L’hémoglobinurie paroxystique nocturne (HPN) est une maladie chronique et il est recommandé de poursuivre le traitement par Aspaveli à vie, sauf si l’arrêt de ce dernier est cliniquement indiqué (voir Mises en garde et précautions).
Posologie usuelle
Aspaveli peut être administré par un professionnel de santé, ou par le patient lui-même ou son aidant en suivant les instructions appropriées.
Aspaveli doit être administré deux fois par semaine sous la forme d’une perfusion sous-cutanée à 1080 mg réalisée à l’aide d’une pompe à perfusion avec seringue disponible dans le commerce qui permet de délivrer des volumes allant jusqu’à 20 ml. Les deux doses hebdomadaires doivent être administrées le jour 1 et le jour 4 de chaque semaine de traitement (voir Mode d’administration).
Avant le traitement par Aspaveli:
·Patients déjà vaccinés: il convient de s’assurer que la vaccination contre des bactéries encapsulées telles que Streptococcus pneumoniae, Neisseria meningitidis des types A, C, W, Y et B et Haemophilus influenzae de type B (Hib) a eu lieu dans les deux ans précédant le début du traitement par Aspaveli (voir Mises en garde et précautions).
·Patients non vaccinés auparavant: les vaccins nécessaires doivent être administrés au moins deux semaines avant l’administration de la première dose d’Aspaveli (voir Mises en garde et précautions).
oSi un traitement immédiat par Aspaveli est indiqué, il convient de réaliser les vaccinations nécessaires dès que possible et de prescrire au patient des médicaments antibactériens pour un traitement prophylactique de deux semaines (voir Mises en garde et précautions).
Passage d’un inhibiteur de C5 à Aspaveli
·Pendant les quatre premières semaines, Aspaveli doit être administré à raison de deux doses sous-cutanées de 1080 mg par semaine en complément de la dose d’inhibiteur de C5 déjà administrée, afin de limiter le risque d’hémolyse liée à un arrêt brutal du traitement.
·Au-delà des quatre semaines, le patient doit arrêter le traitement par l’inhibiteur de C5 et poursuivre le traitement par Aspaveli en monothérapie.
·Le passage d’inhibiteurs complémentaires autres qu’éculizumab au pegcétacoplan n’a pas été étudié. L’arrêt d’autres inhibiteurs complémentaires avant d’avoir atteint l’état d’équilibre du pegcétacoplan doit être effectué avec prudence (voir Pharmacocinétique).
Ajustement de la posologie
·La posologie peut être ajustée à 1080 mg tous les trois jours (c’est-à-dire jour 1, jour 4, jour 7, jour 10, jour 13, etc.) si le patient présente un taux de lactate déshydrogénase (LDH) supérieur à deux fois la limite supérieure de la normale (ULN, upper limit of normal).
·En cas d’augmentation de la dose, le taux de LDH devra être surveillé deux fois par semaine pendant au moins quatre semaines.
En cas d’oubli d’une dose
Si une dose d’Aspaveli a été oubliée, il convient de l’administrer dès que possible, puis de poursuivre le traitement selon le schéma posologique habituel.
Instructions posologiques particulières
Patients présentant des troubles de la fonction hépatique
La sécurité et l’efficacité du pegcétacoplan n’ont pas été étudiées chez des patients qui présentent des troubles de la fonction hépatique; cependant, aucun ajustement posologique n’est préconisé, car l’insuffisance hépatique ne devrait pas avoir d’impact sur la clairance du pegcétacoplan (voir Pharmacocinétique).
Patients présentant des troubles de la fonction rénale
Une insuffisance rénale sévère (clairance de la créatinine < 30 ml/min) n’a eu aucun impact sur la pharmacocinétique du pegcétacoplan; par conséquent, il n’est pas nécessaire d’ajuster la dose de pegcétacoplan chez les patients atteints d’insuffisance rénale. Aucune donnée n’est disponible concernant l’utilisation du pegcétacoplan chez les patients atteints d’insuffisance rénale terminale (IRT) nécessitant une hémodialyse (voir Pharmacocinétique).
Patients âgés
Bien qu’aucune différence manifeste liée à l’âge n’ait été observée au cours des études cliniques et qu’aucun élément n’indique que des précautions particulières doivent être prises lors du traitement de patients âgés, le nombre de patients âgés de 65 ans et plus n’était pas suffisant pour déterminer s’il existe des différences liées à l’âge.
Enfants et adolescents
La sécurité et l’efficacité du pegcétacoplan chez les enfants atteints d’HPN âgés de 0 à moins de 18 ans ne sont pas établies. Aucune donnée n’est disponible.
Mode d’administration
Aspaveli doit être exclusivement administré par voie sous-cutanée à l’aide d’une pompe à perfusion avec seringue permettant de délivrer des doses d’un volume nominal de 20 ml.
Lors de l’instauration du traitement par Aspaveli, un professionnel de santé qualifié doit former le patient aux techniques de perfusion, à l’utilisation d’une pompe à perfusion avec seringue, à la tenue d’un carnet de suivi du traitement, à l’identification des effets indésirables possibles et aux mesures à prendre le cas échéant.
Aspaveli doit être administré par perfusion sous-cutanée dans l’abdomen, la cuisse ou le haut du bras. Les différents sites de perfusion doivent être espacés d’au moins 7,5 cm. Il convient de changer de site de perfusion à chaque administration et d’éviter toute perfusion dans des zones où la peau est sensible, contusionnée, rouge ou dure ainsi que dans les tatouages, les cicatrices ou les vergetures.
La durée habituelle de la perfusion est d’environ 30 minutes (si deux sites sont utilisés) ou d’environ 60 minutes (si un seul site est utilisé). La perfusion doit débuter dès qu’Aspaveli a été prélevé dans la seringue. L’administration doit être terminée dans les deux heures qui suivent la préparation de la seringue.
Voir Remarques concernant la manipulation.
Contre-indicationsAspaveli est contre-indiqué chez les patients:
·qui présentent une hypersensibilité au pegcétacoplan ou à l’un des excipients;
·qui présentent une infection non guérie due à une bactérie encapsulée telle que Streptococcus pneumoniae, Neisseria meningitidis et Haemophilus influenzae;
·qui n’ont pas reçu à ce jour de vaccination contre Neisseria meningitidis, Streptococcus pneumoniae et Haemophilus influenzae, à moins qu’ils ne reçoivent un traitement prophylactique par des antibiotiques appropriés jusqu’à deux semaines après la vaccination.
Mises en garde et précautionsInfections graves dues à des bactéries encapsulées
L’administration de pegcétacoplan peut entraîner des infections graves dues à des bactéries encapsulées telles que Streptococcus pneumoniae, Neisseria meningitidis et Haemophilus influenzae. Afin de réduire le risque d’infection, tous les patients doivent être vaccinés contre ces bactéries, conformément aux directives locales en vigueur, au moins deux semaines avant le début du traitement par pegcétacoplan, sauf si le risque d’un report du traitement par pegcétacoplan est supérieur au risque d’infection.
Patients déjà vaccinés auparavant
Avant de démarrer le traitement par pegcétacoplan, il convient de vérifier que les patients déjà vaccinés ont bien reçu des vaccins contre des bactéries encapsulées, dont Streptococcus pneumoniae, Neisseria meningitidis des types A, C, W, Y et B, et Haemophilus influenzae de type B, dans les deux ans précédant le début du traitement par pegcétacoplan.
Patients pas encore vaccinés
Les patients qui ne sont pas encore vaccinés doivent recevoir les vaccins nécessaires au moins deux semaines avant l’administration de la première dose de pegcétacoplan. Si un traitement immédiat est indiqué, les vaccins nécessaires doivent être administrés dès que possible et le patient doit recevoir un traitement par des antibiotiques appropriés jusqu’à deux semaines après la vaccination.
La vaccination pourrait ne pas suffire à prévenir une infection grave. Les recommandations officielles pour l’utilisation appropriée des antibiotiques devront être prises en considération. Tous les patients devront être suivis afin de surveiller l’apparition de signes précoces d’infections dues à des bactéries encapsulées telles que Neisseria meningitidis, Streptococcus pneumoniae et Haemophilus influenzae, être évalués immédiatement en cas de suspicion d’une infection et recevoir un traitement antibiotique approprié si besoin. Les patients doivent être informés des signes et symptômes associés et être invités à consulter immédiatement un médecin, le cas échéant.
Hypersensibilité
Des réactions d’hypersensibilité ont été rapportées. Si une réaction d’hypersensibilité sévère (y compris une anaphylaxie) survient, la perfusion de pegcétacoplan doit être immédiatement arrêtée et un traitement approprié doit être instauré.
Surveillance des manifestations de l’HPN après l’arrêt du traitement par pegcétacoplan
Lors de l’arrêt du traitement par pegcétacoplan chez les patients atteints d’HPN, l’apparition de signes et symptômes d’une hémolyse intravasculaire grave doit être étroitement surveillée. L’hémolyse intravasculaire se manifeste par des taux de LDH élevés accompagnés d’une diminution soudaine de la taille du clone HPN ou du taux d’hémoglobine, ou par une réapparition de symptômes tels qu’une fatigue, une hémoglobinurie, des douleurs abdominales, une dyspnée, un événement vasculaire indésirable majeur (y compris thrombose), une dysphagie ou une dysfonction érectile. S’il est nécessaire de stopper l’administration de pegcétacoplan, un autre traitement doit être envisagé, car, sans traitement, l’HPN menace le pronostic vital. En cas de survenue d’une hémolyse grave après l’arrêt du traitement, il faut envisager les procédures ou traitements suivants: transfusion sanguine (concentrés érythrocytaires), exsanguino-transfusion, traitement anticoagulant ou corticoïdes. Les patients doivent être étroitement surveillés pendant au moins huit semaines après l’administration de la dernière dose afin de détecter une hémolyse grave et d’autres réactions. Un sevrage lent doit par ailleurs être envisagé.
Contraception chez les femmes en âge de procréer
Il est recommandé aux femmes en âge de procréer d’utiliser des méthodes de contraception efficaces pour éviter une grossesse durant le traitement par le pegcétacoplan et pendant au moins 8 semaines après la dernière dose de pegcétacoplan (voir Grossesse, Allaitement).
Accumulation de polyéthylène glycol (PEG)
Aspaveli est un médicament pegylé. Les effets potentiels à long terme de l’accumulation de PEG dans les reins, dans les plexus choroïdes du cerveau et d’autres organes, sont inconnus (voir Données précliniques). Il est recommandé de réaliser régulièrement des analyses biologiques permettant d’évaluer la fonction rénale.
Matériel éducatif
Tous les médecins qui ont l'intention de prescrire ASPAVELI doivent s'assurer qu'ils ont reçu le matériel éducatif pour les médecins et qu'ils en ont pris connaissance . Les médecins doivent expliquer et discuter des avantages et des risques du traitement par ASPAVELI avec le patient, et lui remettre le dossier d’information du patient et la carte de sécurité du patient. Le patient doit être informé qu'il doit consulter rapidement un médecin s’il présente un quelconque signe ou symptôme d’infection grave ou d’hypersensibilité pendant le traitement par ASPAVELI, en particulier s'il est révélateur d’une infection par des bactéries encapsulées.
Effets sur les analyses biologiques
Des interférences sont possibles entre les réactifs à base de silice utilisés pour les panels d’analyse de la coagulation et le pegcétacoplan, entraînant un allongement artificiel du temps de céphaline activée (TCA). L’utilisation de réactifs à base de silice pour les panels d’analyse de la coagulation devra donc être évitée.
Sorbitol
Ce médicament contient 820 mg de sorbitol par flacon de 20 ml. Les patients présentant une intolérance héréditaire au fructose (IHF) ne doivent pas recevoir ce médicament.
Sodium
Ce médicament contient 7,4 mg de sodium par flacon de 20 ml, c.-à-d. qu’il est essentiellement «sans sodium».
InteractionsAucune étude d’interaction n’a été réalisée. D’après les données in vitro, le risque d’interactions cliniques entre le pegcétacoplan et d’autres médicaments est faible.
Grossesse, AllaitementFemmes en âge de procréer
Il est recommandé aux femmes en âge de procréer d’utiliser des méthodes de contraception efficaces pour éviter une grossesse durant le traitement par le pegcétacoplan et pendant au moins huit semaines après la dernière dose de pegcétacoplan.
Pour les femmes ayant un projet de grossesse, l’utilisation de pegcétacoplan ne doit être envisagée qu’après évaluation du rapport bénéfice/risque (voir Grossesse).
Grossesse
Les données disponibles sur l’utilisation de pegcétacoplan chez la femme enceinte sont limitées, voire inexistantes. Les études effectuées chez l’animal ont mis en évidence une toxicité sur la reproduction (voir Données précliniques).
Le pegcétacoplan ne doit pas être utilisé pendant la grossesse et chez les femmes en âge de procréer n’utilisant pas de contraception, sauf si l’état clinique de la patiente exige un traitement par le pegcétacoplan.
Allaitement
On ne sait pas si le pegcétacoplan passe dans le lait maternel. Une excrétion minime (moins de 1 %, excrétion non significative d’un point de vue pharmacologique) du pegcétacoplan dans le lait maternel a été mise en évidence chez des guenons. Il est improbable que l’exposition soit cliniquement significative chez le nourrisson allaité (voir Données précliniques).
Il est recommandé de ne pas allaiter pendant le traitement par le pegcétacoplan.
Fertilité
Les répercussions du pegcétacoplan sur la fertilité n’ont pas été étudiées chez l’animal. Lors d’études de toxicité menées chez le singe, aucune anomalie microscopique n’a été constatée au niveau des organes reproductifs des mâles et des femelles (voir Données précliniques).
Effet sur l’aptitude à la conduite et l’utilisation de machinesAspaveli n’a aucune influence ou a une influence négligeable sur l’aptitude à la conduite ou l’utilisation de machines.
Effets indésirablesRésumé du profil de sécurité
Les effets secondaires signalés le plus fréquemment chez les patients traités par pegcétacoplan ont été des réactions au site d’injection: érythème au site d’injection, prurit au site d’injection, gonflement au site d’injection, douleur au site d’injection et hématome au site d’injection. D’autres effets indésirables rapportés chez plus de 10 % des patients au cours des études cliniques étaient une infection des voies aériennes supérieures, une diarrhée, une hémolyse, des douleurs abdominales, des céphalées, de la fatigue, de la fièvre, une toux, une infection des voies urinaires, une complication de la vaccination, des douleurs dans les extrémités, une sensation vertigineuse, une arthralgie et une dorsalgie. Les effets indésirables graves signalés le plus fréquemment ont été l’hémolyse et le sepsis.
Liste des effets indésirables
Le tableau 1 présente les effets indésirables observés dans les études cliniques avec le pegcétacoplan chez des patients atteints d’HPN. Les effets indésirables sont rangés par classe de système d’organes de la classification MedDRA et par fréquence selon la convention suivante: très fréquents (≥ 1/10), fréquents (≥ 1/100, < 1/10), occasionnels (≥ 1/1‘000, < 1/100), rares (≥ 1/10‘000, < 1/1‘000), très rares (< 1/10‘000) et fréquence inconnue (ne peut être estimée sur la base des données disponibles).
Au sein de chaque catégorie de fréquence, les effets indésirables sont présentés en respectant un ordre décroissant en termes de sévérité.
Tableau 1 Effets indésirables
|
Classe de système d’organes selon la classification MedDRA
|
Fréquence
|
Effet indésirable
| |
Infections et infestations
|
Très fréquents
|
Infection des voies aériennes supérieures
Infection des voies urinaires
| |
Fréquents
|
Sepsis1
COVID-19
Infection gastro-intestinale
Infection fongique
Infection cutanée
Infection buccale
Infection de l’oreille
Infection
Infection des voies aériennes
Infection virale
Infection bactérienne
Infection vaginale
Infection oculaire
| |
Occasionnels
|
Cervicite
Infection de l’aine
Pneumonie
Abcès nasal
Tuberculose
Candidose de l’œsophage
Pneumonie COVID-19
Abcès anal
| |
Affections hématologiques et du système lymphatique
|
Très fréquents
|
Hémolyse
| |
Fréquents
|
Thrombopénie
Neutropénie
| |
Troubles du métabolisme et de la nutrition
|
Fréquents
|
Hypokaliémie
| |
Affections du système nerveux
|
Très fréquents
|
Céphalée
Sensation vertigineuse
| |
Affections vasculaires
|
Fréquents
|
Hypertension
| |
Affections respiratoires, thoraciques et médiastinales
|
Très fréquents
|
Toux
| |
Fréquents
|
Dyspnée
Épistaxis
Douleur oropharyngée
Congestion nasale
| |
Affections gastro-intestinales
|
Très fréquents
|
Douleurs abdominales
Diarrhée
| |
Fréquents
|
Nausée
| |
Affections de la peau et du tissu sous-cutané
|
Fréquents
|
Érythème
Rash
| |
Affections musculosquelettiques et du tissu conjonctif
|
Très fréquents
|
Arthralgie
Dorsalgie
Douleurs dans les extrémités
| |
Fréquents
|
Myalgie
Spasmes musculaires
| |
Affections du rein et des voies urinaires
|
Fréquents
|
Insuffisance rénale aiguë
Chromaturie
| |
Troubles généraux et anomalies au site d’administration
|
Très fréquents
|
Érythème au site d’injection
Prurit au site d’injection
Gonflement au site d’injection
Hématome au site d’injection
Fatigue
Fièvre
Douleur au site d’injection
| |
Fréquents
|
Réaction au site d’injection
Induration au site d’injection
| |
Affections hépatobiliaires
|
Fréquents
|
Alanine aminotransférase augmentée
Bilirubine augmentée
| |
Lésions, intoxications et complications d’interventions
|
Très fréquents
|
Complication de la vaccination2
|
Les effets indésirables mentionnés dans le tableau ont été identifiés dans le cadre des études cliniques suivantes menées sur l’HPN: APL2-302, APL2-308, étude 202, étude 204 et étude CP0514.
Les termes similaires d’un point de vue médical ont été regroupés lorsqu’ils relevaient du même concept médical.
1Le sepsis contient un cas de choc septique
2Les complications vaccinales ont été observées dans le contexte des vaccinations obligatoires.
Description d’effets indésirables spécifiques
Infections
Compte tenu de son mécanisme d’action, le pegcétacoplan est susceptible de majorer le risque d’infections, en particulier d’infections dues à des bactéries encapsulées telles que Streptococcus pneumoniae, Neisseria meningitidis des types A, C, W, Y et B, et Haemophilus influenzae (voir Mises en garde et précautions). Aucune infection grave due à des bactéries encapsulées n’a été signalée au cours de l’étude APL2-302. Quarante-huit patients ont présenté une infection durant l’étude. Les infections les plus fréquentes chez les patients traités par le pegcétacoplan durant l’étude APL2-302 ont été les infections des voies aériennes supérieures (28 cas, 35 %). La plupart des infections signalées chez les patients traités par le pegcétacoplan durant l’étude APL2-302 étaient sans gravité, et le plus souvent d’intensité légère. Des infections jugées graves ont été signalées chez dix patients, dont l’un est décédé de la COVID-19. Les infections graves les plus fréquentes ont été: sepsis (trois cas) (ayant conduit à l’arrêt du pegcétacoplan chez un patient) et gastroentérite (trois cas); toutes ces infections se sont résolues. Onze patients ont présenté une infection durant l’étude APL2-308. À une exception, toutes les infections signalées étaient légères ou modérément sévères. Un patient présentant une infection a développé un choc septique et est décédé.
Hémolyse
Dix-neuf patients parmi ceux traités par le pegcétacoplan durant l’étude APL2-302 ont présenté une hémolyse. Dans sept cas, l’hémolyse a été considérée comme sévère; dans cinq cas, le pegcétacoplan a dû être arrêté et la dose de pegcétacoplan a été augmentée chez dix patients.
Pendant l’étude APL2-308, trois cas d’hémolyse ont été observés parmi les patients traités par pegcétacoplan. Dans aucun de ces cas, l’hémolyse n’a été considérée comme sévère ou n’a entraîné l’arrêt du pegcétacoplan. La dose de pegcétacoplan a été augmentée chez les trois patients.
Réactions au site d’injection
Des réactions au site d’injection (érythème, gonflement, prurit et douleur, par exemple) ont été rapportées au cours de l’étude APL2-302. Ces réactions étaient d’intensité légère à modérée et n’ont pas nécessité d’interrompre le traitement.
Diarrhée
Des cas de diarrhée, parmi lesquels aucun n’était grave ou n’a abouti à l’interruption du traitement, ont été signalés durant l’étude APL2-302.
Immunogénicité
L’immunogénicité d’Aspaveli a été évaluée à partir d’anticorps anti-médicament (ADA) spécifiques dont l’un permet de mettre spécifiquement en évidence les ADA dirigés contre les composants peptidiques du pegcétacoplan (anticorps anti-peptide du pegcétacoplan) et un deuxième est spécifiquement destiné à la détection des ADA dirigés contre les composants PEG (polyéthylène glycol) du pegcétacoplan (anticorps anti-PEG).
L’incidence des anticorps anti-médicament (séroconversion ou amplification d’ADA préexistants) était faible et, lorsque des ADA étaient présents, ils n’ont eu aucun impact notable sur la pharmacocinétique, la pharmacodynamique, l’efficacité ou le profil de sécurité du pegcétacoplan. Sur toute la durée des études APL2-302 et APL-308, trois patients sur 126, ayant reçu du pegcétacoplan, ont développé des anticorps anti-peptide du pegcétacoplan. Les trois patients ont également été testés positifs aux anticorps neutralisants. La réponse aux anticorps neutralisants n’a eu aucun impact évident sur la pharmacocinétique ou l’efficacité clinique. Dix-huit patients sur 126 ont développé des anticorps anti-PEG; dans neuf cas, il s’agissait d’une séroconversion. Chez les neuf autres patients, le développement de ces anticorps a été renforcé par le traitement.
L’annonce d’effets secondaires présumés après l’autorisation est d’une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d’effet secondaire nouveau ou grave via le portail d’annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageAucun cas de surdosage n’a été rapporté à ce jour.
Propriétés/EffetsCode ATC
L04AJ03
Le pegcétacoplan est une molécule symétrique composée de deux pentadécapeptides identiques attachés par une liaison covalente aux extrémités d’une molécule de polyéthylène glycol (PEG) linéaire. Le poids moléculaire du pegcétacoplan est d’environ 43,5 kilodaltons (kDa). Les unités peptidiques se lient au complément C3, inhibant ainsi largement la cascade du complément. Le fragment PEG de 40 kDa confère une meilleure solubilité et une durée de vie plus longue dans l’organisme après l’administration du médicament.
Mécanisme d’action
Le pegcétacoplan se lie à la protéine C3 du complément et au fragment C3b résultant de son activation avec une haute affinité, régulant ainsi le clivage de la C3 et la production des effecteurs de l’activation du complément en aval. Dans le cadre de l’HPN, l’hémolyse extravasculaire (HEV) est favorisée par l’opsonisation du fragment C3b, tandis que l’hémolyse intravasculaire (HIV) est médiée par le complexe d’attaque membranaire (CAM) en aval. Le pegcétacoplan régule globalement la cascade du complément grâce à une action proximale sur la formation du C3b et du CAM, contrôlant ainsi les mécanismes qui conduisent à l’HEV et à l’HIV.
Pharmacodynamique
Dans l’étude APL2-302, la concentration moyenne en C3 a augmenté, passant de 0,94 g/l au début de l’étude à 3,83 g/l à la semaine 16 dans le groupe traité par le pegcétacoplan, et restée à ce niveau jusqu’à la semaine 48. Dans l’étude APL2-308, la concentration moyenne en C3 a augmenté, passant d’une valeur à l’inclusion de 0,95 g/l à 3,56 g/l à la semaine 26.
Dans l’étude APL2-302, le pourcentage moyen de globules rouges HPN de types II et III, qui était de 66,80 % à l’inclusion, a augmenté à 93,85 % à la semaine 16 et est resté à ce niveau jusqu’à la semaine 48. Dans l’étude APL2-308, le pourcentage moyen de globules rouges HPN de type II et III, qui était de 42,4 % à l’inclusion, a augmenté à 90,0 % à la semaine 26.
Dans l’étude APL2-302, le pourcentage moyen de globules rouges HPN de types II et III avec dépôt de C3, qui était de 17,73 % à l’inclusion, a diminué pour atteindre 0,20 % à la semaine 16 et est resté à ce niveau jusqu’à la semaine 48. Dans l’étude APL2-308, le pourcentage moyen de globules rouges HPN de type II et III avec dépôt de C3, qui était de 2,85 % à l’inclusion, a diminué pour atteindre 0,09 % à la semaine 26.
Électrophysiologie cardiaque
Aucune étude spécifique n’a été menée pour déterminer si et dans quelle mesure le pegcétacoplan peut retarder la repolarisation cardiaque. Le pegcétacoplan est une structure peptidique pégylée qui ne s’est pas révélée inhiber le canal ionique hERG (human Ether-a-go-go-Gen) lors du test correspondant. L’analyse de la relation concentration-QTc (intervalle QT corrigé en fonction de la fréquence cardiaque) a confirmé que le pegcétacoplan n’avait aucun impact sur la repolarisation cardiaque.
Efficacité clinique
L’efficacité et la sécurité du pegcétacoplan chez les patients atteints d’HPN ont été évaluées dans deux études contrôlées randomisées ouvertes de phase III : l’étude APL2-302 a été menée chez des patients déjà prétraités par un inhibiteur complémentaire, et l’étude APL2-308 a été menée chez des patients qui n’avaient pas été traités au préalable par un inhibiteur complémentaire. Dans les deux études, la dose de pegcétacoplan était de 1080 mg deux fois par semaine. Si nécessaire, la dose de pegcétacoplan pouvait être ajustée à 1080 mg tous les 3 jours.
Étude chez des patients adultes déjà prétraités par un inhibiteur complémentaire (APL2-302)
L’étude APL2-302 était une étude ouverte, randomisée, comprenant une période contrôlée contre comparateur actif de 16 semaines, suivie d’une période en ouvert de 32 semaines (OLP). Cette étude a été menée chez des patients atteints d’HPN qui étaient traités par éculizumab à dose stable depuis au moins trois mois et présentaient un taux d’hémoglobine < 10,5 g/dl.
Les patients éligibles ont été soumis à une période de préinclusion de quatre semaines durant laquelle on leur a administré du pegcétacoplan par voie sous-cutanée à raison de 1080 mg deux fois par semaine en complément de la dose d’éculizumab qu’ils recevaient déjà. Les patients ont ensuite été randomisés selon un ratio de 1:1 en vue de recevoir soit du pegcétacoplan à raison de 1080 mg deux fois par semaine, soit leur dose actuelle d’éculizumab sur toute la durée de la période contrôlée randomisée de 16 semaines. La randomisation a été stratifiée en fonction du nombre de transfusions de concentrés érythrocytaires reçues dans les 12 mois précédant le jour -28 (< 4 ou ≥ 4) et de la numération plaquettaire lors de la sélection (< 100 000/μl; ≥ 100 000/μl). Les patients arrivés au terme de la période contrôlée randomisée ont été inclus dans la période en ouvert, durant laquelle tous les patients ont reçu du pegcétacoplan pendant jusqu’à 32 semaines (les patients ayant reçu l’éculizumab durant la période contrôlée randomisée ont intégré une période de préinclusion de quatre semaines avant de passer sous pegcétacoplan en monothérapie).
Les patients avaient été vaccinés contre Streptococcus pneumoniae, Neisseria meningitidis des types A, C, W, Y et B, et Haemophilus influenzae de type B (Hib) soit dans les deux ans qui ont précédé le premier jour, soit dans les deux semaines qui ont suivi le début du traitement par pegcétacoplan. Les patients qui ont été vaccinés après le jour 1 ont reçu un traitement prophylactique par des antibiotiques appropriés jusqu’à deux semaines après la vaccination. De plus, le médecin-investigateur pouvait décider d’administrer une antibiothérapie prophylactique conformément aux directives thérapeutiques locales en vigueur aux patients atteints d’HPN qui étaient traités par un inhibiteur complémentaire. Le pegcétacoplan a été administré en perfusion sous-cutanée. La durée de la perfusion était de 20 à 40 minutes environ.
Les critères d’efficacité principal et secondaires ont été évalués à la semaine 16. Le critère principal d’efficacité était l’évolution du taux d’hémoglobine entre l’inclusion et la semaine 16 (durant la période contrôlée randomisée). La valeur à l’inclusion a été définie comme la moyenne des mesures obtenues avant l’administration de la première dose de pegcétacoplan. Les transfusions évitées, c-à-d. la part de patients n’ayant pas eu besoin d’une transfusion durant la période contrôlée randomisée, et l’évolution du nombre absolu de réticulocytes, du taux de LDH et du score sur l’échelle FACIT-Fatigue entre l’inclusion et la semaine 16 étaient des critères secondaires d’efficacité importants. Au total, 80 patients ont intégré la période de préinclusion. À la fin de la période de préinclusion, les 80 patients ont tous été randomisés: 41 ont été placés dans le groupe sous pegcétacoplan et 39 dans le groupe sous éculizumab. Les caractéristiques démographiques et les caractéristiques initiales de la maladie étaient globalement équilibrées entre les groupes de traitement (voir Tableau 2). Au total, 38 patients du groupe traité par pegcétacoplan et 39 patients du groupe traité par l’éculizumab sont allés au terme de la période contrôlée randomisée de 16 semaines et ont ensuite participé à la période de traitement en ouvert de 32 semaines. Au total, 12 patients sur 80 traités par pegcétacoplan (15 %) ont arrêté l’étude en raison d’événements indésirables. Chez 15 patients, la posologie a été ajustée à 1080 mg tous les trois jours conformément au protocole de l’étude. Les bénéfices ont été évalués chez douze patients, et chez huit d’entre eux, l’ajustement de la posologie a apporté un bénéfice.
Tableau 2: Données démographiques et caractéristiques initiales des patients dans l’étude APL2-302
|
Paramètres
|
Statistiques
|
Pegcétacoplan (n=41)
|
Éculizumab (n=39)
| |
Âge (ans)
|
Moyenne (ET)
|
50,2 (16,3)
|
47,3 (15,8)
| |
Dose d’éculizumab à l’inclusion
900 mg par voie i.v. toutes les 2 semaines
900 mg par voie i.v. tous les 11 jours
1200 mg par voie i.v. toutes les 2 semaines
1500 mg par voie i.v. toutes les 2 semaines
|
n (%)
n (%)
n (%)
n (%)
|
26 (63,4)
1 (2,4)
12 (29,3)
2 (4,9)
|
29 (74,4)
1 (2,6)
9 (23,1)
0
| |
Femmes
|
n (%)
|
27 (65,9)
|
22 (56,4)
| |
Délai (années) entre le diagnostic de l’HPN et le jour -28
|
Moyenne (ET)
|
8,7 (7,4)
|
11,4 (9,7)
| |
Taux d’hémoglobine (g/dl)
|
Moyenne (ET)
|
8,7 (1,1)
|
8,7 (0,9)
| |
Nombre absolu de réticulocytes (109/l)
|
Moyenne (ET)
|
218 (75,0)
|
216 (69,1)
| |
Taux de LDH (U/l)
|
Moyenne (ET)
|
257,5 (97,6)
|
308,6 (284,8)
| |
Score total FACIT-F
|
Moyenne (ET)
|
32,2 (11,4)
|
31,6 (12,5)
| |
Nombre de transfusions reçues dans les 12 mois précédant le jour -28
|
Moyenne (ET)
|
6,1 (7,3)
|
6,9 (7,7)
| |
< 4
|
n (%)
|
20 (48,8)
|
16 (41,0)
| |
≥ 4
|
n (%)
|
21 (51,2)
|
23 (59,0)
| |
Numération plaquettaire lors de la sélection (109/l)
|
Moyenne (ET)
|
167 (98,3)
|
147 (68,8)
| |
Numération plaquettaire lors de la sélection <100 000/μl
|
n (%)
|
12 (29,3)
|
9 (23,1)
| |
Numération plaquettaire lors de la sélection ≥100 000/μl
|
n (%)
|
29 (70,7)
|
30 (76,9)
| |
Antécédents d’anémie aplasique
|
n (%)
|
11 (26,8)
|
9 (23,1)
| |
Antécédents de syndrome myélodysplasique
|
n (%)
|
1 (2,4)
|
2 (5,1)
|
Le pegcétacoplan s’est révélé supérieur à l’éculizumab s’agissant du critère d’évaluation principal, à savoir l’évolution du taux d’hémoglobine par rapport à l’inclusion (p<0,0001). L’évolution médiane ajustée du taux d’hémoglobine par rapport à l’inclusion était de 2,4 g/dl dans le groupe sous pegcétacoplan contre -1,5 g/dl dans le groupe sous éculizumab, soit une augmentation médiane ajustée à la semaine 16 de 3,8 g/dl sous pegcétacoplan par comparaison avec l’éculizumab (figure 1).
Figure 1: Évolution moyenne ajustée (± ET) du taux d’hémoglobine (g/dl) entre l’inclusion et la semaine 16 dans l’étude APL2-302
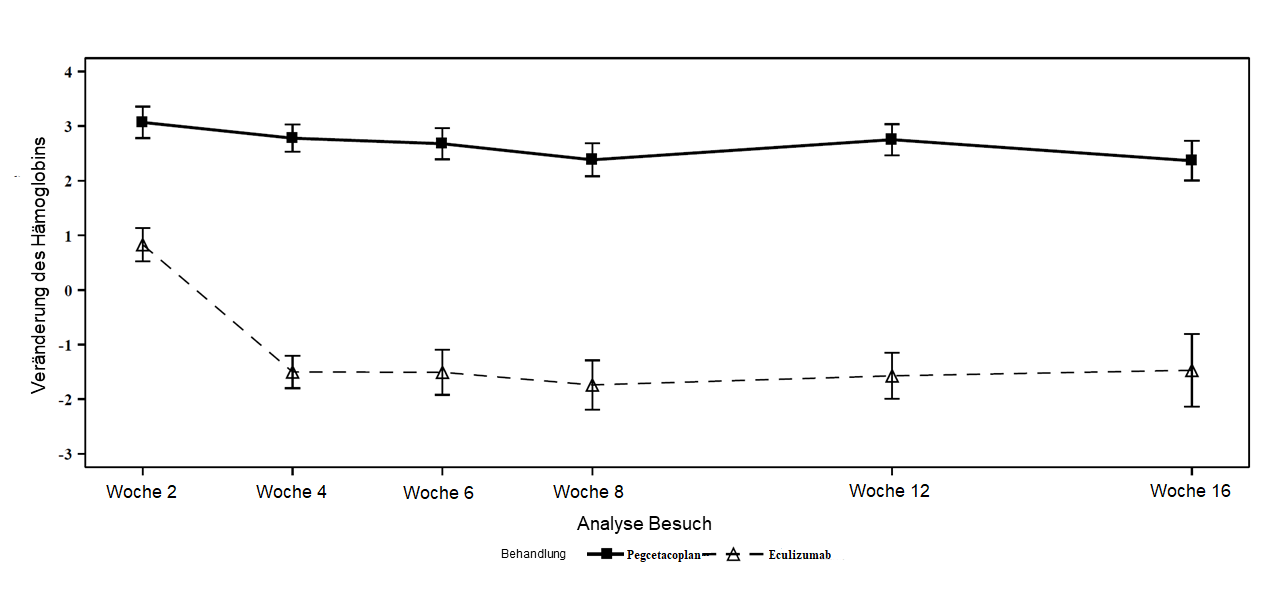
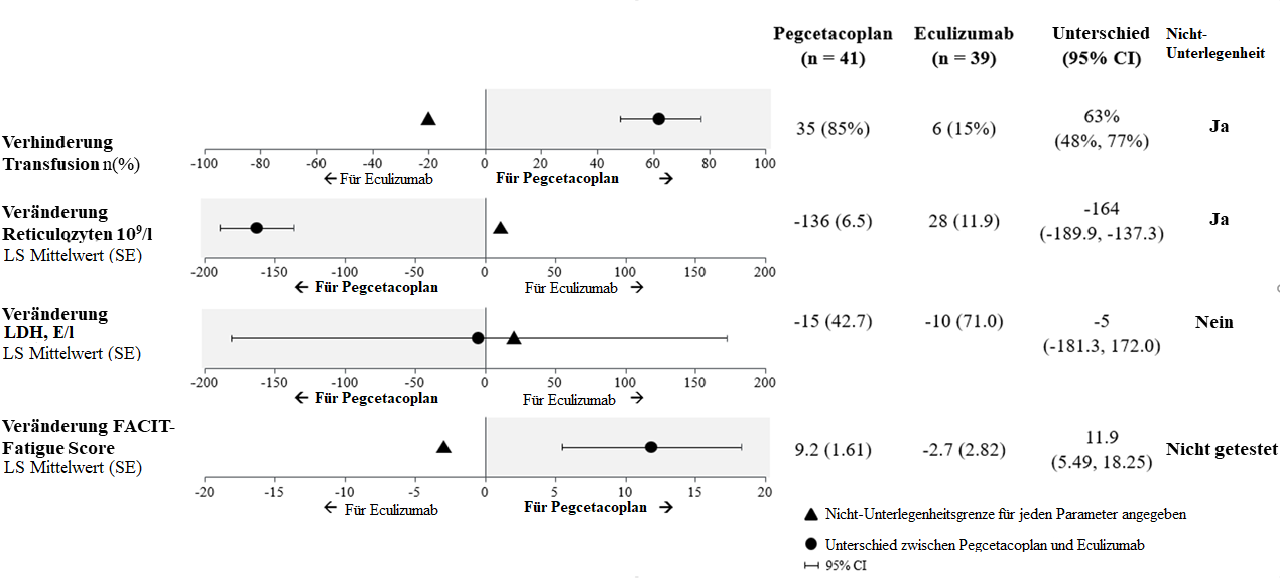
La non-infériorité s’agissant des critères d’évaluation secondaires importants, à savoir les transfusions évitées et l’évolution du nombre absolu de réticulocytes par rapport à l’inclusion, a été démontrée. Des transfusions ont pu être évitées chez 85 % des patients du groupe sous pegcétacoplan contre chez 15 % des patients du groupe sous éculizumab.
Concernant l’évolution du taux de LDH par rapport à l’inclusion, la non-infériorité n’a pas été prouvée.
En raison de la hiérarchie des tests, l’évolution du score FACIT-Fatigue par rapport à l’inclusion n’a pas été formellement analysée.
Les moyennes ajustées, la différence entre les traitements, les intervalles de confiance et les analyses statistiques réalisées pour les principaux critères d’évaluation secondaires sont présentés à la figure 2.
Figure 2: Analyse des critères d’évaluation secondaires importants dans l’étude APL2-302
Les résultats ont été cohérents dans toutes les analyses de confirmation du critère principal et des critères secondaires importants, en incluant toutes les données observées, y compris les données post-transfusion.
Les analyses de l’efficacité basées sur les critères d’évaluation principal et secondaires n’ont mis en évidence aucune différence notable entre les patients traités par pegcétacoplan selon le sexe, l’origine ethnique ou l’âge.
Une normalisation du taux d’hémoglobine a été obtenue à la semaine 16 chez 34 % des patients du groupe sous pegcétacoplan contre 0 % dans le groupe sous éculizumab. Au total, 78 % des patients traités par pegcétacoplan ont vu leur nombre absolu de réticulocytes se normaliser par rapport à 3 % dans le groupe sous éculizumab. Une normalisation du taux de LDH a été obtenue chez 71 % des patients traités par pegcétacoplan contre 15 % dans le groupe sous éculizumab.
Au total, 77 patients ont intégré la période en ouvert de 32 semaines durant laquelle tous les patients ont reçu du pegcétacoplan, ce qui correspond à une exposition totale de 48 semaines au maximum. Globalement, les résultats à 48 semaines concordaient avec ceux enregistrés à la semaine 16 et prouvent que l’efficacité est durable.
Étude chez des patients adultes n’ayant pas reçu de traitement préalable par un inhibiteur complémentaire (APL2-308)
L’étude APL2-308 était une étude ouverte, randomisée, contrôlée, menée chez des patients atteints d’HPN qui n’avaient pas été traités par un inhibiteur complémentaire au cours des trois mois précédant l’étude et qui présentaient un taux d’hémoglobine inférieur à la limite inférieure de la normale (LLN). Les patients éligibles ont été randomisés selon un ratio de 2:1 et ont reçu du pegcétacoplan ou un traitement de soutien (p. ex. transfusions, corticostéroïdes, supplémentation, notamment en fer, acide folique et vitamine B12), désigné ci-après comme groupe témoin, pendant toute la durée de traitement de 26 semaines.
La randomisation a été stratifiée en fonction du nombre de transfusions de concentrés érythrocytaires (PRBC) reçues dans les 12 mois précédant le jour -28 (< 4 ou ≥ 4). À tout moment durant l’étude, un patient affecté au groupe témoin dont le taux d’hémoglobine était de ≥ 2 g/dl en dessous de la valeur à l’inclusion ou présentant un évènement thromboembolique associé à l’HPN, pouvait passer dans le groupe pegcétacoplan pour le reste de l’étude, conformément au protocole de l’étude.
Au total, 53 patients ont été randomisés : 35 patients dans le groupe pegcétacoplan et 18 patients dans le groupe témoin. Les données démographiques et les caractéristiques de la maladie des patients à l’inclusion étaient globalement équilibrées dans les groupes de traitement. L’âge moyen était de 42,2 ans dans le groupe pegcétacoplan et de 49,1 ans dans le groupe témoin. Le nombre moyen de transfusions de concentrés érythrocytaires reçues dans les 12 mois précédant l’étude préliminaire était de 3,9 dans le groupe pegcétacoplan et de 5,1 dans le groupe témoin. Cinq patients dans chaque groupe (14,3 % dans le groupe pegcétacoplan et 27,8 % dans le groupe témoin) présentaient des antécédents d’anémie aplasique. Les autres valeurs à l’inclusion étaient : valeur moyenne d’hémoglobine à l’inclusion (groupe pegcétacoplan 9,4 g/dl contre 8,7 g/dl dans le groupe témoin), nombre absolu de réticulocytes (groupe pegcétacoplan 230,2 × 109/l contre 180,3 × 109/l dans le groupe témoin), taux de LDH (groupe pegcétacoplan 2 151,0 E/l contre 1 945,9 E/l dans le groupe témoin) et numération plaquettaire (groupe pegcétacoplan 191,4 × 109/l contre 125,5 × 109/l dans le groupe témoin). 11 patients sur les 18 affectés au groupe témoin sont passés au pegcétacoplan, car leur taux d’hémoglobine a baissé de ≥ 2 g/dl en dessous de la valeur à l’inclusion. 52 patients randomisés sur 53 (97,8 %) ont reçu un traitement antibiotique prophylactique conformément aux directives de prescription locales.
Les critères d’efficacité principaux et secondaires ont été évalués à la semaine 26. Les deux critères co-principaux d’efficacité étaient la stabilisation du taux d’hémoglobine, définie comme l’évitement d’une chute de la concentration d’hémoglobine > 1 g/dl par rapport à l’inclusion sans transfusion, et l’évolution de la concentration de LDH par rapport à l’inclusion.
Dans le groupe traité par pegcétacoplan, 30 patients sur 35 (85,7 %) ont atteint une stabilisation du taux d’hémoglobine contre 0 patient dans le groupe témoin. L’écart ajusté entre le groupe pegcétacoplan et le groupe témoin était de 73,1 % (IC à 95 % : 57,2 % à 89,0 % ; p < 0,0001).
La variation moyenne (ET) des moindres carrés (LS) de la concentration de LDH à la semaine 26 par rapport à l’inclusion était de -1 870 E/l dans le groupe traité par pegcétacoplan contre -400 E/l dans le groupe témoin (p < 0,0001). La différence entre le groupe pegcétacoplan et le groupe témoin était de 1 470 (IC à 95 % : -2 113 à -827). Les différences de traitement entre le groupe pegcétacoplan et le groupe témoin ont été observées à la semaine 2 et ont perduré jusqu’à la semaine 26 (figure 3). Les concentrations de LDH du groupe témoin sont restées élevées.
Figure 3 : Concentration de LDH (E/l) moyenne (±ET) dans le temps selon le groupe de traitement dans l’étude APL2-308
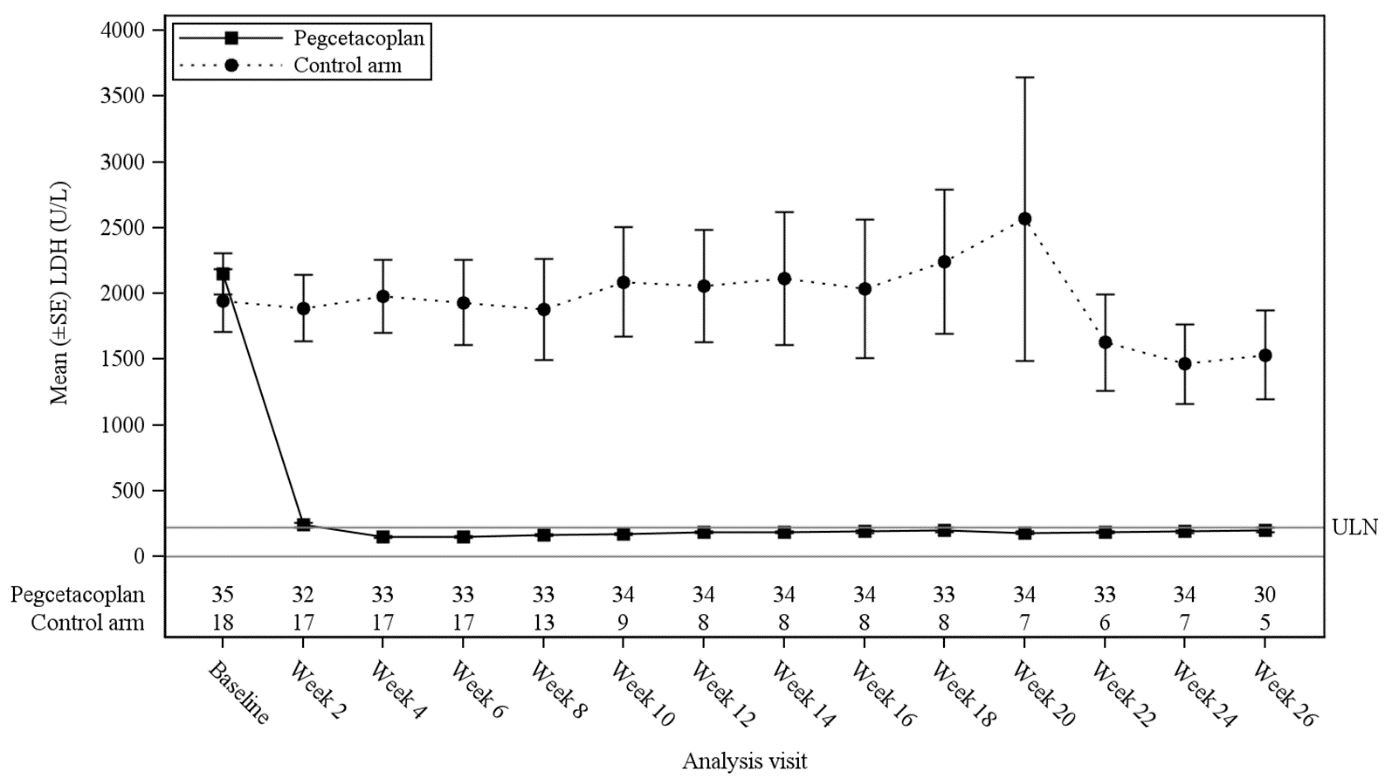
25 patients (71 %) traités dans le groupe pegcétacoplan contre 1 patient (6 %) dans le groupe témoin ont atteint une stabilisation de l’hémoglobine sans transfusion (écart [IC à 95 %] : 54 % [34 %, 74 %]).
Pour les critères d’efficacité secondaires importants, réponse de l’hémoglobine sans transfusion, variation du taux d’hémoglobine et évolution du nombre absolu de réticulocytes, une différence significative entre les traitements a été observée dans le groupe traité par pegcétacoplan par rapport au groupe témoin (tableau 3).
Tableau 3 : analyse des critères secondaires importants dans l’étude APL2-308
|
Paramètre
|
Pegcétacoplan
(N = 35)
|
Groupe témoin
(N = 18)
|
Différence
(IC à 95 %)
Valeur p
| |
Réponse de l’hémoglobine sans transfusiona
(n, %)
|
25 (71 %)
|
1 (6 %)
|
54 % (34 %; 74 %)
p < 0,0001
| |
Variation du taux d’hémoglobine (g/dl) de l’inclusion à la semaine 26
Moyenne LS (ET)
|
2,9 (0,38)
|
0,3 (0,76)
|
2,7 (1,0 ; 4,4)
| |
Évolution du nombre absolu de réticulocytes (109/l) de l’inclusion à la semaine 26
Moyenne LS (ET)
|
-123 (9,2)
|
-19 (25,2)
|
-104 (-159 ; -49)
|
a La réponse de l’hémoglobine était définie comme l’augmentation de l’hémoglobine de ≥ 1 g/dl de l’inclusion à la semaine 26. IC = intervalle de confiance, LS = moindre carré (least square), ET = erreur type
PharmacocinétiqueAbsorption
Le pegcétacoplan est administré par voie sous-cutanée et progressivement absorbé dans la circulation générale, avec un Tmax médian compris entre 108 et 144 heures (4,5 à 6,0 jours). Lors de l’administration de 1080 mg deux fois par semaine chez des patients atteints d’HPN, les concentrations sériques ont atteint l’état d’équilibre quatre à six semaines environ après la première dose. Chez les patients ayant suivi un traitement préalable avec un inhibiteur complémentaire (étude APL2-302), la moyenne géométrique (%CV) des concentrations sériques moyennes à l’état d’équilibre chez les patients traités pendant 16 semaines était comprise entre 655 μg/ml (18,6 %) et 706 μg/ml (15,1 %). Chez les patients n’ayant pas suivi de traitement préalable par un inhibiteur complémentaire (APL2-308), la moyenne géométrique (%CV) des concentrations sériques moyennes à l’état d’équilibre était de 744 µg/ml (25,5 %) à la semaine 26 pour une administration deux fois par semaine. Aucune étude formelle n’a été réalisée concernant la biodisponibilité absolue; lors d’une étude transversale visant à comparer l’exposition après l’administration de formulations sous-cutanées et intraveineuses chez des volontaires sains, la biodisponibilité a été estimée à 87 %.
Distribution
Chez les patients atteints d’HPN, le volume de distribution moyen du compartiment central (%CV) est d’environ 3,98 l (32 %).
Métabolisme
En raison de sa structure peptidique pégylée, il est probable que le pegcétacoplan soit dégradé en petits peptides, acides aminés et PEG via des voies cataboliques. Les résultats d’une étude de radio-marquage chez le singe Cynomolgus suggèrent que la voie d’élimination principale du fragment peptidique marqué est l’excrétion urinaire.
Élimination
Après l’administration répétée de doses de pegcétacoplan par voie sous-cutanée chez des patients atteints d’HPN, la clairance (CL) moyenne (CV%) estimée est de 0,015 l/heure (30 %) et la demi-vie d’élimination effective médiane (t1/2) est de 8,6 jours.
Linéarité/non-linéarité
L’exposition au pegcétacoplan augmente de façon proportionnelle à la dose dans l’intervalle de 45 à 1440 mg.
Cinétique pour certains groupes de patients
Aucun impact sur la pharmacocinétique du pegcétacoplan n’a été identifié en fonction de l’âge, de l’origine ethnique ou du sexe, d’après les résultats de l’analyse pharmacocinétique de population.
On estime que l’exposition moyenne à l’état d’équilibre est jusqu’à 20 % plus élevée chez un patient de 50 kg que chez un patient de référence de 70 kg. On estime que la concentration moyenne chez les patients pesant 40 kg est plus élevée de 45 %. Les données disponibles concernant le profil de sécurité du pegcétacoplan chez les patients pesant moins de 50 kg sont extrêmement limitées.
Troubles de la fonction rénale
Lors d’une étude menée chez huit patients atteints d’insuffisance rénale sévère, définie sur la base d’une clairance de la créatinine (ClCr) inférieure à 30 ml/min selon la formule de Cockcroft-Gault (dont quatre patients présentant des valeurs inférieures à 20 ml/min), l’insuffisance rénale n’a eu aucun effet sur la pharmacocinétique d’une dose unique de 270 mg de pegcétacoplan (voir Posologie/Mode d’emploi). Les données disponibles concernant les patients atteints d’HPN et d’insuffisance rénale qui ont reçu la dose clinique de 1080 mg deux fois par semaine sont extrêmement limitées. On ne dispose d’aucune donnée clinique concernant l’utilisation du pegcétacoplan chez des patients atteints d’IRT nécessitant une hémodialyse.
Troubles de la fonction hépatique
Aucune étude spécifique n’a été effectuée pour déterminer les répercussions de troubles de la fonction hépatique sur la pharmacocinétique du pegcétacoplan. La biotransformation ayant principalement lieu par catabolisme, des troubles de la fonction hépatique ne devraient pas influer sur la clairance du pegcétacoplan (voir Patients présentant des troubles de la fonction hépatique).
Patients âgés
Selon une analyse pharmacocinétique de population, la clairance apparente (CL/F) était similaire chez les patients âgés et les patients de moins de 65 ans. Aucune différence manifeste liée à l’âge n’a en outre été observée (voir Patients âgés). Le nombre de patients âgés était toutefois limité.
Données précliniquesLes données de toxicologie in vitro et in vivo n’ont pas révélé de toxicité particulièrement préoccupante pour l’être humain. Les effets observés chez l’animal à des niveaux d’exposition similaires à l’exposition clinique sont décrits ci-dessous.
Toxicité en cas d’administration répétée
Des études en administration répétée ont été réalisées chez le lapin et le singe Cynomolgus avec des doses quotidiennes sous-cutanées de pegcétacoplan correspondant à jusqu’à sept fois la dose clinique (1080 mg deux fois par semaine) chez l’être humain. Les altérations histologiques constatées chez les deux espèces incluaient une vacuolisation épithéliale dépendante de la dose et des infiltrations de macrophages vacuolisés dans différents tissus. Ces observations ont été associées à des doses cumulées importantes de PEG à longue chaîne obtenues avec d’autres médicaments pégylés autorisés. Elles n’ont pas eu de conséquences cliniques et n’ont pas été jugées délétères.
Après quatre semaines et neuf mois d’administration quotidienne de pegcétacoplan, une dégénérescence tubulaire rénale minime et non évolutive a été observée au microscope chez les deux espèces à des niveaux d’exposition (Cmax et ASC) inférieurs ou comparables à ceux atteints à la dose clinique chez l’être humain.
Bien qu’aucun signe manifeste de dysfonctionnement rénal n’ait été observé chez l’animal, les implications cliniques et les conséquences fonctionnelles de ces observations ne sont pas connues.
Génotoxicité
Le pegcétacoplan n’a pas montré de potentiel mutagène lors des tests de mutation inverse bactérienne in vitro (test d’Ames), ni de potentiel génotoxique lors d’un test in vitro sur des cellules TK6 humaines ou d’un test du micronoyau in vivo chez la souris.
Carcinogénicité
Aucune étude de carcinogénicité à long terme n’a été réalisée chez l’animal avec le pegcétacoplan.
Toxicité sur la reproduction
Le pegcétacoplan a fait l’objet d’études de reproduction chez le singe Cynomolgus. L’administration sous-cutanée de pegcétacoplan chez des guenons Cynomolgus gravides à la dose de 28 mg/kg/jour (2,9 fois la Cmax à l’état d’équilibre chez l’être humain) durant la période de gestation jusqu’à la mise bas a conduit à une augmentation statistiquement significative des avortements (31,6 %) ou des mortinaissances (21,1 %) par rapport au groupe témoin (5,0 % et 0 % respectivement).
Ces hausses ont été considérées comme liées au pegcétacoplan et défavorables. En raison de l’incidence accrue d’avortements et de mortinaissances à la dose de 28 mg/kg/jour, la DSENO a été établie à 7 mg/kg/jour dans cette étude.
Aucune toxicité maternelle ni aucun effet tératogène n’ont été observés chez la progéniture née à terme. Par ailleurs, aucun effet sur le développement de la progéniture n’a été observé jusqu’à six mois après la naissance. Une exposition systémique au pegcétacoplan a été détectée chez les fœtus de guenons ayant reçu 28 mg/kg/jour de la période de l’organogenèse jusqu’au deuxième trimestre, mais l’exposition était minime (moins de 1 %, exposition non significative d’un point de vue pharmacologique).
Fertilité
Le pegcétacoplan n’étant pharmacologiquement actif que chez l’être humain et les primates non humains, aucune étude spécifique portant sur la fertilité et le développement embryonnaire précoce n’a été menée avec le pegcétacoplan chez des rongeurs. Des analyses microscopiques des organes sexuels masculins et féminins réalisées au cours d’études de toxicité après administration réitérée chez le singe n’ont révélé aucun effet nocif du pegcétacoplan chez les animaux mâles ou femelles.
Lactation
Il a été démontré que l’excrétion de pegcétacoplan dans le lait maternel de guenons était inférieure à 1 %. Par conséquent, la probabilité d’exposition cliniquement significative de nourrissons au pegcétacoplan par le lait maternel est considérée comme minime.
Remarques particulièresIncompatibilités
Non pertinent.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l’emballage.
Remarques particulières concernant le stockage
Conserver au réfrigérateur (2-8 °C).
Conserver le récipient dans son emballage d’origine pour le protéger de la lumière.
Conserver hors de portée des enfants.
Remarques concernant la manipulation
Des instructions détaillées pour l’administration d’Aspaveli peuvent être retrouvées dans le mode d’emploi.
Ne pas utiliser la solution si elle paraît trouble, contient des particules ou a pris une couleur jaune foncé.
Éliminer les flacons partiellement utilisés et les éléments à usage unique conformément à la réglementation locale.
Numéro d’autorisation68674
PrésentationAspaveli est disponible en solution prête à l’emploi en flacons à usage unique.
1 flacon [A]
8 flacons [A]
Titulaire de l’autorisationSwedish Orphan Biovitrum AG, Basel
Mise à jour de l’informationOctobre 2024
|



