CompositionPrincipes actifs
Toxine botulinique de type A*.
* sécrétée par Clostridium botulinum (souche CBFC26).
Excipients
Albumine humaine, chlorure de sodium.
Un flacon contient 0,18 mg de sodium.
Indications/Possibilités d’emploiLetybo est indiqué dans la correction temporaire de l’apparence des rides verticales intersourcilières modérées à sévères chez l’adulte de moins de 75 ans observées lors du froncement maximal des sourcils (rides glabellaires), lorsque la sévérité des rides du visage entraîne un retentissement psychologique important.
Posologie/Mode d’emploiLetybo doit être administré exclusivement par des médecins possédant les qualifications et l’expertise appropriées pour ce traitement et pour l’utilisation du matériel requis.
Posologie usuelle
La dose recommandée est un total de 20 unités réparties en 5 injections de 4 unités (0,1 ml) chacune: 2 injections dans chaque muscle corrugator supercilii et 1 injection dans le muscle procerus.
Les unités de toxine botulinique ne sont pas interchangeables d’un produit à l’autre.
Les doses recommandées diffèrent des autres préparations de toxine botulinique.
L’intervalle entre les traitements doit être d’au moins trois mois.
En l’absence d’effets secondaires consécutifs à une séance de traitement, il est possible d’entamer une nouvelle séance après un délai d’au moins trois mois.
En cas d’échec du traitement un mois après une première séance, c’est-à-dire en l’absence d’amélioration significative par rapport à la situation initiale, les approches suivantes peuvent être envisagées:
-L’analyse des causes de l’échec, par exemple l’injection dans les mauvais muscles, une technique d’injection inappropriée, la formation d’anticorps neutralisant la toxine ou un dosage insuffisant.
-La réévaluation de la pertinence du traitement par toxine botulinique de type A.
L’efficacité et la sécurité des injections répétées de Letybo au-delà d’une période de 12 mois n’ont pas été évaluées.
Afin d’assurer la traçabilité des médicaments biotechnologiques, il convient de documenter pour chaque traitement le nom commercial et le numéro de lot.
Instructions posologiques particulières
Patients âgés
Il n’existe pas de données cliniques concernant l’utilisation de Letybo chez les patients de plus de 75 ans. L’utilisation de Letybo chez les personnes de plus de 75 ans est déconseillée. Aucun ajustement spécifique de la dose n’est nécessaire pour l’utilisation chez les personnes âgées de plus de 65 ans (voir «Propriétés/Effets»).
Enfants et adolescents
Il n’y a pas d’utilisation justifiée de Letybo chez les enfants et les adolescents. La sécurité et l’efficacité de Letybo chez les patients de moins de 18 ans n’ont donc pas été étudiées. L’utilisation de Letybo chez les personnes de moins de 18 ans est déconseillée.
Mode d’administration
Voie intramusculaire.
Après reconstitution, Letybo ne doit être utilisé que pour une seule séance d’injection par patient.
Pour les instructions concernant la dilution, l’utilisation, la manipulation et l’élimination des flacons, voir «Remarques particulières».
Les injections intramusculaires doivent être réalisées à l’aide d’une seringue stérile du type utilisé pour l’insuline ou la tuberculine, avec une capacité de 1 ml, des graduations de 0,01 ml et une aiguille de calibre 30 à 31 G.
Aspirer dans la seringue stérile 0,5 ml de la solution de Letybo dûment reconstituée et expulser toute bulle d’air présente dans le cylindre. L’aiguille utilisée pour reconstituer le médicament doit être retirée et remplacée pour l’administration.
Veiller à ce que Letybo ne soit pas injecté dans un vaisseau sanguin.
Afin de réduire le risque de blépharoptose, éviter les injections à proximité du muscle levator palpebrae superioris, en particulier chez les patients présentant de puissants complexes abaisseurs des sourcils. Lors de l’injection dans deux sites pour chaque muscle corrugator supercilii, réaliser la première injection juste au-dessus du bord médial des sourcils. La seconde injection sera pratiquée à environ 1 cm au-dessus du bord supra-orbitaire (limites osseuses rigides palpables au-dessus de la marge haute de la paupière supérieure), au point de rencontre des lignes médianes des sourcils. Le site d’injection pour le muscle procerus se situe juste au-dessus de la ligne médiane de l’arête nasale, à l’endroit où se forment les rides horizontales entre les extrémités médiales des sourcils. Lors de l’administration dans les extrémités médiales des muscles corrugator supercilii et sur les lignes médianes des sourcils, les sites d’injection doivent être éloignés d’au moins 1 cm du bord supra-orbitaire (limites osseuses rigides palpables au-dessus de la marge haute de la paupière supérieure).
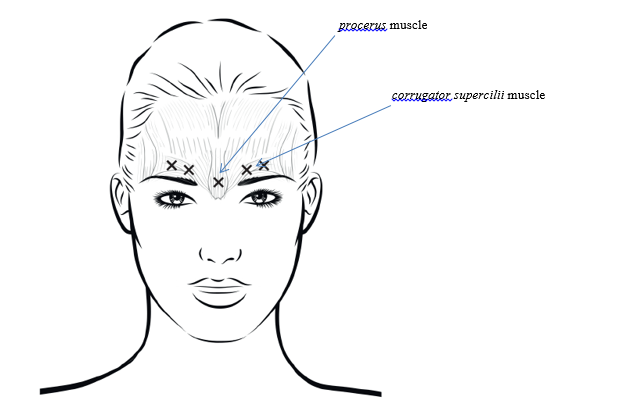
Lors de l’administration, agir avec prudence pour éviter toute injection intravasculaire. Avant l’injection, il est possible de placer fermement le pouce ou l’index sous le bord orbitaire pour éviter l’épanchement du médicament dans cette zone. Orienter l’aiguille vers le haut et médialement.
Contre-indicationsLetybo ne doit pas être utilisé dans les cas suivants:
-Hypersensibilité au principe actif ou à l’un des excipients mentionnés à la rubrique «Composition».
-Troubles généralisés de l’activité musculaire (par exemple, myasthénie grave, syndrome myasthénique de Lambert-Eaton, sclérose latérale amyotrophique).
-Présence d’une infection ou d’une inflammation aiguë aux sites d’injection proposés.
Mises en garde et précautionsGénéralités
Avant toute administration de Letybo, il importe de comprendre l’anatomie des muscles et des structures vasculaires et nerveuses environnantes dans la région glabellaire, ainsi que toute altération anatomique liée à des interventions chirurgicales antérieures. Éviter l’injection dans des structures anatomiques vulnérables.
Agir avec prudence si Letybo est utilisé alors que le muscle ciblé présente une faiblesse ou une atrophie excessive.
Il existe un risque de ptosis après le traitement. Voir les instructions d’administration à la rubrique «Posologie/Mode d’emploi» pour limiter cette éventualité.
L’utilisation de Letybo est déconseillée chez les personnes de moins de 18 ans ou de plus de 75 ans.
Événements liés à la procédure
Après le traitement par d’autres toxines botuliniques, une douleur et/ou une anxiété liée à l’aiguille ont donné lieu à des réactions vasovagales, notamment à une hypotension symptomatique transitoire et à une syncope.
Troubles neuromusculaires préexistants
Les patients atteints de troubles neuromusculaires non reconnus peuvent présenter un risque accru d’effets systémiques cliniquement significatifs à l’administration de doses thérapeutiques de toxine botulinique de type A, notamment une dysphagie sévère et une atteinte respiratoire.
Réactions d’hypersensibilité
Dans de très rares cas, une réaction anaphylactique peut se produire après l’injection de toxine botulinique. Il convient donc d’avoir à disposition de l’épinéphrine (adrénaline) ou toute autre mesure anti-anaphylactique.
Diffusion locale ou à distance des effets de la toxine
Des effets secondaires potentiellement liés à la diffusion de la toxine à distance du site d’administration ont été signalés dans de très rares cas pour la toxine botulinique (voir «Effets indésirables»). Les patients recevant des doses thérapeutiques peuvent présenter une faiblesse musculaire excessive.
Les difficultés à avaler et à respirer sont graves et peuvent entraîner la mort. L’injection de Letybo n’est pas recommandée chez les patients présentant des antécédents de dysphagie et d’inhalation.
Les patients doivent être avertis de la nécessité d’une prise en charge médicale immédiate en cas d’apparition de troubles de la déglutition, de troubles de la parole ou de troubles respiratoires.
Formation d’anticorps
L’administration de doses trop rapprochées ou trop élevées peut accroître le risque de formation d’anticorps. La formation d’anticorps peut entraîner l’échec du traitement par toxine botulinique de type A, même dans le cadre d’autres indications.
Troubles hémorragiques
Agir avec prudence lorsque Letybo est utilisé chez des patients présentant des troubles hémorragiques, car l’injection peut générer des contusions.
Sodium
Ce médicament contient moins de 1 mmol (23 mg) de sodium par dose, c.-à-d. qu’il est essentiellement «sans sodium».
InteractionsAucune étude d’interaction n’a été réalisée. Aucune autre interaction cliniquement significative n’a été signalée dans le cadre de cette indication.
Théoriquement, l’effet de la toxine botulinique peut être potentialisé par les antibiotiques du groupe des aminosides, la spectinomycine ou d’autres médicaments qui perturbent la transmission neuromusculaire (par exemple, les agents bloquants neuromusculaires).
L’effet de l’administration de différents sérotypes de neurotoxine botulinique simultanément ou à plusieurs mois d’intervalle n’est pas connu. Une faiblesse neuromusculaire excessive peut être exacerbée par l’injection d’une autre toxine botulinique avant la disparition des effets de la toxine botulinique administrée précédemment.
Grossesse, AllaitementGrossesse
Il n’existe pas de données appropriées sur l’utilisation de la toxine botulinique de type A chez la femme enceinte. Les études effectuées chez l’animal ont mis en évidence une toxicité sur la reproduction à haute dose (voir «Données précliniques»). Le risque potentiel pour l’homme n’est pas connu. Letybo n’est pas recommandé pendant la grossesse et chez les femmes en âge de procréer n’utilisant pas de contraception.
Allaitement
On ne sait pas si la toxine botulinique de type A est excrétée dans le lait maternel. L’utilisation de Letybo pendant l’allaitement n’est pas recommandée.
Fertilité
Il n’existe pas de données cliniques concernant les effets de la toxine botulinique de type A sur la fertilité. Les études effectuées chez l’animal avec la toxine botulinique de type A ont montré une diminution de la fertilité (voir «Données précliniques»).
Effet sur l’aptitude à la conduite et l’utilisation de machinesAucune étude correspondante n’a été effectuée. Toutefois, la toxine botulinique de type A a été associée à des cas d’asthénie, de faiblesse musculaire, de sensations vertigineuses et de perturbation visuelle qui pourraient affecter l’aptitude à la conduite de véhicules et l’utilisation de machines.
Effets indésirablesRésumé du profil de sécurité
La sécurité de Letybo a été évaluée dans trois études cliniques pivots de phase III comprenant toutes une partie contrôlée par placebo (cycle 1) et une partie d’extension à long terme (cycles 2-4) couvrant jusqu’à une année et incluant 1162 patients traités par Letybo. En outre, il existe des données probantes issues d’une étude de phase III sur les rides glabellaires réalisée en Corée, ainsi que des données post-commercialisation.
Les effets secondaires peuvent être liés au médicament à l’étude (Letybo), à la procédure d’injection ou aux deux. En général, les effets secondaires sont transitoires et surviennent dans les premiers jours suivant l’injection. La plupart des événements indésirables signalés étaient d’une intensité légère à modérée. Les réactions indésirables au médicament les plus fréquentes (signalées chez au moins 2 patients traités par Letybo au cours du cycle 1) dans les trois études pivots sur Letybo dans le traitement des rides glabellaires étaient la céphalée (1,7% des patients), la douleur au site d’injection (0,3% des patients) et le ptosis, le blépharospasme, la gêne de la tête et la contusion (0,2% des patients pour chaque réaction).
Des cas de douleur localisée, d’inflammation, de paresthésie, d’hypoesthésie, de sensibilité au toucher, de gonflement/œdème, d’érythème, d’infection localisée, d’hémorragie et/ou de contusion ont été associés à l’injection. Des cas de fièvre et de syndrome de grippe ont également été signalés après des injections de toxine botulinique (voir «Mises en garde et précautions»).
Liste des effets indésirables
Les effets indésirables sont rangés par classe de système d’organes de la classification MedDRA et par fréquence selon la convention suivante: «très fréquent» (≥ 1/10); «fréquent» (≥ 1/100, < 1/10); «peu fréquent» (≥ 1/1000, < 1/100); «rare» (≥ 1/10 000, < 1/1000); «très rare» (< 1/10 000).
Tableau 1: Effets secondaires signalés dans les études cliniques et post-commercialisation après l’administration de Letybo
|
Classe de système d’organes
|
Fréquence
|
Effet secondaire
| |
Infections et infestations
|
peu fréquent
|
Rhinopharyngite
| |
|
rare
|
Herpès buccal, folliculite*
| |
Affections hématologiques
et du système lymphatique
|
rare
|
Augmentation du potassium sanguin
| |
Affections du système nerveux
|
fréquent
|
Céphalée
| |
peu fréquent
|
Gêne de la tête*
| |
rare
|
Migraine, sensation vertigineuse, paresthésie, défaut du champ visuel, dysarthrie
| |
Affections oculaires
|
peu fréquent
|
Ptosis, blépharospasme, œdème périorbitaire
| |
rare
|
Hémorragie conjonctivale*, sécheresse oculaire, vision trouble, douleur oculaire*, trouble de la sensibilité palpébrale**
| |
Affections respiratoires, thoraciques et médiastinales
|
rare
|
Hypoesthésie pharyngée
| |
Affections gastro-intestinales
|
rare
|
Constipation, nausée
| |
Affections de la peau et du tissu sous-cutané
|
rare
|
Ptose sourcilière, sécheresse cutanée, urticaire
| |
Affections musculosquelettiques et du tissu conjonctif
|
peu fréquent
|
Signe de Méphisto (élévation latérale des sourcils)
| |
Troubles généraux et anomalies au site d’administration
|
fréquent
|
Réaction au site d’injection
| |
peu fréquent
|
Douleur au site d’injection, contusion au site d’injection, gonflement au site d’administration*, prurit au site d’injection, masse au site d’injection, pression au site d’injection**
| |
|
rare
|
Douleur faciale*, syndrome grippal, fièvre
| |
Lésions, intoxications et complications liées aux procédures
|
peu fréquent
|
Contusion, hématome périorbitaire*
|
Remarque: sur les 1162 patients traités par Letybo, 1 seul a connu des événements rares.
Une «approche du pire des cas» a été utilisée pour qualifier la fréquence des événements survenus lors des études cliniques et post-commercialisation.
* Réaction indésirable liée à la procédure d’injection. À noter que ces informations n’ont pas été recueillies pour l’étude coréenne post-commercialisation.
** Étude post-commercialisation uniquement.
Description d’effets indésirables spécifiques et informations complémentaires
Effets secondaires liés à l’application
Les effets secondaires liés à l’application qui ont été signalés après l’administration de Letybo sont peu fréquents lorsqu’ils sont pris individuellement, mais fréquents lorsqu’ils sont additionnés. Les réactions peu fréquentes au site d’injection comprennent la douleur, la contusion, le gonflement, le prurit, la tuméfaction et la pression. Les événements rares au niveau du site d’injection comprennent la douleur et la gêne.
Risque de diffusion de la toxine à distance du site d’administration
Des effets secondaires potentiellement liés à la diffusion de la toxine à distance du site d’administration ont été signalés dans de très rares cas pour la toxine botulinique (par exemple faiblesse musculaire, dysphagie, constipation ou pneumopathie d’inhalation possiblement fatale) (voir «Mises en garde et précautions»).
Déclaration des effets secondaires suspectés
L’annonce d’effets secondaires présumés après l’autorisation est d’une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d’effet secondaire nouveau ou grave via le portail d’annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageSignes et symptômes
Le surdosage de Letybo dépend de la dose, du site d’injection et des propriétés des tissus sous-jacents.
Aucun cas de toxicité systémique résultant d’une injection accidentelle de toxine botulinique de type A n’a été observé. Des doses trop élevées peuvent engendrer une paralysie neuromusculaire généralisée et profonde, locale ou à distance. Aucun cas d’ingestion de toxine botulinique de type A n’a été signalé.
Les symptômes de surdosage peuvent ne pas être visibles immédiatement après l’injection.
Traitement
En cas d’injection ou d’ingestion accidentelle, le patient doit être mis sous observation médicale afin de déceler tout signe ou symptôme de faiblesse générale ou de paralysie musculaire. L’hospitalisation doit être envisagée si le patient présente des symptômes d’intoxication par la toxine botulinique de type A (faiblesse généralisée, ptosis, diplopie, troubles de la déglutition et de la parole, ou parésie des muscles respiratoires).
Propriétés/EffetsCode ATC
M03AX01
Mécanisme d’action/Pharmacodynamique
La neurotoxine de type A sécrétée par Clostridium botulinum bloque la libération périphérique du neurotransmetteur acétylcholine au niveau des terminaisons nerveuses cholinergiques présynaptiques des jonctions neuromusculaires en clivant la SNAP-25, une protéine nécessaire à la fixation et à la libération de l’acétylcholine par les vésicules situées dans les terminaisons nerveuses, conduisant ainsi à une dénervation du muscle et à une paralysie flasque.
Après l’injection, il se produit une liaison initiale rapide et extrêmement forte de la toxine à des récepteurs cellulaires de surface spécifiques. Cette étape est suivie d’un passage de la toxine à travers la membrane plasmatique par endocytose médiée par récepteurs. Enfin, la toxine est libérée dans le cytosol, entraînant une inhibition progressive de la libération d’acétylcholine. Les signes cliniques sont visibles au bout de 2 à 3 jours, le pic d’effet étant observé 4 semaines après l’injection. Le rétablissement survient généralement dans les 3 à 4 mois suivant l’injection, lorsque les terminaisons nerveuses recréent leurs connexions avec les plaques basales.
Efficacité clinique
La sécurité et l’efficacité de Letybo ont été analysées dans 3 études pivots de phase 3 en double aveugle (BLESS I, BLESS II et BLESS III) au cours desquelles un total de 955 patients ont été traités par Letybo et 317 patients ont été traités par placebo dans le cadre de 1 traitement. En outre, des données sont disponibles pour 854 patients traités par Letybo dans une extension en ouvert des études BLESS I et II dans le cadre de 1 à 3 traitements supplémentaires. Le programme de développement clinique en Corée a permis d’obtenir des données complémentaires sur les rides glabellaires. Il comprenait une étude de phase 3 (HG-11-01) portant sur 137 patients et une étude post-commercialisation (HG-13-02) portant sur 815 patients.
Au moment de l’inclusion dans les études BLESS I, BLESS II et BLESS III, tous les patients présentaient des rides glabellaires modérées (27% des sujets) ou sévères (73% des sujets) lors du froncement maximal des sourcils. À la dose de 20 unités, Letybo a réduit de manière significative la sévérité des rides glabellaires observées au froncement maximal des sourcils, telle que mesurée à travers une évaluation par l’investigateur et par le patient sur une échelle des rides du visage en 4 points (Facial Wrinkle Scale, FWS). Un taux de réponse statistiquement significatif a été observé avec Letybo en utilisant un critère d’évaluation exigeant une amélioration de 2 points du score FWS. Des taux de réponse élevés en faveur de Letybo ont également été observés en appliquant la définition de la réponse cliniquement significative, à savoir l’obtention d’un score FWS de 0 ou 1 (rides absentes ou légères) selon l’évaluation de l’investigateur à la semaine 4 (voir tableau 2).
Tableau 2: Taux de réponse à la semaine 4 par rapport à l’inclusion au froncement maximal des sourcils selon l’échelle des rides du visage (FWS) dans les études BLESS I, BLESS II et BLESS III – Analyse des données complètes
|
|
BLESS I
|
BLESS II
|
BLESS III
| |
Évaluation par:
|
Letybo
(N = 529)
|
Placebo
(N = 175)
|
Letybo
(N = 160)
|
Placebo
(N = 53)
|
Letybo
(N = 266)
|
Placebo
(N = 89)
| |
Taux de réponse (n [%]): Réduction du score FWS de modéré ou sévère à nul ou léger (amélioration ≥ 2 points requise)a
| |
Investigateur ET patient
|
246 (46,5%)*
|
0 (0%)
|
78 (48,8%)*
|
1 (1,9%)
|
172 (64,7%)*
|
0 (0,0%)
| |
Investigateur
|
348 (65,8%)*
|
1 (0,6%)
|
120 (75,0%)*
|
1 (1,9%)
|
209 (78,6%)*
|
1 (1,1%)
| |
Patient
|
290 (54,8%)*
|
0 (0%)
|
83 (51,9%)*
|
1 (1,9%)
|
183 (68,8%)*
|
0 (0,0%)
| |
Taux de réponse (%): Réduction du score FWS de modéré ou sévère à nul ou légerb
| |
Investigateur
|
393 (74,3%)*
|
3 (1,7%)
|
136 (85,0%)*
|
2 (3,8%)
|
218 (82,0%)*
|
1 (1,1%)
|
* Valeur p < 0,001 au test de Cochran-Mantel-Haenszel pour la différence entre Letybo et le placebo; N: nombre de patients randomisés, n: nombre de répondeurs
a Critère principal d’évaluation de l’efficacité
b Analyse post hoc
Au total, 38,3% des sujets traités par Letybo présentaient une amélioration de 3 points du score de sévérité des rides, passant de sévère (grade 3 de la FWS) au moment de l’inclusion à nul (grade 0 de la FWS) à la semaine 4, selon l’évaluation de l’investigateur.
L’amélioration des rides glabellaires (basée sur une réduction ≥ 2 points du score FWS au froncement maximal des sourcils selon l’évaluation du patient et de l’investigateur) a débuté pendant la semaine suivant l’injection, avec un effet maximal au cours de la deuxième semaine suivant l’injection. On peut considérer que l’effet dure entre 12 et 16 semaines (voir figure 1).
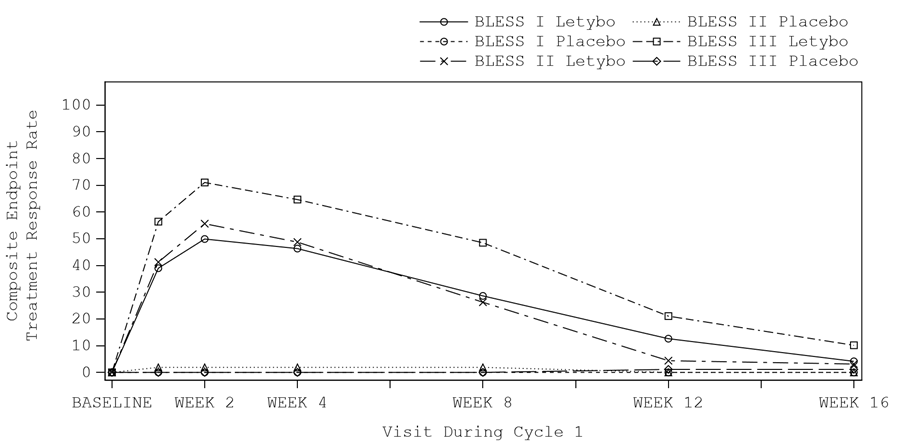
Figure 1: Évolution dans le temps du taux de répondeurs (amélioration ≥ 2 points du score FWS requise selon l’évaluation du patient et de l’investigateur) pendant le cycle 1 pour le traitement actif par rapport au placebo dans les études pivots BLESS
Il a pu être démontré que, sur le plan statistique, le taux de répondeurs avec une réduction ≥ 1 point du score FWS au repos était significativement plus élevé dans le groupe sous Letybo que dans le groupe sous placebo: quatre semaines après l’injection, les investigateurs ont estimé que 63,1%, 59,4% et 61,3% des patients traités par Letybo et 15,4%, 5,7% et 9,0% des patients traités par placebo avaient connu une amélioration ≥ 1 point du score FWS au repos dans les études BLESS I, BLESS II et BLESS III, respectivement (la valeur p des différences entre les traitements était < 0,001 pour toutes les études).
Les données en ouvert sur les doses répétées à long terme ont confirmé que les taux de réponse après les deuxième, troisième et quatrième traitements par Letybo sur la période étudiée d’une année sont restés élevés même si, d’après la méthodologie de l’étude, les cycles de retraitement comportaient un biais de non-réponse.
Selon la nouvelle échelle Skindex-16 modifiée qui évalue la qualité de vie des personnes présentant des rides glabellaires, au moment de l’inclusion dans les études, les rides glabellaires avaient un retentissement psychologique négatif modéré ou sévère chez plus de 85% des participants, et un retentissement léger chez environ 15% d’entre eux.
Comme le montrent les scores de l’échelle Skindex-16 modifiée, une nette amélioration du retentissement psychologique a été observée chez les patients traités par Letybo par rapport à ceux traités par placebo.
Des résultats cosmétiques largement favorables, corroborés par des taux élevés de satisfaction, ont été enregistrés par les patients.
Données post-commercialisation
Les données post-commercialisation, y compris celles d’une étude post-commercialisation sur les rides glabellaires (HG-13-02) impliquant 815 patients, sont conformes à celles observées dans les études cliniques.
Patients âgés
Sur l’ensemble des études BLESS I, BLESS II et BLESS III, 152/1272 patients (11,91%) étaient âgés de 65 ans ou plus au moment de la sélection. Aucun patient n’était âgé de plus de 75 ans. Toujours sur l’ensemble des études BLESS I, BLESS II et BLESS III, le taux de répondeurs composite à la semaine 4 (critère d’évaluation principal) parmi les patients traités par Letybo était plus faible chez les patients de 65 ans ou plus, avec 46/118 (39,0%), que chez les patients de moins de 65 ans, avec 450/839 (53,6%). Aucune différence majeure n’a été observée au niveau du taux global de patients présentant des EIAT considérés comme liés au traitement en double aveugle par Letybo au sein des 3 études combinées (3,7% et 1,7% chez les patients de moins de 65 ans et de 65 ans ou plus, respectivement, lorsque les EIAT liés au médicament et/ou à la procédure d’injection étaient pris en compte).
PharmacocinétiqueAbsorption
Non pertinent.
Distribution
La toxine botulinique de type A ne devrait pas être présente dans le sang périphérique à un niveau mesurable après une injection intramusculaire à la dose recommandée de 20 unités.
Métabolisme
Non pertinent.
Élimination
Non pertinent.
Données précliniquesToxicité à dose unique et à doses répétées
Des études de toxicité à dose unique et à doses répétées avec injections intramusculaires hebdomadaires ou mensuelles de Letybo chez le rat ont mis en évidence une paralysie dépendant de la dose au niveau du muscle concerné par l’injection. Ce phénomène a entraîné une diminution de la locomotion, de la consommation alimentaire, du poids corporel et de la créatinine en raison d’une atrophie musculaire considérée comme consécutive à la paralysie musculaire et à la réduction de l’agilité des animaux. Aucun autre effet indésirable grave (local ou systémique) présentant un intérêt toxicologique n’a été observé jusqu’à la dose de 15 U/kg.
Mutagénicité et carcinogénicité
Aucune étude sur le potentiel de génotoxicité ou de carcinogénicité de Letybo n’a été menée.
Toxicité sur la reproduction
Aucune étude de fertilité n’a été réalisée concernant Letybo. Chez les rats mâles et femelles, des atteintes de la fertilité ont toutefois été observées avec d’autres produits contenant de la toxine botulinique de type A à doses élevées.
Dans une étude sur le développement embryo-fœtal avec injections intramusculaires quotidiennes de Letybo jusqu’à la dose de 8 U/kg entre les jours 5 et 16 de la gestation chez des rates gravides, une paralysie musculaire dépendant de la dose a été mise en évidence chez les mères, entraînant une atrophie musculaire, une réduction du poids corporel et une région périnéale souillée. Un retard de l’ossification fœtale et une réduction du poids corporel fœtal (≥ 20%) sans malformation ont été détectés. En conformité avec l’expérience acquise avec d’autres produits à base de toxine botulinique de type A, ils ont été interprétés comme des conséquences secondaires de la toxicité maternelle. Les effets sur le développement péri-/post-natal n’ont pas été évalués.
Remarques particulièresIncompatibilités
Ce médicament ne peut être mélangé qu’aux médicaments mentionnés sous Remarques concernant la manipulation.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l’emballage.
Stabilité après ouverture
Une fois reconstituée, la préparation injectable ne doit pas être conservée. Sa stabilité chimique et physique «in use» a été démontrée pendant 48 heures entre 2 et 8 °C. D’un point de vue microbiologique, la solution reconstituée doit être utilisée immédiatement. Si elle n’est pas utilisée immédiatement, les durées et conditions de conservation en cours d’utilisation relèvent de la responsabilité de l’utilisateur et ne devraient pas dépasser 24 heures à une température comprise entre 2 et 8 °C, sauf en cas de reconstitution réalisée en conditions d’asepsie dûment contrôlées et validées.
Remarques particulières concernant le stockage
Conserver au réfrigérateur (2-8 °C).
Conserver le récipient dans son carton pour le protéger de la lumière.
Conserver hors de portée des enfants.
Remarques concernant la manipulation
Les instructions d’utilisation, de manipulation et d’élimination doivent être strictement respectées.
La reconstitution doit être effectuée conformément aux bonnes pratiques cliniques, notamment en ce qui concerne les techniques d’asepsie.
Pour reconstituer Letybo, utiliser 1,25 ml d’une solution injectable de chlorure de sodium à 9 mg/ml (0,9%) comme diluant.
Il est recommandé de reconstituer le contenu du flacon et de préparer la seringue au-dessus de serviettes en papier à doublure en plastique pour récupérer tout déversement éventuel. Aspirer la solution injectable de chlorure de sodium à 9 mg/ml (0,9%) dans une seringue et l’injecter délicatement dans le flacon pour éviter la formation de mousse/bulles ou toute agitation vigoureuse qui pourrait dénaturer le produit. Si le vide n’aspire pas le solvant dans le flacon, celui-ci doit être éliminé. Après reconstitution, Letybo se présente comme une solution limpide, incolore et pratiquement dépourvue de particules. Avant utilisation, inspecter visuellement le flacon pour s’assurer que le produit est exempt de particules étrangères.
Letybo ne doit pas être utilisé si la solution reconstituée est trouble ou contient des particules.
Toute solution injectable qui a été conservée plus de 24 heures doit être éliminée.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Procédure à suivre pour une élimination en toute sécurité des flacons, des seringues et des matériels utilisés
Pour une élimination en toute sécurité, la fraction de Letybo non reconstituée doit être reconstituée dans le flacon avec une petite quantité d’eau, puis autoclavée. Les flacons vides ou contenant un résidu de solution, les seringues et les déversements doivent être autoclavés. La fraction restante de Letybo peut sinon être inactivée à l’aide d’une solution diluée d’hydroxyde de sodium (0,1 N NaOH) ou d’hypochlorite de sodium (NaOCl à 0,5% ou 1%).
Après inactivation, les flacons, seringues et matériels usagés ne doivent pas être vidés, mais placés dans des récipients appropriés et éliminés conformément à la réglementation nationale en vigueur.
Recommandations en cas d’accident lors de la manipulation de la toxine botulinique
-Tout déversement du produit doit être essuyé: soit à l’aide d’un matériau absorbant imprégné d’une solution d’hypochlorite de sodium dans le cas du produit en poudre, soit à l’aide d’un matériau absorbant sec dans le cas du produit reconstitué.
-Les surfaces contaminées doivent être nettoyées avec un matériau absorbant imprégné d’une solution d’hypochlorite de sodium, puis séchées.
-Si un flacon est cassé, recueillir soigneusement les morceaux de verre et essuyer le produit comme indiqué ci-dessus, en évitant toute coupure de la peau.
-En cas de contact du médicament avec la peau, laver la zone concernée avec une solution d’hypochlorite de sodium, puis rincer abondamment à l’eau.
-En cas de contact du médicament avec les yeux, rincer abondamment à l’eau ou avec une solution de rinçage oculaire.
-En cas de contact du médicament avec une plaie, une coupure ou de la peau éraflée, rincer abondamment à l’eau et prendre les mesures médicales appropriées en fonction de la dose d’exposition.
Numéro d’autorisation68864 (Swissmedic).
PrésentationBoîtes contenant 1 flacon ou 2 flacons [A].
Boîte multi-pack contenant 2 flacons (2 boîtes de 1 flacon) [A].
Boîte multi-pack contenant 6 flacons (6 boîtes de 1 flacon) [A].
Titulaire de l’autorisationMedius AG, 4132 Muttenz.
Mise à jour de l’informationJuin 2023.
|


