Propriétés/EffetsCode ATC
M03AX01
Mécanisme d’action/Pharmacodynamique
La neurotoxine de type A sécrétée par Clostridium botulinum bloque la libération périphérique du neurotransmetteur acétylcholine au niveau des terminaisons nerveuses cholinergiques présynaptiques des jonctions neuromusculaires en clivant la SNAP-25, une protéine nécessaire à la fixation et à la libération de l’acétylcholine par les vésicules situées dans les terminaisons nerveuses, conduisant ainsi à une dénervation du muscle et à une paralysie flasque.
Après l’injection, il se produit une liaison initiale rapide et extrêmement forte de la toxine à des récepteurs cellulaires de surface spécifiques. Cette étape est suivie d’un passage de la toxine à travers la membrane plasmatique par endocytose médiée par récepteurs. Enfin, la toxine est libérée dans le cytosol, entraînant une inhibition progressive de la libération d’acétylcholine. Les signes cliniques sont visibles au bout de 2 à 3 jours, le pic d’effet étant observé 4 semaines après l’injection. Le rétablissement survient généralement dans les 3 à 4 mois suivant l’injection, lorsque les terminaisons nerveuses recréent leurs connexions avec les plaques basales.
Efficacité clinique
La sécurité et l’efficacité de Letybo ont été analysées dans 3 études pivots de phase 3 en double aveugle (BLESS I, BLESS II et BLESS III) au cours desquelles un total de 955 patients ont été traités par Letybo et 317 patients ont été traités par placebo dans le cadre de 1 traitement. En outre, des données sont disponibles pour 854 patients traités par Letybo dans une extension en ouvert des études BLESS I et II dans le cadre de 1 à 3 traitements supplémentaires. Le programme de développement clinique en Corée a permis d’obtenir des données complémentaires sur les rides glabellaires. Il comprenait une étude de phase 3 (HG-11-01) portant sur 137 patients et une étude post-commercialisation (HG-13-02) portant sur 815 patients.
Au moment de l’inclusion dans les études BLESS I, BLESS II et BLESS III, tous les patients présentaient des rides glabellaires modérées (27% des sujets) ou sévères (73% des sujets) lors du froncement maximal des sourcils. À la dose de 20 unités, Letybo a réduit de manière significative la sévérité des rides glabellaires observées au froncement maximal des sourcils, telle que mesurée à travers une évaluation par l’investigateur et par le patient sur une échelle des rides du visage en 4 points (Facial Wrinkle Scale, FWS). Un taux de réponse statistiquement significatif a été observé avec Letybo en utilisant un critère d’évaluation exigeant une amélioration de 2 points du score FWS. Des taux de réponse élevés en faveur de Letybo ont également été observés en appliquant la définition de la réponse cliniquement significative, à savoir l’obtention d’un score FWS de 0 ou 1 (rides absentes ou légères) selon l’évaluation de l’investigateur à la semaine 4 (voir tableau 2).
Tableau 2: Taux de réponse à la semaine 4 par rapport à l’inclusion au froncement maximal des sourcils selon l’échelle des rides du visage (FWS) dans les études BLESS I, BLESS II et BLESS III – Analyse des données complètes
|
|
BLESS I
|
BLESS II
|
BLESS III
| |
Évaluation par:
|
Letybo
(N = 529)
|
Placebo
(N = 175)
|
Letybo
(N = 160)
|
Placebo
(N = 53)
|
Letybo
(N = 266)
|
Placebo
(N = 89)
| |
Taux de réponse (n [%]): Réduction du score FWS de modéré ou sévère à nul ou léger (amélioration ≥ 2 points requise)a
| |
Investigateur ET patient
|
246 (46,5%)*
|
0 (0%)
|
78 (48,8%)*
|
1 (1,9%)
|
172 (64,7%)*
|
0 (0,0%)
| |
Investigateur
|
348 (65,8%)*
|
1 (0,6%)
|
120 (75,0%)*
|
1 (1,9%)
|
209 (78,6%)*
|
1 (1,1%)
| |
Patient
|
290 (54,8%)*
|
0 (0%)
|
83 (51,9%)*
|
1 (1,9%)
|
183 (68,8%)*
|
0 (0,0%)
| |
Taux de réponse (%): Réduction du score FWS de modéré ou sévère à nul ou légerb
| |
Investigateur
|
393 (74,3%)*
|
3 (1,7%)
|
136 (85,0%)*
|
2 (3,8%)
|
218 (82,0%)*
|
1 (1,1%)
|
* Valeur p < 0,001 au test de Cochran-Mantel-Haenszel pour la différence entre Letybo et le placebo; N: nombre de patients randomisés, n: nombre de répondeurs
a Critère principal d’évaluation de l’efficacité
b Analyse post hoc
Au total, 38,3% des sujets traités par Letybo présentaient une amélioration de 3 points du score de sévérité des rides, passant de sévère (grade 3 de la FWS) au moment de l’inclusion à nul (grade 0 de la FWS) à la semaine 4, selon l’évaluation de l’investigateur.
L’amélioration des rides glabellaires (basée sur une réduction ≥ 2 points du score FWS au froncement maximal des sourcils selon l’évaluation du patient et de l’investigateur) a débuté pendant la semaine suivant l’injection, avec un effet maximal au cours de la deuxième semaine suivant l’injection. On peut considérer que l’effet dure entre 12 et 16 semaines (voir figure 1).
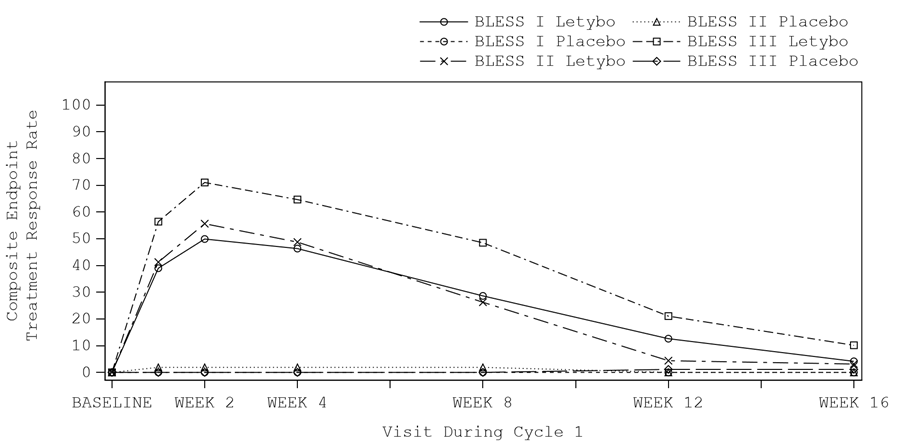
Figure 1: Évolution dans le temps du taux de répondeurs (amélioration ≥ 2 points du score FWS requise selon l’évaluation du patient et de l’investigateur) pendant le cycle 1 pour le traitement actif par rapport au placebo dans les études pivots BLESS
Il a pu être démontré que, sur le plan statistique, le taux de répondeurs avec une réduction ≥ 1 point du score FWS au repos était significativement plus élevé dans le groupe sous Letybo que dans le groupe sous placebo: quatre semaines après l’injection, les investigateurs ont estimé que 63,1%, 59,4% et 61,3% des patients traités par Letybo et 15,4%, 5,7% et 9,0% des patients traités par placebo avaient connu une amélioration ≥ 1 point du score FWS au repos dans les études BLESS I, BLESS II et BLESS III, respectivement (la valeur p des différences entre les traitements était < 0,001 pour toutes les études).
Les données en ouvert sur les doses répétées à long terme ont confirmé que les taux de réponse après les deuxième, troisième et quatrième traitements par Letybo sur la période étudiée d’une année sont restés élevés même si, d’après la méthodologie de l’étude, les cycles de retraitement comportaient un biais de non-réponse.
Selon la nouvelle échelle Skindex-16 modifiée qui évalue la qualité de vie des personnes présentant des rides glabellaires, au moment de l’inclusion dans les études, les rides glabellaires avaient un retentissement psychologique négatif modéré ou sévère chez plus de 85% des participants, et un retentissement léger chez environ 15% d’entre eux.
Comme le montrent les scores de l’échelle Skindex-16 modifiée, une nette amélioration du retentissement psychologique a été observée chez les patients traités par Letybo par rapport à ceux traités par placebo.
Des résultats cosmétiques largement favorables, corroborés par des taux élevés de satisfaction, ont été enregistrés par les patients.
Données post-commercialisation
Les données post-commercialisation, y compris celles d’une étude post-commercialisation sur les rides glabellaires (HG-13-02) impliquant 815 patients, sont conformes à celles observées dans les études cliniques.
Patients âgés
Sur l’ensemble des études BLESS I, BLESS II et BLESS III, 152/1272 patients (11,91%) étaient âgés de 65 ans ou plus au moment de la sélection. Aucun patient n’était âgé de plus de 75 ans. Toujours sur l’ensemble des études BLESS I, BLESS II et BLESS III, le taux de répondeurs composite à la semaine 4 (critère d’évaluation principal) parmi les patients traités par Letybo était plus faible chez les patients de 65 ans ou plus, avec 46/118 (39,0%), que chez les patients de moins de 65 ans, avec 450/839 (53,6%). Aucune différence majeure n’a été observée au niveau du taux global de patients présentant des EIAT considérés comme liés au traitement en double aveugle par Letybo au sein des 3 études combinées (3,7% et 1,7% chez les patients de moins de 65 ans et de 65 ans ou plus, respectivement, lorsque les EIAT liés au médicament et/ou à la procédure d’injection étaient pris en compte).
|

