CompositionPrincipes actifs
Calcipotriolum, Betamethasonum ut Betamethasoni dipropionas
Excipients
Butylhydroxyanisolum 1,0 mg/g (E320), Macrogolglyceroli hydroxystearas 3,4 mg/g, Isopropylis myristas, Paraffinum liquidum, Triglycerida media, Alcohol isopropylicus, Macrogoli 4 aether laurilicus, Poloxamerum 407, Carbomera, Trolaminum, Dinatrii phosphas heptahydricus, Natrii dihydrogenophosphas monohydricus, alpha-Tocopherolum, Aqua purificata
Indications/Possibilités d’emploiPour le traitement topique du psoriasis vulgaire léger à modéré (y compris le psoriasis du cuir chevelu) chez l’adulte.
Posologie/Mode d’emploiPosologie
Wynzora Crème doit être appliqué en fine couche sur les zones affectées une fois par jour et en frictionnant bien. La durée de traitement recommandée est de 8 semaines au maximum. Le traitement doit être arrêté lorsque le résultat thérapeutique visé a été atteint. Wynzora Crème ne doit pas être appliqué au niveau du visage, de l’aine ou des aisselles ou en cas d’atrophie cutanée.
Lors de l’utilisation de médicaments contenant du calcipotriol, la dose maximale journalière de 15 g ne doit pas être dépassée. La surface cutanée traitée par des médicaments à base de calcipotriol ne doit pas excéder 30% de la surface corporelle (voir «Mises en garde et précautions»).
En cas d’utilisation sur le cuir chevelu
Toutes les zones du cuir chevelu affectées peuvent être traitées par Wynzora Crème, à l’exception du visage.
Instructions posologiques particulières
Patients présentant des troubles de la fonction hépatique
La sécurité et l’efficacité de Wynzora Crème n’ont pas été évaluées chez les patients présentant des affections hépatiques sévères.
Patients présentant des troubles de la fonction rénale
La sécurité et l’efficacité de Wynzora Crème n’ont pas été évaluées chez les patients atteints d’insuffisance rénale sévère.
Enfants et adolescents
La sécurité et l’efficacité de Wynzora Crème n’ont pas été établies chez les enfants et les adolescents de moins de 18 ans.
Mode d’administration
Wynzora Crème ne doit pas être appliqué directement sur le visage ou les yeux. Pour un effet optimal, il est recommandé de ne pas prendre de douche ou de bain immédiatement après l’application de Wynzora Crème. Wynzora Crème devrait demeurer au minimum 8 heures sur la peau.
Se laver les mains après utilisation.
Contre-indications§Hypersensibilité aux principes actifs ou à l’un des excipients (voir «Composition»).
§Wynzora Crème est contre-indiqué en cas de psoriasis érythrodermique, exfoliant et pustuleux.
§En raison de la teneur en calcipotriol, Wynzora Crème est contre-indiqué chez les patients présentant des troubles connus du métabolisme calcique (voir «Mises en garde et précautions»).
§En raison de la teneur en corticostéroïdes, Wynzora Crème est contre-indiqué en présence des affections suivantes: lésions cutanées d’origine virale (par ex. par le virus de l’herpès ou de la varicelle), infections cutanées d’origine fongique ou bactérienne, infections parasitaires, manifestations cutanées de la tuberculose, dermatite périorale, atrophie cutanée, Striae atrophicae (vergetures), fragilité des veines cutanées, ichtyose, acné vulgaire, acné rosacée, rosacée, ulcérations et plaies (voir «Mises en garde et précautions»).
Mises en garde et précautionsEffets sur le système endocrinien
Les effets indésirables observés en lien avec un traitement systémique par corticostéroïdes, comme la suppression corticosurrénale ou les répercussions sur le contrôle métabolique du diabète sucré, peuvent également se produire lors d’un traitement topique par un corticostéroïde en raison d’une absorption systémique.
L’application sous pansement occlusif doit être évitée car cela entraîne une absorption systémique accrue des corticostéroïdes.
L’application sur de larges surfaces de peau lésée, sur les muqueuses ou au niveau des plis cutanés doit être évitée car cela augmente l’absorption systémique des corticostéroïdes (voir «Effets indésirables»).
La suppression de l’axe HHS (axe hypothalamo-hypophyso-surrénalien) par Wynzora a été étudiée chez des patients adultes (N = 27) atteints de psoriasis étendu (y compris du cuir chevelu). Une suppression surrénalienne a été observée chez 6 patients sur 26 (23%) après 4 semaines de traitement, et chez 3 patients sur 25 (12%) après 8 semaines de traitement.
Troubles visuels
Des troubles visuels peuvent survenir lors de l’administration de corticostéroïdes par voie systémique et topique. Si un patient se présente avec des symptômes tels qu’une vision trouble ou d’autres troubles visuels, il convient d’envisager de l’adresser à un ophtalmologue afin d’explorer les causes possibles; celles-ci incluent entre autres la cataracte, le glaucome ou les maladies rares telles que la choriorétinopathie séreuse centrale (CSC) rapportée après l’utilisation de corticostéroïdes systémiques ou topiques.
Répercussions sur le métabolisme calcique
Une hypercalcémie peut se produire en raison de la teneur en calcipotriol de Wynzora Crème. Le taux sérique de calcium se normalise après l’arrêt du traitement. Le risque d’hypercalcémie est faible lorsque la dose maximale journalière (15 g) ou hebdomadaire 100 g de Wynzora Crème n’est pas dépassée (voir «Posologie/Mode d’emploi»).
Effets indésirables locaux
Lors d’un test de vasoconstriction mené chez des sujets sains, l’ampleur du blanchiment de la peau par Wynzora Crème, en comparaison à d’autres corticostéroïdes topiques, correspondait à celle observée avec un corticostéroïde de classe III. Tout traitement concomitant par d’autres stéroïdes sur la même zone doit être évité.
La peau du visage et de la région génitale réagit de manière très sensible aux corticostéroïdes. Le médicament ne doit pas être appliqué sur ces zones.
Le patient doit être formé à l’utilisation correcte du médicament afin d’éviter toute application et tout transfert accidentel sur le visage, la bouche et les yeux. Se laver les mains après chaque application afin d’éviter tout transfert accidentel sur ces zones.
Infections cutanées concomitantes
En cas de survenue d’infections secondaires, celles-ci doivent être traitées par une thérapie antimicrobienne. Toutefois, si l’infection s’aggrave, le traitement par corticostéroïdes doit être interrompu (voir «Contre-indications»).
Arrêt du traitement
Lorsqu’un traitement du psoriasis par corticostéroïdes est arrêté, il existe un risque de psoriasis pustuleux généralisé ou d’effets rebond. La surveillance médicale doit donc se poursuivre durant la phase post-traitement.
Utilisation à long terme
L’utilisation à long terme de corticostéroïdes peut augmenter le risque d’effets indésirables locaux et systémiques. Le traitement doit être arrêté en cas de survenue d’effets indésirables liés à l’utilisation à long terme de corticostéroïdes (voir «Effets indésirables»).
Utilisation non testée
Il n’existe pas de données concernant l’emploi de Wynzora Crème dans le psoriasis en gouttes.
Traitement concomitant et exposition aux rayons UV
Les expériences disponibles concernant l’utilisation de Wynzora Crème en association avec d’autres antipsoriasiques topiques sur les mêmes zones du corps, avec des antipsoriasiques systémiques ou avec la photothérapie sont insuffisantes pour émettre des recommandations à ce sujet.
Pendant le traitement avec Wynzora Crème, il est recommandé de limiter ou d’éviter l’exposition excessive à la lumière solaire naturelle ou artificielle. Le calcipotriol topique ne doit être utilisé avec des rayons UV que si, après une appréciation soigneuse par le médecin et le patient, le bénéfice potentiel l’emporte sur le risque potentiel.
Wynzora Crème contient du butylhydroxyanisole et de l’hydroxystéarate de macrogolglycérol
Le butylhydroxyanisole peut provoquer des réactions cutanées locales (par ex. dermatite de contact) ou une irritation des yeux et des muqueuses.
L’hydroxystéarate de macrogolglycérol peut provoquer des réactions cutanées.
InteractionsAucune étude visant à répertorier les interactions avec Wynzora Crème n’a été effectuée.
Wynzora Crème ne doit pas être mélangé à des préparations qui contiennent de l’acide salicylique, car l’acide salicylique inactive rapidement le calcipotriol. L’effet de la bétaméthasone contenue dans Wynzora Crème n’est cependant pas influencé par l’acide salicylique. L’acide salicylique n’est pas absorbé et demeure quelques heures à la surface de la peau, si bien que l’effet du calcipotriol peut diminuer, même en cas d’application différée. Aucune expérience n’est disponible sur les interactions possibles avec d’autres produits antipsoriasiques. Dans des circonstances particulières, telles qu’un traitement cutané très fortement dosé et étendu, les principes actifs de Wynzora Crème peuvent être absorbés par voie systémique en quantités cliniquement significatives.
Grossesse/AllaitementGrossesse
Il n’existe pas de données suffisantes à ce jour concernant l’emploi de produits à base de calcipotriol/bétaméthasone chez la femme enceinte. Des études menées chez l’animal avec le calcipotriol administré par voie orale n’ont pas révélé d’effets tératogènes, bien qu’une toxicité pour la reproduction ait été mise en évidence (voir «Données précliniques»). Les études expérimentales menées chez l’animal avec des glucocorticoïdes ont révélé une toxicité pour la reproduction (voir «Données précliniques»), mais une série d’études épidémiologiques (moins de 300 issues de grossesses) n’a pas montré d’anomalies congénitales chez les nourrissons nés de femmes traitées par des corticostéroïdes pendant la grossesse. Le risque potentiel pour l’être humain est incertain. Par conséquent, Wynzora Crème ne doit être utilisé pendant la grossesse que si le bénéfice potentiel justifie le risque potentiel.
Allaitement
La bétaméthasone est excrétée dans le lait maternel, mais la survenue d’effets indésirables chez le nourrisson allaité semble peu probable aux doses thérapeutiques. Il n’existe aucune donnée sur l’excrétion du calcipotriol dans le lait maternel. Wynzora Crème doit être prescrit avec prudence aux femmes qui allaitent. L’allaitement n’est pas autorisé en cas d’application de Wynzora Crème sur les seins.
Fertilité
Des études menées chez le rat avec des doses orales de calcipotriol ou de dipropionate de bétaméthasone n’ont révélé aucune altération de la fertilité chez le mâle et la femelle (Voir «Données précliniques»).
Effet sur l’aptitude à la conduite et l’utilisation de machinesL’effet de Wynzora Crème sur l’aptitude à la conduite et l’utilisation de machines n’a pas été étudié.
Effets indésirablesL’estimation de la fréquence des effets indésirables repose sur l’analyse groupée de données issues d’études cliniques.
Tous les effets indésirables rapportés ont été observés à une fréquence inférieure à 1%. Les effets indésirables les plus fréquemment observés étaient des «réactions au site d’application» telles que irritations, douleurs, prurit, eczéma, exfoliation, télangiectasie et folliculite.
Les effets indésirables sont présentés par classe de systèmes d’organes de la classification MedDRA et par fréquence dans le Tableau 1 ci-dessous. Dans chaque groupe de fréquence, les effets indésirables sont présentés par ordre décroissant de gravité. La fréquence des effets indésirables est exprimée selon les catégories suivantes: «très fréquents» (≥ 1/10), «fréquents» (≥ 1/100 à < 1/10), «occasionnels »(≥ 1/1’000 à < 1/100), «rares» (≥ 1/10’000 à < 1/1’000), «très rares» (< 1/10’000), «fréquence inconnue» (ne peut être estimée sur la base des données disponibles).
Tableau 1: Effets indésirables rapportés pour Wynzora
|
Classe de systèmes d’organes
|
Occasionnels
|
Fréquence inconnue
| |
Infections et infestations
|
Folliculite au site d’application
Infections des voies aériennes supérieures
|
| |
Affections du système nerveux
|
Insomnie
|
| |
Affections oculaires
|
|
Vision trouble*
| |
Affections de la peau et du tissu sous-cutané
|
Prurit
Rash
Urticaire
|
| |
Troubles généraux et anomalies au site d’administration
|
Irritation au site d’application
Douleurs au site d’application
Prurit au site d’application
Eczéma au site d’application
Exfoliation au site d’application
Télangiectasie au site d’application
Céphalée
|
|
* Voir la rubrique «Mises en garde et précautions»
Les effets indésirables suivants sont attribués respectivement aux classes pharmacologiques du calcipotriol et de la bétaméthasone:
Calcipotriol
Les effets indésirables incluent réactions au site d’application, prurit, irritation cutanée, sensation de brûlure et picotements, sècheresse cutanée, érythème, rash cutané, dermatite, eczéma, psoriasis aggravé, photosensibilité et réactions d’hypersensibilité, y compris de très rares cas d’angiœdème et d’œdème de la face.
Très rarement, des effets indésirables systémiques peuvent se produire après une utilisation topique et provoquer une hypercalcémie ou une hypercalciurie (voir «Mises en garde et précautions»).
Bétaméthasone (sous forme de dipropionate)
Des réactions locales peuvent se produire après utilisation topique, en particulier en cas d’utilisation prolongée, et incluent atrophie cutanée, télangiectasie, vergetures, folliculite, hypertrichose, dermatite périorale, dermatite allergique de contact, dépigmentation et milium colloïde.
Lors du traitement du psoriasis par des corticostéroïdes topiques, il peut y avoir un risque de psoriasis pustuleux généralisé.
Les réactions systémiques dues à l’utilisation topique de corticostéroïdes sont rares chez les adultes, mais elles peuvent être graves. Une suppression corticosurrénale, une cataracte, des infections, des répercussions sur le contrôle métabolique dans le diabète sucré et une augmentation de la pression intraoculaire peuvent survenir, notamment après un traitement à long terme. Les réactions systémiques se produisent plus fréquemment en cas d’application sous occlusion (plastique, plis cutanés), d’utilisation sur de grandes surfaces et dans le cadre d’un traitement à long terme (voir «Mises en garde et précautions»).
L’annonce d’effets secondaires présumés après l’autorisation est d’une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d’effet secondaire nouveau ou grave via le portail d’annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageL’application d’une dose supérieure à la dose recommandée peut entraîner une augmentation du taux sérique de calcium qui se normalise après l’arrêt du traitement. Les symptômes de l’hypercalcémie incluent polyurie, constipation, faiblesse musculaire, confusion mentale et coma.
On a rapporté un cas de patient atteint d’un psoriasis érythrodermique extensif, ayant développé un syndrome de Cushing traité de manière abusive par 240 g de gel à base de calcipotriol/bétaméthasone par semaine (dose maximale recommandée: 100 g/semaine) pendant 5 mois et ayant présenté un psoriasis pustuleux après une interruption abrupte du traitement.
Traitement:
Une utilisation excessivement longue de corticostéroïdes topiques peut entraîner une suppression corticosurrénale, généralement réversible. Un traitement symptomatique peut être indiqué.
En cas de toxicité chronique, le traitement par corticostéroïdes doit être arrêté progressivement.
Propriétés/EffetsCode ATC
D05AX52
Mécanisme d’action
Le calcipotriol est un dérivé de la vitamine D3. Les données in vitro montrent que le calcipotriol induit la différenciation des kératinocytes et inhibe leur prolifération. Ces deux actions sont supposés être à l’origine de l’effet thérapeutique dans le psoriasis.
L’ester de dipropionate de bétaméthasone présente les propriétés fondamentales des corticostéroïdes. À des dosages pharmacologiques, les corticostéroïdes sont surtout employés pour leur action anti-inflammatoire et/ou immunodépressive. Le mécanisme d’action précis des corticostéroïdes dans le psoriasis n’a pas été élucidé.
Pharmacodynamique
La suppression de l’axe HHS a été évaluée chez des sujets adultes (N = 27) atteints de psoriasis étendu, affectant 20 à 30% de la surface corporelle (incluant le cuir chevelu), dans des conditions d’utilisation maximales. Le traitement consistait en une application une fois par jour de Wynzora Crème sur le corps et le cuir chevelu (75% des sujets présentaient une atteinte du cuir chevelu) pendant 8 semaines au maximum. Une suppression surrénalienne a été observée chez 6 patients sur 26 (23%) après 4 semaines de traitement, et chez 3 patients sur 25 (12%, dont un sujet avec une suppression se poursuivant après 4 semaines et deux autres sujets) après 8 semaines de traitement.
Aucune tendance à la diminution des taux de cortisol n’a été observée après la stimulation à l’ACTH, avec une concentration systémique de B17P en augmentation, mesurée au moyen de l’ASC0-7 ou de la Cmax, ou avec une augmentation de la quantité hebdomadaire moyenne de Wynzora Crème utilisée.
Aucun sujet n’a présenté de résultats de laboratoire indiquant une modification du métabolisme calcique pendant le traitement par Wynzora Crème.
Efficacité clinique
L’efficacité de l’utilisation une fois par jour de Wynzora Crème a été évaluée au cours de deux études cliniques de phase III randomisées, en aveugle pour l’investigateur et d’une durée de 8 semaines, menées auprès de 738 patients atteints de psoriasis sur le corps et le tronc (également sur le cuir chevelu dans l’étude 1) léger à modéré, selon le score de l’évaluation globale de la gravité de la maladie par le médecin (PGA). Ces patients ont été traités par Wynzora Crème, un gel à base de calcipotriol/bétaméthasone ou le véhicule correspondant. Lors des deux études de phase III, Wynzora Crème a été utilisé à une dose plus élevée que celle utilisée dans les groupes témoins actifs. Dans l’étude européenne de phase III MC2-01-C7, 257,9 g de Wynzora Crème ont été appliqués sur 8 semaines, alors que 181,9 g de gel à base de calcipotriol/bétaméthasone, le comparateur actif, ont été appliqués pendant la même période. Dans l’étude de phase III MC2-01-C2, menée aux États-Unis, Wynzora Crème a été utilisé à raison de 33,8 g de crème par semaine, alors que le gel à base de calcipotriol/bétaméthasone, le comparateur actif, a été utilisé à raison de 27,1 g par semaine.
La répartition des grades de sévérité de la maladie chez les participants randomisés était similaire dans les deux études et était représentative de la pratique clinique, la majorité des sujets présentant une forme légère à modérée de la maladie; 24% présentaient une maladie sévère selon la surface corporelle (plus de 10% de la surface corporelle [SC], affectés) et plus de 12% présentaient une maladie sévère selon le score mPASI (mPASI > 12) à l’inclusion. Wynzora Crème s’est avéré efficace pour tous les grades de sévérité de la maladie. Un gel à base de calcipotriol/dipropionate de bétaméthasone a été utilisé comme comparateur actif.
Les résultats des critères principaux et secondaires d’évaluation de l’efficacité dans l’étude 1 et l’étude 2 ont montré que Wynzora Crème présentait une efficacité supérieure à celle du véhicule pour tous les critères d’évaluation de confirmation de l’efficacité dans le traitement du psoriasis sur le corps et le tronc (p < 0,0001; Tableau 2). Le succès du traitement, évalué selon le score PGA, était défini par «peau sans lésions» ou «peau presque sans lésions» pour les patients présentant une forme modérée de la maladie à l’inclusion et par «peau sans lésions» pour les patients présentant une forme légère de la maladie à l’inclusion.
Tableau 2: Efficacité dans l’étude 1 et l’étude 2 avec Wynzora Crème
|
|
Étude 1
|
Étude 2
| |
|
Wynzora Crème
N= 213
|
Crème véhicule
N = 68
|
Wynzora Crème
N = 342
|
Crème véhicule
N = 115
| |
Proportion de patients avec un «succès du traitement» selon le score PGA à la semaine 8 (IC à 95%)
|
50,7
(43,9; 57,5)
|
6,1
(-0,2; 12,4)
|
37,4
(32,1; 42,6)
|
3,7
(0,1; 7,2)
| |
Pourcentage moyen de réduction du score mPASI à la semaine 8
|
67,5
|
11,7
|
62,9
|
22,9
| |
PASI75 à la semaine 8 (IC à 95%)
|
47,6
(40,8; 54,4)
|
5,1
(-0,5; 10,7)
|
41,6
(36,3; 47,0)
|
8,1
(2,8; 13,5)
|
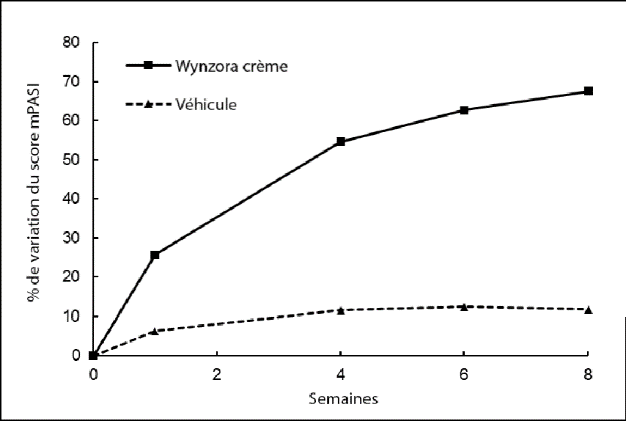
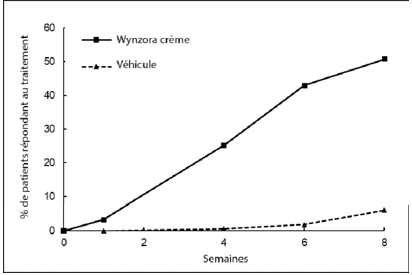
Figure 1: Résultats d’efficacité au cours du temps dans l’étude 1
|
|
|
|
| |
Étude 1: Pourcentage de variation du score mPASI par rapport à l’inclusion. Des différences statistiquement significatives entre le traitement et le véhicule ont été observées dès la semaine 1 (p < 0,0001) et au-delà.
|
Étude 1: Succès du traitement selon le score PGA. Des différences statistiquement significatives entre le traitement et le véhicule ont été observées dès la semaine 4 (p < 0,0001) et au-delà.
|
À la semaine 8, Wynzora Crème a, selon le score PGA, entraîné un succès du traitement statistiquement et significativement plus important que le gel à base de calcipotriol/dipropionate de bétaméthasone.
Dans l’étude 1, l’efficacité de Wynzora Crème sur le psoriasis du cuir chevelu a été évaluée par le pourcentage de sujets avec un «succès du traitement» selon le score PGA (Tableau 3). L’efficacité de Wynzora Crème sur le psoriasis du cuir chevelu était statistiquement et significativement plus élevée que celle du véhicule à la semaine 4 (p = 0,0051) et à la semaine 8 (p = 0,0002).
Tableau 3: Efficacité de Wynzora Crème sur le psoriasis du cuir chevelu dans l’étude 1
|
|
Étude 1
| |
|
Wynzora Crème
N = 112
|
Crème véhicule
N = 38
| |
Proportion de patients avec un «succès du traitement» selon le score PGA à la semaine 8
(IC à 95%)
|
50,8
(41,4; 60,1)
|
9,3
(-0,5; 19,1)
|
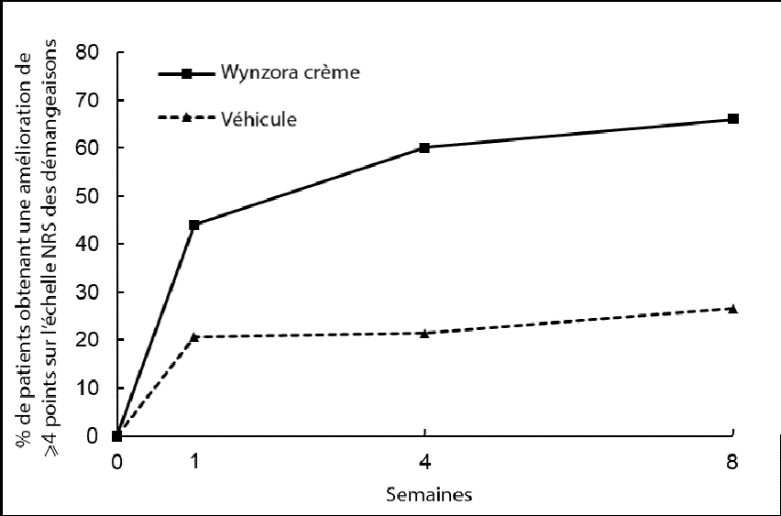
Dans l’étude 2, Wynzora Crème a entraîné une réduction plus importante du prurit par rapport au véhicule, définie par une amélioration du prurit d’au moins 4 points sur une échelle d’évaluation numérique (NRS) entre l’inclusion et la semaine 4. Une différence statistiquement significative entre les traitements (p < 0,0001) a été observée dès la semaine 1 et au-delà.
Figure 2: Amélioration du score sur la NRS pour le prurit entre l’inclusion et la semaine 4 avec Wynzora Crème dans l’étude 2
PharmacocinétiqueAbsorption
L’ampleur de l’absorption percutanée des deux principes actifs après application topique de Wynzora Crème a été déterminée dans le cadre de l’étude portant sur l’axe HHS menée chez des sujets atteints d’un psoriasis vulgaire étendu (voir «Propriétés/Effets, Pharmacodynamique»).
L’atteinte moyenne ± ET pour la surface corporelle totale était de 25 ± 5%, et 74% des participants à l’étude présentaient une atteinte du cuir chevelu, l’atteinte moyenne ± ET pour le cuir chevelu étant de 52 ± 40%. La dose hebdomadaire moyenne ± ET était de 79 ± 30 g pendant les 8 semaines de traitement.
Distribution
Les concentrations plasmatiques de calcipotriol et de dipropionate de bétaméthasone et de leurs principaux métabolites ont été mesurées après 4 et 8 semaines d’application de Wynzora Crème une fois par jour.
La moyenne de tous les analytes se situait dans la plage de concentrations plasmatiques subnanomolaires, et dans la plupart des échantillons en dessous ou proche de la limite inférieure de quantification.
Des taux mesurables de calcipotriol ont été observés chez un sujet de l’étude sur 27 (3,7%) à la semaine 4. La Cmax et l’ASC0-7 étaient respectivement de 30 pg/ml et de 229 pg*h/ml. Trois sujets de l’étude sur vingt-sept (11,1%) ont présenté des taux mesurables du principal métabolite du calcipotriol, le MC1080, à la semaine 4. La Cmax et l’ASC0-7 moyennes ± ET étaient respectivement de 30 ± 4 pg/ml et de 224 ± 16 pg*h/ml. Aucun sujet de l’étude ne présentait de taux mesurables de calcipotriol ou de MC1080 à la semaine 8.
En ce qui concerne le dipropionate de bétaméthasone, des taux mesurables ont été observés chez 3 patients (11,1%) à la semaine 4. La Cmax et l’ASC0-7 moyennes ± ET étaient respectivement de 22 ± 9 pg/ml et de 160 ± 36 pg*h/ml. Le principal métabolite du dipropionate de bétaméthasone, le 17-propionate de bétaméthasone (B17P), était mesurable chez 13 patients sur 27 (48,1%) à la semaine 4. La Cmax et l’ASC0-7 moyennes ± ET étaient respectivement de 96 ± 234 pg/ml et de 419 ± 646 pg*h/ml. Aucun sujet de l’étude ne présentait de taux mesurables de dipropionate de bétaméthasone à la semaine 8, mais 7 sujets de l’étude sur 19 (37%) présentaient des taux mesurables de B17P à la semaine 8. La Cmax et l’ASC0-7 moyennes ± ET étaient respectivement de 31 ± 29 pg/ml et de 205 ± 142 pg*h/ml.
Métabolisme
Calcipotriol:
Le calcipotriol est rapidement métabolisé dans le foie après son absorption systémique. Les principaux métabolites du calcipotriol sont moins efficaces que le composé original.
Le calcipotriol est métabolisé en MC1046 (l’analogue cétonique α, β-insaturé du calcipotriol), lequel est ensuite métabolisé en MC1080 (un analogue cétonique saturé). Le MC1080 est le principal métabolite dans le plasma. Le MC1080 est lentement métabolisé en acide calcitroïque.
Dipropionate de bétaméthasone:
Le dipropionate de bétaméthasone est métabolisé par hydrolyse en 17-propionate de bétaméthasone et en bétaméthasone, y compris les dérivés 6β-hydroxy de ces composés. Le 17-propionate de bétaméthasone (B17P) est le principal métabolite.
Élimination
L’élimination s’effectue par voie rénale et hépatique. Comme le montre l’expérimentation animale, la principale voie d’élimination du calcipotriol se fait par les selles, tandis que le dipropionate de bétaméthasone est éliminé dans les urines.
Données précliniquesLes études réalisées avec les corticostéroïdes chez l’animal ont montré une toxicité pour la reproduction (fente palatine, malformations du squelette). Dans les études de toxicité pour la reproduction avec administration orale de corticostéroïdes à long terme menées chez le rat, un allongement du temps de gestation ainsi qu’une parturition prolongée et difficile ont été observés. De plus, un taux de mortalité accru, un poids de naissance réduit et une prise de poids diminuée de la progéniture ont été observés. Il n’y a pas eu d’altération de la fertilité. La pertinence pour l’être humain n’est pas connue.
Le calcipotriol a montré une toxicité maternelle et fœtale chez le rat et le lapin lorsqu’il était administré par voie orale à des doses de 54 μg/kg/jour et de 12 μg/kg/jour, respectivement. Les anomalies fœtales observées en même temps qu’une toxicité maternelle incluaient des signes évocateurs d’une immaturité du squelette (ossification incomplète des os du pubis et des phalanges des pattes avant, fontanelles élargies) et une incidence accrue de côtes surnuméraires.
L’exposition systémique estimée après application topique de Wynzora Crème chez les patients atteints de psoriasis est négligeable comparée aux concentrations de calcipotriol évaluées dans les études in vivo réalisées avec administration orale, et une exposition thérapeutique à Wynzora Crème n’est pas associée à un risque notable pour la reproduction chez l’être humain.
Les données précliniques issues des études conventionnelles sur la pharmacologie de sécurité, la toxicité en administration répétée et la génotoxicité n’ont pas révélé de risque particulier pour l’être humain.
Une étude de carcinogénicité avec application dermique de calcipotriol réalisée chez la souris et une étude de carcinogénicité avec administration orale effectuée chez le rat n’ont pas révélé de risque particulier pour l’être humain.
Des études de photo(co)carcinogénicité réalisées chez la souris suggèrent que le calcipotriol peut renforcer l’effet inducteur des radiations UV sur les tumeurs cutanées.
Une étude de carcinogénicité avec application dermique réalisée chez la souris et une étude de carcinogénicité avec administration orale effectuée chez le rat n’ont pas révélé de risque particulier du dipropionate de bétaméthasone pour l’être humain.
Dans une étude de tolérance avec application locale menée chez le cochon nain, Wynzora Crème a causé des irritations cutanées légères à modérées.
Remarques particulièresIncompatibilités
Non pertinent.
Stabilité
Ce médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l’emballage.
Stabilité après ouverture
Peut être conservé pendant 6 mois.
Remarques particulières concernant le stockage
Ne pas conserver au-dessus de 25 °C. Ne pas congeler.
Conserver hors de portée des enfants.
Numéro d’autorisation68917 (Swissmedic)
PrésentationUn tube de 60 g [B]
Un emballage de deux tubes de 60 g chacun [B]
Titulaire de l’autorisationAlmirall AG, 8304 Wallisellen
Mise à jour de l’informationAvril 2023
|



