Posologie/Mode d’emploiLe traitement doit être initié et surveillé par un hématologue ou un oncologue expérimenté.
Pomalidomid Zentiva en association avec le bortézomib et la dexaméthasone (PVd) chez les patients atteints d'un myélome multiple, ayant déjà reçu au moins un traitement antérieur.
La dose initiale recommandée d'Pomalidomid Zentiva est de 4 mg par voie orale une fois par jour aux jours 1 à 14 d'un cycle répété de traitement de 21 jours.
La dose recommandée de bortézomib est de 1,3 mg/m2 et la dose recommandée de dexaméthasone est de 20 mg/jour par voie orale une fois par jour, l'administration devant suivre le schéma posologique indiqué au tableau 1.
La posologie est maintenue ou modifiée en fonction des résultats des examens cliniques et des analyses biologiques. Le traitement doit être interrompu en cas de progression de la maladie.
Tableau 1: Schéma posologique recommandé pour Pomalidomid Zentiva en association avec le bortézomib et la dexaméthasone
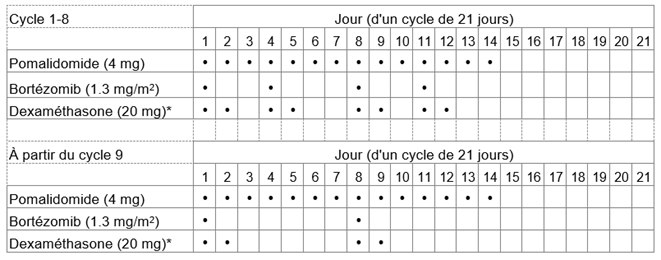
*Pour les patients âgés de >75 ans, voir rubrique «Instructions spéciales pour la posologie».
Pomalidomid Zentiva en association avec la dexaméthasone (Pd) chez les patients présentant un myélome multiple en rechute et réfractaire, ayant déjà reçu au moins deux traitements antérieurs
La dose initiale recommandée d'Pomalidomid Zentiva est de 4 mg par voie orale une fois par jour aux jours 1 à 21 d'un cycle répété de traitement de 28 jours jusqu'à la progression de la maladie. La dose recommandée de dexaméthasone est de 40 mg une fois par jour aux jours 1, 8, 15 et 22 de chaque cycle de traitement de 28 jours.
La posologie est maintenue ou modifiée en fonction des résultats des examens cliniques et des analyses biologiques.
Le schéma posologique est indiqué au tableau 2.
Tableau 2: Schéma posologique recommandé pour Pomalidomid Zentiva en association avec la dexaméthasone
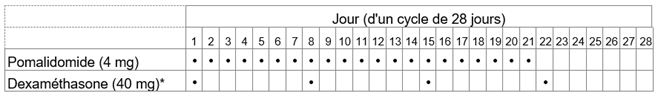
*Pour les patients âgés de >75 ans, voir rubrique «Instructions spéciales pour la posologie».
Ajustement de la posologie
Hématotoxicité
En cas de thrombocytopénie avec chute de la numération plaquettaire <25 x 109/l ou en cas de neutropénie avec chute des polynucléaires neutrophiles (PNN) <0,5 x 109/l ou en cas de neutropénie fébrile (fièvre ≥38,5°C et PNN <1,0 x 109/l), le traitement par pomalidomide doit être interrompu et suivi d'un contrôle hebdomadaire de la numération formule sanguine complète (et en cas de chute des polynucléaires neutrophiles, l'utilisation de facteurs de croissance (G-CSF) doit être envisagée à l'appréciation du médecin traitant). Après le retour à la normale de la numération des thrombocytes/du taux des polynucléaires neutrophiles, le traitement par le pomalidomide doit être repris à la dose de 3 mg par jour. Pour chaque chute ultérieure (<25 x 109/l et <0,5 × 109/l respectivement), le traitement par le pomalidomide doit être interrompu. Après le retour à la normale de la numération des thrombocytes/du taux des polynucléaires neutrophiles, le traitement par le pomalidomide doit être repris à une dose inférieure de 1 mg à la dose antérieure.
Pomalidomid Zentiva en association avec le bortézomib et la dexaméthasone (PVd): pour commencer un nouveau cycle de pomalidomide, le taux des polynucléaires neutrophiles doit être ≥ 1 × 109/l et la numération des plaquettes ≥50 × 109/l.
Pomalidomid Zentiva en association avec la dexaméthasone (Pd): pour commencer un nouveau cycle de pomalidomide, le taux des polynucléaires neutrophiles doit être ≥0.5 x 109/l et la numération des plaquettes ≥50 x 109/l.
Autres effets indésirables de grade 3/4
En cas d'autres effets indésirables de grade 3/4, jugés comme étant liés au pomalidomide, le traitement doit être interrompu et repris à une dose inférieure de 1 mg à la dose antérieure après résolution de l'effet indésirable à un grade ≤ 2, à l'appréciation du médecin. Si les effets indésirables réapparaissent après réduction de la dose à 1 mg, le médicament doit être arrêté.
Pour des précisions relatives aux ajustements posologiques en raison d'une toxicité au bortézomib, il convient de se référer à l'information destinée aux professionnels du médicament concerné.
Ajustement posologique en cas d'administration concomitante d'inhibiteurs du CYP1A2
Il convient d'éviter l'utilisation concomitante du pomalidomide avec des inhibiteurs puissants du CYP1A2. Envisager d'autres modes de traitement. En cas d'administration concomitante d'inhibiteurs puissants du CYP1A2 (p.ex. ciprofloxacine et fluvoxamine) avec le pomalidomide, la dose de pomalidomide doit être réduite de 50%.
Arrêt de pomalidomide
L'interruption ou l'arrêt du traitement par le pomalidomide doit être envisagé(e) en cas d'éruption cutanée de grade 2 ou 3.
Pomalidomide doit être arrêté en cas d'angioedème, d'anaphylaxie, d'éruption cutanée de grade 4, de dermatite exfoliative ou d'éruption bulleuse, ou de suspicion de syndrome de Stevens-Johnson (SJS), de syndrome de Lyell (TEN) ou d'une réaction médicamenteuse accompagnée d'une éosinophilie et de symptômes systémiques (DRESS). Après l'interruption en raison de ces réactions, le traitement ne doit pas être repris.
Instructions posologiques particulières
Patients présentant des troubles de la fonction hépatique
Chez les patients présentant une insuffisance hépatique légère à modérée (grade A ou B de la classification de Child-Pugh), la dose initiale recommandée est de 3 mg par jour (réduction de la dose de 25%). Chez les patients présentant une insuffisance hépatique sévère (grade C de la classification de Child-Pugh), la dose recommandée est de 2 mg (réduction de la dose de 50%).
Patients présentant des troubles de la fonction rénale
Aucun ajustement posologique du pomalidomide n'est nécessaire chez les patients présentant une insuffisance rénale modérée et chez ceux présentant une insuffisance rénale sévère ne nécessitant pas de dialyse. Chez les patients présentant une insuffisance rénale sévère et nécessitant des dialyses, la dose initiale recommandée est de 3 mg par jour (réduction de la dose de 25%). Les jours d'hémodialyse, le pomalidomide doit être pris après l'hémodialyse.
Patients âgés
Aucune adaptation de la dose de pomalidomide n'est nécessaire.
Pomalidomid Zentiva en association avec le bortézomib et la dexaméthasone (PVd) après au moins un traitement antérieur
Chez les patients âgés de >75 ans, la dose de dexaméthasone est de 10 mg une fois par jour aux jours 1, 2, 4, 5, 8, 9, 11 et 12 d'un cycle de 21 jours pour les cycles 1-8, et à partir du cycle 9, de 10 mg une fois par jour aux jours 1, 2, 8 et 9 d'un cycle de 21 jours.
Pomalidomid Zentiva en association avec la dexaméthasone (Pd) après au moins 2 traitements antérieurs
Chez les patients âgés de plus de 75 ans, la dose initiale de dexaméthasone est de 20 mg un fois par jour aux jours 1, 8, 15 et 22 de chaque cycle de 28 jours.
Enfants et adolescents
La sécurité et l’efficacité chez les enfants et adolescents ne sont pas démontrées.
Mode d'administration
Pomalidomid Zentiva doit être pris chaque jour par voie orale environ à la même heure. Les gélules ne doivent pas être ouvertes, cassées ou mâchées. Les gélules d'Pomalidomid Zentiva doivent être avalées entières, de préférence avec de l'eau, indépendamment des repas. Si le patient oublie de prendre une dose d'Pomalidomid Zentiva pendant une journée, il doit prendre la dose normale prescrite à l'heure habituelle le lendemain. La dose ne doit pas être ajustée pour compenser une dose d'Pomalidomid Zentiva omise le jour précédent.
Pour des précisions relatives à d'autres médicaments utilisés en association avec le pomalidomide, il convient de se référer à l'information destinée aux professionnels du médicament concerné.
| 

