Propriétés/EffetsCode ATC
Code ATC : S01LA04
Ranivisio est un biosimilaire.
Mécanisme d’action
Le principe actif de Ranivisio (le ranibizumab) est un fragment d'anticorps monoclonal recombinant humanisé (Fab), dirigé contre le facteur de croissance de l'endothélium vasculaire A (VEGF-A) humain. Le fragment se lie avec une grande affinité au VEGF-A et à ses isoformes. Les isoformes, telles que le VEGF121 et le VEGF165, sont formées par épissage alternatif de l'ARNm et l'isoforme VEGF110 est formée par protéolyse. La liaison du ranibizumab au VEGF-A et à ses isoformes bloque l'activation des récepteurs VEGFR-1 et VEGFR-2 à la surface des cellules endothéliales.
Pharmacodynamique
L'activation des récepteurs VEGFR-1 et VEGFR-2 entraîne une prolifération des cellules endothéliales, une néovascularisation ainsi qu'une hyperperméabilité vasculaire. On suppose que tous ces facteurs contribuent à la progression de la forme néovasculaire de la dégénérescence maculaire liée à l'âge (DMLA), au développement de la NVC, y compris de la NVC consécutive à une myopie pathologique (MP), des œdèmes maculaires diabétiques (OMD) et des occlusions de veines rétiniennes (OVR) induisant la perte de vision.
Efficacité clinique
Traitement de la DMLA humide
La sécurité et l'efficacité cliniques du ranibizumab dans le traitement de la DMLA humide ont été étudiées dans trois études randomisées et en double aveugle, menées au total auprès de 1323 patients (ranibizumab: N = 879, groupe témoin N = 444) avec DMLA néovasculaire. Les traitements simulés de l'étude MARINA et la PDT par Visudyne comme traitement actif de l'étude ANCHOR ont servi de bras de contrôle. Les patients inclus présentaient des lésions d'une taille allant jusqu'à 12 surfaces papillaires et une acuité visuelle dans l'œil étudié allant de 20/40 à 20/320 (selon Snellen). L'âge moyen des patients était de 77 ans. Dans le cadre des études cliniques, les patients ont reçu la consigne de s'appliquer eux-mêmes des gouttes antimicrobiennes dans les yeux (quatre fois par jour, 3 jours avant et après chaque injection).
L'étude MARINA de 24 mois a inclus 716 patients atteints de NVC classique minimale ou de NVC occulte. Ils ont reçu des injections intravitréennes mensuelles de 0,3 mg de ranibizumab (N = 238), de 0,5 mg de ranibizumab (N = 240) ou des injections simulées (N = 238). Durant les 24 mois de la phase de traitement, les patients ont reçu en moyenne 22 traitements sur les 24 possibles. Les résultats de l'étude MARINA observés après 12 mois de traitement ont été pour l'essentiel également confirmés après 24 mois de traitement (1 fois par mois) chez 90% des patients.
L'étude ANCHOR de 24 mois a inclus 423 patients atteints de NVC principalement classique. Ils ont reçu des injections intravitréennes mensuelles de 0,3 mg de ranibizumab et une PDT simulée (N = 143), de 0,5 mg de ranibizumab et une PDT simulée (N = 140) ou des injections intravitréennes simulées et une PDT active par la vertéporfine (N = 143). La première PDT simulée ou active par la vertéporfine a été administrée avec l'injection initiale de ranibizumab. Ensuite, le rythme du traitement était tous les 3 mois lorsque l'œil étudié montrait une poursuite ou une reprise de l'hyperperméabilité vasculaire (angiographie fluorescéinique).
Les résultats sont résumés dans les tableaux suivants:
Tableau 0-1 Étude MARINA: résultats après 12 et 24 mois
|
Variation de l'acuité visuelle (en lettres, ETDRS)
|
Mois
|
Traitement simulé
(n=238)
|
Ranibizumab 0.5 mg
(n=240)
|
Différence
(IC 95%)a
| |
Perte de l'acuité visuelle <15 lettres (%)b
|
12 mois
|
62%
|
95%
|
32%
(26%, 39%)
| |
24 mois
|
53%
|
90%
|
37%
(29%, 44%)
| |
Gain de l'acuité visuelle ≥15 lettres (%)b
|
12 mois
|
5%
|
34%
|
29%
(22%, 35%)
| |
24 mois
|
4%
|
33%
|
29%
(23%, 35%)
| |
Variation moyenne de l'acuité visuelleb
(lettres)
|
12 mois
|
-10.5 (16,6)
|
+7.2 (14,4)
|
17.5
(14,8, 20,2)
| |
24 mois
|
-14.9 (18,7)
|
+6.6 (16,5)
|
21.1
(18,1, 24,2)
| |
a
après stratification
b p <0,01
|
Tableau 0-2 Étude ANCHOR: résultats après 12 et 24 mois
|
Variation de l'acuité visuelle
|
|
PDT par Vertéporfine
(n=143)
|
Ranibizumab 0.5 mg
(n=140)
|
Différence
(IC 95%) a
| |
Perte de l'acuité visuelle <15 lettres (%)b
|
12 mois
|
64%
|
96%
|
33%
(25%, 41%)
| |
24 mois
|
66%
|
90%
|
25%
(16%, 34%)
| |
Gain de l'acuité visuelle ≥15 lettres (%)b
|
12 mois
|
6%
|
40%
|
35%
(26%, 44%)
| |
24 mois
|
6%
|
41%
|
35%
(26%, 44%)
| |
Variation moyenne de l'acuité visuelleb(lettres)
|
12 mois
|
-9,5 (16,4)
|
+11,3 (14,6)
|
21,1
(17,5, 24,6)
| |
24 mois
|
-9,8 (16,4)
|
+10,7 (16,5)
|
20.7
(16,8, 24,7)
| |
a
après stratification
b p <0,01
|
Dans les deux études MARINA et ANCHOR, l'amélioration de l'acuité visuelle observée avec ranibizumab 0,5 mg à 12 mois s'est traduite par un bénéfice pour le patient. Ce bénéfice a été mesuré à l'aide des trois sous-échelles du National Eye Institute Visual Function Questionnaire (VFQ-25) qui étaient les critères secondaires pré-spécifiés pour l'évaluation de l'efficacité (activités liées à la vision de près, activités liées à la vision de loin et activités indépendantes de la vision). Toutes les différences entre ranibizumab 0,5 mg et les deux groupes témoins ont été statistiquement significatives et cliniquement pertinentes, avec des valeurs de p comprises entre 0,009 et < 0,0001.
L'étude PIER a inclus 184 patients présentant des lésions NVC (avec ou sans composante classique). Ils ont reçu pendant les 3 premiers mois une injection intravitréenne par mois de ranibizumab à 0,3 mg ou de ranibizumab à 0,5 mg ou une injection intravitréenne simulée. D'autres injections de ranibizumab ont eu lieu à intervalles de 3 mois. Après le mois 14, les patients qui avaient reçu une injection simulée pouvaient également être traités par ranibizumab et à partir du mois 19, la fréquence des injections de ranibizumab pouvait être augmentée. Les patients traités par ranibizumab dans PIER ont reçu en moyenne 10 traitements en 24 mois.
Le critère d'évaluation principal de l'efficacité était la variation moyenne de l'acuité visuelle pendant les 12 mois. Après une augmentation initiale de l'acuité visuelle durant l'administration des doses mensuelles, les patients traités par une dose de ranibizumab tous les 3 mois ont perdu de l'acuité visuelle, celle-ci revenant à la valeur initiale au mois 12 et cet effet a été conservé à 24 mois chez la plupart des patients traités par ranibizumab (82%). Les données recueillies chez un nombre limité de patients étant passés à ranibizumab après avoir reçu des injections simulées pendant plus d'un an, indiquent qu'un début précoce du traitement est associé à une meilleure conservation de l'acuité visuelle.
Tableau 0-3 Étude PIER: résultats après 12 mois
|
Variation de l'acuité visuelle
|
Traitement simulé (n=63)
|
Ranibizumab 0.5 mg
(n=61)
|
Différence
(IC 95%)a
| |
Perte de l'acuité visuelle <15 lettres (%)b
|
49
|
90
|
37
(23, 52)
| |
Gain de l'acuité visuelle ≥15 lettres (%)b
|
10
|
13
|
2
(-8, 12)
| |
Variation moyenne de l'acuité visuelleb
|
-16,3 (22,3)
|
-0,2 (13,1)
|
14,7
(8,2, 21,2)
| |
a
après stratification
b p <0,0001
|
L'étude SAILOR de phase IIIb, multicentrique d'une durée de 1 an, a été réalisée chez des patients atteints de NVC due à une DMLA, aussi bien naïfs de traitement que prétraités. L'objectif primaire de cette étude était d'évaluer l'incidence des effets indésirables oculaires et non oculaires pendant les 12 mois de traitement. 2378 patients ont été randomisés dans 2 groupes qui ont reçu respectivement 0,3 mg ou 0,5 mg de ranibizumab chaque mois pendant 3 mois; le traitement a ensuite été poursuivi en fonction des résultats, à intervalles d'au moins 1 mois.
Au total, il n'y a pas eu de déséquilibre entre les deux groupes quant aux effets indésirables oculaires et non oculaires. Il n'y a pas eu non plus de déséquilibre entre les deux groupes quant au nombre d'AVC. Sous 0,3 mg, 8 patients sur 1169 (0,7%, IC 95%: de 0,3% à 1,3%) en ont été atteints et sous 0,5 mg, 15 patients sur 1209 (1,2%, IC 95%: de 0,7% à 2%). Les patients ayant des facteurs de risque connus, tels qu'antécédents d'AVC ou d'accident ischémique transitoire, présentent vraisemblablement un risque accru d'AVC pendant le traitement par ranibizumab.
Traitement de la perte de vision due à un OMD
L'efficacité et la sécurité cliniques de ranibizumab chez les patients avec perte de vision due à un œdème maculaire diabétique (OMD) ont été étudiées dans le cadre de l'étude RESTORE, qui a inclus 345 patients présentant une perte de vision due à un OMD. L'étude comportait trois groupes: dans le groupe 1, les patients (N = 116) ont reçu initialement une injection intravitréenne de ranibizumab 0,5 mg en monothérapie et une photocoagulation au laser simulée. Les sujets du groupe 2 (N = 118) ont reçu initialement du ranibizumab 0,5 mg par injection intravitréenne et une photocoagulation au laser. Les patients du groupe 3 (N = 111) ont bénéficié initialement d'une photocoagulation au laser avec une injection simulée.
Le traitement par le ranibizumab a ensuite été poursuivi sous forme d'injections intravitréennes mensuelles et interrompu en cas de vision stable sous ranibizumab au cours de trois contrôles consécutifs. Après une interruption, le traitement a été repris en cas de détérioration de la vision du patient consécutive à la progression de l'OMD. Les répétitions des photocoagulations au laser ont été effectuées le même jour, au moins 30 minutes avant l'injection de ranibizumab, selon les critères de l'ETDRS.
Les résultats sont résumés dans les tableaux suivants:
Tableau 0-4 Étude RESTORE: résultats à 12 mois
|
Variation de la meilleure vision corrigée
|
Ranibizumab
0,5 mg
(n=115)
|
Ranibizumab
0,5 mg + laser
(n=118)
|
Laser
(n=110)
| |
Variation moyenne de la meilleure acuité visuelle corrigée entre le 1er et le 12e mois en nombre de lettres, versus vision au début de l'étude (déviation standard)a
|
6,1 (6,4)
|
5,9 (7,9)
|
0,8 (8,6)
| |
Variation moyenne de la meilleure acuité visuelle corrigée au 12e mois en nombre de lettres, versus vision au début de l'étude (déviation standard)
|
6,8 (8,3)a
|
6,4 (11,8)b
|
0,9 (11,4)
| |
Augmentation de la meilleure vision corrigée ≥10 lettres (% des patients)
|
37,4c
|
43,2
|
15,5
| |
Augmentation de la meilleure vision corrigée ≥15 lettres (% des patients)
|
22,6d
|
22,9e
|
8,2
| |
a
p <0,0001, b p=0,0004, c p=0,0001, d p=0,0032, e p=0,0021
|
240 patients, qui avaient précédemment terminé l'étude RESTORE à 12 mois, ont été inclus dans l'étude d'extension de 24 mois multicentrique en ouvert (RESTORE Extension). Ils ont été traités par le ranibizumab 0,5 mg pro re nata (PRN) dans le même œil que celui sélectionné comme œil d'étude dans l'étude centrale. Le traitement était réinstauré mensuellement après diminution de la MAVC due à l'OMD et poursuivi jusqu'à ce qu'une stabilisation de la MAVC soit atteinte. De plus, un traitement par laser était réalisé conformément aux critères ETDRS, si l'investigateur le jugeait nécessaire.
Le nombre moyen d'injections administrées chez les patients traités par le ranibizumab dans l'étude centrale a été de 6,4 pendant la période d'extension de 24 mois. Parmi les 74 patients du bras traité par laser de l'étude centrale, 59 (79%) ont reçu le ranibizumab à un moment donné dans la phase d'extension. En moyenne, ces 59 patients ont reçu 8,1 injections de ranibizumab pendant la période d'extension de 24 mois. La proportion de patients qui n'a pas eu besoin d'un traitement par le ranibizumab durant la phase d'extension a été respectivement de 19%, 25% et 20% pour le groupe préalablement traité par le ranibizumab, le groupe préalablement traité par le ranibizumab + laser, et le groupe préalablement traité par laser seul.
Les résultats sont résumés dans le tableau suivant:
Tableau 0-5 Étude d'extension RESTORE: résultats à 36 mois
|
Paramètre d'évaluation par rapport aux valeurs initiales dans l'étude centrale
|
Au préalable ranibizumab
n = 83
|
Au préalable ranibizumab
0.5 mg + laser
n = 83
|
Au préalable laser
n = 74*
| |
Variation moyenne de la MAVC par rapport aux valeurs initiales dans l'étude centrale au mois 36 (ET)
|
8,0 (10,09)
|
6,7 (9,59)
|
6,0 (9,35)
| |
Gain ≥10 lettres par rapport aux valeurs initiales dans l'étude centrale ou MAVC ≥84 (%) au mois 36
|
39 (47,0)
|
37 (44,6)
|
31 (41,9)
| |
Gain ≥15 lettres par rapport aux valeurs initiales dans l'étude centrale ou MAVC ≥84 (%) au mois 36
|
23 (27,7)
|
25 (30,1)
|
16 (21,6)
| |
n = nombre de patients pour lesquels les valeurs étaient disponibles, non seulement au début de l'étude (étude centrale, mois 0) mais aussi à la visite du mois 36.
* 59 (79%) des 74 patients avec traitement préalable par laser ont reçu du ranibizumab pendant la phase d'extension.
|
Le profil de sécurité à long terme du ranibizumab observé dans l'étude d'extension de 24 mois est en accord avec le profil de sécurité connu de ranibizumab.
Dans l'étude de phase IIIb (RETAIN), 372 patients présentant une baisse visuelle due à un OMD ont été randomisés pour recevoir des injections intravitréennes:
·de ranibizumab 0,5 mg avec une photocoagulation au laser concomitante selon un protocole «treat-and-extend» (TE) (n = 121),
·de ranibizumab 0,5 mg en monothérapie selon un protocole TE (n = 128) ou
·de ranibizumab 0,5 mg en monothérapie selon un protocole PRN (n = 123).
·Dans tous les groupes, le traitement par le ranibizumab a été initié par des injections intravitréennes mensuelles et poursuivi jusqu'à ce que la MAVC soit stable lors d'au moins trois évaluations mensuelles consécutives. La photocoagulation au laser a été réalisée au début de l'étude, le même jour que la première injection de ranibizumab, puis selon les besoins conformément aux critères ETDRS. Dans le protocole TE, le ranibizumab était ensuite administré à des intervalles prévus de 2 ou maximum 3 mois. Dans le protocole PRN, la MAVC était évaluée mensuellement et le ranibizumab était alors administré au cours de la même visite, si besoin. Dans tous les groupes, le traitement mensuel était réinstauré après une diminution de la MAVC due à la progression de l'OMD et poursuivi jusqu'à ce qu'une stabilisation de la MAVC soit de nouveau atteinte. La durée de l'étude a été de 24 mois.
·Dans l'étude RETAIN, le nombre moyen (médian) d'injections était de 12,4 (12,0) dans le groupe ranibizumab TE + laser, de 12,8 (12,0) dans le groupe ranibizumab TE seul, et de 10,7 (10,0) dans le groupe ranibizumab PRN. Après les trois premières visites mensuelles de traitement, le nombre de visites de traitement nécessaires dans le protocole TE a été de 13 vs 20 requises dans le protocole PRN. Dans les deux schémas de traitement, plus de 70% des patients ont conservé leur MAVC à une fréquence de visite ≥2 mois. L'association du laser n'a pas diminué le nombre moyen d'injections de ranibizumab dans le protocole TE.
Les résultats sont résumés dans le tableau suivant:
Tableau 0-6 Résultats de l'étude RETAIN
|
Résultat exprimé par rapport aux valeurs initiales
|
Ranibizumab TE
0,5 mg + Laser
n = 117
|
Ranibizumab TE
0,5 mg seul
n = 125
|
Ranibizumab PRN
0,5 mg
n = 117
| |
Variation moyenne de la MAVC du mois 1 au mois 12 (ET)
|
5,9 (5,5)b
|
6,1 (5,7)b
|
6,2 (6,0)
| |
Variation moyenne de la MAVC du mois 1 au mois 24 (ET)
|
6,8 (6,0)
|
6,6 (7,1)
|
7,0 (6,4)
| |
Variation de la MAVC au mois 24 (ET)
|
8,3 (8,1)
|
6,5 (10,9)
|
8,1 (8,5)
| |
Gain ≥10 lettres ou MAVC ≥84 (%) au mois 24
|
43,6
|
40,8
|
45,3
| |
Gain ≥15 lettres ou MAVC ≥84 (%) au mois 24
|
25,6
|
28,0
|
30,8
| |
Perte ≥10 lettres au mois 24
|
2,6
|
7,2
|
3,4
| |
Perte ≥15 lettres au mois 24
|
0,9
|
4,0
|
2,6
| |
b
p <0,0001
|
Dans les études dans l'OMD, l'amélioration de la MAVC était accompagnée d'une réduction de la valeur moyenne de l'ECR au cours du temps dans tous les groupes de traitement.
Traitement de la rétinopathie diabétique non proliférante (RDNP) moyennement sévère à sévère ou de la rétinopathie diabétique proliférante (RDP)
La sécurité et l'efficacité cliniques de ranibizumab chez les patients atteints de rétinopathie diabétique proliférante (RDP) ont été évaluées dans une étude de non-infériorité de phase III à groupes parallèles (protocole S), multicentrique, randomisée, contrôlée par traitement actif à laquelle 305 patients (394 yeux étudiés) atteints de RDP avec ou sans OMD (œdème maculaire diabétique) au début de l'étude ont participé et dans laquelle l'injection intravitréenne de 0,5 mg de ranibizumab a été comparée au traitement standard avec photocoagulation panrétinienne (PPR). Au total, 191 yeux (48,5%) ont été randomisés et traités par 0,5 mg de ranibizumab et 203 yeux (51,5%) ont été randomisés et traités par PPR. Au total, 88 yeux (22,3%) présentaient un OMD en situation initiale: 42 (22,0%) et 46 (22,7%) des yeux dans le groupe avec le ranibizumab et la PPR respectivement. Au total, 306 yeux (77,7%) ne présentaient pas d'OMD en situation initiale: 149 (78,0%) et 157 (77,3%) des yeux dans le groupe avec le ranibizumab et la PPR respectivement.
Après 2 ans de traitement, le score de MAVC a été modifié de +2,7 lettres depuis la situation initiale dans le groupe de ranibizumab et de -0,7 lettre depuis la situation initiale dans le groupe de PPR. La différence de 3,5 lettres était comprise dans la marge de non-infériorité, de telle sorte que la non-infériorité de ranibizumab par rapport à la PPR a été confirmée.
La variation de la sévérité de la rétinopathie diabétique a été évaluée au moyen de photos du fond de l'œil par l'utilisation du score de sévérité pour la rétinopathie diabétique (DRSS) de l'étude sur le traitement précoce de la rétinopathie (ETDRS). Dans cette étude, une amélioration du DRSS d'au moins 2 degrés avait eu lieu chez 41,8% des yeux sous traitement par le ranibizumab (n = 189) à 12 mois, comparé à 14,6% chez les yeux traités à la PPR (n = 199).
Dans une méta-analyse de 3 études de phase III randomisées, en double aveugle et contrôlées par traitement actif [D2301 (RESTORE), D2303 (REVEAL) et D2305 (REFINE)], réalisées chez 875 patients atteints d'OMD en tout, 48,4% des 315 patients atteints de RDNP moyenne à sévère ou de RDP (n = 192) traités par le ranibizumab ont montré une amélioration du DRSS d'au moins 2 degrés au 12e mois, comparé à 14,6% des patients traités au laser (n = 123).
Traitement de la perte de vision par œdème maculaire consécutif à une OVR
La sécurité et l'efficacité cliniques de ranibizumab chez les patients avec perte de vision due à un œdème maculaire consécutif à l'occlusion d'une veine rétinienne (OVR) ont été étudiées au cours de deux études BRAVO (N = 397) et CRUISE (N = 392), randomisées, contrôlées, en double aveugle. Dans les deux études, les patients ont reçu soit 0,3 mg de ranibizumab, soit 0,5 mg de ranibizumab, soit un traitement simulé. Dans BRAVO, une photocoagulation au laser était autorisée à tout moment de l'étude à partir du 3e mois dans tous les groupes, en guise de traitement de secours. Les résultats de BRAVO et CRUISE sont résumés dans les tableaux suivants.
Tableau 0-7 Étude BRAVO: résultats à 6 mois et à 12 mois
|
Variation de l'acuité visuelle
|
Traitement simulé
(n=132)
|
Ranibizumab 0,5 mg
(n=131)
| |
Variation moyenne de la meilleure
acuité visuelle corrigée à 6 mois en nombre de lettres versus acuité visuelle au début de l'étudea
|
+7,3
|
+18,3
| |
Variation moyenne de la meilleure acuité visuelle corrigée au 12e mois en nombre de lettres versus acuité visuelle au début de l'étude
|
+12,1
|
+18,3
| |
Proportion de patients avec un gain de l'acuité visuelle ≥15 lettres (%) au 6e mois
|
28,8%
|
61,1%
| |
Proportion de patients avec un gain de l'acuité visuelle ≥15 lettres (%) au 12e mois
|
43,9%
|
60,3%
| |
Proportion de patients ayant reçu un laser de secours pendant 12 mois
|
61,4%
|
34,4%
| |
a
p<0,0001
|
Tableau 0-8 Étude CRUISE: résultats à 6 mois et à 12 mois
|
Variation de l'acuité visuelle
|
Traitement simulé
(n=132)
|
Ranibizumab 0,5 mg
(n=131)
| |
Variation moyenne de la meilleure acuité visuelle corrigée au mois 6, en nombre de lettres, versus début de l'étudea
|
+0,8
|
+14,9
| |
Variation moyenne de la meilleure acuité visuelle corrigée au 12e mois, en nombre de lettres, versus début de l'étudea
|
+7,3
|
+13,9
| |
Proportion de patients avec un gain de l'acuité visuelle ≥15 lettres (%) au 6e mois
|
16,9%
|
47,7%
| |
Proportion de patients avec un gain de l'acuité visuelle ≥15 lettres (%) au 12e mois
|
33,1%
|
50,8%
| |
a
p<0,0001
|
Les patients traités par ranibizumab ont présenté dans les deux études (BRAVO et CRUISE) une diminution constante de l'épaisseur centrale de la rétine.
Hormis l'amélioration de l'acuité visuelle sous ranibizumab aux mois 6 et 12, l'étude comportait également un volet d'évaluation de la qualité de vie à ces deux échéances, au moyen du National Eye Institute Visual Function Questionnaire (VFQ-25). Les différences entre le groupe ranibizumab 0,5 mg et le groupe témoin ont donné des valeurs de p à 6 mois situées entre 0,02 et 0,0002.
Les résultats de l'étude d'extension HORIZON de BRAVO et CRUISE ont montré les éléments suivants après 12 mois:
La réduction de la fréquence des traitements dans l'étude HORIZON a eu peu de répercussions sur les patients OBVR qui ont conservé l'amélioration initiale de leur acuité visuelle telle qu'observée dans l'étude BRAVO (+17,5 lettres après 24 mois avec une dose de 0,5 mg et en moyenne 2,4 injections au cours de la deuxième année).
En revanche, la réduction de la fréquence des traitements chez les patients OVCR s'est traduite par une diminution de l'acuité visuelle acquise dans l'étude CRUISE (+12 lettres après 24 mois avec une dose de 0,5 mg et en moyenne 3,8 injections au cours de la deuxième année).
Études E2401 (CRYSTAL) et E2402 (BRIGHTER)
Les études BRIGHTER et CRYSTAL ont évalué la sécurité et l'efficacité cliniques de ranibizumab sur 24 mois chez les patients atteints de troubles de la vision dus à un œdème maculaire consécutif à une OVR. Les études ont inclus des patients atteints d'OBVR (n = 455) et d'OVCR (n = 357). Dans les deux études, les patients ont reçu 0,5 mg de ranibizumab à la demande. BRIGHTER était une étude randomisée à 3 groupes, contrôlée par principe actif, dans laquelle le ranibizumab à 0,5 mg en monothérapie était comparé au ranibizumab en association avec la photocoagulation laser et à la photocoagulation laser seule. Après 6 mois, les participants du groupe laser en monothérapie ont pu recevoir 0,5 mg de ranibizumab. CRYSTAL était une étude à un groupe sur le ranibizumab à 0,5 mg en monothérapie.
Les principaux résultats fonctionnels et anatomiques des études BRIGHTER et CRYSTAL sont résumés dans le tableau 0-9 et dans les figures 1-0 et 2-0.
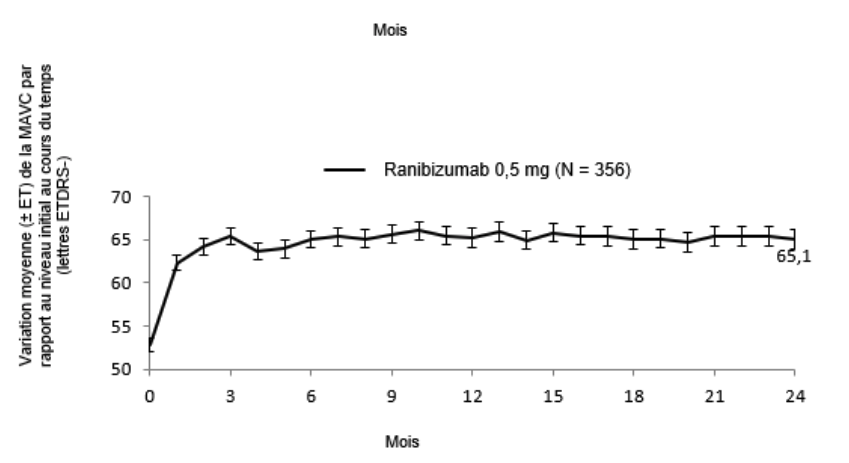
Tableau 0-9 Résultats à 6 mois (BRIGHTER) et à 24 mois (BRIGHTER et CRYSTAL)
|
|
BRIGHTER
|
CRYSTAL
| |
|
Ranibizumab 0,5 mg
n = 180
|
Ranibizumab 0,5 mg
+ Laser
n = 178
|
Laser*
n = 90
|
Ranibizumab 0,5 mg
(n = 356)
| |
Variation moyenne de la MAVC à 6 moisb (lettres) (ET)
|
+14,8
(10,7)
|
+14,8
(11,13)
|
+6,0
(14,27)
|
+12,0
(13,95)
| |
Variation moyenne de la MAVC à 24 moisb (lettres) (ET)
|
+15,5
(13,91)
|
+17,3
(12,61)
|
+11,6
(16,09)
|
+12,1
(18,60)
| |
Proportion de patients qui ont atteint une MAVC ≥15 lettres à 24 mois
|
52,8%
|
59,6%
|
43,3%
|
49,2%
| |
Nombre moyen d'injections (ET) (mois 0–23)
|
11,4
(5,81)
|
11,3
(6,02)
|
N/A
|
13,1
(6,39)
| |
*
À partir du 6e mois, un traitement avec ranibizumab 0,5 mg était autorisé (24 patients n'ont été traités que par laser).
b p <0,0001 pour les deux comparaisons dans l'étude BRIGHTER à 6 mois: ranibizumab 0,5 mg comparé à laser et ranibizumab 0,5 mg + laser comparé à laser.
|
Figure 1-0 BRIGHTER: variation moyenne de la MAVC par rapport au niveau initial sur une période de 24 mois
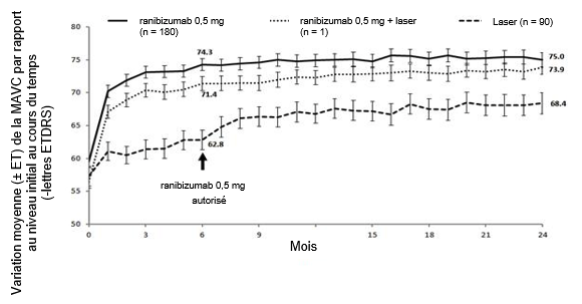
Figure 2-0 CRYSTAL: variation moyenne de la MAVC par rapport au niveau initial sur une période de 24 mois
L'amélioration de la vision s'est révélée similaire chez les patients avec et sans ischémie rétinienne: dans l'étude BRIGHTER, les patients avec ischémie rétinienne (n = 87) ou sans ischémie rétinienne (n = 35) traités par le ranibizumab en monothérapie présentaient, à 24 mois, une variation moyenne par rapport au niveau initial de respectivement +15,4 et +12,9 lettres. Dans l'étude CRYSTAL, les patients avec ischémie rétinienne (n = 107) ou sans ischémie rétinienne (n = 109) présentaient une variation moyenne par rapport au niveau initial de respectivement +11,1 et +12,9 lettres.
Chez les patients malades depuis < 3 mois, une amélioration de l'acuité visuelle de respectivement 13,3 et 10,0 lettres a été observée à 1 mois pour les études BRIGHTER et CRYSTAL, et de respectivement 17,7 et 13,2 lettres à 24 mois. Pour une maladie présente depuis ≥12 mois, elle était respectivement de 4,8 et 7,9 lettres à 1 mois, et de respectivement 8,4 et 8,6 lettres à 24 mois. Une initiation du traitement lors du diagnostic est à envisager.
Le profil de sécurité du ranibizumab, observé dans ces études sur 24 mois, correspond au profil de sécurité de ranibizumab observé dans les études précédentes.
Traitement d'une perte de vision due à une NVC–Étude G2301 (MINERVA)
La sécurité et l'efficacité cliniques de ranibizumab chez des patients ayant une perte de vision due à une NVC consécutive à des étiologies autres qu'une DMLA néovasculaire et une MP ont été évaluées sur la base des données à 12 mois de l'étude G2301 (MINERVA) randomisée, en double aveugle, contrôlée contre une injection simulée. Pour l'analyse, cinq sous-groupes ont été prédéfinis selon l'étiologie (stries angioïdes, choriorétinopathie post-inflammatoire, choriorétinopathie centrale séreuse, choriorétinopathie idiopathique et autres étiologies). 178 patients ont été randomisés selon un ratio 2:1 dans l'un des bras suivants:
Ranibizumab 0,5 mg au début de l'étude, puis schéma posologique individuel selon l'activité de la maladie.
Injection simulée au début de l'étude, puis schéma posologique individuel selon l'activité de la maladie.
À partir du mois 2, tous les patients ont reçu un traitement par le ranibizumab à la demande. Le critère d'évaluation principal était la variation de la meilleure acuité visuelle corrigée (MAVC) entre le début de l'étude et le mois 2.
Les principaux résultats de MINERVA sont résumés dans les tableaux 0-10 et 0-11 et dans la figure 3-0.
Tableau 0-10 Résultats au mois 2 (MINERVA)
|
|
Ranibizumab 0.5 mg
(n = 119)
|
Injections simulées
(n = 59)
| |
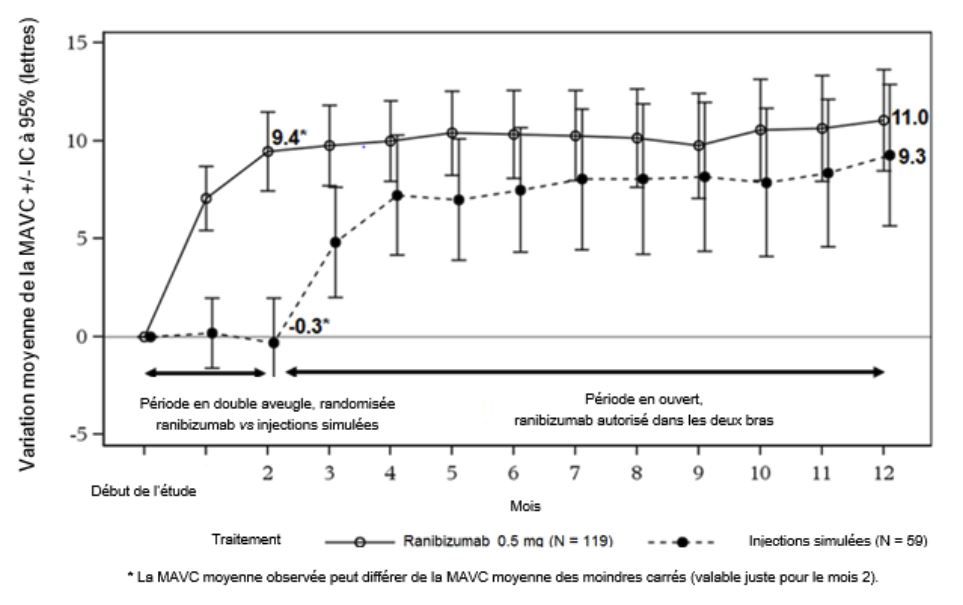
Variation moyenne de la MAVC entre le début de l'étude et le mois 2 (lettres) (moyenne des moindres carrés)a
|
+9,5
|
-0,4
| |
Proportion de patients ayant gagné ≥15 lettres depuis le début de l'étude ou ayant atteint 84 lettres au mois 2
|
31,4%
|
12,3%
| |
Proportion de patients n'ayant pas perdu plus de 15 lettres entre le début de l'étude et le mois 2
|
99,2%
|
94,7%
| |
Diminution de l'épaisseur fovéolaire centrale entre le début de l'étude et le mois 2 (moyenne des moindres carrés)a
|
77 µm
|
-9,8 µm
| |
a
Test unilatéral (p <0,001) avec comparaison avec les injections simulées
|
Figure 3-0: Variation moyenne de la MAVC entre le début de l'étude et le mois 12 au cours du temps (MINERVA)
Lors de la comparaison du ranibizumab avec les injections simulées au mois 2, un effet cohérent a été observé, que ce soit dans la population globale de l'étude ou dans les différents sous-groupes définis selon l'étiologie.
Tableau 0-11 Efficacité du traitement pour la population globale et dans les sous-groupes définis selon l'étiologie au début de l'étude, pour la variable principale au mois 2 (MINERVA)
|
Population globale et sous-groupes stratifiés en fonction de l'étiologie au début de l'étude
|
Efficacité du traitement par rapport aux injections simulées (lettres)
|
Nombre de patients (n) (traitement + injections simulées)
| |
Population globale
|
9,9
|
175*
| |
Stries angioïdes
|
14,6
|
27
| |
Choriorétinopathie post-inflammatoire
|
6,5
|
27
| |
Choriorétinopathie séreuse centrale
|
5,0
|
23
| |
Choriorétinopathie idiopathique
|
11,4
|
62
| |
Autres étiologiesa
|
10,6
|
36
| |
a
Étiologies NVC non comprises dans les autres sous-groupes
* Nombre de patients pour lesquels des données sont disponibles pour l'analyse
|
L'amélioration de la vision s'est accompagnée d'une diminution de l'épaisseur fovéolaire centrale sur une période de 12 mois.
Le nombre moyen d'injections de ranibizumab sur une période de 12 mois dans l'œil étudié a été de 5,8 dans le bras ranibizumab et de 5,4 dans le groupe ayant reçu les injections simulées.
Enfants et adolescents
Cinq patients adolescents âgés de 12 à 17 ans ayant une perte de vision due à une NVC (1x NVC subfovéale lors de drusen papillaires; 1x NVC juxtafovéale et 1x NVC subfovéale lors d'une NVC idiopathique; 2x NVC subfovéale lors d'une maladie de Best) ont reçu un traitement initial par ranibizumab 0,5 mg, puis un schéma thérapeutique individualisé en fonction des signes d'activité de la maladie (p.ex. baisse de l'acuité visuelle, liquide intra/sous-rétinien, hémorragies ou fuites). La variation de la MAVC entre le début de l'étude et le mois 12 s'est améliorée chez les cinq patients et a atteint de + 5 à + 38 lettres. L'amélioration de la vision s'est accompagnée d'une stabilisation ou d'une diminution de l'épaisseur fovéolaire centrale pendant une période de 12 mois (ΔCSFT0-12 mois: de -286 μm à +10 μm). 2 à 5 injections ont été administrées dans l'œil étudié pendant les 12 mois (voir «Posologie/Mode d'emploi»).
Traitement d'une perte de vision due à une NVC consécutive à une MP
La sécurité et l'efficacité cliniques de ranibizumab chez les patients présentant une perte de vision due à une NVC consécutive à une MP ont été évaluées à partir des données portant sur une période de 12 mois provenant de l'étude pivot randomisée, contrôlée, et conduite en double aveugle RADIANCE. Cette étude a été conçue pour évaluer deux schémas posologiques de 0,5 mg de ranibizumab par injection intravitréenne en comparaison à une PDT à la vertéporfine (vPDT, thérapie photodynamique avec Visudyne).
Les 277 patients ont été randomisés dans l'un des bras d'étude suivants:
Groupe I (0,5 mg de ranibizumab, le schéma posologique s'est basé sur des critères de stabilité définis comme une absence de variation de la meilleure acuité visuelle corrigée (MAVC) par rapport à deux examens mensuels précédents);
Groupe II (0,5 mg de ranibizumab, le schéma posologique s'est basé sur des critères d'activité de la maladie définis comme une perte de vision en raison de la présence de liquide intra- ou sous-rétinien ou d'un écoulement actif de liquide suite à la lésion de NVC, avec mise en évidence par une TCO et/ou par une AF);
Groupe III (vPDT; les patients ont pu être traités par le ranibizumab dès le 3e mois).
Au cours des 12 mois de l’étude, les patients du groupe I ont reçu 4,6 injections en moyenne (entre 1 et 11 injections) et ceux du groupe II ont reçu 3,5 injections en moyenne (entre 1 et 12 injections). Dans le groupe II (dans lequel les patients ont reçu le traitement recommandé sur la base de critères déterminés par l’activité de la maladie, voir «Posologie/Mode d’emploi»), 50,9% des patients ont eu besoin d’une ou deux injections, 34,5% des patients de trois à cinq injections et 14,7% des patients de 6 à 12 injections au cours de la période d’étude de 12 mois. 62,9% des patients du groupe II n’ont pas eu besoin d’injections supplémentaires au cours des six derniers mois de l’étude.
Les résultats thérapeutiques les plus importants de l'étude RADIANCE sont résumés dans le tableau 0-12 et dans la figure 0-4.
Tableau 0-12 Résultat du traitement au 3e mois et au 12e mois (RADIANCE)
|
|
Groupe I
0,5 mg de ranibizumab
Stabilité de l'acuité visuelle
(n=105)
|
Groupe II
0,5 mg de ranibizumab
Activité de la maladie
(n=116)
|
Groupe III
vPDT*
(n=55)
| |
3e mois
| |
Variation moyenne de la MAVC entre le 1er et le 3e mois par rapport à la situation initialea (lettres)
|
+10,5
|
+10,6
|
+2,2
| |
Proportion des patients présentant une amélioration de la MAVC:
|
|
|
| |
de ≥10 lettres ou une MAVC globale ≥84 lettres
|
61,9%
|
65,5%
|
27,3%
| |
de ≥15 lettres ou une MAVC globale ≥84 lettres
|
38,1%
|
43,1%
|
14,5%
| |
12e mois
| |
Nombre d'injections jusqu'au 12emois:
|
|
|
| |
Moyenne
|
4,6
|
3,5
|
N/A
| |
Médiane
|
4,0
|
2,0
|
N/A
| |
Variation moyenne de la MAVC entre le 1er et le 12e mois par rapport à la situation initiale (lettres)
|
+12.8
|
12.5
|
N/A
| |
Proportion des patients présentant une amélioration de la MAVC:
|
|
|
| |
de ≥10 lettres ou une MAVC globale ≥84 lettres
|
69,5%
|
69,0%
|
N/A
| |
de ≥15 lettres ou une MAVC globale ≥84 lettres
|
53,3%
|
51,7
|
N/A
| |
* Contrôle comparatif jusqu'au 3e mois. Les patients randomisés dans le groupe vPDT ont pu recevoir un traitement par le ranibizumab dès le 3e mois (dans le groupe III, 38 patients ont reçu du ranibizumab dès le 3e mois): p< 0,00001 pour la comparaison au groupe témoin vPDT
|
Figure 0-4 Variation moyenne de la MAVC par rapport à la MAVC initiale au cours du temps jusqu'au 12e mois (RADIANCE)
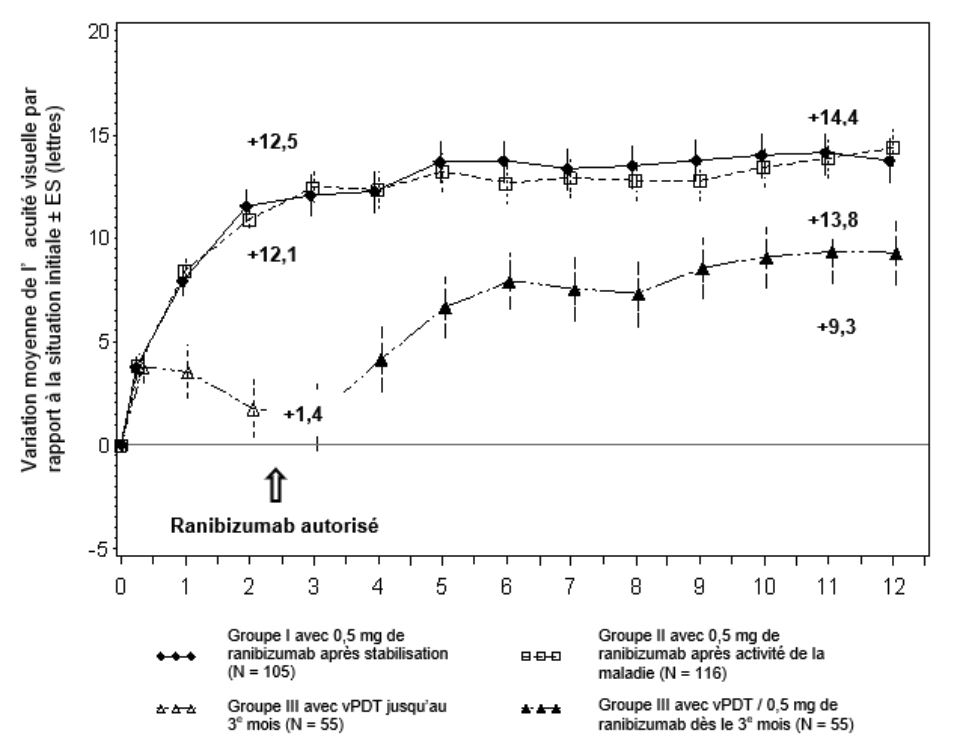
BL = niveau initial; ES = erreur standard de la moyenne.
Figure:
Amélioration moyenne de l'acuité visuelle par rapport au BL ± ES (lettres)
Groupe I avec 0,5 mg de ranibizumab selon stabilisation (N = 105)
Groupe II avec 0,5 mg de ranibizumab selon activité de la maladie (N = 116)
Groupe III avec PDT par Visudyne (N = 55)
Les patients qui ont été randomisés dans le groupe vPDT ont pu recevoir un traitement par le ranibizumab à partir du 3e mois.
L'amélioration de l'acuité visuelle a été accompagnée d'une diminution de l'épaisseur centrale de la rétine.
Dans les bras de traitement par le ranibizumab, un bénéfice subjectivement rapporté par les patients dans le questionnaire VFQ-25 a été constaté par rapport au groupe vPDT (p < 0,05) en ce qui concerne l'amélioration du résultat combiné ainsi que du résultat dans plusieurs sous-échelles (vision globale, activités nécessitant la vision de près, condition psychique et statut d'indépendance fonctionnelle).
Traitement de la RDP chez le prématuré: étude H2301 (RAINBOW)
L'efficacité et la sécurité cliniques de ranibizumab 0,1 mg dans le traitement de la RDP chez le prématuré ont été analysées dans le cadre de l'étude de supériorité randomisée, en ouvert, à trois bras et en groupes parallèles H2301 (RAINBOW) de six mois, conçue pour évaluer l'utilisation du ranibizumab à des doses de 0,1 mg et 0,2 mg, administré par injection intravitréenne, en comparaison avec un traitement au laser. Les patients candidats devaient présenter l'un des signes rétiniens suivants dans les deux yeux:
·Zone I, stade de la maladie 1+, 2+, 3 ou 3+ ou
·Zone II, stade de la maladie 3+ ou
·RDP agressive postérieure (AP-RDP)
Dans le cadre de cette étude, 225 patients ont été randomisés selon un rapport 1:1:1 dans des groupes recevant le ranibizumab par voie intravitréenne à une dose de 0,1 mg (n = 77) ou de 0,2 mg (n = 74) ou un traitement au laser (n = 74).
La réussite du traitement, mesurée par l'absence de RDP active et d'effets indésirables structurels dans les deux yeux 24 semaines après le premier traitement de l'étude, était de 75% dans le groupe ranibizumab 0,1 mg et de 66,2% dans le groupe de traitement au laser. La majorité des patients traités par ranibizumab 0,1 mg (77,6%) ont reçu une seule injection dans chaque œil.
Dans le groupe de traitement ranibizumab 0,1 mg, moins de patients ont changé de mode de traitement en raison d'un manque de réponse que dans le groupe de traitement au laser (16,9% vs 24,3%). Les effets indésirables structurels ont été moins fréquents dans le groupe de traitement ranibizumab 0,1 mg (5 patients, 6,7%) que dans le groupe de traitement au laser (7 patients, 10,1%). En outre, 75% des patients ont obtenu une diminution de la maladie en 8 jours sous ranibizumab 0,1 mg, contre 22,5 jours dans le groupe de traitement au laser.
Étude H2301E1 (étude d'extension RAINBOW)
L'efficacité à long terme et la sécurité du ranibizumab à la dose de 0,1 mg pour le traitement de la RDP chez les prématurés ont été étudiées dans l'étude H2301E1 (étude d'extension RAINBOW), extension de l'étude H2301 (RAINBOW), chez des patients suivis jusqu'à ce qu'ils atteignent l'âge de 5 ans.
L'objectif principal était l'évaluation de la fonction visuelle des patients lorsqu'ils atteignaient l'âge de 5 ans, en évaluant l'acuité visuelle selon les critères de l'étude ETDRS (Early Treatment Diabetic Retinopathy Study, étude du traitement précoce de la rétinopathie diabétique) avec les optotypes symboles de LEA, sur l'œil ayant la meilleure vision (œil obtenant le score ETDRS le plus élevé).
Un score ETDRS a été obtenu pour 78,2% des patients du groupe ranibizumab 0,1 mg (43/55) et 76,6% des patients du groupe traitement au laser (36/47) à l'âge de 5 ans. La différence pour la moyenne (ES) des moindres carrés (LS) entre le groupe ranibizumab 0,1 mg et le groupe traitement au laser a été de 2,5 (IC à 95%: -3,4, 8,3). Les résultats catégorisés pour l'acuité visuelle du meilleur œil à l'âge de 5 ans sont présentés dans le tableau 13. Dans l'ensemble, l'absence d'anomalies structurelles oculaires à l'âge de 5 ans a été observée chez un plus fort pourcentage de patients dans le groupe ranibizumab 0,1 mg [93,8% (61/65)] que dans le groupe traitement au laser [88,7% (47/53)].
Tableau 0-13 Effets sur l'acuité visuelle dans le meilleur œil¹ à l'âge de 5 ans
|
Catégorie d'acuité visuelle
|
Ranibizumab 0,2 mg
N = 65
n (%)
|
Laser
N = 54
n (%)
| |
≥1 à ≤34 lettres
|
3 (4,6)
|
2 (3,7)
| |
≥35 à ≤70 lettres
|
25 (38,5)
|
23 (42,6)
| |
≥71 lettres
|
15 (23,1)
|
11 (20,4)
| |
¹ Le meilleur œil est l'œil obtenant le score ETDRS-lettres le plus élevé lorsque le/la patient(e) atteint l'âge de 5 ans. Lorsque les deux yeux présentent le même score ETDRS-lettres, l'œil droit est considéré comme le meilleur œil.
|
|




