Propriétés/EffetsCode ATC
R07AX32
Mécanisme d'action
L'elexacaftor et le tezacaftor sont des correcteurs de la protéine CFTR qui se lient à des sites différents sur la protéine CFTR. Comparativement à chaque molécule seule, ils ont un effet additif pour faciliter la maturation et le trafic cellulaires de la protéine F508del-CFTR afin d'augmenter la quantité de protéines CFTR amenées à la surface cellulaire. L'ivacaftor potentialise la probabilité d'ouverture (ou de régulation) du canal CFTR au niveau de la surface cellulaire.
L'effet combiné de l'elexacaftor, du tezacaftor et de l'ivacaftor est une augmentation de la quantité de protéines F508del-CFTR et de leur fonction à la surface cellulaire, entraînant une augmentation de l'activité du canal CFTR, mesurée par le transport des ions chlorures par le canal. Les résultats cliniques concordaient avec les résultats in vitro et indiquent que la présence d'une seule mutation F508del suffit pour permettre d'obtenir une réponse clinique significative (voir «Efficacité clinique»).
Pharmacodynamique
Effets sur le taux de chlorure sudoral
Dans l'étude 445-102 (patients porteurs d'une mutation F508del sur un allèle, avec sur le second allèle, une mutation entraînant l'absence de synthèse de la protéine CFTR ou la synthèse d'une protéine CFTR ne répondant pas à l'ivacaftor et au tezacaftor/ivacaftor in vitro [mutation à fonction minimale]), une diminution du taux de chlorure sudoral par rapport à la valeur initiale a été observée à la semaine 4 et s'est maintenue pendant la période de traitement de 24 semaines. La différence de la variation absolue moyenne du taux de chlorure sudoral de l'inclusion jusqu'à la semaine 24 avec Trikafta par rapport au placebo était de -41,8 mmol/l (IC à 95 %: -44,4; -39,3; P < 0,0001).
Dans l'étude 445-103 (patients homozygotes pour la mutation F508del), la différence de la variation absolue moyenne du taux de chlorure sudoral à la semaine 4 par rapport à la valeur initiale avec Trikafta par rapport au traitement par tezacaftor/ivacaftor associé à l'ivacaftor (tezacaftor/ivacaftor) était de -45,1 mmol/l (IC à 95 %: -50,1; -40,1; P < 0,0001).
Dans l'étude 445-104 (patients hétérozygotes pour la mutation F508del et porteurs sur le second allèle d'une mutation d'anomalie de régulation du canal chlorure [Gating] ou d'une mutation associée à une activité résiduelle de la protéine CFTR), après une période de préinclusion de 4 semaines pendant laquelle les patients ont reçu un traitement par ivacaftor ou tezacaftor/ivacaftor, la variation absolue moyenne du taux de chlorures jusqu'à la semaine 8 par rapport à la valeur initiale dans le groupe Trikafta était de -22,3 mmol/l (IC à 95 %: -24,5; -20,2; P < 0,0001). La différence entre le groupe Trikafta et le groupe contrôle (groupe ivacaftor ou tezacaftor/ivacaftor) était de -23,1 mmol/l (IC à 95 %: -26,1; -20,1; P < 0,0001).
Dans l'étude 445-106 partie B (ayant inclus des patients âgés de 6 à moins de 12 ans homozygotes pour la mutation F508del ou hétérozygotes pour la mutation F508del et porteurs d'une mutation à fonction minimale), la variation absolue moyenne du taux de chlorures jusqu'à la semaine 24 par rapport à la valeur initiale était de -60,9 mmol/l (IC à 95 %: -63,7; -58,2). Les valeurs mesurées pour le taux de chlorure sudoral ont été relevées aux jours de mesure prévus chez le nombre de patients suivant: inclusion n=62, jour 15 n=56, semaine 4 n=56, semaine 12 n=50, semaine 24 n=28.
Dans l'étude 445-111 (ayant inclus des patients âgés de 2 à moins de 6 ans homozygotes pour la mutation F508del ou hétérozygotes pour la mutation F508del et porteurs d'une mutation à fonction minimale), la variation absolue moyenne du taux de chlorures jusqu'à la semaine 24 par rapport à la valeur initiale était de -57,9 mmol/l (IC à 95 %: -61,3; -54,6).
Effets cardiovasculaires
Effet sur l'intervalle QT
À des doses allant jusqu'à 2 fois la dose maximale recommandée d'elexacaftor et jusqu'à 3 fois la dose maximale recommandée de tezacaftor et d'ivacaftor, il n'a pas été observé d'allongement de l'intervalle QT/QTc cliniquement significatif chez des volontaires sains.
Fréquence cardiaque
Dans l'étude 445-102, des diminutions moyennes de la fréquence cardiaque de 3,7 à 5,8 battements par minute (bpm) par rapport à la valeur initiale (76 bpm) ont été observées chez les patients traités par Trikafta.
Efficacité clinique
L'efficacité de Trikafta chez les patients atteints de mucoviscidose a été démontrée statistiquement dans trois études de phase III contrôlées en double aveugle (études 445-102, 445-103 et 445-104). Ces études ont inclus des patients atteints de mucoviscidose porteurs d'au moins une mutation F508del. Trois études de phase III en ouvert et non contrôlées (étude 445-105, étude 445-106 partie B et étude 445-111) confirment les données d'efficacité. Trikafta a été développé en tant qu'association contenant de l'elexacaftor, du tezacaftor et de l'ivacaftor. Le bénéfice de l'elexacaftor seul et du tezacaftor seul par rapport au traitement en association n'a pas été évalué dans des études cliniques et ces principes actifs ne sont pas disponibles individuellement sous forme de médicaments.
L'étude 445-102 était une étude randomisée en double aveugle, contrôlée contre placebo, d'une durée de 24 semaines conduite chez des patients porteurs d'une mutation F508del sur un allèle, avec sur le second allèle une mutation à fonction minimale entraînant l'absence de synthèse de la protéine CFTR ou la synthèse d'une protéine CFTR ne répondant pas à l'ivacaftor et au tezacaftor/ivacaftor. Au total, 403 patients âgés de 12 ans et plus (âge moyen: 26,2 ans) ont été randomisés pour recevoir Trikafta ou le placebo. Les patients avaient un VEMS allant de 40 % à 90 % de la valeur théorique lors de la sélection. Lors de l'inclusion, le VEMS moyen était de 61,4 % de la valeur théorique (valeurs extrêmes: 32,3 % à 97,1 %).
L'étude 445-103 était une étude randomisée en double aveugle, contrôlée contre comparateur actif, d'une durée de 4 semaines menée chez des patients homozygotes pour la mutation F508del. Au total, 107 patients âgés de 12 ans et plus (âge moyen: 28,4 ans) ont reçu un traitement par tezacaftor/ivacaftor et ivacaftor (tezacaftor/ivacaftor) pendant une période de préinclusion en ouvert de 4 semaines, puis ont été randomisés pour recevoir Trikafta ou tezacaftor/ivacaftor pendant une période de traitement en double aveugle de 4 semaines. Les patients avaient un VEMS allant de 40 % à 90 % de la valeur théorique lors de la sélection. Le VEMS moyen lors de l'inclusion, après la période de préinclusion sous tezacaftor/ivacaftor, était de 60,9 % de la valeur théorique (valeurs extrêmes: 35,0 % à 89,0%).
L'étude 445-104 était une étude randomisée en double aveugle, contrôlée contre comparateur actif, d'une durée de 8 semaines menée chez des patients hétérozygotes pour la mutation F508del (F) et porteurs sur le second allèle d'une mutation d'anomalie de régulation du canal chlorure (Gating) ou d'une mutation associée à une activité résiduelle de la protéine CFTR (RF). Des patients âgés de 12 ans et plus ayant un VEMS allant de 40 % à 90 % de la valeur théorique lors de la sélection ont reçu un traitement par ivacaftor (patients F/Gating) ou par tezacaftor/ivacaftor (patients F/RF) pendant une période de préinclusion en ouvert de 4 semaines. Les patients porteurs du génotype F/R117H ont reçu l'ivacaftor pendant la période de préinclusion. Les patients ont ensuite été randomisés dans le groupe Trikafta ou ont poursuivi le traitement modulateur de la protéine CFTR reçu pendant la période de préinclusion. Lors de l'inclusion après la période de préinclusion, l'âge moyen était de 37,7 ans et le VEMS moyen était de 67,6 % de la valeur théorique (valeurs extrêmes: 29,7 % à 113,5 %).
L'étude 445-106 était une étude en ouvert et non contrôlée en deux parties d'une durée de 24 semaines menée chez 66 patients âgés de 6 à moins de 12 ans (âge moyen à l'inclusion: 9,3 ans) homozygotes pour la mutation F508del ou hétérozygotes pour la mutation F508del et porteurs d'une mutation à fonction minimale. La partie A a évalué la pharmacocinétique et les résultats préliminaires de sécurité, tandis que la partie B a examiné la sécurité, la tolérance, l'efficacité et la pharmacocinétique. Les patients pesant moins de 30 kg lors de l'inclusion (36 patients, 54,5 %) ont reçu deux comprimés d'elexacaftor 50 mg/tezacaftor 25 mg/ivacaftor 37,5 mg le matin et un comprimé d'ivacaftor 75 mg le soir. Les patients pesant 30 kg ou plus lors de l'inclusion (30 patients, 45,5 %) ont reçu deux comprimés d'elexacaftor 100 mg/tezacaftor 50 mg/ivacaftor 75 mg le matin et un comprimé d'ivacaftor 150 mg le soir. Les patients avaient un VEMS ≥40 % de la valeur théorique lors de la sélection (valeur initiale moyenne du VEMS: 88,8 %) (valeurs extrêmes: 39,0 % à 127,1 %) et pesaient au moins 15 kg (critère d'inclusion requis).
L'étude 445-111 était une étude en ouvert de 24 semaines menée chez des patients âgés de 2 à moins de 6 ans (âge moyen à l'inclusion 4,1 ans). Des patients porteurs d'au moins une mutation F508del ou d'une mutation connue pour répondre à l'elexacaftor/tezacaftor/ivacaftor étaient admissibles à l'étude. Au total, 75 patients homozygotes pour la mutation F508del ou hétérozygotes pour la mutation F508del et porteurs d'une mutation à fonction minimale ont été inclus et ont reçu le traitement selon une posologie déterminée en fonction du poids. Les patients pesant de 10 kg à moins de 14 kg lors de l'inclusion recevaient l'elexacaftor 80 mg/tezacaftor 40 mg/ivacaftor 60 mg une fois par jour (qd) le matin et l'ivacaftor 59,5 mg chaque soir. Les patients pesant au moins 14 kg lors de l'inclusion recevaient l'elexacaftor 100 mg qd/tezacaftor 50 mg qd/ivacaftor 75 mg toutes les 12 heures (q12h).
Dans les études 445-102, 445-103, 445-104, 445-106 et 445-111, les patients ont poursuivi leurs traitements de la mucoviscidose (par exemple bronchodilatateurs, antibiotiques inhalés, dornase alfa et solution de chlorure de sodium hypertonique), mais ont arrêté tous les traitements modulateurs de la protéine CFTR antérieurs, à l'exception des médicaments expérimentaux. Les patients avaient un diagnostic confirmé de mucoviscidose avec au moins une mutation F508del.
Dans les études 445-102, 445-103, 445-104, 445-106, et 445-111, les patients qui présentaient une infection pulmonaire par des agents pathogènes associés à une dégradation plus rapide de l'état pulmonaire, incluant, mais sans s'y limiter, Burkholderia cenocepacia, Burkholderia dolosa ou Mycobacterium abscessus ou une anomalie d'un paramètre hépatique lors de la sélection (ALAT, ASAT, PA ou GGT ≥3 × LSN ou bilirubine totale ≥2 × LSN) étaient exclus des études. Les patients qui avaient un taux d'ALAT ou d'ASAT ≥2 × LSN étaient également exclus de l'étude 445-111.
Les patients ayant participé aux études 445-102 et 445-103 étaient admissibles pour entrer dans une étude d'extension en ouvert de 192 semaines (étude 445-105). Les patients ayant participé aux études 445-104, 445-106 et 445-111 étaient admissibles pour entrer dans des études d'extension en ouvert.
Étude 445-102
Dans l'étude 445-102, le critère d'évaluation principal était la variation absolue moyenne du VEMS exprimé en pourcentage de la valeur théorique de l'inclusion jusqu'à la semaine 24. Par rapport au placebo, le traitement par Trikafta a entraîné une amélioration statistiquement significative de 14,3 % du VEMS (IC à 95 %: 12,7; 15,8; P < 0,0001) (tableau 7). L'amélioration moyenne du VEMS a été observée lors de la première évaluation le jour 15 et a persisté pendant toute la période de traitement de 24 semaines (figure 1). Des améliorations du VEMS exprimé en pourcentage de la valeur théorique ont été observées quels que soient l'âge, le VEMS à l'inclusion, le sexe et la région géographique. Au total, 18 patients recevant Trikafta avaient un VEMS < 40 % de la valeur théorique lors de l'inclusion. La sécurité et l'efficacité dans ce sousgroupe concordaient avec celles observées dans la population totale de l'étude. Voir le tableau 7 pour une synthèse des résultats sur le critère d'évaluation principal et les principaux critères secondaires.
|
Tableau 7: Analyses du critère d'efficacité principal et des principaux critères secondaires, population complète d'analyse (étude 445-102)
| |
Analyse
|
Statistique
|
Placebo
N = 203
|
Trikafta
N = 200
| |
Critère d'efficacité principal
| |
Variation absolue du VEMS de l'inclusion jusqu'à la semaine 24 (%)
|
Différence entre les traitements (IC à 95 %)
|
S/O
|
14,3 (12,7; 15,8)
| |
|
Valeur de P
|
S/O
|
P < 0,0001
| |
|
Variation intragroupe (ES)
|
-0,4 (0,5)
|
13,9 (0,6)
| |
Principaux critères d'efficacité secondaires
| |
Variation absolue du VEMS à la semaine 4 par rapport à la valeur initiale (%)
|
Différence entre les traitements (IC à 95 %)
|
S/O
|
13,7 (12,0; 15,3)
| |
|
Valeur de P
|
S/O
|
P < 0,0001
| |
|
Variation intragroupe (ES)
|
-0,2 (0,6)
|
13,5 (0,6)
| |
Nombre d'exacerbations pulmonaires de l'inclusion jusqu'à la semaine 24‡
|
Nombre d'événements (taux d'événements annuel††)
|
113 (0,98)
|
41 (0,37)
| |
|
Rapport des taux (RR) (IC à 95 %)
|
S/O
|
0,37 (0,25; 0,55)
| |
|
Valeur de P
|
S/O
|
P < 0,0001
| |
Variation absolue du taux de chlorure sudoral par rapport à la valeur initiale jusqu'à la semaine 24 (mmol/l)
|
Différence entre les traitements (IC à 95 %)
|
S/O
|
-41,8 (-44,4; -39,3)
| |
|
Valeur de P
|
S/O
|
P < 0,0001
| |
|
Variation intragroupe (ES)
|
-0,4 (0,9)
|
-42,2 (0,9)
| |
Variation absolue du score du domaine respiratoire CFQ-R de l'inclusion jusqu'à la semaine 24 (points)
|
Différence entre les traitements (IC à 95 %)
|
S/O
|
20,2 (17,5; 23,0)
| |
|
Valeur de P
|
S/O
|
P < 0,0001
| |
|
Variation intragroupe (ES)
|
-2,7 (1,0)
|
17,5 (1,0)
| |
Variation absolue de l'IMC à la semaine 24 par rapport à la valeur initiale (kg/m2)
|
Différence entre les traitements (IC à 95 %)
|
S/O
|
1,04 (0,85; 1,23)
| |
|
Valeur de P
|
S/O
|
P < 0,0001
| |
|
Variation intragroupe (ES)
|
0,09 (0,07)
|
1,13 (0,07)
| |
Variation absolue du taux de chlorure sudoral à la semaine 4 par rapport à la valeur initiale (mmol/l)
|
Différence entre les traitements (IC à 95 %)
|
S/O
|
-41,2 (-44,0; -38,5)
| |
|
Valeur de P
|
S/O
|
P < 0,0001
| |
|
Variation intragroupe (ES)
|
0,1 (1,0)
|
-41,2 (1,0)
| |
Variation absolue du score du domaine respiratoire CFQ-R à la semaine 4 par rapport au score initial (points)
|
Différence entre les traitements (IC à 95 %)
|
S/O
|
20,1 (16,9; 23,2)
| |
|
Valeur de P
|
S/O
|
P < 0,0001
| |
|
Variation intragroupe (ES)
|
-1,9 (1,1)
|
18,1 (1,1)
| |
VEMS: volume expiratoire maximum par seconde exprimé en pourcentage de la valeur théorique; IC: intervalle de confiance; ES: erreur standard; S/O: sans objet; CFQ-R: Cystic Fibrosis Questionnaire Revised, (questionnaire révisé spécifique de la mucoviscidose), IMC: indice de masse corporelle.
‡ Une exacerbation pulmonaire était définie comme une modification de l'antibiothérapie (intraveineuse, inhalée ou orale) en raison de la présence d'au moins 4 des 12 signes/symptômes sinopulmonaires prédéfinis.
†† Taux annuel d'événements estimé calculé sur la base de 48 semaines par an.
|
Figure 1: Variation absolue du VEMS exprimé en pourcentage de la valeur théorique par rapport à la valeur initiale lors de chaque visite dans l'étude 445-102
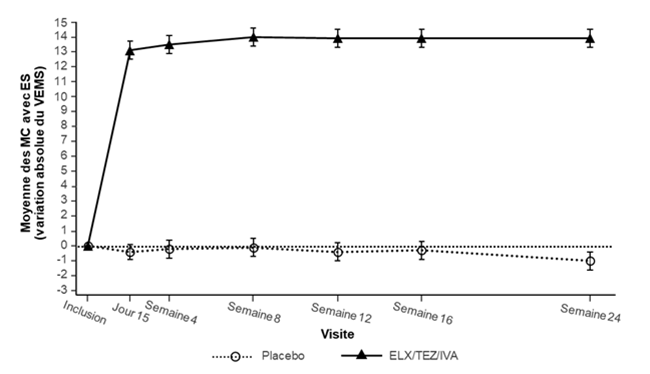
ES: erreur standard; ELX/TEZ/IVA: elexacaftor/tezacaftor/ivacaftor.
Étude 445-103
Dans l'étude 445-103, le critère d'évaluation principal était la variation absolue moyenne du VEMS exprimé en pourcentage de la valeur théorique à la semaine 4 de la période de traitement en double aveugle par rapport à la valeur initiale. Par rapport au traitement par tezacaftor/ivacaftor et ivacaftor (tezacaftor/ivacaftor), le traitement par Trikafta a induit une amélioration statistiquement significative de 10,0 % du VEMS exprimé en pourcentage de la valeur théorique (IC à 95 %: 7,4; 12,6; P < 0,0001) (tableau 8). Des améliorations du VEMS exprimé en pourcentage de la valeur théorique ont été observées quels que soient l'âge, le sexe, le VEMS initial et la région géographique. Voir le tableau 8 pour une synthèse des résultats du critère d'évaluation principal et des principaux critères secondaires.
|
Tableau 8: Analyses du critère d'efficacité principal et des principaux critères secondaires, population complète d'analyse (étude 445-103)
| |
Analyse*
|
Statistique
|
Tezacaftor/
ivacaftor#
N = 52
|
Trikafta
N = 55
| |
Critère d'efficacité principal
| |
Variation absolue du VEMS à la semaine 4 par rapport à la valeur initiale (%)
|
Différence entre les traitements (IC à 95 %)
|
S/O
|
10,0 (7,4; 12,6)
| |
|
Valeur de P
|
S/O
|
P < 0,0001
| |
|
Variation intragroupe (ES)
|
0,4 (0,9)
|
10,4 (0,9)
| |
Principaux critères d'efficacité secondaires
| |
Variation absolue du taux de chlorure sudoral à la semaine 4 par rapport à la valeur initiale (mmol/l)
|
Différence entre les traitements (IC à 95 %)
|
S/O
|
-45,1 (-50,1; -40,1)
| |
|
Valeur de P
|
S/O
|
P < 0,0001
| |
|
Variation intragroupe (ES)
|
1,7 (1,8)
|
-43,4 (1,7)
| |
Variation absolue du score du domaine respiratoire CFQ-R à la semaine 4 par rapport au score initial (points)
|
Différence entre les traitements (IC à 95 %)
|
S/O
|
17,4 (11,8; 23,0)
| |
|
Valeur de P
|
S/O
|
P < 0,0001
| |
|
Variation intragroupe (ES)
|
-1,4 (2,0)
|
16,0 (2,0)
| |
VEMS: volume expiratoire maximum par seconde exprimé en pourcentage de la valeur théorique; IC: intervalle de confiance; ES: erreur standard; S/O: sans objet; CFQ-R: Cystic Fibrosis Questionnaire Revised, (questionnaire révisé spécifique de la mucoviscidose).
* La valeur initiale pour le critère principal et les principaux critères secondaires est définie comme la valeur à la fin de la période de pré-inclusion de 4 semaines sous tezacaftor/ivacaftor et ivacaftor.
# Traitement par tezacaftor/ivacaftor et ivacaftor.
|
Figure 2: Variation absolue du VEMS exprimé en pourcentage de la valeur théorique par rapport à la valeur initiale lors de chaque visite dans l'étude 445-103
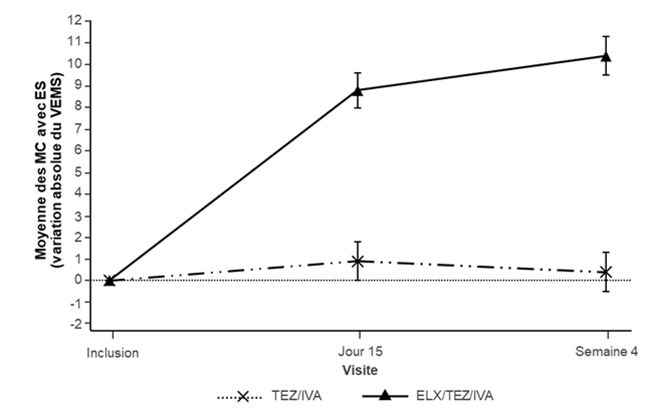
ES: erreur standard; TEZ/IVA: tezacaftor/ivacaftor; ELX/TEZ/IVA: elexacaftor/tezacaftor/ivacaftor
Étude 445-105
Une étude d'extension en ouvert de 192 semaines visant à évaluer la sécurité et l'efficacité du traitement à long terme par Trikafta est en cours chez les patients qui avaient participé à l'étude 445-102 (N = 399) ou 445-103 (N = 107). Dans cette étude d'extension en ouvert, tous les patients ont reçu Trikafta pendant toute la durée de l'étude. Une analyse intermédiaire de l'efficacité a été réalisée après 96 semaines dans l'étude 445-105. Dans l'étude 445-105, les patients des bras témoins des études principales ont présenté des améliorations des critères d'efficacité qui correspondaient à celles des patients ayant reçu Trikafta dans les études principales. Les patients du bras témoin et les patients ayant reçu le Trikafta dans les études principales ont présenté une amélioration durable du VEMS (voir figure 3 et figure 4) et d'autres critères d'efficacité (voir tableau 9) au cours des 96 premières semaines de l'étude d'extension en ouvert. Les résultats en termes d'IMC et de Zscore d'IMC à la semaine 96 de traitement cumulé (semaine 96 dans l'étude 445-105) concordaient avec ceux observés chez les patients porteurs des génotypes étudiés dans l'étude 445-102.
Figure 3: Variation absolue du VEMS par rapport à la valeur initiale à chaque visite d'étude de l'étude 445-102 et de l'étude 445-105 chez les patients repris de l'étude 445-102*.
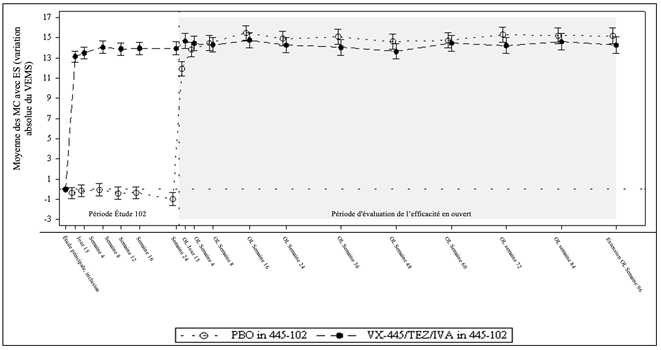
VEMS = volume expiratoire maximum par seconde (VEMS) exprimé en pourcentage de la valeur théorique; moyenne des MC = moyenne calculée par la méthode des moindres carrés; ES = erreur standard; OL = en ouvert.
* Le créneau de la semaine 96 de l'étude d'extension incluait les données lors de la visite de la semaine 96 ainsi que les données des visites planifiées ou non, réalisées après la semaine 96 chez les patients dont les données étaient manquantes à la semaine 96.
Figure 4: Variation absolue du VEMS par rapport à la valeur initiale à chaque visite d'étude de l'étude 445-103 et de l'étude 445-105 chez les patients repris de l'étude 445-103.*
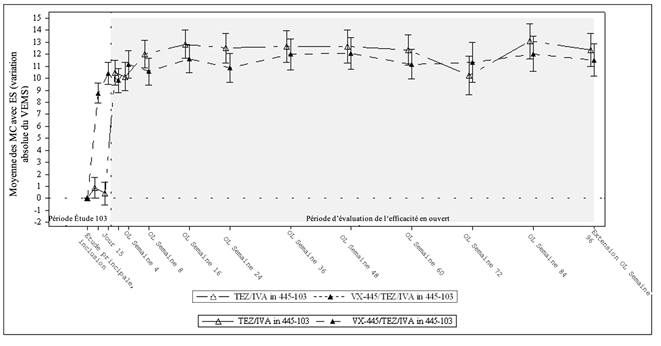
VEMS = volume expiratoire maximum par seconde exprimé en pourcentage de la valeur théorique; moyenne des MC = moyenne calculée par la méthode des moindres carrés; ES = erreur standard; OL = en ouvert.
* Le créneau de la semaine 96 de l'étude d'extension incluait les données lors de la visite de la semaine 96 ainsi que les données des visites planifiées ou non, réalisées après la semaine 96 chez les patients dont les données étaient manquantes à la semaine 96.
|
Tableau 9: Étude 445-105 Analyse non contrôlée des critères d'efficacité secondaires à la semaine 96 de l'étude d'extension (patients porteurs du génotype F/MF ou F/F)
| |
Analyse
|
Statistique
|
À la semaine 96 de l'étude d'extension 445-105*
| |
PBO dans
445-102
N = 203
|
ELX/TEZ/IVA dans l'étude 445-102
N = 196
|
TEZ/IVA dans l'étude 445-103
N = 52
|
ELX/TEZ/IVA dans l'étude 445-103
N = 55
| |
Variation absolue du VEMS par rapport à la valeur initiale†
(%)
|
n
|
161
|
169
|
45
|
45
| |
Moyenne des MC
|
15,2
|
14,3
|
12,4
|
11,5
| |
IC à 95 %
|
(13,6; 16,7)
|
(12,7; 15,8)
|
(9,6; 15,1)
|
(8,8; 14,2)
| |
Variation absolue du taux de chlorure sudoral par rapport à la valeur initiale†
(mmol/)
|
n
|
157
|
166
|
42
|
45
| |
Moyenne des MC
|
-48,6
|
-45,8
|
-48,3
|
-49,7
| |
IC à 95 %
|
(-51,3; -45,8)
|
(-48,5; -43,0)
|
(-53,7; -42,8)
|
(-55,0; -44,4)
| |
Nombre de PEx pendant la période d'évaluation de l'efficacité cumulée de la triple association‡
|
Nombre d'événements
|
253
|
53
| |
|
Taux annuel d'événements estimé (IC à 95 %)
|
0,21 (0,17; 0,26)
|
0,21 (0,14; 0,30)
| |
VEMS: volume expiratoire maximum par seconde exprimé en pourcentage de la valeur théorique; SwCl = taux de chlorure sudoral; PEx = exacerbation pulmonaire; moyenne LS = moyenne calculée selon la méthode des moindres carrés; IC = intervalle de confiance; PBO = placebo.* Le créneau de la semaine 96 de l'étude d'extension incluait les données lors de la visite de la semaine 96 ainsi que les données des visites planifiées ou non, réalisées après la semaine 96 chez les patients dont les données étaient manquantes à la semaine 96.† Valeur initiale = valeur initiale de l'étude principale.‡ Pour les patients randomisés dans le groupe ELX/TEZ/IVA, la période d'évaluation de l'efficacité cumulée de la triple association inclut les données des études principales jusqu'à la semaine 96 de traitement dans l'étude 445-105. Pour les patients randomisés dans le groupe placebo ou TEZ/IVA, la période d'évaluation de l'efficacité cumulée de la triple association inclut uniquement les données jusqu'à la semaine 96 de traitement dans l'étude 445-105.
|
Étude 445-104
Après une période de pré-inclusion de 4 semaines sous ivacaftor ou tezacaftor/ivacaftor, pour le critère d'évaluation principal, la variation absolue moyenne intragroupe du VEMS jusqu'à la semaine 8 par rapport à la valeur initiale, les résultats ont montré une amélioration statistiquement significative de 3,7 % dans le groupe Trikafta (IC à 95 %: 2,8; 4,6; P < 0,0001) (voir le tableau 10). L'amélioration moyenne du VEMS a été observée lors de la première évaluation le jour 15. Des améliorations globales du VEMS exprimé en pourcentage de la valeur théorique ont été observées quels que soient l'âge, le sexe, le VEMS à l'inclusion, la région géographique ou le groupe de génotype (F/Gating ou F/RF).
Voir le tableau 10 pour une synthèse des résultats sur le critère d'évaluation principal et les critères secondaires dans la population totale de l'étude.
|
Tableau 10: Analyses du critère d'efficacité principal et des principaux critères secondaires, population complète d'analyse (étude 445-104)
| |
Analyse*
|
Statistique
|
Groupe contrôle#
N = 126
|
Groupe Trikafta
N = 132
| |
Critère principal
| |
Variation absolue du VEMS de l'inclusion jusqu'à la semaine 8 (%)
|
Variation intragroupe
(IC à 95 %)
|
0,2 (-0,7; 1,1)
|
3,7 (2,8; 4,6)
| |
Valeur de P
|
S/O
|
P < 0,0001
| |
Principaux critères secondaires et autres critères secondaires
| |
Variation absolue du taux de chlorure sudoral de l'inclusion jusqu'à la semaine 8 (mmol/l)
|
Variation intragroupe
(IC à 95 %)
|
0,7 (-1,4; 2,8)
|
-22,3 (-24,5; -20,2)
| |
Valeur de P
|
S/O
|
P < 0,0001
| |
Variation absolue du VEMS jusqu'à la semaine 8 par rapport à la valeur initiale comparativement au groupe contrôle (%)
|
Différence entre les traitements
(IC à 95 %)
|
S/O
|
3,5 (2,2; 4,7)
| |
Valeur de P
|
S/O
|
P < 0,0001
| |
Variation absolue du taux de chlorure sudoral jusqu'à la semaine 8 par rapport à la valeur initiale comparativement au groupe contrôle (mmol/l)
|
Différence entre les traitements
(IC à 95 %)
|
S/O
|
-23,1 (-26,1; -20,1)
| |
Valeur de P
|
S/O
|
P < 0,0001
| |
Variation absolue du score du domaine respiratoire CFQ-R de l'inclusion jusqu'à la semaine 8 (points) ±
|
Variation intragroupe
(IC à 95 %)
|
1,6 (-0,8; 4,1)
|
10,3 (8,0; 12,7)
| |
Variation absolue du score du domaine respiratoire CFQ-R jusqu'à la semaine 8 par rapport au score initial comparativement au groupe contrôle (points) ±
|
Différence entre les traitements
(IC à 95 %)
|
S/O
|
8,7 (5,3; 12,1)
| |
VEMS: volume expiratoire maximum par seconde exprimé en pourcentage de la valeur théorique; IC: intervalle de confiance; S/O: sans objet; CFQ-R: Cystic Fibrosis Questionnaire-Revised, (questionnaire révisé spécifique de la mucoviscidose).
* La valeur initiale pour le critère principal et les critères secondaires est définie comme la valeur à la fin de la période de préinclusion de 4 semaines sous ivacaftor ou tezacaftor/ivacaftor.
# Groupe ivacaftor ou groupe tezacaftor/ivacaftor.
± Il n'a pas été effectué d'ajustement pour multiplicité des scores du domaine respiratoire CFQ-R selon la procédure de tests hiérarchisés.
|
Étude 445-106 partie B
Dans l'étude 445-106 partie B, le critère d'évaluation principal était la sécurité et la tolérance sur 24 semaines. Les critères d'évaluation secondaires étaient l'évaluation de l'efficacité et de la pharmacocinétique, y compris la variation absolue du VEMS (1er critère d'évaluation secondaire) et du taux de chlorure sudoral (2e critère d'évaluation secondaire, voir «Pharmacodynamique») par rapport à l'inclusion à la semaine 24 et le nombre d'exacerbations pulmonaires de l'inclusion à la semaine 24 comprise. En raison de la réalisation de l'étude 445-106 partie B pendant la pandémie de COVID 19, toutes les mesures n'ont pas pu être effectuées comme prévu initialement. Les mesures des critères d'évaluation secondaires ont été affectées à divers degrés par des mesures non effectuées. Le tableau 11 présente les principaux résultats d'efficacité secondaires dans l'analyse globale sur 24 semaines.
Les valeurs mesurées pour le VEMS ont été relevées les jours de mesure prévus chez le nombre de patients suivant: Inclusion n=62, jour 15 n=51, semaine 4 n=52, semaine 8 n=51, semaine 12 n=43, semaine 16 n=29, semaine 24 n=15.
Les valeurs mesurées pour le taux de chlorure sudoral ont été relevées aux jours de mesure prévus chez le nombre de patients suivant: inclusion n=62, jour 15 n=56, semaine 4 n=56, semaine 12 n=50, semaine 24 n=28.
|
Tableau 11: Analyses des critères secondaires d'évaluation de l'efficacité, population complète d'analyse sur 24 semaines (étude 445-106, partie B)
| |
Analyse
|
Variation intragroupe (IC à 95 %) pour Trikafta
N=66
| |
Variation absolue du VEMS de l'inclusion jusqu'à la semaine 24 (%)
|
10,2 (7,9; 12,6)
| |
Variation absolue du taux de chlorure sudoral de l'inclusion jusqu'à la semaine 24 (mmol/l)
|
-60,9 (-63,7; -58,2)
| |
Nombre d'exacerbations pulmonaires jusqu'à la semaine 24‡
|
4 (0,12) ††
| |
IC: intervalle de confiance: VEMS: volume expiratoire maximum par seconde en pourcentage de la valeur théorique.
‡ Une exacerbation pulmonaire était définie comme une modification de l'antibiothérapie (intraveineuse, inhalée ou orale) en raison de la présence d'au moins 4 des 12 signes/symptômes sino-pulmonaires prédéfinis.
†† Nombre d'événements et taux annuel d'événements estimé déterminé sur la base de 48 semaines par an.
|
Étude 445-111
Le profil pharmacocinétique, la sécurité et l'efficacité de Trikafta chez les patients atteints de mucoviscidose âgés de 2 à moins de 6 ans sont étayés par des données d'études de Trikafta menées chez des patients âgés de 12 ans et plus (études 445-102, 445-103 et 445-104), avec des données supplémentaires issues d'une étude de phase III en ouvert de 24 semaines menée chez 75 patients âgés de 2 à moins de 6 ans (étude 445-111).
Dans l'étude 445-111, la sécurité et la tolérance (critère d'évaluation principal) ont été évaluées jusqu'à la semaine 24. Les objectifs secondaires comprenaient une évaluation de la pharmacocinétique et des critères d'efficacité incluant la variation absolue du taux de chlorure sudoral (voir «Pharmacodynamique») et de l'ICP2,5 jusqu'à la semaine 24 par rapport aux valeurs initiales. Voir le tableau 12 pour une synthèse des résultats de critères secondaires d'évaluation de l'efficacité.
|
Tableau 12: Analyses des critères secondaires d'évaluation de l'efficacité, population complète d'analyse (étude 445-111)
| |
Analyse
|
Statistique
|
Trikafta
Variation intragroupe (IC à 95 %)
| |
Variation absolue du taux de chlorure sudoral jusqu'à la semaine 24 par rapport à la valeur initiale (mmol/l)
|
N*
Moyenne des MC (IC à 95 %)
|
75
-57,9 (-61,3; -54,6)
| |
Variation absolue de l'ICP2,5 jusqu'à la semaine 24 par rapport à la valeur initiale
|
N
Moyenne des MC (IC à 95 %)
|
63‡
-0,83 (-1,01; -0,66)
| |
Nombre d'exacerbations pulmonaires jusqu'à la semaine 24**
|
N
Nombre d'événements (taux annuel d'événements estimé)
|
75
12 (0;32) ††
| |
IC: intervalle de confiance; ICP: index de clairance pulmonaire.
* N est le nombre de patients dans la population complète d'analyse correspondante.
‡ ICP évalué uniquement chez les patients âgés de 3 ans et plus lors de la sélection.
** Des définitions spécifiques à l'âge d'une exacerbation pulmonaire sont utilisées pour les patients âgés de 2 à 5 ans et de 6 ans et plus.
†† Nombre d'événements et taux annuel d'événements estimé déterminé sur la base de 48 semaines par an.
|
|




