CompositionPrincipes actifs
Polysaccharida streptococci pneumoniae (serotype 1, 3, 4, 5, 6A, 6B, 7F, 8, 9V, 10A, 11A, 12F, 14, 15B, 18C, 19A, 19F, 22F, 23F, 33F) conjugatum cum proteinum corynebacteriae diphteriae CRM197.
Adjuvant
Aluminii phosphas.
Excipients
Natrii chloridum (corresp. à 1.73 mg de sodium), acidum succinicum, polysorbatum 80, aqua ad iniectabilia.
Indications/Possibilités d’emploiImmunisation active pour la prévention des maladies invasives, des pneumonies et des otites moyennes aiguës causées par Streptococcus pneumoniae chez les nourrissons et les enfants âgés de 6 semaines à 5 ans.
Immunisation active pour la prévention des maladies invasives et des pneumonies causées par Streptococcus pneumoniae chez les personnes âgées de 65 ans et plus.
Prevenar 20 ne protège pas contre les maladies causées par les sérotypes de S. pneumoniae qui ne sont pas contenus dans le vaccin.
Pour des informations sur la protection contre des sérotypes pneumococciques spécifiques, voir «Mises en garde et précautions» et «Propriétés/Effets».
Prevenar 20 doit être utilisé selon les recommandations officielles.
Posologie/Mode d’emploiPosologie usuelle
Nourrissons et enfants âgés de 6 semaines à 5 ans
Il est recommandé, pour les nourrissons qui ont reçu Prevenar 20 en primovaccination, d'achever la série vaccinale avec Prevenar 20.
Nourrissons âgés de 6 semaines à 6 mois
Le schéma vaccinal recommandé comporte 4 doses de 0.5 ml chacune (immunisation de base à 3 doses, suivie d'une dose de rappel):
L'immunisation de base pour les nourrissons comporte 3 doses, la première dose étant normalement administrée à partir de l'âge de 2 mois, la deuxième dose à l'âge de 4 mois et la troisième dose à l'âge de 6 mois.
La première dose peut également être administrée dès l'âge de 6 semaines, l'intervalle entre les doses devant être d'au moins 4 semaines.
La quatrième dose (rappel) est recommandée à l'âge de 11-15 mois (voir «Propriétés/Effets»).
Il n'existe pas ou peu de données sur Prevenar 20 chez les prématurés, les nourrissons et enfants plus âgés non vaccinés ou dont la vaccination est incomplète (voir «Mises en garde et précautions» et «Propriétés/Effets»).
Les recommandations posologiques suivantes s'appuient en premier lieu sur les expériences avec Prevenar 13.
Nourrissons prématurés (<37 semaines de grossesse)
Le schéma vaccinal recommandé pour Prevenar 20 comporte 4 doses de 0.5 ml chacune. L'immunisation de base pour les nourrissons comporte 3 doses, la première dose étant normalement administrée à partir de l'âge de 2 mois et l'intervalle entre les doses s'élevant à au moins 4 semaines. La première dose peut également être administrée dès l'âge de 6 semaines. La quatrième dose (rappel) est recommandée à l'âge de 11-15 mois (voir «Mises en garde et précautions» et «Propriétés/Effets»).
Schéma vaccinal de rattrapage pour les nourrissons et les enfants non vaccinés, âgés de 7 mois à 5 ans
|
Nourrissons non vaccinés âgés de 7 à <12 mois
|
3 doses
|
Deux doses de 0.5 ml chacune, à intervalle d'au moins 4 semaines.
Une troisième dose est recommandée au cours de la deuxième année.
| |
Enfants non vaccinés âgés de 12 à <24 mois
|
2 doses
|
Deux doses de 0.5 ml chacune, à intervalle d'au moins 8 semaines.
| |
Enfants non vaccinés âgés de 2 à <5 ans
|
1 dose
|
Une dose unique de 0.5 ml.
|
Schéma vaccinal de rattrapage pour les enfants âgés de 12 mois à <5 ans, ayant reçu auparavant une vaccination complète par Prevenar 13
Vaccination avec une dose unique (0.5 ml) au cas par cas et selon les recommandations officielles, afin de provoquer une réponse immunitaire aux sérotypes supplémentaires.
Si Prevenar 13 a été administré, il convient d'attendre au moins 8 semaines avant d'administrer Prevenar 20 (voir «Propriétés/Effets»).
Personnes âgées de 65 ans et plus
Chez les personnes âgées de 65 ans et plus, Prevenar 20 est administré en dose unique.
La nécessité d'administrer une nouvelle dose de Prevenar 20 dans le cadre d'une vaccination de rappel n'a pas été étudiée.
On ne dispose d'aucune donnée sur l'administration séquentielle d'autres vaccins pneumococciques ni sur une vaccination de rappel pour Prevenar 20. Sur la base des expériences cliniques acquises avec Prevenar 13 (un vaccin pneumococcique conjugué, composé de 13 conjugués polysaccharidiques également présents dans Prevenar 20), Prevenar 20 doit être administré en premier lieu si l'utilisation d'un vaccin pneumococcique polysaccharidique 23-valent (PPSV23) est envisagée (voir «Propriétés/Effets»).
Traçabilité
Afin d'assurer la traçabilité des médicaments biotechnologiques, il convient de documenter pour chaque traitement le nom commercial et le numéro de lot.
Instructions posologiques particulières
On ne dispose d'aucune donnée sur Prevenar 20 chez des groupes de patients particuliers.
Enfants et adolescents
La sécurité et l'efficacité de Prevenar 20 chez les nourrissons de moins de 6 semaines ne sont pas établies. On ne dispose d'aucune donnée.
Mode d'administration
Voie intramusculaire uniquement.
La dose (0.5 ml) de Prevenar 20 doit être administrée par voie intramusculaire. Les sites d'administration à privilégier sont la face antérolatérale de la cuisse (muscle vaste latéral) chez le nourrisson ou le muscle deltoïde du bras chez l'enfant et l'adulte. Pour l'administration de Prevenar 20, il convient d'éviter l'injection dans ou à proximité des nerfs et des vaisseaux sanguins.
Pour les instructions concernant la manipulation du vaccin avant l'administration, voir «Remarques particulières», «Remarques concernant la manipulation».
Contre-indicationsHypersensibilité aux principes actifs, à l'un des excipients cités dans la rubrique «Composition» ou à l'anatoxine diphtérique.
Mises en garde et précautionsPrevenar 20 ne doit pas être administré par voie intravasculaire.
Hypersensibilité
Comme pour tous les vaccins injectables, une prise en charge médicale et une surveillance adéquates doivent être garanties pour les rares cas de survenue d'une réaction anaphylactique après l'administration du vaccin.
Maladie concomitante
La vaccination doit être reportée à une date ultérieure chez les personnes présentant une maladie fébrile aiguë sévère. Cependant, en cas d'infection légère, telle qu'un rhume, la vaccination ne doit pas être reportée.
Thrombopénie et troubles de la coagulation
Le vaccin doit être administré avec précaution aux personnes présentant une thrombopénie ou des troubles de la coagulation, car des saignements peuvent survenir après l'administration intramusculaire.
Le risque de saignements chez les patients présentant des troubles de la coagulation doit être soigneusement vérifié avant l'administration intramusculaire de tout vaccin, et une administration par voie sous-cutanée doit être envisagée si le bénéfice potentiel dépasse significativement les risques.
Protection contre les maladies pneumococciques
Prevenar 20 protège exclusivement contre les sérotypes de Streptococcus pneumoniae inclus dans le vaccin, voir «Efficacité clinique». Il n'offre pas de protection contre d'autres micro-organismes provoquant des maladies invasives, une pneumonie ou une otite moyenne. Comme tout vaccin, Prevenar 20 peut ne pas protéger toutes les personnes qui reçoivent ce vaccin contre une maladie à pneumocoques.
Personnes immunodéprimées
Aucune donnée sur la sécurité et l'immunogénicité de Prevenar 20 chez les personnes des groupes immunodéprimés n'est disponible. La décision de vacciner ou non doit être prise au cas par cas.
Selon l'expérience acquise avec les vaccins pneumococciques, certaines personnes dont l'immunocompétence est altérée peuvent présenter une réponse immunitaire réduite à Prevenar 20.
Les personnes dont la réponse immunitaire est limitée, que ce soit en raison d'un traitement immunosuppresseur, d'une anomalie génétique, d'une infection par le VIH ou pour d'autres raisons, peuvent présenter une réponse en anticorps réduite à l'immunisation active. La pertinence clinique de cette observation n'est pas connue.
Population pédiatrique
Le risque potentiel d'apnées et la nécessité d'assurer une surveillance respiratoire de 48 à 72 heures doivent être envisagés si l'immunisation de base est administrée à des prématurés extrêmes (nés à la 28e semaine de gestation ou auparavant) et en particulier à ceux qui présentent des antécédents d'immaturité de l'appareil respiratoire. Le bénéfice de la vaccination dans ce groupe de nourrissons est élevé, c'est pourquoi il convient de ne pas priver ces patients du vaccin et de ne pas décaler son administration.
Excipients revêtant un intérêt particulier
Ce médicament contient moins de 1 mmol (23 mg) de sodium par dose de vaccin (0.5 ml de suspension injectable), c.-à-d. qu'il est essentiellement «sans sodium».
InteractionsLes différents vaccins injectables doivent toujours être administrés à des sites d'injection différents.
Prevenar 20 ne peut pas être mélangé à d'autres vaccins/médicaments dans une même seringue.
Population pédiatrique
Des études cliniques menées chez des nourrissons et des jeunes enfants âgés de 6 semaines à <15 mois ont permis d'évaluer l'administration concomitante de Prevenar 20 et des antigènes vaccinaux suivants, sous forme de vaccin monovalent ou de vaccin combiné: diphtérie, tétanos, coqueluche acellulaire, Haemophilus influenzae de type b, poliomyélite inactivée, hépatite B, rougeole, oreillons, rubéole (ROR) et varicelle. Dans les études cliniques, l'administration concomitante de vaccins contre les rotavirus et de Prevenar 20 était autorisée; aucune préoccupation en matière de sécurité n'a été observée.
Adultes ≥65 ans
Une étude menée chez des adultes âgés de 65 ans et plus a évalué l'administration concomitante de Prevenar 20 et d'un vaccin contre la grippe saisonnière (QIV; antigène de surface, inactivé, avec adjuvant). Chez les personnes présentant des affections sous-jacentes associées à un risque élevé de développement d'une maladie pneumococcique pouvant engager le pronostic vital, un intervalle entre les administrations du QIV et de Prevenar 20 (par ex. d'environ 4 semaines) peut être envisagé. Dans une étude randomisée (B7471004) menée en double aveugle chez des adultes âgés de 65 ans et plus, la réponse immunitaire a été formellement non inférieure, cependant des titres numériquement plus faibles ont été observés pour tous les sérotypes pneumococciques contenus dans Prevenar 20 en cas d'administration concomitante avec un vaccin contre la grippe saisonnière (QIV, antigène de surface, inactivé, avec adjuvant) par rapport à Prevenar 20 administré seul. La pertinence clinique de ce résultat n'est pas connue.
Une étude menée chez des adultes âgés de 65 ans et plus a évalué l'administration concomitante de Prevenar 20 et d'un vaccin à ARNm (à nucléoside modifié) contre la COVID-19. La réponse immunitaire a été comparable entre les participants recevant Prevenar 20 et une solution saline placebo par rapport aux participants recevant Prevenar 20 et le vaccin à ARNm (à nucléoside modifié) contre la COVID-19.
Aucune donnée n'est disponible concernant l'administration concomitante de Prevenar 20 avec d'autres vaccins.
Grossesse, allaitementGrossesse
Aucune donnée n'est disponible concernant l'utilisation de Prevenar 20 chez la femme enceinte.
Les études chez l'animal n'ont pas montré d'indices en faveur d'effets délétères directs ou indirects en lien avec la toxicité sur la reproduction.
L'administration de Prevenar 20 pendant la grossesse ne doit être envisagée que lorsque les bénéfices potentiels l'emportent sur les risques éventuels pour la mère et le fœtus.
Allaitement
On ignore si Prevenar 20 passe dans le lait maternel.
Fertilité
Aucune donnée n'est disponible concernant l'effet de Prevenar 20 sur la fertilité humaine. Les études chez l'animal n'ont pas montré d'indices en faveur d'effets délétères directs ou indirects en lien avec la fertilité des femelles (voir «Données précliniques»).
Effet sur l’aptitude à la conduite et l’utilisation de machinesPrevenar 20 n'a aucune influence ou a une influence négligeable sur l'aptitude à la conduite ou l'utilisation de machines. Toutefois, certains des effets mentionnés dans la rubrique «Effets indésirables» peuvent avoir une influence passagère sur l'aptitude à la conduite ou l'utilisation de machines.
Effets indésirablesRésumé du profil de sécurité
Population pédiatrique
La sécurité de Prevenar 20 a été évaluée dans quatre études randomisées en double aveugle et contrôlées contre principe actif et une étude à un bras menées chez 5987 participants âgés de 6 semaines à <18 ans (une étude de phase 2 et quatre études de phase 3). 3664 participants ont reçu au moins une dose de Prevenar 20 et 2323 participants ont reçu Prevenar 13 (vaccin témoin).
Nourrissons et enfants âgés de 6 semaines à <15 mois
Des études cliniques ont été menées chez des nourrissons et des enfants âgés de 6 semaines à <15 mois en suivant un schéma vaccinal à 3 doses (étude de phase 3 B7471012 [étude 1012]) ou à 4 doses (études de phase 3 B7471011 et B7471013 [études 1011 et 1013] et étude de phase 2 B7471003 [étude 1003]). Dans ces 4 études chez le nourrisson, 5156 participants ont reçu au moins 1 dose de vaccin: 2833 ont reçu Prevenar 20 et 2323 ont reçu Prevenar 13. Au total, environ 90% des participants de chaque groupe ont reçu l'ensemble des doses jusqu'à la dose de rappel spécifique à l'étude. Des réactions locales et des événements systémiques ont été recensés après chaque dose dans toutes les études. De même, dans toutes les études, des événements indésirables ont été recensés dès la 1re dose et jusqu'à 1 mois après la dernière dose pour l'immunisation de base et dès la dose de rappel et jusqu'à un mois après la vaccination. Des événements indésirables graves ont été recensés jusqu'à 1 mois après la dernière dose dans l'étude 1012 et jusqu'à 6 mois après la dernière dose dans les études 1011, 1013 et 1003.
Les taux de réactions locales graves et d'événements systémiques étaient faibles et la plupart des réactions ont disparu en l'espace de 1 à 3 jours. Les proportions en pourcentage de participants ayant présenté des réactions locales et événements systémiques après l'administration de Prevenar 20 étaient en général comparables à celles observées après l'administration de Prevenar 13. Sur la base des données relevées chez les nourrissons, les réactions locales et les événements systémiques les plus fréquemment rapportés après une dose quelconque de Prevenar 20 étaient une irritabilité, un endormissement et des douleurs au site d'injection. Dans ces études, Prevenar 20 était co-administré avec certains vaccins pédiatriques standard ou une administration concomitante était autorisée (voir «Interactions»).
L'étude 1012 était une étude pivot de phase 3 randomisée en double aveugle et contrôlée par principe actif, qui a porté sur 601 nourrissons en bonne santé âgés de 2 mois (≥42 à ≤112 jours), nés après >36 semaines de grossesse et qui ont reçu Prevenar 20 selon un schéma vaccinal à 3 doses. Les événements indésirables les plus fréquemment rapportés (>10%) après une dose quelconque de Prevenar 20 étaient une irritabilité (71.0% à 71.9%), un endormissement/une augmentation du temps de sommeil (50.9% à 61.2%), des douleurs au site d'injection (22.8% à 42.4%), un appétit diminué (24.7% à 39.3%), une rougeur au site d'injection (25.3% à 36.9%), un gonflement au site d'injection (21.4% à 29.8%) et une fièvre ≥38.0 °C (8.9% à 24.3%). La plupart des événements indésirables sont survenus entre 1 et 2 jours après la vaccination, ils étaient d'intensité légère à modérée et de courte durée (1 à 2 jours).
Les études 1011, 1013 et 1003 étaient des études randomisées en double aveugle et contrôlées par principe actif auxquelles ont participé 2232 nourrissons en bonne santé qui ont reçu Prevenar 20 selon un schéma vaccinal à 4 doses. Les événements indésirables les plus fréquemment rapportés (>10%) après une dose quelconque de Prevenar 20 chez les nourrissons étaient une irritabilité (58.5% à 70.6%), un endormissement/une augmentation du temps de sommeil (37.7% à 66.2%), des douleurs au site d'injection (32.8% à 45.5%), un appétit diminué (23.0% à 26.4%), une rougeur au site d'injection (22.6% à 24.5%) et un gonflement au site d'injection (15.1% à 17.6%). La plupart des événements indésirables survenus après la vaccination étaient d'intensité légère à modérée et ont disparu en l'espace de 1 à 3 jours. De rares cas de réactions graves ont été rapportés.
Dans l'étude 1013, la fréquence des réactions locales et les événements systémiques dans le sous-groupe des prématurés (111 nourrissons nés à un âge gestationnel de 34 à <37 semaines) étaient similaire ou inférieure à celle observée chez les nourrissons de l'étude nés à terme. Dans le sous-groupe des prématurés, la fréquence de toutes les réactions locales rapportées dans le groupe Prevenar 20 était comprise entre 31.7% et 55.3%. La fréquence de tous les événements systémiques rapportés était comprise entre 65.0% et 85.5% dans le groupe Prevenar 20.
Enfants âgés de 15 mois à <5 ans
Dans l'étude de phase 3 B7471014 (étude 1014), 831 participants âgés de 15 mois à <18 ans au total ont reçu une dose unique de Prevenar 20 dans quatre catégories d'âge (parmi lesquels 209 participants étaient âgés de 15 à <24 mois, 216 participants étaient âgés de 2 à <5 ans). Les participants de moins de 5 ans avaient auparavant reçu au moins 3 doses de Prevenar 13.
Les événements indésirables les plus fréquemment rapportés (>10%) après une dose quelconque de Prevenar 20 chez les participants âgés de moins de 2 ans étaient une irritabilité (61.8%), des douleurs au site d'injection (52.5%), un endormissement/une augmentation du temps de sommeil (41.7%), une rougeur au site d'injection (37.7%), un appétit diminué (25.0%), un gonflement au site d'injection (22.1%) et une fièvre ≥38.0 °C (11.8%). Chez les participants âgés de 2 ans à <5 ans, les effets indésirables les plus fréquemment constatés étaient des douleurs au site d'injection (66.0%), une rougeur au site d'injection (39.1%), une fatigue (37.2%), des douleurs musculaires (26.5%) et un gonflement au site d'injection (23.3%).
Adultes âgés de >65 ans
La sécurité de Prevenar 20 a été évaluée dans six études cliniques (deux études de phase 1, une étude de phase 2 et trois études principales de phase 3) menées chez 4552 participants âgés de 18 ans et plus, ainsi que chez 2496 participants dans des groupes témoins. L'étude de phase 2 a inclus 443 participants âgés de 60 à 64 ans, parmi lesquels 221 ont reçu Prevenar 20 et 222 faisaient partie du groupe témoin. Deux des études principales de phase 3 ont inclus 4315 participants âgés de 50 ans et plus, dont 2465 dans le groupe Prevenar 20 et 1850 dans les groupes témoins.
Dans les études principales de phase 3, 2465 participants âgés de 50 ans et plus ont reçu Prevenar 20. Parmi eux, 334 participants étaient âgés de 50 à 59 ans et 2131 participants étaient âgés de 60 ans et plus (1138 avaient 65 ans et plus). Parmi les participants âgés de 50 ans et plus ayant reçu Prevenar 20 dans les études principales de phase 3, 1841 n'avaient jamais reçu de vaccin pneumococcique, 253 avaient reçu précédemment un PPSV23 (≥1 à ≤5 ans avant l'inclusion dans l'étude), 246 avaient reçu auparavant uniquement Prevenar 13 (≥6 mois avant l'inclusion dans l'étude) et 125 avaient reçu Prevenar 13, suivi du PPSV23 (administration de la dose de PPSV23 ≥1 an avant l'inclusion dans l'étude).
Les participants à l'étude de phase 3 B7471007 (étude pivot 1007) ont été examinés en vue de détecter des événements indésirables pendant 1 mois après la vaccination, et des événements indésirables graves jusqu'à 6 mois après la vaccination. Cette étude a inclus 445 participants âgés de 50 à 59 ans, 1985 participants âgés de 60 à 64 ans, 624 participants âgés de 65 à 69 ans, 319 participants âgés de 70 à 79 ans et 69 participants âgés de ≥80 ans.
Chez les participants âgés de 50 à 59 ans de l'étude 1007, les effets indésirables les plus fréquemment rapportés étaient les douleurs au site d'injection (72.5%), les douleurs musculaires (49.8%), la fatigue (39.3%), les céphalées (32.3%) et les douleurs articulaires (15.4%). Chez les participants âgés de 60 ans et plus de l'étude 1007, les effets indésirables les plus fréquemment rapportés étaient les douleurs au site d'injection (55.4%), les douleurs musculaires (39.1%), la fatigue (30.2%), les céphalées (21.5%) et les douleurs articulaires (12.6%). Ces effets ont été généralement d'intensité légère ou modérée et ont disparu quelques jours après la vaccination.
Les données de sécurité issues d'une analyse groupée d'adultes de ≥65 ans, qui comprenait aussi bien des participants naïfs de tout vaccin pneumococcique (étude 1007) que des participants ayant précédemment reçu un vaccin pneumococcique (étude 1006), portaient sur 1885 participants, dont 1138 avaient reçu Prevenar 20 et 747 le vaccin témoin. Le profil de sécurité de Prevenar 20 chez les adultes de 65 ans et plus avec ou sans vaccination pneumococcique antérieure était, de manière générale, comparable à celui du vaccin témoin. Chez les participants âgés de 65 ans et plus, les effets indésirables répertoriés dans la classe de systèmes d'organes (SOC) MedDRA Affections cardiaques 1 mois après la vaccination étaient similaires pour Prevenar 20 (9 événements parmi 1138 participants (0.8%)) et le PPSV23 (1 événement parmi 127 participants (0.8%)), mais plus élevés que ceux pour Prevenar 13 (1 événement parmi 620 participants (0.2%)). 6 mois après la vaccination, des événements répertoriés dans la SOC Affections cardiaques ont été rapportés chez 0.5% des participants ayant reçu Prevenar 20 (6 événements parmi 1138 participants).
L'étude de phase 3 B7471006 (étude 1006) a évalué Prevenar 20 chez des participants âgés de 65 ans et plus dont le statut vaccinal pneumococcique antérieur était variable (administration antérieure du PPSV23, de Prevenar 13 ou de Prevenar 13 suivi du PPSV23). La fréquence des effets indésirables les plus fréquemment rapportés chez les participants de cette étude a été similaire à la fréquence de ceux rapportés chez les participants âgés de 60 ans et plus dans l'étude 1007, avec une fréquence légèrement plus élevée de douleurs au site d'injection (61.2%) chez les participants ayant déjà reçu Prevenar 13, et des douleurs articulaires (16.8%) chez les participants ayant déjà reçu Prevenar 13 suivi du PPSV23.
Liste des effets indésirables
Les effets indésirables rapportés chez le nourrisson lors de l'étude de phase 2, ainsi que chez l'enfant (6 semaines à <5 ans) et chez l'adulte lors des études cliniques de phase 3 et après la mise sur le marché sont listés ci-après.
Les effets indésirables sont rangés par classe de système d'organes de la classification MedDRA, en ordre décroissant de fréquence et de sévérité. Les fréquences sont définies comme suit: «très fréquents» (≥1/10), «fréquents» (≥1/100 à <1/10), «occasionnels» (≥1/1000 à <1/100), «rares» (≥1/10'000 à <1/1000), «très rares» (<1/10'000) et «fréquence inconnue» (ne peut être estimée sur la base des données disponibles).
Effets indésirables observés dans les études cliniques
Prevenar 20
Étant donné que Prevenar 20 contient les mêmes conjugués polysaccharidiques capsulaires spécifiques de 13 sérotypes et les mêmes excipients vaccinaux que Prevenar 13, les effets indésirables déjà identifiés pour Prevenar 13 ont été repris pour Prevenar 20. Les effets indésirables rapportés chez le nourrisson lors de l'étude de phase 2, ainsi que chez l'enfant (6 semaines à <5 ans) et chez l'adulte au cours des études de phase 3 avec Prevenar 20 sont listés ci-dessous, sur la base de la fréquence la plus élevée des réactions indésirables, des réactions locales ou des événements systémiques après vaccination dans un groupe Prevenar 20 au sein d'une étude ou dans l'ensemble des données collectées. Les données issues d'études cliniques chez le nourrisson portent sur l'administration concomitante de Prevenar 20 et d'autres vaccins pédiatriques standard. En cas d'effets indésirables constatés dans les études cliniques sur Prevenar 13 mais pas dans les études cliniques sur Prevenar 20, la fréquence est inconnue. Dans les études cliniques, le profil de sécurité de Prevenar 20 a été similaire à celui de Prevenar 13.
Population pédiatrique
Nourrissons et enfants âgés de 6 semaines à <5 ans
Affections du système immunitaire
Fréquence inconnue: Réactions d'hypersensibilité, y compris œdème de la face, dyspnée, bronchospasmea.
Troubles du métabolisme et de la nutrition
Très fréquents: Appétit diminué (39.3%).
Affections psychiatriques
Très fréquents: Irritabilité (71.9%).
Fréquence inconnue: Pleursa.
Affections du système nerveux
Très fréquents: Endormissement/augmentation du temps de sommeil (66.2%).
Occasionnels: Crises convulsives (y compris convulsions fébriles).
Fréquence inconnue: Épisode d'hypotonie-hyporéactivité, sommeil agité/diminuéa.
Affections gastro-intestinales
Fréquents: Diarrhée, vomissement.
Affections de la peau et du tissu sous-cutané
Fréquents: Rash.
Occasionnels: Urticaire ou rash urticarien.
Troubles généraux et anomalies au site d'administration
Très fréquents: Fièvre (pyrexie) (24.3%), douleurs/sensibilité au site d'injection (66.0%), érythème au site d'injection (39.1%), induration/gonflement au site d'injection (29.8%), érythème au site d'injection >2.0 cm-7.0 cm (après la dose de rappel et chez les enfants plus âgés [2 à 5 ans]) (15.3%), induration/gonflement au site d'injection (>2.0–7.0 cm) (après la dose de rappel et chez les enfants plus âgés [2 à 5 ans]) (11.9%).
Fréquents: Fièvre >38.9°C, induration/gonflement au site d'injection >2.0–7.0 cm (après l'immunisation de base chez les nourrissons), érythème au site d'injection >2.0 cm-7.0 cm (après l'immunisation de base chez les nourrissons), douleurs/sensibilité au site d'injection avec mobilité limitée des membres.
Occasionnels: Érythème au site d'injection (>7.0 cm), induration/gonflement au site d'injection (>7.0 cm).
Rares: Hypersensibilité au site d'injectionb.
a Les effets indésirables rapportés dans les études cliniques sur Prevenar 13, mais pas dans celles sur Prevenar 20 sont rangés dans la catégorie «Fréquence inconnue».
b Effet indésirable qui n'a pas été rapporté avec Prevenar 13, bien que des cas d'urticaire au site d'injection, de prurit au site d'injection et de dermite au site d'injection aient été notifiés durant la phase de surveillance suivant la mise sur le marché de Prevenar 13.
Adultes
Affections du système immunitaire
Occasionnels: Réactions d'hypersensibilité, y compris œdème de la face, dyspnée, bronchospasme.
Troubles du métabolisme et de la nutrition
Fréquence inconnue: Appétit diminuéc.
Affections du système nerveux
Très fréquents: Céphalées (36.7%).
Affections gastro-intestinales
Occasionnels: Diarrhéec, nausée, vomissementc.
Affections de la peau et du tissu sous-cutané
Occasionnels: Rashc, angioœdème.
Affections musculosquelettiques et du tissu conjonctif
Très fréquents: Douleur musculaire (62.9%), douleur articulaire (16.8%).
Troubles généraux et anomalies au site d'administration
Très fréquents: Douleurs/sensibilité au site de vaccination (79.2%), fatigue (46.7%).
Fréquents: Induration/gonflement au site de vaccinationc, érythème au site de vaccinationc, fièvre (pyrexie).
Occasionnels: Prurit au site de vaccination, lymphadénopathie, urticaire au site de vaccination, frissonsc.
Fréquence inconnue: Mobilité limitée du brasc.
c Effet indésirable rapporté dans les études cliniques portant sur Prevenar 13 à une fréquence définie comme «très fréquents» (≥1/10). L'appétit diminué et la mobilité limitée du bras n'ont pas été rapportés dans les études de phase 3 portant sur Prevenar 20 chez l'adulte. La fréquence est donc définie comme inconnue.
Informations complémentaires pour certains groupes de personnes
Aucune étude clinique n'a été menée sur Prevenar 20 chez les prématurés. On dispose de données sur la sécurité de Prevenar 13 chez les prématurés.
Concernant le risque d'apnées chez les extrêmes prématurés (avant ou à la 28e semaine de grossesse), voir «Mises en garde et précautions».
Dans une étude qui a comparé environ 100 nourrissons prématurés avec environ 100 nourrissons nés à terme après une immunisation de base par 3 doses de Prevenar 13, les cas d'appétit diminué étaient significativement plus fréquents chez les nourrissons prématurés après la 1re et la 2e dose, tout comme les cas d'irritabilité/mauvaise qualité de sommeil après la 2e dose (voir rubrique «Propriétés/Effets»).
Sécurité lors de l'administration concomitante d'un vaccin
Adultes
Lorsque Prevenar 20 a été administré à des adultes âgés de 65 ans et plus en même temps que la troisième dose (de rappel) d'un vaccin à ARNm (à nucléoside modifié) contre la COVID-19, le profil de tolérance a globalement été similaire à celui du vaccin à ARNm (à nucléoside modifié) contre la COVID-19 administré seul. Peu de différences ont été observées dans le profil de sécurité en comparaison de l'administration de Prevenar 20 seul. Dans l'étude de phase 3 B7471026 (étude 1026), la fièvre (13.0%) et les frissons (26.5%) ont été rapportés comme «très fréquents» lors de l'administration concomitante. Un cas de sensation vertigineuse (0.5%) a par ailleurs été rapporté dans le groupe recevant l'administration concomitante.
Prevenar 13
Adultes de ≥65 ans dans l'étude d'efficacité clinique CAPiTA
Dans le cadre de l'étude CAPiTA, 42'240 personnes âgées de ≥65 ans vaccinées avec Prevenar 13 ont été comparées à 42'256 personnes âgées de ≥65 ans sous placebo.
Parmi les 84'496 participants, 58'072 (68.7%) étaient âgés de ≥65 à <75 ans, 23'481 (27.8%) de ≥75 à <85 ans et 2943 (3.5%) de ≥85 ans. La population globale de sécurité incluait plus d'hommes (55.9%) que de femmes. Les adultes souffrant de maladies qui affaiblissent le système immunitaire ou ceux sous traitement immunosuppresseur, ainsi que les adultes hébergés dans un établissement de soins de longue durée ou nécessitant des soins semi-professionnels, ont été exclus de l'étude. Les adultes souffrant de maladies préexistantes et les personnes ayant des antécédents de tabagisme ont été autorisés à participer. Dans la population de sécurité, 42.3% des sujets présentaient des maladies préexistantes, y compris une affection cardiaque (25.4%), une affection pulmonaire ou de l'asthme (15.1%) et un diabète sucré de type 1 et de type 2 (12.5%). Au début de l'étude, un tabagisme a été rapporté chez 12.3% des sujets.
Dans un sous-groupe de 2011 sujets (1006 personnes vaccinées avec Prevenar 13 et 1005 personnes ayant reçu un placebo), les effets indésirables rapportés sur demande ont été enregistrés sur une période de 7 jours après la vaccination en consignant les événements locaux et systémiques dans des journaux électroniques; les effets indésirables rapportés spontanément ont été collectés sur une période de 28 jours après la vaccination et les effets indésirables graves ont été collectés sur une période de 6 mois après la vaccination. Pour les 41'231 autres sujets vaccinés avec Prevenar 13 et les 41'250 personnes vaccinées avec le placebo, les effets indésirables graves ont été collectés sur une période de 28 jours après la vaccination.
Dans l'étude CAPiTA (sujets âgés de 65 ans et plus), des effets indésirables graves ont été rapportés dans le mois suivant la vaccination chez 327 des 42'237 (0.8%) personnes ayant reçu Prevenar 13 (352 événements) et chez 314 des 42'225 (0.7%) personnes ayant reçu le placebo (337 événements). Dans le sous-groupe de sujets chez lesquels des effets indésirables graves ont été observés sur une période de 6 mois, 70 des 1006 (7%) personnes vaccinées avec Prevenar 13 (90 événements) et 60 des 1005 (6%) personnes vaccinées avec le placebo (69 événements) ont rapporté des effets indésirables graves.
Durant la période de suivi (4 ans en moyenne), le cumul des cas fait apparaître 3006 décès (7.1%) dans le groupe Prevenar 13 et 3005 décès (7.1%) dans le groupe placebo. Dans les 28 jours suivant la vaccination, 10 décès (<0.1%) sont survenus dans le groupe Prevenar 13 et 10 décès (<0.1%) dans le groupe placebo. Durant la période allant de 29 jours à 6 mois après la vaccination, 161 décès (0.4%) sont survenus dans le groupe Prevenar 13 et 144 décès (0.3%) dans le groupe placebo.
Ces données ne fournissent aucun indice d'un lien de causalité entre les décès et la vaccination par Prevenar 13.
Effets indésirables identifiés après la mise sur le marché
Les effets indésirables spontanément rapportés lors de l'utilisation de Prevenar 13 chez l'enfant et l'adulte après la mise sur le marché et pouvant également survenir avec Prevenar 20 sont listés ci-dessous. L'expérience relative à la sécurité de Prevenar 13 après la mise sur le marché est également pertinente pour Prevenar 20, car Prevenar 20 contient les mêmes composants (conjugués polysaccharidiques et excipients) que Prevenar 13. Ces événements ont été rapportés volontairement par une population de taille incertaine. Par conséquent, il n'est pas possible d'estimer de manière fiable leur fréquence et d'établir pour tous les événements un lien de causalité avec l'exposition au vaccin.
Affections hématologiques et du système lymphatique
Fréquence inconnue: Lymphadénopathie localisée dans la région du site d'injection.
Affections du système immunitaire
Fréquence inconnue: Réaction anaphylactique/anaphylactoïde, y compris choc.
Affections de la peau et du tissu sous-cutané
Fréquence inconnue: Angioœdème, érythème polymorphe.
Troubles généraux et anomalies au site d'administration
Fréquence inconnue: Dermite au site d'injection, urticaire au site d'injection, prurit au site d'injection.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageUn surdosage de Prevenar 20 est peu probable en raison de sa présentation sous forme de seringue préremplie.
Propriétés/EffetsCode ATC
J07AL02
Mécanisme d'action
Prevenar 20 contient 20 polyosides capsulaires pneumococciques, tous conjugués à une protéine porteuse CRM197, qui modifie la réponse immunitaire au polyoside, passant d'une réponse indépendante des lymphocytes T à une réponse dépendante des lymphocytes T. La réponse dépendante des lymphocytes T entraîne une augmentation de la réponse en anticorps (IgG) et induit des anticorps fonctionnels (OPA, associés à l'opsonisation, la phagocytose et la destruction des pneumocoques) servant de protection contre les maladies pneumococciques. Par ailleurs, la formation de lymphocytes B à mémoire est induite, ce qui permet une réponse anamnestique (rappel) lors d'une nouvelle exposition à la bactérie.
Les niveaux d'anticorps circulants spécifiques des sérotypes ou le titrage de l'OPA qui sont en corrélation avec la protection contre les maladies pneumococciques n'ont pas été clairement définis.
Pharmacodynamique
Aucune donnée.
Efficacité clinique
Aucune étude d'efficacité n'a été réalisée avec Prevenar 20.
Les études Northern California Kaiser Permanente (NCKP) et Finnish Otitis Media (FinOM) fournissent des données d'efficacité pour Prevenar (PCV7) chez les nourrissons/enfants en bas âge contre les maladies pneumococciques invasives, la pneumonie et l'otite moyenne.
Prevenar 13 a été autorisé sur la base d'une non-infériorité de l'immunogénicité par rapport à PCV7. L'autorisation de Prevenar 20 pour la population pédiatrique repose sur la comparaison de l'ensemble des réponses immunitaires chez les enfants après avoir reçu Prevenar 20 avec la réponse immunitaire après avoir reçu Prevenar 13.
L'effet protecteur de Prevenar 20 chez l'adulte de plus de 65 ans repose sur l'efficacité qui a été démontrée dans l'étude portant sur l'immunisation d'adultes contre les pneumonies communautaires/Community-Acquired Pneumonia Immunization Trial in Adults, CAPiTA, avec un vaccin pneumococcique polysaccharidique conjugué 13-valent (voir «Comparaison des réponses immunitaires à Prevenar 20 et à Prevenar 13»). Pour les sérotypes 8, 10A, 11A, 12F, 15B, 22F et 33F, l'indication pour les adultes âgés de ≥65 ans a été approuvée sur la base des réponses immunitaires mesurées par un test d'opsonophagocytose (OPA).
Données d'immunogénicité
Études cliniques portant sur Prevenar 20 dans la population pédiatrique
L'immunogénicité a été évaluée sur la base des taux de réponse des IgG spécifiques du sérotype (proportion des patients ayant atteint une concentration d'IgG spécifiques du sérotype ≥0.35 μg/ml ou une valeur équivalente spécifique à l'essai) et des MGC d'IgG 1 mois après l'immunisation de base et 1 mois après la dose de rappel. Les MGT de l'OPA ont également été mesurées 1 mois après l'immunisation de base et 1 mois après la dose de rappel. La concentration prédéfinie de 0.35 µg/ml au test ELISA de l'OMS (ou valeur seuil équivalente, spécifique à l'essai) vaut uniquement au niveau de la population et ne peut pas servir pour prédire une protection individuelle ou spécifique au sérotype contre les infections invasives à pneumocoques. Il n'existe pas de corrélation de protection pour la pneumonie et l'otite moyenne aiguë.
Réponses immunitaires aux pneumocoques après 3 et 4 doses d'un schéma vaccinal à 4 doses chez le nourrisson
L'étude 1011 menée aux États-Unis et à Porto Rico a inclus 1991 nourrissons en bonne santé, âgés de 2 mois au moment du consentement (≥42 à ≤98 jours) et nés après >36 semaines de grossesse. Les participants ont été randomisés selon un rapport de 1:1 et ont reçu Prevenar 20 ou Prevenar 13 à l'âge d'environ 2, 4, 6 et 12 à 15 mois. Des vaccins pédiatriques standard ont été co-administrés (voir «Interactions»).
La non-infériorité des proportions de participants présentant des concentrations prédéfinies en IgG spécifiques du sérotype un mois après la troisième dose de l'immunisation de base a été atteinte pour 8 des 13 sérotypes communs et ne l'a pas été pour 5 sérotypes (sérotypes 1, 3, 4, 9V et 23F) sur la base d'un critère de non-infériorité de 10%. Six des 7 sérotypes additionnels ont satisfait au critère de non-infériorité; le sérotype 12F n'a pas satisfait au critère de non-infériorité statistique (tableau 1).
Tableau 1: pourcentage de participants vaccinés qui ont atteint les concentrations prédéfinies en IgG pneumococciques spécifiques du sérotype un mois après la dose 3 (à l'âge de 2, 4, 6 mois), étude 1011a
|
|
Prevenar 20
Nb=831-833
|
Prevenar 13
Nb=801-802
|
Prevenar 20 moins Prevenar 13
| |
|
% (IC à 95%c)
|
% (IC à 95%c)
|
Différence en pourcentaged (IC à 95%d,e)
| |
Sérotypes
| |
1
|
79.8 (76.9, 82.5)
|
88.4 (86.0, 90.5)
|
-8.6 (-12.1, -5.1)
| |
3
|
52.1 (48.6, 55.5)
|
67.6 (64.2, 70.8)
|
-15.5 (-20.1, -10.8)
| |
4
|
79.7 (76.8, 82.4)
|
88.2 (85.7, 90.3)
|
-8.4 (-12.0, -4.9)
| |
5
|
82.5 (79.7, 85.0)
|
86.8 (84.2, 89.1)
|
-4.3 (-7.8, -0.8)
| |
6A
|
93.5 (91.6, 95.1)
|
95.9 (94.3, 97.2)
|
-2.4 (-4.6, -0.2)
| |
6B
|
88.3 (85.9, 90.4)
|
92.4 (90.3, 94.1)
|
-4.1 (-7.0, -1.2)
| |
7F
|
96.6 (95.2, 97.8)
|
97.6 (96.3, 98.6)
|
-1.0 (-2.7, 0.7)
| |
9V
|
81.9 (79.1, 84.4)
|
89.8 (87.5, 91.8)
|
-7.9 (-11.3, -4.6)
| |
14
|
93.4 (91.5, 95.0)
|
94.1 (92.3, 95.7)
|
-0.8 (-3.1, 1.6)
| |
18C
|
92.6 (90.6, 94.2)
|
93.1 (91.2, 94.8)
|
-0.6 (-3.1, 1.9)
| |
19A
|
97.1 (95.7, 98.1)
|
98.1 (96.9, 98.9)
|
-1.0 (-2.6, 0.5)
| |
19F
|
96.9 (95.5, 98.0)
|
96.6 (95.1, 97.8)
|
0.2 (-1.5, 2.0)
| |
23F
|
77.9 (74.9, 80.7)
|
85.5 (82.9, 87.9)
|
-7.6 (-11.4, -3.9)
| |
Sérotypes additionnelsf
| |
8
|
96.8 (95.3, 97.9)
|
f, g
|
11.2 (8.6, 14.0)
| |
10A
|
82.2 (79.5, 84.8)
|
f, g
|
-3.3 (-6.9, 0.3)
| |
11A
|
92.7 (90.7, 94.4)
|
f, g
|
7.1 (4.2, 10.2)
| |
12F
|
48.0 (44.6, 51.5)
|
f, g
|
-37.5 (-41.6, -33.3)
| |
15B
|
98.2 (97.0, 99.0)
|
f, g
|
12.7 (10.2, 15.4)
| |
22F
|
98.3 (97.2, 99.1)
|
f, g
|
12.8 (10.3, 15.5)
| |
33F
|
86.7 (84.2, 88.9)
|
f, g
|
1.1 (-2.2, 4.5)
|
Abréviations: IC = intervalle de confiance, IgG = immunoglobuline G.
Remarque: les concentrations prédéfinies en IgG étaient ≥0.35 µg/ml pour tous les sérotypes, à l'exception des sérotypes 5, 6B, 12F et 19A, qui atteignaient respectivement une concentration ≥0.23 µg/ml, ≥0.10 µg/ml, ≥0.69 µg/ml et ≥0.12 µg/ml.
a NCT04382326.
b N = nombre de participants avec résultats d'analyse valides. Ces valeurs sont les dénominateurs pour les calculs des pourcentages correspondants.
c Intervalle de confiance bilatéral exact, selon la méthode de Clopper-Pearson.
d La non-infériorité pour un sérotype était confirmée lorsque la limite inférieure de l'IC bilatéral pour la différence en pourcentage (Prevenar 20 moins Prevenar 13) était >10% (critère de non-infériorité de 10%) pour ce sérotype.
e IC bilatéral selon la méthode de Miettinen et Nurminen pour la différence entre les proportions, exprimé en pourcentage.
f Pour les 7 sérotypes additionnels, le pourcentage de participants présentant la concentration en IgG prédéfinie pour le sérotype 23F (sérotype de Prevenar 13 présentant le pourcentage le plus faible, à l'exception du sérotype 3) dans le groupe Prevenar 13 a été utilisé pour le calcul de la différence en pourcentage.
g Pour les 7 sérotypes additionnels, la proportion en pourcentage de participants avec concentrations en IgG prédéfinies pour les sérotypes 8, 10A, 11A, 12F, 15B, 22F et 33F dans le groupe Prevenar 13 était de 1.6%, 1.2%, 1.5%, 0.1%, 2.6%, 0.9% et 1.1%.
Un mois après la quatrième dose (rappel), aucune des MGC des IgG pour Prevenar 20 n'était inférieure à celles de Prevenar 13 et ce pour les 13 sérotypes communs, sur la base d'un critère de non-infériorité double (limite inférieure de l'IC bilatéral <0.5). Aucune des MGC des IgG pour les 7 sérotypes additionnels n'était inférieure à la MGC des IgG la plus faible pour les sérotypes Prevenar 13 (à l'exception du sérotype 3) sur la base d'un critère de non-infériorité double (tableau 2). Cela valait également pour les MGC des IgG pour Prevenar 20 un mois après la troisième dose de l'immunisation de base (tableau 3).
Tableau 2: MGC des IgG pneumococciques spécifiques du sérotype (µg/ml) et coefficients de MGC un mois après la dose 4 chez les participants vaccinés à l'âge de 2, 4, 6 et 12 à 15 mois, étude 1011a
|
|
Prevenar 20
Nb=753-755
|
Prevenar 13
Nb=744-745
|
Prevenar 20/Prevenar 13
| |
|
MGCc (IC à 95%c)
|
MGCc (IC à 95%c)
|
Coefficient de MGCd (IC à 95%d,e)
| |
Sérotypes
| |
1
|
1.47 (1.37, 1.57)
|
2.12 (1.97, 2.27)
|
0.69 (0.63, 0.76)
| |
3
|
0.56 (0.53, 0.60)
|
0.85 (0.80, 0.90)
|
0.66 (0.61, 0.73)
| |
4
|
3.77 (3.52, 4.04)
|
4.84 (4.50, 5.22)
|
0.78 (0.70, 0.86)
| |
5
|
1.87 (1.74, 2.00)
|
2.51 (2.33, 2.70)
|
0.74 (0.67, 0.82)
| |
6A
|
9.01 (8.45, 9.61)
|
11.69 (10.91, 12.53)
|
0.77 (0.70, 0.85)
| |
6B
|
4.01 (3.70, 4.35)
|
5.74 (5.27, 6.24)
|
0.70 (0.62, 0.79)
| |
7F
|
3.91 (3.70, 4.14)
|
5.18 (4.88, 5.49)
|
0.76 (0.70, 0.82)
| |
9V
|
3.44 (3.23, 3.67)
|
4.30 (4.02, 4.59)
|
0.80 (0.73, 0.88)
| |
14
|
5.68 (5.27, 6.12)
|
6.34 (5.88, 6.83)
|
0.90 (0.81, 1.00)
| |
18C
|
3.46 (3.24, 3.70)
|
4.69 (4.34, 5.05)
|
0.74 (0.67, 0.82)
| |
19A
|
3.53 (3.30, 3.77)
|
4.13 (3.84, 4.45)
|
0.85 (0.77, 0.94)
| |
19F
|
5.01 (4.68, 5.36)
|
5.79 (5.36, 6.25)
|
0.86 (0.78, 0.96)
| |
23F
|
3.95 (3.63, 4.31)
|
6.18 (5.66, 6.75)
|
0.64 (0.57, 0.72)
| |
Sérotypes additionnelsf
| |
8
|
3.97 (3.73, 4.22)
|
f, g
|
1.87 (1.71, 2.06)
| |
10A
|
6.22 (5.75, 6.72)
|
f, g
|
2.94 (2.64, 3.26)
| |
11A
|
3.53 (3.31, 3.78)
|
f, g
|
1.67 (1.51, 1.84)
| |
12F
|
1.85 (1.73, 1.99)
|
f, g
|
0.88 (0.79, 0.97)
| |
15B
|
12.59 (11.78, 13.45)
|
f, g
|
5.95 (5.39, 6.55)
| |
22F
|
10.60 (9.92, 11.33)
|
f, g
|
5.01 (4.54, 5.52)
| |
33F
|
9.31 (8.71, 9.96)
|
f, g
|
4.40 (3.99, 4.85)
|
Abréviations: IC = intervalle de confiance, MGC = moyenne géométrique des concentrations, IgG = immunoglobuline G, LIQ = limite inférieure de quantification.
Remarque: les résultats d'étude inférieurs à la LIQ ont été fixés à 0.5 × LIQ pour l'analyse.
a NCT04382326.
b N = nombre de participants avec concentrations en IgG valides.
c Les MGC et les IC bilatéraux ont été calculés en potentialisant les moyennes des logarithmes des concentrations et des IC correspondants (sur la base du test-t de Student).
d La non-infériorité pour un sérotype était confirmée lorsque la limite inférieure de l'IC bilatéral pour le coefficient MGC IgG (Prevenar 20/Prevenar 13) était >0.5 (critère de non-infériorité double) pour ce sérotype.
e Les IC bilatéraux ont été calculés en potentialisant les différences moyennes des logarithmes des concentrations en IgG (Prevenar 20 moins Prevenar 13) et des IC correspondants (sur la base du test-t de Student).
f Pour les 7 sérotypes additionnels, la MGC des IgG pour le sérotype 1 (sérotype de Prevenar 13 présentant la MGC des IgG la plus faible, à l'exception du sérotype 3) dans le groupe Prevenar 13 a été prise en compte dans le calcul du coefficient de MGC.
g Pour les 7 sérotypes additionnels, les MGC des IgG pour les sérotypes 8, 10A, 11A, 12F, 15B, 22F et 33F dans le groupe Prevenar 13 étaient respectivement de 0.03 µg/ml, 0.01 µg/ml, 0.02 µg/ml, 0.01 µg/ml, 0.02 µg/ml, 0.00 µg/ml et 0.01 µg/ml.
Tableau 3: MGC des IgG pneumococciques spécifiques du sérotype (µg/ml) et coefficients de MGC un mois après la dose 3 chez les participants vaccinés à l'âge de 2, 4, 6 et 12 à 15 mois, étude 1011a
|
Sérotype pneumococcique
|
Prevenar 20
Nb=831-833
|
Prevenar 13
Nb=801-802
|
Prevenar 20/Prevenar 13
| |
|
MGCc (IC à 95% KIc)
|
MGCc (IC à 95%c)
|
Coefficient de MGCd (IC à 95%d,e)
| |
Sérotypes
| |
1
|
0.74 (0.70, 0.79)
|
1.14 (1.06, 1.22)
|
0.65 (0.59, 0.72)
| |
3
|
0.36 (0.33, 0.38)
|
0.51 (0.48, 0.55)
|
0.70 (0.64, 0.76)
| |
4
|
0.75 (0.70, 0.81)
|
1.08 (1.00, 1.17)
|
0.70 (0.63, 0.78)
| |
5
|
0.66 (0.61, 0.71)
|
0.96 (0.88, 1.04)
|
0.69 (0.61, 0.77)
| |
6A
|
1.95 (1.81, 2.10)
|
2.69 (2.48, 2.92)
|
0.72 (0.65, 0.81)
| |
6B
|
0.61 (0.55, 0.68)
|
1.02 (0.91, 1.14)
|
0.60 (0.51, 0.70)
| |
7F
|
1.71 (1.62, 1.81)
|
2.29 (2.16, 2.43)
|
0.75 (0.69, 0.81)
| |
9V
|
0.87 (0.81, 0.93)
|
1.21 (1.12, 1.30)
|
0.72 (0.65, 0.80)
| |
14
|
2.16 (2.01, 2.33)
|
2.72 (2.51, 2.95)
|
0.79 (0.71, 0.89)
| |
18C
|
1.31 (1.23, 1.39)
|
1.71 (1.59, 1.84)
|
0.77 (0.70, 0.84)
| |
19A
|
0.72 (0.67, 0.76)
|
0.91 (0.85, 0.97)
|
0.79 (0.72, 0.86)
| |
19F
|
1.59 (1.50, 1.67)
|
2.00 (1.88, 2.12)
|
0.79 (0.73, 0.86)
| |
23F
|
0.82 (0.75, 0.90)
|
1.25 (1.14, 1.37)
|
0.66 (0.58, 0.75)
| |
Sérotypes additionnelsf
| |
8
|
1.80 (1.70, 1.91)
|
f, g
|
1.98 (1.81, 2.16)
| |
10A
|
1.21 (1.09, 1.33)
|
f, g
|
1.32 (1.18, 1.49)
| |
11A
|
1.39 (1.30, 1.48)
|
f, g
|
1.52 (1.39, 1.67)
| |
12F
|
0.55 (0.50, 0.60)
|
f, g
|
0.60 (0.54, 0.67)
| |
15B
|
4.40 (4.11, 4.71)
|
f, g
|
4.82 (4.39, 5.30)
| |
22F
|
3.71 (3.45, 3.99)
|
f, g
|
4.06 (3.68, 4.48)
| |
33F
|
1.49 (1.36, 1.64)
|
f, g
|
1.64 (1.46, 1.83)
|
Abréviations: IC = intervalle de confiance, MGC = moyenne géométrique des concentrations, IgG = immunoglobuline G, LIQ = limite inférieure de quantification.
Remarque: les résultats d'étude inférieurs à la LIQ ont été fixés à 0.5 × LIQ pour l'analyse.
a NCT04382326.
b N = nombre de participants avec concentrations en IgG valides.
c Les MGC et les IC bilatéraux ont été calculés en potentialisant les moyennes des logarithmes des concentrations et des IC correspondants (sur la base du test-t de Student).
d La non-infériorité pour un sérotype était confirmée lorsque la limite inférieure de l'IC bilatéral pour le coefficient MGC IgG (Prevenar 20/Prevenar 13) était >0.5 (critère de non-infériorité double) pour ce sérotype.
e Les IC bilatéraux ont été calculés en potentialisant les différences moyennes des logarithmes des concentrations en IgG (Prevenar 20 moins Prevenar 13) et des IC correspondants (sur la base du test-t de Student).
f Pour les 7 sérotypes additionnels, la MGC des IgG pour le sérotype 19A (sérotype de Prevenar 13 présentant la MGC des IgG la plus faible, à l'exception du sérotype 3) dans le groupe Prevenar 13 a été prise en compte dans le calcul du coefficient de MGC.
g Pour les 7 sérotypes additionnels, les MGC des IgG pour les sérotypes 8, 10A, 11A, 12F, 15B, 22F et 33F dans le groupe Prevenar 13 étaient respectivement de 0.02 µg/ml, 0.01 µg/ml, 0.02 µg/ml, 0.01 µg/ml, 0.03 µg/ml, 0.01 µg/ml et 0.02 µg/ml.
Les MGT de l'OPA pour les 13 sérotypes communs ont été évaluées un mois après la troisième dose de l'immunisation de base et un mois après la dose de rappel selon une approche descriptive auprès d'un sous-groupe de participants.
Un mois après la troisième dose de l'immunisation de base, les MGT de l'OPA pour les 13 sérotypes communs dans le groupe Prevenar 20 étaient comprises entre 26 (sérotype 1) et 1222 (sérotype 7F), tandis que les MGT de l'OPA dans le groupe Prevenar 13 étaient comprises entre 34 (sérotype 1) et 1149 (sérotype 7F). Un mois après la dose de rappel, les MGT de l'OPA pour les 13 sérotypes communs dans le groupe Prevenar 20 étaient légèrement inférieures aux MGT de l'OPA dans le groupe Prevenar 13, à savoir respectivement entre 36 (sérotype 1) et 2609 (sérotype 9V) et entre 66 (sérotype 1) et 3210 (sérotype 9V).
Les MGT de l'OPA observées étaient nettement supérieures dans le groupe Prevenar 20 par rapport au groupe Prevenar 13 et ce pour les 7 sérotypes additionnels et les deux dates d'observation.
Réponses immunitaires pneumococciques après 2 et 3 doses d'un schéma vaccinal à 3 doses chez le nourrisson
L'étude 1012 a porté sur l'immunogénicité de Prevenar 20 chez 1204 nourrissons en Europe et en Australie. Dans ce cadre, une série de 2 doses (immunisation de base) et 1 dose de rappel ont été administrées à des nourrissons âgés de 2 mois (≥42 à ≤112 jours) nés après >36 semaines de grossesse. Les participants ont été randomisés selon un rapport de 1:1 et ont reçu soit Prevenar 20, soit Prevenar 13, la première dose ayant été administrée à un âge compris entre 42 et 112 jours, une deuxième dose après environ 2 mois et la troisième dose (rappel) à un âge d'environ 11 à 12 mois. Pendant ces visites, les participants recevaient également d'autres vaccins.
Les réponses immunitaires déclenchées par Prevenar 20 ont été évaluées à l'aide des MGC de l'IgG, du pourcentage de participants avec concentrations prédéfinies en IgG et des moyennes géométriques des titres (MGT) de l'OPA pour les 20 sérotypes présents dans le vaccin.
Un mois après la deuxième dose de l'immunisation de base avec Prevenar 20, les MGC de l'IgG observées présentaient une non-infériorité par rapport à celles du groupe Prevenar 13 pour 9 des 13 sérotypes communs, tandis que 4 des 13 sérotypes communs (6A, 6B, 9V et 23F) ne satisfaisaient pas au double critère statistique de non-infériorité.
Le pourcentage de participants avec concentrations en IgG spécifiques du sérotype prédéfinies un mois après la deuxième dose de l'immunisation de base avec Prevenar 20 présentaient une non-infériorité par rapport à celui du groupe Prevenar 13 pour 4 des 13 sérotypes communs, sur la base d'un critère de non-infériorité différentiel de 10%, tandis que 9 des 13 sérotypes communs (1, 3, 4, 5, 6A, 6B, 9V, 18C et 23F) ne satisfaisaient pas au critère de non-infériorité.
Pour les 7 sérotypes additionnels, la proportion de participants avec concentrations en IgG spécifiques du sérotype prédéfinies un mois après la deuxième dose de l'immunisation de base avec Prevenar 20 ne présentait pas d'infériorité, pour 5 des 7 sérotypes supplémentaires, au sérotype présentant la proportion la plus faible parmi les 13 sérotypes (sérotype 6B) dans le groupe Prevenar 13; les sérotypes 10A et 12F ne satisfaisaient pas au critère de non-infériorité. La pertinence clinique de ces résultats n'est pas connue.
Par ailleurs, les MGC de l'IgG pour les 7 sérotypes additionnels après deux doses de l'immunisation de base étaient supérieures aux MGC de l'IgG pour les sérotypes correspondants dans le groupe Prevenar 13.
Un mois après la troisième dose (rappel), les MGC de l'IgG observées pour Prevenar 20 ne montraient aucune infériorité par rapport à celles du groupe Prevenar 13 pour 12 des 13 sérotypes communs, à l'exception du sérotype 6B et aucun des 7 sérotypes additionnels n'était inférieur à la MGC de l'IgG la plus faible dans le groupe Prevenar 13. En outre, les MGC de l'IgG après la troisième dose (rappel) étaient supérieures aux MGC de l'IgG des sérotypes correspondants du groupe Prevenar 13, pour les 7 sérotypes additionnels.
La réponse fonctionnelle, mesurée par les MGT OPA pour les 13 sérotypes communs un mois après la deuxième dose de l'immunisation de base, était comprise entre 14 (sérotype 1) et 858 (sérotype 7F) dans le groupe Prevenar 20 et entre 23 (sérotype 1) et 895 (sérotype 7F) dans le groupe Prevenar 13. Les MGT OPA mesurées pour les 13 sérotypes communs un mois après la dose de rappel étaient comprises entre 54 (sérotype 1) et 3254 (sérotype 9V) dans le groupe Prevenar 20 et entre 82 (sérotype 5) et 4544 (sérotype 9V) dans le groupe Prevenar 13. Les MGT OPA pour les 7 sérotypes additionnels dans le groupe Prevenar 20 étaient supérieures à celles dans le groupe Prevenar 13 un mois après la deuxième dose de l'immunisation de base et après la dose de rappel.
Une augmentation des réponses en anticorps IgG et OPA a été observée pour les 20 sérotypes après la 2e et la 3e doses de Prevenar 20, y compris pour ceux qui n'avaient pas satisfait au critère de non-infériorité, indiquant ainsi une activation de la mémoire immunologique.
Enfants âgés de 12 mois à <5 ans ayant déjà reçu Prevenar 13
Enfants âgés de 12 mois à <24 mois
Une étude de phase 3 multicentrique, randomisée partiellement en double aveugle (étude B7471027) s'est intéressée à l'immunogénicité de 356 enfants âgés de 12 mois à <24 mois, qui avaient déjà reçu 2 doses de Prevenar 13 lorsqu'ils étaient nourrissons. Les participants ont reçu une seule dose de rappel ou 2 doses de rappel de Prevenar 20 ou une dose de rappel de Prevenar 13. Dans le groupe qui a reçu 2 doses de Prevenar 20, la deuxième dose était administrée environ 2 mois après la dose 1.
Après 1 ou 2 doses de Prevenar 20, des réponses immunitaires IgG ont été observées pour les 7 sérotypes additionnels, les réponses IgG aux 7 sérotypes additionnels se révélant supérieures en nombre après 2 doses de Prevenar 20 qu'après une seule dose. Un mois après une dose unique de Prevenar 20, le taux de participants présentant une concentration prédéfinie en IgG spécifique du sérotype (≥0.35 µg/ml) pour les 7 sérotypes additionnels était compris entre 54.6% (sérotype 12F) et 98.1% (sérotype 8). Un mois après la deuxième dose de Prevenar 20, le taux de participants avec une concentration prédéfinie en IgG spécifique du sérotype atteignait ≥91.2% (sérotype 12F).
S'agissant des réponses immunitaires IgG aux 13 sérotypes communs avec Prevenar 20, les MGC de l'IgG observées pour la plupart des 13 sérotypes communs après 1 dose de Prevenar 20 étaient numériquement supérieures aux MGC de l'IgG observées après 2 doses de Prevenar 20.
Les MGC de l'IgG observées pour les 13 sérotypes communs 1 mois après la dernière vaccination étaient inférieures après 1 ou 2 doses de Prevenar 20 par rapport à celles observées après 1 dose de Prevenar 13.
Enfants âgés de 15 mois à <5 ans
Dans une étude multicentrique à un seul bras (étude 1014), les participants ont été inclus par catégorie d'âge (environ 200 participants par groupe) et ont reçu une dose unique de Prevenar 20 comme décrit ci-dessous.
Dans les catégories d'âge de 15 à <24 mois et de 2 ans à <5 ans, les participants avaient auparavant été vaccinés avec 3 ou 4 doses de Prevenar 13.
Chez les participants âgés de 15 mois à <24 mois, une augmentation des MGC de l'IgG a été observée entre la période précédant la vaccination et 1 mois après la vaccination par Prevenar 20 pour les 20 sérotypes du vaccin. Les GMFR (geometric mean fold rise) de l'IgG observés pour les 7 sérotypes additionnels étaient compris entre 27.9 et 1847.7. Chez les enfants âgés de 15 mois à <24 mois, 83.2% à 100.0% des participants présentaient des concentrations prédéfinies en IgG (≥0.35 µg/ml) sur 6 des 7 sérotypes additionnels, 40.0% pour le sérotype 12F.
Chez les participants âgés de 24 mois à <5 ans, une augmentation des concentrations en IgG a été observée entre la période précédant la vaccination jusqu'à 1 mois après la vaccination par Prevenar 20 pour les 20 sérotypes du vaccin. Les GMFR de l'IgG observés pour les 7 sérotypes additionnels étaient compris entre 36.6 et 796.2.
Nourrissons prématurés
La sécurité et la tolérance de Prevenar 20 ont été examinées dans l'étude 1013, qui a inclus 111 prématurés tardifs (>34 à <37 semaines de grossesse) parmi l'ensemble de la population d'étude. Les participants ont été randomisés et ont reçu Prevenar 20 (N=77) ou Prevenar 13 (N=34) selon un schéma vaccinal à 4 doses. Aucune étude spécifique pour la description de l'immunogénicité de Prevenar 20 chez le prématuré n'a été menée. Sur la base des expériences accumulées avec Prevenar et Prevenar 13, des réponses immunitaires sont induites chez les prématurés, mais peuvent être moins fortes que chez les nourrissons nés à terme.
Études cliniques portant sur Prevenar 20 chez l'adulte
Trois études cliniques principales de phase 3, B7471006, B7471007 et B7471008 (étude 1006, étude 1007 et étude 1008), ont été menées aux États-Unis et en Suède en vue d'évaluer l'immunogénicité de Prevenar 20 dans différents groupes d'âge d'adultes et chez des participants qui étaient soit naïfs de vaccin pneumococcique, soit précédemment vaccinés avec Prevenar 13, le PPSV23 ou les deux.
Chaque étude a inclus des participants qui étaient en bonne santé ou immunocompétents présentant des affections sous-jacentes stables, parmi lesquelles une maladie cardiovasculaire chronique, des affections pulmonaires chroniques, des affections rénales, un diabète sucré, une affection hépatique chronique, ainsi que des facteurs de risque médicaux et des comportements (par ex., tabagisme) connus pour augmenter le risque de pneumonie pneumococcique grave et d'infection invasive à pneumocoques. Dans l'étude pivot (étude 1007), ces facteurs de risque ont été identifiés chez 34% des participants âgés de 60 ans et plus. Un état médical stable était défini comme une affection n'ayant pas nécessité de modification significative du traitement au cours des 6 semaines précédentes (c'est-à-dire pas de passage à une nouvelle catégorie de traitement en raison de l'aggravation de la maladie) et sans hospitalisation pour aggravation de la maladie dans les 12 semaines précédant l'administration du vaccin à l'étude.
Dans toutes les études, les réponses immunitaires provoquées par Prevenar 20 et les vaccins pneumococciques témoins ont été mesurées grâce à un test d'opsonophagocytose (opsonophagocytic activity assay, OPA). Le test d'OPA mesure les anticorps fonctionnels contre S. pneumoniae.
Comparaison des réponses immunitaires à Prevenar 20 et à Prevenar 13 et au PPSV23
Dans le cadre d'une étude clinique de noninfériorité, randomisée, contrôlée contre comparateur actif, en double aveugle (étude pivot 1007) portant sur Prevenar 20, des participants de 18 ans et plus, naïfs de vaccin pneumococcique, ont été inclus dans 1 des 3 cohortes en fonction de leur âge au moment de l'inclusion (18 à 49 ans, 50 à 59 ans et ≥60 ans) et ont été randomisés pour recevoir Prevenar 20 ou intégrer le groupe témoin. Les participants âgés de 60 ans et plus ont été randomisés selon un rapport de 1:1 pour recevoir Prevenar 20 (n=1507) suivi, 1 mois plus tard, d'une solution saline placebo, ou Prevenar 13 (n=1490) suivi, un mois plus tard, du PPSV23.
Les moyennes géométriques des titres (MGT) de l'OPA spécifiques du sérotype ont été mesurées avant la première vaccination et 1 mois après chaque vaccination. La noninfériorité de la réponse immunitaire (MGT de l'OPA 1 mois après la vaccination) sous Prevenar 20 par rapport à un vaccin témoin pour un sérotype a été constatée lorsque la limite inférieure de l'intervalle de confiance (IC) bilatéral à 95% pour le rapport des MGT (Prevenar 20/Prevenar 13; Prevenar 20/PPSV23) était supérieure à 0.5 pour le sérotype correspondant.
Un mois après la vaccination, les réponses immunitaires aux 13 sérotypes communs provoquées par Prevenar 20 étaient non inférieures à celles provoquées par Prevenar 13 pour les mêmes sérotypes chez les participants âgés de 60 ans et plus. De manière générale, des moyennes géométriques des titres numériquement plus faibles ont été observées avec Prevenar 20 en comparaison de Prevenar 13 dans les sérotypes communs (tableau 4). La pertinence clinique de ces résultats n'est toutefois pas connue.
Un mois après la vaccination, les réponses immunitaires à 6 des 7 sérotypes additionnels provoquées par Prevenar 20 étaient non inférieures à celles provoquées par le PPSV23 pour les mêmes sérotypes. La réponse immunitaire au sérotype 8 n'a pas satisfait au critère statistique prédéfini pour la noninfériorité. (La limite inférieure de l'IC bilatéral à 95% pour le rapport des MGT est de 0.49 au lieu de >0.50, tableau 4). La pertinence clinique de cette observation n'est pas connue. Des analyses complémentaires pour d'autres critères d'évaluation du sérotype 8 dans le groupe Prevenar 20 ont montré des résultats favorables. Il s'agit notamment d'une augmentation de 22.1 du facteur de séroconversion (GMFR) entre avant la vaccination et 1 mois après la vaccination, d'une augmentation de ≥4 fois des titres OPA entre avant la vaccination et 1 mois après la vaccination chez 77.8% des participants, et de l'obtention de titres OPA ≥LIQ 1 mois après la vaccination chez 92.9% des participants.
Tableau 4: MGT OPA 1 mois après la vaccination chez les participants âgés de 60 ans et plus après l'administration de Prevenar 20 en comparaison de Prevenar 13 pour les 13 sérotypes communs et en comparaison du PPSV23 pour les 7 sérotypes additionnels (étude 1007)a,b,c,d
|
|
Prevenar 20
(n=1157–1430)
|
Prevenar 13
(n=1390–1419)
|
PPSV23
(n=1201–1319)
|
Comparaison entre les vaccins
| |
|
MGTe
|
MGTe
|
MGTe
|
Rapport des MGTe
|
IC à 95%e
| |
Sérotype
|
| |
1
|
123
|
154
|
|
0.80
|
0.71; 0.90
| |
3
|
41
|
48
|
|
0.85
|
0.78; 0.93
| |
4
|
509
|
627
|
|
0.81
|
0.71; 0.93
| |
5
|
92
|
110
|
|
0.83
|
0.74; 0.94
| |
6A
|
889
|
1165
|
|
0.76
|
0.66; 0.88
| |
6B
|
1115
|
1341
|
|
0.83
|
0.73; 0.95
| |
7F
|
969
|
1129
|
|
0.86
|
0.77; 0.96
| |
9V
|
1456
|
1568
|
|
0.93
|
0.82; 1.05
| |
14
|
747
|
747
|
|
1.00
|
0.89; 1.13
| |
18C
|
1253
|
1482
|
|
0.85
|
0.74; 0.97
| |
19A
|
518
|
645
|
|
0.80
|
0.71; 0.90
| |
19F
|
266
|
333
|
|
0.80
|
0.70; 0.91
| |
23F
|
277
|
335
|
|
0.83
|
0.70; 0.97
| |
Sérotypes additionnels
|
| |
8
|
466
|
|
848
|
0.55
|
0.49; 0.62
| |
10A
|
2008
|
|
1080
|
1.86
|
1.63; 2.12
| |
11A
|
4427
|
|
2535
|
1.75
|
1.52; 2.01
| |
12F
|
2539
|
|
1717
|
1.48
|
1.27; 1.72
| |
15B
|
2398
|
|
769
|
3.12
|
2.62; 3.71
| |
22F
|
3666
|
|
1846
|
1.99
|
1.70; 2.32
| |
33F
|
5126
|
|
3721
|
1.38
|
1.21; 1.57
|
Abréviations: IC = intervalle de confiance, MGT = moyenne géométrique des titres, LIQ = limite inférieure de quantification, n = nombre de participants, OPA = activité opsonophagocytaire (opsonophagocytic activity), PPSV23 = vaccin pneumococcique polysaccharidique, 23-valent (pneumococcal polysaccharide vaccine, 23-valent).
a L'étude 1007 a été menée aux États-Unis et en Suède.
b La noninfériorité pour un sérotype était confirmée si la limite inférieure de l'IC bilatéral à 95% pour le rapport des MGT (rapport Prevenar 20/vaccin comparateur) était supérieure à 0.5 (critère de noninfériorité de 2 fois).
c Les résultats des tests inférieurs à la LIQ ont été fixés à 0.5 × LIQ pour l'analyse.
d Population évaluable pour l'immunogénicité.
e Les MGT et les rapports des MGT avec les IC bilatéraux associés étaient basés sur l'analyse des titres OPA transformés en logarithme à l'aide d'un modèle de régression avec le groupe vaccinal, le sexe, le statut relatif au tabagisme, l'âge au moment de la vaccination en années et les titres OPA transformés en logarithme à l'inclusion.
Une analyse post-hoc de l'étude 1007 chez les participants âgés de 65 ans et plus a été réalisée afin d'évaluer les titres OPA spécifiques des sérotypes 1 mois après l'administration de Prevenar 20 en comparaison de Prevenar 13 pour les 13 sérotypes communs et du PPSV23 pour les 7 sérotypes additionnels de ce groupe. Les RMG (ratio des moyennes géométriques) de l'OPA pour chaque sérotype ont été résumés en utilisant le même modèle de régression linéaire que celui utilisé pour l'analyse des cibles primaires d'immunogénicité dans la population de l'étude âgée de 60 ans et plus. En appliquant une marge de non-infériorité de 2 fois (limites inférieures de l'IC bilatéral à 95% pour les RMG de l'OPA basées sur un modèle >0.5) aux résultats comme dans l'analyse primaire, les 20 sérotypes auraient tous atteint la non-infériorité statistique de Prevenar 20 par rapport à Prevenar 13 (ou au PPSV23) chez les sujets de ≥65 ans.
Immunogénicité de Prevenar 20 chez les adultes ayant déjà reçu un vaccin pneumococcique
Une étude clinique de phase 3 randomisée et ouverte (étude 1006) a décrit la réponse immunitaire à Prevenar 20 chez des participants âgés de 65 ans et plus qui avaient été préalablement vaccinés avec le PPSV23, Prevenar 13, ou Prevenar 13 suivi du PPSV23. Les centres d'essai aux États-Unis ont inclus des participants qui avaient été précédemment vaccinés avec Prevenar 13 (Prevenar 13 uniquement ou suivi du PPSV23), tandis que les centres d'essai en Suède ont inclus des participants qui avaient précédemment reçu le PPSV23 uniquement (35.5% dans cette catégorie).
Chez les participants âgés de 65 ans et plus ayant déjà été vaccinés avec un vaccin pneumococcique, Prevenar 20 a déclenché des réponses immunitaires aux 20 sérotypes du vaccin (tableau 5). Les réponses immunitaires étaient plus faibles dans les deux groupes chez les participants qui avaient été préalablement vaccinés avec le PPSV23.
Tableau 5: MGT OPA pour les pneumocoques avant la vaccination et 1 mois après la vaccination avec Prevenar 20 chez les participants âgés de 65 ans et plus ayant déjà reçu un vaccin pneumococcique (étude 1006)a,b,c,d
|
|
Vaccination antérieure uniquement avec le PPSV23
|
Vaccination antérieure uniquement avec Prevenar 13
|
Vaccination antérieure avec Prevenar 13 et le PPSV23
| |
Avant la vaccination
(n=208-247)
|
Après la vaccination
(n=216-246)
|
Avant la vaccination
(n=210-243)
|
Après la vaccination
(n=201-243)
|
Avant la vaccination
(n=106-121)
|
Après la vaccination
(n=102-121)
| |
MGT
(IC à 95%)e
|
MGT
(IC à 95%)e
|
MGT
(IC à 95%)e
|
MGT
(IC à 95%)e
|
MGT
(IC à 95%)e
|
MGT
(IC à 95%)e
| |
Sérotype
| |
1
|
24
(20; 28)
|
51
(42; 62)
|
34
(28; 41)
|
115
(96; 138)
|
42
(32; 56)
|
82
(61; 110)
| |
3
|
13
(11; 15)
|
31
(27; 36)
|
15
(13; 18)
|
54
(47; 63)
|
20
(17; 25)
|
39
(32; 48)
| |
4
|
29
(23; 35)
|
150
(118; 190)
|
67
(53; 84)
|
335
(274; 410)
|
73
(53; 101)
|
194
(143; 262)
| |
5
|
27
(24; 31)
|
63
(53; 75)
|
38
(32; 44)
|
87
(73; 104)
|
47
(37; 59)
|
83
(65; 108)
| |
6A
|
57
(46; 70)
|
749
(577; 972)
|
125
(99; 158)
|
1081
(880; 1327)
|
161
(116; 224)
|
1085
(797; 1478)
| |
6B
|
107
(86; 133)
|
727
(574; 922)
|
174
(138; 219)
|
1159
(951; 1414)
|
259
(191; 352)
|
1033
(755; 1415)
| |
7F
|
156
(132; 184)
|
378
(316; 452)
|
210
(175; 251)
|
555
(467; 661)
|
206
(164; 258)
|
346
(277; 432)
| |
9V
|
203
(171; 241)
|
550
(454; 667)
|
339
(282; 408)
|
1085
(893; 1318)
|
352
(270; 459)
|
723
(558; 938)
| |
14
|
212
(166; 270)
|
391
(315; 486)
|
282
(224; 356)
|
665
(554; 798)
|
336
(238; 473)
|
581
(434; 777)
| |
18C
|
173
(137; 218)
|
552
(445; 684)
|
219
(177; 272)
|
846
(693; 1'033)
|
278
(209; 369)
|
621
(470; 821)
| |
19A
|
82
(66; 100)
|
239
(197; 288)
|
124
(100; 153)
|
365
(303; 440)
|
182
(141; 235)
|
341
(264; 439)
| |
19F
|
61
(52; 71)
|
159
(131; 192)
|
89
(74; 107)
|
242
(199; 294)
|
120
(94; 154)
|
218
(168; 282)
| |
23F
|
23
(18; 28)
|
152
(115; 199)
|
48
(37; 62)
|
450
(358; 566)
|
66
(46; 94)
|
293
(204; 420)
| |
Sérotypes additionnels
| |
8
|
55
(45; 67)
|
212
(172; 261)
|
28
(24; 33)
|
603
(483; 753)
|
139
(99; 195)
|
294
(220; 392)
| |
10A
|
212
(166; 269)
|
1012
(807; 1270)
|
141
(113; 177)
|
2005
(1586; 2536)
|
400
(281; 568)
|
1580
(1176; 2124)
| |
11A
|
510
(396; 656)
|
1473
(1192; 1820)
|
269
(211; 343)
|
1908
(1541; 2362)
|
550
(386; 785)
|
1567
(1141; 2151)
| |
12F
|
147
(112; 193)
|
1054
(822; 1353)
|
53
(43; 65)
|
1763
(1372; 2267)
|
368
(236; 573)
|
1401
(1002; 1960)
| |
15B
|
140
(104; 189)
|
647
(491; 853)
|
74
(56; 98)
|
1480
(1093; 2003)
|
190
(124; 291)
|
1067
(721; 1578)
| |
22F
|
167
(122; 230)
|
1773
(1355; 2320)
|
60
(45; 82)
|
4157
(3244; 5326)
|
286
(180; 456)
|
2718
(1978; 3733)
| |
33F
|
1129
(936; 1362)
|
2026
(1684; 2437)
|
606
(507; 723)
|
3175
(2579; 3908)
|
1353
(1037; 1765)
|
2183
(1639; 2908)
|
Abréviations: IC = intervalle de confiance, MGT = moyenne géométrique des titres, LIQ = limite inférieure de quantification, n = nombre de participants, OPA = activité opsonophagocytaire (opsonophagocytic activity), PPSV23 = vaccin pneumococcique polysaccharidique, 23-valent (pneumococcal polysaccharide vaccine, 23-valent).
a L'étude 1006 a été menée aux États-Unis et en Suède.
b Les résultats des tests inférieurs à la LIQ ont été fixés à 0.5 × LIQ pour l'analyse.
c Population évaluable pour l'immunogénicité.
d Vaccination en ouvert avec Prevenar 20.
e IC bilatéral basé sur la distribution t de Student.
PharmacocinétiqueAucune évaluation des propriétés pharmacocinétiques n'est nécessaire pour les vaccins.
Absorption
Non pertinent.
Distribution
Non pertinent.
Métabolisme
Non pertinent.
Élimination
Non pertinent.
Données précliniquesLes données précliniques issues des études conventionnelles sur la toxicité en administration répétée et la toxicité pour la reproduction et le développement n'ont pas révélé de risque particulier pour l'homme.
Remarques particulièresIncompatibilités
En l'absence d'études de compatibilité, ce vaccin ne doit pas être mélangé avec d'autres médicaments.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Remarques particulières concernant le stockage
Conserver au réfrigérateur (2-8 °C). Les seringues préremplies doivent être conservées au réfrigérateur horizontalement, afin de réduire le temps de remise en suspension.
Ne pas congeler. Éliminer le vaccin s'il a été congelé.
Pour des raisons microbiologiques, le vaccin doit être utilisé immédiatement à sa sortie du réfrigérateur.
Les données de stabilité indiquent que le vaccin est stable pendant 96 heures lorsqu'il est conservé à des températures comprises entre 8 °C et 25 °C et pendant 72 heures lorsqu'il est conservé à des températures comprises entre 0 °C et 2 °C. À la fin de ces périodes, Prevenar 20 doit être utilisé ou éliminé. Ces indications sont destinées à guider les professionnels de la santé uniquement en cas d'écart temporaire de la température de conservation.
Conserver hors de portée des enfants.
Remarques concernant la manipulation
Pendant la conservation, un dépôt de couleur blanche et un surnageant clair peuvent être observés dans la seringue préremplie contenant la suspension. Conserver les seringues préremplies en position horizontale au réfrigérateur afin de réduire le temps de remise en suspension.
Préparation de l'injection
|
Étape 1. Remise en suspension du vaccin
Tenir la seringue préremplie horizontalement entre le pouce et l'index et l'agiter vigoureusement jusqu'à ce que le contenu de la seringue devienne une suspension blanche homogène. Ne pas utiliser le vaccin s'il ne peut pas être remis en suspension.
|
|
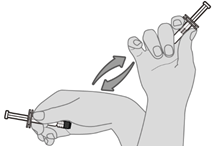
| |
Étape 2. Contrôle visuel
Observer le vaccin avant son administration pour vérifier l'absence de grosses particules et de décoloration. Ne pas utiliser le vaccin si de grosses particules ou des décolorations sont constatées. Si le vaccin ne se présente pas sous la forme d'une suspension blanche homogène, répéter les étapes 1 et 2.
|
|
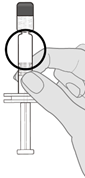
| |
Étape 3. Retrait du capuchon de protection
Retirer le capuchon de l'adaptateur Luer Lock en le tournant lentement dans le sens inverse des aiguilles d'une montre tout en tenant l'adaptateur Luer Lock.
Remarque: veiller à ne pas enfoncer la tige de piston lors du retrait du capuchon.
|
|
| |
Étape 4. Fixation d'une aiguille stérile
Fixer une aiguille adaptée à l'injection intramusculaire à la seringue préremplie en tenant l'adaptateur Luer Lock et en tournant l'aiguille dans le sens des aiguilles d'une montre.
|
Tout médicament non utilisé ou déchet doit être éliminé conformément aux exigences locales.
Numéro d’autorisation69222 (Swissmedic).
Présentation1 seringue préremplie à 0.5 ml et 1 aiguille. [B]
10 seringues préremplies à 0.5 ml et 10 aiguilles. [B]
Titulaire de l’autorisationPfizer AG, Zürich.
Mise à jour de l’informationFévrier 2025
LLD V007
|



