CompositionPrincipes actifs
Sacubitrilum et valsartanum ut complexus sacubitrili et valsartani natrii hydricus.
Entresto contient un complexe salin des formes anioniques du sacubitril et du valsartan, des cations sodiques et de molécules d'eau dans un rapport molaire de 1:1:3:2,5. Après administration orale, Entresto se sépare en sacubitril (ensuite métabolisé en LBQ657) et valsartan.
Excipients
Comprimés pelliculés
Noyau des comprimés
Cellulosum microcristallinum, Hydroxypropylcellulosum substitum humile, Crospovidonum, Magnesii stearas, Talcum, Silica colloidalis anhydrica.
Enveloppe
Hypromellosum, Macrogolum 4000, Talcum, Titanii dioxidum (E171), Ferrum oxidum rubrum (E172).
Comprimé de 100 mg: Ferrum oxidum flavum (E172).
Comprimés de 50 mg et 200 mg: Ferrum oxidum nigrum (E172).
Teneur en sodium: maximum 3,965 mg/comprimé de 50 mg, maximum 7,93 mg/comprimé de 100 mg, maximum 15,86 mg/comprimé de 200 mg.
Granulés pelliculés
Noyau du granulé
Cellulosum microcristallinum, Hydroxypropylcellulosum substitum humile, Magnesii stearas, Silica colloidalis anhydrica, Talcum
Enrobage
Copolymerum methacrylatis butylati basicum, talcum, acidum stearicum, natrii laurilsulfas
Chaque gélule de granulés pelliculés de 6 mg/6 mg contient 1,1 mg de sodium au maximum.
Chaque gélule de granulés pelliculés de 15 mg/16 mg contient 2,6 mg de sodium au maximum.
Indications/Possibilités d’emploiInsuffisance cardiaque chez l'adulte
Entresto est indiqué pour réduire le risque de mortalité et de morbidité cardiovasculaires chez les patients adultes souffrant d'insuffisance cardiaque systolique (classe NYHA II–IV, FEVG ≤40%). Entresto est administré en étant associé, de manière appropriée, à d'autres traitements de l'insuffisance cardiaque (p.ex. bêta-bloquants, diurétiques et antagonistes des minéralocorticoïdes) au lieu d'un inhibiteur de l'ECA ou d'un ARA (voir «Propriétés/Effets»).
Insuffisance cardiaque chez l'enfant et l'adolescent
Entresto est indiqué chez l'enfant et l'adolescent dès un an pour le traitement de l'insuffisance cardiaque chronique symptomatique avec dysfonction systolique ventriculaire gauche.
Posologie/Mode d’emploiInsuffisance cardiaque chez l'adulte
La dose initiale recommandée d'Entresto est de 100 mg deux fois par jour. Une dose initiale de 50 mg deux fois par jour est recommandée pour les patients actuellement non traités par un inhibiteur de l'ECA (enzyme de conversion de l'angiotensine) ou un antagoniste du récepteur de l'angiotensine II (ARA), et doit être envisagée chez les patients traités jusqu'ici avec une dose faible de ces principes actifs (voir «Propriétés/Effets»).
La dose d'Entresto doit être doublée toutes les 2 à 4 semaines jusqu'à la dose cible de 2 × 200 mg par jour, en fonction de la tolérance.
La dose d'entretien cible d'Entresto est de 200 mg deux fois par jour.
Le traitement par Entresto peut être initié au plus tôt 36 heures après l'arrêt d'un inhibiteur de l'ECA, compte tenu du risque potentiel d'angio-œdème lors de l'administration concomitante d'un inhibiteur de l'ECA (voir «Contre-indications»).
Si une dose est oubliée, le patient doit prendre la dose suivante à l'heure prévue.
En raison de son activité antagoniste du récepteur de l'angiotensine II, Entresto ne doit pas être administré de façon concomitante avec un ARA (voir «Mises en garde et précautions» et «Interactions»).
Les patients ayant une pression artérielle systolique (PAS) < 100 mmHg n'ont pas été étudiés; Entresto doit donc être utilisé avec prudence chez ces patients.
Si les patients présentent des problèmes de tolérance (hypotension symptomatique, hyperkaliémie, troubles de la fonction rénale), il est recommandé d'ajuster la posologie des médicaments concomitants, de réduire temporairement la dose d'Entresto ou d'arrêter celui-ci.
Insuffisance cardiaque chez l'enfant et l'adolescent
La tableau 1 présente la dose recommandée pour les patients pédiatriques, en dehors des situation décrites après le tableau. La dose recommandée doit être prise deux fois par jour, par voie orale. Toutes les 2 à 4 semaines, la dose doit être augmentée pour atteindre la dose cible, en fonction que la tolérance du patient. La dose recommandée la plus faible s'élève à 6 mg/6 mg. Les dose peuvent être arrondies positivement ou négativement à l'association de gélules de 6 mg/6 mg et/ou de 15 mg/16 mg la plus proche. En cas d'arrondi de la dose pendant la période de titration, il convient de veiller à garantir une augmentation graduelle jusqu'à la dose cible.
Entresto comprimés pelliculés ne convient pas aux enfants ayant un poids corporel inférieur à 40 kg. Des granulés pelliculés sont disponibles pour ces patients.
Tableau 1 Titration recommandée de la dose
|
Poids du patient
|
|
Dose des étapes de titration (deux fois par jour)
| |
Demi-dose initiale*
|
Dose initiale
|
Deuxième dose
|
Dose cible
| |
Patient ayant un poids corporel inférieur à 40 kg
|
0,8 mg/kg#
|
1,6 mg/kg#
|
2,3 mg/kg#
|
3,1 mg/kg#
| |
Patient ayant un poids corporel supérieur à 40 kg, mais inférieur à 50 kg
|
0,8 mg/kg#
|
24 mg/26 mg
|
49 mg/51 mg
|
72 mg/78 mg
| |
Patient ayant un poids corporel supérieur à 50 kg
|
24 mg/26 mg
|
49 mg/51 mg
|
72 mg/78 mg
|
97 mg/103 mg
|
* La moitié de la dose initiale est recommandée chez les patients qui ne prennent pas d'inhibiteur de l'ECA, ni d'ARA, ou qui prennent ces médicaments à un faible dosage, ainsi que chez les patients présentant des troubles de la fonction rénale (débit de filtration glomérulaire estimé [DFGe] < 30 ml/min/1,73 m²) et chez les patients ayant une insuffisance hépatique modérée (voir «Groupe de patients particuliers»).
# Les 0,8 mg, 1,6 mg, 2,3 mg et 3,1 mg se rapportent au poids combiné du sacubitril/valsartan et doivent être administrés sous forme de granulés pelliculés.
Chez les patients qui, avant le début du traitement par Entresto, ne prenaient pas d'inhibiteur de l'ECA ni d'ARA, ou qui prenaient de faibles doses de ces médicaments, la moitié de la dose initiale est recommandée. Chez les patients pédiatriques dont le poids est d'au moins 40 kg mais qui pèsent moins de 50 kg, une dose initiale de 0,8 mg/kg deux fois par jour (sous forme de granulés pelliculés) est recommandée. Après le début du traitement, la dose doit être augmentée en suivant la titration recommandée de la dose du tableau 1 et adaptée toutes les 3 à 4 semaines.
Le traitement ne doit pas être initié chez les patients ayant un taux sérique de potassium > 5,3 mmol/l ou une pression artérielle systolique (PAS) < 5e percentile pour l'âge du patient. Si des problèmes de tolérance surviennent chez un patient (PAS < 5e percentile pour l'âge du patient, hypotension symptomatique, hyperkaliémie, insuffisance rénale), un ajustement du médicament concomitant, un arrêt temporaire de l'administration ou l'arrêt d'Entresto est recommandé.
Mode d'administration
Comprimés pelliculés
Entresto comprimés pelliculés peut être administré indépendamment des repas (voir «Propriétés/Effets»). Les comprimés doivent être avalés avec un verre d'eau. Il n'est pas recommandé de casser ni d'écraser les comprimés.
Granulés pelliculés
La prise des granulés se fait par ouverture de la gélule et dispersion du contenu sur une petite quantité de nourriture molle (1 à 2 cuillères à café). La nourriture contenant les granulés doit être immédiatement consommée. Les patients peuvent recevoir les gélules de 6 mg/6 mg (coiffe blanche) ou de 15 mg/16 mg (coiffe jaune) ou les deux pour atteindre la dose nécessaire. La gélule ne doit pas être avalée. Les enveloppes vides doivent être jetées après utilisation et ne doivent pas être avalées.
Groupes de patients particuliers
Insuffisance rénale
Aucune adaptation posologique n'est nécessaire chez les patients atteints d'insuffisance rénale légère (DFGe 60–90 ml/min/1,73 m2) à modérée (DFGe 30–60 ml/min/1,73 m2). Chez les patients atteints d'insuffisance rénale sévère (DFGe < 30 ml/min/1,73 m2), il est recommandé de commencer par la moitié de la dose initiale. La prudence est recommandée lors de l'utilisation d'Entresto chez ce groupe de patients.
Entresto est contre-indiqué chez les patients présentant un DFGe < 10 ml/min/1,73m2 (voir «Contreindications»).
Insuffisance hépatique
Aucune adaptation posologique n'est nécessaire en cas d'administration d'Entresto à des patients atteints d'insuffisance hépatique légère (classe Child-Pugh A).
Chez les patients atteints d'insuffisance hépatique modérée (classe Child-Pugh B), il est recommandé de commencer par la moitié de la dose initiale.
Aucune étude n'a été réalisée chez les patients atteints d'insuffisance hépatique sévère (classe Child-Pugh C). Il est donc déconseillé d'utiliser Entresto chez ces patients (voir «Mises en garde et précautions» et «Propriétés/Effets»).
Chez les patients pédiatriques ayant un poids corporel d'au moins 40 kg, mais inférieur à 50 kg, une dose initiale de 0,8 mg/kg de poids corporel deux fois par jour est recommandée. Après l'instauration du traitement, la dose doit être augmentée toutes les 2 à 4 semaines conformément à la titration recommandée de la dose.
Enfants et adolescents
Entresto n'est pas autorisé chez les enfants de moins de 1 an car la sécurité et l'efficacité n'ont pas été démontrées pour cette population. Les données actuellement disponibles sont décrites dans la rubrique «Efficacité clinique». Aucune recommandation de dose ne peut être formulée.
Patients âgés (plus de 65 ans)
Aucune adaptation posologique n'est nécessaire chez les patients âgés de plus de 65 ans.
Contre-indications·Hypersensibilité à l'un des principes actifs, sacubitril ou valsartan, ou à l'un des excipients.
·Utilisation concomitante d'un inhibiteur de l'ECA (voir «Mises en garde et précautions», «Posologie/Mode d'emploi» et «Interactions»). Entresto peut être administré au plus tôt 36 heures après l'arrêt d'un traitement par inhibiteur de l'ECA.
·Antécédent connu d'angio-œdème lié à un traitement antérieur par inhibiteur de l'ECA ou ARA.
·Angio-œdème héréditaire.
·Utilisation concomitante d'Entresto avec des médicaments contenant de l'aliskirène chez les patients atteints de diabète sucré ou présentant une insuffisance rénale (DFG < 60 ml/min/1,73 m2) (voir rubriques «Mises en garde et précautions» et «Interactions»).
·Insuffisance rénale sévère avec DFGe < 10 ml/min/1,73 m2 en raison de données manquantes.
·Grossesse (voir «Grossesse, Allaitement»).
Mises en garde et précautionsDouble blocage du système rénine-angiotensine-aldostérone (SRAA)
·En raison du risque d'angio-œdème, Entresto ne doit pas être administré de façon concomitante avec un inhibiteur de l'ECA. Un traitement par Entresto peut commencer au plus tôt 36 heures après la prise de la dernière dose d'un traitement par inhibiteur de l'ECA. Lors de l'arrêt d'Entresto, un traitement par inhibiteur de l'ECA peut être initié au plus tôt 36 heures après la prise de la dernière dose d'Entresto (voir «Contre-indications», «Posologie/Mode d'emploi» et «Interactions»).
·En raison de son activité antagoniste du récepteur de l'angiotensine II, Entresto ne doit pas être administré avec un ARA (voir «Posologie/Mode d'emploi» et «Interactions»).
·L'utilisation concomitante d'Entresto avec des inhibiteurs directs de la rénine tels que l'aliskirène n'est pas recommandée (voir «Contre-indications» et «Interactions»). Entresto ne doit pas être administré avec l'aliskirène chez les patients atteints de diabète sucré ou les patients présentant une insuffisance rénale (DFG < 60 ml/min/1,73 m2), (voir «Contre-indications» et «Interactions»).
Hypotension artérielle
Des cas d'hypotension symptomatique ont été rapportés chez des patients adultes traités par Entresto dans le cadre des études cliniques; en particulier chez les patients âgés de ≥65 ans, ceux atteints d'une maladie rénale et ceux ayant une PAS basse (< 112 mmHg).
Le traitement ne doit être initié que si la PAS est ≥100 mmHg pour les patients adultes ou ≥5e percentile de la PAS pour l'âge pour les patients pédiatriques. Les patients ayant une PAS inférieure à ces valeurs n'ont pas été étudiés (voir «Efficacité clinique»).
Les rapports d'hypotension en tant qu'événement indésirable ont été plus fréquents sous Entresto (17,6%) que sous énalapril (12,0%). Lors de l'initiation d'un traitement par Entresto ou pendant un ajustement posologique, il convient de surveiller la pression artérielle à des intervalles appropriés, conformément à la pratique clinique habituelle. En cas d'hypotension, il est recommandé de réduire temporairement la dose ou de suspendre temporairement Entresto (voir «Posologie/Mode d'emploi»). Il faudra envisager d'ajuster la posologie des diurétiques, des traitements hypotenseurs concomitants et de traiter les autres causes d'hypotension (p.ex. hypovolémie). En règle générale, il n'est pas nécessaire d'arrêter définitivement le traitement. La probabilité d'une hypotension symptomatique augmente en cas d'hypovolémie, p.ex. à la suite d'un traitement par diurétique, d'un régime alimentaire hyposodé, d'une diarrhée ou de vomissements. La déplétion sodique et/ou volémique doit être corrigée avant d'instaurer le traitement par Entresto.
Insuffisance rénale
Comme tous les principes actifs agissant sur le système rénine-angiotensine-aldostérone, l'utilisation d'Entresto peut être associée à une dégradation de la fonction rénale. Dans l'étude PARADIGM-HF, l'incidence des cas d'insuffisance rénale cliniquement significative a été faible et un arrêt du traitement lié à ce problème était moins fréquent sous Entresto (0,65%) que sous énalapril (1,28%). Une réduction de la dose d'Entresto doit être envisagée chez les patients qui développent une diminution cliniquement significative de la fonction rénale. En cas d'utilisation d'Entresto chez des patients présentant une insuffisance rénale sévère (DFGe < 30 ml/min/1,73 m2), il convient de faire preuve de prudence (voir «Posologie/Mode d'emploi» et «Propriétés/Effets»). Entresto est contre-indiqué chez les patients présentant un DFGe < 10 ml/min/1,73 m2 (voir «Contre-indications»).
Insuffisance hépatique
Aucune étude n'a été menée chez des patients souffrant d'une insuffisance hépatique sévère (classification de Child-Pugh C). L'utilisation d'Entresto n'est donc pas recommandée chez ces patients (voir «Posologie/Mode d'emploi» et «Propriétés/Effets»).
Hyperkaliémie
Comme tous les principes actifs agissant sur le système rénine-angiotensine-aldostérone, l'utilisation d'Entresto peut être associée à un risque accru d'hyperkaliémie. Dans l'étude PARADIGM-HF, l'incidence des cas d'hyperkaliémie cliniquement significative entraînant l'arrêt du traitement a été faible (0,26% des patients sous Entresto pour 0,35% des patients sous énalapril). Des hyperkaliémies > 5,5 mmol/l ont été observées chez environ 16% des patients sous Entresto et 16% des patients sous énalapril. Des événements indésirables associés à l'hyperkaliémie ont été rapportés chez 11,9% des patients traités par Entresto contre 14,3% des patients traités par énalapril (voir «Effets indésirables»). Les médicaments connus pour élever le taux de potassium (p.ex. les diurétiques épargneurs de potassium, les suppléments potassiques) doivent être utilisés avec précaution en cas d'administration concomitante avec Entresto. En cas d'hyperkaliémie cliniquement significative, il faut envisager des mesures telles que la réduction de la teneur en potassium dans l'alimentation ou un ajustement de la posologie des médicaments administrés de manière concomitante. Il est recommandé de surveiller le taux de potassium sérique en particulier chez les patients présentant des facteurs de risque tels qu'une insuffisance rénale sévère, un diabète sucré, un hypoaldostéronisme ou ceux ayant un régime alimentaire riche en potassium (voir «Posologie/Mode d'emploi»).
Angio-œdèmes
Des angio-œdèmes ont été signalés chez des patients traités par Entresto. En cas d'angio-œdème, il faut arrêter immédiatement Entresto et mettre en place un traitement et une surveillance appropriés, jusqu'à la disparition totale et durable des signes et symptômes. Entresto ne doit pas être réadministré. Dans les cas confirmés d'angio-œdème où l'œdème est limité au visage et aux lèvres, celui-ci est généralement résorbé sans traitement. Toutefois, les antihistaminiques se sont avérés utiles pour soulager les symptômes.
Un angio-œdème accompagné d'un œdème pharyngé peut entraîner la mort. Si la langue, la glotte ou le pharynx sont impliqués, ce qui mène probablement à une obstruction des voies respiratoires, il faut immédiatement instaurer un traitement adéquat, p.ex. par une solution d'épinéphrine/adrénaline 1:1000 (0,3 ml à 0,5 ml) sous-cutanée et/ou des mesures pour maintenir les voies respiratoires ouvertes.
Les patients ayant des antécédents d'angio-œdème n'ont pas été étudiés. Ces patients pouvant présenter un risque accru d'angio-œdème, il convient de faire preuve de prudence lors de l'administration d'Entresto à ce groupe de patients. Entresto ne doit pas être utilisé chez des patients ayant un angio-œdème connu dans l'anamnèse lié à un traitement antérieur par des inhibiteurs de l'ECA ou des ARA ou chez des patients présentant un angio-œdème héréditaire (voir «Contre-indications»).
Les patients noirs peuvent avoir une plus grande susceptibilité aux angio-œdèmes.
Patients présentant une sténose de l'artère rénale
Comme d'autres médicaments ayant un effet sur le système rénine-angiotensine-aldostérone, Entresto peut augmenter l'urée sanguine et le taux de créatinine sérique chez les patients présentant une sténose bilatérale ou unilatérale de l'artère rénale. Chez les patients présentant une sténose de l'artère rénale, il convient de faire preuve de prudence et il est recommandé de surveiller la fonction rénale.
Biomarqueurs
Chez les patients traités par Entresto, le peptide natriurétique de type B (BNP) n'est pas un biomarqueur approprié pour l'insuffisance cardiaque, car le BNP est un substrat de la néprilysine (voir «Propriétés/Effets»).
L'effet de l'inhibition de la néprilysine généré par Entresto sur l'expression de CD10 dans des cellules normales et néoplasiques n'a pas été étudié et est inconnu.
Troubles psychiatriques
Un lien a été établi entre des événements psychiatriques, comme des hallucinations, de la paranoïa et des troubles du sommeil, en relation avec des événements psychotiques, et l'utilisation de sacubitril/valsartan. Lorsqu'un patient ressent de tels événements, une interruption du traitement par sacubitril/valsartan doit être envisagée.
Ce médicament contient moins de 1 mmol de sodium (23 mg) par dose de 97/103 mg, c'est-à-dire qu'il est pratiquement «sans sodium».
InteractionsInteractions prévisibles entraînant une contre-indication
Inhibiteurs de l'ECA: l'utilisation concomitante d'Entresto avec des inhibiteurs de l'ECA est contre-indiquée, car l'inhibition de la néprilysine (NEP) en concomitance avec un traitement par inhibiteur de l'ECA peut augmenter le risque d'angio-œdème. Un traitement par Entresto peut être initié au plus tôt 36 heures après la prise de la dernière dose d'un traitement par inhibiteur de l'ECA. Un traitement par inhibiteur de l'ECA peut être initié au plus tôt 36 heures après la prise de la dernière dose d'Entresto (voir «Contre-indications» et «Posologie/Mode d'emploi»).
Aliskirène: l'utilisation concomitante d'aliskirène et d'Entresto est contre-indiquée chez les patients atteints de diabète sucré ou les patients présentant une insuffisance rénale (DFGe < 60 ml/min/1,73 m2), (voir «Contre-indications» et «Mises en garde et précautions»).
Interactions prévisibles en raison desquelles l'utilisation concomitante est non recommandée
En raison de son effet antagoniste sur les récepteurs de l'angiotensine II, Entresto ne doit pas être pris avec un ARA (voir «Mises en garde et précautions»).
Interactions observées à prendre en compte
Statines: les données in vitro portent à conclure que le sacubitril inhibe les transporteurs OATP1B1 et OATP1B3. Entresto peut donc augmenter l'exposition systémique aux substrats d'OATP1B1 et d'OATP1B3, tels que les statines.
L'utilisation concomitante d'Entresto a augmenté la Cmax de l'atorvastatine et de ses métabolites jusqu'à deux fois, et l'ASC jusqu'à 1,3 fois. La prudence est donc de rigueur en cas d'utilisation concomitante d'Entresto avec des statines. Aucune interaction médicamenteuse cliniquement pertinente n'a été observée lors de l'administration concomitante d'Entresto et de simvastatine.
Sildénafil: l'administration d'une dose de sildénafil avec Entresto à l'état d'équilibre chez les patients atteints d'hypertension s'est accompagnée d'une baisse plus importante de la tension artérielle que celle observée lors de l'administration d'Entresto seul. Il convient donc de faire preuve de prudence lors du début d'un traitement par sildénafil ou un autre inhibiteur de PDE-5 chez les patients sous Entresto.
Interactions prévisibles à prendre en compte
Potassium: l'utilisation concomitante de diurétiques épargneurs de potassium (p.ex. triamtérène, amiloride), d'antagonistes des minéralocorticoïdes (p.ex. spironolactone, éplérénone), de suppléments potassiques ou de substituts de sel contenant du potassium peut entraîner une augmentation du potassium sérique et de la créatininémie. Il est recommandé de surveiller le potassium sérique en cas d'administration concomitante d'Entresto avec ces substances (voir «Mises en garde et précautions»).
Anti-inflammatoires non stéroïdiens (AINS) y compris inhibiteurs sélectifs de la cyclooxygénase-2 (inhibiteurs de la COX-2): chez les patients âgés, les patients présentant une déplétion volémique (y compris les patients sous diurétiques) ou les patients présentant une insuffisance rénale, l'utilisation concomitante d'Entresto et d'AINS peut augmenter le risque de détérioration de la fonction rénale. C'est pourquoi il est recommandé de surveiller la fonction rénale en cas d'instauration ou de modification du traitement par Entresto chez les patients traités en même temps par des AINS.
Lithium: le potentiel d'interaction entre Entresto et le lithium n'a pas été étudié. Une augmentation réversible du taux sérique de lithium et une toxicité ont été décrites sous administration concomitante de lithium et d'inhibiteurs de l'ECA ou d'antagonistes des récepteurs de l'angiotensine II. C'est pourquoi il est recommandé de surveiller étroitement le taux sérique de lithium en cas d'utilisation concomitante avec Entresto. Si un diurétique est également utilisé, cela peut encore augmenter le risque de toxicité au lithium.
Transporteurs: les métabolites actifs du sacubitril (LBQ657) et du valsartan sont des substrats d'OATP1B1, OATP1B3, OAT1 et OAT3; le valsartan est en outre un substrat de MRP2. C'est pourquoi l'administration concomitante d'Entresto avec des inhibiteurs d'OATP1B1, OATP1B3, OAT3 (p.ex. rifampicine/rifampine, cyclosporine), OAT1 (p.ex. ténofovir, cidofovir) ou MRP2 (p, ex. ritonavir) peut augmenter l'exposition systémique au LBQ657 ou au valsartan. Il convient de faire preuve de prudence lors de l'initiation ou de l'arrêt d'un traitement concomitant avec ces principes actifs.
Pas d'interactions significatives
Aucune interaction médicamenteuse cliniquement significative n'a été observée lors de l'administration concomitante d'Entresto et de furosémide, digoxine, warfarine, hydrochlorothiazide, amlodipine, metformine, oméprazole, carvédilol, nitroglycérine intraveineuse ou une association de lévonorgestrel/éthinylestradiol. Aucune interaction avec l'aténolol, l'indométhacine, le glyburide ou la cimétidine n'est attendue.
Interactions liées au CYP-450: les études in vitro du métabolisme indiquent que le potentiel d'interactions médicamenteuses reposant sur le CYP-450 est faible en raison de la faible métabolisation d'Entresto par les enzymes CYP-450. Entresto n'a ni un effet inducteur, ni un effet inhibiteur sur les enzymes CYP-450.
Grossesse, allaitementFemmes en âge de procréer
Les femmes en âge de procréer doivent utiliser une méthode de contraception pendant le traitement par Entresto et jusqu'à une semaine après la prise de la dernière dose.
Grossesse
Comme d'autres principes actifs ayant un effet direct sur le SRAA, Entresto ne doit pas être utilisé pendant la grossesse (voir «Contre-indications»). Entresto agit entre autres par un antagonisme de l'angiotensine II; on ne peut donc exclure un risque pour le fœtus. En cas de prise de valsartan pendant la grossesse, des altérations du fœtus en développement (p.ex. avortement spontané, oligoamnios et troubles de la fonction rénale chez le nouveau-né) ont été rapportées. Dans certaines études expérimentales sur des animaux, une toxicité sur la reproduction a été observée (voir «Données précliniques»). En cas de grossesse survenant pendant le traitement, il faut arrêter Entresto dès que possible.
Allaitement
On ignore si Entresto passe dans le lait maternel. Les composants d'Entresto, le sacubitril et le valsartan, ont été excrétés dans le lait de rates allaitantes (voir «Données précliniques»). En raison du risque potentiel d'effets indésirables du médicament chez les nouveau-nés/nourrissons allaités, l'utilisation d'Entresto est déconseillée pendant l'allaitement.
Fertilité
Aucune donnée n'est disponible concernant l'effet d'Entresto sur la fertilité humaine. Dans des études réalisées chez des rats mâles et femelles, aucune altération de la fertilité n'a été observée (voir «Données précliniques»).
Effet sur l’aptitude à la conduite et l’utilisation de machinesAucune étude correspondante n'a été effectuée. Il convient d'être prudent en cas de conduite de véhicules ou d'utilisation de machines, des sensations de vertige ou de la fatigue pouvant se présenter suite à la prise de la préparation.
Effets indésirablesLa sécurité d'Entresto chez les patients adultes atteints d'insuffisance cardiaque chronique a été évaluée dans l'étude pivot de phase 3 PARADIGM-HF, qui a comparé des patients traités deux fois par jour par Entresto 200 mg (n = 4203) ou par énalapril 10 mg (n = 4229). Les patients recevant Entresto ont été traités pendant une période maximale de 4,3 ans, avec une durée médiane d'exposition de 24 mois; 3271 patients ont été traités pendant plus d'une année.
L'arrêt du traitement en raison d'un effet indésirable pendant la phase en double aveugle de l'étude PARADIGM-HF est survenu chez 450 patients sous Entresto (10,71%) et chez 516 patients sous énalapril (12,20%). Les événements les plus fréquemment associés à une adaptation de la posologie ou un arrêt du traitement étaient l'hypotension, l'hyperkaliémie et l'insuffisance rénale.
L'incidence globale des effets indésirables du médicament (EIM) d'Entresto chez les patients souffrant d'insuffisance cardiaque a été comparable à celle observée avec l'énalapril. Le profil des EIM correspond aux propriétés pharmacologiques d'Entresto et aux maladies sous-jacentes des patients.
La fréquence globale des effets indésirables a été indépendante du sexe, de l'âge ou de l'origine ethnique.
Les effets indésirables des médicaments sont mentionnés par classe de système d'organes et au sein de chaque classe par ordre décroissant de fréquence, selon la convention suivante: Très fréquents (≥1/10); fréquents (≥1/100 à < 1/10); occasionnels (≥1/1000 à < 1/100); rares (≥1/10 000 à < 1/1000); très rares (< 1/10 000), y compris les cas isolés. Dans chaque catégorie de fréquence, les effets indésirables sont indiqués par ordre décroissant de gravité.
Affections hématologiques et du système lymphatique
Fréquents: anémie.
Troubles du métabolisme et de la nutrition
Très fréquents: hyperkaliémie.
Fréquents: hypokaliémie, hypoglycémie.
Affections du système nerveux
Fréquents: vertiges, céphalée.
Occasionnels: vertige orthostatique.
Affections de l'oreille et du labyrinthe
Fréquents: vertige.
Affections vasculaires
Très fréquents: hypotension.
Fréquents: syncope, hypotension orthostatique.
Affections respiratoires, thoraciques et médiastinales
Fréquents: toux.
Affections gastro-intestinales
Fréquents: diarrhée, nausées.
Affections de la peau et du tissu sous-cutané
Occasionnels: angio-œdèmes, prurit, rash cutané.
Affections du rein et des voies urinaires
Très fréquents: altération de la fonction rénale.
Fréquents: défaillance rénale (insuffisance rénale, défaillance rénale aiguë).
Affections du système immunitaire
Occasionnels: hypersensibilité (y compris anaphylaxie).
Affections psychiatriques
Rares: hallucinations et trouble du sommeil.
Très rares: paranoïa.
Troubles généraux et anomalies au site d'administration
Fréquents: fatigue, asthénie.
Tableau 2 Effets indésirables du médicament dans l'étude PARADIGM-HF, population soumise à l'évaluation de la sécurité
|
Effets indésirables du médicament
|
Entresto
200 mg deux fois par jour (%)*
|
ENALAPRIL
10 mg deux fois par jour (%)*
|
Catégorie de fréquence
| |
Affections hématologiques et du système lymphatique
| |
Anémie
|
4,00
|
4,75
|
Fréquent
| |
Troubles du métabolisme et de la nutrition
| |
Hyperkaliémie**
|
11,61
|
14,00
|
Très fréquent
| |
Hypokaliémie
|
3,31
|
2,53
|
Fréquent
| |
Affections du système nerveux
| |
Vertiges
|
6,33
|
4,87
|
Fréquent
| |
Vertige orthostatique
|
0,57
|
0,28
|
Occasionnel
| |
Céphalée
|
2,45
|
2,51
|
Fréquent
| |
Affections de l'oreille et du labyrinthe
| |
Vertige
|
1,45
|
1,40
|
Fréquent
| |
Affections vasculaires
| |
Hypotension
|
17,61
|
11,97
|
Très fréquent
| |
Syncope
|
2,24
|
2,70
|
Fréquent
| |
Hypotension orthostatique
|
1,52
|
0,80
|
Fréquent
| |
Affections respiratoires, thoraciques et médiastinales
| |
Toux
|
8,78
|
12,60
|
Fréquent
| |
Affections gastro-intestinales
| |
Diarrhée
|
4,62
|
4,47
|
Fréquent
| |
Nausées
|
2,09
|
2,36
|
Fréquent
| |
Affections de la peau et du tissu sous-cutané
| |
Angio-œdèmes
|
0,45
|
0,24
|
Occasionnel
| |
Affections du rein et des voies urinaires
| |
Altération de la fonction rénale
|
10,14
|
11,52
|
Très fréquent
| |
Défaillance rénale
(insuffisance rénale, défaillance rénale aiguë)
|
4,76
|
5,30
|
Fréquent
| |
Troubles généraux et anomalies au site d'administration
| |
Fatigue
|
2,97
|
3,05
|
Fréquent
| |
Asthénie
|
2,09
|
1,84
|
Fréquent
|
* Population soumise à l'évaluation de la sécurité
** Les événements indésirables associés à l'hyperkaliémie ont été rapportés chez 11,9% des patients traités par Entresto contre 14,3% des patients traités par énalapril (voir «Mises en garde et précautions»).
Fonction cognitive
La néprilysine est l'une des nombreuses enzymes impliquées dans la clairance de la bêta-amyloïde (Aβ) du cerveau et du liquide céphalo-rachidien (LCR). L'administration de 400 mg d'Entresto une fois par jour pendant 2 semaines chez des sujets sains n'a entraîné aucune modification de la concentration d'Aβ 1–40 et 1–42 dans le LCR, mais s'est accompagnée d'une augmentation de l'Aβ 1–38 dans le LCR par rapport au placebo. La pertinence clinique de ces observations est inconnue (voir «Propriétés/Effets»). Dans l'étude PARADIGM-HF, l'incidence globale d'événements indésirables liés à la démence a été faible et comparable d'un groupe de traitement à l'autre (0,3% dans le groupe recevant Entresto et 0,4% dans le groupe recevant l'énalapril). Aucune étude prospective spécifique de la fonction cognitive n'a été réalisée. Des patients présentant un trouble cognitif léger (MCI [mild cognitive impairment]) ou une démence existante n'ont pas été étudiés séparément.
L'effet potentiel d'Entresto sur la fonction cognitive et le dépôt de bêta-amyloïde dans le cerveau a été évalué dans des études chez des patients insuffisants cardiaques.
Population pédiatrique
Dans l'étude PANORAMA-HF, la sécurité du sacubitril/valsartan a été comparée à celle de l'énalapril dans une étude randomisée, contrôlée par comparateur actif, de 52 semaines, comportant 375 patients pédiatriques atteints d'insuffisance cardiaque, âgés de 1 mois à < 18 ans. Le profil de sécurité observé chez les patients pédiatriques traités par le sacubitril/valsartan âgés de 1 mois à < 18 ans a été similaire à celui observé pour les patients adultes. Les données de sécurité des patients âgés de 1 mois à < 1 an étaient limitées.
On dispose de données de sécurité limitées pour les patients pédiatriques atteints d'une insuffisance hépatique modérée ou d'une insuffisance rénale modérée à grave.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageChez l'être humain, les données disponibles sur le surdosage d'Entresto chez des sujets sont limitées. L'administration unique de 1200 mg et l'administration répétée de 900 mg (14 jours) d'Entresto ont été étudiées chez des volontaires sains adultes. Ces administrations ont été bien tolérées.
En raison de l'effet antihypertenseur d'Entresto, l'hypotension est le symptôme le plus probable d'un surdosage. Il convient d'instaurer un traitement symptomatique.
En raison d'une liaison importante aux protéines, il est peu probable qu'Entresto puisse être éliminé par hémodialyse.
Propriétés/EffetsCode ATC
C09DX04
Mécanisme d'action
Entresto contient un complexe salin composé de sacubitril et de valsartan. LBQ657 est le métabolite actif du sacubitril; il inhibe la néprilysine (endopeptidase neutre, NEP). Le valsartan bloque le récepteur de type 1 de l'angiotensine II (AT1). L'association de ces deux inhibiteurs est appelée inhibiteur des récepteurs de l'angiotensine et de la néprilysine (ARNI - angiotensin receptorneprilysin inhibitor).
Les effets cardiovasculaires et rénaux d'Entresto chez les patients insuffisants cardiaques s'expliquent par un mécanisme d'action double: d'une part, l'inhibition de la dégradation des peptides (par exemple les peptides natriurétiques, PN) par l'inhibiteur de la néprilysine LBQ657 entraîne leur accumulation et, d'autre part, le valsartan inhibe les effets nocifs de l'angiotensine II. Les PN agissent en activant les récepteurs membranaires couplés au système guanylate cyclase, ce qui entraîne une augmentation des concentrations de guanosine monophosphate cyclique (cGMP) en tant que «second messenger» (second messager). Ceci favorise à son tour une vasodilatation, une natriurèse et une diurèse, augmente le débit de filtration glomérulaire et le débit sanguin rénal, inhibe la libération de rénine et d'aldostérone, réduit l'activité sympathique et induit des effets antihypertrophiques et antifibrotiques. Une activation durable du système rénine-angiotensine-aldostérone entraîne une vasoconstriction, une rétention rénale hydrosodée, une activation de la croissance et de la prolifération cellulaires et, par la suite, des processus de remodelage cardiovasculaire mal adaptés. Le valsartan inhibe les effets néfastes cardiovasculaires et rénaux de l'angiotensine II en bloquant sélectivement le récepteur AT1, inhibant par ailleurs la libération d'aldostérone dépendante de l'angiotensine II.
Pharmacodynamique
Les effets pharmacodynamiques d'Entresto ont été étudiés après l'administration de doses uniques et multiples chez des sujets sains et des patients insuffisants cardiaques. Ils correspondent à une inhibition de la néprilysine couplée à un blocage du SRAA. Dans le cadre d'une étude de sept jours, contrôlée contre valsartan, menée chez des patients présentant une fraction d'éjection réduite (HFrEF), Entresto a entraîné une augmentation significative, non durable, de la natriurèse, une élévation de la cGMP dans l'urine et une baisse du MRproANP et du NT-proBNP dans le plasma par rapport au valsartan. Dans le cadre d'une étude de 21 jours menée chez des patients atteints de HFrEF, Entresto a augmenté l'ANP et la cGMP dans l'urine et la cGMP dans le plasma, et réduit le NT-proBNP, l'aldostérone et l'endothéline 1 dans le plasma par rapport aux valeurs initiales. En outre, Entresto a bloqué le récepteur AT1, comme le montrent l'augmentation de l'activité rénine plasmatique et les taux plasmatiques de rénine élevés. Dans le cadre de l'étude PARADIGM-HF, Entresto a réduit le NTproBNP dans le plasma, et a augmenté le BNP dans le plasma et la cGMP dans l'urine par rapport à l'énalapril. Dans l'étude PANORAMA-HF, aux semaines 4 et 12, une baisse du NT-proBNP par rapport aux valeurs initiales a été observée pour le sacubitril-valsartan (40,2% et 49,8%) et l'énalapril (18,0% et 44,9%). Les valeurs du NT-proBNP ont continué à diminuer pendant toute la durée de l'étude, de sorte qu'à la semaine 52, par comparaison à la valeur initiale, une baisse de 65,1% a été enregistrée pour sacubitril/valsartan et de 61,6% pour l'énalapril. Alors que le BNP est un substrat de la néprilysine, le NTproBNP ne l'est pas.
Le BNP n'est donc pas un biomarqueur adapté pour surveiller l'insuffisance cardiaque chez les patients traités par Entresto (voir «Mises en garde et précautions»). Le NTproBNP n'est pas un substrat de la néprilysine et convient donc mieux comme biomarqueur.
Dans une étude clinique spécialement conçue dans cette optique réalisée chez des hommes sains, l'administration unique de 400 mg et 1200 mg d'Entresto n'a eu aucun effet sur la repolarisation cardiaque.
La néprilysine est l'une des nombreuses enzymes impliquées dans la clairance de la bêta-amyloïde (Aβ) du cerveau et du liquide céphalo-rachidien (LCR). L'administration de 400 mg d'Entresto une fois par jour pendant 2 semaines à des sujets sains n'a entraîné aucune modification de la concentration d'Aβ 1–40 et 1–42 dans le LCR, mais s'est accompagnée d'une augmentation de l'Aβ 1–38 dans le LCR par rapport au placebo. La signification clinique de ces résultats est inconnue (voir «Données précliniques»), les changements structurels et fonctionnels dans le SNC n'ayant pas été étudiés. Les effets potentiels d'Entresto sur la fonction cognitive et le dépôt de bêta-amyloïde dans le cerveau seront évalués dans une étude qui sera menée auprès de patients insuffisants cardiaques.
Efficacité clinique
PARADIGM-HF
PARADIGM-HF était une étude randomisée, multinationale, en double aveugle, comparant Entresto à l'énalapril chez 8442 patients. Les médicaments ont été administrés à des patients adultes atteints d'insuffisance cardiaque chronique (classe NYHA II à IV) et de dysfonction systolique (fraction d'éjection du ventricule gauche ≤40%) en complément d'autres traitements (> 90% de bêta-bloquants, env. 80% de diurétiques, env. 50% d'antagonistes des minéralocorticoïdes). Le critère d'évaluation principal composite était constitué du décès d'origine cardiovasculaire (CV) et de l'hospitalisation pour cause d'insuffisance cardiaque (IC).
Avant l'inclusion dans l'étude, les patients étaient bien contrôlés par un traitement correspondant à la prise en charge standard, notamment par des inhibiteurs de l'ECA/ARA (> 99%), des bêta-bloquants (94%), des antagonistes des minéralocorticoïdes (58%) et des diurétiques (83%). La durée d'observation médiane était de 27 mois et les patients ont été traités pendant 4,3 ans au maximum. Les patients présentant une PA systolique < 100 mmHg n'ont pas été inclus dans l'étude.
Les patients devaient arrêter leur traitement en cours par inhibiteur de l'ECA ou ARA et ont été inclus dans une phase d'amorce séquentielle en simple aveugle pendant laquelle ils étaient traités par Énalapril 10 mg deux fois par jour. La suite du traitement a été effectuée avec une dose de 100 mg d'Entresto deux fois par jour, portée à 200 mg deux fois par jour après 1 à 2 semaines. Les patients ayant bien toléré les traitements d'amorce ont ensuite été randomisés pour recevoir soit Entresto, soit l'énalapril. Dans la phase en double aveugle de l'étude, les patients recevaient 200 mg d'Entresto ou 10 mg d'énalapril, chacun deux fois par jour (Entresto [n = 4209]; énalapril [n = 4233]).
L'âge moyen du collectif de patients étudié était de 64 ans; 19% avaient 75 ans ou plus. Lors de la randomisation, 70% des patients ont été classés NYHA II et 25% NYHA III/IV.
Dans le groupe sous Entresto, 76% des patients ont reçu jusqu'à la fin de l'étude la dose cible de 200 mg deux fois par jour (dose quotidienne moyenne de 375 mg). Dans le groupe sous énalapril, 75% des patients ont reçu jusqu'à la fin de l'étude la dose cible de 10 mg deux fois par jour (dose quotidienne moyenne de 18,9 mg).
Entresto a réduit de manière statistiquement significative le risque de décès d'origine cardiovasculaire ou d'hospitalisation pour cause d'insuffisance cardiaque de 20% par rapport à l'énalapril (hazard ratio [HR]: 0,80, IC à 95% [0,73–0,87]). La réduction absolue du risque a été de 4,69%. Cet effet a été observé rapidement et s'est maintenu sur toute la durée de l'étude. Une réduction statistiquement significative des décès d'origine cardiovasculaire et de la première hospitalisation pour cause d'insuffisance cardiaque a été observée (décès d'origine CV: RRR 20%, HR 0,80; IC à 95% [0,71–0,89], 3,13% de réduction absolue du risque; hospitalisation pour cause d'insuffisance cardiaque: RRR 21%; HR 0,79; IC à 95% [0,71–0,89], réduction absolue du risque de 2,80%); voir tableau 3 La mort subite cardiaque a été la cause de 45% des décès d'origine CV. Cette valeur a été réduite de 20% chez les patients sous Entresto comparativement aux patients sous énalapril (HR 0,80; IC à 95% [0,68–0,94]). La défaillance cardiaque a été la cause de 26% des décès d'origine CV. Cette valeur a été réduite de 21% chez les patients sous Entresto comparativement aux patients sous énalapril (HR 0,79; IC à 95% [0,64–0,98]).
Cette réduction du risque a été observée de façon cohérente dans les différents sous-groupes, incluant l'âge, le sexe, l'appartenance ethnique, l'origine géographique, la classe NYHA, la fraction d'éjection, la fonction rénale, le diabète ou l'hypertension à l'anamnèse, le traitement antérieur pour insuffisance cardiaque et la fibrillation atriale.
En outre, Entresto a réduit de manière significative la mortalité toutes causes confondues de 16% comparativement à l'énalapril (RRR 16%, HR 0,84; IC à 95% [0,76–0,93]) (tableau 3). La réduction absolue du risque a été de 2,84%.
Tableau 3 Effet du traitement concernant le critère d'évaluation principal composite, ses composantes et la mortalité toutes causes confondues
|
|
Entresto
N = 4187#
n (%)
|
Énalapril
N = 4212#
n (%)
|
Hazard Ratio
(IC à 95%)
|
Réduction relative du risque
|
Réduction absolue du risque
| |
Critère d'évaluation principal composite constitué du décès d'origine CV et de l'hospitalisation pour cause d'insuffisance cardiaque*
|
914
(21,83)
|
1117 (26,52)
|
0,80
(0,73–0,87)
|
20%
|
4,69%
| |
Composantes individuelles du critère d'évaluation principal composite
| |
Décès d'origine CV**
|
558
(13,33)
|
693
(16,45)
|
0,80
(0,71–0,89)
|
20%
|
3,13%
| |
Première hospitalisation pour cause d'insuffisance cardiaque
|
537
(12,83)
|
658
(15,62)
|
0,79
(0,71–0,89)
|
21%
|
2,80%
| |
Critère d'évaluation secondaire
| |
Mortalité toutes causes confondues
|
711
(16,98)
|
835
(19,82)
|
0,84
(0,76–0,93)
|
16%
|
2,84%
|
* Le critère d'évaluation principal était défini comme le délai de survenue du premier événement.
** Les décès d'origine CV comprennent tous les patients décédés jusqu'à la date limite, qu'ils aient été hospitalisés ou non.
# Population d'analyse complète
Illustration 0 Courbes de Kaplan-Meier pour le critère d'évaluation principal composite et la composante «Décès d'origine CV»


Le nombre de patients présentant une détérioration des symptômes d'IC selon le questionnaire KCCQ (Kansas City Cardiomyopathy Questionnaire), y compris une dyspnée, un épuisement et des restrictions physiques, a été plus faible que dans le groupe énalapril.
PANORAMA-HF
PANORAMA-HF était une étude de phase III, multinationale, randomisée, en double aveugle, visant à comparer le sacubitril/valsartan et l'énalapril chez 375 patients pédiatriques âgés de 1 mois à < 18 ans, présentant une insuffisance cardiaque en raison d'un dysfonctionnement systolique ventriculaire gauche (fraction d'éjection du ventricule gauche (FEVG) ≤45% ou raccourcissement fractionnel ≤22,5%). L'objectif principal consistait à établir si le sacubitril/valsartan était supérieur à l'énalapril pour un critère d'évaluation global chez des patients pédiatriques avec insuffisance cardiaque et pour une durée de traitement de 52 semaines. Le critère d'évaluation principal était déduit d'un classement des patients (plus mauvais résultat au meilleur) sur base des résultats cliniques comme le décès, l'introduction de systèmes vitaux mécaniques, la qualification pour une transplantation cardiaque urgente, l'aggravation de l'insuffisance cardiaque, les mesures de la capacité fonctionnelle (scores NYHA/ROSS) et les symptômes d'IC rapportés par le patient (sur l'échelle d'impression globale du patient [PGI-S]). Les patients ayant un ventricule droit systémique ou un seul ventricule et les patients atteints d'une cardiomyopathie restrictive ou hypertrophique ont été exclus de l'étude. La dose d'entretien visée du sacubitril/valsartan était de 2,3 mg/kg de poids corporel, deux fois par jour, pour les patients pédiatriques âgés de 1 mois à < 1 an et de 3,1 mg/kg de poids corporel, deux fois par jour, pour les patients âgés de 1 à < 18 ans, la dose maximale étant de 200 mg deux fois par jour. La dose d'entretien visée pour l'énalapril était de 0,15 mg/kg de poids corporel, deux fois par jour, pour les patients pédiatriques âgés de 1 mois à < 1 an et de 0,2 mg/kg de poids corporel, deux fois par jour, pour les patients âgés de 1 à < 18 ans, la dose maximale étant de 10 mg deux fois par jour.
Dans l'étude, 9 patients étaient âgés de 1 mois à < 1 an, 61 patients avaient de 1 an à < 2 ans, 85 patients de 2 à < 6 ans et 220 patients de 6 à < 18 ans. Au début de l'étude, 15,7% des patients appartenaient à la classe NYHA-ROSS I, 69,3% à la classe II, 14,4% à la classe III et 0,5% à la classe IV. La FEVG moyenne était de 32%. La cause la plus fréquente de l'insuffisance cardiaque était une cardiomyopathie (63,5%). Les traitements les plus fréquents avant la participation à l'étude étaient des inhibiteurs de l'ECA/ antagoniste du récepteur de l'angiotensine II (ARA) (93%), des bêtabloquants (70%), des antagonistes de l'aldostérone (70%) et des diurétiques (84%).
Le ratio Mann-Whitney-Odds pour le critère d'évaluation principal global était de 0,907 (p = 0,424) et donc numériquement en faveur du sacubitril/valsartan (voir tableau 4). Le sacubitril/valsartan et l'énalapril ont entraîné des améliorations cliniques pertinentes comparables pour les critères d'évaluation secondaires classe NYHA/ROSS et modification du score PGIS comparativement aux valeurs initiales. A la semaine 52, les modifications de la classe fonctionnelle NYHA/ROSS comparativement aux valeurs initiales étaient les suivantes pour le sacubitril/valsartan et l'énalapril: amélioration chez 37,7% et respectivement 34,0% des patients, absence de modification chez 50,6% et respectivement, 56,6% des patients et dégradation chez 11,7% et respectivement, 9,4% des patients. Les modifications du score PGIS comparativement à l'état initial ont été similaires, comme suit: amélioration chez 35,5% et respectivement 34,8%, absence de modification chez 48,0% et respectivement, 47,5% et dégradation chez 16,5% et respectivement, 17,7% des patients sous sacubitril/valsartan ou énélapril. Le NT-proBNP a été fortement réduit dans les deux groupes de traitement comparativement à la valeur initiale. L'ampleur de la réduction du NT-proBNP a été comparable à celle observée pour les patients adultes avec insuffisance cardiaque de l'étude PARADIGM-HF. Compte tenu que le sacubitril/valsartan avait amélioré les résultats du traitement et réduit le NT-proBNP dans l'étude PRADIGM-HF, la réduction du NT-proBNP en lien avec les améliorations symptomatiques et fonctionnelles observées dans l'étude PANORAMA-HF comparativement aux valeurs initiales a été considérée comme un motif raisonnable de déduction d'une utilité clinique pour les patients pédiatriques avec insuffisance cardiaque. Les résultats ont été constants dans toutes les tranches d'âge. Le nombre de patients de moins de 1 an ayant participé à l'étude étant insuffisant, l'efficacité du sacubitril/valsartan n'a pas pu être évaluée pour ce groupe de patients.
Tableau 4 Effet du traitement sur le critère d'évaluation principal global dans l'étude PANORAMA-HF
|
|
Sacubitril/Valsartan N = 187
|
Énalapril N = 188
|
Effet du traitement
| |
Critère d'évaluation principal global
|
% de gain*
|
% de gain*
|
Odds** (IC à 95%)
| |
52,4
|
47,6
|
0,907 (0,72; 1,14) valeur de p 0,424
|
* Le pourcentage de gain a été calculé sur base des comparaisons des scores Rank globaux pour chaque patient, pour les patients traités par le sacubitril-valsartan et par l'énalapril (chaque point de pourcentage supérieur est considéré comme un gain, chaque point de pourcentage identique comme un demi-gain).
** Les Mann-Whitney-Odds ont été calculés par division du pourcentage de gain pour l'énalapril par le pourcentage de gain pour le sacubitril/valsartan, avec des Odds < 1 en faveur du sacubitril/valsartan et des Odds > 1 en faveur de l'énalapril.
PharmacocinétiqueAbsorption
Après administration orale, Entresto se dissocie en sacubitril, qui est métabolisé en LBQ657, et en valsartan. Les concentrations plasmatiques maximales respectives sont atteintes après 0,5 heure, 2 heures et 1,5 heure. La biodisponibilité orale absolue de sacubitril et de valsartan est estimée à ≥60% et 23% respectivement.
Le valsartan contenu dans Entresto présente une biodisponibilité plus élevée que le valsartan dans d'autres formulations de comprimés commercialisées; 25,7 mg, 51,4 mg et 102,8 mg de valsartan dans Entresto correspondent à respectivement 40 mg, 80 mg et 160 mg de valsartan dans d'autres formulations de comprimés disponibles sur le marché.
Après administration deux fois par jour d'Entresto, les taux à l'état d'équilibre de sacubitril, LBQ657 et valsartan sont atteints après 3 jours. À l'état d'équilibre, il n'y a pas d'accumulation significative de sacubitril et de valsartan, tandis que l'accumulation du LBQ657 est multipliée par 1,6.
L'administration d'Entresto avec des aliments n'a pas d'influence cliniquement significative sur l'exposition systémique au sacubitril, au LBQ657 et au valsartan. Même si l'administration d'Entresto avec des aliments entraîne une réduction de l'exposition au valsartan, cette réduction n'est pas associée à une baisse cliniquement significative de l'effet thérapeutique. Entresto peut donc être administré indépendamment des repas.
Distribution
Entresto se lie dans une mesure importante aux protéines plasmatiques (94% à 97%). Une comparaison de l'exposition dans le plasma et le LCR a montré que le LBQ657 traverse la barrière hémato-encéphalique dans une faible mesure (0,28%). Le volume de distribution apparent d'Entresto se situe entre 107,8 l et 157,4 l.
Métabolisme
Le sacubitril est transformé rapidement en LBQ657 par l'activité des estérases, LBQ657 n'étant quant à lui pas métabolisé dans une mesure significative. Le valsartan est à peine métabolisé, puisque seuls 20% de la dose environ sont retrouvés en tant que métabolites. Un métabolite hydroxyle a été identifié dans le plasma à une concentration faible (< 10%). La métabolisation du sacubitril et du valsartan ne se faisant que dans une faible mesure via le système enzymatique CYP-450, l'administration concomitante de principes actifs ayant une influence sur le système enzymatique CYP-450 ne devrait pas avoir d'effet sur la pharmacocinétique.
Élimination
Après administration orale, le sacubitril est éliminé dans l'urine à 52–68% (principalement sous forme de LBQ657), le valsartan et ses métabolites l'étant à ~13%; 37–48% du sacubitril (principalement sous forme de LBQ657) et 86% du valsartan et de ses métabolites sont excrétés dans les fèces.
Le sacubitril, le LBQ657 et le valsartan sont éliminés du plasma avec une demi-vie d'élimination moyenne (T1/2) d'env. 1,43 heure, 11,48 heures et 9,90 heures, respectivement.
Linéarité/non-linéarité
La pharmacocinétique du sacubitril, du LBQ657 et du valsartan est linéaire dans la plage de doses étudiée (50 à 400 mg d'Entresto).
Cinétique pour certains groupes de patients
Patients âgés (plus de 65 ans)
L'exposition au LBQ657 et au valsartan est augmentée de 42% et 30% respectivement chez les patients âgés par rapport aux patients plus jeunes. Cependant, cette augmentation n'est pas associée à des effets cliniquement pertinents et par conséquent, aucune adaptation posologique n'est nécessaire.
Enfants et adolescents (≥18 ans)
La pharmacocinétique du sacubitril/valsartan a été étudiée chez des patients pédiatriques atteints d'insuffisance cardiaque, âgés de 1 mois à < 1 an et de 1 an à < 18 ans. Il en ressort que le profil pharmacocinétique du sacubitril/valsartan est similaire chez les patients pédiatriques et adultes (voir «Propriétés/Effets»).
Insuffisance rénale
Une corrélation a été observée entre la fonction rénale et l'exposition systémique au LBQ657, mais pas au valsartan. Chez les patients atteints d'insuffisance rénale légère (60 ml/min/1,73 m2 ≤ DFGe < 90 ml/min/1,73 m2) à modérée (30 ml/min/1,73 m2 ≤ DFGe < 60 ml/min/1,73 m2), l'ASC du LBQ657 a été multipliée par 2. Aucune adaptation posologique n'est nécessaire chez les patients atteints d'insuffisance rénale légère ou modérée. Une augmentation de l'ASC du LBQ657 de 2,7 fois a été observée chez les patients atteints d'insuffisance rénale sévère (DFGe < 30 ml/min/1,73m2). Chez ces patients, une dose initiale de 50 mg deux fois par jour est recommandée. Il convient de faire preuve de prudence lors de l'administration d'Entresto à ce groupe de patients.
Entresto est contre-indiqué chez les patients présentant un DFGe < 10 ml/min/1,73m2 (voir «Contre-indications»).
Aucune étude n'a été réalisée chez les patients dialysés. Cependant, étant donné que le LBQ657 et le valsartan se lient dans une mesure importante aux protéines plasmatiques, il est peu probable qu'une dialyse les élimine efficacement.
Insuffisance hépatique
Chez les patients atteints d'insuffisance hépatique légère à modérée, l'exposition au sacubitril a été multipliée respectivement par 1,5 et 3,4, l'exposition au LBQ657 respectivement par 1,5 et 1,9 et l'exposition au valsartan respectivement par 1,2 et 2,1, comparativement aux sujets sains appariés. Aucune adaptation posologique d'Entresto n'est nécessaire chez les patients atteints d'insuffisance hépatique légère (classe A de Child-Pugh) y compris chez les patients atteints de maladies obstructives biliaires. Chez les patients atteints d'insuffisance hépatique modérée (classe B de Child-Pugh), les expériences cliniques étant limitées, il est recommandé de commencer par une dose de 50 mg deux fois par jour.
Entresto n'a pas été étudié chez les patients présentant une insuffisance hépatique sévère. L'utilisation est donc déconseillée chez les patients atteints d'insuffisance hépatique sévère.
Groupes ethniques
La pharmacocinétique d'Entresto (sacubitril, LBQ657 et valsartan) est comparable chez divers groupes ethniques (blancs, noirs, asiatiques, japonais et autres).
Sexe
La pharmacocinétique d'Entresto (sacubitril, LBQ657 et valsartan) est comparable chez les hommes et les femmes.
Données précliniquesLes données précliniques issues des études conventionnelles (notamment des études portant sur les composants sacubitril et valsartan et/ou sur le sacubitril/valsartan) sur la pharmacologie de sécurité, la toxicité en administration répétée, la génotoxicité, le potentiel carcinogène et la fertilité n'ont pas révélé de risque particulier pour l'homme.
Carcinogénicité, mutagenèse et toxicité génétique
Les études de carcinogénicité réalisées chez le rat et la souris avec le sacubitril et le valsartan n'ont pas révélé de potentiel cancérigène pour Entresto. Les doses de sacubitril étudiées (dose élevée de 1200 et 400 mg/kg/jour, respectivement, chez la souris et le rat) correspondaient environ à 29 et 19 fois la dose maximale recommandée pour l'être humain (MRHD, maximum recommended human dose) en mg/m2. Les doses de valsartan étudiées (dose élevée de 160 et 200 mg/kg/jour, respectivement, chez la souris et le rat) correspondaient environ à 4 et 10 fois la dose maximale recommandée pour l'être humain en mg/m2.
Dans des études de mutagénicité (test d'Ames) et de clastogénicité (aberration chromosomique (test de micronoyaux in vitro et in vivo sur lymphocytes de sang humain périphérique ou sur cellules CHO [chinese hamster ovary (ovaire de hamster chinois)]) avec Entresto, le sacubitril et le valsartan n'ont révélé aucun effet, que ce soit au niveau génique ou chromosomique.
Fertilité, reproduction et développement
Entresto n'a eu aucun effet sur la fertilité ou le développement embryonnaire précoce chez le rat à une dose pouvant atteindre 150 mg/kg/jour (≤1,0 fois et ≤0,18 fois la MRHD sur la base de l'ASC du valsartan et de LBQ657).
Le traitement par Entresto pendant l'organogenèse a entraîné une augmentation de la létalité embryo-fœtale à des doses ≥100 mg/kg/jour (≤0,72 fois la MRHD sur la base de l'ASC) chez le rat et à des doses ≥10 mg/kg/jour (2 fois et 0,03 fois la MRHD sur la base de l'ASC du valsartan et du LBQ657) chez le lapin. Sur la base d'une incidence faible d'hydrocéphalie fœtale associée à des doses toxiques maternelles, observée chez le lapin à une dose d'Entresto ≥10 mg/kg/jour, Entresto est tératogène.
Chez le lapin, un traitement par sacubitril associé à des doses toxiques maternelles (500 mg/kg/jour; 5,7 fois la MRHD sur la base de l'ASC du LBQ657) pendant l'organogenèse a entraîné une létalité et une toxicité embryo-fœtales (diminution du poids fœtal et retard de l'ossification fœtale). Le sacubitril n'a pas d'effet tératogène chez le rat et le lapin. Chez les rats traités par sacubitril, il n'y a pas eu d'indices de toxicité embryo-fœtale ou de tératogénicité. La dose sans effet nocif observé (No-observed-adverse-effect level, NOAEL) du sacubitril au niveau embryo-fœtal était d'au moins 750 mg/kg/jour chez le rat et de 200 mg/kg/jour chez le lapin (2,2 fois la MRHD sur la base de l'ASC du LBQ657).
Des études de développement prénatal et postnatal réalisées chez le rat à des doses de sacubitril allant jusqu'à 750 mg/kg/jour (2,2 fois la MRHD sur la base de l'ASC) et à des doses allant jusqu'à 600 mg/kg/jour (0,86 fois la MRHD sur la base de l'ASC) portent à conclure qu'un traitement par Entresto pendant l'organogenèse, la gravidité et la phase de lactation peut avoir une influence sur le développement et la survie de la progéniture.
Autres résultats précliniques
Sacubitril/valsartan
Les effets d'Entresto sur les concentrations de bêta-amyloïde dans le liquide céphalo-rachidien (LCR) et le tissu cérébral ont été évalués chez des jeunes singes cynomolgus (âgés de 2 à 4 ans) traités pendant deux semaines par Entresto (50 mg/kg/jour). Dans cette étude, Entresto a eu chez les singes cynomolgus un effet pharmacodynamique sur la clairance de l'Aβ du LCR, ce qui a entraîné une élévation de l'Aβ 1–40, 1–42 et 1-38 dans le LCR; aucune élévation correspondante de l'Aβ dans le cerveau n'a été observée. En outre, dans une étude de toxicologie menée chez des singes cynomolgus traités pendant 39 semaines avec 300 mg d'Entresto/kg/jour (donnant lieu à une exposition systémique supérieure à celle atteinte sous 200 mg BID chez l'être humain), il n'y a pas eu d'accumulation de bêta-amyloïde dans le cerveau.
Essais de toxicités chez des animaux juvéniles
Sacubitril
Chez les rats juvéniles (post-partum, jours 7 à 70) traités par le sacubitril, il y a eu une réduction du développement de la masse osseuse et de l'allongement des os liés à l'âge à une exposition d'environ 2 fois l'ASC au métabolite actif du sacubitril, LBQ657, à une dose clinique pédiatrique de sacubitril/valsartan de 3,1 mg/kg, deux fois par jour. Le mécanisme de ces résultats chez le rat juvénile et, par conséquent, la pertinence pour la population pédiatrique chez l'homme ne sont pas connus. Une étude portant sur des rats adultes a montré une influence transitoire minimale sur la densité minérale osseuse. Aucun effet n'a été constaté sur d'autres paramètres pertinents pour la croissance osseuse, ce qui indique que le sacubitril n'a aucun effet important sur les os dans la population adulte de patients et dans des conditions normales. Une légère influence temporaire sur la phase précoce de la consolidation osseuse chez l'adulte due au sacubitril ne peut toutefois pas être exclue.
Valsartan
Chez les rats juvéniles (post-partum, jours 7 à 70) traités par le valsartan, des doses de 1 mg/kg/jour (environ 0,2 fois l'exposition ASC au valsartan à une dose de 3,1 mg/kg de sacubitril/valsartan, deux fois par jour) ont déjà entrainé des modifications rénales durables et irréversibles, en particuler une néphropathie tubulaire (parfois accompagnée d'une nécrose tubulaire) et une dilatation du bassinet. Ces modifications rénales constituent un effet pharmacologique excessif attendu des inhibiteurs de l'enzyme de conversion de l'angiotensine et des antagonistes des récepteurs de type 1 de l'angiotensine II. De tels effets ont été observés lors du traitement de rats pendant les 13 premiers jours de vie. Cette période coïncide avec la 36e semaine de grossesse chez l'homme, qui peut parfois s'étendre chez l'homme, jusqu'à 44 semaines après la conception. La maturation fonctionnelle des reins est un processus continu au cours de la première année de vie chez l'homme. C'est pourquoi on ne peut exclure la pertinence clinique chez l'enfant de moins de 1 an; les données précliniques n'indiquent toutefois aucune préoccupation de sécurité pour l'enfant de plus de 1 an.
Remarques particulièresStabilité
Ce médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Remarques particulières concernant le stockage
Conserver dans l'emballage d'origine, à l'abri de l'humidité; ne pas conserver au-dessus de 30 °C.
Conserver les médicaments hors de portée des enfants.
Précautions spéciales d'élimination
Tout produit non utilisé ou tout produit résiduel doit être éliminé dans les règles conformément aux exigences locales en vigueur.
Numéro d’autorisation65673 (Swissmedic)
69255 (Swissmedic)
PrésentationEntresto 50 mg: emballages de 28 et 56 comprimés pelliculés [B]
Entresto 100 mg: emballages de 56 et 168 comprimés pelliculés [B]
Entresto 200 mg: emballages de 56 et 168 comprimés pelliculés [B]
Entresto 6 mg/6 mg granulés pelliculés: emballages de 60 gélules [B]
Entresto 15 mg/16 mg granulés pelliculés: emballages de 60 gélules [B]
Titulaire de l’autorisationNovartis Pharma Schweiz AG, Risch; domicile: 6343 Rotkreuz
Mise à jour de l’informationDécembre 2023
Mode d'utilisation et de manipulation – Entresto granulés pelliculés
Il est important de suivre les présentes instructions pour s'assurer que vous administrez Entresto correctement à votre enfant. Votre médecin, pharmacien ou prestataire de soins vous expliquera comment procéder.
|
Étape 1
|
·Lavez-vous et séchez-vous les mains
|
|

| |
Étape 2
|
·Placez les accessoires suivants sur une surface plane et propre:
·Un petit bol, une tasse ou une cuillère avec une petite quantité de nourriture molle, que l’enfant aime manger.
·Plaquettes blister avec les gélules qui contiennent les granulés Entresto.
·Vérifiez que vous disposez du ou des dosages corrects de Entresto granulés.
|
|

| |
Étape 3
|
·Pressez sur le blister pour en extraire la ou les gélules.
|
|

| |
Étape 4
|
Pour ouvrir la gélule:
·Tenez la gélule en position verticale (avec la partie colorée vers le haut) de sorte que les granulés se trouvent dans la partie inférieure de la gélule.
·Maintenez la gélule au-dessus de la nourriture molle.
·Pressez prudemment sur le centre de la gélule et tirez légèrement sur la coiffe pour ouvrir la gélule. Veillez à ne pas renverser le contenu.
|
|
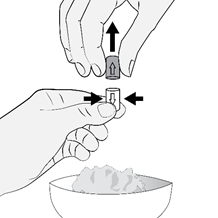
| |
Étape 5
|
·Dispersez l'entièreté des granulés de la gélule sur la nourriture.
·Veillez à n'oublier aucun granulé.
Répétez les étapes 4 et 5 si plus d'une gélule sont nécessaires pour obtenir la dose prescrite.
|
|

| |
Étape 6
|
Donnez la nourriture avec les granulés à votre enfant sans attendre et veillez à ce qu'il avale le tout.
Veillez à ce que votre enfant ne mâche pas le granulé pour éviter des modifications de goût.
|
|

| |
Étape 7
|
Jetez les parties vides de la gélule.
|
|

|
|









