CompositionPrincipes actifs
Atezolizumabum (produit par génie génétique à l'aide de cellules CHO [Chinese Hamster Ovary]).
Excipients
Hyaluronidasum humanum (produit par génie génétique à l'aide de cellules CHO [Chinese Hamster Ovary]), L-histidinum, acidum aceticum, L-methioninum, saccharum (produit à partir de betterave sucrière génétiquement modifiée), polysorbatum 20 (produit à partir de maïs génétiquement modifié), aqua ad iniectabile.
Indications/Possibilités d’emploiCancer du poumon non à petites cellules (CPNPC ou NSCLC) au stade précoce
Tecentriq en monothérapie est indiqué pour le traitement adjuvant des patients atteints d'un NSCLC de stade II ou IIIA (système de classification de l'UICC/AJCC, 7e édition) dont la tumeur n'a pas progressé après une chimiothérapie à base de cisplatine et présente une expression tumorale de PD-L1 ≥50% (voir «Propriétés/Effets»).
Cancer du poumon non à petites cellules (CPNPC ou NSCLC) métastatique
Tecentriq, en association au nab-paclitaxel et au carboplatine, est indiqué pour le traitement de première intention des patients atteints d'un NSCLC non épidermoïde métastatique sans aberrations génomiques tumorales du gène EGFR ou ALK.
Tecentriq, en association au paclitaxel et au carboplatine, est indiqué pour le traitement de première intention des patients atteints d'un NSCLC non épidermoïde métastatique sans aberrations génomiques tumorales du gène EGFR ou ALK et dont les tumeurs présentent une expression de PD-L1 ≥1%.
Tecentriq, en monothérapie, est indiqué pour le traitement des patients atteints d'un cancer du poumon CPNPC (ou NSCLC) localement avancé ou métastatique, après chimiothérapie préalable.
Cancer du poumon à petites cellules (CPPC ou SCLC)
Tecentriq, en association avec le carboplatine et l'étoposide, est indiqué dans le traitement de première intention des patients atteints d'un cancer du poumon à petites cellules de stade avancé (CPPC-SA ou ES-SCLC, extensive-stage small cell lung cancer).
Tecentriq, en association avec la lurbinectédine, est indiqué pour le traitement d'entretien des patients adultes atteints d'un ES-SCLC sans métastases du SNC, chez qui la maladie n'a pas progressé après un traitement d'induction de première intention par Tecentriq, le carboplatine et l'étoposide.
Carcinome urothélial
Tecentriq, en monothérapie, est indiqué pour le traitement de patients adultes atteints d'un carcinome urothélial localement avancé ou métastatique, après chimiothérapie préalable à base de platine.
Cancer du sein triplement négatif
Tecentriq est indiqué en combinaison avec le nab-paclitaxel dans le traitement des patientes adultes atteintes d'un cancer du sein triplement négatif (TNBC) non résécable localement avancé ou métastatique, dont les tumeurs présentent une expression de PD-L1 ≥1% et qui n'ont pas reçu précédemment de chimiothérapie ni de traitement systémique ciblé en raison de leur maladie au stade avancé (posologie du nab-paclitaxel, voir «Posologie/Mode d'emploi»).
Tecentriq ne doit pas être utilisé en combinaison avec le paclitaxel dans le traitement de patientes adultes atteintes d'un TNBC non résécable, localement avancé ou métastatique (voir «Posologie/Mode d'emploi» et «Mises en garde et précautions»).
Mélanome
Tecentriq est indiqué en association avec du cobimétinib et du vémurafénib dans le traitement des patients adultes atteints d'un mélanome métastatique ou non résécable, testés positifs pour la mutation BRAF-V600E (voir «Efficacité clinique»).
Carcinome hépatocellulaire
Tecentriq est indiqué en association avec le bévacizumab dans le traitement des patients atteints de carcinome hépatocellulaire (CHC) inopérable ou métastatique, qui n'ont pas reçu de traitement systémique antérieur (voir rubriques «Mises en garde et précautions» et «Propriétés/Effets»).
Posologie/Mode d’emploiGénéralités
Tecentriq doit être administré sous la surveillance d'un professionnel de la santé qualifié. Il est impératif de vérifier la désignation du produit afin de s'assurer que les patients reçoivent la formulation correcte, conformément à la prescription (Tecentriq pour administration i.v. ou Tecentriq sous-cutané pour administration s.c.). Les patients recevant actuellement Tecentriq i.v. peuvent passer à Tecentriq sous-cutané (et vice versa). Le passage de Tecentriq i.v. en monothérapie à Tecentriq sous-cutané en monothérapie, et vice versa, a été évalué dans une étude randomisée (voir «Effets indésirables» et «Efficacité clinique»).
Afin d'assurer la traçabilité des médicaments biotechnologiques, il convient de documenter pour chaque traitement le nom commercial et le numéro de lot.
Tecentriq dans sa formulation pour administration sous-cutanée (Tecentriq s.c.) n'est pas destiné à être administré par voie intraveineuse. Tecentriq s.c. doit être administré exclusivement en injection sous-cutanée (voir «Remarques particulières: Remarques concernant la manipulation»). Avant l'administration, sortir Tecentriq s.c. du réfrigérateur et laisser la solution revenir à température ambiante.
Injecter 15 ml de la solution de Tecentriq s.c. par voie sous-cutanée dans la cuisse pendant environ 7 minutes. Il est recommandé d'utiliser un set de perfusion pour voie sous-cutanée (p.ex. avec ailettes/«butterfly»). NE PAS administrer le volume mort demeurant dans la tubulure de la perfusion.
Les sites d'injection doivent être alternés uniquement entre la cuisse gauche et la cuisse droite. Les nouvelles injections doivent être administrées à une distance minimale de 2,5 cm du site précédent dans de la peau saine et en aucun cas à des endroits où la peau présente des rougeurs, des lésions, des indurations ou est sensible. Pendant le traitement par Tecentriq s.c., les autres médicaments destinés à être administrés par voie sous-cutanée doivent être injectés de préférence au niveau d'autres sites.
Sélection des patients
Test de PD-L1 pour les patients atteints d'un TNBC qui doivent être traités par Tecentriq en combinaison avec le nab-paclitaxel, pour les patients atteints d'un NSCLC au stade précoce qui doivent être traités par Tecentriq en monothérapie, et pour les patients atteints d'un NSCLC métastatique en 1L qui doivent être traités par Tecentriq en combinaison avec le paclitaxel et le carboplatine.
Pour le traitement par Tecentriq, les patients adultes doivent présenter une expression positive de PD-L1 déterminée à l'aide d'un test validé pour Tecentriq (voir rubrique «Propriétés/Effets»).
Test pour les patients atteints de mélanome
Pour être traités par Tecentriq en association avec du cobimétinib et du vémurafénib, les patients atteints de mélanome doivent présenter une mutation BRAF V600E confirmée par un test validé.
Monothérapie par Tecentriq
Tableau 1: Posologie recommandée pour la monothérapie par Tecentriq en injection sous-cutanée
|
Indication
|
Posologie recommandée et calendrier
|
Durée du traitement
(voir «Efficacité clinique»)
| |
Carcinome urothélial en 2e ligne de traitement (2L)
|
1875 mg toutes les 3 semaines
|
Jusqu'à perte du bénéfice clinique ou survenue d'une toxicité qui ne peut pas être traitée
| |
NSCLC métastatique en 2L*
| |
NSCLC au stade précoce
|
Pendant 1 an, sauf si survenue d'une récidive ou d'une toxicité inacceptable
|
* La formulation sous-cutanée de Tecentriq n'a été étudiée que dans cette population (voir «Propriétés/Effets: Efficacité clinique»).
Traitement combiné avec Tecentriq
Pour l'utilisation de Tecentriq en traitement combiné, il convient de tenir également compte de l'information professionnelle complète du produit associé.
Tableau 2: Posologie recommandée pour le traitement combiné avec Tecentriq en injection sous-cutanée
|
Indication
|
Posologie recommandée et calendrier
|
Durée du traitement
(voir «Efficacité clinique»)
| |
Tecentriq
|
Médicament associé
| |
NSCLC non épidermoïde métastatique en 1L
Tecentriq avec paclitaxel et carboplatine
|
Phase d'induction:
1875 mg toutes les 3 semaines
Tecentriq doit être administré avant le traitement combiné lorsque l'administration a lieu le même jour.
Phase d'entretien (sans chimiothérapie):
1875 mg toutes les 3 semaines
|
Phase d'induction:
·Tecentriq, suivi du paclitaxel, puis du carboplatine en perfusion i.v., sont administrés toutes les 3 semaines.
|
Phase d'induction:
·pendant quatre ou six cycles
Phase d'entretien:
·jusqu'à perte du bénéfice clinique ou survenue d'une toxicité qui ne peut pas être traitée
| |
NSCLC non épidermoïde métastatique en 1L
Tecentriq avec nab-paclitaxel et carboplatine
|
Phase d'induction:
·Le nab-paclitaxel et le carboplatine sont administrés toutes les trois semaines en perfusion intraveineuse.
·Lors de chaque cycles de 21 jours, Tecentriq, le nab-paclitaxel et le carboplatine sont administrés au jour 1.
·Le nab-paclitaxel est également administré aux jours 8 et 15.
| |
ES-SCLC en 1L
Tecentriq avec carboplatine et étoposide
|
Phase d'induction:
·Le carboplatine, puis l'étoposide sont administrés toutes les trois semaines en perfusion intraveineuse.
·Tecentriq, le carboplatine, puis l'étoposide sont administrés au jour 1 de chaque cycle.
·L'étoposide est également administré aux jours 2 et 3 en perfusion intraveineuse.
|
Phase d'induction:
·pendant quatre cycles
Phase d'entretien:
·jusqu'à perte du bénéfice clinique ou survenue d'une toxicité qui ne peut pas être traitée
| |
ES-SCLC en 1L
Traitement d'entretien
Tecentriq avec lurbinectédine
|
1875 mg toutes les 3 semaines
Tecentriq doit être administré en premier lorsque l'administration a lieu le même jour.
|
Phase d'entretien:
·Lors de chaque cycle de 21 jours, Tecentriq est administré au jour 1.
·La lurbinectédine à raison de 3,2 mg/m2 est administrée toutes les 3 semaines en perfusion intraveineuse.
|
Jusqu'à progression de la maladie ou survenue d'une toxicité inacceptable
| |
TNBC en 1L
Tecentriq avec nab-paclitaxel
|
1875 mg toutes les 3 semaines
Tecentriq doit être administré avant le traitement combiné lorsque l'administration a lieu le même jour.
|
·Le nab-paclitaxel est administré à la dose de 100 mg/m2 aux jours 1, 8 et 15 de chaque cycle de 28 jours en perfusion intraveineuse.
·Tecentriq est administré à un intervalle de 3 semaines.
·La substitution du nab-paclitaxel par d'autres formulations de paclitaxel pour le traitement du TNBC n'est pas autorisée (voir «Indications/Possibilités d'emploi» et «Mises en garde et précautions»).
|
Jusqu'à progression de la maladie ou survenue d'une toxicité inacceptable
| |
Mélanome
Tecentriq avec cobimétinib et vémurafénib
|
1875 mg toutes les 3 semaines
|
·Avant l'instauration du traitement par Tecentriq, les patients reçoivent pendant un cycle de 28 jours 60 mg de cobimétinib une fois par jour par voie orale (21 jours avec médication et 7 jours de pause) et 960 mg de vémurafénib deux fois par jour par voie orale aux jours 1-21 et 720 mg de vémurafénib deux fois par jour par voie orale aux jours 22-28.
·Pendant le traitement par Tecentriq, les patients reçoivent 60 mg de cobimétinib une fois par jour (21 jours avec médication et 7 jours de pause) et 720 mg de vémurafénib deux fois par jour par voie orale (voir «Efficacité clinique»).
|
Jusqu'à progression de la maladie ou survenue d'une toxicité inacceptable
| |
CHC en 1L
Tecentriq avec bévacizumab
|
1875 mg toutes les 3 semaines
Tecentriq doit être administré avant le traitement combiné lorsque l'administration a lieu le même jour.
|
·Tecentriq, suivi de 15 mg de bévacizumab par kg de poids corporel en perfusion intraveineuse, sont administrés toutes les 3 semaines.
|
Jusqu'à perte du bénéfice clinique ou survenue d'une toxicité qui ne peut pas être traitée
|
Ajustement de la posologie
Aucune réduction de la dose de Tecentriq n'est recommandée.
Ajustement de la posologie du fait d'effets indésirables à médiation immunitaire/d'interactions
Les recommandations relatives à certaines réactions médicamenteuses indésirables sont présentées dans le tableau 3 (voir rubriques «Mises en garde et précautions» et «Effets indésirables»).
Tableau 3: Recommandations pour l'ajustement posologique de Tecentriq
|
Réaction indésirable à médiation immunitaire
|
Degré de sévérité
|
Ajustement du traitement
| |
Infections
|
Grade 3 ou 4
|
Interrompre l'administration de la dose jusqu'à une amélioration au grade 1 ou jusqu'à résolution complète
| |
Réactions liées à la perfusion
|
Grade 1 ou 2
|
Diminuer la vitesse d'injection ou interrompre l'injection. Le traitement peut être repris après la disparition de l'événement.
Pour les doses suivantes, une prémédication par des antipyrétiques et des antihistaminiques peut être envisagée.
| |
Grade 3 ou 4
|
Arrêter définitivement Tecentriq
| |
Lymphohistiocytose hémophagocytaire
|
Suspicion de lymphohistiocytose hémophagocytaire (quelle que soit la sévérité)
|
Arrêter définitivement Tecentriq
| |
Pneumopathie inflammatoire à médiation immunitaire
|
Grade 2
|
Interrompre l'injection de Tecentriq
En cas d'amélioration de l'événement indésirable au grade 0 ou 1 en l'espace de 12 semaines et de réduction des doses de corticostéroïdes à ≤10 mg par jour de prednisone ou équivalent, le traitement peut être repris.
| |
|
Grade 3 ou 4
|
Arrêter définitivement Tecentriq
| |
Hépatite à médiation immunitaire chez les patients sans CHC
|
Grade 2:
(ALAT ou ASAT > 3 à 5 × la limite supérieure de la norme [LSN]
ou
bilirubinémie > 1,5 à 3 × LSN)
|
Interrompre l'injection de Tecentriq
En cas d'amélioration de l'événement indésirable au grade 0 ou 1 en l'espace de 12 semaines et de réduction des doses de corticostéroïdes à ≤10 mg par jour de prednisone ou équivalent, le traitement peut être repris.
| |
Grade 3 ou 4:
(ALAT ou ASAT > 5 × LSN
ou
bilirubinémie > 3 × LSN)
|
Arrêter définitivement Tecentriq
| |
Hépatite à médiation immunitaire chez les patients atteints de CHC
|
Taux initiaux d'ASAT/ALAT dans les limites de la norme et augmentation à > 3 × à ≤ 10 × LSN
Taux initiaux d'ASAT/ALAT > 1 à ≤ 3 × LSN et augmentation à > 5 × à ≤ 10 × LSN
Taux initiaux d'ASAT/ALAT > 3 × à ≤ 5 × LSN et augmentation à > 8 × à ≤ 10 × LSN
|
Interrompre l'injection de Tecentriq
Le traitement peut être repris lorsque l'effet indésirable s'améliore jusqu'au grade 0 ou au grade 1 en l'espace de 12 semaines et que la dose de corticostéroïdes a été réduite à ≤10 mg de prednisone ou équivalent par jour.
| |
Augmentation des taux d'ASAT/ALAT à > 10 × LSN ou augmentation de la bilirubine totale à > 3 × LSN
|
Arrêter définitivement Tecentriq
| |
Colite à médiation immunitaire
|
Diarrhée de grade 2 ou 3 (augmentation de ≥4 selles/jour par rapport au début du traitement)
ou
colite symptomatique
|
Interrompre l'injection de Tecentriq
En cas d'amélioration de l'événement indésirable au grade 0 ou 1 en l'espace de 12 semaines et de réduction des doses de corticostéroïdes à ≤10 mg par jour de prednisone ou équivalent, le traitement peut être repris.
| |
Diarrhée ou colite de grade 4 (potentiellement fatale; indication pour une intervention d'urgence)
|
Arrêter définitivement Tecentriq
| |
Hypothyroïdie ou hyperthyroïdie à médiation immunitaire
|
Symptomatique
|
Interrompre l'injection de Tecentriq
Hypothyroïdie:
Lorsque les symptômes sont contrôlés par un traitement substitutif de la thyroïde et que les taux de TSH redescendent, le traitement peut être repris.
Hyperthyroïdie:
Lorsque les symptômes sont contrôlés par un médicament suppresseur de la thyroïde et que la fonction thyroïdienne s'améliore, le traitement peut être repris.
| |
Insuffisance surrénalienne à médiation immunitaire
|
Symptomatique
|
Interrompre l'injection de Tecentriq
En cas d'amélioration des symptômes au grade 0 ou 1 en l'espace de 12 semaines et de réduction des doses de corticostéroïdes à ≤10 mg par jour de prednisone ou équivalent, et pour autant que le patient soit stable sous la thérapie substitutive, le traitement peut être repris.
| |
Hypophysite à médiation immunitaire
|
Grade 2 ou 3
|
Interrompre l'injection de Tecentriq
En cas d'amélioration des symptômes au grade 0 ou 1 en l'espace de 12 semaines et de réduction des doses de corticostéroïdes à ≤10 mg par jour de prednisone ou équivalent, et pour autant que le patient soit stable sous la thérapie substitutive, le traitement peut être repris.
| |
Grade 4
|
Arrêter définitivement Tecentriq
| |
Diabète sucré de type 1 à médiation immunitaire
|
Hyperglycémie de grade 3 ou 4 (glycémie à jeun > 250 mg/dl ou 13,9 mmol/l)
|
Interrompre l'injection de Tecentriq
En présence d'un contrôle métabolique obtenu par l'insulinothérapie substitutive, le traitement peut être repris.
| |
Syndrome myasthénique/
myasthénie grave,
syndrome de Guillain-Barré
et méningoencéphalite, à médiation immunitaire
|
Tous les grades
|
Arrêter définitivement Tecentriq
| |
Myélite à médiation immunitaire
|
Tous les grades
|
Arrêter définitivement Tecentriq
| |
Parésie faciale à médiation immunitaire
|
Grade 1 ou 2
|
Interrompre l'injection de Tecentriq
Un traitement par des corticostéroïdes (1–2 mg/kg/jour de prednisone ou équivalent) doit être instauré. En cas de disparition complète ou partielle de l'événement (grade 0 à 1) en l'espace de 12 semaines et après réduction des doses de corticostéroïdes à ≤10 mg/jour de prednisone orale ou équivalent, le traitement par Tecentriq peut être repris.
| |
Grade 3 ou 4
|
Arrêter définitivement Tecentriq
| |
Pancréatite à médiation immunitaire
|
Élévation de grade 3 ou 4 des taux sériques d'amylase ou des taux sériques de lipase (> 2× LSN)
ou pancréatite de grade 2 ou 3
|
Interrompre l'injection de Tecentriq
En cas d'amélioration des taux sériques d'amylase et de lipase au grade 0 ou 1 en l'espace de 12 semaines, ou après la disparition des symptômes de la pancréatite et la réduction des doses de corticostéroïdes à ≤10 mg par jour de prednisone ou équivalent, le traitement peut être repris.
| |
Pancréatite récidivante de grade 4 ou de tout grade
|
Arrêter définitivement Tecentriq
| |
Myocardite à médiation immunitaire
|
Grade 2 ou supérieur
|
Arrêter définitivement Tecentriq
| |
Myosite à médiation immunitaire
|
Grade 2 ou 3
|
Interrompre l'injection de Tecentriq
En cas d'amélioration des symptômes au grade 0 ou 1 en l'espace de 12 semaines et de réduction des doses de corticostéroïdes à ≤10 mg par jour de prednisone ou équivalent, le traitement peut être repris.
| |
Grade 4 ou myosite récidivante de grade 3
|
Arrêter définitivement Tecentriq
| |
Néphrite à médiation immunitaire
|
Grade 2:
(taux de créatinine > 1,5 - 3 × valeur initiale au début du traitement ou > 1,5 - 3 × LSN)
|
Interrompre l'injection de Tecentriq
En cas d'amélioration de l'événement indésirable au grade 0 ou 1 en l'espace de 12 semaines et de réduction des doses de corticostéroïdes à ≤10 mg par jour de prednisone ou équivalent, le traitement peut être repris.
| |
Grade 3:
(taux de créatinine > 3 × valeur initiale au début du traitement ou > 3 - 6 × LSN)
ou grade 4:
(taux de créatinine > 6 × LSN)
|
Arrêter définitivement Tecentriq
| |
Affections du péricarde à médiation immunitaire
|
Péricardite de grade 1
|
Interrompre l'injection de Tecentriq
Effectuer un bilan cardiologique détaillé afin de déterminer l'étiologie et de traiter de manière appropriée.
| |
Grade 2 ou supérieur
|
Arrêter définitivement Tecentriq
| |
Éruption cutanée/Réactions cutanées sévères à médiation immunitaire
|
Grade 3
ou suspicion de syndrome de Stevens-Johnson (SSJ) ou de nécrolyse épidermique toxique (NET)
|
Interrompre l'injection de Tecentriq
Après la disparition de l'éruption cutanée et la réduction des doses de corticostéroïdes à ≤10 mg par jour de prednisone ou équivalent, le traitement peut être repris.
| |
Grade 4
ou confirmation d'un syndrome de Stevens-Johnson (SSJ) ou d'une nécrolyse épidermique toxique (NET)
|
Arrêter définitivement Tecentriq
| |
Autres réactions indésirables à médiation immunitaire
|
Grade 2 ou grade 3
|
Interruption jusqu'à une amélioration des réactions indésirables au grade 0-1 en l'espace de 12 semaines et une réduction des doses de corticostéroïdes à ≤10 mg par jour de prednisone ou équivalent.
| |
Grade 4 ou récidivantes de grade 3
|
Arrêter définitivement Tecentriq (excepté en cas d'endocrinopathies contrôlées par traitement hormonal substitutif)
| |
Effet indésirable persistant à médiation immunitaire de grade 2 ou 3 (à l'exception des endocrinopathies)
|
Effet indésirable à médiation immunitaire de grade 2 ou 3 qui ne s'améliore pas jusqu'au grade 0 ou 1 dans les 12 semaines qui suivent l'administration de la dernière dose de Tecentriq
|
Arrêter définitivement le traitement
| |
Impossibilité de réduire progressivement la dose de corticostéroïdes
|
Impossibilité de réduire à une dose inférieure ou égale à 10 mg par jour de prednisone ou équivalent dans les 12 semaines qui suivent l'administration de la dernière dose de Tecentriq
|
Arrêter définitivement le traitement
| |
Effet indésirable récurrent à médiation immunitaire de grade 3 ou 4
|
Effet indésirable récurrent à médiation immunitaire de grade 3 ou 4 (sévère ou engageant le pronostic vital)
|
Arrêter définitivement le traitement
|
Remarque: Les grades de toxicité correspondent aux critères généraux de terminologie pour les événements indésirables de l'Institut national du cancer (National Cancer Institute Common Terminology Criteria for Adverse Event), version 5.0 (NCI-CTCAE v.5.).
Prise retardée
Si une dose prévue de Tecentriq est omise, elle doit être administrée dès que possible, sans attendre la dose suivante prévue. Le schéma d'administration devrait être ajusté afin de maintenir un intervalle de trois semaines entre les doses.
Instructions posologiques particulières
Patients présentant des troubles de la fonction hépatique
Une analyse pharmacocinétique de population a révélé qu'aucun ajustement posologique n'est nécessaire chez les patients présentant une insuffisance hépatique légère et modérée. Aucune donnée n'existe pour les patients présentant une insuffisance hépatique sévère (voir «Pharmacocinétique»).
Patients présentant des troubles de la fonction rénale
D'après les résultats d'une analyse pharmacocinétique de population, aucun ajustement posologique n'est nécessaire chez les patients présentant une insuffisance rénale légère ou modérée (voir section «Pharmacocinétique»). Les données concernant les patients présentant une insuffisance rénale sévère sont trop limitées pour permettre de tirer des conclusions sur cette population.
Patients âgés
Sur 3040 patients atteints de carcinome urothélial, de cancer du poumon, de cancer du sein triple négatif, de carcinome hépatocellulaire et de mélanome traités avec Tecentriq lors des études cliniques, 43% étaient âgés de 65 ans et plus, et 12% de 75 ans et plus. Une analyse pharmacocinétique de population a révélé qu'aucun ajustement de la dose de Tecentriq n'est nécessaire chez les patients ≥65 ans (voir «Pharmacocinétique»).
Enfants et adolescents
L'utilisation de Tecentriq n'est pas autorisée chez les patients âgés de moins de 18 ans. La sécurité et l'efficacité de Tecentriq pour cette population ne sont pas établies. Dans une étude clinique, Tecentriq n'a présenté aucun bénéfice clinique chez les enfants et les adolescents (voir «Propriétés/Effets: Efficacité clinique»).
Génotype/Polymorphismes génétiques
Patients asiatiques
Il est recommandé d'administrer une dose initiale de 175 mg/m2 de paclitaxel toutes les trois semaines aux patients asiatiques, en raison d'une toxicité hématologique accrue observée dans cette population au cours de l'étude IMpower150.
Contre-indicationsTecentriq est contre-indiqué chez les patients présentant une hypersensibilité connue à l'atézolizumab ou à l'un des excipients.
Mises en garde et précautionsInfections
Tecentriq peut entraîner des infections sévères susceptibles d'être fatales (voir «Effets indésirables, Études cliniques»). Les patients doivent être surveillés pour détecter tout signe et symptôme éventuel d'infection. En présence d'infections de grade 3 ou supérieur, l'administration de Tecentriq doit être interrompue et ne peut être reprise que lorsqu'une stabilisation clinique s'est produite (voir «Posologie/Mode d'emploi, Tableau 1: Recommandations pour l'ajustement posologique de Tecentriq»).
Lors de l'étude IMscin001, des événements infectieux indésirables de grade 5 sont survenus plus fréquemment chez les patients ayant reçu Tecentriq par voie sous-cutanée que chez les patients ayant reçu Tecentriq par voie intra-veineuse (respectivement 3,2% et 1,6%).
Lors de l'étude portant sur le mélanome (CO39262), la fréquence de survenue des infections a été plus élevée chez les patients ayant reçu Tecentriq i.v. en association avec le cobimétinib et le vémurafénib (voir «Effets indésirables»).
Réactions liées à la perfusion
Des réactions liées à la perfusion, y compris une anaphylaxie, ont été observées au cours d'études cliniques réalisées avec Tecentriq (voir «Effets indésirables»).
Chez les patients présentant des réactions liées à la perfusion de grade 1 ou 2, il convient de diminuer la vitesse de l'injection ou de suspendre le traitement. Chez les patients présentant des réactions liées à la perfusion de grade 3 ou 4, il convient d'arrêter définitivement Tecentriq. Chez les patients présentant des réactions liées à la perfusion de grade 1 ou 2, le traitement par Tecentriq peut être poursuivi sous surveillance étroite; une prémédication par antipyrétiques et antihistaminiques peut être envisagée.
Les données précliniques préliminaires (voir «Données précliniques») indiquent que l'atézolizumab pourrait diminuer les réponses primaires et secondaires des IgG (immunoglobulines G) aux antigènes T-dépendants.
Pneumopathie inflammatoire à médiation immunitaire
Des cas de pneumopathies inflammatoires, dont certains d'issue fatale, ont été observés au cours d'études cliniques réalisées avec Tecentriq (voir «Effets indésirables, Études cliniques»). Les patients doivent être surveillés à la recherche de signes et de symptômes d'une pneumopathie inflammatoire.
En cas de pneumopathie inflammatoire de grade 2, il convient d'interrompre le traitement par Tecentriq et d'instaurer un traitement par 1 à 2 mg/kg de prednisone ou équivalent par jour. En cas d'amélioration des symptômes à un grade ≤1, les corticostéroïdes doivent être arrêtés progressivement sur une période de ≥1 mois. Le traitement par Tecentriq peut être repris en cas d'amélioration de l'événement à un grade ≤1 en l'espace de 12 semaines et de réduction des doses de corticostéroïdes à ≤10 mg de prednisone orale ou équivalent par jour. En cas de pneumopathie inflammatoire de grade 3 ou 4, il convient d'arrêter définitivement le traitement par Tecentriq.
Lors de l'étude portant sur le mélanome (CO39262), la fréquence de survenue d'une pneumopathie inflammatoire d'origine immunologique a été plus élevée chez les patients ayant reçu Tecentriq i.v. en association avec le cobimétinib et le vémurafénib (voir «Effets indésirables»).
Hépatite à médiation immunitaire
Des cas d'hépatites, dont certains d'issue fatale, ont été observés au cours d'études cliniques réalisées avec Tecentriq (voir «Effets indésirables, Études cliniques»). Les patients doivent être surveillés à la recherche de signes et de symptômes d'une hépatite. Les taux d'aspartate aminotransférase (ASAT), d'alanine aminotransférase (ALAT) et de bilirubine doivent être contrôlés avant le traitement et régulièrement au cours du traitement par Tecentriq. Chez les patients présentant des anomalies du bilan hépatique (BH) avant le début du traitement, des mesures appropriées doivent être envisagées.
En cas de persistance des symptômes de grade 2 (ALAT ou ASAT > 3× la limite supérieure de la norme (LSN) ou bilirubinémie > 1,5× LSN) pendant plus de 5 à 7 jours, il convient d'interrompre le traitement et d'instaurer un traitement par 1 à 2 mg/kg de prednisone ou équivalent par jour. En cas d'amélioration des anomalies du BH à un grade ≤1, les corticostéroïdes doivent être arrêtés progressivement sur une période de ≥1 mois. Le traitement par Tecentriq peut être repris en cas d'amélioration de l'événement à un grade ≤1 en l'espace de 12 semaines et de réduction des doses de corticostéroïdes à ≤10 mg de prednisone orale ou équivalent par jour. En cas d'événements de grade 3 ou 4 (ALAT ou ASAT > 5,0× LSN ou bilirubinémie > 3× LSN), il convient d'arrêter définitivement le traitement par Tecentriq.
Lors de l'étude portant sur le mélanome (CO39262), la fréquence de survenue d'une hépatite d'origine immunologique a été plus élevée chez les patients ayant reçu Tecentriq i.v. en association avec le cobimétinib et le vémurafénib (voir «Effets indésirables»).
Colite à médiation immunitaire
Des cas de diarrhées, de colite et d'autres événements gastro-intestinaux tels qu'une perforation intestinale ont été observés au cours d'études cliniques réalisées avec Tecentriq (voir «Effets indésirables, Études cliniques»). Les patients doivent être surveillés à la recherche de signes et de symptômes d'une colite.
En cas de diarrhées de grade 2 ou 3 (augmentation de ≥4 selles/jour par rapport au début du traitement) ou de colite (symptomatique), le traitement par Tecentriq doit être interrompu. Lors de diarrhées ou de colite de grade 2, un traitement par 1 à 2 mg/kg de prednisone ou équivalent par jour doit être instauré en cas de persistance des symptômes pendant plus de 5 jours ou de réapparition de ces symptômes. Une diarrhée ou une colite de grade 3 doit être traitée par des corticostéroïdes i.v. (1 à 2 mg/kg de méthylprednisolone ou équivalent par jour). Après amélioration, il faut passer à des corticostéroïdes oraux (1 à 2 mg/kg de prednisone ou équivalent par jour). En cas d'amélioration des symptômes à un grade ≤1, les corticostéroïdes doivent être arrêtés progressivement sur une période de ≥1 mois. Le traitement par Tecentriq peut être repris en cas d'amélioration de l'événement à un grade ≤1 en l'espace de 12 semaines et de réduction des doses de corticostéroïdes à ≤10 mg de prednisone orale ou équivalent par jour. En cas de diarrhées ou de colite de grade 4 (menaçant le pronostic vital: intervention d'urgence indiquée), il convient d'arrêter définitivement le traitement par Tecentriq.
Lors de l'étude portant sur le mélanome (CO39262), la fréquence de survenue de diarrhée ou de colite a été plus élevée chez les patients ayant reçu Tecentriq i.v. en association avec le cobimétinib et le vémurafénib (voir «Effets indésirables»).
Endocrinopathies à médiation immunitaire
Des cas d'hypothyroïdie, d'hyperthyroïdie, d'insuffisance surrénalienne, d'hypophysite et de diabète sucré de type 1, y compris d'acidocétose diabétique, ont été observés au cours d'études cliniques réalisées avec Tecentriq (voir «Effets indésirables, Études cliniques»). Les patients doivent être surveillés à la recherche de signes et de symptômes d'endocrinopathies. La fonction thyroïdienne doit être contrôlée avant le traitement et régulièrement au cours du traitement par Tecentriq. Chez les patients présentant des anomalies du bilan thyroïdien avant le début du traitement, des mesures appropriées doivent être envisagées.
Les patients asymptomatiques présentant des résultats anormaux aux tests de la fonction thyroïdienne peuvent être traités par Tecentriq. Le traitement par Tecentriq doit être interrompu en cas d'hypothyroïdie symptomatique et une thérapie de substitution par hormones thyroïdiennes doit être instaurée en cas de besoin. Une hypothyroïdie isolée peut éventuellement être traitée par une thérapie de substitution sans corticostéroïdes. En cas d'hyperthyroïdie symptomatique, le traitement par Tecentriq doit être interrompu et un traitement par un thyréostatique, par ex. le méthimazole ou le carbimazole, doit être instauré en cas de besoin. Le traitement par Tecentriq peut être repris dès que les symptômes ont pu être contrôlés et que la fonction thyroïdienne s'est améliorée.
En cas d'insuffisance surrénalienne symptomatique, le traitement par Tecentriq doit être interrompu et un traitement par 1 à 2 mg/kg/jour de méthylprednisolone i.v. ou équivalent doit être instauré. Dès que les symptômes se sont améliorés, un traitement par 1 à 2 mg/kg/jour de prednisone orale ou équivalent doit alors suivre. En cas d'amélioration des symptômes à un grade ≤1, les corticostéroïdes doivent être arrêtés progressivement sur une période de ≥1 mois. Le traitement par Tecentriq peut être repris en cas d'amélioration de l'événement à un grade ≤1 en l'espace de 12 semaines, de réduction des doses de corticostéroïdes à ≤10 mg de prednisone orale ou équivalent par jour et pour autant que le patient soit stable sous thérapie de substitution (si nécessaire).
En cas d'hypophysite de grade 2 ou 3, le traitement par Tecentriq doit être interrompu. Un traitement par 1 à 2 mg/kg/jour de méthylprednisolone i.v. ou d'un équivalent doit être instauré, en cas de besoin, une hormonothérapie de substitution peut également s'avérer nécessaire. Une fois l'amélioration des symptômes obtenue, il convient de passer à un corticostéroïde par voie orale (1 à 2 mg/kg/jour de prednisone ou équivalent). En cas d'amélioration des symptômes à un grade ≤1, les corticostéroïdes doivent être arrêtés progressivement sur une période de ≥1 mois. Le traitement par Tecentriq peut être repris en cas d'amélioration de l'événement à un grade ≤1 en l'espace de 12 semaines, de réduction des doses de corticostéroïdes à ≤10 mg de prednisone orale ou équivalent par jour et pour autant que le patient soit stable sous thérapie de substitution (si nécessaire). En cas d'hypophysite de grade 4, le traitement par Tecentriq doit être définitivement arrêté.
En cas de diabète sucré de type 1, il convient d'instaurer une insulinothérapie. En cas d'hyperglycémie de grade ≥3 (glycémie à jeun > 250 mg/dl), il convient d'interrompre le traitement par Tecentriq. Le traitement par Tecentriq peut être repris lorsque le contrôle du métabolisme est obtenu sous l'insulinothérapie substitutive.
Lors de l'étude portant sur le mélanome (CO39262), la fréquence de survenue d'hypothyroïdie et d'hyperthyroïdie a été plus élevée chez les patients ayant reçu Tecentriq i.v. en association avec le cobimétinib et le vémurafénib (voir «Effets indésirables»).
Méningoencéphalite à médiation immunitaire
Des cas de méningoencéphalites ont été observés au cours d'études cliniques réalisées avec Tecentriq (voir «Effets indésirables, Études cliniques»). Les patients doivent être surveillés à la recherche de signes cliniques et de symptômes de méningite ou d'encéphalite.
Le traitement par Tecentriq doit être arrêté définitivement en cas de méningite ou d'encéphalite de quelque grade que ce soit. Un traitement par 1 à 2 mg/kg de méthylprednisolone i.v. ou équivalent par jour doit être administré. Après amélioration de l'état du patient, il faut remplacer ce traitement par 1 à 2 mg/kg de prednisone orale ou équivalent par jour. En cas d'amélioration des symptômes à un grade ≤1, les corticostéroïdes doivent être arrêtés progressivement sur une période de ≥1 mois.
Neuropathies à médiation immunitaire
Un syndrome myasthénique/une myasthénie grave ou un syndrome de Guillain-Barré (pouvant menacer le pronostic vital) et une parésie faciale ont été rapportés chez les patients ayant reçu Tecentriq (voir «Effets indésirables, Études cliniques»). Les patients doivent être surveillés à la recherche de symptômes d'une neuropathie motrice ou sensitive.
En cas de syndrome myasthénique/myasthénie grave ou de syndrome de Guillain-Barré de quelque grade que ce soit, il convient d'arrêter définitivement le traitement par Tecentriq. L'instauration d'un traitement par des corticostéroïdes systémiques à une dose de 1-2 mg/kg de prednisone orale ou équivalent par jour doit être envisagée.
Myélite à médiation immunitaire
Des cas de myélite ont été observés au cours d'études cliniques réalisées avec Tecentriq (voir «Effets indésirables, Études cliniques» et «Effets indésirables, Données post-commercialisation»). Les patients doivent être surveillés à la recherche de signes et de symptômes évocateurs d'une myélite. Voir «Posologie/Mode d'emploi» en ce qui concerne les ajustements posologiques recommandés.
Pancréatite à médiation immunitaire
Des cas de pancréatite, y compris d'augmentation des taux sériques d'amylase et de lipase, ont été observés au cours d'études cliniques réalisées avec Tecentriq (voir «Effets indésirables, Études cliniques»). Les patients doivent être étroitement surveillés à la recherche de signes et de symptômes évocateurs d'une pancréatite aiguë.
En cas d'augmentation des taux sériques d'amylase ou de lipase de grade ≥3 (> 2,0× LSN) ou de pancréatite de grade 2 ou 3, il convient d'interrompre le traitement par Tecentriq et d'instaurer un traitement par 1 à 2 mg/kg de méthylprednisolone i.v. ou équivalent par jour. Dès que les symptômes s'améliorent, il faut passer à un traitement par 1 à 2 mg/kg de prednisone orale ou équivalent par jour. Le traitement par Tecentriq peut être repris en cas d'amélioration des taux sériques d'amylase et de lipase à un grade ≤1 en l'espace de 12 semaines et après la disparition des symptômes de la pancréatite, ainsi qu'en cas de réduction des doses de corticostéroïdes à ≤10 mg de prednisone orale ou équivalent par jour. En cas de pancréatite de grade 4 ou de réapparition d'une pancréatite de quelque grade que ce soit, il convient d'arrêter définitivement le traitement par Tecentriq.
Affections cardiaques
Myocardite à médiation immunitaire
Une myocardite, y compris des cas d'issue fatale, a été observée au cours des essais cliniques avec Tecentriq (voir «Effets indésirables, Études cliniques»). Les patients doivent être surveillés à la recherche de signes et/ou de symptômes de myocardite. Le traitement par Tecentriq doit être définitivement arrêté dès qu'une myocardite de grade ≥2 est constatée (voir «Posologie/Mode d'emploi»). Une myocardite peut également être une manifestation clinique d'une myosite et doit être traitée en conséquence.
Affections du péricarde à médiation immunitaire
Des affections du péricarde, incluant péricardite, épanchement péricardique et tamponnade cardiaque, dont certaines d'issue fatale, ont été observées lors d'études cliniques réalisées avec Tecentriq (voir «Effets indésirables: Études cliniques et Données post-commercialisation»). Les patients doivent être surveillés à la recherche de signes et/ou de symptômes cliniques d'affections du péricarde. Les recommandations pour l'ajustement posologique figurent à la rubrique «Posologie/Mode d'emploi».
Autres affections cardiaques
Lors de l'étude IMscin001, des événements cardiaques indésirables de grade 5 sont survenus plus fréquemment chez les patients ayant reçu Tecentriq par voie sous-cutanée que chez les patients ayant reçu Tecentriq par voie intra-veineuse (respectivement 1,2% et 0,8%).
Myosite à médiation immunitaire
Au cours d'essais cliniques portant sur Tecentriq, des cas de myosite, dont certains d'issue fatale (incluant également une atteinte cardiaque), se sont produits (voir «Effets indésirables, études cliniques»). Les patients doivent faire l'objet d'une surveillance à la recherche de signes et de symptômes d'une myosite. Si un patient développe des signes et des symptômes d'une myosite, une surveillance étroite doit être mise en place et le patient doit être adressé immédiatement à un service spécialisé à des fins d'évaluation et de traitement. Les patients chez lesquels une myosite est suspectée doivent faire l'objet d'une surveillance à la recherche de signes d'une myocardite. En ce qui concerne les ajustements posologiques recommandés, se reporter à la section «Posologie/Mode d'emploi».
Néphrite à médiation immunitaire
Des néphrites ont été observées au cours d'études cliniques réalisées avec Tecentriq (voir «Effets indésirables, Études cliniques»). Les patients doivent être surveillés à la recherche d'altérations de leur fonction rénale. Voir «Posologie/Mode d'emploi» en ce qui concerne les ajustements posologiques recommandés.
Autres événements d'origine immunologique
Lymphohistiocytose hémophagocytaire (LHH)
Des cas de lymphohistiocytose hémophagocytaire (LHH), également d'issue fatale, sont survenus chez des patients traités par Tecentriq (voir «Effets indésirables, Données post-commercialisation»). Une LHH doit être envisagée en cas de tableau clinique atypique ou prolongé de syndrome de relargage des cytokines. Les patients doivent être surveillés à la recherche de signes et de symptômes cliniques d'une LHH. Voir «Posologie/Mode d'emploi» en ce qui concerne les ajustements posologiques recommandés.
La LHH est un syndrome potentiellement mortel s'accompagnant d'une activation pathologique des défenses immunitaires. En l'absence de diagnostic et de traitement précoces, la LHH a fréquemment une évolution létale. Cette maladie se caractérise par des signes et symptômes cliniques d'une inflammation systémique sévère, tels que fièvre, éruption cutanée, hépatosplénomégalie, cytopénie (surtout anémie et thrombocytopénie), lymphadénopathie, symptômes neurologiques, taux élevé de ferritine sérique, hypertriglycéridémie, ainsi que troubles de la fonction hépatique et de la coagulation. Les patients présentant de tels signes et symptômes doivent immédiatement être examinés et leur état doit être évalué en vue d'un éventuel diagnostic de LHH. L'administration de Tecentriq doit être suspendue tant qu'une autre étiologie n'a pas pu être établie.
Sous traitement par Tecentriq et/ou par d'autres inhibiteurs de point de contrôle immunitaire, des cas d'anémie hémolytique et d'anémie aplasique ont été observés. Les patients doivent être surveillés à la recherche de signes et de symptômes évocateurs de ces effets indésirables à médiation immunitaire.
Réactions cutanées sévères à médiation immunitaire
Des réactions cutanées sévères à médiation immunitaire (Severe Cutaneous Adverse Reactions – SCAR) ont été rapportées chez des patients sous traitement par Tecentriq, dont des cas de syndrome de Stevens-Johnson (SSJ) et de nécrolyse épidermique toxique (NET; y compris d'évolution fatale). Les patients doivent être surveillés à la recherche de réactions cutanées sévères. Il convient d'interrompre Tecentriq en cas de réactions cutanées de grade 3 jusqu'au retour à un grade ≤1 et de l'arrêter définitivement en cas de réactions cutanées de grade 4, et d'administrer des corticostéroïdes (voir «Posologie/Mode d'emploi»).
En cas de suspicion de SCAR, il convient d'adresser les patients à un spécialiste afin de réaliser une évaluation et un traitement adéquats. En cas de suspicion d'un SSJ ou d'une NET, le traitement par Tecentriq doit être interrompu. Si le SSJ ou la NET sont confirmés, le traitement par Tecentriq doit être arrêté définitivement.
La prudence est recommandée lorsqu'on envisage d'utiliser Tecentriq chez un patient ayant présenté une réaction cutanée indésirable sévère ou menaçant le pronostic vital lors d'un traitement anticancéreux antérieur par d'autres principes actifs immunostimulants.
Effets de classe des inhibiteurs de point de contrôle immunitaire
Pendant le traitement par d'autres inhibiteurs de point de contrôle immunitaire, des cas d'insuffisance pancréatique exocrine, qui peut aussi survenir sous traitement par atézolizumab, ont été rapportés.
Maladie cœliaque
Des cas de maladie cœliaque ont été rapportés sous traitement par Tecentriq.
Immunogénicité
Des méta-analyses exploratoires, non ajustées, portant sur l'efficacité (sans ajustement de déséquilibres des caractéristiques initiales) montrent une diminution de l'efficacité de Tecentriq concernant la survie globale chez les patients ADA-positifs par rapport aux patients ADA-négatifs (voir «Propriétés/Effets: Efficacité clinique» et «Pharmacocinétique»).
Patients atteints d'une maladie auto-immune préexistante
Des données issues d'études d'observation indiquent que les patients atteints d'une maladie auto-immune (MAI) préexistante présentent un risque accru d'effets indésirables à médiation immunitaire après un traitement par un inhibiteur de point de contrôle immunitaire par rapport aux patients sans MAI préexistante. Par ailleurs, des poussées de la MAI sous-jacente sont survenues plus fréquemment, mais elles étaient la plupart du temps légères et faciles à traiter.
Précautions spécifiques à la maladie
Utilisation de l'atézolizumab en association avec le bévacizumab en cas de carcinome hépatocellulaire
Les patients traités par le bévacizumab présentent un risque hémorragique accru. Des cas d'hémorragies gastro-intestinales sévères, y compris des événements d'issue fatale, ont été rapportés chez des patients atteints de carcinome hépatocellulaire (CHC) traités par l'atézolizumab en association avec le bévacizumab. Avant d'instaurer le traitement par l'association d'atézolizumab et de bévacizumab, il convient de rechercher la présence de varices œsophagiennes et éventuellement d'administrer un traitement conforme aux pratiques cliniques chez les patients atteints de CHC. Le bévacizumab doit être définitivement arrêté pendant le traitement combiné chez les patients présentant des hémorragies de grade 3 ou 4. Consulter l'information professionnelle du bévacizumab.
Risque accru de mortalité pour les patientes atteintes de TNBC métastatique lors de l'utilisation de Tecentriq avec le paclitaxel
Dans une étude randomisée menée chez des patientes atteintes de TNBC métastatique, un risque accru de mortalité a été observé dans la population PD-L1-positive chez les patientes traitées par Tecentriq i.v. plus paclitaxel par rapport à celles traitées par un placebo et le paclitaxel. La survie globale dans la population présentant une expression du PD-L1, dans laquelle la mortalité était de 42%, a donné un HR de 1,11 (IC à 95%: 0,76; 1,64). La survie médiane a été de 22,1 mois (IC à 95%: 19,2; 30,5) chez les patientes ayant reçu Tecentriq en association avec le paclitaxel et de 28,3 mois (IC à 95%: 19,1; NE) chez les patientes ayant reçu un placebo et le paclitaxel (voir «Indications/Possibilités d'emploi» et «Posologie/Mode d'emploi»). La cause de décès la plus fréquente était une progression de la maladie et aucun déséquilibre de la mortalité liée à la toxicité n'a été observé entre les bras de l'étude.
L'efficacité de Tecentriq en association avec le paclitaxel n'a été pas démontrée chez les patientes atteintes d'un TNBC localement avancé ou métastatique. Pour traiter le TNBC métastatique dans la pratique clinique en dehors d'études contrôlées, le paclitaxel lié aux protéines ne doit pas être remplacé par le paclitaxel en association avec Tecentriq.
Groupes de patients particuliers
Patients exclus des études cliniques
Les patients présentant les affections ou les caractéristiques suivantes ont été exclus de la participation aux études cliniques:
·antécédents de pneumopathie inflammatoire,
·métastases cérébrales actives,
·infection par le VIH, l'hépatite B ou l'hépatite C,
·patients ayant reçu un vaccin vivant atténué dans les 28 jours précédant l'inclusion dans l'étude,
·patients ayant reçu un traitement immunostimulant systémique dans les 4 semaines ou un traitement immunosuppresseur systémique dans les 2 semaines précédant l'inclusion dans l'étude,
·antécédents de maladies auto-immunes,
·patients atteints de maladies cardiovasculaires importantes et patients présentant une altération de la fonction hématologique ou une insuffisance des organes cibles.
Les patients avec un score de performance ECOG ≥2 ont été exclus de la participation aux études cliniques en cas de NSCLC et de CU sous traitement de seconde intention.
Toxicité embryonnaire et fœtale
En raison de son mécanisme d'action, l'utilisation de Tecentriq peut avoir des effets délétères sur le fœtus. Les expérimentations menées chez l'animal ont montré que l'inhibition de la voie de signalisation PD-L1/PD-1 peut être associée à un risque accru de rejet à médiation immunitaire du fœtus en développement et peut par conséquent entraîner la mort du fœtus.
Les femmes enceintes doivent être informées du risque potentiel pour le fœtus. Les femmes en âge de procréer doivent être informées de la nécessité d'utiliser des méthodes contraceptives hautement efficaces pendant le traitement par Tecentriq et pendant les 5 mois suivant la dernière dose (voir «Grossesse» et «Données précliniques: Tératogénicité»).
Effets indésirables chez les patients transplantés
Chez les patients traités par des inhibiteurs du PD-1/PD-L1, un rejet de greffes d'organes solides a été observé dans le contexte post-commercialisation. Le traitement par Tecentriq est susceptible d'accroître le risque de rejet chez les receveurs de greffes d'organes solides. Chez ces patients, le bénéfice du traitement par l'atézolizumab doit être évalué par rapport au risque de rejet possible de l'organe.
InteractionsInteractions pharmacocinétiques
Aucune étude formelle d'interactions pharmacocinétiques n'a été réalisée avec l'atézolizumab. Étant donné que l'atézolizumab est éliminé de la circulation sanguine par dégradation catabolique, il ne faut s'attendre à aucune interaction médicamenteuse métabolique.
Interactions pharmacodynamiques
L'emploi de corticostéroïdes systémiques ou d'immunosuppresseurs avant le début du traitement par l'atézolizumab doit être évité en raison d'une possible altération de l'activité pharmacodynamique et de l'efficacité de l'atézolizumab. Des corticostéroïdes systémiques ou d'autres immunosuppresseurs peuvent toutefois être administrés après l'instauration du traitement par l'atézolizumab pour traiter des effets indésirables d'origine immunologique (voir «Mises en garde et précautions»).
Grossesse, allaitementGrossesse
En raison de son mécanisme d'action, Tecentriq peut avoir des effets délétères sur le fœtus lorsqu'il est administré à une femme enceinte. Il n'existe pas d'études cliniques concernant l'emploi de Tecentriq chez la femme enceinte. Les expérimentations menées chez l'animal ont montré que l'inhibition de la voie de signalisation PD-L1/PD-1 peut être associée à un risque accru de rejet immunologique du fœtus en développement, suivi de la mort du fœtus. Tecentriq ne doit pas être administré pendant la grossesse ni aux femmes en âge de procréer qui n'utilisent pas de méthode contraceptive efficace, sauf en cas de nécessité absolue. Si le médicament est utilisé pendant la grossesse ou si la patiente débute une grossesse pendant le traitement, il convient d'informer celle-ci du risque potentiel pour le fœtus.
Les patientes en âge de procréer doivent utiliser des méthodes contraceptives hautement efficaces et prendre des mesures actives pour éviter une grossesse pendant le traitement par Tecentriq et pendant au moins les 5 mois suivant la dernière dose (voir «Mises en garde et précautions: Toxicité embryonnaire et fœtale» et «Données précliniques: Tératogénicité»).
Travail et accouchement
L'utilisation de Tecentriq pendant le travail et l'accouchement n'a pas été évaluée.
Allaitement
On ignore si Tecentriq est excrété dans le lait maternel humain. Aucune étude n'a été réalisée pour évaluer les effets de Tecentriq sur la production de lait ou sur sa présence dans le lait maternel. Comme de nombreux médicaments, dont des anticorps, sont excrétés dans le lait maternel, un risque pour le nouveau-né/l'enfant en bas âge ne peut pas être exclu. En raison des éventuels effets nocifs pour le nourrisson allaité, il est recommandé de ne pas allaiter pendant le traitement par Tecentriq et pendant au moins les 5 mois suivant la dernière dose.
Fertilité
Les expérimentations menées chez l'animal indiquent que Tecentriq peut avoir un effet sur le cycle menstruel des femmes en âge de procréer (voir «Données précliniques»). Les patientes en âge de procréer doivent utiliser des méthodes contraceptives hautement efficaces et prendre des précautions actives pour éviter une grossesse pendant le traitement par Tecentriq et pendant au moins les 5 mois suivant la dernière dose.
Effet sur l’aptitude à la conduite et l’utilisation de machinesTecentriq a une légère influence sur l'aptitude à la conduite ou l'utilisation de machines. Il convient de recommander aux patients ressentant de la fatigue de ne pas conduire de véhicule ni d'utiliser des machines jusqu'à la disparition des symptômes.
Effets indésirablesÉtudes cliniques
L'évaluation de la sécurité de Tecentriq en monothérapie repose sur les données regroupées de 6179 patients atteints de différents types de tumeurs et sur des données complémentaires issues de l'exposition cumulée de > 33 000 patients inclus dans l'ensemble des études cliniques (voir tableau 4). Les effets indésirables les plus fréquemment identifiés dans les études cliniques en rapport avec Tecentriq en monothérapie (> 10%) étaient fatigue (26,1%), diminution de l'appétit (18,6%), éruption cutanée (18,0%), nausées (16,6%), diarrhée (16,4%), toux (16,3%), pyrexie (15,8%), dyspnée (15,1%), arthralgie (14,7%), anémie (14,0%), prurit (12,4%), asthénie (12,4%), dorsalgie (11,4%), hépatite [anomalies des valeurs de laboratoire] (10,9%), infection des voies urinaires (10,8%) et vomissements (10,4%).
Le tableau 4 présente également sous une forme résumée les effets indésirables (EI) observés durant les études cliniques sous traitement combiné avec Tecentriq i.v. (n = 5438). Les effets indésirables les plus fréquents (≥10%) étaient les suivants: anémie (35,1%), nausées (34,6%), neutropénie (34,5%), fatigue (31,9%), éruption cutanée (29,3%), alopécie (28,5%), diarrhée (28,0%), thrombocytopénie (24,3%), constipation (24,1%), neuropathie périphérique (23,9%), diminution de l'appétit (23,1%), arthralgie (20,7%), vomissements (18,7%), pyrexie (18,6%), asthénie (18,4%), anomalies des valeurs de laboratoire pour l'hépatite (18,0%), toux (17,5%), dyspnée (14,8%), douleurs musculosquelettiques (14,8%), céphalée (14,2%), leucopénie (13,8%), prurit (13,6%), hypothyroïdie (13,4%), hypertension (12,7%), infection pulmonaire (12,0%), augmentation du taux d'ALAT (11,2%), dorsalgie (11,1%), augmentation du taux d'ASAT (10,8%), œdème périphérique (10,6%), et rhinopharyngite (10,2%).
Traitement combiné avec Tecentriq lors de mélanome
Dans l'étude CO39262 (IMspire150), les patients qui recevaient Tecentriq i.v. en association avec du cobimétinib et du vémurafénib ont eu une fréquence plus élevée d'anomalies hépatiques de laboratoire (114/230, 49,6%), de pancréatite (89/230, 38,7%), d'hypothyroïdie (60/230, 26,1%), d'hyperthyroïdie (43/230, 18,7%), de pneumopathie inflammatoire (29/230, 12,6%), de méningo-encéphalite (6/230, 2,6%), de diabète (4/230, 1,7%), de myosite (3/230, 1,3%), de néphrite (3/230, 1,3%) et d'hypophysite (2/230, 0,9%). Les effets indésirables graves les plus fréquents (≥2%) étaient les suivants: pyrexie (5,7%) et élévation de l'alanine aminotransférase (2,2%).
Traitement combiné avec Tecentriq lors de cancer du poumon à petites cellules de stade avancé (ES-SCLC)
Dans l'étude GO43104 (IMforte), les patients traités par l'association Tecentriq + lurbinectédine ont présenté, par rapport aux patients traités uniquement par Tecentriq, un nombre accru d'événements indésirables (97,1% contre 81,7%), d'événements indésirables de grade 3-4 (41,3% contre 24,6%), d'événements indésirables de grade 5 (5,0% contre 2,5%), d'événements indésirables graves (34,3% contre 17,9%), d'événements indésirables ayant entraîné un arrêt du traitement (7,0% contre 4,2%) et d'événements indésirables ayant entraîné un ajustement posologique ou une interruption du traitement (41,3% contre 15,8%). Les événements indésirables suivants sont survenus plus fréquemment au cours du traitement par l'association Tecentriq + lurbinectédine (différence > 10%): nausées (37,6%), vomissements (14,9%), fatigue (21,2%), anémie (33,9%), thrombocytopénie (12,8%), neutropénie (12,4%), numération plaquettaire diminuée (15,3%), neutrophiles diminués (13,2%) et diminution de l'appétit (18,2%). Les événements indésirables de grade ≥3 suivants sont survenus plus fréquemment au cours du traitement par l'association Tecentriq + lurbinectédine (différence > 2%): anémie (9,5%), neutrophiles diminués (7,4%), numération plaquettaire diminuée (7,0%), fatigue (3,7%), neutropénie (5,0%), thrombocytopénie (4,5%), nausées (2,9%), ALAT augmentée (2,5%) et globules blancs diminués (2,1%). Les événements indésirables graves suivants sont survenus plus fréquemment au cours du traitement par l'association Tecentriq + lurbinectédine (> 2%): numération plaquettaire diminuée (2,1%).
L'incidence d'événements de (thrombo-)phlébite/vascularite tous grades confondus était au total de 16,9% chez les patients du bras de traitement recevant l'association Tecentriq + lurbinectédine (n = 242) dans l'étude IMforte, contre 0,8% dans le bras de traitement sous Tecentriq dans l'étude IMforte (n = 240), 2,9% dans les données groupées concernant Tecentriq en monothérapie (n = 3178) et 5,8% dans les données groupées concernant la lurbinectédine en monothérapie (n = 554). La plupart de l'ensemble des événements survenus dans le bras de traitement recevant l'association Tecentriq+ lurbinectédine étaient liés au médicament à l'étude, en particulier à la lurbinectédine (9,5%), et nécessitaient un traitement (11,2%). La plupart des cas survenus dans le bras de traitement sous Tecentriq + lurbinectédine concernaient une phlébite et une thrombophlébite (sans plus de précision). La plupart de l'ensemble des événements de (thrombo-)phlébite/vascularite survenus dans le bras de traitement recevant l'association Tecentriq + lurbinectédine étaient de grade 1 à 2 (15,7%), non graves (15,3%), et s'étaient majoritairement résolus à la date limite de collecte des données (DCO, data cut-off) (56,1%). Le délai médian de survenue des symptômes était d'environ 3 mois et le délai médian entre leur survenue et leur régression était de 79 jours, la régression étant toutefois plus rapide (environ 1 à 1,5 mois) dans les cas les plus fréquents de phlébite et de thrombophlébite.
D'autres informations concernant les éventuels effets indésirables graves figurent à la rubrique «Description de certains effets indésirables».
Les catégories de fréquence utilisées sont les suivantes: «très fréquents» (≥1/10), «fréquents» (≥1/100, < 1/10), «occasionnels» (≥1/1000, < 1/100), «rares» (≥1/10 000, < 1/1000) ou «très rares» (< 1/10 000).
Le tableau 4 résume tous les effets indésirables importants rapportés sous Tecentriq sur la base de données groupées issues de monothérapies et de traitements combinés lors de différents types de tumeurs.
Tableau 4: Résumé des effets indésirables rapportés chez les patients traités par Tecentriq i.v. ou s.c. dans le cadre d'études cliniques
|
|
Monothérapie par Tecentriq
n = 6179
|
Traitement combiné avec Tecentriq
n = 5438
| |
Infections et infestations
| |
Très fréquents
|
Infection des voies urinaires a (tous grades confondus: 10,8%, grade 3-4: 2,9%, grade 5: < 0,1%)
|
Infection pulmonaire b (tous grades confondus: 12,0%, grade 3-4: 4,7%, grade 5: 0,6%)
| |
Affections hématologiques et du système lymphatique
| |
Très fréquents
|
Anémie (tous grades confondus: 14,0%, grade 3-4: 3,5%)
|
Anémie (tous grades confondus: 35,1%, grade 3-4: 12,6%), neutropénie c (tous grades confondus: 34,5%, grade 3-4: 22,5%, grade 5: 0,1%), thrombocytopénie d (tous grades confondus: 24,3%, grade 3-4: 9,5%, grade 5: < 0,1%), leucopénie e (tous grades confondus: 13,8%, grade 3-4: 5,5%)
| |
Fréquents
|
Thrombocytopénie d
|
Lymphopénie f
| |
Rares
|
Lymphohistiocytose hémophagocytaire **
|
Lymphohistiocytose hémophagocytaire **
| |
Affections du système immunitaire
| |
Fréquents
|
Réactions liées à la perfusion g
|
Réactions liées à la perfusion g
| |
Occasionnels
|
Hypersensibilité
|
| |
Affections endocriniennes
| |
Très fréquents
|
|
Hypothyroïdie h (tous grades confondus: 13,4%, grade 3-4: 0,2%)
| |
Fréquents
|
Hypothyroïdie h, hyperthyroïdie i
|
Hyperthyroïdie i
| |
Occasionnels
|
Insuffisance surrénalienne j, diabète k, hypophysite l
|
Insuffisance surrénalienne j, hypophysite l
| |
Troubles du métabolisme et de la nutrition
| |
Très fréquents
|
Diminution de l'appétit (tous grades confondus: 18,6%, grade 3-4: 0,8%)
|
Diminution de l'appétit (tous grades confondus: 23,1%, grade 3-4: 1,5%, grade 5: < 0,1%)
| |
Fréquents
|
Hyperglycémie, hypokaliémie n, hyponatrémie o
|
Hypokaliémie n, hyponatrémie o, hypomagnésémie m
| |
Affections du système nerveux
| |
Très fréquents
|
|
Neuropathie périphérique p (tous grades confondus: 23,9%, grade 3-4: 2,9%), céphalées (tous grades confondus: 14,2%, grade 3-4: 0,2%)
| |
Fréquents
|
Céphalées, neuropathie périphérique p
|
Vertiges, dysgueusie, syncope
| |
Occasionnels
|
Méningoencéphalite r
|
| |
Rares
|
Syndrome de Guillain-Barré q, syndrome myasthénique s, parésie faciale **, myélite **
|
Parésie faciale **, myélite **
| |
Affections cardiaques
| |
Occasionnels
|
Affections du péricarde t, myocardite u
|
Affections du péricarde t
| |
Affections vasculaires
| |
Très fréquents
|
|
Hypertension artérielle v (tous grades confondus: 12,7%, grade 3-4: 5,6%)
| |
Fréquents
|
Hypotension artérielle
|
| |
Affections respiratoires, thoraciques et médiastinales
| |
Très fréquents
|
Toux (tous grades confondus: 16,3%, grade 3-4: 0,2%), dyspnée (tous grades confondus: 15,1%, grade 3-4: 2,4%, grade 5: < 0,1%)
|
Toux (tous grades confondus: 17,5%, grade 3-4: 0,2%), dyspnée (tous grades confondus: 14,8%, grade 3-4: 1,7%, grade 5: < 0,1%), rhinopharyngite w (tous grades confondus: 10,2%, grade 3-4: < 0,1%)
| |
Fréquents
|
Hypoxie x, rhinopharyngite w, pneumopathie inflammatoire y, embarras de la respiration nasale
|
Pneumopathie inflammatoire y, dysphonie
| |
Occasionnels
|
|
Hypoxie x
| |
Affections gastro-intestinales
| |
Très fréquents
|
Nausées (tous grades confondus: 16,6%, grade 3-4: 0,7%), diarrhée z (tous grades confondus: 16,4%, grade 3-4: 1,0%), vomissements (tous grades confondus: 10,4%, grade 3-4: 0,6%)
|
Nausées (tous grades confondus: 34,6%, grade 3-4: 1,6%), diarrhée z (tous grades confondus: 28,0%, grade 3-4: 2,4%), constipation (tous grades confondus: 24,1%, grade 3-4: 0,5%), vomissements (tous grades confondus: 18,7%, grade 3-4: 1,4%)
| |
Fréquents
|
Douleurs abdominales, colite aa, dysphagie, douleurs oropharyngées bb, bouche sèche
|
Stomatite, pancréatite cc, bouche sèche
| |
Occasionnels
|
Pancréatite cc
|
| |
Rares
|
Maladie cœliaque **
|
Maladie cœliaque **
| |
Affections hépatobiliaires
| |
Très fréquents
|
Hépatite - anomalies des valeurs de laboratoire dd (tous grades confondus: 10,9%, grade 3-4: 2,9%)
|
Hépatite - anomalies des valeurs de laboratoire dd (tous grades confondus: 18,0%, grade 3-4: 5,5%, grade 5: < 0,1%), augmentation du taux d'ALAT (tous grades confondus: 11,2%, grade 3-4: 2,5%), augmentation du taux d'ASAT (tous grades confondus: 10,8%, grade 3-4: 2,2%)
| |
Fréquents
|
Augmentation du taux d'ALAT, augmentation du taux d'ASAT, hépatite ee
|
| |
Affections de la peau et du tissu sous-cutané
| |
Très fréquents
|
Éruption cutanée ff (tous grades confondus: 18,0%, grade 3-4: 1,0%), prurit (tous grades confondus: 12,4%, grade 3-4: 0,2%)
|
Éruption cutanée ff (tous grades confondus: 29,3%, grade 3-4: 2,6%), alopécie gg (tous grades confondus: 28,5%, grade 3-4: < 0,1%), prurit (tous grades confondus: 13,6%, grade 3-4: 0,2%)
| |
Fréquents
|
Sécheresse cutanée hh
|
| |
Occasionnels
|
Réactions cutanées indésirables sévères (nécrolyse épidermique toxique, syndrome de Stevens Johnson) ii, psoriasis jj
|
Réactions cutanées indésirables sévères (nécrolyse épidermique toxique, syndrome de Stevens Johnson) ii, psoriasis jj
| |
Affections musculosquelettiques et du tissu conjonctif
| |
Très fréquents
|
Arthralgie (tous grades confondus: 14,7%, grade 3-4: 0,8%), dorsalgie (tous grades confondus: 11,4%, grade 3-4: 1,0%)
|
Arthralgie (tous grades confondus: 20,7%, grade 3-4: 1,1%), douleurs musculosquelettiques kk (tous grades confondus: 14,8%, grade 3-4: 0,7%), dorsalgie (tous grades confondus: 11,1%, grade 3-4: 0,8%)
| |
Fréquents
|
Douleurs musculosquelettiques kk
|
| |
Occasionnels
|
Myosite ll, mm
|
| |
Affections du rein et des voies urinaires
| |
Fréquents
|
Créatinine sanguine augmentée nn
|
Protéinurie oo, créatinine sanguine augmentée nn
| |
Occasionnels
|
Néphrite pp
|
Néphrite pp
| |
Investigations
| |
Fréquents
|
|
Phosphatase alcaline sanguine augmentée
| |
Occasionnels
|
Créatine phosphokinase sanguine augmentée
|
| |
Troubles généraux et anomalies au site d'administration
| |
Très fréquents
|
Fatigue (tous grades confondus: 26,1%, grade 3-4: 2,2%), pyrexie (tous grades confondus: 15,8%, grade 3-4: 0,5%), asthénie (tous grades confondus: 12,4%, grade 3-4: 1,4%)
|
Fatigue (tous grades confondus: 31,9%, grade 3-4: 3,5%), pyrexie (tous grades confondus: 18,6%, grade 3-4: 0,9%), asthénie (tous grades confondus: 18,4%, grade 3-4: 2,7%), œdème périphérique (tous grades confondus: 10,6%, grade 3-4: 0,2%)
| |
Fréquents
|
Frissons, affection grippale, œdème périphérique
|
| |
Occasionnels
|
Réaction au site d'injection qq
|
|
a Inclut des cas rapportés d'infection urinaire, de cystite, de pyélonéphrite, d'infection urinaire à Escherichia, d'infection urinaire bactérienne, d'infection rénale, de pyélonéphrite aiguë, d'infection fongique des voies urinaires, d'infection urinaire à Pseudomonas, d'infection urinaire à entérocoques, de pyélonéphrite chronique, d'infection urinaire à staphylocoques, d'abcès rénal, de pyélite, d'urétrite, d'infection urinaire à streptocoquesb Inclut des cas rapportés de pneumonie, de bronchite, d'infection des voies respiratoires inférieures, d'exacerbation infectieuse d'une bronchopneumopathie chronique obstructive, d'épanchement pleural infectieux, de pneumonie atypique, d'abcès pulmonaire, d'infection pleurale, de pneumonie post-procédure, de trachéobronchite, de pneumonie paranéoplasique, de pyopneumothoraxc Inclut des cas rapportés de neutropénie, de neutrophiles diminués, de neutropénie fébrile, de sepsis neutropénique, d'agranulocytose et de granulocytopénied Inclut des cas rapportés de thrombopénie immunitaire, de thrombocytopénie et de numération plaquettaire diminuéee Inclut des cas rapportés de diminution du nombre de globules blancs et de leucopénief Inclut des cas rapportés de lymphocytopénie et de numération de lymphocytes diminuéeg Inclut des cas rapportés de réaction liée à la perfusion, de syndrome de libération des cytokines, d'hypersensibilité et d'anaphylaxie (réaction anaphylactique, choc anaphylactique, réaction anaphylactoïde, choc anaphylactoïde)h Inclut des cas rapportés d'hypothyroïdie, d'augmentation et de diminution des taux sanguins de thyréostimuline, de thyroïdite auto-immune (des cas de thyroïdite auto-immune ont été rapportés dans des études en dehors des données groupées), de goitre, de thyroïdite, de diminution des taux sanguins de thyroxine libre ou de tri-iodothyronine, de troubles thyroïdiens, d'augmentation des taux sanguins de thyroxine libre ou de thyroxine totale, de diminution des taux sanguins de tri-iodothyronine totale, d'augmentation des taux sanguins de tri-iodothyronine libre, de taux sanguins anormaux de thyréostimuline, de syndrome euthyroïdien, de coma myxœdémateux, de paramètres fonctionnels thyroïdiens anormaux, de diminution de la thyroxine, de tri-iodothyronine anormale, de positivité des anticorps antithyroïdiens, de thyroïdite silencieuse, de thyroïdite chronique, de thyroïdite à médiation immunitaire, de myxœdème, de thyroïdite aiguë, de tri-iodothyronine libre anormale, d'augmentation de la tri-iodothyronine, d'hypothyroïdie auto-immune, d'hypothyroïdie primaire, de goitre hypothyroïdien, d'hypothyroïdie à médiation immunitairei Inclut des cas rapportés d'hyperthyroïdie, de maladie de Basedow, d'ophtalmopathie endocrinienne, d'exophtalmie, d'hyperthyroïdie primairej Inclut des cas rapportés d'insuffisance surrénalienne, de déficit en glucocorticoïdes, d'insuffisance surrénalienne primaire, de diminution du cortisol, d'insuffisance corticosurrénalienne aiguë, de test de stimulation à l'ACTH anormal, de maladie d'Addison, d'inflammation des glandes surrénales, de déficit en hormone adrénocorticotrope (ACTH), de taux sanguins anormaux de corticotropine, d'augmentation des taux sanguins de corticotropine, d'insuffisance corticosurrénalienne secondaire, de corticotropine sanguine diminuéek Inclut des cas rapportés de diabète, de diabète sucré de type 1, d'acidocétose diabétique et d'acidocétosel Inclut des cas rapportés d'hypophysite, d'hypopituitarisme, de trouble de la régulation de la température, d'insuffisance surrénalienne secondairem Inclut des cas rapportés d'hypomagnésémie et de diminution du magnésium dans le sangn Inclut des cas rapportés d'hypokaliémie et de diminution du potassium dans le sango Inclut des cas rapportés d'hyponatrémie et de diminution du sodium dans le sangp Inclut des cas rapportés de neuropathie périphérique, de neuropathie sensitive périphérique, de polyneuropathie, de neuropathie motrice périphérique, de neuropathie auto-immune, d'amyotrophie névralgique, de neuropathie sensitivo-motrice périphérique, de neuropathie axonale, de plexopathie brachiale, de plexopathie lombo-sacrée, de neuropathie toxique, de névriteq Inclut des cas rapportés de syndrome de Guillain-Barré, de polyneuropathie démyélinisante, de paralysie flasque ascendanter Inclut des cas rapportés d'encéphalite, de méningite, de photophobie, d'encéphalite auto-immune, de méningite aseptiques Inclut des cas rapportés de myasthénie gravet Inclut des cas rapportés de péricardite, d'épanchement péricardique, de tamponnade cardiaque et de péricardite constrictiveu Inclut des cas rapportés de myocardite, de myocardite auto-immune, de myocardite à médiation immunitaire (des cas de myocardite ont été rapportés dans des études en dehors des données combinées)v Inclut des cas rapportés d'hypertension, d'augmentation de la pression artérielle, de crise hypertensive, d'augmentation de la pression artérielle systolique, d'hypertension diastolique, de pression artérielle insuffisamment contrôlée, de rétinopathie hypertensive, d'hypertension essentielle, de néphropathie hypertensive, d'hypertension orthostatiquew Inclut des cas rapportés de rhinopharyngite, de congestion nasale et de rhinorrhéex Inclut des cas rapportés d'hypoxie, de diminution de la saturation en oxygène et de diminution de la PO2y Inclut des cas rapportés de pneumopathie inflammatoire, d'alvéolite, de toxicité pulmonaire, d'infiltration pulmonaire, de bronchiolite, de pneumopathie interstitielle, de pneumopathie inflammatoire radique, d'opacité pulmonaire, de pneumopathie alvéolaire, de pneumonie à éosinophiles, de pneumopathie inflammatoire à médiation immunitaire, de fibrose pulmonaire, de lésions pulmonaires radiques, de maladie pulmonaire à médiation immunitairez Inclut des cas rapportés de diarrhées, de selles fréquentes, d'hypermotilité gastro-intestinale, de selles impérieusesaa Inclut des cas rapportés de colite, de colite de dérivation, de colite auto-immune, de colite ischémique, de colite microscopique, de colite ulcéreuse, d'entérocolite à médiation immunitaire (des cas d'entérocolite à médiation immunitaire ont été rapportés dans des études en dehors des données groupées), de colite éosinophiliquebb Inclut des cas rapportés de douleurs oropharyngées, de troubles oropharyngés et d'irritation de la gorgecc Inclut des cas rapportés de pancréatite, de pancréatite auto-immune, de pancréatite aiguë, d'augmentation de la lipase, d'augmentation de l'amylase, d'augmentation des enzymes pancréatiques, d'amylase anormaledd Inclut des cas rapportés d'augmentation des taux d'ALAT, d'augmentation des taux d'ASAT, d'augmentation de la bilirubine dans le sang, d'augmentation de la gamma-glutamyltransférase, d'ascite, d'augmentation des transaminases, de douleurs hépatiques, d'hyperbilirubinémie, d'augmentation des paramètres fonctionnels hépatiques, d'augmentation des enzymes hépatiques, de trouble de la fonction hépatique, d'hypertransaminasémie, d'augmentation des taux sanguins de bilirubine non conjuguée, d'hyperammoniémie, d'augmentation des taux d'acides biliaires totaux, d'augmentation des taux d'ammoniaque, d'hépatopathie congestive, d'augmentation des taux urinaires de bilirubine, d'augmentation des taux sanguins de bilirubine conjuguée, d'hépatomégalie, d'enzymes hépatiques anormaux, de paramètres fonctionnels hépatiques anormaux, de bilirubine sanguine anormaleee Inclut des cas rapportés d'ascite, d'hépatite auto-immune, de lésion hépatocellulaire, d'hépatite, d'hépatite aiguë, d'hépatotoxicité, de maladie hépatique, de lésion hépatique d'origine médicamenteuse, de défaillance hépatique, de stéatose hépatique, de lésion hépatique, d'hémorragie de varices œsophagiennes, de varices œsophagiennes, d'hépatomégalie et d'hépatite toxique, de cytolyse hépatique, d'hépatite à médiation immunitaire, de lésion hépatique, de péritonite bactérienne spontanéeff Inclut des cas rapportés d'éruption cutanée, d'éruption cutanée maculopapuleuse, d'érythème, d'éruption cutanée prurigineuse, de dermatite acnéiforme, d'eczéma, de dermatite, d'éruption cutanée érythémateuse, d'ulcération cutanée, d'éruption cutanée papuleuse, de folliculite, d'éruption cutanée maculeuse, de desquamation cutanée, de dermatite des mains, d'eczéma infecté, de dermatite scrotale, d'éruption cutanée nodulaire, d'éruption cutanée folliculaire, d'éruption cutanée morbilliforme, d'éruption cutanée pustuleuse, de furoncle, d'acné, d'exanthème médicamenteux, de syndrome d'érythrodysesthésie palmo-plantaire, de dermatite séborrhéique, de dermatite allergique, d'érythème de la paupière, de toxicité cutanée, d'éruption cutanée de la paupière, d'exanthème fixe, d'éruption cutanée papulo-squameuse, d'éruption cutanée vésiculaire, de bulle cutanée, de vésicules labiales, de pemphigoïde, de bulle hémorragique buccale, d'exanthème de l'accès vasculaire, de dermatite à médiation immunitairegg Inclut des cas rapportés d'alopécie, de madarose, d'alopécie en plaques, d'alopécie totale et d'hypotrichosehh Inclut des cas rapportés de sécheresse cutanée, de xéroseii Inclut des cas rapportés de dermatite bulleuse, d'exanthème exfoliatif, d'érythème polymorphe, de dermatite exfoliative généralisée, d'exanthème toxique, de syndrome de Stevens-Johnson (SSJ), de dermatite exfoliative, de réaction médicamenteuse avec éosinophilie et symptômes systémiques (DRESS), de nécrolyse épidermique toxique (NET) et de vascularite cutanée (des cas de SSJ et de DRESS ont été rapportés dans des études en dehors des données combinées)jj Inclut des cas rapportés de dermatite psoriasiforme, de psoriasis en gouttes et de psoriasiskk Inclut des cas rapportés de douleurs de l'appareil locomoteur, de myalgies et de douleurs osseusesll Inclut des cas rapportés de myosite, de rhabdomyolyse, de pseudopolyarthrite rhizomélique, de dermatomyosite, d'abcès musculaire, de présence de myoglobine dans les urines, de myopathie, de polymyosite, de myosite à médiation immunitairemm Des cas mortels ont été rapportés dans des études en dehors des données combinéesnn Inclut des cas rapportés d'augmentation de la créatinine dans le sang et d'hypercréatininémieoo Inclut des cas rapportés de protéinurie, de microalbuminurie, de présence de protéines dans les urines, d'hémoglobinurie, de syndrome néphrotique, d'anomalie urinaire et d'albuminuriepp Inclut des cas rapportés de néphrite, de glomérulonéphrite paranéoplasique, de glomérulonéphrite chronique, de néphropathie du purpura rhumatoïde (purpura d'Henoch-Schönlein), de néphrite tubulo-interstitielle, de néphrite d'origine auto-immune, de néphrite allergique, de glomérulonéphrite, de syndrome néphrotique et de glomérulonéphrite mésangioproliférativeqq Rapportée dans des études en dehors des données groupées (se référant à l'administration par voie sous-cutanée). L'indication de fréquence repose sur l'exposition à Tecentriq s.c. dans l'étude IMscin001 (n = 11/247; 4,5%) et dans IMscin002 (n = 18/175; 10,3%, les patients recevaient Tecentriq s.c. et Tecentriq i.v.) et inclut des rapports de réactions au site d'injection, de douleurs au site d'injection, d'érythème au site d'injection et d'éruption cutanée au site d'injection
** Rapportées après la commercialisation en dehors de l'ensemble des données regroupées. L'indication de fréquence repose sur l'exposition dans la totalité du programme
Données post-commercialisation
Les réactions médicamenteuses indésirables suivantes ont été identifiées dans le cadre de la surveillance post-commercialisation de Tecentriq. Les réactions médicamenteuses indésirables observées dans le cadre de la surveillance post-commercialisation sont rangées par classe de système d'organes de la classification MedDRA.
Affections hématologiques et du système lymphatique
Rares: lymphohistiocytose hémophagocytaire a.
Affections du système nerveux
Rares: parésie faciale a.
Rares: myélite a.
Affections oculaires
Occasionnels: uvéite a.
a Rapportées dans le cadre de l'expérience post-commercialisation en dehors de l'ensemble des données combinées. La fréquence repose sur l'exposition dans la totalité du programme.
Description de certains effets indésirables
Les données ci-dessous contiennent des indications relatives aux réactions indésirables substantielles survenues sous Tecentriq en monothérapie. Les détails concernant les principales réactions indésirables de Tecentriq utilisé en traitement combiné sont mentionnés lorsque des différences cliniques pertinentes ont été constatées par rapport à Tecentriq en monothérapie. Pour la conduite à tenir lors des événements suivants, voir «Mises en garde et précautions, Généralités»:
Infections
Lors des études cliniques menées chez 5939 patients atteints de différents types de cancers, qui ont reçu Tecentriq, 41,0% des patients ont développé des infections, notamment des infections de grade 3 (8,5%), de grade 4 (1,5%) et de grade 5 (1,2%). Les infections de grade 3 ou supérieur les plus fréquentes étaient les infections des voies urinaires et les pneumonies, survenues chez respectivement 2,4 et 2,6% des patients.
Dans l'étude sur le mélanome (CO39262), les infections étaient plus fréquentes chez les patients ayant reçu Tecentriq i.v. en association avec du cobimétinib et du vémurafénib. Des infections sont survenues chez 60,4% (139/230) des patients, dont des infections de grade 3-4 chez 8,7% (20/230) et des infections de grade 5 chez 1,7% (4/230) des patients. L'infection urinaire était l'infection la plus fréquente et elle est survenue chez 7,8% (18/230) des patients.
Lymphohistiocytose hémophagocytaire
Une lymphohistiocytose hémophagocytaire (LLH) est survenue chez < 0,1% (2/5939) des patients ayant reçu Tecentriq en monothérapie. Le délai médian d'apparition a été de 2,7 mois (intervalle: de 1,6 à 3,8 mois). La durée a été de 1,1 mois (intervalle: de 0,9 à 1,4 mois). Chez 1 patient (< 0,1%), la LLH a entraîné l'arrêt de Tecentriq. Aucun des deux patients n'a eu besoin de corticostéroïdes.
Pneumopathie inflammatoire à médiation immunitaire
Une pneumopathie inflammatoire est survenue chez 3,0% (177/5939) des patients ayant reçu Tecentriq en monothérapie. Cet événement a eu une issue fatale chez quatre des 177 patients. Le délai médian d'apparition a été de 4,0 mois (intervalle: de 0,1 à 29,8 mois). La durée médiane a été de 2,1 mois (intervalle: de 0 à 64,0+ mois; le signe + signale une valeur censurée). Chez 51 patients (0,9%), la pneumopathie inflammatoire a entraîné une interruption du traitement par Tecentriq. Une pneumopathie inflammatoire ayant nécessité l'utilisation de corticostéroïdes est survenue chez 1,8% (104/5939) des patients traités par Tecentriq.
Dans l'étude IMscin001, une pneumopathie inflammatoire est survenue chez 2,0% (5/247) des patients traités par Tecentriq s.c.
Dans l'étude sur le mélanome (CO39262), les pneumopathies inflammatoires d'origine immunologique étaient plus fréquentes chez les patients ayant reçu Tecentriq i.v. en association avec du cobimétinib et du vémurafénib. Une pneumopathie inflammatoire d'origine immunologique est survenue chez 12,6% (29/230) des patients et était de grade 3 à 4 chez 1,3% (3/230) des patients.
Hépatite à médiation immunitaire
Une hépatite est survenue chez 1,6% (97/5939) des patients ayant reçu Tecentriq en monothérapie. Cet événement a eu une issue fatale chez quatre des 97 patients. Le délai médian d'apparition a été de 2,0 mois (intervalle: de 0,2 à 18,8 mois). La durée médiane a été de 1,1 mois (intervalle: de 0 à 58,5+ mois; le signe + signale une valeur censurée). Une hépatite a entraîné une interruption du traitement par Tecentriq chez 22 patients (0,4%). Une hépatite a nécessité l'administration de corticostéroïdes chez 0,6% (37/5939) des patients traités par Tecentriq.
Dans l'étude IMscin001, une hépatite à médiation immunitaire est survenue chez 1,2% (3/247) des patients traités par Tecentriq s.c.
Dans l'étude sur le mélanome (CO39262), les hépatites d'origine immunologique étaient plus fréquentes chez les patients ayant reçu Tecentriq i.v. en association avec du cobimétinib et du vémurafénib. Une hépatite d'origine immunologique est survenue chez 53,0% (122/230) des patients et était de grade 3-4 chez 22,2% (51/230) des patients et de grade 5 chez 0,9% (2/230) des patients. La plupart des événements en lien avec une hépatite d'origine immunologique signalée chez les patients traités par Tecentriq en association avec du cobimétinib et du vémurafénib étaient des valeurs de laboratoire anormales (114 des 122 patients [93,4%]).
Colite à médiation immunitaire
Une colite est survenue chez 1,1% (67/5939) des patients ayant reçu Tecentriq en monothérapie. Le délai médian d'apparition a été de 4,9 mois (intervalle: de 0,5 à 36,4 mois). La durée médiane a été de 1,4 mois (intervalle: de 0,1 à 61,7+ mois; le signe + signale une valeur censurée). Chez 26 patients (0,4%), la colite a entraîné une interruption du traitement par Tecentriq. Chez 0,6% (34/5939) des patients sous traitement par Tecentriq, la survenue d'une colite a nécessité l'utilisation de corticostéroïdes.
Dans l'étude sur le mélanome (CO39262), les diarrhées ou les colites étaient plus fréquentes chez les patients ayant reçu Tecentriq i.v. en association avec du cobimétinib et du vémurafénib. Des diarrhées ou une colite sont survenues chez 50,4% (116/230) des patients et étaient de grade 3-4 chez 3,0% (7/230) des patients.
Endocrinopathies à médiation immunitaire
Affections de la thyroïde
Une hypothyroïdie est survenue chez 8,6% (511/5939) des patients ayant reçu Tecentriq en monothérapie. Le délai médian d'apparition a été de 4,1 mois (intervalle: de 0 à 38,5 mois). L'hypothyroïdie a entraîné une interruption du traitement par Tecentriq chez 10 patients (0,2%). La durée médiane a été de 51,1 mois (intervalle: de 0,1+ à 88,6+ mois; le signe + signale une valeur censurée).
Une hyperthyroïdie est survenue chez 2,5% (149/5939) des patients ayant reçu Tecentriq en monothérapie. Le délai médian d'apparition a été de 2,7 mois (intervalle: de 0 à 24,3 mois). La durée médiane a été de 2,6 mois (intervalle: de 0+ à 77,2+ mois; le signe + signale une valeur censurée). L'hyperthyroïdie a entraîné une interruption du traitement par Tecentriq chez 6 patients (0,1%).
Une hyperthyroïdie est survenue chez 4,9% (23/473) des patients ayant reçu Tecentriq en association avec du carboplatine et du nab-paclitaxel. Un patient (0,2%) a arrêté le traitement à cause d'une hyperthyroïdie.
Dans l'étude IMscin001, une hypothyroïdie est survenue chez 10,5% (26/247) des patients traités par Tecentriq s.c. et une hyperthyroïdie est survenue chez 2,0% (5/247) des patients traités par Tecentriq s.c.
Dans l'étude sur le mélanome (CO39262), l'hypothyroïdie et l'hyperthyroïdie étaient plus fréquentes chez les patients ayant reçu Tecentriq i.v. en association avec du cobimétinib et du vémurafénib. Une hypothyroïdie est survenue chez 26,1% (60/230) des patients; aucune n'était de grade 3-4. Une hyperthyroïdie est survenue chez 18,7% (43/230) des patients et était de grade 3-4 chez 0,9% (2/230) des patients.
Insuffisance surrénalienne
Une insuffisance surrénalienne est survenue chez 0,4% (26/5939) des patients ayant reçu Tecentriq en monothérapie. Le délai médian d'apparition a été de 6,7 mois (intervalle: de 0,1 à 21,4 mois). L'insuffisance surrénalienne a entraîné l'interruption du traitement chez 5 patients (< 0,1%). Chez 0,4% (23/5939) des patients sous traitement par Tecentriq, la survenue d'une insuffisance surrénalienne a nécessité l'utilisation de corticostéroïdes.
Dans l'étude IMscin001, une insuffisance surrénalienne est survenue chez 0,4% (1/247) des patients traités par Tecentriq s.c.
Une insuffisance surrénalienne est survenue chez 1,5% (7/473) des patients ayant reçu Tecentriq i.v. en association avec du carboplatine et du nab-paclitaxel. Une insuffisance surrénalienne nécessitant l'utilisation de corticoïdes est survenue chez 0,8% (4/473) des patients ayant reçu Tecentriq en association avec du carboplatine et du nab-paclitaxel.
Hypophysite
Une hypophysite est survenue chez 0,2% (10/5939) des patients ayant reçu Tecentriq en monothérapie. Le délai médian d'apparition a été de 5,1 mois chez deux de ces patients (intervalle: de 0,7 à 13,7 mois). L'hypophysite a entraîné l'interruption de Tecentriq chez 1 patient (< 0,1%) et nécessité le recours à des corticostéroïdes chez 0,1% (7/5939) des patients sous traitement par Tecentriq. Dans une étude en cours, une hypophysite est survenue chez 0,8% (3/393) des patients ayant reçu Tecentriq i.v. en association au bévacizumab, au paclitaxel et au carboplatine. Le délai médian d'apparition a été de 7,7 mois (intervalle: de 5,0 à 8,8 mois). Les trois patients ont nécessité un traitement par des corticostéroïdes.
Diabète
Un diabète est survenu chez 0,5% (30/5939) des patients ayant reçu Tecentriq en monothérapie. Le délai médian d'apparition a été de 5,5 mois (intervalle: de 0,1 à 29,0 mois). La durée médiane a été de 4,9 mois (intervalle: de 0,1 à 62,0+ mois; le signe + signale une valeur censurée). Chez 3 patients (< 0,1%), le diabète a entraîné une interruption du traitement par Tecentriq et quatre patients ont nécessité un traitement par des corticostéroïdes.
Un diabète est survenu chez 2,0% (10/493) des patients atteints de CHC ayant reçu Tecentriq i.v. en association avec le bévacizumab. Le délai médian d'apparition a été de 4,4 mois (intervalle: de 1,2 à 8,3 mois). Aucun des cas de diabète n'a nécessité l'arrêt de Tecentriq.
Méningoencéphalite à médiation immunitaire
Une méningoencéphalite est survenue chez 0,4% (26/5939) des patients ayant reçu Tecentriq en monothérapie. Le délai d'apparition a été de 0,5 mois (intervalle: de 0 à 12,5 mois). La durée médiane a été de 0,7 mois (intervalle: de 0,1+ à 14,5+ mois; le signe + signale une valeur censurée). Une méningoencéphalite a entraîné l'interruption de Tecentriq chez 11 patients (0,2%) et nécessité le recours à des corticostéroïdes chez 0,3% (16/5939) des patients sous traitement par Tecentriq.
Neuropathies à médiation immunitaire
Syndrome de Guillain-Barré et polyneuropathie démyélinisante
Un syndrome de Guillain-Barré et une polyneuropathie démyélinisante sont survenus chez 0,1% (6/5939) des patients ayant reçu Tecentriq en monothérapie. Le délai médian d'apparition de cet événement a été de 4,1 mois (intervalle: de 0,6 à 8,1 mois). La durée médiane a été de 8,0 mois (intervalle: de 0,6 à 24,5+ mois; le signe + signale une valeur censurée). Un syndrome de Guillain-Barré a entraîné l'interruption de Tecentriq chez 1 patient (< 0,1%). Chez < 0,1% (3/5939) des patients, un syndrome de Guillain-Barré a nécessité le recours à des corticostéroïdes.
Parésie faciale à médiation immunitaire
Une parésie faciale est survenue chez < 0,1% (1/5939) des patients ayant reçu Tecentriq en monothérapie. Le délai d'apparition a été de 1,0 mois. La durée a été de 1,1 mois. Cet événement n'a pas nécessité le recours à des corticostéroïdes et n'a pas entraîné l'arrêt de Tecentriq.
Myélite à médiation immunitaire
Une myélite à médiation immunitaire est survenue chez < 0,1% (1/5939) des patients ayant reçu Tecentriq en monothérapie. Le délai d'apparition a été de 0,8 mois. Cet événement a nécessité le recours à des corticostéroïdes, mais n'a pas entraîné l'arrêt de Tecentriq.
Pancréatite à médiation immunitaire
Une pancréatite, y compris une augmentation des taux sériques d'amylase et de lipase, est survenue chez 0,8% (47/5939) des patients ayant reçu Tecentriq en monothérapie. Le délai médian d'apparition a été de 5,5 mois (intervalle: de 0 à 24,8 mois). La durée médiane a été de 0,7 mois (intervalle: de 0 à 40,4+ mois; le signe + signale une valeur censurée). Chez 3 patients (< 0,1%), la pancréatite a entraîné l'interruption du traitement par Tecentriq. Chez < 0,1% (8/5939) des patients ayant reçu Tecentriq, une pancréatite a nécessité le recours à des corticostéroïdes.
Myosite à médiation immunitaire
Une myosite est survenue chez 0,6% (34/5939) des patients qui avaient reçu Tecentriq en monothérapie. Le délai médian d'apparition a été de 3,5 mois (intervalle: de 0,4 à 11,5 mois). La durée médiane a été de 6,4 mois (intervalle: de 0,3 à 73,0+ mois; le signe + signale une valeur censurée). La myosite a entraîné l'interruption de Tecentriq chez 6 patients (0,1%). Chez 0,2% (12/5939) des patients sous traitement par Tecentriq, la myosite a nécessité l'administration de corticostéroïdes.
Néphrite à médiation immunitaire
Une néphrite est survenue chez 0,2% (13/5939) des patients ayant reçu Tecentriq en monothérapie. Le délai médian d'apparition a été de 5,1 mois (intervalle: de 0,1 mois à 20,4 mois). Une néphrite a entraîné l'interruption de Tecentriq chez 6 patients (0,1%). Six patients (0,1%) ont dû suivre un traitement par des corticostéroïdes.
Réactions cutanées sévères à médiation immunitaire
Des réactions cutanées indésirables sévères (SCAR) sont survenues chez 0,6% (33/5939) des patients qui avaient reçu Tecentriq en monothérapie. Chez deux des 33 patients, cet événement a eu une issue fatale. Le délai médian d'apparition a été de 4,9 mois (intervalle: de 0,1 à 15,5 mois). La durée médiane a été de 2,8 mois (intervalle: de 0 à 67,6+ mois; le signe + signale une valeur censurée). Chez 3 patients (< 0,1%), les SCAR ont entraîné une interruption du traitement par Tecentriq. Des SCAR ayant nécessité l'utilisation systémique de corticostéroïdes sont survenues chez 0,2% (11/5939) des patients ayant reçu Tecentriq en monothérapie.
Dans l'étude IMscin001, des SCAR sont survenues chez 0,8% (2/247) des patients traités par Tecentriq s.c.
Affections du péricarde à médiation immunitaire
Des affections du péricarde sont survenues chez 0,8% (50/5939) des patients ayant reçu Tecentriq en monothérapie. Le délai médian de survenue a été de 1,5 mois (intervalle: 0,2 à 17,5 mois). La durée médiane était de 2,5 mois (intervalle: 0 à 51,5+ mois; + signale une valeur censurée). Les affections du péricarde ont conduit à l'arrêt du traitement par Tecentriq chez 3 patients (< 0,1%). Des affections du péricarde ayant nécessité l'utilisation de corticoïdes sont survenues chez 0,1% (7/5939) des patients.
Passage du traitement par Tecentriq i.v. à Tecentriq sous-cutané (et vice versa)
Le passage de Tecentriq i.v. à Tecentriq sous-cutané (et vice versa) a été évalué dans le cadre de l'étude IMscin002 (voir «Efficacité clinique»).
Avant le passage (cycles 1-3) de Tecentriq i.v. à Tecentriq s.c. et de Tecentriq s.c. à Tecentriq i.v., les incidences des événements indésirables (EI) de grade 3–4 et des événements indésirables graves (EIG) étaient supérieures (< 20%) aux incidences observées après le changement de traitement (cycles 4-6) (< 10%). L'incidence des EI de grade 5 était plus élevée avant le passage de Tecentriq s.c. à Tecentriq i.v. (3,5% contre 0%). L'incidence des EI de grade 5 était comparable avant et après le passage de Tecentriq i.v. à Tecentriq s.c. (1,1% contre 1,4%).
Immunogénicité
Comme toutes les protéines thérapeutiques, Tecentriq peut également potentiellement provoquer une réponse immunitaire. Dans plusieurs études de phase III menées avec Tecentriq i.v., 17,9 à 38,5% des patients ont présenté des anticorps dirigés contre le médicament (ADA: anti-drug antibodies) en lien avec le traitement et 4,3% à 19,9% des patients ont présenté des anticorps neutralisants (NAb) (voir «Mises en garde et précautions», «Propriétés/Effets», «Pharmacocinétique»). Au cours de l'étude IMscin001, l'incidence des ADA était de 19,5% chez les patients traités par Tecentriq s.c. et de 13,9% chez les patients traités par Tecentriq i.v.
Dans les données regroupées des patients ayant reçu Tecentriq i.v. en monothérapie (n = 3460) ou Tecentriq i.v. en traitement combiné (n = 2527) et Tecentriq s.c. (n = 221), les taux suivants d'événements indésirables ont été observés pour la population ADA-positive, par rapport à la population ADA-négative: événements indésirables de grade 3-4: 46,2% contre 39,5%; événements indésirables graves: 39,6% contre 33,4%; événements indésirables ayant entraîné l'interruption du traitement: 8,5% contre 7,8% (en monothérapie); événements indésirables de grade 3-4: 63,7% contre 58,0%, événements indésirables graves: 44,3% contre 34,8%, événements indésirables ayant entraîné l'interruption du traitement: 22,8% contre 16,8% (en traitements combinés); événements indésirables de grade 3-4: 20,9% contre 21,3%, événements indésirables graves: 18,6% contre 18,5%, événements indésirables ayant entraîné l'interruption du traitement: 0% contre 1,7% (avec le traitement par Tecentriq s.c.).
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageAucun cas de surdosage n'a été rapporté.
Propriétés/EffetsCode ATC
L01FF05
Mécanisme d'action
Tecentriq s.c. contient de l'atézolizumab et de la hyaluronidase humaine recombinante (rHuPH20).
La liaison du PD-L1 aux récepteurs PD-1 et B7.1 sur les cellules T provoque une suppression de l'activité cytotoxique des lymphocytes T par inhibition de la prolifération et de la production de cytokines par les lymphocytes T. Le PD-L1 peut être exprimé sur les cellules tumorales (TC) ainsi que les cellules immunitaires infiltrant les tumeurs (IC) et contribuer à inhiber la réponse immunitaire antitumorale dans le microenvironnement.
L'atézolizumab est un anticorps monoclonal humanisé de type immunoglobuline G1 (IgG1) à fragment Fc modifié, qui se lie directement à PD-L1 et provoque un blocage des interactions avec les récepteurs PD-1 et B7.1. Cela permet de lever l'inhibition de la réponse immunitaire médiée par la voie de signalisation PD-L1/PD-1 et entraîne une réactivation de la réponse immunitaire antitumorale. L'atézolizumab ne modifie pas l'interaction PD-L2/PD-1. Dans des modèles tumoraux syngéniques murins, le blocage de l'activité du PD-L1 a entraîné une diminution de la croissance tumorale.
La double inhibition des voies de signalisation PD-1/PD-L1 et MAPK ainsi que BRAF et MEK entrave la croissance tumorale dans les modèles de cancer chez les souris et améliore l'immunogénicité des tumeurs en augmentant la présentation de l'antigène ainsi que l'activation et l'infiltration des cellules T par rapport à la thérapie ciblée seule.
Localement et de manière transitoire, la hyaluronidase humaine recombinante (rHuPH20) dégrade l'acide hyaluronique (AH), un glycosaminoglycan présent naturellement dans tout l'organisme, dans le compartiment extracelluaire de l'espace sous-cutané, en clivant la liaison entre les deux sucres qui composent l'AH (N-acétylglucosamine et acide glucuronique).
Efficacité clinique
Forme pharmaceutique intraveineuse
Pour des informations détaillées sur les études cliniques ayant été réalisées avec Tecentriq i.v., veuillez consulter l'information professionnelle de Tecentriq i.v.
Cancer du poumon non à petites cellules
NSCLC prétraité par chimiothérapie
IMscin001
BP40657 (IMscin001), une étude de phase Ib/III ouverte, multicentrique, internationale et randomisée, a été réalisée pour évaluer la pharmacocinétique, l'efficacité et la sécurité de Tecentriq s.c. en comparaison avec Tecentriq i.v. chez des patients atteints de NSCLC localement avancé ou métastatique n'ayant pas encore reçu d'immunothérapie anticancéreuse (CIT) et chez des patients dont la maladie a progressé ou récidivé après une chimiothérapie précédente à base de platine. L'étude IMscin001 a été conçue pour démontrer la non-infériorité de l'atézolizumab s.c. comparé à l'atézolizumab i.v. en ce qui concerne le taux sérique résiduel (Cmin) et l'AUC prédite par le modèle, du jour 0 au jour 21 du cycle 1 d'atézolizumab (avant l'administration de la dose au cycle 2) (co-critère principal d'évaluation). Les critères d'évaluation secondaires descriptifs ont inclus la survie sans progression (PFS), le taux de réponse objective (ORR) et la survie globale (OS).
Dans la partie 2 (phase III), 371 patients au total ont été inclus et randomisés pour recevoir soit 1875 mg de Tecentriq s.c. q3w, soit 1200 mg de Tecentriq i.v. q3w. Une réduction de la dose n'était pas autorisée.
Ont été exclus de l'étude les patients présentant des antécédents connus de maladie auto-immune ou des métastases cérébrales évolutives ou corticodépendantes, ainsi que les patients ayant reçu des vaccins vivants atténués dans les 4 semaines précédant la randomisation ou encore ceux ayant utilisé des principes actifs immunostimulants systémiques dans les 4 semaines précédant la randomisation ou des médicaments immunosuppresseurs systémiques dans les 2 semaines précédant la randomisation.
L'âge médian de la population en intention de traiter (intention-to-treat) était de 64 ans (intervalle: de 27 à 85 ans) et 69% des patients étaient de sexe masculin. La majorité des patients étaient des Blancs (67%). Presque les deux tiers des patients (65%) avaient un carcinome non épidermoïde, 5% présentaient une mutation connue de l'EGFR, 2% présentaient des translocations connues de l'ALK, 40% étaient PD-L1-positifs (TC ≥1% et/ou IC ≥1%), 16% présentaient des métastases du SNC non actives à l'inclusion, 26% avaient un score de performance ECOG de 0 et 74% avaient un score de performance ECOG de 1, et la plupart des patients étaient fumeurs ou d'anciens fumeurs (70%).
La non-infériorité de l'exposition à l'atézolizumab dans Tecentriq s.c., comparé à l'atézolizumab i.v., a été démontrée (voir «Pharmacocinétique»). Les résultats d'une analyse d'efficacité post-hoc actualisée, avec une durée de survie médiane de 9,5 mois, sont résumés dans le tableau 5.
Tableau 5: Résumé des analyses d'efficacité actualisées (IMscin001)
|
Critère d'évaluation de l'efficacité
|
Tecentriq s.c.
|
Tecentriq i.v.
| |
ORR évalué et confirmé par l'investigateur (RECIST v1.1)*
|
n = 245
|
n = 124
| |
Nombre de répondeurs (%)
|
27 (11,0%)
|
13 (10,5%)
| |
|
|
| |
PFS évaluée par l'investigateur (RECIST v1.1)*
|
n = 247
|
n = 124
| |
Nombre d'événements (%)
|
219 (88,7%)
|
107 (86,3%)
| |
Médiane (mois)
|
2,8
|
2,9
| |
OS*
|
n = 247
|
n = 124
| |
Nombre d'événements (%)
|
144 (58,3%)
|
79 (63,7)
| |
Médiane (mois)
|
10,7
|
10,1
|
ORR = taux de réponse objective; OS = survie globale; PFS = survie sans progression; RECIST = critères d'évaluation de la réponse pour les tumeurs solides version 1.1 (response evaluation criteria in solid tumors v1.1)
* Analyses descriptives
Efficacité de l'atézolizumab en présence d'anticorps dirigés contre le médicament
Des méta-analyses exploratoires, non ajustées, portant sur l'efficacité (sans ajustements de déséquilibres des caractéristiques initiales) ont été réalisées avec Tecentriq i.v. Selon ces méta-analyses, la valeur estimée du HR pour la survie globale (OS) était de 0,815 entre le sous-groupe ADA-positif et le bras témoin (IC à 95%: 0,732; 0,908) et la valeur estimée du HR pour l'OS était de 0,672 entre le sous-groupe ADA-négatif et le bras témoin (IC à 95%: 0,617; 0,732), voir graphiques 1 et 2.
Graphique 1: Méta-analyse de l'OS (non ajustée) chez des patients ADA-positifs par rapport au bras témoin
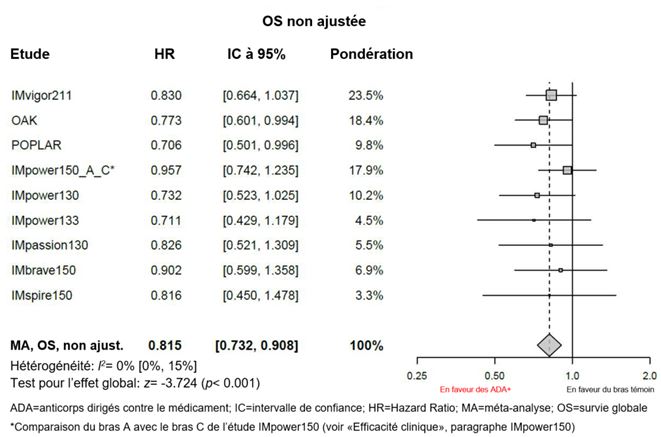
Graphique 2: Méta-analyse de l'OS (non ajustée) chez des patients ADA-négatifs par rapport au bras témoin
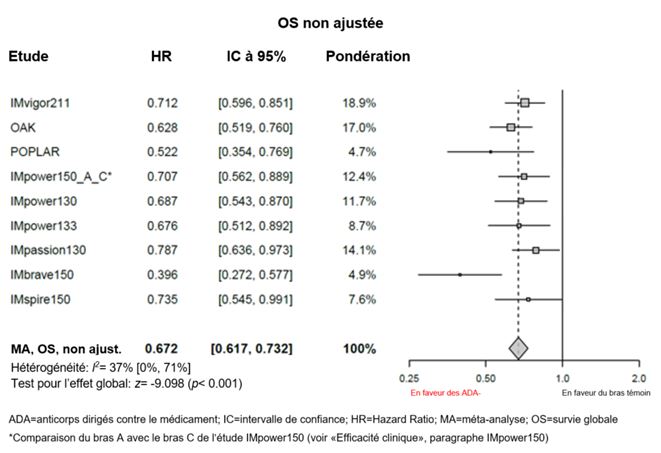
Dans l'étude IMscin001, l'incidence des anticorps anti-atézolizumab en lien avec le traitement était respectivement de 19,5% [43/221] et 13,9% [15/108] chez les patients ayant été traités par Tecentriq s.c. ou par Tecentriq i.v. L'incidence des anticorps anti-rHuPH20 en lien avec le traitement chez les patients traités par Tecentriq s.c. était de 5,4% (12/224).
L'OS médiane était de 12,6 mois (IC à 95%: 10,6; 16,5) chez les patients traités par Tecentriq s.c. qui étaient ADA-négatifs (n = 178) et de 6,9 mois (IC à 95%: 5,0; non estimable) chez les patients qui étaient ADA-positifs (n = 43) à un moment quelconque de l'étude.
IMscin002
L'étude IMscin002 randomisée, multicentrique, croisée, en ouvert, menée chez des patients atteints d'un cancer du poumon non à petites cellules (CPNPC) avait pour objectif principal de déterminer la préférence des patients vis-à-vis de Tecentriq s.c. ou de Tecentriq i.v. Les 179 patients randomisés de l'étude étaient atteints soit d'un CPNPC PD-L1-positif au stade précoce et avaient achevé auparavant un traitement adjuvant, soit d'un CPNPC au stade IV présentant une forte expression de PD-L1 sans chimiothérapie préalable. Après la randomisation, les patients ont reçu 3 cycles de Tecentriq s.c., suivis de 3 cycles de Tecentriq i.v. (bras A) ou 3 cycles de Tecentriq i.v., suivis de 3 cycles de Tecentriq s.c. (bras B).
Parmi les 126 patients éligibles, 123 (98%) ont répondu au questionnaire sur la préférence des patients (PPQ). L'analyse principale a révélé que 87 des 123 patients (71%) préféraient l'administration sous-cutanée de Tecentriq s.c. à Tecentriq i.v., la raison la plus fréquemment évoquée étant que l'administration demandait moins de temps passé à l'hôpital. Vingt-six des 123 patients (21%) ont indiqué préférer Tecentriq i.v. à Tecentriq s.c. La raison la plus fréquente était que l'administration était perçue comme plus agréable. Dix des 123 patients (8%) n'ont exprimé aucune préférence quant au mode d'administration.
PharmacocinétiqueLa valeur de la Cmin d'atézolizumab mesurée dans le sérum au cycle 1 (c.-à-d. avant l'administration de la dose au cycle 2) n'a pas indiqué d'infériorité de l'atézolizumab dans Tecentriq s.c. par rapport à l'atézolizumab intraveineux, pour un rapport des moyennes géométriques (RMG) de 1,05 (IC à 90%: 0,88–1,24). Le RMG pour l'AUC calculée sur la base du modèle, du jour 0 au jour 21 du cycle 1 (AUC0-21j), était de 0,87 (IC à 90%: 0,83–0,92). Le rapport de la moyenne pour l'accumulation systémique après l'administration de 1875 mg de Tecentriq s.c. q3w était de 2,2. À l'état d'équilibre, les valeurs de la Cmin et de l'AUC calculées sur la base du modèle étaient comparables pour Tecentriq s.c. et l'atézolizumab intraveineux (voir tableau 6).
Tableau 6: Exposition à l'atézolizumab à l'état d'équilibre (moyenne géométrique du 5e au 95e percentile) après administration sous-cutanée ou intraveineuse d'atézolizumab
|
Paramètre
|
Atézolizumab dans Tecentriq s.c.
|
Atézolizumab intraveineux
| |
Cmin à l'état d'équilibre a
(µg/ml)
|
205
(70,3–427)
|
179
(98,4–313)
| |
AUC à l'état d'équilibre a
(µg/ml•jour)
|
6163
(2561–11340)
|
6107
(3890–9334)
|
a L'exposition calculée sur la base du modèle reposait sur une analyse pharmacocinétique de population
Absorption
Sur la base d'une analyse pharmacocinétique de population, la biodisponibilité absolue était de 72% et le taux d'absorption de premier ordre (Ka) de 0,3 (1/jour). La moyenne géométrique de la concentration sérique maximale (Cmax) d'atézolizumab au cycle 1 était de 189 µg/ml et le temps médian jusqu'à obtention de la concentration sérique maximale (Tmax) était de 4,5 jours (médiane; 2,2–9,0 jours, min.-max.).
Distribution
Une analyse pharmacocinétique de population a montré que chez un patient typique, le volume de distribution du compartiment central (V1) est de 3,28 l et le volume de distribution à l'état d'équilibre (Vss) de 6,91 l.
Métabolisme
Le métabolisme de Tecentriq n'a pas été directement étudié. Les anticorps sont en principe éliminés par catabolisme.
Élimination
Une analyse pharmacocinétique de population a montré que la clairance de Tecentriq est de 0,200 l/jour et la demi-vie d'élimination typique (t1/2) de 27 jours. Dans les études cliniques menées avec Tecentriq administré par voie intraveineuse, la clairance médiane de l'atézolizumab était augmentée de 22% (intervalle de 18% à 49%) chez les patients présentant des ADA en lien avec le traitement par rapport aux patients sans ADA liés au traitement.
Cinétique pour certains groupes de patients
Troubles de la fonction hépatique
Aucune étude spécifique n'a été réalisée avec Tecentriq chez des patients insuffisants hépatiques. L'analyse pharmacocinétique de population n'a montré aucune différence cliniquement significative concernant la clairance de Tecentriq, administré par voie intraveineuse ou sous-cutanée, entre les patients présentant une insuffisance hépatique légère (bilirubine ≤ LSN et ASAT > LSN ou bilirubine < 1,0 jusqu'à 1,5× LSN et quel que soit le taux d'ASAT) ou modérée (bilirubine > 1,5 jusqu'à 3× LSN et quel que soit le taux d'ASAT) et ceux présentant une fonction hépatique normale (bilirubine et ASAT ≤ LSN). Parmi les patients traités par Tecentriq présentant une insuffisance hépatique modérée, un seul a reçu Tecentriq par voie sous-cutanée. Il n'existe aucune donnée chez les patients présentant une insuffisance hépatique sévère (bilirubine > 3,0× LSN, quel que soit le taux d'ASAT). Les troubles de la fonction hépatique ont été définis selon les critères de l'insuffisance hépatique établis par le National Cancer Institute (NCI) (voir «Posologie/Mode d'emploi: Instructions posologiques particulières»).
Troubles de la fonction rénale
Aucune étude spécifique n'a été réalisée avec Tecentriq chez des patients insuffisants rénaux. Chez les patients ayant reçu Tecentriq soit par voie sous-cutanée soit par voie intraveineuse, l'analyse pharmacocinétique de population n'a montré aucune différence cliniquement significative en termes de clairance en cas d'insuffisance rénale légère (DFGe de 60 à 89 ml/min/1,73 m²; n = 111 par traitement s.c. ou n = 208 par traitement i.v.) ou modérée (DFGe de 30 à 59 ml/min/1,73 m²; n = 32 par traitement s.c. ou n = 116 par traitement i.v.), par rapport aux patients présentant une fonction rénale normale (DFGe supérieur ou égal à 90 ml/min/1,73 m²; n = 103 par traitement s.c. ou n = 140 par traitement i.v.). Seuls quelques patients traités par Tecentriq par voie intraveineuse présentaient une insuffisance rénale sévère (DFGe de 15 à 29 ml/min/1,73 m²; n = 8) (voir «Posologie/Mode d'emploi: Instructions posologiques particulières»).
Patients âgés
Aucune étude spécifique n'a été réalisée avec Tecentriq chez des patients âgés. L'influence de l'âge sur la pharmacocinétique de Tecentriq a été évaluée dans une analyse pharmacocinétique de population. Chez les patients âgés de 21 à 89 ans (n = 472), avec un âge médian de 62 ans, l'âge n'a pas été identifié comme une covariable significative affectant la pharmacocinétique de Tecentriq administré par voie intraveineuse. Aucune différence cliniquement significative concernant la pharmacocinétique de Tecentriq, administré par voie sous-cutanée ou par voie intraveineuse, n'a été observée entre les patients < 65 ans (n = 138 par traitement s.c. ou n = 274 par traitement i.v.), les patients âgés de 65 à 75 ans (n = 89 par traitement s.c. ou n = 152 par traitement i.v.) et les patients > 75 ans (n = 19 par traitement s.c. ou n = 46 par traitement i.v.) (voir «Posologie/Mode d'emploi: Instructions posologiques particulières»).
Données précliniquesPharmacologie de sécurité
Les critères d'évaluation pharmacologiques de sécurité de Tecentriq administré par voie intraveineuse ont été évalués dans le cadre de deux études portant sur la toxicité chronique, l'une de 8 semaines et l'autre de 26 semaines, menées chez le singe cynomolgus. Elles n'ont révélé aucun risque particulier pour l'être humain.
Propriétés toxicologiques chez l'animal
Dans une souche spécifique de souris, des neuropathies minimes du nerf sciatique ont été observées à des doses ≥10 mg/kg administrées par voie intraveineuse. Des artérites/périartérites minimes à légères touchant de multiples organes sont survenues chez le singe cynomolgus après administration sous-cutanée de doses ≥15 mg/kg et après administration intra-veineuse de doses de 50 mg/kg. Chez les singes femelles, des cycles sexuels irréguliers ont été observés à des doses de 50 mg/kg administrées par voie intraveineuse. Une augmentation des inflammations sous-cutanées (irritations légères) au niveau du site d'injection a été observée chez le singe.
Une augmentation de la réponse immunitaire ayant entraîné une mortalité accrue a été observée dans le modèle murin d'infection virale par le LCMV CL-13, mais pas par le LCMV Armstrong.
Dans une étude sur des singes cynomolgus exposés à l'hémocyanine de patelle (Keyhole Limpet Hemocyanin, KLH) utilisée comme antigène T-dépendant, l'administration de 50 mg d'atézolizumab par kg en injection i.v. pendant une période allant jusqu'à 26 semaines a été bien tolérée. Chez les singes cynomolgus ayant reçu la KLH, aucune toxicité inattendue ou nouvelle n'est survenue. L'administration au long cours d'atézolizumab a entraîné une diminution non significative des réponses primaires des IgM et des réponses primaires et secondaires des IgG à la KLH. Même si la signification toxicologique est incertaine en raison du faible nombre d'animaux utilisés dans cette étude et de la grande variabilité entre les animaux, on peut en conclure que l'atézolizumab pourrait diminuer les réponses primaires et secondaires des IgG aux antigènes T-dépendants.
Mutagénicité
Aucune étude de mutagénicité n'a été réalisée avec Tecentriq.
Carcinogénicité
Aucune étude de carcinogénicité n'a été réalisée avec Tecentriq.
Toxicité sur la reproduction
Aucune étude de reproduction ou de tératogénicité n'a été réalisée chez l'animal avec Tecentriq. L'importance capitale de la voie de signalisation du PD-L1/PD-1 pour la tolérance maternelle et fœtale ainsi que pour la survie embryonnaire et fœtale pendant la gestation est bien démontrée. On peut s'attendre à ce que l'administration de Tecentriq ait des effets néfastes sur la grossesse et expose le fœtus humain à un risque, notamment de mort de l'embryon.
Fertilité
Aucune étude de fertilité n'a été réalisée avec Tecentriq. L'étude portant sur la toxicité chronique a cependant comporté une évaluation des organes reproducteurs de singes cynomolgus mâles et femelles. Chez tous les singes femelles du groupe ayant reçu la dose de 50 mg/kg, Tecentriq administré par voie intraveineuse a eu des effets sur le cycle menstruel, caractérisés par des cycles irréguliers pendant la phase d'administration et par l'absence de corps jaunes nouvellement formés dans les ovaires à l'autopsie. Ces effets sont survenus à une AUC estimée environ 6 fois supérieure à l'AUC observée chez les patients après administration de la dose recommandée; ils ont été réversibles au cours de la phase de récupération sans administration. Aucun effet sur les organes reproducteurs mâles n'a été constaté.
Autres données
Aucune étude de carcinogénicité, de génotoxicité ou de fertilité n'a été réalisée avec la rHuPH20. Au cours d'études générales effectuées chez le singe cynomolgus, aucun effet nocif sur les organes de reproduction des animaux mâles ou femelles n'a été observé. En outre, aucun effet de la rHuPH20 n'a été constaté sur la qualité du sperme. Des études toxicologiques sur la reproduction menées avec la rHuPH20 chez la souris ont révélé, après une forte exposition systémique, une toxicité embryo-fœtale, mais pas de potentiel tératogène.
Remarques particulièresIncompatibilités
Aucune incompatibilité n'a été observée entre Tecentriq s.c. et le polypropylène (PP), le polycarbonate (PC), l'acier inoxydable (SS), le polychlorure de vinyle (PVC) et les polyuréthanes (PU).
Stabilité
Ce médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Stabilité après ouverture
Pour des raisons d'hygiène, le médicament doit être utilisé immédiatement après son transfert du flacon dans la seringue, car il ne contient pas de conservateur antimicrobien. Si le médicament n'est pas utilisé immédiatement, la durée et les conditions de stockage avant son utilisation relèvent de la responsabilité de l'utilisateur et ne doivent normalement pas dépasser 24 heures à une température comprise entre 2 et 8 °C, sauf si la préparation s'est déroulée dans des conditions aseptiques contrôlées et validées.
La seringue munie de son bouchon peut être conservée jusqu'à 8 heures à une température ≤30 °C à la lumière du jour diffuse et jusqu'à 30 jours au réfrigérateur (à une température comprise entre 2 °C et 8 °C).
Remarques particulières concernant le stockage
Conserver au réfrigérateur (2-8 °C).
Ne pas agiter. Ne pas congeler.
Conserver le récipient dans son carton pour le protéger de la lumière.
Conserver hors de portée des enfants.
Remarques concernant la manipulation
Tecentriq s.c. est une solution prête à l'emploi destinée exclusivement à être injectée par voie-sous-cutanée, qui ne doit pas être diluée ou mélangée à d'autres médicaments.
Tecentriq s.c. doit être soumis à un contrôle visuel avant toute utilisation, afin de s'assurer qu'il n'y a ni particules, ni changement de couleur. La solution injectable de Tecentriq est destinée à un usage unique et doit être préparée par un professionnel de la santé.
Préparation de la seringue
Tecentriq s.c. ne contient pas de conservateur antimicrobien. Si la dose n'est pas administrée immédiatement au patient, il convient de respecter les indications mentionnées au paragraphe «Conservation de la seringue».
Sortir le flacon du réfrigérateur avant de l'utiliser et laisser la solution revenir à température ambiante.
Prélever l'intégralité du contenu du flacon contenant la solution de Tecentriq s.c au moyen d'une seringue et d'une aiguille de transfert (18 G de préférence). Détacher l'aiguille de transfert et connecter un set de perfusion pour administration sous-cutanée (p.ex. avec ailettes/«butterfly») muni d'une aiguille en acier inoxydable de taille comprise entre 23 et 25 G pour l'injection. Pour l'administration au patient, utiliser un set de perfusion s.c. disposant d'un volume mort MAXIMAL de 0,5 ml. Remplir la tubulure pour l'injection sous-cutanée avec la solution médicamenteuse afin d'évacuer l'air de la tubulure, mais arrêter le débit avant que le liquide n'atteigne l'aiguille. Veiller à ce que la seringue contienne exactement 15 ml de solution médicamenteuse après son remplissage et après l'élimination du volume excédentaire de la seringue. Administrer la dose immédiatement afin d'éviter toute obstruction de l'aiguille. NE PAS conserver la seringue préparée avec le set de perfusion connecté et déjà rempli.
Conservation de la seringue
Si la dose n'est pas administrée immédiatement, prélever dans des conditions aseptiques l'intégralité du contenu de la solution de Tecentriq s.c. du flacon dans la seringue, afin de prélever le volume de la dose (15 ml) plus le volume de remplissage du set de perfusion s.c. Remplacer l'aiguille de transfert par un bouchon. NE PAS connecter de set de perfusion s.c. pour conserver la seringue.
Si la seringue a été conservée au réfrigérateur, la laisser revenir à température ambiante avant d'administrer la dose.
Élimination des médicaments non utilisés/périmés
Le rejet de médicaments dans l'environnement doit être réduit au minimum. Les médicaments ne doivent pas être éliminés avec les eaux usées. Éviter toute élimination avec des déchets ménagers. Utilisez les systèmes collecteurs établis disponibles sur place.
Numéro d’autorisation69262 (Swissmedic).
PrésentationFlacon de 15 ml de solution injectable pour administration sous-cutanée (125 mg/ml) [A]
Titulaire de l’autorisationRoche Pharma (Suisse) SA, Bâle.
Mise à jour de l’informationSeptembre 2025.
|


